FACULDADE DE FARMÁCIA
ABORDAGEM GENÉTICA DA DOENÇA DE ALZHEIMER
FAMILIAR: DO DIAGNÓSTICO AO TRATAMENTO
Leticia de Bastos
Relatório de estágio orientado pela Professora Doutora Isabel Antolin Rivera e pelo Dr. Carlos José Faria Diogo Cortes, e coorientado pela Dra. Joana Selada Domingues.
MESTRADO EM ANÁLISES CLÍNICAS
FACULDADE DE FARMÁCIA
ABORDAGEM GENÉTICA DA DOENÇA DE ALZHEIMER
FAMILIAR: DO DIAGNÓSTICO AO TRATAMENTO
Leticia de Bastos
Relatório de estágio orientado pela Professora Doutora Isabel Antolin Rivera e pelo Dr. Carlos José Faria Diogo Cortes, e coorientado pela Dra. Joana Selada Domingues.
MESTRADO EM ANÁLISES CLÍNICAS
Prefácio
O presente trabalho é parte integrante do plano de estudos do Curso de Mestrado em Análises Clínicas pela Faculdade de Farmácia da Universidade de Lisboa. Este documento é composto por duas partes fundamentais, que visam alcançar objetivos distintos, mas interligados.
A primeira é composta pelo relatório de estágio, onde é apresentado todo o trabalho desenvolvido e os conhecimentos adquiridos, de uma forma sintetizada, nas áreas da Bioquímica, Hematologia e Microbiologia. O estágio de Bioquímica decorreu no Serviço de Patologia Clínca do Hospital de Cascais e o estágio das valências de Hematologia e Microbiologia foram realizadas no Serviço de Patologia Clínca do Hospital Nossa Senhora da Graça, em Tomar, tendo tido deste modo o privilégio de conhecer a dinâmica de dois Serviços distintos.
A segunda parte é composta pela dissertação, que foi desenvolvida na área da genética, com o tema: “Abordagem genética da doença de alzheimer familiar: do diagnóstico ao tratamento.” A escolha do tema deveu-se ao interesse em aprofundar os conhecimentos relativamente à doença de Alzheimer, aliada à importância da genética no possível diagnóstico e tratamento precoce.
Resumo
O presente trabalho é parte integrante do plano de estudos do Mestrado em Análises Clínicas da Faculdade de Farmácia da Universidade de Lisboa e constitui um dos principais elementos da avaliação final. Este documento encontra-se dividido em duas partes fundamentais. A primeira parte consiste no relatório de estágio e a segunda é constituída pela dissertação.
No relatório de estágio é apresentado o local onde decorreram os estágios e as atividades desenvolvidas em cada valência, focando os aspetos mais relevantes no que diz respeito à experiência desenvolvida e ao enquadramento dos conhecimentos adquiridos no contexto real de trabalho num Laboratório e da sua aplicação à Clínica.
O estágio foi realizado em Laborotórios de Serviços de Patologia Clínica de dois hospitais. No Hospital Dr. José de Almeida, em Cascais, decorreu o estágio de Bioquímica, no período compreendido entre os dias 9 de janeiro e 10 de março de 2017. No Hospital da Nossa Senhora da Graça, em Tomar, foram realizadas as valências de Hematologia e Microbiologia, entre os dias 3 de abril e 4 de agosto de 2017.
Na dissertação, é apresentada uma revisão da literatura na qual é desenvolvido o tema: "Abordagem genética da doença de Alzheimer Familiar: do diagnóstico ao tratamento".
A doença de Alzheimer (DA) de início precoce é a forma rara da doença (5-10% dos casos diagnosticados), apresentando um padrão de hereditariedade autossómico dominante e tendo essencialmente origem em mutações nos genes que codificam as presenilinas (PSEN1 e
PSEN2) e a proteína precursora amilóide (APP), que levam ao aumento do péptido Aβ42 e,
consequentemente, à perda de função e morte neuronal.
Atualmente, o diagnóstico definitivo desta patologia é obtido a partir da autópsia dos tecidos cerebrais, pois os procedimentos de diagnóstico tradicionais da DA assentam essencialmente na exclusão de outras causas de demência. Contudo, diversas pesquisas estão centradas na possibilidade do diagnóstico precoce recorrendo a biomarcadores específicos, que capturam tanto a extensão da patologia quanto os seus efeitos sobre a função cerebral, passando de uma abordagem de diagnóstico de exclusão para um diagnóstico positivo. Os biomarcadores
encontram-se divididos em duas grandes categorias permitindo uma observação sequencial de eventos relacionados com os processos fisiopatológicos da doença, sendo fundamentais para uma possível caracterização da situação clínica do doente.
Relativamente ao tratamento, este é baseado essencialmente na sintomatologia, sendo usados inibidores da acetilcolinesterase e antagonistas do recetor do N-Metil-D-Aspartato. No entanto, diversos tratamentos baseados na etiologia encontram-se já em estudo e englobam, não só a imunoterapia Aβ, mas também inibidores das secretases, da agregação do péptido Aβ, e da fosforilação e agregação da proteína tau.
No futuro, os micro-RNAs (miRNAs), elementos reguladores da expressão de genes, constituem biomarcadores promissores para o diagnóstico precoce e as tecnologias baseadas em RNA de interferência poderão abrir novos caminhos para o tratamento da DA.
Abstract
The present work is an integral part of the study plan of the Masters in Laboratorial Medicine of the Faculty of Pharmacy of the University of Lisbon and is one of the main elements of the final evaluation. This document is divided into two fundamental parts. The first part consists of the internship report and the second part consists of the monograph.
The internship report presents the place where the internships and activities developed in each valency took place, introducing the most relevant aspects regarding the experience developed and the framework of the knowledge acquired in the real context of work in a Laboratory and its application to the Clinic.
The internship was carried out in Clinical Pathology Laboratories of two hospitals. At the Dr. José de Almeida Hospital in Cascais, the biochemistry course was held from January 9 to March 10, 2017. At the Nossa Senhora da Graça Hospital in Tomar, the Hematology and Microbiology, areas took place between April 3 and August 4, 2017.
In the monograph, a review of the literature in which the theme "Genetic Approach of Familial Alzheimer's Disease: from Diagnosis to Treatment" is presented.
Early-onset Alzheimer's disease (AD) is the rare form of the disease (5-10% of diagnosed cases), presenting an autosomal dominant inheritance pattern and essentially originating from mutations in genes encoding presenilins (PSEN1 and PSEN2) and amyloid precursor protein (APP), which lead to the increase of the Aβ42 peptide and, consequently, loss of neuronal function and death.
Currently, the definitive diagnosis of this pathology is obtained from the autopsy of brain tissues, since the traditional diagnostic procedures of AD are essentially based on the exclusion of other causes of dementia. However, several studies are focused on the possibility of early diagnosis using specific biomarkers, which capture both the extent of the disease and its effects on brain function, moving from an exclusion diagnosis approach to a positive diagnosis. Biomarkers are divided into two broad categories allowing a sequential observation of events related to the pathophysiological process of the disease and are fundamental for a possible characterization of the clinical situation of the patient.
Regarding treatment, this is based essentially on symptomatology, using acetylcholinesterase inhibitors and N-methyl-D-Aspartate receptor antagonists. However, several treatments based on the etiology are already under study and encompass not only Aβ immunotherapy, but also inhibitors of secretases, aggregation of Aβ peptide, and phosphorylation and aggregation of tau protein.
In the future, micro-RNAs (miRNAs), regulators of gene expression, are promising biomarkers for early diagnosis and interference-based RNA technologies may open new avenues for AD treatment.
Agradecimentos
É com satisfação que expresso o meu agradecimento a todos os que contribuíram para que chegasse até aqui.
Aos meus pais, Glória e Fernando, pois sem eles nada disto seria possível. Obrigada por tudo, pelos valores transmitidos, pelo amor e apoio incondicional que me têm dado ao longo da vida.
À minha irmã por acreditar em mim e ter estado sempre presente quando lhe pedi ajuda.
Ao Patrick por todo o amor e paciência que tem demonstrado ao longo desta caminhada.
Aos colegas de mestrado, pelos momentos que passamos juntos, pela amizade, troca de experiências e sabedoria.
Aos Professores do Mestrado em Análises clínicas, pela aprendizagem que proporcionaram, em especial à Doutora Isabel Bettencourt, pela força que me deu quando a minha vontade era desistir, à Doutora Isabel Rivera, pela orientação na dissertação e à Doutora Cristina Marques, por todo o apoio no processo transição de local de trabalho/estágio.
Às minhas colegas de trabalho que fizeram com que a conciliação entre a minha vida profissional e académica se tornasse mais fácil.
Índice Geral
Relatório
Índice……….14 Índice de Figuras ………...19 Índice de Tabelas...………...…………21 Siglas e Abreviaturas ………23 1. Introdução ……….27 1.1. Objetivo ………..272. Caracterização dos Serviços de Patologia Clínica ……….28
2.1. Serviço de Patologia Clínica do Hospital Dr. José de Almeida ……….28
2.2. Serviço de Patologia Clínica do Hospital Nossa Senhora da Graça ………..30
3. Higiene e Segurança no Laboratório ……….33
4. Fluxograma Geral ………..37
5. Amostras Inadequadas para Análise ……….39
6. Controlo de Qualidade ………..40
6.1. Controlo de Qualidade Interno ………..40
6.2. Avaliação Externa da Qualidade ………42
7. Valência de Bioquímica ……….43
7.1. Bioquímica Clínica ………43
7.2. Interferência da Hemólise, Icterícia e Lipémia nos Métodos Analíticos …………...90
7.3. Análise da Urina Tipo II ………91
7.4. Avaliação da Urina a Tempo Determinado ……….103
8. Valência de Hematologia ………105
8.1. Hemogramas……….105
8.2. Hemoglobina Glicada ………..124
8.4. Hemostase ………128
9. Valência de Microbiologia ………..139
9.1. Marcha Laboratorial em Microbiologia ………...139
9.2. Exame Microscópico ………141
9.3. Exame Cultural ………146
9.4. Testes de Identificação Presuntiva ………...154
9.5. Teste de Identificação da Escherichia coli O157:H7 ………..157
9.6. Teste para identificação de Streptococcus pneumoniae ………...158
9.7. Identificação de Microrganismos e Teste de Suscetibilidade aos Antimicrobianos 159 9.8. Teste Screening para Streptococcus do Grupo A ……….162
9.9. Teste Screening para Streptococcus pneumoniae ………162
9.10. Teste Screening para Legionella pneumophila ……….163
9.11. Teste Screening para Clostridium difficile ………...164
9.12. Teste Screening para Campylobacter spp.…..………..166
9.13. Pesquisa de Vírus………..167
9.14. Pesquisa de Micobactérias ………170
9.15. PCR em Tempo Real ………175
9.16. Colheita de Produtos Biológicos e Processamento de Amostras ……….176
9.17. Fluxograma para Identificação de Bactérias Gram Negativos ……….202
9.18. Fluxograma para Identificação de Bactérias Gram Positivos ………..204
9.19. Fluxograma para Identificação de Leveduras ………..205
9.20. Fluxograma para Identificação de Fungos Filamentosos ……….206
9.21. Pesquisa de Sangue Oculto nas Fezes ………..206
10. Fase Pós-Analítica………208
11. Conclusão ……….209
Dissertação
Índice………...225 Índice de Figuras ……….227 Índice de Tabelas ………228 Siglas e Abreviaturas ………..229 1. Introdução ………231 1.1. Objetivos ………..2332. Doença de Alzheimer Familiar ………234
2.1. Proteína Precursora Amilóide ………..235
2.2. Presenilinas 1e 2 ………...241
2.3. Apolipoproteína E ………248
2.4. Recetor Ligado à Sortilina 1……….249
3. Em Portugal ……….250
4. Diagnóstico ………..251
4.1. História Clínica do Doente ………..253
4.2. Entrevista a Informante Informado ………..254
4.3. Testes Cognitivos Breves ……….255
4.4. Investigação Laboratorial ……….256 4.5. Testes Neuropsicológicos ……….256 4.6. Testes Genéticos ………...256 4.7. Neuroimagem ………..257 4.8. Outros Biomarcadores ……….259 5. Hipóteses Terapêuticas ………261 5.1. Tratamento Sintomático ………...261
5.2. Tratamento Baseado na Etiologia……….262
6. No futuro………..269
8. Discussão e Conclusão ………273 9. Referências Bibliográficas ………..275
Anexos
Anexo I………283 Anexo II ………..285 Anexo III ……….287 Anexo IV ……….288 Anexo V ………..289 Anexo VI ……….291UNIVERSIDADE DE LISBOA
FACULDADE DE FARMÁCIA
RELATÓRIO DE ESTÁGIO
Leticia de Bastos
Relatório de estágio orientado pelo Dr. Carlos José Faria Diogo Cortes,
coorientado pela Dra. Joana Selada Domingues.
MESTRADO EM ANÁLISES CLÍNICAS
Índice
Índice ... 14 Índice de Figuras ... 19 Índice de Tabelas ... 21 Siglas e Abreviaturas ... 23 1. Introdução ... 27 1.1. Objetivo ... 272. Caracterização dos Serviços de Patologia Clínica ... 28
2.1. Serviço de Patologia Clínica do Hospital Dr. José de Almeida ... 28
2.2. Serviço de Patologia Clínica do Hospital Nossa Senhora da Graça ... 30
3. Higiene e Segurança no Laboratório ... 33
4. Fluxograma Geral ... 37
5. Amostras Inadequadas para Análise ... 39
6. Controlo de Qualidade ... 40
6.1. Controlo de Qualidade Interno ... 40
6.2. Avaliação Externa da Qualidade ... 42
7. Valência de Bioquímica ... 43
7.1. Bioquímica Clínica ... 43
7.1.1. Avaliação do Ionograma ... 45
7.1.2. Avaliação do Metabolismo do Ferro ... 47
7.1.3. Avaliação da Função Cardíaca ... 50
7.1.4. Avaliação da Função Renal ... 55
7.1.5. Avaliação da Função Pancreática ... 58
7.1.6. Avaliação da Função Hepática ... 60
7.1.8. Avaliação do Metabolismo Lipídico ... 67
7.1.9. Avaliação das Proteínas ... 72
7.1.10. Avaliação da Gonadotrofina Coriónica Humana ... 74
7.1.11. Avaliação da Desidrogenase Láctica ... 75
7.1.12. Avaliação da Creatina-Cinase ... 76
7.1.13. Metabolismo Mineral-Ósseo ... 77
7.1.14. Avaliação da Proteína C Reativa ... 81
7.1.15. Monitorização de Drogas Terapêuticas ... 81
7.1.16. Rastreio de Drogas de Abuso ... 85
7.2. Interferência da Hemólise, Icterícia e Lipémia nos Métodos Analíticos ... 90
7.3. Análise da Urina Tipo II ... 91
7.3.1. Exame Físico e Químico da Urina Tipo II ... 92
7.3.2. Avaliação Microscópica do Sedimento Urinário ... 98
7.4. Avaliação da Urina a Tempo Determinado ... 103
8. Valência de Hematologia ... 105
8.1. Hemogramas ... 105
8.1.1. Esfregaço de Sangue Periférico ... 115
8.1.2. Velocidade de Sedimentação Eritrocitária ... 123
8.2. Hemoglobina Glicada ... 124
8.3. Eletroforese das Hemoglobinas ... 126
8.4. Hemostase ... 128
8.4.1. Determinação do Tempo de Protrombina ... 132
8.4.2. Determinação do Tempo de Tromboplastina Parcial Ativada ... 132
8.4.3. Determinação do Tempo de Trombina ... 133
8.4.4. Determinação do Fibrinogénio ... 133
8.4.5. Determinação do Anticoagulante Lúpico ... 133
8.4.7. Determinação da Proteína C ativada ... 136
8.4.8. Determinação da Proteína S Livre ... 136
8.4.9. Determinação dos D-Dímero ... 137
8.4.10. Fator von Willebrand ... 137
8.4.11. Fator VIII ... 138
9. Valência de Microbiologia ... 139
9.1. Marcha Laboratorial em Microbiologia ... 139
9.2. Exame Microscópico ... 141
9.2.1. Exame Direto a Fresco ... 141
9.2.2. Exame após Coloração ... 141
9.2.3. Exame Direto a Fresco com Contraste Negativo por Tinta da China ... 145
9.2.4. Análise Morfológica de Fungos Filamentosos ... 145
9.3. Exame Cultural ... 146
9.3.1. Técnica de Sementeira ... 152
9.3.2. Condições de Incubação ... 153
9.3.3. Aspeto Macroscópico das Colónias ... 154
9.4. Testes de Identificação Presuntiva ... 154
9.4.1. Prova da Catalase ... 154
9.4.3. Prova de Sensibilidade à Optoquina ... 155
9.4.4. Prova da Urease ... 156
9.4.5. Prova da Coagulase ... 156
9.5. Teste de Identificação da Escherichia coli O157:H7 ... 157
9.6. Teste para identificação de Streptococcus pneumoniae ... 158
9.7. Identificação de Microrganismos e Teste de Suscetibilidade aos Antimicrobianos 159 9.7.1. Preparação da Suspensão ... 160
9.7.2. Identificação de Microrganismos ... 160
9.8. Teste Screening para Streptococcus do Grupo A ... 162
9.9. Teste Screening para Streptococcus pneumoniae ... 162
9.10. Teste Screening para Legionella pneumophila ... 163
9.11. Teste Screening para Clostridium difficile ... 164
9.11.1. Pesquisa da Desidrogenase do Glutamato ... 165
9.11.2. Pesquisa das Toxinas A/B ... 165
9.12. Teste Screening para Campylobacter spp. ... 166
9.13. Pesquisa de Vírus ... 167
9.13.1. Teste Screening para Rotavírus e Adenovírus ... 167
9.13.2. Teste Screening para Vírus Sincicial Respiratório ... 168
9.13.3. Pesquisa do Vírus Influenza A e B ... 169
9.13.4. Pesquisa do Vírus Papiloma Humano de Alto Risco ... 170
9.14. Pesquisa de Micobactérias ... 170
9.14.1. Exame Direto e Cultural ... 171
9.14.2. Hemoculturas ... 173
9.14.3. Pesquisa por PCR ... 175
9.15. PCR em Tempo Real ... 175
9.16. Colheita de Produtos Biológicos e Processamento de Amostras ... 176
9.16.1. Trato Respiratório Superior ... 177
9.16.2. Trato Respiratório Inferior ... 178
9.16.3. Exsudado Ocular ... 180
9.16.4. Exsudado Auricular ... 181
9.16.5. Exsudados Purulentos ... 182
9.16.6. Biópsias Cirúrgicas e Material de Próteses ... 184
9.16.7. Líquido Biliar e Líquidos de Serosas: Ascítico, Pleural, Sinovial e Pericárdico. ………...184
9.16.9. Urina Asséptica ... 187
9.16.10. Esperma e Exsudado Vaginal, Endocervical e Uretral ... 191
9.16.12. Hemoculturas ... 195
9.16.13. Catéteres ... 198
9.16.14. Fezes ... 199
9.17. Fluxograma para Identificação de Bactérias Gram Negativos ... 202
9.18. Fluxograma para Identificação de Bactérias Gram Positivos ... 204
9.19. Fluxograma para Identificação de Leveduras ... 205
9.20. Fluxograma para Identificação de Fungos Filamentosos ... 206
9.21. Pesquisa de Sangue Oculto nas Fezes ... 206
10. Fase Pós-Analítica ... 208 11. Conclusão ... 209 12. Referências Bibliográficas ... 210 Anexo I ... 283 Anexo II ... 285 Anexo III ... 287 Anexo IV ... 288 Anexo V ... 289 Anexo VI ... 291
Índice de Figuras
Figura 1. Pictogramas de perigo. ... 34
Figura 2. Fluxograma geral que se aplica ao Serviço de Patologia Clínica do Hospital de Cascais e ao do C.H.M.T. ... 38
Figura 3. Dimension® EXLTM with LM, da Siemens. ... 44
Figura 4. Equipamento Aution Max, da A. Menarini Diagnostics ... 92
Figura 5. Sysmex XN-1000TM. ... 108
Figura 6. Tecnologia da focagem hidrodinâmica ... 108
Figura 7. Histograma de plaquetas (à esqueda) e dos eritrócitos (à direita). ... 109
Figura 8. Tecnologia da citometria de fluxo e sinais de dispersão da luz frontal, lateral e da fluorescência lateral ... 110
Figura 9. Diagramas de dispersão normal dos leucócitos do canal DIFF, à esquerda e diagrama de dispersão com a localização das diferentes células da série branca, consoante as suas características físico-químicas, à direita. ... 111
Figura 10. Diagramas de dispersão normal do canal WNR ... 112
Figura 11. Diagramas de dispersão normal do canal das plaquetas fluorescentes. ... 112
Figura 12. Diagrama de dispersão no canal dos reticulócitos com distribuição normal ... 113
Figura 13. Ilustração de como fazer um esfregaço de sangue periférico, à esquerda e esfregaço bem executado, à direita ... 115
Figura 14. Equipamento de coloraçãoAutomate RAL Stainer. ... 116
Figura 15. Alifax Test 1 THL ... 124
Figura 16. Arkray Adams A1c HA-8160, da A. Menarini Diagnostics ... 125
Figura 17. Representação esquemática da percentagem da produção de diversos tipos de hemoglobinas desde o inicio da gestação até à idade adulta ... 127
Figura 18. HYDRASYS, da sebia. ... 127
Figura 19. Migração, em pH alcalino, das hemoglobinas normais à esquerda e as variantes mais frequentes à direita. ... 128
Figura 20. Cascata da coagulação. ... 129
Figura 21. Sistema fibrinolítico e inibidores da fibrinólise ... 130
Figura 22. STA Compact Max®, da Satgo. ... 130
Figura 23. Princípio de medição por cronometria. ... 131
Figura 24. Marcha laboratorial em Microbiologia, quando um doente possui uma infeção. . 140
Figura 25. Representação esquemática da parede celular das bactérias Gram negativo e Gram positivo ... 143
Figura 26. Representação esquemática da técnica de sementeira em quatro quadrantes. ... 152
Figura 27. Representação esquemática da técnica de sementeira por espalhamento. ... 152
Figura 28. Representação esquemática da técnica de sementeira semi-quantitativa. ... 152
Figura 29. Equipamento GeneXpert® System, em cima e cartucho de reação em baixo. ... 176
Figura 30.Fluxograma para identificação de cocos Gram negativos. ... 202
Figura 31. Fluxograma para a identificação de bacilos Gram negativo. ... 203
Figura 32.Fluxograma para a identificação de cocos Gram positivo. ... 204
Figura 33. Fluxograma para a identificação de bacilos Gram positivo. ... 205
Figura 34. Fluxograma para identificação de leveduras. ... 205
Figura 35. Fluxograma para identificação de fungos filamentosos. ... 206
Índice de Tabelas
Tabela 1. Triagem e acondicionamento de resíduos num laboratório ... 35
Tabela 2. Causa do aumento e da diminuição dos eletrólitos no soro ... 46
Tabela 3. Marcadores bioquímicos após situação de EAM sem complicações ... 51
Tabela 4. Causa do aumento e da diminuição do cálcio, fósforo e magnésio no soro ... 80
Tabela 5. Compostos dosados na urina para o rastreio de drogas de abuso e respetivo conjugado ... 89
Tabela 6. Concentrações utilizados para estabelecer valores de índice HIL ... 90
Tabela 7. Células que podem ser observadas num sedimento urinário e o seu significado clínico ... 99
Tabela 8. Cilindros que podem ser observadas num sedimento urinário e o seu significado clínico ... 100
Tabela 9. Cristais que podem ser observadas num sedimento urinário e o pH a que se encontram ... 101
Tabela 10. Alterações qualitativas da serie vermelhas que podem ser observados com a coloração de May-Grünwald-Giemsa e as principais causas ... 117
Tabela 11. Alterações quantitativas da serie branca que podem ser observados com a coloração de May-Grünwald-Giemsa e principais causas ... 121
Tabela 12. Alterações quantitativas da serie plaquetar que podem ser observados com a coloração de May-Grünwald-Giemsa e principais causas. ... 123
Tabela 13. Teste de primeira linha para investigação de alterações hemostáticas ... 135
Tabela 14. Descrição dos meios utilizados ... 147
Tabela 15. Plano CQI da secção de Bioquímica do Serviço de Patologia Clínica do Hospital de Cascais. ... 283
Tabela 16. Plano CQI da secção de Hematologia do Serviço de Patologia Clínica do Hospital de Tomar. ... 285
Tabela 17. Estirpes bacterianas disponíveis manipuladas semanalmente segundo a ordem estabelecida, e respetivo teste de identificação e TSA executados no equipamento automático. ... 287
Siglas e Abreviaturas
α-KG α-cetoglutarato
AEQ Avaliação Externa da Qualidade
ADH (Anti-diuretic Hormone) Hormona Anti-diurética
ADP Adenosina Difosfato
ALP (Alkaline Phosphatase) Fosfatase Alcalina
ALT Alanina Aminotransferase
aPTT (Activated Partial Thromboplastin Time) Tempo de Tromboplastina Parcial Ativada
AST Aspartato Aminotransferase
ATCC American Type Culture Collection
ATP Adenosina Trifosfato
BAAR Bacilos Álcool-Ácido Resistentes
BHI (Brain Heart Infusion) Caldo Cérebro e Coração
BK Bacilo de Koch
BNP (Brain Natriuretic Peptide) Péptidos Natriuréticos Cerebral
CAM Gelose Campylosel
CAN2 Gelose chromIDTM Candida
CHGM Concentração de Hemoglobina Globular Média
CIVD Coagulação Intravascular Disseminada
CKMB Isoenzima MB da Creatina CCinase
CLED Gelose Cistina, Lactose, Deficiente em Eletrólitos
CNA Gelose COS com Ácido Nalidíxico e Colistina
COS Gelose de Columbia +5% de Sangue de Carneiro
CPR (Chlorophenol Red) Vermelho de Clorofenol
CPRG (Chlorophenol Red-β-D-galactopyranoside) Vermelho de
Clorofenol-β-D-galactopiranosido
CQ Controlo de Qualidade
CQI Controlo de Qualidade Interno
EAM Enfarte Agudo do Miocárdio
EDTA Ácido Etilenodiaminotetracético
FSC (Forward) Dispersão da Luz Frontal
GDH Desidrogenase Específica do Glutamato do Clostridium difficile
GGT Gama-glutamil Transferase
GLDH Glutamato Desidrogenase
G-6-PDH Glucose-6-fosfato Desidrogenase
HAE2 Gelose Chocolate Heamophilus 2
Hb Hemoglobina
HbA1c Hemoglobina Glicosilada ou Glicada
hCG Gonadotropina Coriónica Humana
HEK Gelose Hektoen
HDL (High Density Lipoprotein) Lipoproteínas de Alta Densidade
HIL Hemólise, Icterícia e Lipémia
HK Hexocinase
HPV (Human Papillomavirus) Papiloma Vírus Humano
HTC Hematócrito
ICC Insuficiência Cardíaca Congestiva
IFCC (International Federation of Clinical Chemistry) Federação Internacional de
Química Clínica
INR (International Normalized Ratio) Índice Internacional Normalizado
LCR Líquido Cefalorraquidiano
LDH (Lactate Dehydrogenase) Desidrogenase Láctica ou Lactato Desidrogenase
LDL (Low Density Lipoprotein) Lipoproteínas de Baixa Densidade
MCK Gelose MacConkey
NAD+ Nicotinamida e Adenina Dinucleótido (forma oxidada)
NADH Nicotinamida e Adenina Dinucleótido (forma reduzida)
NADP+ Nicotinamida Adenina Dinucleótido Fosfato (forma oxidada)
NADPH Nicotinamida Adenina Dinucleótido Fosfato (forma reduzida)
NRBC (Nucleated Red Blood Cells) Eritroblastos
NT-proBNP N-terminal proBNP
OMS Organização Mundial de Saúde
PCR Proteína C-reativa
PDW (Platelet Distribution Width) Coeficiente de Dispersão Plaquetária
PEG Polietilenoglicol
PVX Gelose Chocolate PolyViteX
RBC (Red Blood Cells) Eritrócitos
RDW (Red Cell Distribution Witdth) Coeficiente de Dispersão Eritrocitária
RSV (Respiratory Syncytial Virus) Vírus Sincicial Respiratório
SFL Fluorescência Lateral
SGC2 Gelose Sabouraud com Cloranfenicol 2
SNC Sistema Nervoso Central
SSC (Scatter) Dispersão da Luz Lateral
STRB Gelose chromIDTM Strepto B
TP Tempo de Protrombina
TSA Teste de Suscetibilidade aos Antimicrobianos
TSDT Técnico Superior de Diagnóstico e Terapêutica
TT Tempo de Trombina
UFC Unidade Formadora de Colónias
VCA3 Gelose Chocolate VCAT
VGM Volume Globular Médio
VPM Volume Plaquetário Médio
VS Velocidade de Sedimentação Eritrocitária
1. Introdução
O Relatório de Estágio pretende fazer uma apresentação do local onde decorreram os estágios, descrever as atividades desenvolvidas em cada valência, realçando a importância do controlo de qualidade interno e da avaliação externa da qualidade, bem como alguns aspetos da fase pré-analítica. Dentro de cada valência encontra-se destacado o tipo de produto biológico necessário à execução dos diferentes parâmetros analíticos, quais os equipamentos utilizados ou técnicas manuais desenvolvidas, o fundamento dos métodos, apresentando os aspetos mais relevantes no que diz respeito à experiência desenvolvida e ao enquadramento dos conhecimentos adquiridos no contexto real de trabalho num Laboratório e da sua aplicação à Clínica.
O estágio é de grande importância para sedimentar e aprofundar conhecimentos, assim como adquirir capacidade de organização e de execução das tarefas diárias num Laboratório. Neste caso, tive o privilégio de conhecer a dinâmica de dois Serviços de Patologia Clínca distintos.
O estágio profissional da valência de Bioquímica decorreu no Serviço de Patologia Clínca do Hospital Dr. José de Almeida, em Cascais, no período compreendido entre o dia 9 de janeiro e o 10 de março de 2017. As valências de Hematologia e Microbiologia foram realizadas no Serviço de Patologia Clínca do Hospital Nossa Senhora da Graça, em Tomar, entre o dia 3 de abril e 4 de agosto de 2017.
1.1. Objetivo
O principal objetivo do estágio e da execução do relatório é a aquisição competências e métodos de trabalho, bem como consolidar conhecimentos.
2.
Caracterização dos Serviços de Patologia Clínica
Os Serviços de Patologia Clínca, do Hospital Dr. José de Almeida, em Cascais, bem como o do Hospital Nossa Senhora da Graça, em Tomar, respondem às necessidades da urgência hospitalar tendo um funcionamento permanente para garantir um rápido e adequado apoio aos doentes. Também são realizadas análises de rotina aos doentes internados, bem como aos utentes da consulta que procuram estas unidades de saúde, que se regem segundo os mais rigorosos padrões de qualidade, respeitando as Boas Práticas Laboratoriais.
Ambos os Serviços de Patologia Clínica possuem um fluxo de trabalho bastante organizado e encontrando-se na sua maioria automatizados e informatizados, conseguido, deste modo, a total rastreabilidade de todo o processo.
Possuem ainda uma diferenciada secção de Microbiologia que presta apoio ao Hospital e à Comissão de Controlo da Infeção Hospitalar.
Os Serviços de Patologia Clínca têm ainda implementado um Sistema de Gestão de Qualidade e encontram-se Certificados pela norma NP EN ISO 9001.
2.1. Serviço de Patologia Clínica do Hospital Dr. José de Almeida
O Hospital Dr. José de Almeida, situado em Alcabideche, é um hospital público de gestão privada que presta cuidados de saúde à população de Cascais e Sintra (na área materno-infantil) tendo como objetivo tornar esta região um exemplo na prestação dos cuidados de saúde. Atualmente possui um total de 287 camas.
O Serviço de Patologia Clínica, gerido pela empresa Labco, foi instalado de forma a proporcionar aos utentes, um serviço de qualidade e excelência. A Direção Técnica encontra-se a cargo do Doutor Luís Santos, Patologista Clínico.
Para além do Diretor Técnico, existe ainda uma Patologista Clínica, uma Técnica Superior de Saúde, a Dra. Joana Domingues, responsável pela secção de Microbiologia, uma
Técnica Superior de Regime Geral, coordenadora do serviço, diversos Técnicos Superiores de Diagnóstico e Terapêutica (TSDT) e uma Assistente Operacional.
O Serviço de Patologia Clínica é constituído de uma central de colheitas com sala de espera e um laboratório que possui diversas secções, nomeadamente, Microbiologia, Hematologia, Hemóstase, Bioquímica e Imunologia. Tudo o que não é processado no laboratório é encaminhado para o Laboratório Central, situado em Lisboa.
2.1.1. Missão
A General Lab é um grupo de laboratórios dedicados à realização de análises clínicas, que oferece aos seus clientes um serviço responsável, profissional e inovador, com eficiência e qualidade, tanto humana como técnica.
2.1.2. Visão
A General Lab pretende ser o líder europeu no setor das Análises Clínicas e proporcionar um serviço que acompanha e tende a superar as expectativas dos clientes utilizando os nossos valores.
2.1.3. Valores
O potencial dos Recursos Humanos;
A capacidade de adaptação dos nossos processos às necessidades dos clientes;
Espirito de inovação na procura constantes de novas soluções técnicas;
A parceria e a integração de todos os profissionais e colaboradores incluindo os fornecedores;
O poder de estabelecer alianças estratégicas com outras Organizações;
2.1.4. Política da Qualidade
A política de qualidade do Grupo General Lab consiste em fomentar o trabalho em equipas, no controlo e melhoria contínua dos processos para garantir a satisfação do cliente e superar as suas expectativas.
2.2. Serviço de Patologia Clínica do Hospital Nossa Senhora da Graça
O Centro Hospitalar do Médio Tejo, E.P.E. (C.H.M.T.) é constituído por três Unidades Hospitalares, Abrantes (Hospital Doutor Manoel Constâncio) Tomar (Hospital Nossa Senhora da Graça) e Torres Novas (Hospital Rainha Santa Isabel), distribuídas, entre si, a uma distância de 30-35km. O C.H.M.T possui um total de 400 camas, disponíveis para o internamento de doentes, tendo como objetivo o tratamento e a reabilitação, em tempo clinicamente adequado, com condições ótimas de qualidade e humanidade dos serviços prestados.
O Serviço de Patologia Clínica encontra-se centralizado no Hospital Nossa Senhora da Graça que possui uma estrutura laboral bem definida que compreende as áreas de Hematologia, Bioquímica, Imunoquímica, Imunologia, Microbiologia e Urgência, tendo cada setor um especialista responsável. Possui ainda uma sala de colheitas com sala de espera e consulta de hipocoagulação, que se realiza uma vez por semana. Para além de dar resposta aos serviços do próprio Hospital, também processa amostras da consulta vindas dos Hospitais de Abrantes e Torres Novas. No entanto, em cada unidade existe um Serviço de Patologia Clínica que possui uma central de colheitas, um laboratório com capacidade de dar resposta à urgência e ao internamento, bem como um espaço para a execução da consulta da hipocoagulação. O sector de Microbiologia encontra-se totalmente centralizado em Tomar.
A direção do Serviço de Patologia Clínica é da responsabilidade do Dr. Carlos Cortes e a coordenação dos TSDT encontra-se a cargo da TSDT Sandra Paredes. O Serviço de Patologia Clínica abrange trabalhadores qualificados nomeadamente, 4 Técnicos Superiores de Saúde, 2 Técnicos Superiores de Regime Geral, 5 Patologistas Clínicos, diversos TSDT e 4 Assistentes Operacionais.
2.2.1. Visão
O C.H.M.T. pretende ser reconhecido como um Centro Hospitalar de referência na prestação de cuidados de saúde, com especialidades diferenciadas, apostando no desenvolvimento de serviços eficientes e inovadores com uma gestão adequada dos recursos, sempre com o objetivo de atingir a satisfação dos seus utentes.
2.2.2. Missão
Prestação de cuidados de saúde diferenciados, com eficiência e qualidade, em articulação com outros serviços de saúde e sociais da comunidade, a custos comportáveis, assumindo-se como um Centro de elevada competência na organização e prestação assistencial, uma referência no esforço de investigação, desenvolvimento e inovação, promovendo a complementaridade entre as 3 Unidades Hospitalares.
2.2.3. Valores
Qualidade, procurando obter os melhores resultados e níveis de serviço na prestação de cuidados, tendo como base a satisfação das necessidades da comunidade, assumindo o princípio da melhoria contínua e promovendo a cooperação entre os diferentes Serviços;
Ética e integridade, orientando as ações tomadas segundo os mais nobres princípios de conduta, nas relações;
Respeito pelos direitos individuais, assumindo o compromisso de salvaguardar a dignidade de cada indivíduo nas relações decorrentes da sua operacionalidade;
Competência e inovação, promovendo o desenvolvimento da Instituição e a implementação de novas soluções que permitam assegurar a prestação dos melhores cuidados de saúde.
2.2.4. Política da Qualidade
O C.H.M.T. orienta a prestação de cuidados de saúde na perspetiva dos princípios da Gestão pela Qualidade, visando a satisfação dos utentes e colaboradores.
Neste sentido, a política da qualidade é estabelecida pelos seguintes princípios:
Competência e respeito pelos requisitos legais, éticos e deontológicos no exercício das suas atividades, sempre orientadas para a satisfação das necessidades dos utentes.
Cumprimento dos requisitos aplicáveis a de melhoria contínua da eficácia do Sistema de Gestão da Qualidade.
Cultura de Qualidade e Segurança assente num modelo de gestão global de risco.
Cultura de competências assente na responsabilidade e formação contínua dos colaboradores, garantindo a sua satisfação e otimizando a performance organizacional.
Garantia de uma comunicação eficaz com os colaboradores e com a comunidade envolvente à área de influência do Médio Tejo.
3. Higiene e Segurança no Laboratório
Em ambos os Laboratórios existe um procedimento escrito de Higiene e Segurança, que contempla os requisitos para a segurança de pessoas e instalações, planos de emergência, tratamento de resíduos, requisitos para a limpeza das instalações, bem como para a lavagem e esterilização de materiais.
As Normas Gerais de Segurança visam minimizar o risco de acidentes, assim como estabelecer normas que garantem a proteção dos profissionais saúde, nomeadamente os técnicos, sendo fundamental:
A utilização de equipamentos de segurança individual e coletivos, sempre que necessário;
Tratar todos os produtos como sendo potencialmente perigosos;
Os recipientes e/ou requisições visivelmente conspurcados com matéria orgânica não devem ser aceites pelo laboratório;
Colocar tampas nos tubos antes de se proceder à sua centrifugação e armazenamento;
Frascos que contenham produtos transferidos ou preparados a partir de frascos originais devem ser etiquetados com a identificação do produto, data da preparação e de validade, modo de preparação, rúbrica de quem o preparou e simbologia de perigo adequada (Figura 1);
Não comer, fumar, beber ou conservar alimentos/bebidas na zona laboratorial;
Manter as áreas de trabalho limpas e desimpedidas;
Fechar portas e gavetas de armários após utilização;
Minimizar o uso de objetos pessoais;
Antes de se iniciar qualquer operação, é necessário conhecer as características dos equipamentos, reagentes e produtos que se irão manipular e os seus requisitos de segurança.
Quanto à gestão de resíduos do Laboratório, os resíduos hospitalares são classificados de acordo com o Despacho conjunto nº242/96 de 5 de julho bem como de acordo com a Portaria nº 209/2004 de 3 de março (Lista Europeia de Resíduos) (Tabela1).
Tabela 1. Triagem e acondicionamento de resíduos num laboratório (Adaptado de [2]). Re síd u os Não Pe rigoso s
Grupo I - Resíduos equiparados a urbanos
Grupo II - Resíduos hospitalares não perigosos
Embalagens vazias com exceção dos incluídos no Grupo III e IV.
Material não contaminado e sem vestígios de sangue. Material de proteção individual utilizados nos serviços de apoio, com exceção dos utilizados na recolha de resíduos.
Re síd u os Pe rigoso s
Grupo III - Resíduos com risco biológico
Amostras biológicas;
Material contaminados ou com vestígios de sangue; Material de proteção individual em que exista contacto com produtos contaminados.
Grupo IV - Resíduos hospitalares específicos
Resíduos cortantes e perfurantes;
Citostáticos e todo o material utilizado na sua manipulação e administração;
Produtos químicos passíveis de incineração.
Resíduos Especiais Perigosos Resíduos líquidos de risco biológico.
Reagentes não identificados ou obsoletos ou outros resíduos sujeitos a recolha pontual.
A eliminação e tratamento dos resíduos depende da classe a que pertencem. A Legislação aplicável à gestão de resíduos são o D.L nº 178/2006 e o D.L nº73/2011.
A recolha de resíduos é efetuada por uma empresa contratada, especializada e licenciada neste tipo de serviço – Stericycle Portugal ®. A recolha periódica deve ser registada em modelo próprio para posterior elaboração do relatório anual a enviar à Direção Geral de Saúde.
Os resíduos sólidos perigosos não descartáveis (Grupo III) são colocados em recipiente contendo lixívia diluída. No fim do dia, a lixívia é despejada sob água corrente e o material é lavado numa cuba de lavagem contendo detergente e lixívia diluída.
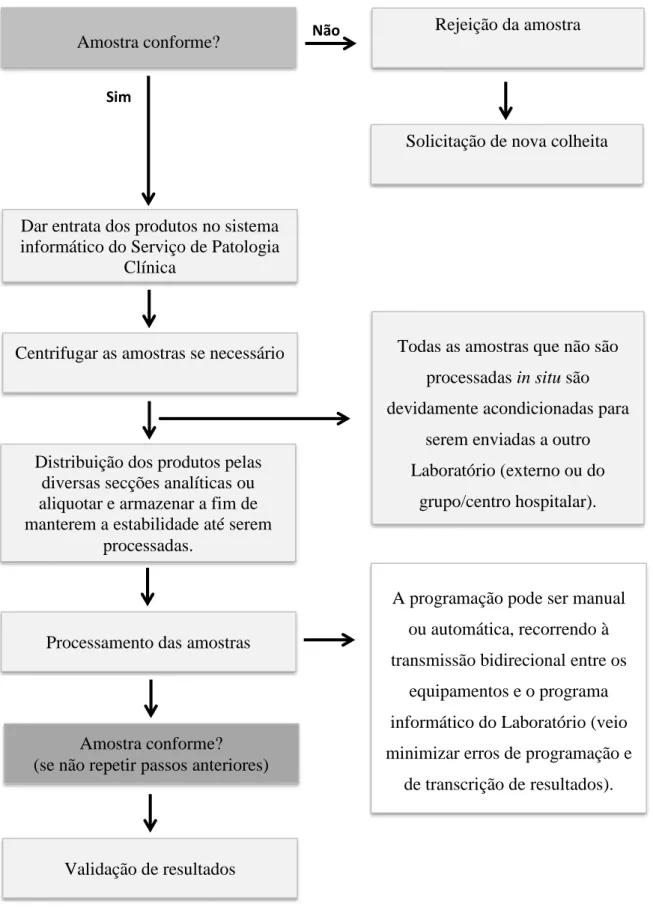
4. Fluxograma Geral
Colheita e identificação das amostras Fornecer instruções para colheita(s)
Prescrição médica
Registo da colheita
Acondicionamento e envio das amostras ao Laboratório
Receção das amostras
Requisição conforme?
É atribuído um número de registo que servirá para a identificação da amostra, com os dados do utente (nome, número de processo e data
de nascimentos/idade), serviço, tipo de tubo e secção a que se destina ou origem do produto (no caso da microbiologia) e código de
barras.
Não Contacto com o médico prescritor
Retificação da requisição
Sim
Dependendo dos analitos a serem doseados o transporte é feito à temperatura ambiente, refrigerado
Amostra conforme? Não
Rejeição da amostra
Solicitação de nova colheita
Sim
Dar entrata dos produtos no sistema informático do Serviço de Patologia
Clínica
Centrifugar as amostras se necessário
Distribuição dos produtos pelas diversas secções analíticas ou aliquotar e armazenar a fim de manterem a estabilidade até serem
processadas.
Todas as amostras que não são processadas in situ são devidamente acondicionadas para
serem enviadas a outro Laboratório (externo ou do
grupo/centro hospitalar).
Processamento das amostras
Amostra conforme? (se não repetir passos anteriores)
A programação pode ser manual ou automática, recorrendo à transmissão bidirecional entre os
equipamentos e o programa informático do Laboratório (veio minimizar erros de programação e
de transcrição de resultados).
Validação de resultados
Figura 2. Fluxograma geral que se aplica ao Serviço de Patologia Clínica do Hospital de Cascais e ao do C.H.M.T.
5. Amostras Inadequadas para Análise
A fase pré-analítica concentra a grande maioria dos erros laboratoriais que geram a rejeição de amostras biológicas, com possibilidade de vir a ser necessário a repetição da colheita. Entre eles, destacam-se aspetos relacionados com o não cumprimento das recomendações que antecedem à colheita ou com a colheita em si:
Hemólise: Libertação do conteúdo intracelular do eritrócito para o plasma, que leva à elevação de alguns parâmetros analíticos e a cor vermelha que pode causar interferências analíticas na leitura das absorvências (dependendo do grau de hemólise, o grau de interferência varia). Pode ser patológico ou resultante de erro pré-analítico.
Lipémia: Turvação do soro devido à elevada concentração de lipoproteínas ricas em triglicéridos que leva a interferências em diversas técnicas analíticas. Atenua se o tempo de jejum for cumprido.
Icterícia: Relacionada com patologia hepatobiliar. Pode causar interferência nalgumas técnicas analíticas.
Amostra coagulada: Deve-se geralmente colheitas difíceis e demoradas, ou à não homogeneização dos tubos que contenham anticoagulante logo após colheita. Leva a interferência nos resultados e poderá entupir o equipamento.
Proporção sangue-anticoagulante não respeitada: leva a alterações nos resultados analíticos. É importante encher os tubos até a marca. A largura da marca presente nos tubos indica a margem de tolerância.
6. Controlo de Qualidade
O Controlo de Qualidade (CQ) num Laboratório de Análises Clínicas, trata-se de um processo estatístico útil na monitorização e avaliação dos processos analíticos, assegurando a qualidade e fiabilidade dos resultados, através de um conjunto de ações pré-estabelecidas e sistemáticas, que abrange as fases pré-analítica, analítica e pós-analítica [3,4].
Os procedimentos de controlo incluem o controlo de qualidade interno (CQI) e a avaliação externa da qualidade (AEQ) [3], sendo que as matérias de controlo devam ser examinadas periodicamente, com uma frequência baseada na estabilidade do procedimento e tendo em conta o risco de danos para o utente de um resultado errado [4].
6.1. Controlo de Qualidade Interno
O CQI define-se como um conjunto de procedimentos que se destinam a assegurar e controlar a qualidade dos resultados obtidos durante a execução de análises laboratoriais [3]. Permite avaliar a precisão dos sistemas analíticos. A precisão é a concordância entre os vários valores medidos de um analíto (mínimo 20 réplicas), na mesma amostra, sob as mesmas condições (repetibilidade) ou sob condições variáveis (reprodutibilidade), sendo afetada pelo erro aleatório. A imprecisão é medida através do cálculo do coeficiente de variação (CV).
𝐶𝑉 (%) =𝐷𝑒𝑠𝑣𝑖𝑜 𝑃𝑎𝑑𝑟ã𝑜 (𝐷𝑃) 𝑀é𝑑𝑖𝑎 (𝑋) × 100 𝐷𝑃 = √∑ (𝑋𝑖 − 𝑋) 𝑛 𝑖=1 𝑛 − 1 𝑋 = ∑ 𝑋𝑖 𝑛 𝑖=1 𝑛
Em ambos os Serviço de Patologia Clínca, são processados diariamente CQI, no entanto os níveis de controlo e a periodicidade com que são passados depende do que está estabelecido na instrução de trabalho e aprovado pelo Diretor Técnico (Anexos I e II).
Para além do que está estipulado na rotina diária, existem outras situações em que é necessário processar CQI: após uma calibração ou recalibração, sempre que se utilize um novo reagente, após uma manutenção específica ou procedimentos de resolução rápida de um problema no equipamento, quando se verifica uma possível tendência nos resultados, e sempre que se achar necessário.
Os controlos, tal como as amostras, são programados através de um sistema de códigos de barras. A transmissão bidirecional permite que os resultados sejam transmitidos para um programa informático e registados em cartas de Levey-Jennings que diariamente são analisadas, sendo os critérios de aceitação estabelecidos pelo responsável da qualidade do laboratório, tendo como base as Regras de Westgard.
Quando alguma regra de controlo de qualidade é violada, ou se verifica uma tendência, os resultados das análises podem ser suscetíveis de conter erros clinicamente significativos. Neste caso, as amostras devem ser de novo examinadas após a correção do erro, podendo ser necessário executar manutenções, recalibrar ou colocar um novo regentes. Qualquer ação corretiva ou preventiva tem de ser devidamente registada.
Antes de se iniciar o processamento das amostras dos utentes é necessário validar os resultados de controlo e verificar se tudo está operacional.
No que diz respeito à secção de Microbiologia, o CQI é executado com base na manipulação e conservação de estirpes bacterianas ATCC (do inglês American Type Culture
Collection), que têm características fenotípicas previamente conhecidas. As estirpes a utilizar é
quase sempre obtidas a partir das culturas de trabalho. A cultura de trabalho é preparada uma vez por semana com início de procedimento às segundas, terças ou quartas-feiras (Anexo III, A). O controlo é realizado semanalmente (uma estirpe diferente por semana), procedendo-se à sua identificação e teste de suscetibilidade aos antimicrobianos no equipamento automático (Anexo III, B). Quando algum resultado não estiver conforme o esperado, deverá procurar-se a causa do erro e corrigir-se sempre que possível. Nestas situações, o teste deverá ser repetido na
semana seguinte, juntamente com o programado para essa semana, devendo qualquer ação corretiva ficar devidamente registada.
Relativamente às técnicas manuais, os controlos são processados sempre que uma caixa nova é colocada a uso, e, se possível (se os controlos não foram de uso único), sempre que haja dúvidas no desempenho ou interpretação do resultado de um teste, sendo o dia da abertura, lote do Kit e o desempenho do controlo registado no dossier das técnicas manuais.
6.2. Avaliação Externa da Qualidade
A AEQ corresponde à avaliação por um organismo exterior da qualidade dos resultados fornecidos pelo laboratório. Permite a melhoria dos níveis de desempenho do laboratório e a comparabilidade de resultados com outros laboratórios, dando uniformidade e credibilidade ao trabalho desenvolvido [3]. Quando um resultado de controlo não cumpre os critérios de desempenho pré-estabelecidos tem de se implementar ações corretivas.
Em ambos os Serviço de Patologia Clínca, a grande maioria dos parâmetros são alvos da AEQ, permitindo deste modo aferir a exatidão dos resultados, avaliar e quantificar a inexatidão e as tendências dos sistemas analíticos. As amostras são enviadas com uma periodicidade adequada, para que se possa efetuar correções aos eventuais desvios observados em tempo útil. A exatidão é afetada pelo erro sistemático.
A inexatidão (ou bias) corresponde à percentagem do afastamento entre o valor medido em relação ao valor verdadeiro.
𝐵𝑖𝑎𝑠(%) =|𝑉𝑎𝑙𝑜𝑟 𝑚𝑒𝑑𝑖𝑑𝑜 − 𝑉𝑎𝑙𝑜𝑟 𝑣𝑒𝑟𝑑𝑎𝑑𝑒𝑖𝑟𝑜|
𝑉𝑎𝑙𝑜𝑟 𝑣𝑒𝑟𝑑𝑎𝑑𝑒𝑖𝑟𝑜 × 100
O resultado da AEQ é avaliado pelo Diretor Técnico, em conjunto com o responsável da qualidade do Serviço de Patologia Clínca e o responsável da secção.
Os planos de controlo da AEQ em que os Serviços de Patologia Clínica participam encontram-se apresentados no Anexo IV.
7. Valência de Bioquímica
7.1. Bioquímica Clínica
A área da Bioquímica Clínica é uma área multidisciplinar, que tem por objetivo determinar os parâmetros bioquímicos, permitindo a sua utilização no diagnóstico, prognóstico, tratamento e monitorização da doença.
Local: Serviço de Patologia Clínca do Hospital Dr. José de Almeida, Cascais Responsáveis da secção:
Dr. Luis Santos (Patologista Clínico) Dra. Stela Lopes (Patologista Clínico)
Dra. Joana Domingues (Técnica Superior de Saúde)
Período de Estágio: 09/01/2017 - 10/03/2017
Volume de trabalho: Em média cerca de 6900 pedidos/mês (estatística feita com base no número de pedidos ionograma/mês)
Atividades realizadas na seção no referendo período:
Colheitas de produtos biológicos no internamento e consulta externa; Receção de produtos e avaliação da sua conformidade;
Manutenção dos equipamentos;
Execução e avaliação CQI e das amostras da AEQ; Processamento de amostras;
Validação técnica de resultados; Gestão de stocks.
Equipamento em funcionamento na secção:
Equipamento: Dimension® EXLTM with LM, da Siemens
O Dimension® EXLTM possui um sistema automatizado que permite a determinação dos parâmetros bioquímicos em amostras de soro, plasma, urina e líquidos orgânicos, nomeadamente, líquido cefalorraquidiano (LCR).
Os produtos que se destinam a determinações bioquímicas neste equipamento são centrifugados a 3500rpm, 10 minutos. As urinas não precisam de nenhum tratamento específico a não ser que se apresentem muito turvas ou com uma consistência viscosa, e neste caso também têm de ser centrifugadas, a fim de prevenir o entupimento das agulhas do equipamento.
Quanto aos líquidos orgânicos, sempre que haja pedido de citoquímico1, primeiro tem
de se avaliar a cor e o aspeto do líquido e posteriormente centrifugar para ser processado no equipamento. Quando é pedido a densidade e o pH esta determinação é efetuada recorrendo a tiras de teste de análise de urina tipo II.
Diversos parâmetros bioquímicos são doseados no Dimension® EXLTM with LM (Figura 3) com o objetivo de auxiliar o médico no diagnóstico e prognóstico de determinada patologia ou condição clínica.
1 Geralmente, o pedido do citoquímico vem sempre acompanhado do exame citológico (líquido colhido em tubo contendo
como anticoagulante o EDTA), em que após a contagem de células pelo analisar automático, proceder-se à montagem da câmara de Nageotte para contagem dos leucócitos, com contagem diferencial entre células polimorfonucleares e mononucleares, assim como efetuar uma avaliação semi-quantitativa dos eritrócitos.
7.1.1. Avaliação do Ionograma
A função dos eletrólitos no corpo humano é múltipla, sendo que quase todos os processos metabólicos são dependentes dos eletrólitos ou afetados por eles. O aporte destes eletrólitos no organismo é feito através da dieta [5].
Os iões de cloretos (Cl-) e sódio (Na+) são os principais iões extracelulares, sendo responsáveis pela osmolalidade do plasma e desempenham um papel fundamental na manutenção da distribuição da água e da pressão osmótica no compartimento líquido extracelular [5]. A hiponatrémia leva a convulsões, letargia, desorientação, edema pulmonar, cefaleias, coma ou até mesmo à morte. A hipernatrémia pode levar à agitação, espasmos musculares, letargia e irritação [6].
Os iões de potássio (K+) são os principais catiões intracelulares, sendo responsáveis por manter o equilíbrio da água, em conjunto com o sódio, regular processos metabólicos e excitabilidade muscular. A hipocaliémia leva a fraqueza muscular, diminuição dos reflexos e arritmias cardíacas. A hipercaliémia pode levar a confusão mental, fraqueza, dormência, formigueiro nas extremidades, fraqueza muscular e paragem cardíaca [5].
Diferentes causas podem estar na origem das alterações hidro-eletrolíticas, sendo que algumas delas encontram-se apresentadas na Tabela 2.
Amostra: Soro, plasma heparinizado2 ou urina [7]. Método: Potenciometria.
Existem 3 elétrodos incorporados no Multisensor Integrado QuikLYTE® que são seletivos para os iões de sódio, potássio e cloro, para além do elétrodo de referência. Depois de uma amostra ser posicionada no sensor, os iões estabelecem um equilíbrio com a superfície do elétrodo. É gerado um potencial que é proporcional ao logaritmo da atividade da substância a analisar na amostra, que é comparado com o potencial gerado numa solução padrão. A concentração dos iões é calculada com recurso à Equação de Nernst [7].
2Heparina é um anticoagulante. Ativa (co-fator) a antitrombina III que exerce ação anticoagulante, principalmente pela inibição
Intervalo de Medição Analítica: Soro:Na+: 50-200mmol/L, K+: 1.0-10.0mmol/L, Cl-: 50-200mmol/L; Urina: Na+: 5-300mmol/24H, K+: 1.0-300mmol/24H, Cl-: 10-330mmol/24H[7]
Valores de Referência: Soro: Na+: 136-145mmol/L, K+: 3.5 -5.1mmol/L, Cl-: 98-107mmol/L; Urina: Na+: 40-220mmol/24H; K+: 25-125mmol/24H, Cl-: 110-250mmol/24H
Tabela 2. Causa do aumento e da diminuição dos eletrólitos no soro (Adaptado de [5]).
Eletrólitos Aumento Diminuição
Sódio
Desidratação
Níveis diminuídos de ADH
Produção excessiva de mineralocorticóides Infusão intravenosa de Na+
Ingestão excessiva de sal sem entrada de água Insuficiência renal Hiperaldosteronismo Queimaduras Diurese osmótica Ingestão diminuída Perdas gastrointestinais Sudação excessiva Insuficiência de mineralocorticóides Hipoaldosteronismo Acetoacidose diabética Acidose tubular renal Insuficiência cardíaca Insuficiência renal Hipoalbunimémia
Níveis aumentados de ADH Administração excessiva de água
Potássio Infusão intravenosas de K+ Desidratação Rabdomiólise Queimaduras graves Insuficiência renal Hemorragias Acidose metabólica Défice de mineralocorticóides Diuréticos Ingestão diminuída Perdas gastrointestinais Perdas renais Alcalose metabólica Incorporação celular Doença hepática Insuficiência cardíaca Queimaduras Diurese osmótica Cloro Desidratação
Insuficiência renal aguda Acidose metabólica Diabetes insipidus
Nefropatia
Perdas intestinais de bicarbonato Insuficiência adrenal
Alcalose metabólica
7.1.2. Avaliação do Metabolismo do Ferro
O ferro é um elemento fundamental e vital para o bom funcionamento do organismo. O tecido com maior necessidade de aporte em ferro é a medula óssea para a síntese de hemoglobina, sendo este aporte garantido pela dieta [8]. O ferro que não é utilizado é armazenado nas formas de ferritina e hemossiderina [9]. Porém, capacidade de armazenamento é limitada e em excesso torna se tóxico para o organismo [8].
A transferrina é fundamental para o transporte do ferro para os locais de armazenamento (células do sistema reticuloendotelial do fígado, baço e medula óssea) e para as células que sintetizam compostos contendo ferro, tais como hemoglobina, mioglobina e citocromo. Esta glicoproteína é produzida no fígado, sendo os seus níveis plasmáticos influenciados pela disponibilidade de ferro.A carência de ferro leva a um aumento da sua síntese [10].
Os níveis de ferritina circulante refletem com exatidão os níveis de ferro que se encontram armazenados no organismo e são úteis em situações de suspeita de deficiência ou sobrecarga de ferro [9]. É um indicador precoce, manifestando alterações antes da diminuição
dos níveis séricos de ferro e do aparecimento de anomalias morfológicas nos eritrócitos [11]. Existe um forte mecanismo homeostáticos, no entanto podem surgir distúrbios do metabolismo do ferro que levam a situações patológicas, das quais de destacam a anemia ferropénica, anemia da doença crónica [12], hemossiderose, hemocromatose, anemia sideroblástica [11], anemia hemolítica e necrose hepática aguda (por libertação aumentada do ferro armazenado) [13].
Na anemia ferropénica verifica-se uma diminuição dos níveis plasmáticos de ferro resultante da depleção das reservas, podendo ser consequência de deficiências nutricionais, perdas sanguíneas ou problemas de absorção [12].
Frequentemente, as doenças infeciosas, inflamatórias, traumáticas, neoplásicas ou com comprometimento hepático, são acompanhadas por uma anemia leve a moderada, com diminuição dos níveis plasmáticos de ferro e níveis normais ou ligeiramente aumentados de ferritina, denominada de anemia de doença crónica, causada pela resposta de fase aguda associada à inflamação crónica [12].
Ferritina
Amostra: Soro ou plasma heparinizado [14]. Método: Imunoensaio enzimático.
A amostra é incubada com partículas de dióxido de crómio revestidas com anticorpos monoclonais específicos para a ferritina (FERR) e com um conjugado (β-galactosidase marcada com anticorpo monoclonal específico para um segundo local de ligação na ferritina). O que não se ligou é removido. A β-galactosidase ligada é combinada com um substrato cromogénico, o vermelho de clorofenol-β-D-galactopiranosido (CPRG, do inglês chlorophenol
red-β-D-galactopyranoside). A hidrólise do CPRG liberta um cromóforo, o vermelho de clorofenol
(CPR, do inglês chlorophenol red). A concentração de ferritina é diretamente proporcional à taxa de variação de cor devido à formação de CPR medida a 577/700nm [14].
Intervalo de Medição Analítica: 1 – 1000ng/mL [14]
Valores de Referência: Mulher: 8 – 252ng/mL [µg/L]; Homem: 26 – 388ng/mL [µg/L]; Combinadas: 8 – 388ng/mL [µg/L]
Ferro
Método: Adaptação do método desenvolvido por Smith et al. utilizando o cromóforo Ferene®3, que possui uma elevada sensibilidade para a determinação do ferro. A potencial interferência do cobre é minimizada pela adição de tioureia.
Em condições ácidas, o ferro férrico (Fe3+) ligado à transferrina é libertado. Na presença do agente redutor, ácido ascórbico, o Fe3+ é reduzido para ferro ferroso (Fe2+). O Fe2+ forma um complexo azul com o sal dissódico do àcido 5,5’(3-(2-piridil)-1,2,4-triazina-5,6-diil)-bis-2-furano-sulfónico (Ferene®). A absorvência do complexo é medida por uma técnica bicromática de ponto final (600, 700nm) sendo diretamente proporcional à concentração do ferro presente na amostra [13].
Intervalo de Medição Analítica: 5 – 1000µg/dL [0.9 – 179.0µmol/L] [13]
Valores de Referência: Homens: 65 – 175µg/dL [11.6 – 31.3µmol/L]; Mulheres: 50 – 170µg/dL [9.0 – 30.4µmol/L]
Transferrina
Amostra: Soro ou plasma heparinizado [15]. Método: Turbidimétrico.
A transferrina liga-se a anticorpo policlonal levando à formação de imunocomplexos. A adição de polietilenoglicol (PEG) que acelera a sua formação. O aumento da turvação é proporcional à concentração de transferrina, medida através de uma técnica bicromática de ponto final (340, 700nm) [15].
Intervalo de Medição Analítica: 40 – 750mg/dL [0.40 – 7.50g/L] [15] Valores de Referência: 202 – 364mg/dL [2.02 – 3.64g/L]
7.1.3. Avaliação da Função Cardíaca
O enfarte agudo do miocárdio (EAM) é uma das principais causas de morte e de incapacidade em todo o mundo, sendo a sua deteção precoce crucial. A nível laboratorial define-se com a subida e/ou descida do biomarcador cardíaco (de preferência troponina, ou como alternativa a isoenzima MB da creatina cinase - CKMB), pelo menos um valor acima do percentil 99 do Limite Superior de Referência [16].
No entanto, existem outros marcadores bioquímicos cardíacos e o conhecimento da sua cinética tem grande importância não só para auxiliar no diagnóstico, como na estratificação do risco, prognóstico, monitorização do doente, mostrando a extensão e comprometimento cardíaco.
A mioglobina é uma proteína heme encontrada no músculo cardíaco e esquelético sendo libertada para a circulação quando ocorre lesão celular. Na ausência de traumatismos do músculo esquelético ou de outros fatores que levam a um aumento de mioglobina circulante de origem não cardiaca, a sua determinação é utilizada como um marcador precoce de EAM (Tabela 3) [17].
A CKMB encontra-se essencialmente ao nível do músculo cardíaco e em concentrações substancialmente mais baixas no músculo esquelético. Esta isoenzima para além de ser um biomarcador de eleição para o perioperatório de EAM nas primeiras 48h, a sua determinação também tem sido utilizada para avaliar a extensão do enfarte e reenfartes subsequentes, apresentando uma boa sensibilidade, especificidade e eficiência para o diagnóstico (Tabela 3)
O complexo da troponina é constituído por três componentes polipeptídicos distintos: a troponina C, troponina I e a troponina T, que desempenham um papel essencial na contração do musculo estriado. O doseamento da troponina I pode ser utilizada como auxiliar no diagnóstico de EAM e na estratificação de risco em doentes com síndrome coronário agudo relativamente ao risco relativo de mortalidade. Também está aumentada em traumatismos no peito, cirurgia, insuficiência cardíaca congestiva (ICC), insuficiência renal, toxicidade cardíaca provocada por fármacos, miocardite, embolismo pulmonar, doenças infiltrativas e doenças neurológicas agudas. Este biomarcador é mais específico do que a CKMB para a deteção de lesões do miocárdio na presença de lesões do músculo esquelético (Tabela 3) [19].
Os péptidos natriuréticos cerebrais (BNP, do inglês Brain natriuretic peptide) têm propriedades natriuréticas, diuréticas e também são eficazes no controlo do funcionamento do sistema cardiovascular. O proBNP é segregado principalmente ao nível do ventrículo esquerdo, que posteriormente se dissocia em BNP (fisiologicamente ativo), e no fragmento N-terminal proBNP (NT-proBNP), que pode ser utilizado para fins de diagnóstico, prognóstico e estratificação do risco em doentes com síndromes coronários agudos e insuficiência cardíaca. A determinação do NT-proBNP ajuda a identificar indivíduos com disfunção no ventrículo esquerdo, que pode ocorrer devido a uma doença coronária, hipertensão arterial, doença valvular e doença primária do miocárdio, insuficiência cardíaca crónica. Nestes casos, ambas as concentrações de BNP e NT-proBNP aumentam. Também se verifica um aumento dos níveis de NT-proBNP em doentes com angina instável e após EAM [20].
Tabela 3. Marcadores bioquímicos após situação de EAM sem complicações (Adaptado de [17-19]).
EAM: enfarte agudo do miocárdio; CKMB: isoenzima MB da creatina cinase. Marcadores
Bioquímicos
Aumento após a
EAM Pico
Regresso aos Valores Basais
Mioglobina 1-3h 6-12h 24-36h
CKMB 4-8h 12-24h 48h
![Figura 1. Pictogramas de perigo [1].](https://thumb-eu.123doks.com/thumbv2/123dok_br/18145346.871426/34.892.120.769.223.917/figura-pictogramas-de-perigo.webp)
![Tabela 1. Triagem e acondicionamento de resíduos num laboratório (Adaptado de [2]).](https://thumb-eu.123doks.com/thumbv2/123dok_br/18145346.871426/35.892.119.787.148.1118/tabela-triagem-acondicionamento-resíduos-num-laboratório-adaptado.webp)

![Tabela 5. Compostos dosados na urina para o rastreio de drogas de abuso e respetivo conjugado (Adaptado de [82-87])](https://thumb-eu.123doks.com/thumbv2/123dok_br/18145346.871426/89.892.103.787.189.398/tabela-compostos-dosados-rastreio-drogas-respetivo-conjugado-adaptado.webp)
![Tabela 6. Concentrações utilizados para estabelecer valores de índice HIL (Adaptado de [90])](https://thumb-eu.123doks.com/thumbv2/123dok_br/18145346.871426/90.892.107.786.670.921/tabela-concentrações-utilizados-para-estabelecer-valores-índice-adaptado.webp)
![Tabela 8. Cilindros que podem ser observadas num sedimento urinário e o seu significado clínico (Adaptado de [91]) .](https://thumb-eu.123doks.com/thumbv2/123dok_br/18145346.871426/100.892.113.776.516.1071/tabela-cilindros-observadas-sedimento-urinário-significado-clínico-adaptado.webp)
![Tabela 9. Cristais que podem ser observadas num sedimento urinário e o pH a que se encontram (Adaptado de [91])](https://thumb-eu.123doks.com/thumbv2/123dok_br/18145346.871426/102.892.112.788.199.599/tabela-cristais-podem-observadas-sedimento-urinário-encontram-adaptado.webp)
![Figura 6. Tecnologia da focagem hidrodinâmica [99].](https://thumb-eu.123doks.com/thumbv2/123dok_br/18145346.871426/108.892.258.632.162.417/figura-tecnologia-da-focagem-hidrodinâmica.webp)
![Figura 8. Tecnologia da citometria de fluxo e sinais de dispersão da luz frontal, lateral e da fluorescência lateral [101]](https://thumb-eu.123doks.com/thumbv2/123dok_br/18145346.871426/110.892.109.787.742.988/figura-tecnologia-citometria-dispersão-frontal-lateral-fluorescência-lateral.webp)