UNIVERSIDADE FEDERAL DE UBERLÂNDIA
FACULDADE DE MEDICINA
PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
CARACTERIZAÇÃO DE BIOMOLÉCULAS E PADRÃO DE
EXPRESSÃO DE CITOCINAS NA TUBERCULOSE
Léa Duarte da Silva Morais
LÉA DUARTE DA SILVA MORAIS
CARACTERIZAÇÃO DE BIOMOLÉCULAS E PADRÃO DE
EXPRESSÃO DE CITOCINAS NA TUBERCULOSE
Orientador: Prof. Dr. Luiz Ricardo Goulart Filho
Uberlândia – MG 2017
Tese apresentada ao Programa de
Pós-Graduação em Ciências da
Saúde da Faculdade de Medicina da
Universidade Federal de Uberlândia,
como
requisito
parcial
para
a
obtenção do título de Doutora em
Ciências da Saúde.
Dados Internacionais de Catalogação na Publicação (CIP) Sistema de Bibliotecas da UFU, MG, Brasil.
M827c 2017
Morais, Léa Duarte da Silva, 1976
Caracterização de biomoléculas e padrão de expressão de citocinas na tuberculose / Léa Duarte da Silva Morais. - 2017.
136 f. : il.
Orientador: Luiz Ricardo Goulart Filho.
Tese (Doutorado) - Universidade Federal de Uberlândia, Programa de Pós-Graduação em Ciências da Saúde.
Disponível em: http://dx.doi.org/10.14393/ufu.te.2018.452 Inclui bibliografia.
1. Ciências médicas - Teses. 2. Tuberculose - Teses. 3. Saliva - Teses. 4. Biomarcadores - Teses. I. Goulart Filho, Luiz Ricardo. II. Universidade Federal de Uberlândia. Programa de Pós-Graduação em Ciências da Saúde. III. Título.
FOLHA DE APRESENTACÃO
LÉA DUARTE DA SILVA MORAIS
CARACTERIZAÇÃO DE BIOMOLÉCULAS E PADRÃO DE EXPRESSÃO DE CITOCINAS NA TUBERCULOSE
Presidente da banca: Prof. Dr. Luiz Ricardo Goulart Filho
Banca Examinadora:
______________________________________________ Titular: Professora Dra. Theolis Costa Barbosa Bessa
Instituição: Fundação Oswaldo Cruz
______________________________________________ Titular: Professor Dr.Julio Henrique Rosa Croda
Instituição: FIOCRUZ/UFMS
______________________________________________ Titular: Professor Dr. RobinsonSabino da Silva
Instituição: UFU
______________________________________________ Titular: Professor Dr. Thulio Marquez Cunha
Instituição: UFU
Tese apresentada ao Programa de Pós-Graduação em Ciências da Saúde da Faculdade de Medicina da Universidade Federal de Uberlândia, como requisito parcial para a obtenção do título de Doutora em Ciências da Saúde.
Dedico
aos pacientes
AGRADECIMENTOS
Agradeço a Deus,
“Porque Dele, por Ele e para Ele são todas as coisas” Rm11.36
Aos meus pais, Francisco e Lucila, meus maiores mestres, pelo apoio singular e exemplo.
Ao meu esposo, Márcio, minha outra metade; gratidão pela compreensão, apoio e companheirismo. Amo você.
Aos meus filhos, Emilli, Ezequiel e Daniel, por me fazerem mais forte, pela alegria de viver por vocês todos os dias. Obrigada pela compreensão e
paciência nas ausências, mesmo estando ao lado. Amor que não se mede.
Agradeço ao meu orientador Prof. Dr. Luiz Ricardo Goulart, por acreditar neste projeto e pela oportunidade de executá-lo, pelo otimismo e incentivo.
Que Deus prospere o seu trabalho!
À Dra. Fabiana Almeida, pelo auxílio, por ser amiga e professora sempre. Que BOM que você voltou!
À Patrícia Terra, a irmã do coração que nasceu entre um experimento e outro; descobrimos que tínhamos muito mais em comum que anseios por
resultados, sua amizade foi um presente de Deus!
À Luciana Machado pela solicitude e amizade. À Aline Gomes, Roberta, Ana Paula e Larissa pelo empenho
e colaboração nos experimentos e análises;
Às minhas amáveis irmãs e cunhados, aos meus sobrinhos, pelo estímulo e crédito não merecido, em especial à Marley, seu apoio e dedicação são
peculiares. Amo vocês.
Aos meus irmãos e irmãs por herança, em especial à Vera Lúcia, amiga presente sempre, cuidando de todos com detalhe, obrigada pelo seu apoio
e intercessão, foram muito importantes.
Aos amigos que ganhei no Laboratório de Nanobiotecnologia, pela receptividade sempre calorosa. Sempre me senti muito bem nesta “casa”.
Obrigada pela amizade, e pelas horas descontraídas e encorajadoras.
Aos colegas dos Laboratórios Colaboradores do Instituto de Genética.
Aos amigos e companheiros do Laboratório de Análises Clínicas do HC-UFU em especial do setor de Microbiologia, obrigada pelo apoio, pelas concessões neste
À equipe médica do Ambulatório de Moléstia Infecciosa e Pneumologia . Ao Professor Dr. Thulio e equipe pela cooperação no recrutamento dos
voluntários.
Aos pacientes e voluntários que se dispuseram a participar, pela doação das amostras clínicas e cooperação para a produção do conhecimento.
Às agências de fomento que financiaram esta pesquisa: FAPEMIG, CNPQ e INCT
O lugar mais alto que o homem pode chegar é aos pés da cruz.
RESUMO
A tuberculose (Tb) é uma infecção heterogênea causada pelo Mycobacterium tuberculosis (Mtb), com altos índices de mortalidade. O principal método diagnóstico consiste em achados bacteriológicos, carecendo de alternativas mais eficazes. Acurácia, agilidade e acessibilidade no diagnóstico são cruciais para a contenção do fluxo infeccioso. Neste trabalho, objetivamos caracterizar o padrão de expressão de 27 citocinas na saliva e no soro de pacientes com Tb em associação com o tempo de tratamento, avaliar a aplicação de peptídeos sintéticos, TBC10 e TB2C10, em ensaios imunoenzimáticos e biossensor para o diagnóstico da Tb pela saliva e selecionar ácidos nucleicos ligantes de proteínas específicas. 27 citocinas, em soro
e saliva de 86 indivíduos, foram dosadas simultaneamente por kit multiplex. Os indivíduos foram agrupados em TB (doentes sem tratamento), TBT (doentes em curso de tratamento), TBTDO (doentes ao término do tratamento), PPD+ (saudáveis reativos ao teste tuberculínico PPD) e C- (saudáveis não reativos ao PPD). Nove citocinas apresentaram maior expressão em TB que em C-. A expressão IL-2, IL-15 e IL-4 na saliva foi significativamente diferente entre doentes e PPD+. Todos os grupos positivos para Tb apresentaram maior expressão de IL-2, IL15, IL-8, IL-9 na saliva que indivíduos saudáveis. Os valores obtidos para IP-10 no soro permitiu distinguir os grupos positivos entre si e negativo, apresentando potencial pra monitoramento do tratamento de Tb. Seis citocinas, IL-13, IL-10, IL-6, IL-2, IL-15 e IL-8, foram significativamente mais expressas no soro dos grupos positivos que de saudáveis. O score associando as quatro citocinas com melhor representatividade na saliva e as seis no soro, permitiu predizer a infecção por Mtb com assertividade de 77% na saliva e 96% no soro. A quantificação de citocinas pode auxiliar no diagnóstico de Tb. Para validação dos peptídeos sintéticos, TBC10 e TB2C10 foram testados em imunoensaios pra detecção de IgA específica de tuberculose presente em saliva. Ambos foram capazes de discriminar doentes de saudáveis com sensibilidade de 94,12% e especificidades 76,92% e 84,62%, com valores de p<0,0001. Foi realizado um biopanning de anticorpo para caracterização molecular
dos ligantes de IgA específica de Tb, a partir de um fago C10. Obteve-se um scFv
(fragmento variável de cadeia única) capaz de se ligar a TBC10, TB2C10 e a
ligante de TBC10 e TB2C10. Quatro aptâmeros apresentaram capacidade de reconhecer os biomarcadores e também proteínas de Mtb. Tanto o scFv quanto os aptâmeros de DNA selecionados a partir dos biomarcadores puderam reconhecer proteínas de Mtb, confirmando a fidelidade dos epítopos das proteínas e dos biomarcadores. Os biomarcadores TBC10 e TB2C10 apresentaram alto potencial de aplicação para diagnóstico de Tb através da saliva, os aptâmeros, úteis para
confirmação da identidade dos epítopos ligantes a IgA, apresentaram potencial para fins diagnósticos e terapêuticos, assim como os scores utilizados a partir da
expressão de citocinas em soro e saliva permitem predizer a infecção ativa de tuberculose.
ABSTRACT
Tuberculosis (TB) is a heterogeneous infection caused by Mycobacterium
tuberculosis (Mtb), with high mortality rates. The main diagnostic method consists of
bacteriological findings, lacking more effective alternatives. Accuracy, agility and
accessibility in diagnosis are crucial for the containment of infectious flow. In this
work, we aimed to characterize the expression pattern of 27 cytokines in the saliva
and serum of patients with Tb in association with the time of treatment, to evaluate
the application of synthetic peptides, TBC10 and TB2C10, in immunoenzymatic and
biosensor assays for the diagnosis of Tb by saliva and select specific protein binding
nucleic acids. 27 cytokines, in serum and saliva of 86 individuals, were
simultaneously dosed by multiplex kit. The individuals were grouped into TB
(untreated patients), TBT (patients undergoing treatment), TBTDO (patients at the
end of treatment), PPD + (healthy individuals reactive tuberculin test PPD) and C-
(healthy non-reactive to PPD). Nine cytokines presented greater expression in TB
than in C-. The expression IL-2, IL-15 and IL-4 in saliva was significantly different
between patients and PPD +. All Tb-positive groups had higher expression of IL-2,
IL-15, IL-8, IL-9 in saliva than healthy individuals. The values obtained for IP-10 in
the serum allowed to distinguish the positive groups from each other and negative,
presenting potential for monitoring the treatment of Tb. Six cytokines, 13, 10,
IL-6, IL-2, IL-15 and IL-8 were significantly more expressed in serum than the positive
groups. The score associated with the four cytokines with better representativeness
in the saliva and the six in the serum allowed to predict Mtb infection with
assertiveness of 77% in saliva and 96% in serum. Quantification of cytokines may aid
in the diagnosis of Tb. For the validation of the synthetic peptides, TBC10 and
TB2C10 were tested in immunoassays for the detection of specific IgA of
tuberculosis present in saliva. Both were able to discriminate healthy patients with
sensitivity of 94.12% and specificities 76.92% and 84.62%, with values of p <0.0001.
An antibody biopanning was performed for molecular characterization of Tb-specific
IgA ligands from a C10 phage. A scFv (single chain variable fragment) was obtained
capable of binding to TBC10, TB2C10 and Mtb proteins, which allowed to delineate
the likely epitopes of Mtb proteins recognized by IgA. SELEX was used to select
TBC10 and TB2C10 binding DNA molecules. Four aptamers were able to recognize
from the biomarkers were able to recognize Mtb proteins, confirming the fidelity of
protein epitopes and biomarkers. The biomarkers TBC10 and TB2C10 presented
high potential of application for diagnosis of Tb through saliva, the aptamers, useful
for confirming the identity of IgA binding epitopes, presented potential for diagnostic
and therapeutic purposes, as well as the scores used from the expression of
cytokines in serum and saliva allow prediction of active tuberculosis infection.
LISTA DE ILUSTRAÇÕES
Capítulo I:
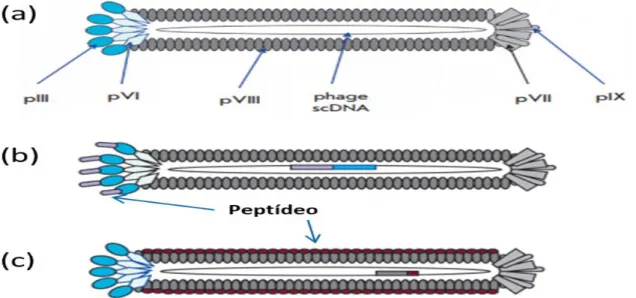
Figura 01 - Esquema representativo de um bacteriófago filamentoso: (a) fago filamentoso tipo selvagem ilustrando as proteínas do capsídeo viral: pIX, pVII, pVIII, pVI e pIII, (b) peptídeo fusionado à pIII do fago, (c) peptídeo fusionado à pVIII do fago (TIKUNOVA; MOROZOVA, 2009).
Capítulo II:
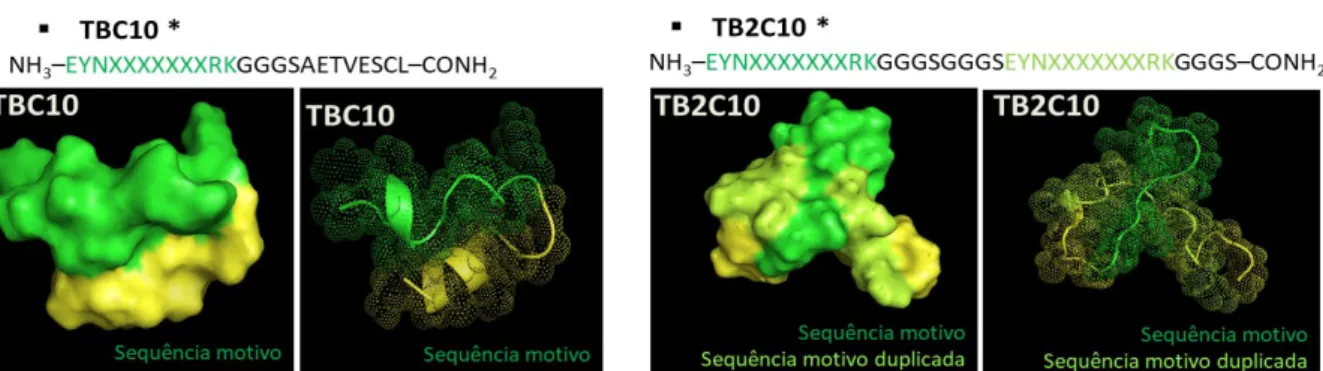
Figura 01: Representação sequencial e estrutura molecular dos peptídeos TBC10 e TB2C10. TBC10 - Motivo proteico de 12 aminoácidos em verde, espaçador
e parte da PIII do fago em amarelo, TB2C10 – Motivo proteico de 12 aminoácidos
em verde, motivo proteico duplicado em verde limão e espaçador em amarelo. *As sequências estão protegidas.
Figura 02: ELISA Avaliação em ELISA da reatividade de C10, TBC10 e TB2C10 frente a IgA de saliva de indivíduos positivos para Tb não tratados (PNT), de indivíduos positivos para Tb em tratamento (PT), indivíduos sadios PPD+ (NP+) e indivíduos sadios PPD- (NP-). Representação das curvas ROC geradas a partir do ELISA, com seus respectivos valores de sensibilidade (Se), especificidade (Sp), OddsRatio (OR), Intervalo de confiança (IC), área da curva ROC (AUC) e valor de p.
Figura 03: Sensor Eletroquímico. Detecção por voltametria de pulso diferencial da ligação de IgA em TBC10 e TB2C10 imobilizados em eletrodos de grafite, tampão fosfato 0,1M foi usado como eletrólito (pH 7,4). Em verde valores da corrente em
eletrodo vazio, azul os valores após imobilização do alvo e tratamento com pool de
saliva NP-, vermelho os valores após imobilização do alvo e tratamento com pool de
saliva PNT.
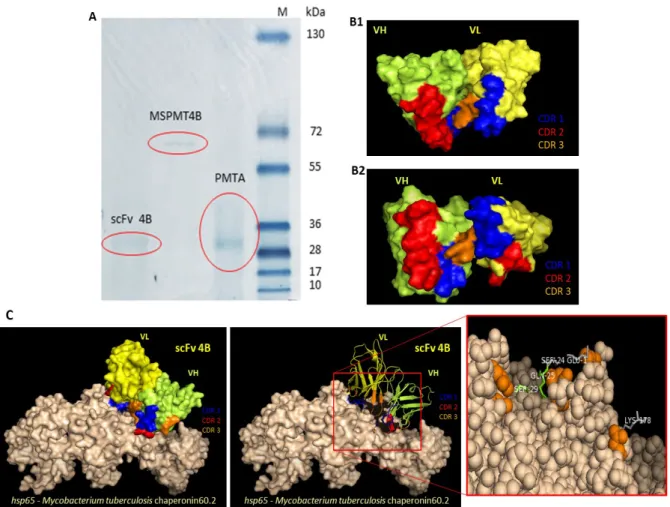
Figura 04: Reatividade dos fragmentos scFv. (A) Ensaio dot blot da expressão de clones scFv, (B) ELISA para avaliação do padrão de expressão dos clones selecionados e capacidade de reconhecimento do alvo, (C) reatividade do clone 4B
ao fago (C10), aos peptídeos (TBC10 e TB2C10), a proteínas de: M. tuberculosis
(PMt), Strongyloides sp (PSs), Brucella sp (PBs), Candida sp (PCs) e Escherichia
coli (PEc).
Figura 05: Caracterização molecular de ligantes. (A) Gel SDS PAGE com as bandas da moléculas scFv 4B (~28kDa), fração proteica imunocaptura pelo scFv
(MSPMT4B) ~65kDa, e extrato proteico de M. tuberculosis (PMTA) ~30kDa. (B)
proteína chaperonin60.2/hsp65 de M. tuberculosis com destaque pra os aminoácidos de ligação.
Figura S01: Reatividade do fago C10 à IgA de saliva. A- Avaliação em phage-ELISA da reatividade do fago C10 frente a saliva de pacientes doentes não tratados (PNT), doentes em tratamento (PT), indivíduos sadios PPD+ (NP+) e indivíduos
sadios PPD- (NP-). B- Representação da curva ROC gerada a partir do
phage-ELISA, com o valor da área obtida e valor de p.
Figura S02: Representação do percentual de IgA alvo-específica em relação à IgA total na saliva de cada indivíduo nos grupos positivos para TB sem tratamento (PNT), positivos para TB em curso de tratamento (PT), controles negativos para TB não reativos ao PPD (NP-) e controles negativos para TB reativos ao PPD (NP+).
Figura S03: Correlação Fago C10 X TBC10/TB2C10. Representação gráfica da correlação da afinidade dos peptídeos sintéticos TBC10 e TB2C10 frente a IgA de saliva em relação à do fago C10.
Capítulo III:
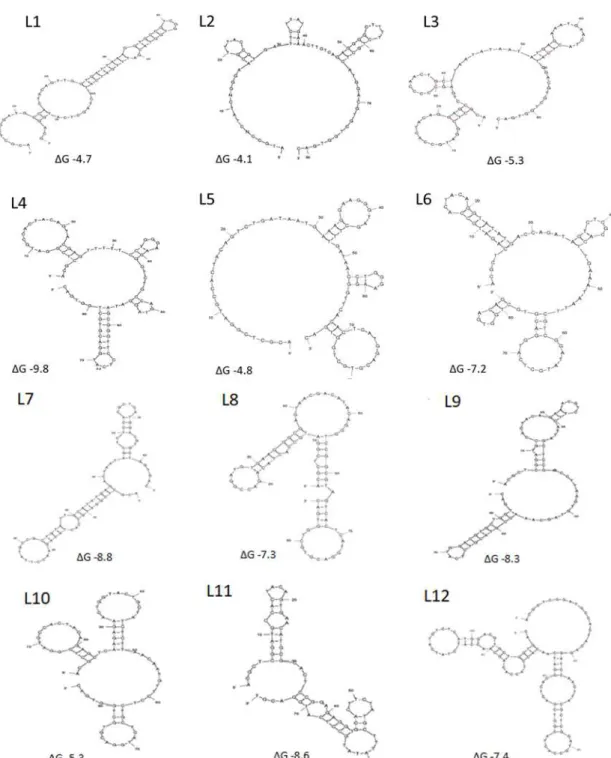
Figura 01: Estrutura secundária de aptâmeros selecionados contra peptídeo sintético TBC10 mimético a proteínas de M. tuberculosis.
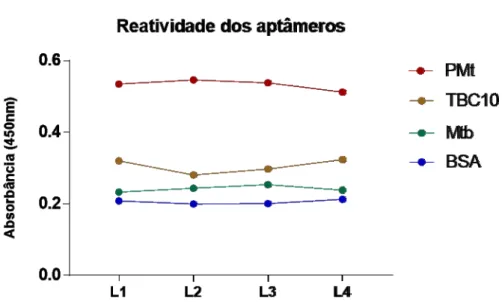
Figura 02: ELISA – reatividade dos aptâmeros L1, L2, L3 e L4 contra o peptídeo TBC10, proteínas de M. tuberculosis (PMt), bacilo M. tuberculosis inativo (Mtb), e BSA como controle negativo.
Capítulo IV:
Figura 01: Citocinas com expressão significativa na Tb/soro - Expressão, em soro, das citocinas IL-13, IL-10, IL-6, IL-2, IL-8 e IL-15 nos grupos TB (positivos sem tratamento), TBT (positivos em tratamento), TBTDO (positivos tratados), PPD+ (saudáveis PPD+) e C- (saudáveis não reativos ao PPD).
Figura 02: Perfil de expressão de IP-10 no soro - Representação gráfica do padrão de expressão da IP-10 em soro. Onde TB (positivos sem tratamento), TBT (positivos em tratamento), TBTDO (positivos tratados) e C- (saudáveis não reativos ao PPD). Curvas ROC para os grupos TBxC-, TBxTBTDO e TBTxC- com respectivos valores de p e área.
Figura 03: Citocinas com expressão significativa na Tb/saliva - Expressão, em saliva, das citocinas IL-2, IL-15, IL-8 IL-9, RANTES e IL-12p70 nos grupos TB (positivos sem tratamento), TBT (positivos em tratamento), TBTDO (positivos tratados), PPD+ (saudáveis PPD+) e C- (saudáveis PPD-).
LISTA DE TABELAS
Capítulo I:
Tabela 01: Métodos diagnósticos de tuberculose.
Capítulo II:
Tabela 01: Dados demográficos das amostras.
Capítulo IV:
Tabela 01: Dados demográficos amostrais.
Tabela 02A: Valores significativos de p (<0,05) para comparação dos grupos a partir
de citocinas de soro.
Tabela 02B: Valores significativos de p (<0,05) para comparação dos grupos a partir
de citocinas de saliva.
Tabela 03: Referenciais estatísticos das citocinas significativamente mais expressas
Tabela 04: Score da combinação de citocinas em saliva e soro / percentual de acerto.
TabS1: Concentração de citocinas na saliva: TB, TBT, TBTDO, PPD+ e C-. Em pg/mL, apresentados pela mediana (interquartil). TB (positivos sem tratamento), TBT (positivos em tratamento), TBTDO (positivos tratados), PPD+ (saudáveis PPD+) e C- (saudáveis PPD-).
LISTA DE ABREVIATURAS E SIGLAS
3D Três dimensões
a.a aminoácidos
Ag85 Antígeno 85
anti-HA/HRP Anti-IgA conjugada com peroxidase humana AUC Area under curve, área sob a curva
BCG Bacilo Calmette-Guérin
BLAST Basic Local Alignment Search Tool
BSA Bovin Serum Albumin, soro albumina bovina
C- Controle negativo para Tb não reativo ao teste tuberculínico C10 Fago de peptídeo mimético à proteínas de M. tuberculosis CaCl2 Cloreto de cálcio
CDR Complementarity Determining Region, região determinante de complementariedade (região variável)
CFP-10 Culture Filtrate Protein-10 kDa DAB 3,3-diaminobenzidina
DNA Deoxyribonucleic Acid, ácido desoxirribonucléico
DOT Directly Observed Treatment, Tratamento Diretamente Observado ELISA Enzyme-linked immunosorbent assay, ensaio imunoenzimático ESAT-6 early secreted antigenic target-6 kDa
FGF Fator de Crescimento Fibroblasto Fr Framework Region, região conservada Fv Variable Fragment, fragmento variável
g Gravidade
G-CSF Fator estimulante de colônia de granulócito
GM-CSF Fator estimulante de colônia de granulócito e macrófago H2O2 Peróxido de hidrogênio
H2SO4 Ácido sulfúrico
HA Hemaglutinina HCl Ácido clorídrico His Histidina
IC Intervalo de confiança IFN-γ Interferon-gama IgA Imunoglobulina A IL Interleucina
IL-1Ra Receptor antagonista de IL-1
IP-10 Proteína 10 induzida por interferon gama
IPTG Isopropil b-D-thiogalactopiranosideo kDa kiloDalton
LJ Lowenstein Jensen
LTBI Infecção Latente de Tuberculose
M Molar
M13 Bacteriófago M13
MCP-1 Monocyte Chemoattractant Protein, proteínas quimioatraentes de monócito
MIP-1 Proteínas Inflamatórias de Macrófagos mL Mililitro
mM Milimolar
MPT64 proteína de M. tuberculosis
MSPMT4B Proteína de sobrenadante de cultura de M. tuberculosis imunocapturada pelo scFv 4B
Mtb Mycobacterium tuberculosis
N Normal
NaCl Cloreto de sódio
ng Nanograma
NH4HCO3 Bicarbonato de amônio
NK Natural Killer
nm Nanômetro
NP- Controle negativo para Tb, não reativo ao PPD NP+ Controle negative, reativo ao PPD
ºC Graus Celsius OD Densidade ótica
OMS Organização Mundial de Saúde OPD orthophenylenediamine
p Nível de significância PBs Proteína de Brucella sp
PBS Phosphate Buffered Saline, salina tamponada com fosfato PBST PBS acrescido de Tween 20
PCR Polymerase Chain Reaction, reação em cadeia da polimerase PCs Proteína de Candida sp
PDB Protein Data Bank
PDGF-bb Factor de crescimento derivado de plaquetas PEc Proteínas de Escherichia coli
pH Potencial hidrogeniônico
pIII Proteína III do capsídeo de bacteriófagos filamentosos PM Peso molecular
PMt Proteína de M. tuberculosis
PMTA Proteína de sobrenadante de cultura de M. tuberculosis PNT Positivo não tratado
PPD Proteína Purificada Derivada PPD+ Controle saudável reativo ao PPD PSs Proteína de Strongyloides sp
RANTES Regulated on Activation, Normal T Cell Expressed and Secreted RD1 Região de Diferenciação 1
RNA Ácido Ribonucleico
ROC Receiver operating characteristic curve, curva ROC rpm Rotações por minuto
SB Superbroth
scFv single-chain variable fragment; fragmento variável de cadeia única SDS-PAGE Sodium dodecyl sulfate poly-acrilamide gel eletrophoresis,
eletroforese em gel de poliacrilamida com dodecil sulfato de sódio Se Sensibilidade
SELEX Systematic Evolution of Ligands by EXponential Enrichment)
Evolução Sistemática de Ligantes por Enriquecimmento Exponencial Sp Especificidade
ssDNA single strain DNA, DNA de fita simples TA Temperatura ambiente
TabS2 Tabela suplementar 2 Tb Tuberculose
TB2C10 Peptídeo TB2C10 TBC10 Peptídeo TBC10
TBT Positivos para Tb em tratamento TBTDO Positivos para Tb tratados
TNF- α Tumor necrosis factor alpha, fator de necrose tumoral alfa Tris tris(hidroximetil) aminometano
UFU Universidade Federal de Uberlândia VCSM13 Bacteriófago auxiliar VCSM13
VEGF Fator de Crescimento Endotelial Vascular VH Cadeia pesada
VL Cadeia leve
μg Micrograma
μL Microlitro
μM Micromolar
SUMÁRIO
Introdução ... 22
Capítulo I Fundamentação teórica ... 24
Tuberculose ... 25
Etiologia ... 25
Infecção ... 25
Epidemiologia ... 26
Tratamento ... 27
Vacina ... 27
Resposta Imunológica ... 28
Diagnóstico ... 29
Amostras clínicas... 31
Biomarcadores ... 31
Phage display ... 32
Biopanning de peptídeo ... 34
Biopannning de anticorpo ... 34
SELEX ... 34
Referências ... 36
Objetivos ... 44
Capítulo II Biomarcadores para o diagnóstico de tuberculose pela saliva ... 46
Introdução ... 48
Resultados ... 49
Síntese de peptídeos ... 49
Imunorreatividade e biossensor ... 50
Seleção de scFv ... 51
Imunocaptura e caracterização molecular de ligantes ... 52
Materiais e métodos ... 55 Referências ... 60 Suplementar... 63
Capítulo III
Novos aptâmeros ligantes aos antígenos de Mycobacterium tuberculosis ... 64 Introdução ... 66 Material e métodos ... 67 Resultados ... 69 Discussão ... 71 Referências ... 72
Capítulo IV
Perfil de expressão de citocinas na tuberculose: da doença à cura ... 75 Introdução ... 77 Materiais e métodos ... 77
Resultados ... 79
Perfil de expressão de citocinas ... 79 Discussão ... 80
Referências bibliográficas: ... 83 Figuras ... 86 Tabelas ... 90
ANEXO A
Patente BR 10 2017 015071 2 - Peptídeos recombinantes associados à .
INTRODUÇÃO
A tuberculose (Tb) é uma doença antiga e está entre as dez que mais assolam a humanidade. Diretamente associada à pobreza, condições sanitárias precárias, nutrição e imunidade comprometida, a Tb é uma das principais causas de morte. Embora milenar a tuberculose ainda é um grave problema de saúde pública. Estima-se que um terço da população conviva com a infecção latente (LTBI), onde o bacilo Mycobacterium tuberculosis consegue sobreviver silenciosamente no interior de macrófagos.
A resposta imunológica da Tb é realizada principalmente por macrófagos e células T e é predominantemente celular, orquestrada por citocinas e quimiocinas. A susceptibilidade do indivíduo para desenvolver a doença, os eventos imunológicos e a complexa interação das proteínas do parasito com as células do hospedeiro determinam a heterogeneidade da infecção tuberculosa.
A principal ação de controle de doenças infecciosas consiste na descoberta de casos novos e tratamento efetiva. Os métodos diagnósticos atualmente
utilizados, bacteriológicos, radiológicos e imunoenzimáticos, são limitados quanto à sensibilidade, praticidade e extensão, dificultando a ideal descoberta precoce da infecção. Os esforços empregados para se conhecer melhor esta doença, desenvolver metodologias diagnósticas e encontrar alternativas que possibilitem a contenção da propagação da Tb são pertinentes e ainda não atingiram seus objetivos. É preciso maior viabilidade técnica que permita em tempo hábil diagnosticar e avaliar a resposta ao tratamento, garantir a eficácia do mesmo, minimizar a incidência da doença e facilidade de propagação.
É importante considerar que somente indivíduos com infecção ativa transmitem a doença, contudo, além de controlar a infecção ativa, impedir que a infecção latente reative é válido e promissor na redução da incidência. Encontrar biomarcadores que permitam definir e compreender melhor os diferentes estágios da doença representaria um grande avanço para monitoramento e controle da epidemia.
permitiu obtenção de peptídeos de 12 aminoácidos fusionados a fagos (C10) com capacidade de reconhecer IgA específicas de tuberculose em saliva. As análises in silico mostraram que os peptídeos apresentavam similaridade a proteínas de M. tuberculosis de importante valor analítico para o diagnóstico de tuberculose.
O peptídeo mimético a M. tuberculosis (C10) foi utilizado para síntese e caracterização de biomoléculas aplicáveis em plataformas para o diagnóstico de
CAPÍTULO I
1. TUBERCULOSE
A tuberculose (Tb) é uma doença contagiosa, causada pelo bacilo Mycobacterium tuberculosis (Mtb), que afeta tipicamente os pulmões, mas pode também afetar outros órgãos e sítios. A forma mais comum de infecção do M. tuberculosis se dá por via aerógena, pela inalação de gotículas contendo a bactéria, quando o doente com Tb de pulmão (em fase bacilífera) espirra ou tosse (FLYNN, JOANNE L; CHAN, 2001).
A variedade de manifestações clínicas é decorrente dos diversos mecanismos de escape e fatores de virulência da bactéria, além da heterogeneidade da resposta imunológica dos indivíduos. A forma como a infecção se estabelece e a reativação
da doença pode ser definida pela ação de proteínas secretadas pelo Mtb que interferem na regulação da resposta imune do hospedeiro, assim como um conjunto de fatores como ambiente, hospedeiro, patógeno, coinfecção por HIV, má nutrição e outras imunodeficiências (BEHAR; DIVANGAHI; REMOLD, 2010; GOLDBERG;
SAINI; PORCELLI, 2014; O’GARRA et al., 2013)
O grau de comprometimento do órgão afetado e magnitude das manifestações clínicas, e principalmente das formas subclínicas, associadas às limitações diagnósticas são fatores cruciais para a assertividade do tratamento e contenção da doença (CADENA; FORTUNE; FLYNN, 2017; PAI et al., 2016a).
1.1. ETIOLOGIA
O agente causador, o Mycobacterium tuberculosis, foi descoberto em 1882 por Robert Koch, que o isolou ao conseguir o seu cultivo e reproduzir a doença em animais de laboratório (CAMBAU; DRANCOURT, 2014). É um bacilo delgado, ligeiramente encurvado de 1,0 a 4,0 µm de comprimento e 0,3 a 0,6 µm de diâmetro, é considerado um parasito intracelular facultativo, de crescimento lento (FLYNN, JOANNE L; CHAN, 2001), bastante hábil para persistir dentro de macrófagos de indivíduos imunocompetentes (CAMBAU; DRANCOURT, 2014; FLYNN, JOANNE L.; CHAN, 2003).
1.2. INFECÇÃO
inflamação com secreção de citocinas e estímulo e quimiotaxia de células imunitárias, formando um aglomerado organizado de células, denominado granuloma. No interior dos granulomas, onde há predomínio de macrófagos infectados, alguns macrófagos sobrem apoptose como uma das formas de eliminar o bacilo, ocasionando uma necrose, que caracteriza o núcleo caseoso. Estes eventos ocorrem nos pulmões e tem como característica tosse persistente, hemoptise,
importante perda de peso e febre, que caracteriza a infecção primária. (AHMAD, 2011; PIETERS, 2008; SULIS et al., 2014; WALZL et al., 2011).
Com a ruptura de macrófagos, o bacilo fica livre no interior do cáseo e favorecido pela maior aeração, prolifera e infecta novos macrófagos, que ao alcançar a circulação pode veicular a bactéria para outros locais. O equilíbrio entre o Mtb e o macrófago é o que define infecção latente (LTBI), sem aparentes sintomas pode perdurar por muito tempo (AKHTER; TUNDUP; HASNAIN, 2007; CADENA; FORTUNE; FLYNN, 2017)
Em indivíduos com LTBI, caso haja imunossupressão, pode ocorrer a reativação da forma ativa da infecção, com aparecimento dos sintomas e possivelmente novos focos infecciosos (FLYNN, JOANNE L.; CHAN, 2003; LAPA; SILVA; BOÉCHAT, 2004).
1.3. EPIDEMIOLOGIA
Estima-se cerca de 10,4 milhões de casos novos de Tb em 2015, e 1,4 milhões de mortes associadas à doença, sendo uma das 10 principais causas de morte em todo o mundo (WHO, 2016). A Tb é um problema de saúde pública grave tanto pela facilidade de propagação e quanto pela dificuldade de contenção das vias de transmissão, um problema social relacionado às condições econômicas, condições de moradias, além dos fatores relacionados ao sistema imunológico, o que torna as populações vulneráveis mais susceptíveis a desenvolver a doença. A descoberta precoce dos casos bacilíferos é fundamental para interromper a cadeia de transmissão (BRASIL, 2011).
Os altos índices de mortalidade e de disseminação da doença indicam a necessidade de maiores cuidados e investimentos no sentido de controlar a doença.
doença, sugerindo a implantação de programas de monitoramento ao doente (WHO, 2008), favorecendo a implantação e disponibilidade de métodos diagnósticos, para enfrentar o desafio de contenção da epidemia da tuberculose, com o
estabelecimento de metas para o “fim da tuberculose até 2030” (WHO, 2016)
1.4. TRATAMENTO
A Tb é curável desde que o tratamento seja realizado, com associação apropriada de drogas antituberculose, dose e tempo de tratamento adequados. A associação de medicamentos é feita a base de drogas com alto poder esterilizante, rifampicina e isoniazida associadas a outras quatro drogas, por tempo mínimo de
seis meses (WHO, 2016).
O surgimento de cepas de M. tuberculosis resistentes aos fármacos é um agravante no controle da Tb (DUTTA et al., 2007). A rifampicina, antibiótico utilizado no tratamento da tuberculose, é a "chave" do esquema terapêutico, (O’GARRA et al., 2013). Outra dificuldade relativa ao controle da doença observada é o abandono do tratamento por parte dos indivíduos, pelo fato de ser de longa duração e ser composto de um esquema múltiplo de drogas com seus efeitos adversos. O DOT (Directly Observed Treatment) é uma das estratégias criadas pela OMS que consiste no monitoramento ao paciente durante o tratamento a fim de garantir o uso correto dos medicamentos e não abandono do tratamento (WHO, 2008).
1.5. VACINA
A BCG, sigla para Bacilo Calmette-Guérin, é o nome da vacina preparada a partir de Mycobacterium bovis com a região de diferenciação (RD1) inativada. RD1 é a região gênica que codifica proteínas de alta virulência em algumas espécies de Mycobacterium. É a única vacina licenciada para uso em humanos. Estudos avaliam quem sua eficácia seja variável entre 60 a 80% de proteção contra as formas mais graves da doença em criança, contribui para o controle da epidemia e diminui significativamente o risco das manifestações graves hematogênicas (MANGTANI et al., 2014; ROSEMBERG, 2001; ROY et al., 2014; TEIXEIRA; ABRAMO; MUNK, 2007)
fragmentos de Mtb, vetores virais, BCG recombinante e até Mtb vivo atenuado (PAI et al., 2016b). Há também expectativas com relação à vacinas de DNA, que são relativamente simples, mas ainda há muito que caminhar para compreender a diversidade de epítopos antigênicos do Mtb e os mecanismos relativos à imunidade celular em que a Tb está circunscrita (APARECIDA et al., 2004; ROSEMBERG, 2001). Uma vacina eficaz deverá ser capaz de proteger a reativação da infecção.
1.6. RESPOSTA IMUNOLÓGICA
A principal característica da Tb em humanos é a formação do granuloma, importante para contenção da bactéria, porém, no granuloma ocorre a comunicação
entre o parasito e as células do hospedeiro, é também local que propicia a proliferação do bacilo, que o torna favorável ao parasito. A resposta imunológica ao Mtb depende de como será organizada e de sua manutenção para contenção e eliminação do bacilo e envolve células fagocíticas e subpopulações de linfócitos T e é mediada por citocinas e quimiocinas (O’GARRA et al., 2013; PIETERS, 2008; PORCELLI; GOLDBERG; SAINI, 2014).
A secreção de proteínas pelo Mtb é que garante sua evasão da ação deletéria das células de defesa. Proteínas como, lipoproteínas, lipoarabinomanana (LAM), culture filtrate protein-10 kDa (CFP-10), early secreted antigenic target-6 kDa (ESAT-6), proteína imunogênicaMPT64, Ag85A, B e C, e as hsp60, são capazes de impedir a fusão do fago-lisossomo, inativar caminhos autofágicos intracelulares e inibir vias de reconhecimento, limitando as respostas imunes inatas e o desenvolvimento da resposta imune adaptativa (GRÖSCHEL et al., 2016; PAI et al., 2016b; ROSEMBERG, 2001).
Muitos estudos tem buscado compreender melhor o papel destas proteínas e suas interações celulares (BELAY; BJUNE; AMEN, 2011; HETT et al., 2007; MUKHERJEE et al., 2007; PYDI et al., 2011; ZHANG, H et al., 2006). A população celular envolvida da resposta imunológica da Tb é diversa, e o arranjo entre as células imunológicas do hospedeiro frente à bactéria é orquestrado por citocinas que
são produzidas por células ativadas.
O macrófago é a principal célula de defesa na imunidade contra Tb, é
desencadeiam uma cascata de produção e secreção de citocinas e quimiocinas que atuam simultaneamente para estabelecer e controlar a resposta imunológica para eliminação do bacilo (ANBARASU; PONNU RAJA; RAJA, 2013; BARNES et al., 1993; BOURGARIT et al., 2006; CHANDRASHEKARA et al., 2016; CHEGOU et al., 2014; CHEN et al., 2012; CHOWDHURY et al., 2014; CLIFFORD et al., 2015; DUFOUR et al., 2002).
Em resumo, são muitas variáveis que envolvem a resposta imunológica da Tb, seja a capacidade celular de eliminar o bacilo, seja o padrão de respostas de citocinas, particularidades do hospedeiro e susceptibilidade genética, ou ainda pela variabilidade de antígenos virulentos associados a biodiversidade micobacteriana. (JACOBS et al., 2016; JEONG et al., 2015; KASSA et al., 2016; LAZAREVIC et al., 2005; WANG et al., 2012; WON et al., 2017).
1.7. DIAGNÓSTICO
Os métodos diagnósticos atualmente utilizados apresentam limitações, quanto à sensibilidade e agilidade, e de modo geral carecem de mão de obra e infraestrutura especializada.
O diagnóstico se baseia em métodos radiográficos, sorológicos, achados bacteriológicos e amplificação de ácidos nucléicos Tabela 01. A radiografia por raios-X requer equipamento especializado, porém é útil como método auxiliar em infecções paucibacilares e exclusão de outras patologias que exigem tratamento concomitante (ANISE OSÓRIO FERRI ET AL., 2014). A bacterioscopia, pesquisa de bacilos álcool-ácido resistente – coloração de Ziehl Neelsen, é o método mais utilizado para diagnóstico de casos novos e também monitoramento da redução da carga bacilar durante o tratamento, é barato, tem ótima especificidade, porém é pouco sensível, observador dependente e limitado pela representatividade e qualidade da amostra clínica. A cultura do bacilo, considerada padrão-ouro, é altamente específica, indicada para a confirmação dos casos novos e monitoramento do tratamento, permite determinar suscetibilidade à drogas, contudo
demanda tempo, é semi-quantitativa, e também requer infra-estrutura adequada e especializada(CHEE et al., 2013). O teste da tuberculina, também conhecido como
necessariamente a doença, a positividade indica somente a exposição prévia ao antígeno, mas não implica em infecção ativa. A detecção de ácidos nucléicos, mais recentemente GeneXpert MTB/RIF é altamente específico e sensível, porém além do alto custo não pode diferenciar doença ativa de infecção tratada, além de não detectar micobacterioses atípicas e não é aplicável ao diagnóstico de recidivas e nem monitoramento do tratamento. Quanto à sorologia, é o método mais prático,
mas os antígenos atuais não permitem distinguir a tuberculose ativa da infecção latente, não sendo aplicáveis a áreas endêmicas(CAILLEAUX-CEZAR, 2012). O exame bioquímico ADA – Adenosina Deaminase - é aplicável para o diagnóstico de tuberculose pleural, mas de baixa acurácia a infecções mycobacteriana de outros sítios. Os testes diagnósticos atualmente utilizados deixam a desejar, o que dificulta o rastreamento do doente e o monitoramento da evolução clínica (BRASIL, 2011; GOLETTI et al., 2016; GUTLAPALLI et al., 2016; WHO, 2006).
Tabela 01: Métodos diagnósticos de tuberculose
Método Sensibilidade Especificidade Limitações
Radiografia Satisfatória Baixa Equipamento especializado
Microscopia
(Pesquisa de BAAR) Baixa Alta
Representatividade amostral Observador dependente
Cultura Alta Alta Serviço especializado e tempo
PCR Alta Alta Custo Elevado e Infra-estrutura
elaborada
IGRAs (Interferon-gamma release assay)
Baixa Variável Não aplicável em áreas
endêmicas
PPD Baixa Baixa Detecta apenas a infecção.
Diante deste contexto, a grande preocupação a nível mundial continua a ser a falta de um diagnóstico para a tuberculose ativa de baixo custo e fácil utilização em campo (point-of-care) e que viabilize mais agilidade no diagnóstico e início de
permita melhor atender a população mais vulnerável, os que vivem em situação de rua, privados de liberdade, classes menos favorecidas.
1.8. AMOSTRAS CLÍNICAS
A Tb pulmonar representa 90% das infecções por Mtb, cujo diagnóstico é realizado principalmente por bacterioscopia no escarro. Apesar de predominantemente utilizado em testes diagnósticos, a representatividade deste espécime clínico é diretamente influenciada por fatores diversos como horário e qualidade da coleta, expectoração e outros fatores relacionados à condição física do doente, e coopera para a baixa sensibilidade do exame bacterioscópico. Embora o
soro seja uma amostra clínica com boa representatividade do estado do organismo, e utilizada amplamente em diversos diagnósticos, não oferece possibilidades satisfatórias para o diagnóstico de tuberculose em virtude da heterogeneidade da infecção (POTTUMARTHY; WELLS; MORRIS, 2000).
Alguns pesquisadores chamam a atenção para o fato do fluido salivar, apresentar excelente potencial diagnóstico por conter numerosas proteínas, fragmentos proteicos e anticorpos, que conferem a este fluido importante valor analítico (LARREA et al., 2006; LAWRENCE, 2002; RIBEIRO et al., 2010; STRECKFUS; BIGLER, 2002; TABAK; PH, 2001). Cerca de 85% dos anticorpos presentes na saliva são imunoglobulinas A que geralmente desempenham papel protetor, se ligando às bactérias bloqueando estruturas de ligação inibindo a aderência das mesmas (VAN NIEUW AMERONGEN; BOLSCHER; VEERMAN, 2004). A representatividade amostral deste fluido vem sendo explorada para o diagnóstico e monitoramento de tratamento de várias patologias como câncer, cardiopatias e doenças infecciosas (JACOBS et al., 2016; YAP; SIL; NG, 2011).
A saliva é uma alternativa amostral promissora tanto para o diagnóstico de doenças infecciosas quanto para o monitoramento da evolução do tratamento por sua produção contínua, evidenciando mais precisamente o estado atual do organismo (LAWRENCE, 2002). Além disso, agrega a vantagem de coleta não
invasiva e indolor para o indivíduo. Portanto, identificar biomarcadores presentes na saliva pode contribuir para o monitoramento de tuberculose.
Os produtos celulares e metabólitos de Mycobacterium tuberculosis podem ser detectados diretamente no sangue, saliva, urina e outros espécimes clínicos. Alguns destes componentes celulares têm sido propostos como biomarcadores para diagnóstico de Tb, tais como fragmentos de DNA, proteínas da parede celular, lipoarabinomanan(LAM), complexos proteicos secretados (CFP-10/ESAT-6) e antígenos Ag85, MPT64, hsp60 e outros (BORGSTRÖM et al., 2011;
“CARACTERIZAÇÃO DOS NÍVEIS PLASMÁTICOS E DO POLIMORFISMO
+874T/A NO GENE IFN-γ EM PACIENTES COM DIFERENTES FORMAS
CLÍNICAS DA TUBERCULOSE”, 2009; CHATTERJEE et al., 2011; FLINT et al., 2004; SINGH et al., 2005; WIKER; HARBOE, 1992)
É de suma importância para a tomada de decisões clínicas, a possibilidade de predição da infecção latente ou ativa e o monitoramento o tratamento. O desenvolvimento de um marcador diagnóstico que pudesse ser útil para distinguir indivíduos infectados, doentes e imunizados caracterizaria um grande avanço para o controle epidemiológico da doença, assim como redução de recursos gastos para a contenção da doença. Ampla abrangência e facilidade na busca de casos novos, assegurando rapidez e acurácia no diagnóstico são primordiais no estabelecimento das estratégias para a contenção da epidemia (GOLETTI et al., 2016; WALZL et al., 2011).
2. PHAGE DISPLAY
Phage display é uma técnica eficiente para identificar peptídeos ou proteínas que se ligam a outras moléculas com diversas finalidades, como mapeamento de epítopos reconhecidos por anticorpos. A tecnologia é baseada no princípio de que polipeptídeos podem ser expressos na superfície de bacteriófagos filamentosos pela
inserção de um segmento de DNA codificante no genoma dos mesmos, de modo que o peptídeo ou proteína expressado fique exposto na superfície da partícula viral fusionado a uma proteína viral naturalmente expressa no bacteriófago (SMITH, 1985).
um bacteriófago que infecta uma variedade de bactérias gram-negativas, frequentemente a Escherichia coli do gênero masculino (BRATKOVIČ, 2009).
Os bacteriófagos M13 são formados por uma fita simples de DNA envolta por uma capa protéica constituída por cinco proteínas (pIII, pVI, pVII, pVIII e pIX) (Figura 01). Destas cinco proteínas existem aproximadamente 2.800 cópias da pVIII e cinco cópias da pIII. Neste sistema, o gene codificador do peptídeo ou proteína de
interesse é geralmente fusionado a um dos genes destas duas proteínas da capa protéica do fago (BRATKOVIČ, 2009).
Figura 01 - Esquema representativo de um bacteriófago filamentoso: (a) fago filamentoso tipo selvagem ilustrando as proteínas do capsídeo viral: pIX, pVII, pVIII, pVI e pIII, (b) peptídeo fusionado à pIII do fago, (c) peptídeo fusionado à pVIII do fago (TIKUNOVA; MOROZOVA, 2009).
Uma das vantagens do uso do bacteriófago é que eles não geram uma infecção lítica em Escherichia coli, mas preferencialmente induzem um estado no qual a bactéria infectada produz e secreta partículas de fago sem sofrer lise (TIKUNOVA; MOROZOVA, 2009).
A seleção de sequências baseada na afinidade de ligação do fago a uma molécula alvo é feita por um processo de seleção in vitro denominado biopanning. O biopanning
2.1. BIOPANNING DE PEPTÍDEO
Bibliotecas de peptídeos geradas por phage display são extensivamente aplicadas na descoberta de uma grande variedade de polipeptídeos incluindo anticorpos, receptores e enzimas (ARAP, 2005). Epítopos ou determinantes antigênicos, regiões de reconhecimento do antígeno pelos anticorpos, podem também ser identificados através desta metodologia de apresentação de peptídeos
em fagos, a qual tem sido extremamente importante para a identificação e caracterização de novos ligantes de alta afinidade e seus receptores de uma infinidade de doenças, incluindo câncer, doenças infecciosas, cardiovasculares e autoimunes (MULLEN et al., 2006; STERNBERG; HOESS, 1995).
2.2. BIOPANNING DE ANTICORPO
A técnica de Phage Display pode ser usada para a seleção de fragmentos de anticorpos expressos na superfície de bacteriófagos. Fragmentos de cadeia única das regiões variáveis de anticorpos (single-chain variable fragment, scFv) representa o menor domínio funcional de cadeias leve e pesada (VL e VH) de um anticorpo necessário à ligação específica ao seu antígeno. A expressão desses fragmentos é realizada na forma de fragmentos recombinantes de anticorpos, através da fusão das regiões codificadoras da porção variável do anticorpo (Fv) ao gene III do fago M13, sendo capaz de codificar e expressar o scFv na proteína PIII do fago (HOOGENBOOM, 2005).
Os anticorpos selecionados podem ser expressos em larga escala e serem utilizados em ensaios químicos, fisiológicos e imunológicos.
3. SELEX
SELEX (Systematic Evolution of Ligands by EXponential Enrichment), uma técnica in vitro desenvolvida e descrita a partir da década de 1990 (AQUINO-JARQUIN; TOSCANO-GARIBAY, 2011; ELLINGTON, A.D. & SZOSTAK, 1998; TUERK; GOLD, 1990) para seleção de pequenas moléculas sintéticas de ácidos
nucleicos (RNA e DNA de cadeia simples – ssDNA) por PCR.
As moléculas selecionadas por esta técnica são denominadas aptâmeros.
aptâmeros são capazes de se ligar a pequenas moléculas, como receptores de moléculas alvo. O arranjo molecular dos aptâmeros é resultado de um processo termodinamicamente favorável e confere estabilidade à estrutura secundária e à conformação. São ligantes altamente sensíveis e específicos, com vantagens em relação aos outros ligantes como produção química mais rápida e fácil, menos propensa a contaminação viral ou bacteriana, estocáveis e não imunogênicos (AMAYA-GONZÁLEZ et al., 2013; ESPOSITO; CATUOGNO; DE FRANCISCIS, 2015; GOPINATH et al., 2006; SHANNON PENDERGRAST et al., 2005; ZHU et al.,
2014).
Os aptâmeros ainda contam com a vantagem de serem reversíveis, capazes de atravessarem barreiras celulares, alcançando alvos intra e extracelulares específicos não disponíveis a anticorpos (BUNKA; PLATONOVA; STOCKLEY, 2010; ESPOSITO; CATUOGNO; DE FRANCISCIS, 2015). Possuem aplicações terapêuticas, diagnósticas, para detecção de fármacos, metabólitos e toxinas em fluidos corporais, sinalização celular, usados como sondas em marcações celulares para exames de imagens, ou carreadores de nanopartículas terapêuticas e procedimentos biomoleculares de laboratório (ACQUAH et al., 2015; DARMOSTUK et al., 2014; RADOM et al., 2013)
REFERÊNCIAS
ACQUAH, Caleb et al. A review on immobilised aptamers for high throughput biomolecular detection and screening. Analytica Chimica Acta v. 888, p. 10–18 , 2015. Disponível em: <http://dx.doi.org/10.1016/j.aca.2015.05.050>.1873-4324 (Electronic) 0003-2670 (Linking).
AHMAD, Suhail. Pathogenesis, immunology, and diagnosis of latent Mycobacterium tuberculosis infection. Clinical & developmental immunology v. 2011, p. 814943 ,
jan. 2011. Disponível em:
<http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=3017943&tool=pmcentre z&rendertype=abstract>. Acesso em: 13 jul. 2011.
AKHTER, Yusuf; TUNDUP, Smanla; HASNAIN, Seyed E. Novel biochemical properties of a CRP/FNR family transcription factor from Mycobacterium tuberculosis. International Journal of Medical Microbiology v. 297, n. 6, p. 451–457 , 2007.1438-4221 (Print)r1438-4221 (Linking).
AMAYA-GONZÁLEZ, Sonia et al. Aptamer-based analysis: A promising alternative for food safety control. Sensors (Switzerland) v. 13, n. 12, p. 16292–16311 , 2013.3498510312.
ANBARASU, D.; PONNU RAJA, C.; RAJA, Alamelu. Multiplex analysis of cytokines/chemokines as biomarkers that differentiate healthy contacts from tuberculosis patients in high endemic settings. Cytokine v. 61, n. 3, p. 747–754 , 2013. Disponível em: <http://dx.doi.org/10.1016/j.cyto.2012.12.031>.1043-4666.
ANISE OSÓRIO FERRI ET AL. Diagnóstico da tuberculose: uma revisão. Revista Liberato p. 105–212 , 2014.
APARECIDA, Sandra et al. É possível uma vacina gênica auxiliar no controle da
tuberculose ? Could a DNA vaccine be useful in the control of tuberculosis ? Jornal Brasileiro de Pneumologia v. 30, n. 4, p. 468–477 , 2004.
AQUINO-JARQUIN, Guillermo; TOSCANO-GARIBAY, Julia D. RNA aptamer evolution: Two decades of selection. International Journal of Molecular Sciences v. 12, n. 12, p. 9155–9171 , 2011.5255574775.
ARAP, Marco Antonio. Phage display technology - Applications and innovations. Genetics and Molecular Biology v. 28, n. 1, p. 1–9 , 2005.1415-4757.
BARNES, P F et al. Cytokine production at the site of disease in human tuberculosis. Infect Immun v. 61, n. 8, p. 3482–3489 , 1993. Disponível em: <http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Cit ation&list_uids=8335379>.0019-9567 (Print)n0019-9567 (Linking).
BELAY, Mulugeta; BJUNE, Gunnar; AMEN, Gobena. Serodiagnostic Performance of Resat-6-CFP-10 in the Diagnosis of Pulmonary Tuberculosis in Ethiopia. Mycobacterial Diseases v. 1, n. 2, p. 1–7 , 2011. Disponível em:
<http://www.omicsonline.org/2161-1068/2161-1068-1-103.digital/2161-1068-1-103.html>. Acesso em: 27 jan. 2012.
BORGSTRÖM, Emilie et al. Detection of proliferative responses to ESAT-6 and CFP-10 by FASCIA assay for diagnosis of Mycobacterium tuberculosis infection. Journal of Immunological Methods , 2011.1872-7905 (Electronic)r0022-1759 (Linking).
BOURGARIT, Anne et al. Explosion of tuberculin-specific Th1-responses induces immune restoration syndrome in tuberculosis and HIV co-infected patients. AIDS (London, England) v. 20, n. 2, p. F1-7 , 9 jan. 2006. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/16511406>.
BRASIL, Ministério da Saúde - Secretaria de Vigilância em Saúde. Manual de recomendações para o controle da tuberculose no Brasil. [S.l: s.n.], 2011. 284 p. Disponível em: <http://www.saude.gov.br/bvs>. .9788533418165.
BRATKOVIČ, Tomaž. Progress in phage display: evolution of the technique and its
applications. Cellular and molecular life sciences : CMLS v. 3, p. 749–767 , 15 nov. 2009. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/19915992>. Acesso em: 22 jun. 2011.
BUNKA, David H J; PLATONOVA, Olga; STOCKLEY, Peter G. Development of aptamer therapeutics. Current Opinion in Pharmacology v. 10, n. 5, p. 557–562 , 2010. Disponível em: <http://dx.doi.org/10.1016/j.coph.2010.06.009>.1471-4973 (Electronic)r1471-4892 (Linking).
CADENA, Anthony M.; FORTUNE, Sarah M.; FLYNN, JoAnne L. Heterogeneity in tuberculosis. Nature Reviews Immunology p. 1–12 , 2017. Disponível em: <http://www.nature.com/doifinder/10.1038/nri.2017.69>.
CAILLEAUX-CEZAR, Michelle. Diagnóstico e Tratamento da Tuberculose Latente Diagnosis and Treatment of Latent Tuberculosis. Pulmão RJ v. 21, n. 1, p. 41–45 , 2012.
CAMBAU, E.; DRANCOURT, M. Steps towards the discovery of Mycobacterium tuberculosis by Robert Koch, 1882 .Clinical Microbiology and Infection. [S.l: s.n.]. , 2014
CARACTERIZAÇÃO DOS NÍVEIS PLASMÁTICOS E DO POLIMORFISMO +874T/A NO GENE IFN-γ EM PACIENTES COM DIFERENTES FORMAS CLÍNICAS DA TUBERCULOSE. Patologia , 2009.
CHANDRASHEKARA, S. et al. High IL-and low IL-15 levels mark the presence of TB infection: A preliminary study. Cytokine v. 81, p. 57–62 , 2016. Disponível em: <http://dx.doi.org/10.1016/j.cyto.2016.02.003>.
CHATTERJEE, Samit et al. Early Secreted Antigen ESAT-6 of Mycobacterium tuberculosis Promotes Protective T Helper 17 Cell Responses in a Toll-Like Receptor-2-dependent Manner. Cell Differentiation v. 7, n. 11 , 2011.
Mycobacterium tuberculosis. Respirology v. 18, n. 2, p. 205–216 , 2013. Disponível em: <http://doi.wiley.com/10.1111/resp.12002>.
CHEGOU, Novel N. et al. Beyond the IFN-γ horizon: Biomarkers for immunodiagnosis of infection with Mycobacterium tuberculosis. European Respiratory Journal v. 43, n. 5, p. 1472–1486 , 2014.1399-3003 (Electronic)r0903-1936 (Linking).
CHEN, C. Y. et al. IL-2 Simultaneously Expands Foxp3+ T Regulatory and T Effector Cells and Confers Resistance to Severe Tuberculosis (TB): Implicative Treg-T Effector Cooperation in Immunity to TB. The Journal of Immunology v. 188, n. 9, p.
4278–4288 , 2012. Disponível em:
<http://www.jimmunol.org/cgi/doi/10.4049/jimmunol.1101291>.1550-6606 (Electronic)0022-1767 (Linking).
CHOWDHURY, Imran Hussain et al. Alteration of serum inflammatory cytokines in active pulmonary tuberculosis following anti-tuberculosis drug therapy. Molecular Immunology v. 62, n. 1, p. 159–168 , 2014. Disponível em: <http://dx.doi.org/10.1016/j.molimm.2014.06.002>.
CLIFFORD, Vanessa et al. Serum IP-10 in the diagnosis of latent and active tuberculosis. Journal of Infection v. 71, n. 6, p. 696–698 , 2015.01634453 (ISSN). DARMOSTUK, Mariia et al. Current approaches in SELEX: An update to aptamer selection technology. Biotechnology Advances v. 33, n. 6, p. 1141–1161 , 2014. Disponível em: <http://dx.doi.org/10.1016/j.biotechadv.2015.02.008>.1873-1899 (Electronic)r0734-9750 (Linking).
DUFOUR, Jennifer H et al. IFN-gamma-inducible protein 10 (IP-10; CXCL10)-deficient mice reveal a role for IP-10 in effector T cell generation and trafficking.
Journal of immunology (Baltimore, Md. : 1950) v. 168, n. 7, p. 3195–204 , 1 abr. 2002. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/11907072>.
DUTTA, Noton Kumar et al. Activity of diclofenac used alone and in combination with streptomycin against Mycobacterium tuberculosis in mice. International Journal of Antimicrobial Agents v. 30, n. 4, p. 336–340 , 2007.0924-8579 (Print)n0924-8579 (Linking).
ELLINGTON, A.D. & SZOSTAK, J.W. © 19 90 Nature Publishing Group. Journal of Colloid and Interface Science v. 245, n. 1, p. 118–143 , 1998. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/16290341%5Cnhttp://link.springer.com/10.100 7/BF01177222%5Cnhttp://linkinghub.elsevier.com/retrieve/pii/0021979780905019%5 Cnhttp://scitation.aip.org/content/aip/journal/pof2/10/9/10.1063/1.869740%5Cnhttp:// www.sciencedire>.0021-9797.
ESPOSITO, Carla Lucia; CATUOGNO, Silvia; DE FRANCISCIS, Vittorio. Aptamer-mediated selective delivery of short RNA therapeutics in cancer cells. Journal of RNAi and Gene Silencing v. 10, n. 2, p. 500–506 , 2015.1747-0854 (Electronic)r1747-0854 (Linking).
FLYNN, JoAnne L.; CHAN, John. Immune evasion by Mycobacterium tuberculosis: Living with the enemy .Current Opinion in Immunology. [S.l: s.n.]. , 2003
FLYNN, Joanne L; CHAN, John. Tuberculosis: Latency and Reactivation. INFECTION AND IMMUNITY v. 69, n. 7, p. 4195–4201, 2001. https://doi.org/10.1128/IAI.69.7.4195-4201.2001
PMid:11401954 PMCid:PMC98451
GOLDBERG, Michael F; SAINI, Neeraj K; PORCELLI, Steven A. Evasion of Innate and Adaptive Immunity by Mycobacterium tuberculosis. Microbiology Spectrum v. 2, n. 5, p. 1–24 , 2014.978-1-55581-883-8 978-1-55581-884-5.
GOLETTI, Delia et al. Tuberculosis biomarkers: From diagnosis to protection. Infectious Disease Reports v. 8, n. 2, p. 24–32 , 2016.
GOPINATH, Subash C B et al. An RNA aptamer that distinguishes between closely related human influenza viruses and inhibits haemagglutinin-mediated membrane fusion. Journal of General Virology v. 87, n. 3, p. 479–487, 2006. https://doi.org/10.1099/vir.0.81508-0
PMid:16476969
GRÖSCHEL, Matthias I et al. ESX secretion systems: mycobacterial evolution to counter host immunity. , 2016.
GUTLAPALLI, Ravi et al. Detection of tuberculosis in HIV co-infected individuals: Use of multiple ELISA responses to 38kDa, lipoarabinomannan and ESAT??? 6 of M. tuberculosis. Journal of Clinical and Diagnostic Research , 2016.
HETT, Erik C et al. A partner for the resuscitation-promoting factors of Mycobacterium tuberculosis. Molecular Microbiology v. 66, n. October, p. 658–668 , 2007.
HOOGENBOOM, Hennie R. Selecting and screening recombinant antibody libraries. Nature Biotechnology v. 23, n. 9, p. 1105–1116 , 2005. Disponível em: <http://www.nature.com/doifinder/10.1038/nbt1126>.1087-0156.
JACOBS, Ruschca et al. Host biomarkers detected in saliva show promise as markers for the diagnosis of pulmonary tuberculosis disease and monitoring of the response to tuberculosis treatment. Cytokine v. 81, p. 50–56 , 2016. Disponível em: <http://dx.doi.org/10.1016/j.cyto.2016.02.004>.1043-4666.
JEONG, Yun Hee et al. Discrimination between active and latent tuberculosis based on ratio of antigen-specific to mitogen-induced IP-10 production. Journal of Clinical Microbiology , 2015.1098-660X (Electronic)r0095-1137 (Linking).
KASSA, Desta et al. The effect of HIV coinfection, HAART and TB treatment on cytokine/chemokine responses to Mycobacterium tuberculosis (Mtb) antigens in active TB patients and latently Mtb infected individuals. Tuberculosis , 2016.1873-281X (Electronic)r1472-9792 (Linking).
LARREA, Carlos Fernández De et al. The secretory immunoglobulin A response to Mycobacterium tuberculosis in a childhood population Resposta da imunoglobulina A secretória ao Mycobacterium tuberculosis em população infantil. Revista da Sociedade Brasileira de Medicina Tropical v. 39, n. 5, p. 456–461 , 2006.
LAWRENCE, Herenia P. Salivary Markers of Systemic Disease : Noninvasive
Diagnosis of Disease. Journal of the Canadian Dental Association v. 68, n. 3, p. 170–174 , 2002.
LAZAREVIC, Vanja et al. Induction of Mycobacterium tuberculosis-Specific Primary and Secondary T-Cell Responses in Interleukin-15-Deficient Mice. Society v. 73, n. 5, p. 2910–2922 , 2005.
MANGTANI, Punam et al. Protection by BCG vaccine against tuberculosis: A systematic review of randomized controlled trials. Clinical Infectious Diseases v. 58, n. 4, p. 470–480 , 2014.1537-6591 (Electronic)r1058-4838 (Linking).
MUKHERJEE, P et al. The RD1-encoded antigen Rv3872 of Mycobacterium tuberculosis as a potential candidate for serodiagnosis of tuberculosis. Clinical microbiology and infection : the official publication of the European Society of Clinical Microbiology and Infectious Diseases v. 13, n. 2, p. 146–52 , fev. 2007. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/17328726>.
MULLEN, Lisa M et al. Phage display in the study of infectious diseases. Trends in microbiology v. 14, n. 3, p. 141–7 , mar. 2006. Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/16460941>. Acesso em: 21 ago. 2011.
O’GARRA, Anne et al. The Immune Response in Tuberculosis. Annual Review of Immunology v. 31, n. 1, p. 475–527 , 2013. Disponível em:
<http://www.annualreviews.org/doi/10.1146/annurev-immunol-032712-095939>.0327120959.
PAI, Madhukar et al. Tuberculosis. Nature Reviews Disease v. 2, p. 1–23 , 2016a. PAI, Madhukar et al. Tuberculosis. Nature Reviews Disease v. 2, p. 1–23 , 2016b.9783642801686.
PIETERS, Jean. Mycobacterium tuberculosis and the Macrophage: Maintaining a Balance .Cell Host and Microbe. [S.l: s.n.]. , 2008
PORCELLI, Steven A.; GOLDBERG, Michael F.; SAINI, Neeraj K. Evasion of Innate and Adaptive Immunity by Mycobacterium tuberculosis. Microbiology Spectrum v. 2, n. 5, p. 1–24 , 2014.
POTTUMARTHY, S; WELLS, V C; MORRIS, A J. A comparison of seven tests for serological diagnosis of tuberculosis. Journal of clinical microbiology v. 38, n. 6, p.
2227–31 , jun. 2000. Disponível em:
<http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=86769&tool=pmcentrez&r endertype=abstract>.
RADOM, Filip et al. Aptamers: Molecules of great potential. [S.l.]: Elsevier B.V.,
2013. 1260-1274 p. 31 v. Disponível em:
<http://dx.doi.org/10.1016/j.biotechadv.2013.04.007>. Aptamers emerged over 20. years ago as a class of nucleic acids able to recognize specific targets. Today, aptamer-related studies constitute a large and important field of biotechnology. Functional oligonucleotides have proved to be a versatile tool in biomedical research due to the ease of synthesis, a wide range of potentially recognized molecular targets and the simplicity of selection. Similarly to antibodies, aptamers can be used to detect or isolate specific molecules, as well as to act as targeting and therapeutic agents. In this review we present different approaches to aptamer application in nanobiotechnology, diagnostics and medicine. © 2013 Elsevier Inc.1873-1899 (Electronic)r0734-9750 (Linking).
RIBEIRO, Vanessa S. et al. Detergent fraction of heterologous antigen to detect IgA and IgG in strongyloidiasis using saliva and serum paired samples. Immunology Letters v. 134, n. 1, p. 69–74 , 2010.1879-0542 (Electronic)r0165-2478 (Linking).
ROSEMBERG, J. Mecanismo imunitário da tuberculose s’\intese e atualização. Boletim de Pneumologia Sanitária v. 9, n. 1, p. 35–59 , 2001. Disponível em:
<http://scielo.iec.pa.gov.br/scielo.php?script=sci_arttext&pid=S0103-460X2001000100005&lng=en&nrm=iso&tlng=pt>. Acesso em: 16 out. 2011.
ROY, A. et al. Effect of BCG vaccination against Mycobacterium tuberculosis infection in children: systematic review and meta-analysis. Bmj v. 349, n. aug04 5, p.
g4643–g4643 , 2014. Disponível em:
<http://www.bmj.com/cgi/doi/10.1136/bmj.g4643>.1756-1833 (Electronic)r0959-535X (Linking).
SHANNON PENDERGRAST, P. et al. Nucleic acid aptamers for target validation and therapeutic applications. Journal of Biomolecular Techniques v. 16, n. 3, p. 224– 234 , 2005.1524-0215 (Print)r1524-0215 (Linking).
SINGH, Krishna K et al. Antigens of Mycobacterium tuberculosis Recognized by Antibodies during Incipient , Subclinical Tuberculosis. Society v. 12, n. 2, p. 354–358 , 2005.
SMITH, George P. Phage Display Introduction I Phage Display Types of Phage Display Libraries. Direct , 1985.
STERNBERG, N; HOESS, R H. Display of peptides and proteins on the surface of bacteriophage lambda. Proceedings of the National Academy of Sciences of the United States of America v. 92, n. 5, p. 1609–13 , 28 fev. 1995. Disponível em: <http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=42569&tool=pmcentrez&r endertype=abstract>.
STRECKFUS, C F; BIGLER, L R. Saliva as a diagnostic fluid. Oral Diseases n. September 2001, p. 69–76, 2002. https://doi.org/10.1034/j.1601-0825.2002.1o834.x SULIS, Giorgia et al. Tuberculosis: Epidemiology and control .Mediterranean Journal of Hematology and Infectious Diseases. [S.l: s.n.]. , 2014