AMAZÔNIA ORIENTAL
UNIVERSIDADE FEDERAL RURAL DA AMAZÔNIA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL
SYLVIA CRISTINA GARCIA DE GARCIA
AVALIAÇÃO HISTOLÓGICA DO OVÁRIO DE CAITITU
(
Tayassu tajacu
) CRIADO EM CATIVEIRO
AVALIAÇÃO HISTOLÓGICA DO OVÁRIO DE CAITITU
(
Tayassu tajacu
) CRIADO EM CATIVEIRO
Dissertação apresentada ao Curso de Mestrado em Ciência Animal da Universidade Federal do Pará, da Empresa Brasileira de Pesquisa Agropecuária – Amazônia Oriental e da Universidade Federal Rural da Amazônia, como requisito parcial para obtenção do título de Mestre em Ciência Animal. Área de concentração: Produção Animal.
Orientador(a): Prof. Dra. Diva Anelie Guimarães
Dados Internacionais de Catalogação na Publicação (CIP) –
1 BIBLIOTECA NÚCLEO DE CIÊNCIAS AGRÁRIAS E DESENVOLVIMENTO
RURAL / UFPA, BELÉM-PA
Garcia , Sylvia Cristina Garcia de
Avaliação histológica do ovário em duas fases do ciclo estral de caititu (Tayassu tajacu) criado em cativeiro / Sylvia Cristina Garcia de Garcia; orientadora, Diva A. Guimarães – 2007.
Dissertação (mestrado) – Universidade Federal do Pará, Núcleo de Ciências Agrárias e Desenvolvimento Rural, Programa de Pós-Graduação em Ciência Animal, Belém, 2007.
1. Suíno - Reprodução. 2. Histologia veterinária. 3. Collared peccary. 4. Animais selvagens em cativeiro. I. Título.
AVALIAÇÃO HISTOLÓGICA DO OVÁRIO DE CAITITU
(
Tayassu tajacu
) CRIADO EM CATIVEIRO
Dissertação apresentada ao Curso de Mestrado em Ciência Animal da Universidade Federal do Pará, da Empresa Brasileira de Pesquisa Agropecuária – Amazônia Oriental e da Universidade Federal Rural da Amazônia, como requisito parcial para obtenção do título de Mestre em Ciência Animal.
Área de concentração: Produção Animal.
Data: ______/_______/_______
______________________________________ Profa. Dra. Diva Anelie Guimarães
Departamento de Histologia e Embriologia – UFPA
______________________________________ Profa. Dra. Rosemar Luz Ramos
Departamento de Biologia - UFPA
______________________________________ Profa. Dra. Maria Auxiliadora Ferreira
Departamento de Histologia e Embriologia – UFPA
Dedico este trabalho...
À minha mãe Ana Garcia, por todo o amor, estímulo, força, amizade, confiança e pelo exemplo de vida que és para mim.
À minha filha Ana Letícia, pela plenitude de sentir a minha profissão em sua existência e pela imensa alegria que trouxeste para mim.
Ao meu companheiro, Andrei Rodrigues, pelo amor, dedicação, presença, paciência, compreensão e respeito dedicados a mim.
Ao meu irmão, Leandro Garcia, pelo amor e pela força que me transmite
À Deus pelo dom da vida e pela força para vencer as adversidades.
À minha família pelo amor e dedicação durante todas as etapas da minha vida. À família Rodrigues pelo apoio oferecido.
À Universidade Federal do Pará, e em especial ao curso de pós-graduação em Ciência Animal pela oportunidade de realização deste trabalho.
À EMBRAPA pela disponibilidade do espaço físico para a realização deste trabalho.
À minha orientadora, Dra. Diva Anelie Guimarães, pelos ensinamentos, estímulo, apoio, incentivo e orientação.
À Prof. Dra. Rosemar Luz Ramos pela amizade, incentivo, confiança, apoio durante este trabalho e, principalmente, pelo exemplo de profissional que és.
À Prof. Dra. Maria Auxiliadora Ferreira pelos ensinamentos e apoio valioso durante este trabalho.
Às Msc. Patrícia Souza e Ana Cássia pelo auxílio no início do trabalho, pelo apoio e pela grande amizade.
Ao Msc. Jurupytan Silva pelos ensinamentos e o auxílio durante a realização deste trabalho. Aos colegas de pós-graduação: Alessandra Rodrigues, Andréa Castro, Rose Chaves, Ronald Cardoso, Caio Aguiar pela colaboração durante as disciplinas do curso.
À Carol Montes, Luís Henrique e Deise pela ajuda e convívio quase diário no Laboratório de Reprodução.
Ao tratador Deoclécio pela coragem e por todo o apoio dado.
Aos animais do plantel científico da EMBRAPA, Lêda, Rosa, Pedrita, Laura, Camila e Delia, sem as quais seria impossível a realização deste trabalho.
Ao CNPq pelo financiamento do projeto Tayataja Proc. 471705/03-9 Edital Universal 2004. A SECTAM/FUNTEC/FADESP/J.PESQUISADORES/CAITITU pelo financimento do Edital Nº 1025/2004
“A vida só pode ser compreendida
olhando-se para trás, mas só pode ser
vivida olhando-se para frente”
O objetivo deste estudo foi de avaliar os aspectos morfométricos e histológicos do ovário de caititu (Tayassu tajacu) durante duas fases do ciclo estral, e obter dados a respeito da população folicular ovariana. O estudo foi realizado no campo experimental Embrapa-Amazônia Oriental (Belém, Pará). Ovários de seis fêmeas adultas de caititu foram obtidos através de ovariectomia para posteriormente processamento histológico. Os mesmos foram fixados em Bouin, seccionados obtendo cortes de 7 μm de espessura e corados com Hematoxilina e Eosina. Os folículos pré-antrais foram classificados em folículo primordial, primário e secundário. Os folículos antrais foram caracterizados pela presença da cavidade antral. O número de folículos pré-antrais e antrais por ovário foi estimado usando o Fractionator Method. Para análise qualitativa, todos os folículos foram classificados em normais ou degenerados. O diâmetro do folículo, do oócito e de seu núcleo e da camada da granulosa, exceto do folículo antral, foi medido utilizando uma ocular micrométrica para acompanhar o desenvolvimento folicular. Todos os resultados foram representados como média ± desvio padrão. Os resultados revelaram diferenças entre as categorias de folículos pré-antrais nos ovários direito e esquerdo. A média numérica de folículos pré-antrais presentes foi maior no ovário esquerdo e na fase folicular do ciclo estral. Folículos primordiais foram encontrados no córtex com uma única camada de células foliculares de formato pavimentoso, envolvendo o oócito esférico. Nos folículos primários, foi observado a proliferação de células pavimentosas e/ou cúbicas formando mais de uma camada envolvendo o oócito. Folículos secundários apresentaram-se constituídos de duas ou mais camadas concêntricas de células cuboidais. A zona pelúcida e as células imaturas da teca foram primeiramente localizadas em folículos secundários. Folículos antrais foram caracterizados pela presença da cavidade antral, pela projeção do cumulus oophorus no interior do antro, envolvendo o oócito e pela divisão da teca interna e teca externa. O número médio de folículos primordiais e primários normais foi significativo (p<0,05) quando comparado ao número médio de folículos degenerados. As mudanças nos diâmetros observados podem ser utilizadas, possivelmente, como um parâmetro na classificação das diferentes categorias foliculares.
The aim of this study was to evaluate the morphometric and histological aspects the ovary the collared peccary (Tayassu tajacu), and to obtain data about the follicular ovarian population. The study was conducted on the experimental farm of EMBRAPA-UFPA, Belem do Para (Brazil). Ovaries from six adult females of collared peccary were obtained through ovariectomy. The ovaries were fixed in Bouin, sectioned serially at a thickness of 7 μm and stained with hematoxylin and eosin. The preantral follicles were classified into primordial, primary and secondary follicles. Antral follicles were characterized those that presented an antral cavity. The number of preantral and antral follicles for ovary was estimated using the Fractionator Method. All counted follicles were classified as normal or degenerated. The diameter of the follicles, oocytes and nuclei, and layer of granulosa cells were made using a micrometric ocular for to accompany the follicular development. All results were represented as mean ±SE. The variation in the categories of preantral follicles of both the right and left ovaries was observad. The mean number of preantral follicles present was higher in the left ovary and follicular phase of the oestrous cycle. Primordial follicle were found in the cortex, a singler layer of flattened squamous follicular cells, enveloped the spherical oocyte. Primary follicles of the proliferation of the flattened follicular cells surrounding the oocyte gave rise to their flattened squamous and/or cuboidal shape. The secondary follicles were characterized that possess two or more concentric layers of cuboidal cells. The pellucid zone and immature theca cells was first localized in the secondary follicles. Antral follicles were characterized by a central cavity, the cumulus oophorus projected into the antrum and surrounded the oocyte, and divided into the theca interna and theca externa. The mean of normal follicles was significantly greater than the mean of degenerate follicles in categories of primordial and primary follicles. The changes in the diameters observed that is possible to use it to aid in the classification of the different follicular categories. All results were represented as mean ±SE. The variation in the categories of preantral follicles of the right and left ovaries was observed (p<0,05). The mean number of preantral follicles present was higher in the left ovary and follicular phase of the oestrous cycle. Primordial follicle were found in the cortex, a singler layer of flattened squamous follicular cells, enveloped the spherical oocyte. Primary follicles of the proliferation of the flattened follicular cells surrounding the oocyte gave rise to their flattened squamous and/or cuboidal shape. The secondary follicles were characterized that possess two or more concentric layers of cuboidal cells. The pellucid zone and immature theca cells was first localized in the secondary follicles. Antral follicles were characterized by a central cavity, the cumulus oophorus projected into the antrum and surrounded the oocyte, and divided into the theca interna and theca externa. The mean of normal follicles was significantly greater (p<0,05) than the mean of degenerate follicles in categories of primordial and primary follicles. The changes in the diameters observed that is possible to use it to aid in the classification of the different follicular categories.
Figura 1 - Dois exemplares da espécie Tayassu tajacu criados em cativeiro. A seta indica a presença do colar de pêlos brancos no pescoço do animal.
27
Figura 2 - Distribuição geográfica das três espécies de taiassuídeos, demonstrando a relação simpátrida entre os referidos animais.
28
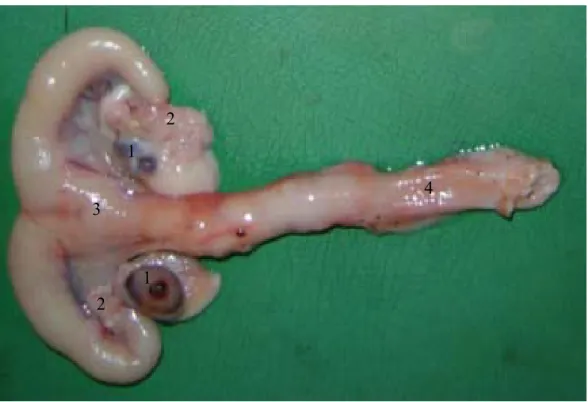
Figura 3 - Observação macroscópica do sistema genital feminino de caititu (1-ovários; 2-tubas uterinas; 3-útero; 4-vagina).
29
Figura 4 - Ovário de suíno (Sus scrofa) apresentando formato irregular devido a presença de folículos (A) e corpo lúteo proeminentes (área pontilhada).
31
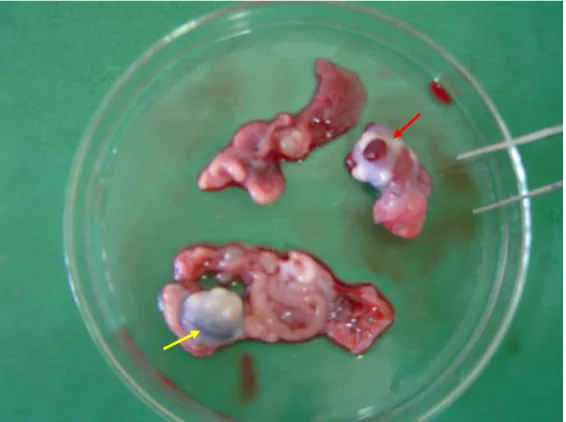
Figura 5 - Observação macroscópica de ovário de caititu. As setas amarela e vermelha indicam o órgão em formatos distintos (ovóide e irregular, respectivamente). .
40
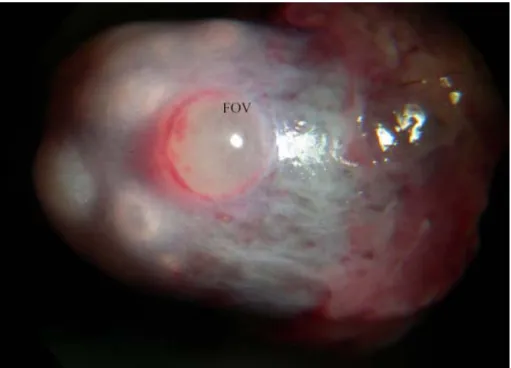
Figura 6 - Observação macroscópica de ovário de caititu. mostrando o folículo pré-ovulatório (FOV).
41
Figura 7 - Observação macroscópica do formato irregular de ovário de caititu devido à presença de corpo hemorrágico (seta amarela) e corpo albicans (seta vermelha).
41
Figura 8 - Fotomicrografia ilustrando os folículos primordiais (seta preta) presentes no córtex ovariano, 40 X H.E.
44
Figura 9 - Fotomicrografia ilustrando o folículo secundário (FS) com início da formação do antro (seta preta), o folículo antral apresentando o antro (A) e a corona radiata (*) e o corpo albicans (CA), 40 X H.E.
45
Figura 10 - Fotomicrografia ilustrando o corpo lúteo com a presença de células luteinizadas (setas pretas), 40 X H.E.
46
Figura 11 - Média de folículos pré-antrais normais e degenerados nos ovários de três fêmeas de caititu durante a fase folicular.
50
Figura 12 - Média de folículos pré-antrais normais e degenerados nos ovários de três fêmeas de caititu durante a fase luteal.
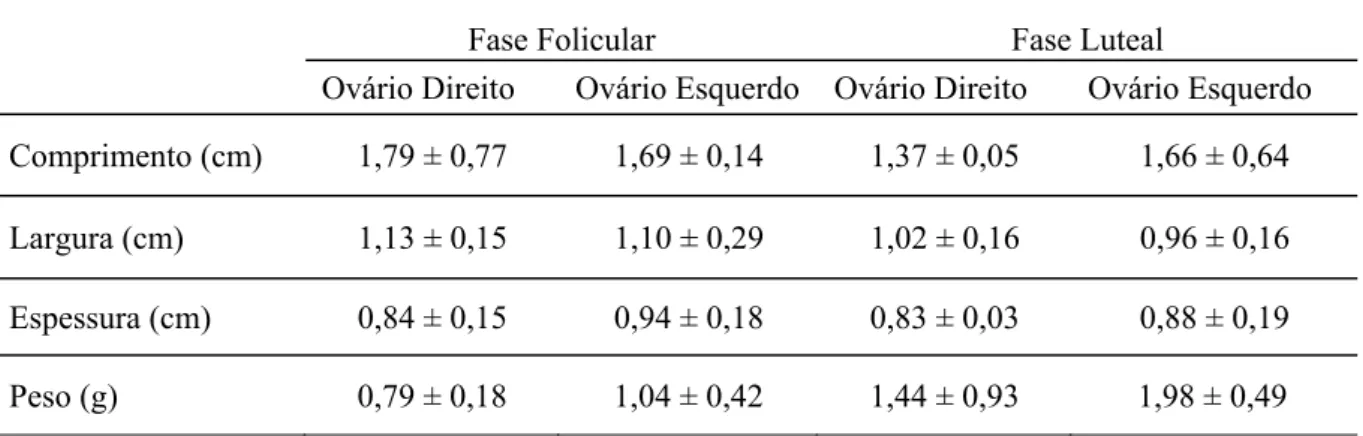
Tabela 1. Médias dos dados biométricos referentes a comprimento, largura, espessura e peso dos ovários direito e esquerdo de seis fêmeas decaititudurante as fases folicular e luteal.
42
Tabela 2. Média da contagem macroscópica de folículos, corpos lúteos, corpos hemorrágicos, corpos albicans nos ovários direito e esquerdo de seis fêmeas de caititu durante as fases folicular e luteal.
42
Tabela 3. População média de folículos pré-antrais dos ovários direito e esquerdo de três fêmeas de caititu durante a fase folicular.
47
Tabela 4. População média de folículos pré-antrais dos ovários direito e esquerdo de três fêmeas de caititu durante a fase luteal.
47
Tabela 5. População média de folículos antrais de seis fêmeas de caititu durante a fase folicular e luteal.
48
Tabela 6. População média de folículos antrais dos ovários direito e esquerdo de seis fêmeas de caititu durante a fase folicular e luteal.
49
Tabela 7. População média de folículos antrais de seis fêmeas de caititu durante as fases folicular e luteal.
49
Tabela 8. Diâmetro médio (μm) do folículo, oócito, camada da granulosa e do núcleo do oócito de folículos pré-antrais de seis fêmeas de caititu durante a fase folicular e luteal.
52
Tabela 9. Diâmetro médio (μm) do folículo, do oócito e do núcleo do oócito de folículos antrais de seis fêmeas de caititu durante a fase folicular e luteal.
52
Tabela 10. Número médio de células constituintes da camada da granulosa de folículos pré-antrais de seis fêmeas de caititu durante as fases folicular e luteal.
µm Micrômetro.
bFGF Fator de crescimento fibroblástico básico. c-Kit Receptor de tirosina kinase.
CGPs Células germinativas primordiais. FGF Fator de crescimento fibroblástico. FSH Hormônio folículo estimulante.
FSH-R Receptor do hormônio folículo estimulante. GDF-9 Fator de diferenciação de crescimento 9. GH Hormônio de crescimento.
KL “kit ligant”.
LH Hormônio Luteinizante.
LH-R Receptor do hormônio luteinizante. TGFβ Fatores de crescimento transformantes β TZP Projeções transzonais
1. INTRODUÇÃO 15 2. REVISÃO DE LITERATURA
2.1. CONSIDERAÇÕES GERAIS SOBRE A GÔNADA FEMININA DE MAMÍFEROS
16
2.1.1 Oogênese – Formação e desenvolvimento de oócitos 17
2.1.2. Foliculogênese 18
2.1.2.1. Folículos Primordiais 19
2.1.2.2. Folículos Primários 21
2.1.2.3. Folículos Secundários 22
2.1.2.4. Folículos Terciários 22
2.1.2.5. Folículos Pré-ovulatórios 23
2.1.3.Dinâmica Folicular 24
2.2. FAMÍLIA TAYASSUIDAE 26
2.3. DISTRIBUIÇÃO GEOGRÁFICA 28
2.4. ASPECTOS REPRODUTIVOS DA FÊMEA DO CAITITU 29
2.5. MORFOLOGIA DO SISTEMA GENITAL FEMININO DE Tayassu tajacu 30 2.6. ASPECTOS MORFOHISTOLÓGICOS DO OVÁRIO DE SUIFORMES 32 3. OBJETIVO
3.1. OBJETIVO GERAL 36
3.2. OBJETIVOS ESPECÍFICOS 36
4. MATERIAIS E MÉTODOS
4.1. ANIMAIS 37
4.2. COLETA DOS OVÁRIOS 37
4.3. MORFOLOGIA OVARIANA 38
4.3.1.Classificação Folicular 38
4.3.2. Análise Qualitativa da População Folicular 39
4.3.3. Estimativa da População Folicular Ovariana 40
4.3.4. Dimensões Foliculares 40
4.5. ANÁLISE ESTATÍSTICA 40
5. RESULTADOS
5.3. HISTOLOGIA OVARIANA 44
5.4.ESTIMATIVA DA POPULAÇÃO FOLICULAR 47
5.5. ANÁLISE QUALITATIVA 51
5.6. DIÂMETRO FOLICULAR 53
6. DISCUSSÃO
6.1. MORFOLOGIA OVARIANA 55
6.2. BIOMETRIA E CONTAGEM MACROSCÓPICA DAS ESTRUTURAS OVARIANAS
56
6.3. HISTOLOGIA OVARIANA 57
6.4.ESTIMATIVA DA POPULAÇÃO FOLICULAR 59
6.5. ANÁLISE QUALITATIVA DA POPULAÇÃO FOLICULAR 60
6.6. DIÂMETRO FOLICULAR 60
7. CONCLUSÕES 62
1. INTRODUÇÃO
A fauna silvestre representa uma fonte protéica importante para a subsistência de populações rurais na Amazônia, além disso, os subprodutos como couro, pele, pêlos e penas também são comercializados na maioria das vezes de forma ilegal (NËO, 1992; BODMER et al. 1994; SECRETARIA PRO TEMPORE, 1999; LISBOA, 2002). Esta situação representa um problema sério para a perda da biodiversidade uma vez que o uso deste recurso é baseado em um modelo insustentável, fundamentado na extração direta da natureza (ROCHA, 2001).
Bodmer e Lozano (2001), estudando o desenvolvimento rural e o uso sustentável da vida silvestre no Peru, observaram que dentre os ungulados, o caititu (Tayassu tajacu) e o queixada (Tayassu pecari) são uma importante fonte de carne e representam grande parcela de biomassa caçada. Na Amazônia brasileira, no município de Uruará (PA) o caititu, conhecido como porco-do-mato, representa 14,4% do total de animais caçados (BONAUDO et al 2005). Esta espécie é de interesse no mercado nacional e internacional tanto para a comercialização do couro, que possui excelente qualidade para a confecção de vestuário e acessórios, como para o consumo da carne (NOGUEIRA FILHO et al. 2000).
Para o desenvolvimento de sistemas viáveis de produção animal e melhoramento zootécnico do caititu em cativeiro, vários estudos abordando os aspectos reprodutivos, etológicos, sanitários e nutricionais foram desenvolvidos (BARBELLA, 1993; SOWLS, 1997; GOTTDENKER; BODMER, 1998, VENTURIERI, 2002; GUIMARÃES et al. 2004, ALBUQUERQUE et al. 2004, LE PENDU et al. 2005; MAYOR et al. 2006).
2. REVISÃO DE LITERATURA
2.1. CONSIDERAÇÕES GERAIS SOBRE A GÔNADA FEMININA DE MAMÍFEROS
O ovário de mamíferos é um órgão glandular que desempenha duas importantes funções, a produção e liberação de oócitos capazes de serem fertilizados (exócrina ou gametogênica) e a produção e liberação de hormônios esteróides (endócrina ou esteroidogênica) (RODGERS et al., 1999; GARTNER; HIATT, 2002; HAFEZ, 2004; MOORE; PERSAUD, 2004). Essas duas funções são processos interdependentes e complementares, de fundamental importância para o sucesso reprodutivo (PINEDA, 1989).
A estrutura ovariana difere com a espécie, idade e fases do ciclo reprodutivo (PINEDA, 1989; NUNEZ, 1993; HAFEZ, 2004). A superfície ovariana é revestida por um epitélio cúbico simples sustentado pela membrana basal. Segundo Duke (1980), na maioria dos mamíferos ocorre uma mudança conformacional das células do epitélio de revestimento (cúbicas para planas) em conseqüência da presença de algumas estruturas como grandes corpos lúteos que pressionariam esse epitélio.
Abaixo se observa uma espessa camada de tecido conjuntivo denso, denominada de túnica albugínea e, o estroma cortical formado por tecido conjuntivo frouxo. Em uma secção do ovário distinguem-se duas regiões: uma zona central ou medular e uma zona periférica ou cortical (GARTNER; HIATT, 2002; HAFEZ, 2004; MOORE; PERSAUD, 2004).
A zona medular é responsável pela nutrição e sustentação do ovário e consiste de tecido conjuntivo fibroelástico (fibroblasto, fibras de colágeno I e III e fibronectina), de nervos e de vasos sanguíneos e linfáticos que penetram pelo hilo em contato com o mesovário (SMITH et al. 1994; HAFEZ, 2004).
2.1.1 Oogênese – Formação e desenvolvimento de oócitos
Segundo Wassarman (1988), a oogênese tem início na vida fetal e é definida como desenvolvimento e diferenciação das células germinativas primordiais (CGPs) até a formação do oócito haplóide fertilizado. Todas as fêmeas dos mamíferos possuem um estoque finito de CGPs estabelecido durante a vida fetal e que será utilizado na foliculogênese (REYNAUD; DRIANCOURT, 2000).
Essas células precursoras do oócito são altamente móveis e podem responder a estímulos quimiotáxicos com capacidade de migrar do sítio de origem, no epiblasto embrionário, para as cristas genitais, onde penetram no mesênquima subjacente e são incorporadas nos cordões sexuais primários (PICTON et al. 1998; MOORE; PERSAUD, 2004). A migração depende do local de produção de citoquineses, incluindo o kit-ligante e o fator de crescimento de transformação β1 (TGPβ1), e da combinação de movimentos morfogenéticos e de propulsão (PICTON et al. 1998).
Após as CGPs migrarem para a gônada indiferenciada, estas e as células somáticas sofrem extensa hiperplasia e intensas divisões mitóticas (HIRSHFIELD, 1991). As CGPs se associam a gônada indiferenciada através da formação de clusters que possuem conexões intercitoplasmáticas para troca de organelas, principalmente de mitocôndrias, em resposta ao sincronismo das divisões mitóticas e da citoquinese incompleta (EPIFANO; DEAN, 2002).
Através da alta freqüência de divisões mitóticas as CGPs transformam-se em oogônias. Dessas divisões, têm-se como resultado duas linhagens de células germinativas diferentes, onde uma origina a linhagem de células oogônais; enquanto a outra permanece em intérfase, dividindo-se periodicamente originando novas CGPs que posteriormente irão se diferenciar em oogônias (RÜSSE, 1983; PICTON et al. 1998).
Nos estágios iniciais da meiose inativações ou mutações de determinados genes causam a perda excessiva de oócitos primários, a inabilidade na formação de folículos, a esterilidade (EPIFANO; DEAN, 2002) e o decréscimo de um grande número de oogônias após o nascimento ocasionado pelo atrito entre várias CGPs (HIRSHFIELD, 1991). Sendo assim, o número de oócitos primários nos ovários no nascimento, está em função da duração da proliferação das oogônias e, por extensão, do atrito entre elas (HIRSHFIELD, 1991).
Uma outra evidência sobre a perda de CGPs é a morte celular programada (apoptose), a qual é associada à ativação de endonucleases com clivagens específicas no DNA entre unidades nucleossomais regularmente espaçadas (REYNAUD; DRIANCOURT, 2000).
Coincidentemente, com o início da meiose, na região medular, cordões de células somáticas se ramificam no córtex e invadem os clusters das oogônias e oócitos primários. Durante este processo os oócitos primários perdem qualquer relação intercelular e são envolvidos por uma única camada plana de células da pré-granulosa derivadas dos cordões celulares, dispostas sobre a membrana basal, formando assim o folículo primordial (PICTON, 2001).
Os oócitos primários permanecem em repouso meiótico até o início da puberdade. Um pouco antes da ovulação, forma-se o oócito secundário, iniciando a segunda divisão meiótica, que se completa totalmente após a fecundação. Alguns estudos demonstram que a realização da meiose secundária ocorre por meio do fator de ativação de maturação (MIP) e proteína kinase ativador de mitose (MAPK) (GOUDET et al. 1998).
2.1.2. Foliculogênese
O folículo é a unidade funcional básica do ovário de mamíferos (GORE-LANGTON; ARMSTRONG, 1994). Uma vez estabelecida a unidade folicular, esta irá ajudar a manter o oócito em um ambiente controlado e isolado de qualquer substância que possa prejudicá-lo, proporcionando assim um ambiente ideal para o seu crescimento e maturação, além de ser responsável pela produção de hormônios esteróides (GORDON, 1994; PICTON, 2001).
Este processo requer a regulação coordenada dos genes que controlam o crescimento folicular, a progressão do ciclo celular, a apoptose e a diferenciação celular (ERICKSON; SHIMAMSAKI, 2000). A alteração na diferenciação celular é requerida durante a foliculogênese de um estágio primordial até o estágio luteal do desenvolvimento. (SKINNER, 2005).
A classificação dos folículos ovarianos varia com a espécie e o padrão de classificação morfológica adotado. De acordo com Saumande (1981), a população folicular ovariana de mamíferos é heterogênea e varia com o grau de crescimento dos folículos pré-antrais ou não cavitários (primordiais, primários e secundários) e folículos antrais ou cavitários (terciários e pré-ovulatórios) diferenciados pela forma e número de camadas da granulosa que circundam o oócito.
Segundo Hulshof et al (1994), os folículos pré-antrais incluem três tipos 1. Primordiais, que consistem de um oócito circundado por uma única camada de células da granulosa de forma pavimentosa, 2. Primários, caracterizados pela presença de um oócito central, circundado por uma camada de células da granulosa de formato cúbico, 3. Secundários, constituídos por um oócito central, circundado por duas ou mais camadas de célula da granulosa de forma cúbica. Em camundongos (Lintern-Moore & Moore, 1979), em mulheres (Gougeon & Chairy, 1987), e caprinos (Bezerra, 1998), sugere-se que existe um estado de transição entre folículo primordial e primário, denominado por estes autores de folículo de transição. A categoria de folículos antrais compreende os folículos terciários e os folículos de Graaf, último estágio do desenvolvimento folicular (SAUMANDE, 1981).
2.1.2.1. Folículos Primordiais
A maioria dos folículos primordiais é formada durante a vida fetal em alguns animais como suínos e ruminantes, porém em outras espécies, como coelho e os roedores estes surgem durante a vida neonatal (TELFER, 1997). Em suínos, aproximadamente 500.000 folículos primordiais estão presentes em ambos os ovários no décimo dia após o nascimento (CÁRDENAS; POPE, 2002).
de células da pré-granulosa, sob a membrana basal (ERICKSON, 1986; HIRSHFIELD, 1991; ROSS; ROWRELL, 1993; EPPIG; O`BRIEN, 1996; FORTUNE et al. 2000; GARTNER; HIATT, 2002; SKINNER, 2005).
O oócito quiescente de folículos primordiais possui formato esférico ou ovóide, com citoplasma homogêneo, núcleo excêntrico com a cromatina parcialmente condensada e a presença de um a dois nucléolos (ROSS; ROWRELL, 1993; CÓDON et al. 2001; BASSO; ESPER, 2002; GARTNER e HIATT, 2003; KACINSKIS et al. 2005).
Em relação às organelas citoplasmáticas, as mitocôndrias, localizadas próximas ao núcleo, são as mais abundantes (CÓDON et al. 2001; BASSO; ESPER, 2002; KACINSKIS, et al. 2005). São observadas com maior freqüência, mitocôndrias de formato oval ou redondas com poucas cristas periféricas e grânulos eletrodensos, que segundo Fair et al. (1997a) seriam as formas imaturas desta organela. Já as mitocôndrias de formato alongado, com a matriz sendo dividida por uma membrana em dois ou mais compartimentos, são pouco freqüentes (CÓDON et al. 2001; BASSO; ESPER, 2002; KACINSKIS et al. 2005).
Complexos de Golgi e gotas lipídicas são pouco observados, assim como, os retículos endoplasmáticos que podem estar isolados ou associados a algumas mitocôndrias. Vários ribossomos livres e polirribossomos também são observados (ROSS; ROWRELL, 1993; CÓDON et al. 2001; BASSO; ESPER, 2002; GARTNER; HIATT, 2002; KACINSKIS et al. 2005).
Nesta fase, a superfície do oócito é lisa e há comunicação entre o oócito e as células foliculares através de junções do tipo desmossomos, denominadas por Kacinskis et al. (2005) de coated pits. Com a formação completa das células foliculares, também há a formação de microvilos entre as células foliculares e o oócito (CÓDON et al. 2001; BASSO; ESPER, 2002; KACINSKIS et al. 2005).
2.1.2.2. Folículos Primários
O crescimento dos folículos pré-antrais está relacionado ao aumento do diâmetro do oócito, nas alterações do estroma adjacente e na proliferação e mudanças no formato das células da granulosa (CGs) (HIRSHIFIELD, 1991; FIGUEIREDO et al. 1994). A atividade de proliferação das CGs resulta na formação de uma camada de células cuboidais ao redor do oócito que caracterizam o folículo primário (HIRSHIFIELD, 1991; ROSS; ROWRELL, 1993; FORTUNE, 1994; EPPIG; O`BRIEN, 1996; GARTNER; HIATT, 2002; SKINNER, 2005).
O oócito de folículos primários possui formato esférico e posição excêntrica além de apresentar a vesícula germinativa. A distribuição de organelas no ooplasma altera-se à medida que este amadurece, podendo ser visualizada numerosas mitocôndrias redondas, diversos complexos de Golgi, retículos endoplasmáticos, ribossomos livres e pequenas vesículas (CÓDON et al. 2001; BASSO; ESPER, 2002; KACINSKIS et al. 2005). Também possuem grânulos corticais localizados no córtex do citoplasma liberados por exocitose quando o oócito é ativado pelo espermatozóide (ROSS; ROWRELL, 1993; GARTNER; HIATT, 2002; KACINSKIS et al. 2005).
Com o crescimento do oócito forma-se uma camada homogênea acidófila retrátil denominada de zona pelúcida (ZP) (WASSARMAN, 1988; HIRSHIFIELD, 1991; COHEN et al. 1992; RANKIN et al. 2002). Esta membrana é responsável por fornecer um revestimento protetor impermeável a moléculas maiores que 170 kDa (HIRSFIELD, 1991).
Bioquimicamente, a estrutura da ZP é composta de três glicoproteínas relativamente designados de ZP1, ZP2 e ZP3 que combinam para dar formar uma camada de até 15μm de espessura que cerca o oócito (COHEN et al. 1992). A ZP 1 (PM 2000.000) é a mais adjacente ao oócito, enquanto a ZP 2 (PM 120.000) a mais intermediária, é convertida em ZP 2f pelas proteases dos grânulos corticais após a fertilização. A ZP 3 é a camada que possui o receptor preliminar do espermatozóide e induz a reação acrossômica (WASSARMAN, 1988).
2.1.2.3. Folículos Secundários
Quando os folículos atingem um estádio com mais de duas camadas de CGs cúbicas é, então, denominado de secundário. Ultraestruturalmente, as organelas citoplasmáticas são observadas próximas a periferia, sendo que as mitocôndrias alongadas, os retículos endoplasmáticos lisos, as gotas de lipídeos e outras vesículas citoplasmáticas tornam-se mais freqüentes (HYTTEL et al. 1997; LUCCI et al., 2001; BASSO; ESPER, 2002; KACINSKIS et al. 2005).
O tipo de interação entre as CGs e o oócito em folículos secundários passa a ser realizada por junções gap e projeções transzonais (TZPs). As junções gap são especializações da membrana que mediam o transporte de pequenas moléculas reguladoras e de metabólitos essenciais para o crescimento oocitário (EPPIG O’BRIEN, 1996). Já as TZPs são extensões comunicantes das CGs que atravessam a ZP e terminam sobre a superfície do oócito (NUTTINCK et al. 1993; MOTTA et al. 1994).
Durante o crescimento dos folículos secundários, ocorre um fluxo das células mesenquimatosas que migram em direção à lâmina basal, formando um arranjo de células radiais rodeando todo o folículo. Esta nova camada é denominada de teca e posteriormente diferencia-se em teca interna e externa (ERICKSON, 1986).
Em folículos secundários ocorre a aquisição de suprimento sanguíneo, pois folículos pequenos não o possuem e independem de suprimento. Porém, os folículos de tamanho médio (80-100 μm de diâmetro) são servidos por uma ou duas arteríolas, formando uma rede fora da membrana basal. Esta rede, conforme o folículo cresce, torna-se mais extensa e é responsável por manter um sistema próprio de suprimento sanguíneo (HIRSHIFIELD, 1991).
2.1.2.4. Folículos Terciários
O núcleo do oócito é excêntrico e seu citoplasma contém poucas mitocôndrias, corpos multivesiculares, e microtúbulos, porém abundantes vesículas, ribossomos e polirribossomos (CÓDON et al. 2001).
As células da granulosa são grandes, heterocromáticas, possuindo núcleo redondo e citoplasma escasso. Em relação às organelas citoplasmáticas, nestas células observou-se extensos retículos endoplasmáticos granular e complexo de Golgi e escassas mitocôndrias redondas. As células foliculares mantém íntimo contato com a membrana basal formando uma camada compacta (CÓDON et al. 2001).
A camada da teca apresentou-se diferenciada em teca externa e interna. A teca externa é composta principalmente por tecido conjuntivo fibroso, enquanto a camada interna possui células cúbicas altamente vascularizadas e com características ultraestruturais semelhantes à de células produtoras de esteróides, como a presença de gotas lipídicas, retículo endoplasmático liso e mitocôndrias ovóides com cristas tubulares (SHARMA; SAWHENEY, 1996), além de uma membrana basal separando-a da camada de células da granulosa (ERICKSON, 1986).
Uma das funções principais destas células em algumas espécies tais como, bovinos, humanos e roedores é a secreção dos andrógenos (FORTUNE; ARMSTRONG, 1977), além de produzirem também progestágenos sobre o controle de gonadotrofinas. O estradiol 17 β (E2) é o produto de um processo cooperativo entre as células da teca e as células da granulosa.
As células tecais, sob estímulo do hormônio luteinizante (LH) produzem andrógenos que percorre a membrana basal até atingir as células da granulosa, aonde sob a ação do hormônio folículo estimulante (FSH) ocorre a aromatização, resultando em estrógenos (DRUMMOND; FINDLAY, 1999).
2.1.2.5. Folículos Pré-ovulatórios
Com o acúmulo de líquido folicular, ocorre a fusão das cavidades, formando apenas uma única cavidade chamada de antro folicular, o que caracteriza os folículos pré-ovulatórios ou De Graaf (HIRSFIELD, 1991; 1991; ROSS e ROWRELL, 1993; FORTUNE, 1994; EPPIG e O`BRIEN, 1996; CÓDON et al., 2001; GARTNER; HIATT, 2002).
oophurus intimamente ligadas aooócito formam uma camada de formato cilíndrico, a corona radiata, externamente a ZP (ROSS; ROWRELL, 1993; GARTNER; HIATT, 2003).
Quando o folículo De Graaf atinge seu máximo desenvolvimento, a ovulação ocorre de forma espontânea ou induzida através da cópula ou de outro estímulo. O folículo ovulado colapsa e torna-se pregueado, sendo que alguns vasos sanguíneos se rompem e extravasam sangue para dentro da cavidade folicular formando assim o corpo hemorrágico ROSS; ROWRELL, 1993; GARTNER; HIATT, 2003; HAFEZ, 2004).
Enquanto isso, devido os altos níveis de LH, ocorre a luteinização das células da camada da teca e das células da granulosa que culminará com a formação do corpo lúteo, o qual secreta progesterona que induz mudanças no endométrio, permitindo a implantação e o estabelecimento da gravidez (ROSS; ROWRELL, 1993; GARTNER; HIATT, 2003; HAFEZ, 2004).
Caso não ocorra a fertilização, há a regressão do CL permitindo com que haja a maturação de outros folículos ovarianos. À medida que há a regressão das células luteais, o órgão diminui de tamanho e torna-se branco ou castanho-claro denominando-se de corpo albicans (ROSS; ROWRELL, 1993; GARTNER; HIATT, 2003; HAFEZ, 2004).
2.1.3.Dinâmica Folicular
Os folículos primordiais representam um pool de reserva que darão origem a todos os folículos dominantes que poderão ser ou não selecionados para ovular. Assim que o pool de folículos primordiais é estabelecido, inicia-se a fase de recrutamento do folículo continuando pelo resto da vida ou até o final da atividade ovariana (NILSON; SKINNER, 2001).
Depois de iniciado o desenvolvimento dos folículos primordiais, estes podem seguir duas vias: a ovulação ou a atresia (SKINNER, 2005). Embora a maioria dos folículos se torne atrésicos, processo fisiológico que leva a regressão de 99% dos folículos presentes nos ovários, alguns são recrutados em uma onda folicular e continuam a crescer (HAFEZ, 2004).
Os folículos primordiais in vivo são rodeados por um ambiente extra-folicular complexo, incluindo o estroma ovariano, e a influência que os diferentes tipos celulares exercem nos eventos intrafoliculares ao longo da foliculogênese está sendo estudada, porém os mecanismos envolvidos precisam ser elucidados (McNATTY et al. 1999, FORTUNE, 2003). Contudo, há evidências de que o início e o crescimento do folículo primordial de mamíferos dependam de nutrientes e requerem a expressão de vários fatores e receptores, como os receptores de gonadotrofinas, fator de crescimento β (TGF-β) e fator fibroblástico 2 (MACNATTY et al. 1999).
Segundo Nilson; Skinner (2001), Fortune, (2003), Hafez, (2004) a ativação do folículo primordial é independente da ação de gonadotrofinas. O FSH parece ser o mais importante fator no desenvolvimento in vivo de folículos pré-antrais, devido ser um regulador essencial da função ovariana, atuando principalmente na diferenciação e proliferação das CGs (HAFEZ, 2004). Enquanto o LH aumenta a produção de E2 na ovulação (SPEARS et al., 1998).
Em particular, membros do TGF-β tem se mostrado potentes reguladores da proliferação e diferenciação em diferentes espécies (FORTUNE et al. 2003). Três membros da família TGF-β, fator de crescimento e diferenciação 9 (GDF-9), bone morphogenetic protein 15 e 6 (BMP-15 e 6), são expressos pelo oócito e acredita-se serem mediadores do crescimento do folículo pré-antral (ELVIN et al, 2000).
O crescimento e a maturação folicular representam uma série de transformações celulares e moleculares, de forma seqüencial. O crescimento folicular envolve a proliferação e a diferenciação induzida hormonalmente, tanto das células da teca como da granulosa. A produção de E2 determina qual folículo obterá o número de receptores para LH necessários
para a ovulação e a luteinização (HAFEZ, 2004).
O recrutamento folicular refere-se à formação de um pool de folículos pré-ovulatórios que serão selecionados para a ovulação (FORTUNE, 1994). Assim, o número final de folículos ovulatórios é determinado pela quantidade de folículos que são recrutados e na habilidade dos mesmos para continuar o crescimento ou passar pelo processo de atresia (CÁRDENAS; POPE, 2001). O recrutamento folicular em suínos ocorre entre o décimo quarto e décimo sexto dia do ciclo estral (FOXCROFT ; HUNTER, 1985).
bovinos, ovinos, eqüinos, o recrutamento, a seleção, e a dominância ocorrem em intervalos regulares, mas somente o folículo dominante presente durante a fase folicular irá ovular.
Evidências demonstraram que o mecanismo que permite que alguns folículos sejam recrutados para o potencial dominância/ovulação é uma elevação pequena no FSH basal que, por acaso, ocorra no momento da atresia (FORTUNE et al. 2003).
A seleção e a dominância são acompanhadas por aumentos progressivos na habilidade das células tecais de produzirem andrógenos e das CGs aromatizarem o andrógeno em estradiol (FORTUNE, 1994). Cerca de três dias antes da ovulação, os níveis de estradiol aumentam provocando a liberação de uma onda de LH, responsável pela ovulação.
A maturação folicular culmina com a formação do corpo lúteo (CL) o qual é originado a partir das CGs, das células da teca interna e de uma associação destes dois tipos celulares. Assim, as células luteais pequenas seriam originadas exclusivamente das células tecais, enquanto que as células luteais grandes das CGs (SMITH et al. 1994).
A preparação das células luteais para a síntese de progesterona começa antes da ovulação. Porém, a luteinização e a secreção da progesterona podem ocorrer na ausência da ovulação em bovinos, em ovinos e em suínos (SMITH et al. 1994). Em suínos, os corpos lúteos aumentam de peso e conteúdo de progesterona do segundo ao oitavo dia, permanecendo relativamente constante até o décimo quinto dia quando começa a regressão (HAFEZ, 2004). Conseqüentemente, os mecanismos associados com a luteinização não são dependentes da ruptura folicular, e assim a ovulação não garante o desenvolvimento e a função luteal normais (SMITH et al. 1994).
2.2. FAMÍLIA TAYASSUIDAE
A família Tayassuidae é originada da América do Norte (HERSHKOVITZ, 1972), representa um grupo de mamíferos neotropicais que possuem características biológicas distintas dos suídeos do velho mundo (SOWLS, 1997). Compreende os gêneros Tayassu e Catagonus. O gênero Tayassu é representado por duas espécies: Tayassu tajacu e Tayassu pecari. Enquanto que no segundo gênero existe apenas uma espécie Catagonus wagneri (NOWAK, 1991; REDFORD; EINSENBERG, 1992; SOWLS, 1997).
indivíduo adulto tem aproximadamente 75 cm à 1 m de altura, 44 à 57 cm de largura e o peso entre 14 à 30 kg (NOWAK, 1991), não apresentando dimorfismo sexual (EINSENBERG, 1981; ROMÁN, 1996). Uma característica desta espécie é a presença de uma faixa de pêlos esbranquiçados que formam um colar na região do pescoço (ROMÁN, 1996) (Figura 1).
2.3. DISTRIBUIÇÃO GEOGRÁFICA
O caititu distribui-se desde o sul do Estados Unidos da América (Arizona, Novo México e Texas) até o norte da Argentina (EMMONS, 1990; NOWAK, 1991; REDFORD e EINSENBERG, 1992; SOWLS, 1997). As três espécies de taiassuídeos sobrepõem-se em muitas regiões ocupando na maioria das vezes as mesmas áreas geográficas em uma relação simpátrica (SOWLS, 1997) (Figura 2).
2.4. ASPECTOS REPRODUTIVOS DA FÊMEA DO CAITITU
O caititu possui o ciclo estral do tipo poliestral, ou seja, apresenta ciclos estrais regulares e sucessivos (MAYOR et al. 2006). Segundo Barbella (1993a) na Venezuela, o ciclo dura em média de 22,4 + 1,7 dias variando de 17 a 25 dias e um período de estro de 3 a 5 dias. Na Guiana Francesa, Mauget et al. (1996) baseados dosagem de progesterona, detectaram a média do período do ciclo em 27,8 + 1,5 dias, com o período do estro de 4 + 2,9 dias. No Arizona (EUA), os ciclos variam entre 22,6 e 24,6 dias e o período de estro de 3,5 a 4,8 dias (SOWLS, 1997). Na Amazônia brasileira, Da Silva et al.(2002) verificaram o período médio do ciclo estral em três fêmeas com duração de em média 16,2 + 2,6 dias, 22,38 + 3,8 dias, 15,9 + 3,1 dias. Mayor (2002) observou em Iquitos (Peru) o período de 16,28 + 1,53 dias, com duração de fase estro de 3,41 + 1,10 dias.
Os caititus possuem ovulação espontânea e a média do número de folículos ovulados observados em cada ciclo estral é de 2,0-2,1 folículos (MAYOR et al. 2006).
Em algumas áreas, como Texas e Guiana Francesa, onde existem diferenças nas condições ambientais (estação chuvosa e seca), há a sazonalidade reprodutiva regulada pela disponibilidade de recursos alimentares (BODMER et al. 1997). Na Amazônia brasileira e no nordeste peruano, os caititus apresentam reprodução contínua tanto na natureza como em cativeiro (BODMER et al. 1997; SILVA et al. 2002).
Quanto ao período gestacional, há variações de resultados entre os autores. Segundo Barbella, (1993 a) a duração da gestação é estimada em 146 + 2,5 dias, período que se enquadra no obtido por Sowls (1997) que varia de 140 a 150 dias. Já Guimarães et al. (2004) determinaram um período de 138,3 + 5,3 dias. A maioria das gestações é gemelar, entretanto há partos simples, duplos e triplos (BARBELLA, 1993b; GOTTDENKER; BODMER, 1998; DA SILVA et al. 2002; GUIMARÃES et al. 2004).
Segundo os dados de Da Silva et al. (2002) a proporção sexual de animais nascidos em cativeiro foi de 51,8% fêmeas para 48,2% machos. A média do peso de fêmeas ao nascer é de 760 g e de 859 g para os machos. O período lactacional dura de seis a oito semanas (SOWLS, 1997).
de fêmeas prenhas e não prenhas e em estro e determinou o período de 129 dias, com variações de 80 a 205 dias. Na Amazônia brasileira, Guimarães et al. (2004) observando caititus criados em cativeiros determinou a média de 179,2 + 55,6 dias.
2.5. MORFOLOGIA DO SISTEMA GENITAL FEMININO DE Tayassu tajacu
Os órgãos reprodutivos femininos do caititu compõem-se internamente de ovários, tubas uterinas, útero e vagina (Figura 3); além da genitália externa (SANTOS et al. 2000; PAULA et al. 2003; MAYOR, et al. 2006).
Os ovários no caititu localizam-se na parte superior da cavidade abdominal, abaixo da quarta vértebra lombar (MAYOR, et al. 2006), suspensos por uma prega de peritônio e são revestidos parcialmente pela bolsa ovárica (SANTOS et al. 2000; PAULA et al. 2003; MAYOR, et al. 2006). Possuem duas faces, uma medial, voltada para o interior da cavidade abdominal, e outra lateral, voltada para a parede da cavidade abdominal, na região sublombar (SANTOS et al. 2000; PAULAet al. 2003).
Figura 3 - Observação macroscópica do sistema genital feminino de caititu (1-ovários; 2-tubas uterinas; 3-útero; 4-vagina). (Fonte: GUIMARÃES, 2006).
1 1
2
2 3
A forma dos ovários é geralmente ovalada (MAYOR, et al. 2006) podendo adquirir aspecto irregular pela projeção de corpos lúteos ou folículos (SANTOS et al. 2000; CARVALHO, et al., 2003; PAULA et al., 2003). Mayor et al. (2006), descrevem macroscopicamente os corpos lúteos como corpos ovóides de coloração avermelhada protuberantes na superfície ovárica e os folículos em desenvolvimento como corpos translúcidos que podem ou não emergir na superfície.
Os ovários de caititu são revestidos por um estreito epitélio superficial cúbico e logo abaixo possuem a túnica albugínea que em alguns momentos é interrompida pela presença de folículos e corpos lúteos. O estroma ovariano possui fibras musculares envolvendo os folículos (MAYOR, et al. 2006).
As tubas uterinas são longas, finas e não tão sinuosas como nos suínos, medindo em média 8,88 cm + 2,59 cm lado direito e 8,26cm + 2,14 cm lado esquerdo (PAULA et al. 2003) e possuem os ligamentos que ajudam na formação da bolsa ovárica (SANTOS et al. 2000). Podem ser divididas em três segmentos funcionais: o istmo, porção estreita próxima do útero e bem visível; a ampola, uma dilatação na tuba uterina e o infundíbulo, caracterizado por numerosas pregas, as fímbrias, que se projetam sobre a superfície do ovário (SANTOS et al. 2000).
No caititu o útero pode ser classificado como bicórneo, semelhante ao dos suínos (SOWLS, 1997; SANTOS et al. 2000; PAULA et al. 2003; MAYOR et al. 2006). Os cornos uterinos direito e esquerdo, com comprimento de 10,42 cm + 2,36 cm e 10,40 cm + 1,79 cm, respectivamente (PAULA et al. 2003), apresentaram-se grossos, curtos e pouco flexível, comunicando-se com o corpo uterino e com as tubas uterinas (SANTOS et al. 2000). O corpo uterino é curto e possui comprimento de 3,08 cm + 0,32 cm, enquanto que nos suínos esta região pode atingir um comprimento de 5 cm em média. A cérvix apresenta-se longa e espessa nas fêmeas pluríparas e fina nas nulíparas, apresentando várias projeções da mucosa para sua luz (SANTOS et al. 2000).
2.6. ASPECTOS MORFOHISTOLÓGICOS DO OVÁRIO DE SUIFORMES
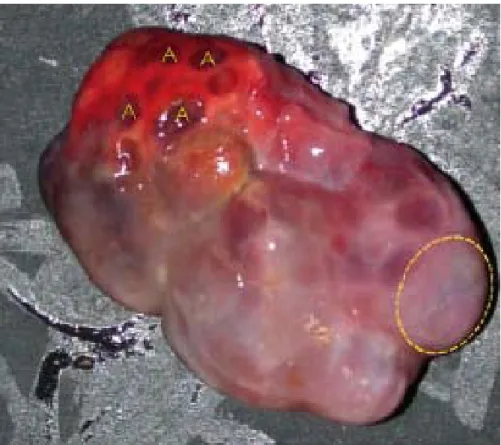
Os suínos possuem ovários revestidos pela bolsa ovárica bastante desenvolvida (SANTOS et al. 2000; HAFEZ, 2004). A superfície ovárica é extremamente granulosa (CARVALHO et al. 2003) e bem irregular com o formato semelhante a “cachos de uva” (Figura 4), devido a permanência e o desenvolvimento simultâneo de vários folículos e corpos lúteos que dificultam a visualização do tecido ovariano subjacente (CARVALHO et al. 2003; HAFEZ, 2004).
Figura 4 - Ovário de suíno (Sus scrofa) apresentando formato irregular devido a presença de folículos (A) e corpo lúteo proeminentes (área pontilhada). Fonte: www.ext.vt.edu/pubs/swine/414-038/414-038.html, acessado em: 22/06/07.
de células foliculares e a formação da cavidade antral ou antro, os quais corresponderam a somente 2-3 % da população folicular ovariana.
Low (1970), estudando 73 pares de ovários de caititu, descreveu-os como órgãos relativamente grandes. Em fêmeas gestantes, a forma do ovário era vista freqüentemente como bilobada devido a presença do corpo lúteo funcional protuberante. Histologicamente, no período ovulatório formavam-se dois folículos de 3 a 6mm de diâmetro.
Barbella (1993) com base nas mudanças morfométricas do aparelho reprodutivo de caititu desde o nascimento até aos doze meses de idade, afirmou que não era possível evidenciar estruturas na superfície exterior dos ovários, entre o nascimento e até os sete meses de idade. O primeiro vestígio do crescimento folicular foi observado aos oito meses, com a presença de folículos, minúsculas áreas translúcidas na superfície ovárica, e somente com um ano foi detectado o primeiro corpo lúteo. Este autor cita que o peso dos ovários aos doze meses é de 1,22 ± 0,72 g para o ovário direito e 1,04 ± 0,72 g para o ovário esquerdo e que a área deste órgão oscilou entre 0,5 cm x 0,4 cm e 1,5 cm x 1,0 cm, ao nascer e aos 12 meses de idade, respectivamente.
Microscopicamente, Barbella (1993) observou que durante os três primeiros meses havia a presença de folículos com apenas uma camada de células da granulosa localizados abaixo da túnica albugínea, e escassos folículos com duas camadas. A partir do sexto mês foi verificado o primeiro folículo antral, com tendência a localizar-se na superfície, à medida que adquiriam dimensões maiores, sendo que não houve identificação de nenhum folículo em processo de atresia ou já atrésicos. No décimo segundo mês notou-se a presença do corpo lúteo, sendo uma estrutura circular de 0,5 cm de diâmetro, e de vários folículos em seu maior grau de desenvolvimento. Segundo o autor, durante esse período é possível que ocorra atresia folicular.
Mangini (1999) realizando estudos sobre a estrutura do trato genital feminino de queixadas (Tayassu pecari) observou que os ovários desta espécie possuem um epitélio de revestimento constituído de células planas, uma túnica albugínea envolvendo a camada cortical, sendo esta constituída de folículos em diferentes graus de desenvolvimento, corpos lúteos, células intersticiais e tecido conjuntivo frouxo, e uma camada medular composta por tecido conjuntivo frouxo vascularizado.
camadas de células foliculares, a zona pelúcida torna-se visível e a camada da teca começa a se organizar; já nos folículos terciários ou de Graaf ocorre a formação do antro folicular, além da formação do cumulus oophurus, da corona radiata e o desenvolvimento total das tecas externas e internas (MANGINI, 1999).
Na fase estrogênica foi observado folículos bem desenvolvidos e tecido luteal em estágio de regressão, caracterizado pela presença marcante de tecido conjuntivo em seu interior. A cápsula de tecido conjuntivo, distinta nos corpos lúteos em atividade, apresentava-se pouco definida com proliferação tecidual para o interior da massa de células luteais. Já na fase progesterônica, o tecido luteal estava em desenvolvimento com células endócrinas vacuolares e vascularização bem desenvolvida, formando grupos de células delimitados pelo tecido conjuntivo (MANGINI, 1999).
Santos et al. 2000 estudando a morfologia dos órgãos genitais de caititu e queixadas, observaram que em ambas as espécies não há diferenças significativas em relação aos dados morfométricos como largura, comprimento e espessura. Em caititu, as médias referentes a largura, comprimento e espessura dos ovários direito é de 0,90 cm, 1,22 cm; 0,98 cm, e dos ovários esquerdo é 0,93 cm, 1,34 cm, 1,1 cm; e em queixadas, as médias referentes a largura, comprimento e espessura dos ovários direito é de 0,71 cm, 1,47 cm; 0,86 cm, e dos ovários esquerdo é 0,86 cm, 1,24 cm, 0,86 cm. Paula, et al. (2003) avaliando a morfologia dos órgãos genitais femininos de caititus obtiveram peso médio de 1,93 ± 0,41 g para o ovário direito e 1,58 ± 0,33 g para o ovário esquerdo.
Carvalho et al. (2003) observaram que no caititu o corpo lúteo representava cerca de 30% da área total ovariana, sendo que em seu lado, encontrava-se o corpo hemorrágico que corresponderia a 50% da área. Segundo estes autores estas estruturas são recobertas por epitélio e por uma cápsula de tecido conjuntivo denso (túnica albugínea ovarii). A área restante do ovário era constituída pelo córtex e medula, assumindo o formato de “meia-lua”, devido o corpo lúteo deslocar o tecido no sentido oposto.
No córtex, observou-se diferentes fases do desenvolvimento folicular, folículos primários, em crescimento, maduros e atrésicos, sendo que nenhum folículo poliovular foi observado, o contrário do descrito para suínos. Na zona medular foram encontrados vasos sangüíneos, vasos linfáticos e nervos envolvidos por tecido conjuntivo frouxo (CARVALHO et al. 2003).
células luteais os corpos lúteos (CL) foram classificados: em CL verdadeiro (cíclico e gravídico) e em CL atrésico.
Segundo estes autores, o diâmetro dos folículos primordiais foi de 22,7 ± 4,8 µm e localizavam-se no córtex abaixo da túnica albugínea, sendo caracterizados pela presença de um oócito com 20,5 + 3,6 µm de diâmetro, envolto por apenas uma camada de células planas. Os folículos primários eram encontrados na área periférica do córtex, apresentando uma camada de células foliculares cúbicas, possuindo diâmetro folicular de 26,0 + 4,1 µm
Os folículos pré-antrais pequenos apresentaram duas a quatro camadas concêntricas de células cúbicas, envolvendo o oócito com diâmetro de 84,6 + 24,2µm, a zona pelúcida incipiente com uma espessura de 2,9 + 1,1 µm e a formação da teca interna com duas camadas de células fusiformes. Já nos folículos pré-antrais grandes, a membrana granulosa possuia cinco a seis camadas, sendo separada do oócito pela zona pelúcida com 3,5 + 2,1 µm de espessura e da teca interna pela membrana basal (MAYOR et al. 2006).
Os folículos antrais foram caracterizados pela presença da cavidade antral. Nos folículos antrais pequenos, as células foliculares apresentaram formato poliédrico, possuindo de seis a dez camadas com diâmetro folicular de 917,7 + 509 µm, sendo que o antro folicular obteve 530 µm de diâmetro. Nesta fase, a camada das tecas atingiu 56,0 + 17,1 µm de espessura e foi dividida em teca externa formada por fibroblastos e algumas camadas de fibras elásticas e teca interna constituída de células fusiformes . O diâmetro do folículo antral grande foi de 2252,7 + 558,2 µm, sendo maior que o folículo antral pequeno, porém não houve diferença significativa entre o tamanho do oócito e o da zona pelúcida (MAYOR et al. 2006).
3. OBJETIVO
3.1. OBJETIVO GERAL
Caracterizar histologicamente a população folicular ovariana de Tayassu tajacu criados em cativeiro nas fases folicular e luteal do ciclo estral com a finalidade de contribuir para utilização de biotécnicas para a conservação desta espécie.
3.2. OBJETIVOS ESPECÍFICOS
1. Caracterizar a morfologia ovariana de Tayassu tajacu;
2. Quantificar micro e macroscopicamente os folículos, corpos lúteos, corpos albicans e hemorrágicos visíveis nas fases folicular e luteal;
3. Analisar qualitativamente a população folicular ovariana em ambas as fases do ciclo estral;
4. MATERIAL E MÉTODOS
4.1. ANIMAIS
Foram utilizadas seis fêmeas multíparas ciclando regularmente com idade entre 12 e 24 meses, e mantidas no criatório científico de caititus (Processo IBAMA nº 02018.000542/96-61) localizado no campo experimental Álvaro Adolfo da Embrapa-Amazônia Oriental (Belém, Pará).
Os animais foram mantidos em baias de 3 m x 12 m, alimentados com ração de crescimento (14% Proteína Bruta), ocasionalmente era ofertado capim elefante (Pennisetum hybridum), banana (Musa sp) e tucumã (Astrocaryum aculeatum).
4.2. COLETA DOS OVÁRIOS
4.3. HISTOLOGIA OVARIANA
Os ovários foram descritos quanto às características anatômicas (localização, formato, coloração), mensurados com auxílio de paquímetro1 obtendo as medidas de largura, comprimento e espessura, e pesados em balança analítica de precisão2. Através da lupa estereomicroscópica3, os ovários foram inspecionados para contagem de corpos hemorrágicos, lúteos, albicans e folículos visíveis. Após, foram fixados durante 48 horas em solução Bouin, e posteriormente lavados com hidróxido de amônia. O material passou por um processo de desidratação, diafanização e inclusão em parafina, realizando-se posteriormente cortes de 7 µm, os quais foram corados com Hematoxilina-Eosina (H.E).
A análise dos cortes ovarianos foi feita através de microscópio óptico 4com objetivas de 10x e 40x, fazendo-se a quantificação e descrição histológica das estruturas ovarianas, como: folículos e corpos lúteos, albicans e hemorrágicos.
4.3.1. Classificação Folicular
Os folículos ovarianos observados em diferentes estágios de maturação foram classificados de acordo com GARTNER; HIATT (2003) em:
1- Folículos primordiais: o oócito primário está rodeado de uma única camada de células foliculares pavimentosas;
2- Folículos primários: o oócito primário está envolvido por uma única camada de células foliculares pavimentosas e/ou células cúbicas;
3- Folículos secundários: o oócito primário está envolvido por várias camadas de células foliculares, a zona pelúcida torna-se visível e a camada da teca começa a se organizar;
5- Folículos terciários ou de Graaf (maduros): folículos com formação do antro folicular. Há a formação do cumulus oophurus, da corona radiata e o desenvolvimento total das tecas externas e internas.
1
Paquímetro (Somet Inox) 2
Balança (Startorius)
3
Lupa estereomicroscópica (Zeiss SV 11)
4
4.3.2. Análise Qualitativa da População Folicular
Para análise qualitativa todos os folículos contados foram classificados em normais e degenerados. Os folículos normais eram aqueles que apresentaram a membrana basal completa, ausência de corpos picnóticos no núcleo do oócito e sem sinais de degeneração do oócito e das CGs (BAILEY et al. 1976). Para serem considerados degenerados, as camadas da granulosa e das tecas estavam hipertrofiadas e estendidas ocupando o antro, e o oócito estava em processo de degeneração (GARTNER; HIATT, 2003).
4.3.3. Estimativa da População Folicular Ovariana
Para cada fase foi realizada a contagem de folículos pré-antrais a cada 30º secção montada, considerando aqueles que apresentavam núcleo visível do oócito, já os folículos antrais, caracterizados pela presença da cavidade antral, foram estimados a cada 40º secção.
As populações foliculares foram estimadas através do Fractionator method (Gundersen, et al. 1988), que consiste na contagem das estruturas ovarianas, segundo a fórmula:
Número de folículos x número de secções
4.3.4. Dimensões Foliculares
Os folículos foram medidos através de ocular micrométrica acoplada ao microscópio óptico (10x e 40x). Foram selecionados cinco folículos pré-antrais em cada fase do ciclo estral para mensuração do diâmetro do oócito, do seu núcleo, e do próprio folículo, assim como, para os folículos antrais. O diâmetro aproximado da camada de CGs foi obtido de todos os folículos pré-antrais, subtraindo-se o diâmetro folicular do diâmetro do oócito.
4.5. ANÁLISE ESTATÍSTICA
5. RESULTADOS
5.1. MORFOLOGIA OVARIANA
Os ovários de caititu observados encontravam-se parcialmente envoltos pela bolsa ovárica. A maioria dos ovários analisados apresentou formato ovóide, entretanto alguns possuíam formato variável (Figura 5), e superfície irregular devido a presença de folículos caracterizados como pontuações arredondadas e translúcidas (Figura 6), de corpos lúteos descritos como pontos redondos, consistentes e avermelhados e de corpos hemorrágicos (Figura 7) identificados pela presença de um coágulo sangüíneo. Foi observado que na fase folicular os ovários possuíam formato mais regular com alguns folículos em destaque e menos pesados por não possuírem os corpos hemorrágicos, diferente da fase luteal.
Figura 6 - Observação macroscópica de ovário de caititu mostrando o folículo pré-ovulatório (FOV).
5.2.BIOMETRIA E CONTAGEM MACROSCÓPICA DAS ESTRUTURAS OVARIANAS
Os valores médios referentes ao comprimento, largura, espessura e peso entre os ovários direito e esquerdo nas fases folicular e luteal, não mostraram diferenças significativas conforme demonstra a Tabela 1.
Tabela 1. Médias dos dados biométricos referentes a comprimento, largura, espessura e peso dos ovários direito e esquerdo de seis fêmeas decaititudurante as fases folicular e luteal.
Fase Folicular Fase Luteal
Ovário Direito Ovário Esquerdo Ovário Direito Ovário Esquerdo
Comprimento (cm) 1,79 ± 0,77 1,69 ± 0,14 1,37 ± 0,05 1,66 ± 0,64
Largura (cm) 1,13 ± 0,15 1,10 ± 0,29 1,02 ± 0,16 0,96 ± 0,16
Espessura (cm) 0,84 ± 0,15 0,94 ± 0,18 0,83 ± 0,03 0,88 ± 0,19
Peso (g) 0,79 ± 0,18 1,04 ± 0,42 1,44 ± 0,93 1,98 ± 0,49
Os valores médios da contagem macroscópica das estruturas ovarianas, como folículos, corpos lúteos, corpos hemorrágicos e corpos albicans, estão demonstrados na Tabela 2.
Tabela 2. Média da contagem macroscópica de folículos, corpos lúteos, corpos hemorrágicos, corpos albicans nos ovários direito e esquerdo de seis fêmeas de caititu durante as fases folicular e luteal.
Fase Folicular Fase Luteal
Ovário Direito Ovário Esquerdo Ovário Direito Ovário Esquerdo
Folículos 37,6± 3,8a 33,2 ± 2,7a 31,0 ± 5,3a 34,8 ± 3,9 a
Corpos lúteos 1,33 ± 0,5b 1,4 ± 0,7b 2,1 ± 0,8b 2,67 ± 0,5b
Corpos albicans 12,6 ± 1,7c 13,3 ± 3,3c 16 ± 3,7c 19,6 ± 2,6c
Corpos
hermorrágicos - - 1,4 ± 0,3
d
0,9 ± 0,2d
Nas fases folicular e luteal, os valores médios de cada estrutura analisada entre os ovários direito e esquerdo não apresentaram diferença significativa. Contudo, foi observado que a média de folículos encontrada diferiu significantemente, apresentando número superior às demais estruturas, bem como, o número médio de corpos albicans quando comparado ao número de corpos lúteos.
5.3. HISTOLOGIA OVARIANA
Verificou-se histologicamente que a superfície ovárica de caititu mostrou-se envolvida por um epitélio cúbico simples, sendo que essas células tornavam-se planas quando apresentavam corpos lúteos, corpos hemorrágicos e folículos pré-ovulatórios que ocupavam grande parte da área total do ovário.
Observou-se que o ovário apresenta-se constituído pelas regiões cortical e medular. A região cortical encontrava-se envolvida por uma camada de tecido conjuntivo fibroso, a túnica albugínea, e continha folículos em várias etapas de desenvolvimento, corpos lúteos, hemorrágicos e albicans, células intersticiais e tecido conjuntivo frouxo. Não foi verificado a ocorrência de folículos poliovulares (2 a 4 ovócitos) em pré-antrais e antrais. Já a região medular era composta de tecido conjuntivo frouxo ricamente vascularizado.
Figura 8 - Fotomicrografia ilustrando os folículos primordiais (seta preta) presentes no córtex ovariano, 40 X H.E.
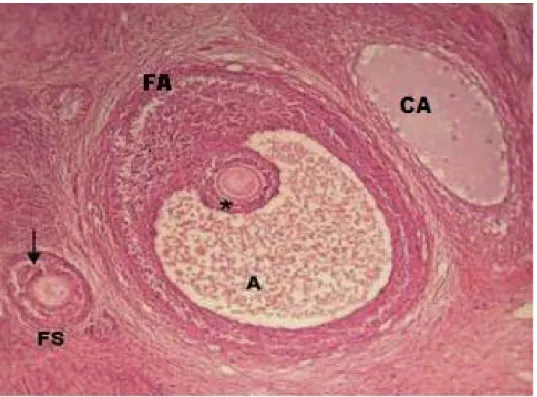
Os folículos secundários (Figura 9) apresentaram a estratificação da camada da granulosa e o início da formação da cavidade antral, além da formação da zona pelúcida e de um arranjo de células de formato fusiforme que caracterizaram a teca interna.
Os folículos antrais (Figura 9) localizavam-se nas áreas mais centrais do estroma ovárico, e apresentavam o oócito circundado por diversas células da granulosa, além da presença da cavidade antral preenchida pelo líquido folicular que invade o interior do folículo pressionando a camada das células da granulosa para a periferia. Nos folículos antrais foi observada a camada da teca constituída de células planas (teca interna) e fibrosas (teca externa).
Figura 9 - Fotomicrografia ilustrando o folículo secundário (FS) (seta preta), o folículo antral apresentando o antro (A) e a corona radiata (*) e o corpo albicans (CA), 40 X H.E.
Figura 10 - Fotomicrografia ilustrando o corpo lúteo com a presença de células luteinizadas, (setas pretas) 40 X H.E.
5.4. ESTIMATIVA DA POPULAÇÃO FOLICULAR
Tabela 3. População média de folículos pré-antrais dos ovários direito e esquerdo de três fêmeas de caititu durante a fase folicular .
Fase Folicular
Ovário Direito Ovário Esquerdo
Primordial 358,8 ± 152,6ª,1 561,6 ± 219,9ª,2
Primário 273,6 ± 101,5ª,3 333,6 ± 137,4b,3
Secundário 122,4 ± 42,4b,4 188,4 ± 49,4c, 5
Letras diferentes sobrescritas entre linhas na mesma coluna representam diferença estatística (p<0,05); Números diferentes sobrescritos entre colunas representam diferença estatística (p<0,05).
Durante a fase folicular (Tabela 3), foi observado que no ovário direito houve semelhanças entre as médias de folículos primordiais quando comparada com a média de folículos primários. Entretanto, quando se comparou a média de folículos secundários com as demais categorias houve diferença estatística significativa (p<0,05). Já no ovário esquerdo, entre todas as categorias analisadas, houve diferença significativa. Nesta fase percebeu-se que os folículos primordiais e secundários obtiveram maiores valores médios no ovário esquerdo, enquanto que os folículos primários não apresentaram diferença significativa entre os ovários.
Tabela 4. População média de folículos pré-antrais dos ovários direito e esquerdo de três fêmeas de caititu durante a fase luteal.
Fase Luteal
Ovário Direito Ovário Esquerdo
Primordial 182,8 ± 108,4a,1 369,6 ± 107,4ª,2
Primário 202 ± 90,7ª,3 252 ± 97,3a,3
Secundário 59,6 ± 21,3b,4 103,2 ± 53,4b,5
Analisando a população de folículos pré-antrais na fase luteal (Tabela 4), nota-se que nos ovários direito e esquerdo, os números médios de folículos primários quando comparado aos números médios de folículos primordiais eram semelhantes, porém em relação aos folículos secundários apresentou diferença significativa (p<0,05). As médias da população de folículos secundários também apresentaram diferença significativa quando comparado com o número médio dos folículos primordiais. Na fase luteal, semelhante ao observado na fase folicular, os folículos primordiais e secundários obtiveram maiores valores médios no ovário esquerdo, e na categoria de folículos primários não houve diferença significativa entre os ovários.
Na Tabela 5, observou-se que as médias da população de folículos pré-antrais encontradas na fase folicular apresentaram diferença significativa (p<0,05) quando comparada com as médias da fase luteal, com exceção dos folículos primários.
Tabela 5. População média de folículos pré-antrais de seis fêmeas de caititu durante a fase folicular e luteal.
‘ Fase Folicular Fase Luteal
Primordial 460,2 ± 211,3 a
276,2 ± 78,0 b
Primário 303,6 ± 122,1
c
237,0 ± 68,8c
Secundário 155,4 ±55,9
d
78,3 ± 23,3e
Letras diferentes sobrescritas entre colunas representam diferença estatística (p<0,05).
Tabela 6. População média de folículos antrais dos ovários direito e esquerdo de seis fêmeas de caititu durante a fase folicular e luteal.
Fase Folicular Fase Luteal
Ovário Direito Ovário Esquerdo Ovário Direito Ovário Esquerdo
Antral 61,80 ± 45a 115,3 ± 43,1b 54,1 ± 19,1c 65,3 ± 30,5c
Letras diferentes sobrescritas entre linhas representam diferença estatística (p<0,05).
Já na Tabela 7, observou-se que o valor médio de folículos antrais na fase folicular apresentou diferença significativa quando comparada à fase luteal.
Tabela 7. População média de folículos antrais de seis fêmeas de caititu durante as fases folicular e luteal.
Fase Folicular Fase Luteal
Antral 103,5 ± 45,6
a
60,0 ± 26,1 b
5.5. ANÁLISE QUALITATIVA
Os folículos pré-antrais e antrais analisados foram classificados como normais e degenerados. Nas Figuras 12, 13 e 14 estão demonstradas as médias de folículos normais e degenerados em cada categoria de folículos pré-antrais e antrais respectivamente, de acordo com as fases folicular e luteal.
Nas fases folicular e luteal, verificou-se a ocorrência predominante de folículos pré-antrais normais nas diferentes categorias, com exceção dos folículos secundários que apresentaram médias de degeneração folicular superiores às outras categorias. Em relação as médias de folículos antrais, em ambas as fases observou-se um alto grau de degeneração.
Fase folicular
205.1 142.6 98.6 119.4 82.6 187 0 50 100 150 200 2501 2 3
1-Primordiais;2-Primários;3-Secundários M é di a d a pop. f ol ic ul a r Normais Degenerados
Fase Luteal
159.4 156.4 80.4 124.3 89.6 112.2 0 20 40 60 80 100 120 140 160 1801 2 3
1-Primordiais;2-Primários;3-Secundários M é d ia da pop . f ol ic u la r Normais Degenerados
Figura 11 - Média de folículos pré-antrais normais e degenerados nos ovários de três fêmeas de caititu durante a fase luteal.
Folículo Antral
38.8 46.7 62.4 74.1 0 10 20 30 40 50 60 70 80 1 2Folicular Luteal
Mé d ia d a p o p . f o li c u la r Normais Degenerados