Disciplina Ligações Químicas
Prof. Dalmo Mandelli
Ligações em Moléculas Poliatômicas
Parte 5
Teoria do orbital molecular: a abordagem dos orbitais de grupo ligantes (OGL) e a aplicação a moléculas triatômicas
Apesar de seu sucesso, a aplicação da teoria da ligação de valência à ligação em
moléculas poliatômicas leva a dificuldades conceituais.
O método indica que as ligações são localizadas.
Como consequência, conjuntos de estruturas de ressonância e a visão de ligações
envolvendo esquemas de hibridização se tornam difíceis de se estabelecer, mesmo para moléculas relativamente pequenas
Assim, vamos voltar nossa atenção para a teoria do orbital molecular (OM).
Diagramas de OM: partindo das espécies diatômicas para as poliatômicas
No tratamento da ligação em espécies diatômicas, construímos diagramas OM como abaixo
Os OAs dos dois átomos eram representados à esquerda e à direita do diagrama, com os OM no meio.
Foram construídas linhas de correlação ligando os AO aos
OM para produzir um
diagrama facilmente interpretável.
Molécula triatômica como o CO
2Considere agora a situação para uma molécula triatômica como o CO2 .
Os OM contêm contribuições de OA dos três átomos.
Temos o problema de tentar esquematizar um diagrama OM envolvendo quatro conjuntos
de orbitais (três conjuntos de OA e um conjunto de OM) .
Uma descrição da ligação no CF4 envolve cinco conjuntos de OA e um conjunto de OM, ou seja, é um problema de seis componentes.
Da mesma forma, o SF6 é um problema de oito componentes.
É claro que esses diagramas OM são complicados e, provavelmente, difíceis de serem construídos e interpretados.
A fim de superar essa dificuldade, é comum tratar a descrição de uma molécula poliatômica
como um problema de três componentes, um método conhecido como abordagem dos
orbitais de grupo ligantes (OGL) (Ligand Group Orbital Approach – LGO).
Abordagem OM à ligação no XH2 linear: combinação das simetrias por inspeção
Na molécula triatômica linear XH2 os orbitais de valência de X são os orbitais atômicos
2s e 2p.
Vamos orientar o esqueleto H-X-H de modo a coincidir com o eixo z, como mostrado na figura abaixo.
Molécula triatômica XH
2Abordagem do orbital de grupo ligante (OGL) para construir um
diagrama OM para uma molécula linear XH2 a partir das interações entre os orbitais de valência de X (orbitais atômicos 2s e 2p) e um fragmento H---H.
Para maior clareza, as linhas que marcam as energias dos orbitais 2p
são traçadas separadas, embora esses orbitais sejam, na verdade, degenerados.
Cada orbital atômico l s tem duas fases
possíveis e, quando os dois orbitais ls são tratados como um grupo, há duas combinações de fase possíveis.
Estes são
denominados orbitais de grupo ligantes (OLG) e são mostrados no
lado direito.
Estamos
transformando a descrição da ligação no XH2 de uma base formada pelos OA dos átomos de X e H
em outra na qual a
base é formada pelos
O número de
orbitais de grupo ligantes formados é
igual ao número de
orbitais atômicos usados.
OA=OGL
Ao construirmos um diagrama OM para o XH2 consideramos as interações entre os OA de valência de X com os
orbitais de grupo ligantes do
fragmento H---H.
Os diagramas superiores são representações mais realistas dos OM e foram obtidos computacionalmente usando Spartan '04, © Wavefunction Inc., 2003.
Orbital de grupo ligante OLG (1) tem a
simetria correta para interagir com o
orbital 2s de X, dando um OM com caráter ligante H-X-H.
A simetria do OLG (2) coincide com a do OA 2pz de X.
O orbital ligante resultante e sua contraparte antiligante e o diagrama OM são mostrados abaixo.
1 2 3 4
5 6
Pode-se ver as interações
correspondentes entre os orbitais.
Os OAs 2px e 2py de X se tornam orbitais
não ligantes em XH2.
A etapa final na construção do
diagrama OM é alocar os elétrons disponíveis nos OM conforme o
princípio do aufbau
Resultado importante no tratamento OM da ligação no XH2 é que o caráter ligante nos orbitais 1 e 2 é espalhado sobre todos os três átomos,
indicando que o caráter ligante é
delocalizado ao longo do esqueleto H- X- H.
A ligação
delocalizada é um
Abordagem OM à ligação no XH
2:
partindo da simetria molecular
O método mostrado anteriormente
para obter uma descrição da ligação no
XH2 linear não pode ser facilmente estendido a moléculas maiores.
Um método mais rigoroso é identificar o grupo de pontos do XH2 como Dh.
A tabela de caracteres é usada para
atribuir simetrias aos orbitais sobre um átomo X e aos orbitais de grupo ligantes. O diagrama OM é então construído permitindo-se as
interações entre orbitais de mesma
simetria.
Infelizmente, embora uma molécula linear XH2 seja estruturalmente simples, a tabela de caracteres Dh não o é.
Portanto, este é um primeiro exemplo ruim do uso da teoria de grupos na análise dos orbitais.
Podemos fazer uma analogia entre as
simetrias dos orbitais em XH2 linear e
daqueles em moléculas diatômicas
(também Dh )
No diagrama de OM ao lado são dadas as
simetrias dos orbitais no átomo X e dos orbitais de grupo ligantes.
Compare os símbolos de simetria abaixo com os das figuras ao lado.
A construção do diagrama OM abaixo é feita permitindo-se as interações (ligantes ou
Uma molécula triatômica angular - H
2O
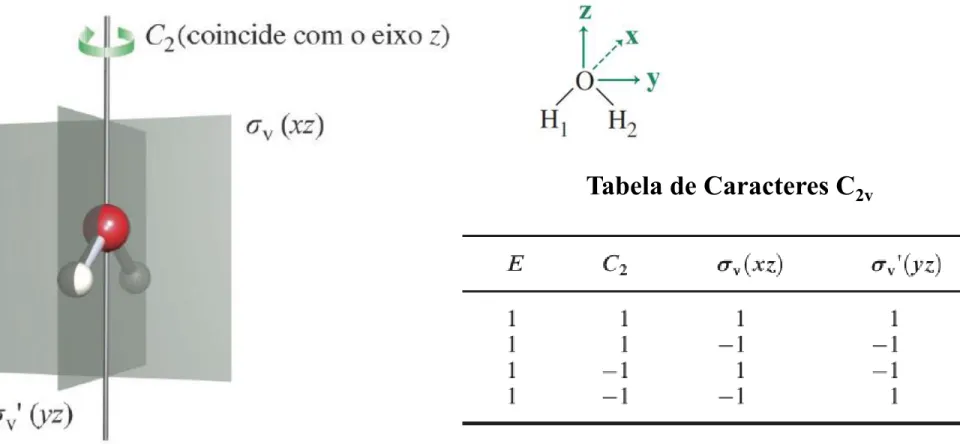
A molécula de H2O tem simetria C2v
Vamos usar essa informação para desenvolver um esquema OM para a ligação na H2O.
Tabela de Caracteres C2v
Os símbolos na primeira coluna (abaixo do símbolo do grupo de pontos) indicam os tipos de simetria dos orbitais que são permitidos para o grupo de pontos especificado.
Os números na coluna encabeçada por E (o operador identidade) indicam a degenerescência de cada tipo de orbital.
No grupo de pontos C2v todos os orbitais têm degenerescência igual a 1 (não são degenerados).
Os símbolos na primeira coluna (abaixo do símbolo do grupo de pontos) indicam os tipos de simetria dos orbitais que são permitidos para o grupo de pontos especificado.
Os números na coluna encabeçada por E (o operador identidade) indicam a degenerescência de cada tipo de orbital.
No grupo de pontos C2v todos os orbitais têm degenerescência igual a 1 (não são degenerados).
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
Os símbolos na primeira coluna (abaixo do símbolo do grupo de pontos) indicam os tipos de simetria dos orbitais que são permitidos para o grupo de pontos especificado.
Os números na coluna encabeçada por E (o operador identidade) indicam a degenerescência de cada tipo de orbital.
No grupo de pontos C2v todos os orbitais têm degenerescência igual a 1 (não são degenerados).
Cada linha de números que se segue ao símbolo de simetria indica como um determinado orbital se comporta sob cada operação de simetria.
Um número 1 significa que o orbital não se altera pela operação, um -1 indica que o orbital troca de sinal e um zero significa que o orbital muda de outra maneira
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
Cada linha de números que se segue ao símbolo de simetria indica como um determinado orbital se comporta sob cada operação de simetria.
Um número 1 significa que o orbital não se altera pela operação,
Um número -1 indica que o orbital troca de sinal e um zero significa que o orbital muda de outra maneira
Operador E deixa o orbital atômico 2s inalterado.
Rotação em torno do eixo C2 deixa 2s inalterado.
Reflexões através dos plano v (xz) e v (yz) deixam 2s inalterado.
Esses resultados correspondem à seguinte linha de caracteres
orbital atômico
2s do oxigênio
e ela coincide com o tipo de simetria A1 na tabela de caracteres de C2v
Assim identificamos o orbital atômico 2s no átomo de oxigênio na água como um orbital a1
São usadas letras minúsculas para o símbolo do orbital, letras maiúsculas para o tipo de simetria na tabela de caracteres.
Operador E e a reflexão através do plano v (xz) deixam o orbital atômico 2px inalterado.
Rotação em torno do eixo C2 e reflexão através do plano v (yz) invertem a fase de 2px.
Esses resultados correspondem à seguinte linha de caracteres
Esta linha coincide com o tipo de simetria B1 na tabela de caracteres de C2v
Portanto o orbital atômico 2px no átomo de oxigênio possui simetria b1
Orbital p
xC. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
Operador E e a reflexão através do do plano v (yz) deixam o orbital atômico 2py inalterado.
Rotação em torno do eixo C2 e reflexão através do plano v (xz)
invertem a fase de 2py.
Esses resultados correspondem à seguinte linha de caracteres
Esta linha coincide com o tipo de simetria B2 na tabela de caracteres de C2v
Portanto o orbital atômico 2py no átomo de oxigênio possui simetria b2
Operador E deixa o orbital atômico 2pz inalterado.
Rotação em torno do eixo C2 deixa 2pz inalterado.
Reflexões através dos plano v (xz) e v (yz) deixam 2pz inalterado.
Esses resultados correspondem à seguinte linha de caracteres
Da mesma forma que para 2s, esta linha coincide com o tipo de simetria A1 na tabela de caracteres de C2v
Assim identificamos o orbital atômico 2pz no átomo de oxigênio na água como um orbital a1
São usadas letras minúsculas para o símbolo do orbital, mas letras maiúsculas para o tipo de simetria na tabela de caracteres.
Natureza dos OGL (Orbitais de Grupo Ligantes) H---H
A etapa seguinte é definir a
natureza dos orbitais de
grupo ligantes H---H que são
permitidos dentro do grupo de pontos C2v
Como iniciamos com dois
orbitais 1s do H, só podem ser construídos dois OGL.
As simetrias desses OGL são deduzidas como segue.
Vamos ver o que ocorre com
cada um dos dois orbitais 1s do H quando é realizada cada operação de simetria.
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
Ambos os orbitais 1s são deixados inalterados por
E e pela reflexão através do plano v (yz)
Mas ambos são afetados pela rotação em torno do eixo C2 e pela reflexão
através do plano v (xz).
Essas informações são resumidas na seguinte linha de caracteres:
"2" mostra que “2 orbitais ficam inalterados pela operação" “0" significa que "nenhum orbital é inalterado pela operação".
Ambos os orbitais 1s são deixados inalterados por
E e pela reflexão através do plano v (yz)
Mas ambos são afetados pela rotação em torno do eixo C2 e pela reflexão
através do plano v (xz).
Essas informações são resumidas na seguinte linha de caracteres:
Em seguida, observamos dois fatos:
(i) podemos construir apenas dois OGL
(ii) a simetria de cada OGL deve
corresponder a um dos tipos de simetria na tabela de caracteres.
Agora, comparamos a linha de caracteres vista anteriormente com os somatórios de duas linhas de caracteres na tabela de caracteres de C2v
É encontrada uma combinação com o somatório dos caracteres para as representações A1 e B2.
Assim podemos deduzir que os dois OGL possuem simetrias a1 e b2, respectivamente.
OM a1 de menor E OM a1 de maior E
OM b2 OM b1
Nesse caso, é relativamente simples usar os símbolos de simetria a1 e b2 para esquematizar os OGL mostrados
O orbital a1 corresponde a uma combinação em fase de orbitais 1s do H, enquanto o orbital b2 é a combinação fora de fase de orbitais l s do H.
No entanto, uma vez conhecidas suas simetrias, o método rigoroso de determinar a natureza dos orbitais é o que segue
Agora, olhamos o efeito que cada operação de simetria do grupo de pontos C2v tem sobre 1.
O operador E e a reflexão através do plano v (yz) deixam 1 inalterado
Mas uma rotação de C2 e uma reflexão através do plano v(xz)
transformam, cada uma delas, 1 em 2
Os resultados são anotados na forma de uma linha de caracteres:
1
2Representemos os orbitais 1s dos dois átomos de H como 1 e 2.
Para determinar a composição do OGL a1 do fragmento H---H na H2O, multiplicamos cada caractere da linha vista anteriormente pelo caractere correspondente para a
representação A1 na tabela de caracteres de C2v isto é,
O resultado da multiplicação dá a função de onda não normalizada para o orbital a1
Isso pode ser simplificado dividindo-se por 2 e, após a normalização tem-se a equação final para a função de onda
combinação em fase
De modo semelhante, pelo uso da representação B2 na tabela de caracteres de C2v
podemos escrever a equação não normalizada
combinação fora de fase
e em seguida sua versão normalizada
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
OM a1 de menor E OM a1 de maior E
OM b2 OM b1
Como construir o diagrama abaixo via simetria?
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
Cada um dos orbitais 2s e 2pz,
do átomo de oxigênio possui a
simetria correta (a1) para interagir com o orbital a1 do fragmento H---H.
Essas interações de orbitais devem levar a três OM: dois OM ligantes com simetria a1
e um OM antiligante (a1)
Em termos de simetria, o OM
a1 de menor E também
poderia incluir o caráter 2pz,
mas o caráter 2s domina por causa da separação de E entre os orbitais atômicos 2s e 2pz
Como construir o diagrama abaixo via simetria?
H
A interação entre o orbital atômico 2py e o OGL com
simetria b2 leva a dois OM que possuem caráter ligante e
antiligante H-O-H, respectivamente.
O orbital 2px do oxigênio tem
simetria b1 e não há nenhuma
combinação de simetria com um OGL.
Dessa forma, o orbital 2px do oxigênio é não ligante na H2O.
Como construir o diagrama abaixo via simetria?
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
Os oito elétrons de valência na
H2O ocupam os OM de acordo
com o princípio de aufbau
Formam-se dois OM ligantes
H-O-H ocupados e outros dois
(também OM ocupados) com caráter principalmente de oxigênio.
Como construir o diagrama abaixo via simetria?
H
2
O
Teoria do OM aplicada às moléculas poliatômicas BH3, NH3 e CH4
v
v
vC
3NH
3Consideremos as ligações no BH3 e no NH3.
Em ambas as moléculas envolvem interações , mas enquanto o BH3 tem simetria D3h, o NH3 pertence ao grupo de pontos C3v.
v
v
v
hC
3, S
3C
2C
2
C
2BH
3A existência do BH3 em fase gasosa foi estabelecida ainda que a molécula
dimerize facilmente para B2H6
BH3 pertence ao grupo de pontos D3h
Considerando as interações de orbitais
entre os orbitais atômicos do átomo de B
e os OGL de um fragmento H3
apropriado, podemos estabelecer um
esquema de ligação molecular.
BH
3
v
v
v
hC
3, S
3C
2C
2
C
2Começamos escolhendo um conjunto apropriado de eixos.
O eixo z coincide com o eixo C3 do BH3, e todos os átomos localizam-se no plano xy.
BH
3
v
v
v
hC
2C
2
C
2-o orbital 2s tem simetria a1
-o orbital 2pz tem simetria a2
-os orbitais 2px, e 2py são degenerados e o conjunto de orbitais tem simetria e
Apóstrofos únicos são simétricos para h e
apóstrofos duplos são assimétricos quando é necessária uma distinção entre representações (C3h, C5h, D3h, D5h).
Consideramos a natureza dos três OGL que são formados a partir de combinações lineares dos três orbitais 1s do H.
Por referência ao fragmento H, no BH3, calculamos quantos orbitais 1s do H são deixados inalterados por operação de simetria no grupo de pontos D3h
O resultado é representado pela seguinte linha de caracteres:
3 = 3 orbitais ficam inalterados pela operação
1 = 1 orbital ficou inalterado pela operação
0 = nenhum orbital é inalterado pela operação
Essa mesma linha de caracteres pode ser obtida pelo somatório das linhas de
caracteres para as representações A1' e
E' na tabela de caracteres de D3h
Assim, os três OGL têm simetrias a1' ou e'
Identificador e designa um conjunto de orbitais duplamente degenerados.
Agora temos que determinar a função de onda para cada OGL.
Sejam os três orbitais 1s do H no fragmento H3 do BH3: 1 2 3
3 2
1
v
v
v
hC
2C
2
C
2Devemos avaliar como 1 é afetado por cada
operação de simetria do grupo de pontos D3h
A operação C3 transforma 1 em 2
C32 transforma
1 em 3
As três operações C2
-deixam 1 inalterado
-transformam 1 em 2
-transformam 1 em 3
OGL (1)
BH
Devemos avaliar como 1 é afetado por cada
operação de simetria do grupo de pontos D3h
A operação C3 transforma 1 em 2
C32 transforma
1 em 3
As três operações C2
-deixam 1 inalterado
-transformam 1 em 2
-transformam 1 em 3
A linha de caracteres a seguir fornece o resultado completo:
continua em OGL (1)
v
v
v
hC
2C
2
C
2OGL (1)
BH
A função de onda não normalizada para o OGL (1) é determinada multiplicando-se
cada caractere na linha vista anteriormente pelo caractere correspondente para a representação A1' na tabela de caracteres de D3h
BH
3A função de onda não normalizada para o OGL (1) é determinada multiplicando-se cada caractere na linha vista anteriormente pelo caractere correspondente para a representação A1' na tabela de caracteres de D3h
Após simplificação (dividindo por 4) e normalização, a função de onda pode ser escrita como abaixo.
BH
3D3h
E
Esta função e pode ser descrita esquematicamente como uma
combinação em fase de orbitais
1s apresentada como o OGL(1)
BH
3E
BH
3https://chem.libretexts.org/Textbook_Maps/Inorganic_Chemistry_Textbook_Maps/Map%3A_Inorganic_Chemistry_(Housecroft)/05%3A_Bonding_in_polyatomic_mol ecules/5.5%3A_MO_Theory_Applied_to_Polyatomic_Molecules_%5C(BH_3%5C)%2C_%5C(NH_3%5C)%2C_and_%5C(CH_4%5C)/5.5A%3A_%5C(BH_3%5C)
How to determine the shapes of the LGOS?
-LGO's symmetry labels are a1' + e'. There are 3 LGOs that can be made out of these symmetry labels - One LGO is from a1' and two LGOs are from e' due to doubly degenerate. In order to determine the shape of each LGO, we would use the wavefunctions.
-Three H in BH3 are assigned with Ψ1, Ψ2, Ψ3. Now lets look at how each Ψ is affected by the symmetry operations of the D3h and their results are completed in the following table:
LGO(1)
3 2
1
OGL (2)
Vamos usar um procedimento semelhante para deduzir que a
equação ao lado
descreve a
função de onda normalizada para um dos orbitais e' degenerados.
De modo
esquemático, isto é representado como o OGL(2)
Este orbital
contém um plano nodal.
BH
3Vê-se que as operações do grupo de pontos
D3h transformam 1 da seguinte maneira:
Deduzindo a função de onda para os orbitais e´
A função de onda não
normalizada para o OGL(2) é determinada multiplicando-se
cada caractere na linha obtida acima pelo caractere
correspondente para a
representação E' na tabela de caracteres de D3h
3 2
1
OGL (2)
(e) = 21 - 12 - 13 + 01 + 03 + 02 + 21 - 2 - 3 + 01 + 03 + 02
(e) = 41 - 22 - 23
(e) = 2(21 - 2 - 3)
Simplificando (divide-se por 2)
Normalizando
(e) = (21 1 - 2 - 3)
√6
Multiplicando pela linha correspondente
E´ obtém-se...
OGL (2)
BH
3https://chem.libretexts.org/Textbook_Maps/Inorganic_Chemistry_Textbook_Maps/Map%3A_Inorganic_Chemistry_(Housecroft)/05%3A_Bonding_in_polyatomic_mol ecules/5.5%3A_MO_Theory_Applied_to_Polyatomic_Molecules_%5C(BH_3%5C)%2C_%5C(NH_3%5C)%2C_and_%5C(CH_4%5C)/5.5A%3A_%5C(BH_3%5C)
LGO (2)
Cada orbital e' deve conter um plano nodal, e os planos nos dois orbitais são ortogonais um ao outro.
De modo similar, podemos escrever a equação abaixo para descrever o segundo
orbital e‘
O plano nodal passa pelo átomo H(1) e o orbital 1s desse átomo não faz nenhuma contribuição para o OGL.
Isso está representado como o OGL(3)
OGL (3)
BH
3-Noticed that in the LGO2, we have 1 nodal plane which is the horizontal line between the positive charge and negative charge.
-Therefore, the LGO3 (doubly degenerate with e') would also 1 nodal plane and its wavefunction would be Ψ(e') = 1/√2 (Ψ2-Ψ3). The shape of the LGO3 is
https://chem.libretexts.org/Textbook_Maps/Inorganic_Chemistry_Textbook_Maps/Map%3A_Inorganic_Chemistry_(Housecroft)/05%3A_Bonding_in_polyatomic_mol ecules/5.5%3A_MO_Theory_Applied_to_Polyatomic_Molecules_%5C(BH_3%5C)%2C_%5C(NH_3%5C)%2C_and_%5C(CH_4%5C)/5.5A%3A_%5C(BH_3%5C)
LGO (3)
OGL (3)
OGL (2)
O orbital 2pz, no átomo de B tem simetria a2"
e não se pode encontrar qualquer
combinação de simetria com um OGL do fragmento H3
Assim, o orbital 2pz, é não ligante no BH3.
A abordagem OM descreve a ligação no BH3
em termos de três OM de simetrias a1' e e'.
O orbital a1' possui caráter ligante e está
delocalizado sobre todos os quatro átomos.
Os orbitais e' também exibem caráter delocalizado, e a ligação no BH3 é descrita
considerando-se uma combinação de todos os três OM ligantes.
O diagrama OM para o BH3, pode agora ser construído
permitindo-se que os orbitais de mesma simetria interajam.
3
2
BH
3A molécula de NH3 tem simetria C3v e pode ser derivado um esquema de ligação considerando-se a interação entre os OA do átomo de N e os OGL de um fragmento H3 apropriado.
Um conjunto apropriado de eixos tem o eixo z coincidente com o eixo C3 do NH3
Os eixos x e y são direcionados conforme mostrado
ao lado
v
v
vC
3NH
3NH
3NH
3Olhando-se como cada operação de simetria afeta cada orbital do átomo de N do NH3, as simetrias dos orbitais são identificadas da seguinte maneira:
-cada um dos orbitais 2s e 2pz tem simetria a1; -os orbitais 2px e 2py são degenerados e o conjunto de orbitais tem simetria e.
v
v
vC
3NH
3Para determinar a natureza dos orbitais de grupo ligantes, consideramos quantos orbitais 1s do H são deixados inalterados por cada operação de simetria no grupo C3v.
O resultado é representado pela linha de caracteres:
v
v
vC
3NH
3NH
3Os três OGL têm simetrias a1 e e.
Embora os símbolos de simetria dos OGL dos fragmentos H3 no NH3 e BH3 difiram (as moléculas pertencem a diferentes grupos de pontos), as funções de onda
Os três OGL têm simetrias a1 e e.
Embora os símbolos de simetria dos OGL dos fragmentos H3 no NH3 e BH3 difiram (as moléculas pertencem a diferentes grupos de pontos), as funções de onda
ERRO: invertidos aqui na 2ª Ed. do Inorg. Chem, C. Housecroft
Os três OGL têm simetrias a1 e e.
Embora os símbolos de simetria dos OGL dos fragmentos H3 no NH3 e BH3 difiram (as moléculas pertencem a diferentes grupos de pontos), as funções de onda
normalizadas para os OGL são as mesmas.
Um dos OM e
HOMO (a1)
OM a1 de E mais baixa
OM gerados com Spartan 04©Wavefunction Inc. 2003
NH
3O diagrama OM é qualitativo
e construído permitindo-se
interações entre orbitais com as mesmas simetrias.
Como os orbitais 2s e 2pz do nitrogênio têm simetria a1 eles podem interagir com o OGL a1, formando três OM a1.
Em termos de simetria, o OM
a1 de mais baixa E também poderia conter o caráter 2pz
do N, mas a separação de E dos OA 2s e 2p é tal que o caráter 2s predomina. Isto é
análogo ao caso para a H2O
descrito anteriormente.
NH
3NH
3Após construir o
diagrama OM, os oito elétrons de valência são colocados nos OM em conformidade com o
princípio de aufbau.
Os caracteres de três dos orbitais ocupados são
mostrados no lado direito.
O orbital (a1) de mais baixa E tem caráter
ligante N- H
deslocalizado.
O OM de mais alta E
ocupado (HOMO) tem
algum caráter ligante N- H, mas retém um lóbulo de orbital apontando
A molécula de CH4 tem simetria Td
A relação entre um tetraedro e um cubo é vista
formalmente pelo fato de o grupo de pontos Td pertencer a uma família de grupo de pontos cúbico.
Tal família inclui os grupos de pontos Td e Oh.
A tabela mostra parte da tabela de caracteres de Td.
Os eixos C3 no CH4 coincidem com as ligações C-H e os eixos C2 e S4 coincidem com os eixos x, y e z definidos ao lado.
CH
4Segundo a simetria Td , os orbitais do átomo de C do CH4 são classificados como segue:
-o orbital 2s tem simetria a1
-os orbitais 2px, 2py e 2p, são degenerados e o conjunto de orbitais tem simetria t2.
Para construir os OGL do fragmento H4 no CH4 , começamos calculando o
número de orbitais ls do H deixados inalterados por cada operação de simetria do grupo de pontos .
O resultado é resumido na linha de caracteres:
2 = duas ligações inalteradas
0 = sem ligações inalteradas (todas se alteraram)
Para GLO =em C2v vimos
Resulta esta mesma linha de caracteres quando é feito o somatório das linhas de caracteres para as representações A1 e T2 na tabela de caracteres de Td.
Portanto, os quatro orbitais de grupo ligantes têm simetrias a1 e t2; o símbolo t
designa um conjunto triplamente degenerado de orbitais.
As funções de onda normalizadas para esses OGL são dadas abaixo
OA 2s, 2px 2pye 2pz do C
4 OA 1s do H
OA 2s, 2px 2pye 2pz do C
4 OA 1s do H
combinam-se gerando 4 OGL
Por comparação as simetrias dos OA 2s, 2px, 2py e 2pz do C podem ser combinadas facilmente com as simetrias dos 4 OGL do H
Td
OM ligantes triplamente degenerados (t2)
OM ligante (a1)
Td
OM ligantes triplamente degenerados (t2)
OM ligante (a1)
BH3
CH4
NH3
Uma comparação dos modelos de ligação OM e LV
Teoria da Ligação de Valência: para descrever a ligação usa esquemas de hibridização adequados de forma que as ligações conhecidas como
estruturalmente equivalentes fiquem equivalentes no esquema de ligação. Portanto, pela TLV todas as ligações são equivalentes
Um orbital híbrido contribui para cada ligação X-H localizada (X = B, C ou N).
BH3
CH4
NH3
Teoria do Orbital Molecular indica que o caráter ligante é delocalizado.
Além disso, existem no BH3, NH3 e no CH4 dois tipos
diferentes de OM ligante: um OM único envolvendo o orbital atômico 2s do átomo central, e um conjunto
degenerado de dois (no BH3 e NH3) ou três (no CH4) OM envolvendo os orbitais 2p do átomo central.
Como as ligações podem ser idênticas (mostrado por RMN 1H, IV ?
BH3
CH4
NH3
A evidência para esses ordenamentos dos OM vem da
espectroscopia de fotoelétrons
Como os resultados da teoria OM podem responder pela equivalência experimentalmente observada das ligações
X- H em uma dada molécula?
Vamos usar o CH4 para explicar...
Uma comparação dos modelos de ligação OM e LV
CH4
Espectro fotoeletrônico do CH4
Brundle, C.R.; Robin, M.B.
J. Chem. Phys. 1970 , 53, 2196.
a1
t2
Na teoria OM, a ligação em uma molécula é
descrita pela combinação dos caracteres de todos
os OM ocupados que têm caráter ligante.
O orbital a1 é esfericamente simétrico e oferece igual caráter ligante em todas as quatro interações C-H.
Os orbitais t2 devem ser considerados um conjunto e não orbitais individuais.
Tomados juntos, esse conjunto de orbitais oferece uma imagem de quatro interações ligantes C- H equivalentes e, portanto, o quadro global é de equivalência de ligação C-H.
March's Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, 7th Edition (2013), Localized Chemical Bonding, Photoelectron Spectroscopy, em
CH4
a1
t2
Na teoria OM, a ligação em uma molécula é
descrita pela combinação dos caracteres de todos os OM ocupados que têm caráter ligante.
O orbital a1 é esfericamente simétrico e oferece igual caráter ligante em todas as quatro interações C-H.
Os orbitais t2 devem ser considerados um conjunto e não orbitais individuais.
Tomados juntos, esse conjunto de orbitais oferece uma imagem de quatro interações ligantes C- H equivalentes e, portanto, o quadro global é de equivalência de ligação C-H.
(
t
2)
(
a
1)
a1
CH4
a1
t2
O espectro fotoelétrico de CH4 mostra duas bandas (20-23 eV e 14 eV), e não a única banda esperada da equivalência das quatro ligações C-H.
Na verdade o espectro fotoeletrônico e a TOM apenas sugerem que o C usa os orbitais disponíveis para formar quatro ligações e os elétrons nas
ligações são distribuídos entre o carbono e os quatro átomos envolvidos nas ligações
(
t
2)
(
a
1)
Teoria do orbital molecular: as análises das ligações logo se tornam complicadas
Embora o BF3 seja uma molécula bastante simples, a discussão a seguir
demonstra a complexidade do tratamento quando a base de OA de cada átomo contém orbitais s e p.
A molécula de BF3 tem simetria D3h
O eixo z é definido para coincidir com o eixo C3 e a molécula localiza-se no plano xy
Assim como no BH3, aos OA do B no BF3 são atribuídas as seguintes simetrias:
BF
3 Uso dos orbitais p do Fluor no BF3 leva a uma maiorcomplexidade quando comparado ao BH3
-orbital 2s tem simetria a1'
-o orbital 2pz tem simetria a2"
-os orbitais 2px e 2py são degenerados com simetria e'
Acima estão as representações dos OGL para um fragmento D3h de F3 cuja geometria é análoga à do BF3.
Triângulo de F3 localiza-se no plano xy.
OGL(5), OGL(8) e OGL(9) contêm contribuições dos OA 2pz dirigidos perpendicularmente ao triângulo de F3.
Os tamanhos relativos dos lóbulos de cada representam as contribuições relativas dos OA de cada F aos respectivos OGL. C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
OGL envolvendo os orbitais 2s do F no BF3 e que têm simetrias a1 e e' podem ser derivados da mesma maneira que para o fragmento H3 no BH3.
Eles são mostrados como OGL(1)-OGL(3)
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
Os orbitais p nos átomos de F podem ser divididos em dois tipos: os que se localizam no plano da molécula (2px e 2py) e os perpendiculares ao plano (2pz).
Os OGL podem ser formados de combinações de orbitais 2pz e de combinações dos
orbitais 2p no plano.
Em primeiro lugar, vamos considerar os orbitais 2pz.
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
O procedimento para derivar as funções de onda que descrevem os OGL permitidos dentro do grupo de pontos D3h é o mesmo que utilizamos antes, mas há uma
importante diferença:
Quando consideramos como um orbital 2pz é alterado por uma operação de
simetria, temos que procurar não apenas pelo orbital sendo transformado para outra posição, mas também por uma mudança da fase.
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
Se um orbital pz, é
perpendicular a um
plano h, a reflexão
através do plano mudará sua fase, mas sua
posição permanecerá a
mesma.
hp
zC. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
BF
3Isto é exemplificado quando calculamos
quantos orbitais 2pz do F ficam inalterados por cada operação de
simetria no grupo de pontos D3h.
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
BF
3
hA linha de caracteres vista a seguir resume o resultado.
Um sinal negativo significa que o orbital está na mesma posição, mas sua fase mudou.
hp
zC3 3 = 3 orbitais ficam inalterados pela operação
1 = 1 orbital ficou inalterado pela operação
1 = 1 orbital ficou inalterado pela operação, mas mudou o sinal 0 = nenhum orbital é inalterado pela operação (todos se alteram)
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
3 - 3 orbitais ficam inalterados pela operação 1 - 1 orbital ficou inalterado pela operação
-1 - 1 orbital ficou inalterado pela operação, mas mudou o sinal 0 - nenhum orbital é inalterado pela operação (todos se alteram)
0 - uma entrada diferente de zero somente se o orbital(is) não muda(m) de posição. 0 - qualquer orbital que mude de posição durante a operação de simetria
1 - qualquer orbital que permaneça na posição original (como um orbital p que mantém sua
G. Miesler, P. Fischer, D. Tarr, Química Inorgânica, 5ª Ed.
C. Housecroft e A. G. Sharpe, Quimica Inorgâanica, 4ª Ed.
posição e direção (sinais de seus lóbulos)
-1 - qualquer orbital que permaneça na posição original com os sinais de seus lóbulos invertidos
Esta linha de caracteres também é produzida pela soma das linhas de caracteres para as representações A2" e E" na tabela de caracteres de D3h
Portanto, os OGL são de simetrias a2" e e".
Considerando os efeitos de cada operação em um dos orbitais 2pxz, do F no fragmento F3, podemos (como anteriormente) chegar a uma equação da função de onda não
normalizada de cada OGL.
Considere que os três orbitais 2pz do F sejam 1 2 3 e geramos a seguinte linha de caracteres
Considere que os três orbitais 2p, do F sejam
1
2
3 e geramos a seguinte linha de caracteres incluindo um sinal negativo sempre que a operação produz uma mudançade fase orbital
p
zC3
2
3
1
h
2
3
1A multiplicação de cada caractere dessa linha pelo caractere correspondente na linha para a representação A2" na tabela de caracteres de D3h dá a forma não normalizada da função de onda para o OGL a2"
A simplificação e a normalização fornecem a equação:
Assim, o OGL a2" pode ser descrito como uma
combinação em fase de orbitais 2pz, e é
mostrado na forma do OGL(5).
De modo semelhante, podem ser deduzidas as equações para os orbitais e
OGL(8)
BF
3Pode ser utilizado o mesmo procedimento para derivar o fato de os orbitais 2p do F no
plano se combinarem dando OGL(4) e OGL(10) com simetrias a1 e a2 respectivamente...
...e dois conjuntos de OGL e, indicados como OGL(6), OGL(7) e OGL(11) e OGL (12).
D3h
Agora estamos em posição de
construir um diagrama OM
qualitativo para descrever a ligação no BF3.
As simetrias dos orbitais do B
pertencentes ao grupo D3h são dadas do lado esquerdo da figura e as dos
OGL foram7 são mostradas
anteriormente.
O problema é considerado em três etapas:
• procure interações de orbitais que deem origem a OM
• procure interações de orbitais que deem origem a orbitais
• procure qualquer orbital que tenha uma simetria que impede interações
de orbitais entre fragmentos.
A ligação no BF3 surge das
interações que envolvem os orbitais a1' e e' do fragmento.
Existem dois OGL do fragmento F3
com simetria a1 e três conjuntos
de orbitais e'.
A extensão da mistura entre orbitais
do fragmento de mesma simetria
depende das suas energias relativas, e é impossível prever com qualquer grau de confiabilidade.
D3h
BH
3BF
3BH
3BF
3Podemos supor uma imagem da ligação que imita a do BH3.
O OM do BH3 (direita) envolve o OGL(1) na formação dos OM a1' e a1'* simbolizados na
figura da direita (BF3), mas deixa o OGL(4) como um orbital não ligante.
Esse modelo pode ser refinado permitindo-se de que parte do caráter do OGL(4) seja misturado nos OM a1' e a1'* com caráter ligante ou antiligante B- F.
BH
3BF
3De modo semelhante, poderíamos permitir que
contribuições vindas dos OM e' do fragmento
contendo caráter 2px e 2py do F se misturassem nos
OM e' e e'* com caráter ligante ou antiligante B- F.
No mais simples dos quadros de ligação, esses OM contêm caráter 2s do F, e os OGL (6), (7), (11) e (12)
BH
3BF
3Avaliar a extensão da mistura de orbitais é difícil, se não impossível, em um nível qualitativo.
BH
3BF
3A simetria a2" do orbital 2pz do B combina-se com a do
BH
3BF
3Os únicos orbitais no fragmento F3 para os quais não há nenhuma combinação de simetria no
átomo de B são aqueles com simetrias e" e a2'
(ou seja, OGL 8, 9 e 10).
OM a1
OM a2
OM e D3h
Segue acima a imagem global de ligação para o BF3
Há quatro OM ligantes, quatro OM antiligantes e oito OM não ligantes.
OM a1
OM a2
OM e D3h
Trata-se de uma imagem simples da ligação que não permite mistura de orbitais.
No entanto, ela oferece uma descrição que inclui o caráter parcial em cada ligação B-F, sendo, portanto, consistente com o tratamento LV
OA 2p ocupado no F
D3h
Trata-se de uma imagem simples da ligação que não permite mistura de orbitais.
No entanto, ela oferece uma descrição que inclui o caráter parcial em cada ligação B-F, sendo, portanto, consistente com o tratamento LV
OA 2p ocupado no F
Teoria do orbital molecular: aprendendo a usar a teoria objetivamente
Vamos mostrar maneiras objetivas de utilizar o modelo OM para explicar aspectos particulares a respeito de
uma molécula.
Isto frequentemente envolve o desenho de um diagrama OM parcial para a molécula em questão.
Temos que considerar as implicações desse tratamento parcial: pode ser perigoso porque os aspectos de ligação, a não ser aqueles sobre os quais se está concentrado, são
ignorados.
Ligação
no CO
2Para desenvolver uma descrição OM da ligação no CO2 temos que considerar que orbitais de valência não podem ser usados após a ligação .
A molécula de CO2 pertence ao grupo de pontos Dh.
O eixo z é definido para coincidir com o eixo C.
eixo z
Ligação
no CO
2Pode ser desenvolvida uma imagem semelhante a
molécula XH2 para a ligação
no CO2,
A diferença é que os orbitais 1s do H
em XH2 são substituídos pelos orbitais
2s e 2pz do O no CO2.
A sobreposição deles com os orbitais
2s e 2pz, do C leva à formação de seis OM com simetria g ou u, quatro ocupados e dois desocupados.
Ligação
no CO
2Uma combinação em fase de orbitais 2p é não centrossimétrica e tem simetria u ,
enquanto uma combinação fora de fase é centrossimétrica e tem simetria g.
Somente os OGL u têm a simetria correta para interagir com os orbitais 2px e 2py do C, deixando os OGL g como OM não ligantes no CO2.
Após a formação de interações C O, os
orbitais restantes são os orbitais 2px e 2py
do C e do O.
Agora usamos a abordagem
dos OGL para descrever a
ligação em termos das
interações entre os orbitais
2px e 2py do C e os OGL
(derivados dos orbitais 2px e
2py do O) de um fragmento
O----O.
Ligação
no CO
2Após preencher os OM ligantes de mais baixa E, há oito elétrons
restantes que ocupam os OM u e g.
Para cada conjunto degenerado de OM, o caráter do segundo OM u é o mesmo que o primeiro, mas é ortogonal em relação a ele.
Cada OM u tem caráter de ligação O- C-O delocalizada, e o resultado líquido de ter ambos os orbitais u ocupados é uma ordem de ligação u de 1 por interação CO.
[NO3]
Pela Teoria de Ligação de Valência (TLV) são necessárias três estruturas
de ressonância para levar em conta a equivalência das ligações N-O
A ordem de ligação líquida por ligação N-O é 1,33.
A teoria do OM nos permite
representar o sistema N-O em termos de interações delocalizadas.
Interação ligante NO
Orbital híbrido sp2 no
[NO3]
Tem simetria D3h e o eixo z é definido para coincidir com o eixo C3.
Os orbitais de valência de cada átomo de N e O são orbitais 2s e 2p.
A ligação pode ser descrita em termos das interações do orbital 2pz do N com os OGL apropriados do fragmento O3
Interação ligante NO
Orbital híbrido sp2 no
[NO
3]
No grupo pontual D3h o orbital 2pz do N tem uma simetria a2“
Os OGL que podem ser construídos a partir dos
orbitais 2pz do O são mostrados ao lado juntamente com suas simetrias
O método de derivação é
idêntico àquele para os
OGL correspondentes
para o fragmento F3 no BF3
D3h
x y
[NO
3]
O diagrama parcial de
OM pode ser construído por coincidência de
simetrias dos orbitais.
Os OM resultantes têm caráter ligante (a2"), não ligante (e") e anti-ligante (a2"*)
OM a2"*
OM a2" mostrando a deslocalização do caráter