! ! UNIVERSIDADEDELISBOA FACULDADEDEFARMÁCIA
!
!
"#$%$&'!(')&*+,&+'!)%*-.&+'!,-!
&/(,-"&."+,-*&!/%")&$!/-!01,".(&'!!
!
!
!"#"$%&"'("$%"'(%)*+',-'.+/0"'
!
!
*(').&/-!+,)(2.&/-!(*!"+3,"+&'!4&.*&"3%)+"&'! ' ' ' 56789567:! !%,+;(.'+/&/(!/(!$+'<-&! ! 4&"%$/&/(!/(!4&.*="+&!! !
!
!
!
"#$%$&'!(')&*+,&+'!)%*-.&+'!,-!
&/(,-"&."+,-*&!/%")&$!/-!01,".(&'!!
!
!"#"$%&"'("$%"'(%)*+',-'.+/0"'
!
1$%-&#",+$"2'3$+4-00+$"'5+/#+$"'6&"'7%#"'!+&,-! ! ! *(').&/-!+,)(2.&/-!(*!"+3,"+&'!4&.*&"3%)+"&'! ' ' 56789567:! ! !Resumo
O cancro do pâncreas, entre os cancros mais comuns é aquele que apresenta maior taxa de mortalidade. Estima-se que em 2014 provoque na UE, 41 300 mortes entre o sexo masculino e 41 000 no sexo feminino.
Nos últimos anos, vários estudos têm mostrado que as Células Estaminais Tumorais (CETs) pancreáticas têm um papel fundamental no desenvolvimento e progressão deste tipo de cancro.
Nesta monografia, pretende-se analisar as principais características destas células e de que forma estão implicadas no desenvolvimento e progressão desta doença. Para além disso, a análise etiológica desta patologia é crucial para o desenvolvimento de novas estratégias de prevenção, detecção e diagnóstico mais eficazes, o que também é discutido ao longo deste trablho.
As opções terapêuticas não têm mudado muito nas últimas décadas e a alterativa passa pela detecção precoce e prevenção da doença. Por isso é muito importante não só perceber que barreiras estão a limitar o avanço terapêutico bem como a identificação de marcadores e a realização de novos testes genéticos que permitam o desenvolvimento de novas opções terapêuticas.
Palavras-chave: Cancro, Pâncreas, Cancro do Pâncreas, Célula Estaminal Tumoral, Células Estaminal Tumoral Pancreática, Heterogeneidade Celular, Modelo de Células Estaminais Tumorais, Modelo Estocástico.
Abstract
Pancreatic cancer is amongst the most common cancers and the one that has the highest mortality rate. It is estimated that in 2014 in the EU, it can cause 41300 deaths among the male gender and 41000 among the female gender.
In the last years, several investigations concluded that pancreatic Tumor Stem Cells have been the key to developing and progressing in this type of cancer.
This monograph is intended to analyze the main characteristics of the cell and the way it works in the development and progress of this disease. Furthermore, the etiological analyze of this disease is very important to the development of new and more effective strategies for prevention, detection, diagnosis and more effective, which is also discussed in this presentation.
Therapeutic options haven't changed much in the last decades and the alternative go through early detection and the prevention of disease. So it's very important not only to understand that barriers are limiting therapeutic advances, but that the identification of markers and the realization of new genetic tests allow the development of new therapeutic options.
Key-words: Cancer, Pancreas, Pancreatic cancer, Cancer Stem Cell, Pancreatic Cancer Stem Cell, Cell Heterogeneity, Cancer Stem Cells Model, Sthocastic Model.
Índice
1. Introdução………..…....1
1.1. O Cancro – Contextualização………..…..1
1.1.1. Processo Carcinogénico – Crescimento e Regulação Celulares...3
2. Cancro do Pâncreas……….…………...……..8
2.1 Biologia da Doença……….…...11
2.1.1. Células Estreladas do Pâncreas………...14
2.2 Apresentação Clínica, Diagnóstico e Prevenção da Doença…………...15
3. Células Estaminais Tumorais………...18
3.1 Origem das CETs……….….………18
3.2 Marcadores Celulares das CETs………..……….20
3.3 Xenotransplantes (PDX)………...21
3.4 Células Estaminais Tumorais Envolvidas no Processo de Metastização….22 4. Células Estaminais Tumorais Pancreáticas………..25
4.1 Heterogeneidade das Células Pancreáticas e Marcadores das CETs..……..27
4.2 Células Estaminais Tumorais Pancreáticas e o Prognóstico da Doença…...29
5. Terapêutica Usada Actualmente……….………..30
5.1 Barreiras ao Tratamento………...31
5.2 Células Estaminais Tumorais Pancreáticas - Implicações no Tratamento....33
5.3 Células Estaminais Tumorais e Células EMT como Alvos Terapêuticos no Cancro do Pâncreas……….34
7. Conclusão………...35
! "!
1. Introdução
!
1.1 O Cancro – Contextualização
O cancro representa uma complexa família de doenças e resulta da ocorrência de falhas nos mecanismos que controlam o crescimento e proliferação celulares. Sendo assim, surgem células cancerígenas a partir de células normais, que proliferam de forma descontrolada podendo aparecer em qualquer idade. A rapidez com que a célula cancerígena se divide constituí uma das suas principais características. (1,2)
Na maior parte dos cancros a etiologia não está bem definida, mas sabe-se que o desenvolvimento da doença é influenciado por factores externos e internos. Os tipos de tumores podem dividir em tumores benignos ou malignos e tanto os malignos como os benignos são classificados consuante o tipo de célula que lhe deu origem. Podem ser divididos em três grupos principais: carcinomas que representam cerca de 90% dos tumores e têm origem em células epiteliais; sarcomas que têm origem no tecido conjuntivo e são raros; e finalmente as leucemias/linfomas que têm origem nas células sanguíneas e que representam cerca de 7% dos tumores que surgem no ser humano. Dentro de todos os tumores já documentados os mais comuns são o cancro da próstata, pulmão e cólon/recto, sendo o do pulmão o que apresenta maior taxa de mortalidade. (1)
Os tumores benignos caracterizam-se por um crescimento lento e ocupam uma área bem definida, não atingindo outros tecidos. Por outro lado os tumores malignos têm um crescimento irregular e invadem células adjacentes, chegando a outros tecidos do organismo, processo esse denominado metastização. (1,3)
! #! Embora em alguns casos não se consiga perceber a causa que originou a doença, vários estudos ao longo dos anos mostraram que há determinados factores que aumentam o risco de desenvolver esta doença. Sendo assim, de uma forma geral os factores de risco mais comuns são: (4,5)
• Infecções – certas viroses e infecções representam a causa mais comum para o aparecimento de muitos casos de cancro, principalmente nos países em desenvolvimento. Como por exemplo: Hepatite B e C, vírus de Epstein-Barr, Helicobacter pylori e o Vírus do papiloma Humano.
• Radiação UV e Ionizante - Existem dois tipos de radiação envolvidas no aumento do risco de cancro. A radiação UV proveniente do sol, é a principal ceusa de cancro da pele. A radiação ionizante inclui por exemplo, a radiação de origem médica, usada para vários testes de diagnóstico.
• Consumo de tabaco – o consumo de tabaco é a causa de cerca de 30% das mortes por cancro no EUA. Este factor de risco é a causa para diferentes tipos de cancro, como por exemplo o cancro do pâncreas. • Medicina Imunossupressora – Este tipo de intervenção é feita, por
exemplo, quando se procede a um transplante, para não haver a rejeição do órgão transplantado e que pode constituir também um factor de risco para o desenvolvimento desta doença.
• Para além disso uma dieta pobre, falta de exercício físico, a obesidade, o envelhecimento e a exposição a certos produtos químicos, representam factores de risco importantes nesta doença.
! $! Muitos destes factores de risco podem ser evitados e por isso é muito importante apostar na prevenção. Por outro lado outros factores que têm um histórico familiar inerente e não permitem aos indivíduos apostar na prevenção. (4,5)
Muitos dos cancros surgem por mutações no genoma do indivíduo e o aparecimento de células cancerígenas ocorre após a acumulação de várias mutações. (4) Sendo assim, é importante aprofundar e perceber melhor todo o processo carcinogénico, de crescimento e regulação celular.
1.1.1 Processo Carcinogénico – Crescimento e Regulação Celulares
A célula representa a unidade fundamental da vida graças à capacidade que as células têm de crescer e de se reproduzir. O ser humano é um organismo multicelular e por isso apresenta uma enorme variedade de células que se relacionam entre si. As células apresentam-se sobre diferentes formas/tamanhos e para além dessas diferenças morfológicas, distiguem-se também pela sua organização e constituição interna, que detemina a actividade metabólica que desempenham. (1,3)
O processo de diferenciação celular começa sobre a forma de zigoto, a partir do qual surgem centenas de células que se vão diferenciando e adquirindo funções específicas no organismo. As células organizam-se em tecidos, órgãos e membros e durante este processo as células adquirem funções específicas, produzindo proteinas específicas e essenciais para o desempenho de determinada função, ou seja ocorre uma expressão genética diferencial. (1,2,3) Á medida que ocorre o processo de desenvolvimento do organismo humano existem mecanismos de reparação e
! %! regulação celular que permitem por exemplo a regeneração de determinado tecido ou órgão. (2,5)
O processo carcinogénico é o processo que transforma uma célula normal numa célula neoplásica e começa exactamente quando há perda da regulação celular. As células alvo deste processo são, em regra, as células progenitoras de determinado tecido. Este processo não ocorre num só passo, requer a acumulação de alterações sucessivas que conferem vantagem selectiva à célula neoplásica, adquirindo a capacidade de se multiplicar de forma autónoma e descontrolada. Na maioria das neoplasias malignas é possível identificar quatro fases de desenvolvimento: (2,5)
1- Transformação: Processo que conduz à formação de uma neoplasia a partir de células normais e que requer a acção de agentes mutagénicos. É um processo relactivamente longo, na maioria dos casos, que implica a aquisição de um número variável de alterações genéticas, que conferem vantagem selectiva às células neoplásicas. 2- Crescimento: Sabe-se que a massa tumoral mínima detectável pesa
1g e contém cerca de 109 células neoplásicas, resultando em cerca de 30 ciclos de duplicação da população celular. Para atingir o limite máximo de massa compatível com a vida bastarão apenas 10 ciclos de duplicação adicionais.
A taxa de crescimento tumoral depende: do tempo de duplicação celular, da fracção de células neoplásicas no compartimento replicativo e da taxa de eliminação e morte celulares. Todos estes factores influenciam a velocidade de crescimento da massa tumoral e a sua sensibilidade a agentes quimioterapêuticos. Os tumores com
! &! elevada taxa de proliferação tendem a ser mais quimiossensíveis pois os agentes quimioterapêuticos agem predominamtemente nas céluas em divisão celular activa.
3- Invasão local: As neoplasias benignas crescem numa capsúla conjuntiva e não infiltram tecidos adjacentes. Contrariamente a estas, as neoplasias malignas invadem e destroem tecidos adjacentes. As neoplasias estimulam o crescimento de vasos sanguíneos que são essenciais para a nutrição das células neoplásicas, processo denominado angiogénese. Este processo ocorre pelo recrutamento de precursores de células endoteliais e a partir do crescimento de capilares pré-existentes. Os vasos neoformados são diferentes dos normais apresentando-se mais irregulares e com maior tortuosidade, têm maior permeablidade e apresentam um crescimento contínuo. A neovascularização tem um efeito duplo na neoplasia, por um lado a perfusão fornece nutrientes indispensáveis ao crescimento tumoral e por outro, as células endoteliais neoformadas estimulam o crescimento do tumor adjacente através da secreção de factores de crescimento. Este processo só começa quando há um predomínio de factores pró-angiogénicos (VEGF, HIF-1) sobre os antipró-angiogénicos (trombospodina 1), eventualmente mediado pela inactivação do gene TP53
4- Metastização: Salvo raras excepções como por exemplo gliomas, todas as neoplasias malignas possuem a capacidade de metastizar. Normalmente, a metastização está directamente relacionada com a
! '! capacidade de proliferação celular da neoplasia. Existem várias vias de disseminação que vão variando consoante o tipo de neoplasia.
Na grande maioria dos casos, estas alterações celulares resultam da acumulação de mutações em dois grandes grupos de genes: proto-oncogenese genes supressores de tumores.
Os proto-oncogenes codificam proteínas oncogénicas e funcionam como elementos das vias de sinalização, influenciando a proliferação e diferenciação celular.es Uma vez mutados, estes genes originam proteínas oncogénicas que funcionam como elementos de sinalização estimulando a diferenciação celular. (1,3)
Os genes supressores de tumores inibem a acção de genes que estimulam a proliferação celular, suprimindo o desenvolvimento tumoral, por exemplo, a proteína plasmática p53 que induz a apoptose. (1,3)
A mutação desses genes resulta da exposição descontrolada a agentes carcnogénios de origem química, física ou biológica. A interação entre estes factores e factores genéticos leva à alteração de determinadas características celulares: (1,4,5)
• Auto-suficiência em sinais de crescimentos
• Insensibilidade a factores inibidores do crescimento • Evasão da apoptose
• Potencial replicativo ilimitado • Invasão dos tecidos e metastização • Angiogénese continua e sustentada
O processo carcinogénico resulta da acumulação progressiva de alterações celulares, às quais chamamos tumor. Nalguns casos, pode ocorrer o processo de
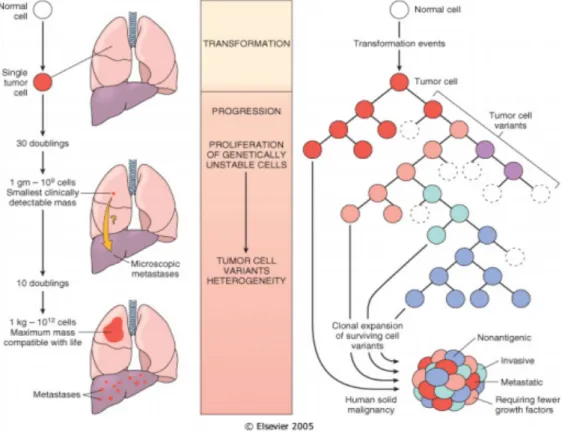
! (! metastização, ou seja a formação de um tumor secundário a partir do tumor primário. Esta invasão tecidular não é aleatória e normalmente à medida que o tumor se desenvolve vai ficando cada vez mais apto a invadir novos tecidos. (figura 1) (3)
O sistema imunitário detecta e destroi células neoplásicas na sua fase inicial de desenvolvimento, sendo assim o desenvolvimento de uma neoplasia resulta da diminuição da função do sistema imunitário, aumentando a capacidade da célula neoplásica de escapar a esta vigilância. (2)
! !
! ! !
Figura 1 – Processo de transformação de uma célula normal em células neoplásicas. Evolução do tumor e o seu ciclo de crescimento.
! )! !
2. Cancro do Pâncreas
O pâncreas é um órgão abdominal, localizado atrás do estômago e que representa uma das principais glândulas do corpo humano. É composta por tecido endócrino e exócrino, secretando substâncias que fluem para o duodeno através dos ductos. Estas duas funções são asseguradas por populações de células diferentes. (6,7)
A porção exócrina, que constitui cerca de 90% do órgão e é composta por células acinares, está envolvida na função gastrointestinal através da secreção não só de enzimas digestivas (desempenham funções na digestão dos principais grupos de alimentos), como também de um líquido rico em iões bicarbonato (neutraliza o quimo que entra no intestino delgado proveniente do estômago). (6,7)
O pâncreas endócrino é responsável pela produção de hormonas e constituído por ilhas de células especializadas conhecidas como ilhéus de Langerhans, cuja função é regular os níveis de glicémia no sangue. (6,7)
O cancro do pâncreas representa a quarta maior causa de morte nos USA cerca de 95% dos cancros detectados são classificados como Adenocarcinoma Ductal do Pâncreas (PDAC). (8,9) O PDAC constitui assim a forma mais comum deste tipo de cancro, apresentando uma forte componente fibrótica. (10) Actualmente, esta doença é mais comum em idosos que em indivíduos mais jovens e quando é feito o diagnóstico já se encontra num estadio muito avançado, apresentando uma elevada taxa de infiltração e metastização. (8,9).
Ao contrário do que acontece com outros tipos de cancro, a incidência de PDAC está a aumentar e estima-se que em 2030 a percentagem de mortes provocadas por esta doença duplique. Nesta altura esta doença representará a segunda maior causa
! *! de morte por cancro nos USA. O PDAC é o único, entre os cancros mais comuns, no qual se prevê um aumento da taxa de morte. (8)
As causas que estão na origem desta doença ainda não estão completamente esclarecidas, no entanto sabe-se que existem factores risco implicados no desenvolvimento da doença. De entre as possíveis causas apontadas o único factor que demontra evidências comprovadas é o tabaco. Indivíduos fumadores têm um risco 2,5 a 3,6 vezes superior para desenvolver a doença face a indivíduos não fumadores. (11)
Para além deste existem, como foi referido, outros indicadores que podem estar associados ao desenvolvimento da doença tais como: (8,9)
- Consumo de álcool, café e carnes vermelhas; - Consumo de aspirina,
- Diabetes,
- Colesterol elevado, - Cirrose crónica.
Os dados estatísticos mostram que a maior parte dos doentes com PDAC são diabéticos e muitos deles só lhes é diagnosticada a doença um ano ou dois após o diagnóstico de cancro. Estes factos não tornam claro se a diabetes é um factor de risco para o desenvolvimento deste tipo de cancro ou se é um resultado da doença. (8,9).
Actualmente sabe-se que a pancreatite crónica contitui também um factor de risco importante para o desenvolvimento de cancro do pâncreas. Este factor torna-se mais evidente em casos de doentes que tenham histórico de tabagismo associado, ou então em doentes que apresentem pancreatite crónica hereditária, resultante de
! "+! mutações em alguns genes supressores de tumores como por exemplo: P16Ink4a/ CDKN2A, BRCA2, MLH1, MLH2, STH1 ou VHL. (8) O aparecimento de pancreatite crónica pode também resultar de episódios recorrentes de pancreatite aguda e por isso esta também constitui um factor de risco para o desenvolvimento de PDAC.(10)
Dados recentes mostram que indivíduos do grupo sanguíneo A, B ou AB têm maior risco de desenvolver a doença que indivíduos do grupo zero. Para além disso, o risco associado ao grupo sanguíneo B é superior ao risco associado ao grupo A ou AB. Esta relação não se verifica em todos os indivíduos que têm cancro do pâncreas. (16)
O diagnóstico tardio da doença resulta em maus prognósticos. Em mais de 80% dos casos torna-se impossível intervenção cirúrgica pela elevada metastização em que se encontra o tumor aquando do diagnóstico e/ou pela elevada irrigação do meio envolvente, o que faz com que os indivíduos apresentem 6 a 9 meses de esperança média de vida após o diagnóstico. (8,13) A elevada taxa de metastização é explicada pela localização anatómica do órgão em causa. O pâncreas encontra-se na parte superior do abdómen, perto de muitos órgãos vitais como o fígado, baço, estômago, intestino delgado e intestino grosso. A porção direita deste órgão abrange o ducto biliar comum, através do qual a bílis se junta ao suco pancreático e segue para o intestino delgado; portanto a obstrução deste canal pode ser um dos primeiros sinais de cancro no pâncreas.(7) Para além disso, este órgão está situado no retroperitoneu, que contém importantes vasos tal como a artéria mesentérica superior e outras veias o que significa que frequentemente este tumor invade estes vasos e metastiza para outras zonas do organismo. (7) Por tudo isto torna-se muito dificil operar este tipo de cancro, sendo possível apenas em 15% dos casos. (7,14)
! ""! O mau prognóstico para estes doentes está relacionado com a resistência à quimoterapia e radioterapia, devido à elevada metastização. (13)
O PDAC tem-se revelado nos últimos 30 anos, o cancro com menos avanços ciêntificos a nível terapêutico. Actualmente, os desafios e dificuldades passam pela descoberta de agentes que se mostrem efectivos no tratamento e que permitam desenvolver novas terapêuticas contra o PDAC, o que implica um conhecimento profundo da genética e biologia da doença.(8,13) Em suma, as razões que sustentam os dados estatísticos associados a morte por esta doença passam por desafios de diagnóstico e principalmente por opções terapêuticas muito limitadas. (11)
2.1 Biologia da Doença
O cancro do pâncreas resulta da acumulação sucessiva de mutações genéticas. (9) Estudos genéticos mostram que a activação oncogene KRAS2, nas células do ducto pancreático, podem estar na origem do processo neoplásico. (15) Para além disso, a inactivação do gene supressor de tumores CDKN2A e da proteína p53 também contibuem para o desenvolvimento da doença. Todas estas evidências são suportadas por estudos genéticos realizados em ratos. (9) A neoplasia intra-epitelial do pâncreas é um importante percursor histológico do adenocarcinoma ductal do pâncreas e, portanto, a prevenção destas lesões pode ser muito importante no aumento da esperança média de vida destes doentes, especialmente em idosos. (16)
Esta doença é caracterizada por uma intensa reacção desmoplásica (DR) que envolve as células malignas, portanto o microambiente que envolve o tumor condiciona o nível de agressividade da doença. A DR é composta por matriz
! "#! extracelular, proteinas, fibroblastos, células estreladas, células endoteliais, células do sistema imunitário e células nervosas. (13)
O estroma não é apenas uma barreira mecânica, ele constitui um compartimento dinâmico envolvido no processo cancerígeno. (9) As células tumorais do pâncreas estimulam as células estromais, que por sua vez estimulam o crescimento, metastização e resistência à terapêutica. (13) Portanto, percebendo de que forma como os componentes do estroma facilitam a invasão celular, é possível encontrar novos alvos terapêuticos e assim melhorar o tratamento. (14)
A angiogénese está correlacionada com um rápido crescimento do tumor e um mau prognóstico. Este processo começa com a estimulação quer de células epiteliais quer endoteliais e as células inflamatórias que representam um importante mediador. (14)
No processo carcinogénico o microambiente em que as células tumorais se encontram, caracteriza-se por um estado de hipóxia, provocado pela baixa perfusão do local.(figura 2) Esta condição faz com que as células tenham que se adaptar ao novo ambiente, através por exemplo da transcrição do gene HIF1-alpha. Valores elevados de expressão deste gene estão correlacionados com maus prognósticos. (13)
! "$! ,-./01!#!2!34565789:!;97:8-8/-785:!<9!;17;09!<9!=>7;051:?!3:81!<957@1!;101;850-A1B:5!=90!/61!545C1<1! ;96=45D-<1<5!.57E8-;1!5!=90!:50!6/-89!F58509.E751?!G:!;E4/41:!5:816-71-:!8/6901-:!05=05:57816!6579:! <5!&H!<1!=9=/41@I9!;54/410!<9!8/690!5!=9<56!:50!-<578-J-;1<1:!=90!610;1<905:!5:=5;KJ-;9:?!!3:81:!;E4/41:! :I9!05:-:85785:!19:!8018165789:!;97C57;-971-:?!L90!9/809!41<9!1:!;E4/41:!5:80541<1:!<9!=>7;051:!:I9!9! 54565789!;F1C5!<9!5:80961?!M*N!!
! "%! 2.1.1 Células Estreladas do Pâncreas
O adenocarcinoma ductal do pâncreas é uma doença muito agressiva e mortal. Na maioria dos casos o prognóstico revela-se difícil pela forte reação desmoplásica, que consiste na produção de tecido fibroso pelas células neoplásicas. (13) Esta reação é observada em muitos tumores e depende da secreção, pelas células tumorais, de factores hormonais que estimulem a proliferação celular conferindo consistência ao tumor. (17)
No pâncreas esta reacção desmoplásica é conduzida principalmente pelas células estreladas do pâncreas (PSCs), que estão presentes na porção exócrina desse órgão, constituindo cerca de 4% do total de células do órgão. (10,17) Estas células participam activamente no desenvolvimento biopatológico de doenças do pâncreas exócrino tal como: a pancreatite crónica e o cancro do pâncreas. No entanto, para que estas células se envolvam no desenvolvimento fisiopatológico da doença têm que ser activadas e passar ao estado miofibroblástico. (10) Para além do pâncreas, estas células também existem no fígado e participam no mecanismo da cirrose. (14)
Vários estudos mostraram que existem pontenciais activadores das PSCs, na consequência de lesões no pâncreas e são eles: citocinas (IL-1,IL-6,IL-8,TNF-alfa), factores de crescimento (PDGF e TNF-beta1), angiotensina II e várias espécias reactivas de oxigénio. Para além disto, também o stress oxidativo e metabolitos do etanol se mostraram pontenciais activadores.
Uma vez activadas estas células produzem por sua vez, citocinas, TGF- Beta1, PDGF e moléculas pré-inflamatórias como COX-2.
Como já foi referido, o adenocarcinoma ductal do pâncreas é o tipo de cancro do pâncreas mais comum e que se caracteriza pela produção de tecido fibroso; uma análise da expressão genética quer no adenocarcinoma do pâncreas quer na
! "&!
pancreatite crónica induzida pelo álcool, mostraram que ambas as patologias apresentam mecanismos semelhantes no desenvolvimento de tecido fibroso. (10)
As PSCs participam no desenvolvimento do adenocarcinoma e estabelecem relações de simbiose entre si, tal como é evidenciado na figura 5, inclusé promovem a angiogénese do tumor.
2.2 Apresentação Clínica, Diagnóstico e Prevenção da Doença
As manifestações clínicas da doença dependem da localização do tumor na glândula, bem como do estadio em que se encontra. A maioria dos tumores do pâncreas surge na cabeça da glândula ou são resultantes de uma obstrução colestática. Os sintomas frequentes são: naúseas, desconforto abdominal profundo, perda de peso (anorexia) e astenia. Em situações excepcionais, provoca obstrução duodenal ou, por vezes, surge sangramento ao nível gastro-intestinal. (15) Outras manifestações menos comuns incluem trombose venosa profunda e superficial, paniculite, alterações da função hepática, aumento da circunferência abdominal e depressão. Uma avaliação Figura 3– Efeito das PSCs na invasão das células tumorais e desmoplasia. (10)
! "'!
física do doente pode revelar icterícia, hepatomegália, ascite e linfoadenopatia periférica. Por outro lado, as análises de rotina realizadas ao sangue apresentam resultados muito pouco específicas mas podem revelar pequenas alterações a nível hepático, hiperglicémia e anemia. (9)
O cancro do pâncreas deve ser tido em conta aquando do diagnóstico de pancreatite aguda e na diabetes recém-diagnosticada. No caso de se suspeitar de cancro do pâncreas deve ser de imediato avaliado o estadío em que se encontra a doença, bem como os sintomas apresentados pelo doente. (9)
A imagiologia de alta qualidade tem tido um papel crucial no diagnóstico desta doença e tem contribuido para o aumento do número de casos diagnosticados. Na maior parte do pacientes um único corte de um plano transversal é suficiente para avaliar a ressecabilidade do tumor e fazer o diagnóstico e o potencial maligno, pode ser avaliado por endoscopia de ultra-sons, analisando por aspiração o líquido cístico. Caso seja necessário, antes de dar inicio à quimioterapia, este método é a melhor forma para se obter tecido para diagnóstico. (11)
A recorrência a ressonâncias magnéticas não acrescenta informação sobre a ressecabilidade do tumor. (11) A realização de biópsia percutânea pré-operatória em tumores pancreáticos que podem ser operados não é aconselhável, porque podem ser arrastadas células tumorais ao longo do trajecto que a agulha percorre. (11)
No que respeita à prevenção, ainda não existe nenhum painel de biomarcadores que preencha os requisitos de precisão exigidos. O método de endoscopia por ultra-sons tem tido alguns avanços nos últimos anos, o que o tornou um método mais específico e sensível. A avaliação de doentes considerados de
! "(! elevado risco, combinando a endoscopia de ultra-sons com a tomografia computorizada será utilizada em ensaios futuros. (11)
Nos últimos anos o tratamento associado aos diferentes estadios da doença tem sofrido alterações. A tabela 1 apresenta a última avaliação da “American Joint Comittee on Cancer”, dos diferentes estadios da doença bem como a sua ressecabilidade consuante o estadio em que se encontra.
O1P541!"!2!Q5=05:5781@I9!<9:!<-J505785:!5:81<-9:!<9!;17;09!<9!=>7;05:!<5!1;90<9! ;96!1!R48-61!1C14-1@I9!<1!SG650-;17!T9-78!U96-8855!97!U17;50V?!!
! ")! 3. Células Estaminais Tumorais
O cancro é uma doença composta por diferentes populações celulares entre as quais se destacam as Células Estaminais Tumorais (CET). (17) A presença de CETs tem vindo a ser reconhecida na maior parte se não em todos os cancros. Estas células têm sido identificadas e isoladas no cancro da mama, ovário, fígado, pulmão, cabeça e pescoço, prostata, cérebro, cólon, bexiga, leucemia e pâncreas. Esta identificação resulta da existência de marcadores à superfície das células que permitem o seu isolamento e purificação. Até hoje ainda não existe nenhum marcador específico que permita isolar CETs de diferentes tipos de tumores. (17)
A designação de célula estaminal tumoral surge do facto destas células possuírem propriedades semelhantes às células estaminais.
As células estaminais são células não especializadas, que dão início à linhagem celular e que podem originar não só novas células estaminais mas também células especializadas. A linhagem celular termina quando ocorre a especialização celular, por exemplo na diferenciação em células da pele. (1)
Portanto as CETs caracterizam-se por: (8)
• Capacidade de auto-renovação por divisão assimétrica; • Capacidade de se diferenciarem em diferentes fenótipos; • Capacidade para iniciar um processo cancerígeno; • Resistência à quimioterapia.
! "*! 3.1 Origem das CETs
Até ao momento existem dois modelos que tentam explicar a heterogeneidade inerente à capacidade regeneradora dos tumores: O Modelo Estocástico ou Clonal e o Modelo Hierárquico, tal como é ilustrado na figura 4.
Inicialmente considerava-se que todas as células tumorais possuíam igual capacidade para iniciar um tumor (“Tumor-initiating cell”), ou seja, que todas tinham igual capacidade replicativa e que as mutações que estas células sofriam lhes conferiam vantagem proliferativa e de sobrevivência. Este modelo é o chamado Modelo Estocástico e de facto esta evolução clonal ocorre em vários tumores, no entanto, não explica a diversidade celular que existe entre os tumores sólidos. (18,19) Figura 4 – Representação dos dois modelos de propagação de tumores. O modelo da esquerda representa o Modelo Estocástico ou Evolução Clonal, no qual todas as células têm a capacidade de iniciar o crescimento tumoral (representado pelas setas pretas arredondadas). As diferentes cores representam os diferentes estados de diferenciação e maturação celular. O modelo da direita representa o Modelo Hierárquico, no qual apenas uma pequena população de células estaminais tumorais (representadas a amarelo) tem a capacidade de se auto-renovar e participar no crescimento tumoral. (21)
! #+! Esta teoria foi posta em causa pelo Modelo Hierárquico ou de Células Estaminais Tumorais. Este modelo prevê que pelo menos duas subpopulações de células: as células estaminais tumorais que se dividem lentamente e têm a capacidade de proliferar e sustentar o crescimento e progressão do tumor e uma segunda população constituída por células que se dividem rapidamente mas têm baixo potencial tumorigénico. (20)
Este conceito não é recente e já em 1855, Rudolph Virchow e mais tarde Julius Cohnheim propuseram algumas teorias neste sentido.(20) Em 1960 foram identificadas as primeiras células estaminais tumorais, tendo sido isoladas a partir de cancros hematopoiéticos. Alexandre Brunschwig, Chester Southan e Arthur Levin realizaram experiências a partir das se concluíu que apenas uma pequena minoria de células tumorais tem capacidade de iniciar e manter o crescimento do tumor. (20,21)
Os tumores sólidos, no qual se incluí o cancro do pâncreas, constituem o tipo de cancro mais comum e que representa enormes desafios terapêuticos. O Modelo das Células Estaminais constitui um modelo relevante para uma possível explicação da heterogeneidade observada neste tipo de tumores. É importante realçar que estes dois modelos não são mutuamente exclusivos e a prova disso é que as CETs podem sofrer evolução clonal, tal como acontece por exemplo na leucemia. (22)
3.2 Marcadores Celulares das CETs
Os marcadores desempenham um papel muito importante na identificação e caracterização das células estaminais tumorais. Vários ensaios in vivo e in vitro mostraram que a expressão dos diferentes marcadores depende da origem do tumor, da sua capacidade de auto-renovação e diferenciação, e da sua capacidade de reproduzir o fenótipo das células tumorais originais. (22)
! #"! Na tabela 2 estão descritos alguns marcadores que foram encontrados em vários tumores, no ser humano.
3.3 Xenotransplantes (PDX)
O estudo biológico das CETs implica a avaliação da precisão e representação dessas células dentro de populações de células tumorais. Posto isto, os xenotransplantes têm-se mostrado muito importantes no estudo biológico em causa, permitindo a realização dessa avaliação dentro de populações de células tumorais. (16,23)
Os xenotransplantes têm sido utilizados para demonstrar a capacidade estaminal das células estaminais tumorais e na maioria dos casos em estudo, apenas uma
O1P541!#!2!W10;1<905:!<1:!U3O:!57;97801<9:!56!<-J505785:!8/6905:X!79!:50! F/6179?M#+N!
! ##! pequena população das células, que constituem o tumor, tem mostrado resultados positivos no que diz espeito ao crescimento do tumor. (24) Estas análises de representação das CETs são muito influenciadas pela qualidade do tecido do hospedeiro. Os modelos animais permitem uma reprodução mais fiel da realidade e, como tal, permitirão medições mais fiáveis. O modelo ideal seria aquele que representasse fielmente o tumor e a biologia das CETs, tal como acontece no ser humano. (23) Actualmente, para se conseguir preservar a integridade genómica e a heterogeneidade do tumor estão a ser cada vez mais utilizados modelos PDX, recorrendo a amostras de tumores transplantados em hospedeiros imunodeprimidos. Estes modelos mantêm tumor no seu estado natural e preservam a arquitectura dos cromossomas das células tumorais. (23,25)
Ao longo dos últimos anos estas células têm sido isoladas em tumores específicos e tem-se verificado que a natureza do xenotransplante é um parâmetro crítico para a avaliação da existência deste tipo de células. (13) A maior barreira deste método de avaliação é o custo de pesquisa e a difícil identificação das CETs. Primeiro, porque envolve a implantação em ratos geneticamente modificados que representam maior investimento fianaceiro e, em segundo, porque as CETs têm poucos marcadores conhecidos que permitam purificar determinada população de CETs. (20,25)
3.4 Células Estaminais Tumorais Envolvidas no Processo de Metastização
Em geral, o cancro caracteriza-se como uma doença heterogénea que na maior parte dos casos tem início num local específico. Em alguns casos, verifica-se o aparecimento de tumores secundários, que surgem pela presença de células tumorais metásticas. Estas células abandonam o tumor primário e chegam a outras partes do corpo através do sistema circulatório e linfático.
! #$! No processo carcinogénico a transição epitélio-mesenquima (EMT) promove, como primeiro agente, o processo de invasão local e metastização de tumores. Este processo biológico caracteriza-se pela perda de polaridade e adesão celulares, conferindo mobilidade e a consequente capacidade invasiva e de disseminação. Pesquisas recentes mostram que nos estadios iniciais da doença as células começam a perder adesão intercelular, que normalmente é preservada pelas E-cadherina/ beta-catenina que preservam a integridade do epitélio. (26,27) Estudos mostraram que o factor Foxc2 é o único factor de transcrição cuja expressão está associada a um elevado potencial maligno, promovendo especificamente a diferenciação mesenquimal durante a EMT. (27,28)
No cancro do pâncreas, bem como noutros tipos de cancro, as CETs estão directamente relacionadas com a EMT. No caso do pâncreas as células estreladas do pâncreas (PSCs) também estão directamente relacionadas com a indução da EMT e das CETs, com consequências directas na eficácia do tratamento. Na presença das PSCs ocorre uma sobreregulação quer das CETs quer da EMT. Por outro lado inibindo o TGF-beta ocorre uma supressão das CETs e sobregulação da EMT. (17)
Estas células têm sido reconhecidas como causas viáveis de metastização no adenocarcinoma ductal do pâncreas e, para além disso, têm-se revelado determinantes no desenvolvimento de resistências associadas à quimoterapia e radioterapia. (8,17) Por tudo isto, esta sub-população de células constitui um alvo terapêutico importante e crucial na erradicação da doença. (8)
A metastização constitui a maior causa de morte nos indivíduos com cancro do pâncreas e para a qual ainda não existe nenhum tratamento. A metastização é um processo que envolve a invasão por células estaminais tumorais a partir do tumor
! #%! primário, tendo sido associados vários marcadores das CETs ao aparecimento de metástases. (22)
! #&!
4. Células Estaminais Tumorais Pancreáticas
Actualmente, o número de evidências que defende uma organização hierárquica das células tumorais ao nível dos tumores sólidos, é cada vez maior. No entanto, a aplicação desta teoria para o desenvolvimento do cancro do pâncreas continua a ser uma questão ainda por esclarecer. Para além disso, também a origem das células estaminais pancreáticas continua por identificar. Uma possibilidade é estas terem origem em células estaminais tumorais ou em células somáticas que tenham sofrido mutações genéticas o que lhes conferiram potencial cancerígeno. A ausência de evidência que prove a existência de células estaminais no pâncreas saudável, torna esta questão ainda mais complicada e, neste sentido, têm sido desenvolvidas várias investigações que tentam perceber qual a origem das CETs no cancro do pâncreas. (22)
Apesar de tudo, está provado que as células estaminais tumorais estão implicadas no processo carcinogénico desta doença bem como no seu prognóstico e resistência ao tratamento. Para além disso, estas células são reguladas por vias semelhantes às células estaminais normais, o que tal como já foi referido noutro tópico desta monografia, as torna possíveis alvos de tratamento. Têm sido identificados vários marcadores das células estaminais tumorais que são muito importantes para encontrar terapêuticas alternativas. (29)
As células estaminais tumorais são reguladas e mantidas por vias semelhantes às células estaminais. Essas vias incluem Hedgehog, Notch, Wnt, BMI-1 e PTEN.
No caso da via Notch, alguns estudos mostraram que a activação desta via aumenta a percentagem de CETs bem como a formação do tumor. Por outro lado, o bloqueio desta via leva a uma diminuição da percentagem de CETs bem como do processo de formação do tumor. Por tudo isto, a Notch é importante para manter as
! #'! CETs pancreáticas e por isso constitui um potencial alvo para o tratamento do cancro do pâncreas. (30)
A via Hedgehog (Hg) mostra-se importante na formação das CETs bem como na transição EMT, essencial para o processo de metastização. A expressão desta via é favorecida por situações de hipóxia, através do factor indutor de hipóxia 1-alfa
(HIF-1alfa) e pelo factor nuclear kB (NF-kB). A inibição desta via patogénica inibe a
auto-renovação das CETs e reverte a resistência à quimioterapia. (8)
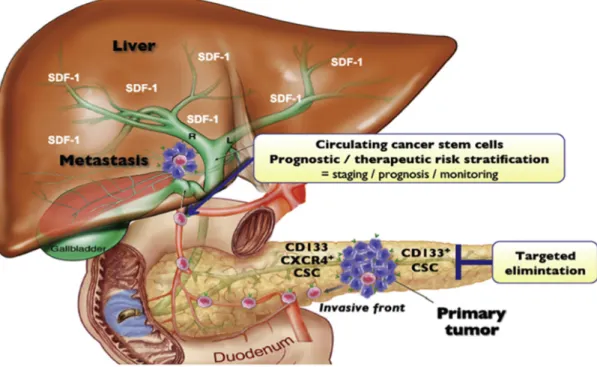
A metastização constitui a maior causa de morte nos indivíduos com cancro do pâncreas e para a qual ainda não existe nenhum tratamento. A metastização é um processo que envolve a invasão por células estaminais tumorais a partir do tumor primário e a disseminação é feita a partir dos vasos sanguíneos e do sistema linfático. Em todos este processos as CETs assumem um papel fundamental em todo o processo de metastização (figura 5) . (22)
,-./01!&!2!Y58509.575-<1<5!<1:!;E4/41:!5:816-71-:!8/6901-:?!Z!7R6509!<5!;E4/41:! 5:816-71-:!8/6901-:!5:8[!1::9;-1<1!19!=09.7\:8-;9!<1!<957@1?!M##N!
! #(! 4.1 Heterogeneidade das Células Estaminais Pancreáticas e
Marcadores das CETs
O isolamento das primeiras células estaminais tumorais pancreáticas foi feito com o seguinte perfil de marcadores: ESA/CD44/CD24. (29)
No adenocarcinoma ductal do pâncreas os marcadores chave que têm sido utilizados na identificação das CETs incluem CD133, ALDH (aldeído desidrogenase) e a combinação ESA/CD24/CD44.
O marcador CD133 foi identificado como marcador de células estaminais tumorais pancreáticas em 2007. Alguns estudos identificaram um grande volume de células que apresentam CD133 negativo e que não mostram capacidade de induzir o processo tumoral, por outro lado identificou-se um pequeno volume de células com o marcador CD133 positivo e que se mostraram muito tumorigénicas e resistentes à quimioterapia. (29) A associação do CXCR4 com CD133 tem se revelado importante na metastização do adenocarcinoma do pâncreas (figura 6).
Figura 6 – Diferentes populações de células estaminais tumorais pancreáticas, entre as quais uma subpopulação de CETS identificada pelos marcadores CXCR4/CD133. Esta subpopulação pode ser detectada na circulação sanguínea e na frente invasiva do tumor. (22)
! #)! O marcador ALDH também está identificado como marcador de células estaminais tumorais pancreáticas. (13,29) Estudos recentes mostram que populações celulares com uma elevada actividade deste marcador são suficientes para iniciar o processo tumoral incluvé mostram-se mais tumorigénicas que populações celulares que apresentam elevada actividade do marcador CD133. (26,31)
Foi identificada uma população de células denominada “side-population” (SP) que apresenta propriedades e características semelhantes às células estaminais tumorais. Estas células têm uma elevada capacidade proliferativa, de se auto-renovar e diferenciar, o que as torna potenciais CETs, contribuindo para o crescimento do tumor. Num estudo recente, estas células foram identificadas em linhas celulares de metastases do adenocarcinoma do pâncreas, podendo representar um modelo viável para estudar as CETs. (32)
Actualmente, o fenótipo das CETs pode ser definido pelo seu potencial cancerígeno, capacidade de resistência à quimioterapia e pela sua capacidade de metastização e reconstrução da hierarquia celular. Estas conclusões resultam de estudos feitos a partir do isolamento de populações específicas de células do tumor. (13) Os Micro-RNAs que estão associados à reacção EMT, também regulam a actividade das CETs; por exemplo várias populações de células estaminais tumorais isoladas de diferentes tumores mostraram um aumento da expressão do miR-21 (13)
Apesar de todos os estudos feitos até aos dias de hoje, ainda não existe nenhum marcador que seja selectivo o suficiente para permitir a identificação de uma população pura de CETs. Apesar disso a utilização destes marcadores tem permitido conhecer a biologia destas células. (22)
! #*! 4.2 Células Estaminais Tumorais Pancreáticas e o Prognóstico da
Doença
A expressão de marcadores de células estaminais tumorais tem sido associado à diminuição da sobrevivência em vários cancros incluindo o cancro do pâncreas. Os marcadores associados a um prognóstico desfavorável são: CD44, CD133, CD24, ESA, ALDH e SP. O aumento da expressão dos marcadores CD133, CD44/CD24, ALDH, ou SP está associado a uma diminuição da esperança média de vida a cinco anos. (33)
! $+!
5. Terapêutica Usada Actualmente
O tratamento do cancro do pâncreas depende do estadío em que o cancro se encontra e geralmente é diagnosticado quando já se encontra num estadío bastante avançado.
O tratamento de eleição neste tipo de adenocarcinoma passa pela intervenção cirurgica usando o processo de Whipple, usado para a maioria dos tumores localizados na cabeça do pâncreas, ou então a pancreoestectomia distal. Esta última é usada com menor frequência e em casos de lesões menores, quer na zona do corpo que na zona da cauda do órgão sempre acompanhado de quimioterapia. Este tipo de tratamento só pode ser feito em doentes que resistam à cirurgia, que não apresentem uma elevada taxa de metastização e cuja localização do tumor não esteja rodeado por vasos sanguíneos de elevado calibre. Dados estatíticos mostram que este tipo de terapêutica é aplicada em menos de 20% dos indivíduos com PDAC. (8)
Por outro lado, a maior parte dos doentes é submetido a quimioterapia como tratamento paliativo e que mais recentemente tem sido feita com gencitabina ou 5-fluororacilo (5-FU), em tumores já avançados e metastizados. A gencitabina aumenta a sobrevivência em doentes com doença em estadío avançado em média 5 semanas. A combinação da gencitabina com o erlotinib, que é um inibidor da tirosina cinase, aumenta a sobrevivência dos doentes. (8)
Recentemente foram adicionadas novas combinações terapêuticas que estabelecem novos padrões de tratamento. A primeira chamada folfirinox, combina leucovorina, 5-FU, irinotecan e oxiplatina; contudo, esta terapêutica apresenta alguns efeitos secundários que restrigem a sua utilização apenas para pacientes que apresentem um quadro clínico favorável. A segunda nova terapêutica é a combinação
! $"! de gencitabina com paclitaxel formulação injectável (nab-paclitaxel). Tanto o folfirinox como a gencitabina/nab-paclitaxel têm mostrado resultados favoráveis face ao uso isolado de gencitabina. Actualmente as terapêuticas standard, usadas na PDAC, estão de acordo com o estadío em que se encontra a doença.(8)
Com tudo isto, é clara a necessidade de novas estratégias para o tratamento do PDAC porque todas as terapias usadas até ao momento trazem poucas melhorias para a esperança média de vida destes doentes. O desenvolvimento de novas terapêuticas para este tipo de cancro tem sido dificil para a comunidade ciêntifica e as razões que fazem com que esta doença ainda represente um desafio terapêutico, são discutidas no ponto seguinte.(8)
5.1 Barreiras ao Tratamento
O PDAC tem imposto muitas barreiras ao desenvolvimento de terapêuticas eficazes que aumentem a esperança média de vida dos pacientes. (8)
Como já foi referido esta doença é diagnosticada muito tardiamente e esta constitui a principal barreira ao tratamento. (8)
O diagnóstico tardio do PDAC resulta de vários factores, que são eles: (8) - Inacessibilidade ao órgão para proceder a uma avaliação
- Sintomas tardios
- Inexistência de métodos de triagem rápidos
Este diagnótico tardio contribui em grande parte para as dificuldades encontradas no tratamento destes pacientes e que só pode ser solucionado com o desenvolvimento de métodos que permitam diagnostiar a doença nos seus estadíos iniciais. (8)
! $#! Outra grande dificuldade são as alterações metabólicas provocadas pelo PDAC. Estes pacientes apresentam uma caquexia severa, que se caracteriza pela perda significativa de peso com perda preferêncial de tecido muscular. A caquexia revela-se a maior causa de morbilidade e mortalidade do PDAC, na qual os mecanismo de perda de peso e tecido muscular não estão bem esclarecidos. A perda de peso e energia pode ser compensada com nutrição parentérica, já a perda de músculo é um processo que não pode ser revertido. Os pacientes que se encontram nesta condição são menos resistentes à quimioterapia e radioterapia. (8)
Como já foi referido anteriormente, o PDAC está intimamente ligado com a Diabetes Mellitus. Estudos mostraram que entre um a dois terços dos indivíduos com PDAC, têm também diabetes mellitus. A grande questão está na origem desta doença doença e se ela constitui um factor de risco ou uma consequência deste tipo de cancro, uma vez que há evidências de ambas as hipóteses. A insulina revelou-se um potente factor de crescimento para o PDAC, por outro lado o tratamento da diabetes com metformina pode aumentar a esperança média de vida total destes doentes de 11,1 para 15,2 meses, diminuindo o risco de morte em 32%. Estudos recentes mostraram uma redução de 46% do risco de desenvolver PDAC em doentes a realizar uma terapêutica com metformina. Este fármaco revelou-se um importante inibidor do crescimento das células estaminais tumorais (CETs) e por isso existe a hipotese de este fármaco poder ser usado como prevenção ou como complementar à terapêutica. Neste âmbito, têm sido desenvolvidos vários estudos que suportam esta hipótese e que associam o efeito anticancerígeno da metformina à diminuição da expressão de marcadores das CETs (CD44, EpCAM (molécula de ligação celular ao epitélio), N-metiltransferase e histona-lisina e Notch-1) , e à indução de micro-RNAs que são
! $$! perdidos nesta doença. Para além disto a metformina diminui a expressão do Shh (sonic hedgehog) mRNA e proteinas. (8)
5.2 Células Estaminais Tumorais Pancreáticas – Implicações no Tratamento
As células estaminais tumorais têm claras implicações no tratamento do cancro do pâncreas, e tal como já foi referido estas células são resistentes à quimioterapia e radioterapia. A terapia citotóxica pode enriquecer a fracção de CETs. (29)
As CETs são reguladas por várias vias patogénicas que se mostram potenciais alvos terapêuticos.
O bloqueio da via Hedgehog em modelos animais, diminui drasticamente a capacidade de metastização e tumorigénese das CETs. Os inibidores desta via que têm sido investigados são : IPI-269609, GDC-0449, e “Cyclopamine”. Estudos in vito com o inibidor IPI-269609 mostram uma diminuição não só da via Hedgehog como também da ALDH, resultanto numa diminuição no volume do tumor e bloqueio total da metastização. O inibidor GDC-0449 mostrou-se importante na indução da apoptose de células do pâncreas. O inibidor “Cyclopamine” diminui o risco de metastização e diminui o processo de EMT, em modelos animais. Este inibidor não só bloqueia a via Hedgehog como também diminui a ALDH. Para além disto também o bloqueio da via Notch diminui o crescimento tumoral.(29)
O tratamento usando a combinação da Gencitamiba com XL184 mostrou-se eficaz na prevenção da metastização. (29)
! $%! 5.3 Células Estaminais Tumorais e Células EMT como Alvos
Terapêuticos no Cancro do Pâncreas
Recentemente foram desenhadas novas terapias focadas nas CETs e nas células EMT, com o objectivo de aumentar a sensibilidade à terapêutica e inibir a invasão e metastização pelas CETs. Estas alternativas terapêuticas são particularmente importantes para o adenocarcinoma ductal do pâncreas que se mostra muito resistente à terapêutica convencional. (32)
É difícil encontrar agentes que sejam tóxicos para as CETS, não só porque são células muitos instáveis mas também porque são uma pequena população de células dentro de toda a população de células tumorais. Após vários testes na tentativa de encontrar agentes toxicos e seletivos para as CETS encontrou-se o salinomycina. Esta molécula reduz a proporção de CETs comparativamente ao paclitaxel. Experiências in vivo, relativamente ao cancro da mama, mostraram que o tratamento com salinomycina resulta numa diminuição da expressão dos genes das CETs previamente identificados em tecidos retirados directamente de indivíduos com a doença. (34)
! $&!
6. Conclusão e Prespectivas Futuras
Ao longo de toda esta monografia foi várias vezes sugerido que as propriedades das CETs podem ser a explicação para vários eventos clínicos que agravam a situação clínica do doente.
Os marcadores das CETs, em especial no adenocarcinoma ductal do pâncreas, devem ser cuidadosamente testados e estudados, na tentativa de encontrar uma forma viável de purificar estas populações celulares. Esta limitação no seu isolamento condiciona não só a caracterização biológica completa destas células, como também a compreensão do Modelo de Células Estaminais Tumorais. É importante que, no futuro, se associem testes de heterogeneidade genética a estudos do potencial cancerígeno, na tentativa de chegar a uma explicação mais sustendada para capacidade que as CETs têm de reproduzir a heterogeneidade do tumor de origem. Estas células são consideradas raras e fenotipicamente distintas em alguns tipos de tumores.
Actualmente ainda não se sabe que a fracção de tumores que segue o Modelo Estocástico ou o Modelo das Células Estaminais Tumorais. É possível que no mesmo tumor possam coexistir uma organização hierárquica entre as células tumorais e uma evolução clonal característica do Modelo Estocástico.
No adenocarcinoma do pâncreas a análise etiológica desta patologia é crucial para o desenvolvimento de novas estratégias de prevenção, detecção e diagnóstico mais eficazes. O consumo de tabaco, álcool, o excesso de peso, a existência de Diabetes Mellitus ou história de pancretite crónica têm-se demonstrado factores de risco importantes no desenvolvimento desta doença.
! $'! Em conclusão, as CET’s têm-se revelado muito importantes no desenvolvimento do tumor e por isso é importante perceber em que medida elas podem contribuir para o desenvolvimento de alternativas terapêuticas. Sendo assim o futuro passa por apostar na detecção precoce, na prevenção e na descoberta de terapias alternativas mais eficazes específicas para as CET’s. Todas as alternativas terapêuticas têm que ser ajustadas a cada doente em particular porque cada caso de cancro é um caso único que evolui consoante o doente em causa.
! $(!
Bibliografia
1 - Cooper, G.& Hausman, R. The Cell a Molecular Approach (2007)
2 - Craig A Almeida, Sheila A. Barry, Cancer: Basic Science and Clinical Aspects (2010)
3 - Azevedo, C. Biologia Celular e Molecular. 503–521 (2005) 4 - Nacional Cancer Institute - Cancer Prevencion Overview at
http://www.cancer.gov/cancertopics/pdq/prevention/overview/patient/page3 5 - Roche. InfoCANCRO. at <http://www.roche.pt/sites- tematicos/infocancro/index.cfm/nocoes/>
6 – Vander, Sherman & Luciano, Fisiologia Humana: Os Mecanismos das Funções Corporais, 9ª Edição, (2006)
7 - M. Schwab (ed.), Encyclopedia of Cancer, Springer-Verlag Berlin Heidelberg DOI 10.1007/978-3-642-16483-5 (2011)
8 – Al Haddad AH, Adrian TE, Challenges and future direcions in therapeutics for pancreatic ductal adenocarcinoma, Expert Opin Investing Drugs. 1-17 (2014)
9 - Hidalgo M. Pancreatic cancer. N Engl J Med., 362:1605–1617 (2010)
10 - M. Bishr Omary, Aurelia Lugea, Anson W. Lowe e Stephen J. Pandol, Pancreatic stellate cell: a star on the rise in pancreatic diseases, J Clin Invest. 117(1): 50–59. (2007)
11 - Buanes TA. Pancreatic cancer-improved care achievable. World J Gastroenterol, 10405-10418 (2014)
12 – Wolpin BM, Chan AT, Hartge P, et al. ABO blood group and the risk of pancre- atic cancer. J Natl Cancer Inst, 101: 424-31. (2009)
! $)! 13 - Edited by Paul J. Grippo andHidayatullah G. Munshi, Pancreatic Cancer
and Tumor Microenvironment (2012)
14 - Farrow B, Albo D, Berger DH. The role of the tumor microenvironment in the progression of pancreatic cancer.J Surg Res. 149:319–328 (2008)
15 - Vogelstein B, Kinzler KW. Cancer genes and the pathways they control. Nat Med, 10:789-99 (2004)
16 - Hruban RH, Maitra A, Goggins M. Update on pancreatic intraepithelial neo- plasia. Int J Clin Exp Pathol;1:306-16 (2008)
17 - Contextual regulation of pancreatic cancer stem cell phenotype and radioresistance by pancreatic stellate cells, Radiother Oncol., 243-51 (2014)
18 - Mazza, M. Cancer stem cells – hope for the future ? (2011)
19 - Williams, S. a, Anderson, W. C., Santaguida, M. T. & Dylla, S. J. Patient-derived xenografts, the cancer stem cell paradigm, and cancer pathobiology in the 21st century. Laboratory investigation; a journal of technical methods and pathology 93, 970–82 (2013).
20 – Rahman M1, Deleyrolle L., Vedam-Mai V, Azari H, Abd-El –Barr M, Rey nolds BA. ,The Cancer Stem Cell Hypothesis: Failures and Pitfalls, Neurosurgery, (2011)
21 - Clarke, M. F. et al. Cancer Stem Cells !! Perspectives on Current Status and Future Directions : AACR Workshop on Cancer Stem Cells Cancer Stem Cells — Perspectives on Current Status and Future Directions : AACR Workshop on Cancer Stem Cells. 9339–9344 (2006)
! $*! 22 – Enza Lonardo, Patrick C. Hermann, Christopher Heeschen Pancreatic Cancer Stem Cells – update and future perpectives Molecular Oncology, Volume 4, Issue 5, 43–442 (2010)
23 - Gupta, P. B., Chaffer, C. L. & Weinberg, R. a. Cancer stem cells: mirage or reality? Nature medicine 15, 1010–2 (2009).
24 - Z. Rasheed, Q. Wang, W. Matsui, Isolation of stem cells from human pancreatic cancer xenografts, J. Vis. Exp. (2010).
25 - Williams, S. a, Anderson, W. C., Santaguida, M. T. & Dylla, S. J. Patient-derived xenografts, the cancer stem cell paradigm, and cancer pathobiology in the 21st century. Laboratory investigation; a journal of technical methods and pathology 93, 970–82 (2013).
26 - Rasheed ZA, Yang J, Wang Q, Kowalski J, Freed I, Murter C, Hong S-M, Koorstra J-B, Rajeshkumar NV, He X, et al. Prognostic significance of tumorigenic cells with mesenchymal features in pancreatic adenocarcinoma. J Natl Cancer Inst., 102:340–351. (2010)
27 – Galván JA1, Astudillo A, Vallina A, Fonseca PJ, Gómez-Izquierdo L, García-Carbonero R, González MV. Epithelial-Mesenchymal Transition Markers in the Differential Diagnosis of Gastroenteropancreatic Neuroendocrine Tumors. Am J Clin Pathol, 140:61-72 (2013)
28 - Mani, S. a et al. Mesenchyme Forkhead 1 (FOXC2) plays a key role in metastasis and is associated with aggressive basal-like breast cancers. Proceedings of the National Academy of Sciences of the United States of America 104, 10069–74 (2007).
! %+! 29 - Fitzgerald TL, McCubrey JA. ,Pancreatic Cancer Stem Cells: Association with cell surface markers, prognosis, resistance, metastasis and treatment, Advances in Biological Regulation 56: 45-50 (2014)
30 - Abel EV, Kim EJ, Wu J, Hynes M, Bednar F, Proctor E, et al. The notch pathway is important in maintaining the cancer stem cell population in pancreatic cancer. PloS one (2014)
31 - Kim MP, Fleming JB, Wang H, Abbruzzese JL, Choi W, et al. ALDH Activity Selectively Defines an Enhanced Tumor-Initiating Cell Population Relative to CD133 Expression in Human Pancreatic Adenocarcinoma, (2011)
32 - Pancreatic cancer stem cells: Emerging target for designing novel therapy
Yiwei Li a, Dejuan Kong a, Aamir Ahmad a, Bin Bao a, Fazlul H. Sarkar a,b, Cancer Letters 338, 94-100 (2013)
33 - Li, C., Heidt, D.G., Dalerba, P., Burant, C.F., Zhang, L., Adsay, V., Wicha, M., Clarke, M.F., Simeone, D.M., Identification of pancreatic cancer stem cells. Cancer Res. 67, 1030 – 1037 (2007)
34 - P.B. Gupta, T.T. Onder, G. Jiang, K. Tao, C. Kuperwasser, R.A. Weinberg, E.S. Lander, Identification of selective inhibitors of cancer stem cells by high- throughput screening, Cell 138, 645-659 (2009)
! %"! Agradecimentos
Aos meus pais, João e Lurdes, por serem peças fundamentais na construção deste sonho. Por todo o amor e apoio incondicional em todas as minha decisões, ao longo destes anos.
À minha irmã Lúcia que partilhou comigo de perto tantos momentos da minha vida académica e pessoal, por ser um exemplo de responsabilidade e dedicação e por todos os bons momentos que vivemos juntas.
À minha irmã Maria pela boa disposição e energia contagiante.
Aos meus amigos, à Maria Inês Mendes e à Mariana Afonso por estarem comigo desde o início deste percurso. À Inês Monteiro, por todo apoio, paciência, serenidade, e optimismo, tanto nas dúvidas e inquietações como nos sucessos.
À Tuna A Feminina por todas as gargalhadas, por todas as lágrimas, por me ter ajudado a construir a pessoa que sou hoje.
A todos os membros da DAEFFUL 2013/2014 por todos os momentos partilhados ao longo desse ano e por tudo aquilo que conseguimos juntos.
À Professora Doutora Ana Rita Conde pela disponibilidade e apoio desde o primeiro instante, que tornou possível a concretização deste trabalho.