3- ÁREA DE ESTUDO
3.1- Localização
A área de estudo abrange o litoral da cidade de Fortaleza que tem
aproximadamente 25 Km de extensão e localiza-se entre os rios Cocó e Ceará, onde
o litoral apresenta uma linha de costa não linear formada por enseadas e
desembocaduras. Nesta região foram distribuídos três pontos amostrais, conforme
mostrado na Figura 1.
O município possui uma população de 2.008.203 habitantes e uma superfície
de 336 Km² (IBGE, 2000). No litoral de Fortaleza são observadas duas zonas
marcantes. A primeira estende-se do rio Ceará até o espigão da praia do Titanzinho
(Setor Oeste-Centro), onde a ocupação urbana é de grande intensidade. Nessa
zona, a vegetação e as formas de paisagens nativas foram degradadas pela
influência antrópica. Apresentam ainda como característica da paisagem algumas
dunas isoladas que são submetidas à extração de areia para uso na construção civil.
Nesta região, é reduzida a rede de saneamento, sendo observado a olho nu a
presença de dejetos nos aqüíferos, fato que evidencia a poluição do lençol freático.
A segunda zona (Setor Leste) estende-se desde o espigão da praia do Titanzinho
até a foz do rio Cocó. Essa área apresenta-se degradada devido à intensa
urbanização (SEMACE, 1992) e a poluição das drenagens locais.
Em Fortaleza, a principal fonte de contaminação das praias origina-se dos
sistemas de drenagem pluvial ao longo do litoral da região metropolitana. Onde
esses sistemas drenam runoff urbano, esgoto doméstico e industrial. Também
contribuem para a poluição das praias os riachos Maceió, Pajeú e Jacarecanga e em
menor proporção os rios Ceará e Cocó (SEMACE, 1992).
A Tabela 3 caracteriza o percentual dos domicílios, por bairros, servidos por
água, saneamento básico e coleta de lixo na área deste estudo. Em cada um dos
sistemas de drenagem foi incluída uma área de amostragem. As galerias (Figura 2)
amostradas foram: Leste-Oeste (0550712-9589516), Náutico (555940-9588276) e
Riacho Maceió (557310-9588564), que pertencem à bacia da Vertente Marítima
Figura 2: Galerias amostradas: Ponto 1- Leste-Oeste (A), Ponto 2- Náutico (B) e Ponto 3- Riacho
Maceió (C).
A
B
3.2- Características Abióticas
A cidade de Fortaleza está localizada na costa do Estado do Ceará, com 576
km de extensão, possui principalmente longas faixas de praias arenosas,
interrompidas apenas por pequenos rios e afloramentos rochosos que determinam
mudanças na orientação da costa (Maia et al., 1998).
A Região Metropolitana de Fortaleza (RMF) insere-se, no contexto
Geológico/Geotectônico, na faixa de dobramentos Jaguaribeana, sendo que os
terrenos gnássicos-migmatitos ocupam grande parte da mesma e podem receber
diferentes denominações litoestratigráfica na literatura. As coberturas sedimentares
Cenozóicas, representadas pela Formação Barreiras, Coberturas Colúvio-Eluviais,
Dunas fixas, Dunas móveis, Depósitos Flúvios-Aluvionares e de Mangues (DNPM,
1998).
O regime pluvial é sazonal e definido como do tipo tropical, com período
chuvoso de Janeiro á Julho, onde as chuvas se concentram e o seco de Agosto a
Dezembro, quando virtualmente as precipitações alcançam valores mínimos (Maia et
al., 2001). As precipitações anuais médias na região litorânea se encontram na faixa
de 1400-1600 mm. Na região há predominância dos ventos alísios, produto da zona
de convergência intertropical na direção E-W, com velocidade média anual de 3,6
m.s-1, atingindo o máximo em setembro (7,2 m.s-1) e diminuindo gradativamente até o mês de março (Consórcio Concremat, 1993).
A região é caracterizada por mesomarés do tipo semi-diurna com amplitude
desigual (preamar 1,7 m e quadratura 3,0 m ), apresentando período de 12,4 horas e
nível médio de 1.55 m. As marés têm um máximo de 3,2 m com média de 2,8 m,
sendo os maiores valores observados de 3,87 m e os menores de -0,2 m (Maia et al,
2002).
A Bacia Região Metropolitana de Fortaleza subdivide-se em quatro bacias
hidrográficas: o Sistema Ceará-Maranguapinho, Vertente Marítima e nas águas
oceânicas do litoral de Fortaleza, rio Cocó e rio Pacoti. Este sistema de drenagem
possui ainda inúmeras lagoas, riachos e açudes que são importantes no equilíbrio
hidráulico, manutenção do macro-clima e valorização da paisagem (Consórcio
Concremat, 1993).
O canal principal dos rios apresenta um aspecto meandriforme, com a região
formados por areia quatzosa, com tamanho variável entre areias finas nas regiões
mais internas e mais grosseiras com elevada quantidade de conchas nas regiões de
desembocadura, que comprova o aporte de material marinho para dentro do
estuário. Durante o período de maior pluviosidade, quando aumenta a capacidade
de transporte, pode-se observar a erosão das margens e o transporte da vegetação
7- Referências Bibliográficas
Abreu, I. M. Distribuição geoquímica de carbono, nitrogênio e fósforo em sedimentos
estuarinos do rio Jaguaribe, Ceará. Dissertação de Mestrado. Pós-Graduação em
Geologia. Universidade Federal do Ceará. 105p., Fortaleza, 2004.
Alm, E. W.; Burke, J. & Spain, A. Fecal indicator bacteria are abundant in wet sand at
freshwater beaches. Water Research, v. 37, p. 3978-3982, 2003.
Almeida, M. M. M.; Silva, F. J. A. & Ferreira, R. L. U. C. Balneabilidade das praias do
litoral de Fortaleza, nordeste brasileiro. XXVI Congresso Interamericano de
Engenharia Sanitária e Ambiental. Lima, 1998.
Azevedo, F. A. Toxicologia do Mercúrio. Rima, 292p., São Carlos, 2003.
An, Y.; Kampbell, D. H. & Breidenbach, G. P. Escherichia coli and coliforms in water
and sediments at lake marinas. Environment Pollution, v. 120, p. 771-778, 2002.
Berner, R. A. & Rao J. Phosphorus in sediments of the Amazon River and estuary:
implications for the global flux of phosphorus to the sea. Geochimica Cosmochimica
Acta, v. 58, n. 10, p. 2333-2339, 1994.
Braga, E. S.; Bonetti, C. V. D. H.; Burone, L. & Bonetti-Filho, J. Eutrophication and
bacterial pollution caused by industrial and domestic wastes at the Baixada Santista
estuarine system, Brazil. Marine Pollution Bulletin, v. 40, n. 2, p. 165-173, 2000.
Campos, M. L. A. M.; Brendo, A. & Viel, F. C. Método de baixo custo para a
purificação de reagentes e controle da contaminação para a determinação de
metais-traço em águas naturais. Química Nova, v. 25, n. 5, p. 808-813, 2002.
Cardonha, A. M. S.; Vieira, R. H. S. F.; Rodrigues, D. P.; Macrae, A.; Peirano, G. &
seashores in Natal, Rio Grande do Norte, Brazil. International Microbiology, v. 7, p.
213-218, 2004.
CETESB. Companhia de Tecnologia de Saneamento Ambiental. Relatório de
balneabilidade das praias paulistas de 1998. 230p., São Paulo, 1999.
CONAMA. Conselho Nacional do Meio Ambiente. Resolução nº 274 de 29 de
novembro de 2000. Diário Oficial de República Federativa do Brasil. 89p, Brasília,
2000.
CONAMA. Conselho Nacional do Meio Ambiente. Resolução nº 357 de 17 de março
de 2005. Diário Oficial de República Federativa do Brasil. 23p, Brasília, 2005.
Conrad, C. F. & Chisholm-Brause, C. J. Spatial survey of trace metal contamination
in sediments of the Elizabeth River, Virginia. Marine Pollution Bulletin, v. 49, p.
319-324, 2004.
Consórcio CONCREMAT/CSL/CAB - Secretaria de Desenvolvimento Urbano e
Ambiental. Relatório de Impacto Ambiental - Sistema de depuração oceânica de
esgotos sanitários, Fortaleza, 1993.
Councell, T. B.; Duchenfield, K. U.; Landa, E. R. & Callender, E. Tire-wear particles
as a source of Zn to the environment. Environment Science and Technology, v. 38, p.
4206-4214, 2004.
Curtius, A. J.; Seibert, E. L.; Fieldler, H. D.; Ferreira, J. F. & Vieira, P. H. F. Avaliando
a contaminação por elementos traços em atividades de maricultura. Resultados
parciais de um estudo de caso realizado na ilha de santa Catarina, Brasil. Química
Nova, v. 26, n. 1, p. 44-52, 2003.
Davis, A. p.; Shokouhian, M. & Ni, S. Loading estimates of lead, copper, cadmium
and zinc in urban runoff from specific sources. Chemosphere, v. 44, p. 997-1009,
DNPM. Departamento Nacional de Produção Mineral. Plano diretor de mineração
para a região metropolitana de Fortaleza. 191p., Brasília, 1998.
Esteves, F.A.; Fundamentos de Limnologia. 2ª ed., Interciência, 602p, Rio de
Janeiro, 1998.
FIEC. Federação das Indústrias do Estado do Ceará. Guia industrial do Ceará
2001-2202. LCR, Fortaleza, 2004.
Fiszman, M; Pfeiffer, W. C. & Lacerda, L. D. Comparison of methods used for
extraction and geoquimical distribution of heavy metal in bottom sediments from
Sepetiba bay, RJ. Science and Technology Letters, p. 567-575, 1984.
Garthright, W. E. Appendix 2: Most probable number from seral dilutions. In: Food
and drug administration – FDA. Bacteriological Analytical Manual on line.
FDA/CFSAM, 2001.
Gauthier, M. J.; Flatau, G. N.; Clement, R. L. & Munro, P. M. Sensitivity of
Escherichia coli cells to seawater closely depends on their growth stage. Journal of
Apllied Bacteriology, v. 73, p. 257-262, 1992.
George, I.; Crop, P. & Servais, P. Fecal coliform removal in wastewater treatment
plants studied by plate counts and enzymatic methods. Water Research, v. 36, p.
2607-2617, 2002.
Guerra-Riba, A.; Rubio, R.; Rauret, G.; Muntau, H. & Sahuquillo. A. Method study for
preparation of a wet sediment quality control material. Analytica Chimica Acta, v. 555,
p. 384-390, 2006.
IBGE - Instituto de Geografia e Estatística. Censo demográfico 2000, Fortaleza,
2000.
IPECE. Instituto de Pesquisa e Estratégia Econômica do Ceará. Ceará em números.
Kolm, H. E. & Andretta, L. Bacterioplancton in different tides of the Perequê tidal
creek, Pontal do Sul, Paraná, Brazil. Brazilian Journal of Microbiology, v. 34, p.
97-103, 2003.
Koroleff, F. & Hansen, H. P. Determination of nutrients. In: Grasshoff, K. et al.
Methods of Seawater Analysis. 2nd ed., Verlag-Chimie, p. 117-156, 1976.
Kucuksezgin, F.; Kontas, A.; Altay, O.; Uluturhan, E & Darilmaz, E. Assessment of
marine pollution in Izmir Bay: nutrient, heavy metal and total hydrocarbon
concentrations. Environment International, v. 32, p. 41-51, 2006.
Kunz, A.; Peralta-Zamora, P; Moraes, S. G. & Durán, N. Novas técnicas no
tratamento de efluentes têxteis. Química Nova, v. 25, n. 1, p. 78-82, 2002.
Machado, W.; Moscatelli, M.; Rezende, L. G. & Lacerda, L. D. Mercury, zinc and
copper acumulation in mangrove sediments surrouding a large landfill in southeast
Brazil. Environmental Pollution, v. 120, p. 455-46, 2002.
Maia, L. P.; Freire, G. S. S.; Morais, J. O.; Rodrigues, A. C. R.; Pessoa, P. R. &
Magalhães, S. H. O. Dynamics of coastal dunes at Ceará state, northeastern Brazil:
dimensions and migrations rate. Arquivo de Ciências do Mar, v. 34, p. 11-22, 2001.
Maia, L. P.; Jimenez, J. A.; Serra, J. & Morais, J. O. The coasttline of Fortaleza city, a
product of environmental impacts caused by the Mucuripe harbor. Arquivo de
Ciências do Mar, v. 31, p. 93-98, 1998.
Maia, L. P.; Ximenes, J. A. & Raventos, J. S. Influencia de los procesos costeros en
las características granulométricas de los sedimentos. Arquivo de Ciências do Mar,
v. 35, p. 11-22, 2002.
Maia, S. R. R. Distribuição e partição geoquímica de metais-traço na costa norte de
Fortaleza, CE. Dissertação de Mestrado. Pós-Graduação em Ciências Marinhas
Malm, O. Nova ameaça do clima. Ciência Hoje. v. 37, 2005.
Marins, R. V. Avaliação da contaminação por mercúrio emitido por fontes difusas em
sistema costeiro subtropical - O caso da Baía de Sepetiba, SE, Rio de Janeiro. Tese
de Doutorado. Pós-Graduação em Geociências. Universidade Federal Fluminense.
77p, Rio de Janeiro, 1998.
Marins, R. V.; Maia, S. R. R. & Maia, L. P. Geochemical distribution and partitioning
of Hg, Cu, Cd, Pb and Zn in sediments from Fortaleza Northern coast (CE).
Environmental Geochemistry in Tropical Countries, Búzios, 2004.
Marins, R. V.; Lacerda, L. D. & Villas Boas, R. C. Mercury Contamination Sites:
Characterization, Risk Assessment and Remediation. Ebinghoaus, R.; Turner, R.;
Lacerda, L. D.; Vasiliev, O. & Solomons, W. (eds.). Springer-Verlag, Berlin, 1999.
Marins, R. V.; Lacerda, L. D.; Paula-Filho, F. J. & Maia, S. R. R. Distribuição de
mercúrio total como indicador de poluição urbana e industrial na costa brasileira.
Química Nova, v. 27, n. 5, p. 763-770, 2004.
Marins, R. V.; Paraquetti, H. H. M. & Ayres, G. A. Alternativa analítica para a
especiação físico-química de mercúrio em águas costeiras tropicais. Química Nova,
v. 25, n. 3, p. 372-378, 2002.
Mendes, B.; Nascimento, M. J. & Oliveira, J. S. Preliminary characterization and
proposal of microbiological quality standard of sand beaches. Water Science
Technology, v. 27, n. 3-4, p. 453-456, 1993.
Menezes, F. G. R.; Nascimento, S. M. M.; Abreu, L. M.; Marins, R. V. & Vieira, R. H.
S. F. Monitoramento (físico-químico e bacteriológico) de algumas galerias pluviais da
costa leste de Fortaleza. Congresso de Ecologia do Brasil, Fortaleza, 2003.
Molisani, M. M., Environmental changes in Sepetiba bay, SE, Brazil. Regional
Mirlean, N.; Andrus, V. E.; Baisch, P.; Griep, G. & Casartelli, M. R. Arsenic pollution
in Patos lagoon estuarine sediments, Brazil. Marine Pollution Bulletin, v. 46,
p.1480-1484, 2003.
Moreira, R. C. A. & Boaventura, G. R. Referência geoquímica regional para a
interpretação das concentrações de elementos químicos nos sedimento da bacia do
lago de Paranoá, DF. Química Nova, v. 26, n.6, p. 812-820, 2003.
Molina, M. C. F.; Alcántara A. A. & García, M. E. Transmisión fecohídrica y virus de
la hepatitis A. Higiene y Sanidad Ambiental, v.1, p. 8-18, 2001.
Osório, V. K. L. & Oliveira, W. Polifosfatos em detergentes em pó comerciais.
Química Nova, v. 24, n. 5, p. 700-708, 2001.
Paraquetti, H. H. M.; Ayres, G. A.; Almeida, M. D.; Molisani, M. M. & Lacerda, L. D.
Mercury distribution, speciation and flux in Sepetiba Bay tributaries, SE Brazil. Water
Research, v. 38, p. 1439-1448, 2004.
Paula-Filho, F. J. Distribuição e partição geoquímica de fósforo em sedimentos
estuarinos do rio Jaguaribe, Ceará. Dissertação de Mestrado. Pós-Graduação em
Ciências Marinhas Tropicais. Universidade Federal do Ceará. 88p., Fortaleza, 2004.
Pekey, H.; Karakas, D. & Bakoglu, M. Source apportionment of trace metals in
surface waters of a polluted stream using multivariate statistical analyses. Marine
Pollution Bulletin, v.49, p. 809-818, 2004.
Peltola, P.; Ivask, A.; Aström, M & Virta, M. Lead and Cu contaminated urban soils:
extraction with chemical reagents and bioluminescent bacteria and yeast. Science of
Total Environment, v. 350, p. 194-203, 2005.
Reeves, R. L.; Grant, S. B.; Mrse, R. D.; Copil, C. M. O.; Sander, B. F. & Boehm, A.
watershed in southern California. Environment Science Technology, v. 38, p.
2637-2648, 2004.
Rozen, Y. & Belkin, S. Survival of enteric bacteria in seawater. FEMS Microbiology
Reviews, v. 25, p. 513-529, 2001.
Sabin, L. D.; Lim, J. H.; Stolzenbach, K.D. & Schiff, K. C. Contribution of trace metals
from atmospheric deposition to stormwater runoff in a small impervious urban
catchment. Water Research, v. 39, p. 3929-3937, 2005.
Sanchez, P. S., Stoppe, N. C., Sato, M. I. Z., Martinez, S. C. G. L., Osteni, S.;
Sevamarcho, A. A. & Almeida, G. L. Caracterização da qualidade microbiológica de
águas marinhas e moluscos bivalves no litoral norte do estado de São Paulo.
Congresso Brasileiro de Engenharia Sanitária e Ambiental, v. 1, Goiânia, 1991.
Sankararamakrishnan, N. & Guo, Q. Chemical traces as indicatior of human fecal
coliforms at storm water outfalls. Environment International, v. 31, p. 1133-1140,
2005.
Schiff, K. C.; Morton, J. & Weisberg, S. B. Retrospective evaluation of shoreline
water quality along Santa Monica Bay beaches. Marine Environment Research, v.
56, p. 245-253, 2003.
Schiff, K.; Bay, S. & Stransky, C. Caracterization of stormwater toxicants from an
urban watershed to freshwater and marine organisms. Urban Water, v. 4, p. 215-227,
2002.
SEMACE. Superintendência Estadual do Meio Ambiente. Avaliação da
balneabilidade das praias do litoral de Fortaleza. 67p., Fortaleza, 1992.
Silva, C. A. R. Análise Físico-Química de Sistemas Marginais Marinhos. Interciência,
Smith, D. R.; Warnemuende, E. A.; Haggard, B. E. & Huang, C. Changes in
sediments-water column phosphorus interactions following sediment disturbance.
Ecological Engineering,n_, v_, 2006.
Stevenson, W. J. Estatística aplicada à administração. Haper & Row do Brasil, 495p.,
São Paulo, 1981.
Soares, J. B. Água: microbiologia e tratamento. Edições UFC, 214p., 1999.
Tortora, G. J.; Funke, B. R. & Case, C. L. Microbiologia. 6ª ed., Artmed, 827p., Porto
Alegre, 2000.
UNESCO. Methods of nutrients analysis. Manuals and Guias, n. 33, 1995.
Vasconcelos, F. P. & Albuquerque, M. F. C. Aterro da Praia de Iracema sob ameaça
de extinção. Pesquisas Funcap, n. 3, 2003.
Vaze, J & Chiew, F. H. S. Experimental study of pollutant accumulation on an urban
road surface. Urban Water, v. 4, p. 379-389, 2002.
Vieira, R. H. S. F.; Menezes, F. G. R.; Nascimento, S. M. M.; Marins, R. V.; Abreu, I.
M. & Fonteles-Filho, A. A. Stormwater drainage system: A pollution vector in Ceará
State’s seashore. Arquivo de Ciências do Mar, no prelo
Vieira, R. H. S. F. Microbiologia, higiene e qualidade do pescado: teoria e prática.
Varela, 380p., São Paulo, 2004.
Vieira, R. H. S. F.; Catter, K. M.; Saker-Sampaio, S.; Rodrigues, D. P.; Theophilo, G.
N. D. & Fonteles-Filho, A. A. The stormwater drain system as a pollution vector of the
seashore in Fortaleza (Ceara State, Brazil). Brazilian Journal of Microbiology, v.33, p.
Viera. R. H. S. F.; Rocha, C. A. S.; Menezes, F. G. R.; Aragão, J. S.; Rodrigues, D.
P.; Theophilo, G. N. D. & Reis, E. M. F. Poluição da água e areia de três praias de
Fortaleza, Ceará, Brasil. Arquivo de Ciências do Mar, v. 35, p. 113-118, 2002b.
Vieira, R. H. S. F.; Silva, A. I. M.; Sousa, O. V.; Hofer, E.; Vieira, G. H. F.;
Saker-Sampaio, S. & Lima, E. A. Análise experimental sobre a viabilidade de Escherichia
coli em água do mar. Arquivo de Ciências do Mar, v. 34, p. 43-48, 2001a.
Vieira, R. H. S. F.; Rodrigues, D. P.; Menezes, E. A.; Evangelista, N. S. S.; Reis, E.
M. F.; Barreto, L. M. & Gonçalves, F. A. Microbial contamination of sand from major
beaches in Fortaleza, Ceará State, Brazil. Brazilian Journal of Microbiology, v. 32, n.
2, 2001b.
Vogel, A. I. Análise Química Quantitativa. 6ª ed. LTC, 462p, Rio de Janeiro, 2000.
Wasserman, J. C. & Queiroz, E. L.; The attenuation of concentrations model: A new
method for assessing mercury mobility in sediments. Química Nova, v. 27, n. 1, p.
17-21, 2004.
Wong, C. S. C.; Li, X. & Thornton, I. Urban environmental geochemistry of trace
metals. Environment Pollution, v_, p. 1-16, 2005.
Worsfold, P. J.; Gimbert, L. J.; Mankasingh, U.; Omaka, O. N.; Hanrahan, G.;
Gardolinshi, P. C. F. C.; Haygarth, P. M.; Turner, B. L.; Keith-Roach, M. J. &
McKelvie, I. D. Sampling, sample treatment and quality assurance issues for the
determination of phosphorus species in natural waters and soils. Talanta, v. 66, p.
273-293, 2005.
Yuan, C.; Shi, J.; He, B.; Liu, J.; Liang, L. & Jiang, G. Speciation of heavy metals in
marine sediments from the east China sea by ICP-MS with sequential extraction.
6- CONCLUSÕES
A contaminação nas águas das galerias pluviais drenadas para a orla de
Fortaleza, avaliadas neste estudo, é constante e intensa para os coliformes
termotolerantes, E. coli e fosfato. Onde os teores estão em geral acima dos valores
máximos preconizados pelo Conselho Nacional do Meio Ambiente (CONAMA).
A galeria do Náutico é a que apresenta menor contaminação entre os três
sistemas de drenagem amostrados. Entretanto, esta galeria se diferencia das
demais em relação aos parâmetros salinidade, pH, fostafo, coliformes
temotolerantes, E. coli e cobre. Sendo importante salientar que, os NMPs de
coliformes termotolerantes e E. coli estão sempre acima dos 1.000 CT/100mL ou
800 E. coli/100mL após as cinco semanas consecutivas de coletas.
A relação inversa entre salinidade e pH com teores de fosfato, coliformes
termotolerantes e E. coli confirmam que a contaminação das praias por esgotamento
urbano é depurada pela lixiviação promovida pelas águas marinhas e,
provavelmente, seja a razão da menor contaminação apresentada pela galeria do
Náutico.
As correlações de coliformes termotolerantes e E. coli entre água e sedimento
não se mantêm quando o número de amostras é pequeno ou inexistente, mostrando
que monitorar sedimento para este tipo de contaminante pode gerar resultados
falso-negativo, o que gera risco à população usuária dessas praias e caracterizaria a
imprescindível medida desses parâmetros em água.
As concentrações dos metais-traço (Cu, Pb e Hg) apresentaram teores abaixo
dos preconizados pela Resolução 357/05 do CONAMA, não havendo correlação
entre os compartimentos água e sedimento, para esses metais, durante as
campanhas de amostragens em todo o período de estudo.
Os teores de fosfato na água apresentaram variação inversa com os
parâmetros salinidade e pH, mostrando que as águas marinhas também diluem esta
contaminação. Os teores de fósforo nas três galerias, em geral, estavam acima dos
valores estabelecidos (0,124 mg.L-1) pelo CONAMA e mostraram correlação estatisticamente significativa com os NMPs de coliformes termotolerantes.
O fosfato é o único parâmetro abiótico que pode facilitar o monitoramento da
balneabilidade na orla de Fortaleza, embora não se deva considerar para isto o
excedido, pode haver contaminação por coliformes acima do limite recomendável
para área própria ao banho. Assim sempre, deverá ser utilizada a equação obtida
neste trabalho para prever a possível contaminação por coliformes termotolerantes
e, no caso dela estar acima do recomendável, iniciar o monitoramento completo da
1- INTRODUÇÃO
1.1- Região Metropolitana de Fortaleza (RMF)
Na década de 70, Fortaleza presenciou mudanças na sua orla marítima como
a construção de hotéis, pousadas, restaurantes, estações balneárias, barracas,
loteamentos etc. Estas foram algumas das intervenções privadas com o respaldo de
políticas públicas que determinaram a verticalização da zona leste de Fortaleza. Uma
das conseqüências dessa expansão, iniciada com a obra do Porto do Mucuripe e dos
espigões, foram um notório recuo na linha de costa na área da praia de Iracema e na
costa oeste do município de Fortaleza (Vasconcelos & Albuquerque, 2003).
Após a implementação desta política de expansão, a população de Fortaleza
dobrou de 1970 a 1991, e atualmente já ultrapassa dois milhões de habitantes.
Apesar deste crescimento populacional, a infra-estrutura da cidade nos seus
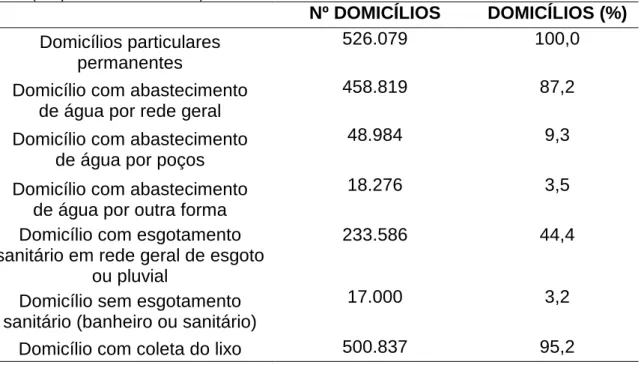
serviços básicos não acompanhou o desenvolvimento (Tabela 1) (IBGE, 2000).
TABELA 1 - Porcentagem dos domicílios servidos por água, saneamento básico e coleta de lixo em
Fortaleza (adaptado do IBGE, 2000).
Nº DOMICÍLIOS DOMICÍLIOS (%) Domicílios particulares
permanentes
526.079 100,0
Domicílio com abastecimento de água por rede geral
458.819 87,2
Domicílio com abastecimento de água por poços
48.984 9,3
Domicílio com abastecimento de água por outra forma
18.276 3,5
Domicílio com esgotamento sanitário em rede geral de esgoto
ou pluvial
233.586 44,4
Domicílio sem esgotamento sanitário (banheiro ou sanitário)
17.000 3,2
Domicílio com coleta do lixo 500.837 95,2
A ocupação do litoral de Fortaleza apresenta grandes contrastes, tanto no
comportamento da população como nas atividades produtivas. A ocupação é
desordenada e se divide em área para a população de baixa renda e outras para a
Além do crescimento populacional, houve o desenvolvimento de atividades
industriais e portuárias na RMF. Segundo dados da FIEC (2004), o município de
Fortaleza ocupa o primeiro lugar em quantidade de indústrias em todo o Estado do
Ceará. Estas indústrias drenam seus efluentes para o sistema de esgoto da cidade
que deságua na costa através do emissário submarino de Fortaleza.
O emissário submarino de Fortaleza (ESF), após tratamento primário dos
resíduos, destina quase 99% do esgoto doméstico coletado na RMF, tendo uma
vazão máxima de 4,2 m-3.s-1 e média de 1,4 m3.s-1 (Consórcio Concremat, 1993). O
lançamento de volumes consideráveis de esgoto doméstico e efluente industrial, sem
tratamento, nos oceanos e estuários, tem causado a contaminação das águas
marinhas e animais aquáticos com microrganismos patogênicos e compostos
tóxicos, pondo em risco a saúde pública (Sanchez et al., 1991; Menezes et al.,
2003).
O mais grave, porém, é que somente 44,4% dos domicílios de Fortaleza
contam com esgotamento sanitário que é descarregada na rede de esgoto. Além
disso, os 55,6% restantes dos domicílios possuem esgotamento sanitário do tipo
fossa séptica, rudimentar e vala, ou ainda, liberam seus efluentes diretamente para
drenagens superficiais (IBGE, 2000). Por outro lado, a vocação turística de Fortaleza
torna suas praias um recurso natural de importância econômica. Assim, a falta de
infra-estrutura que preserve a qualidade ambiental da zona urbana de Fortaleza é
um fator de depreciação do seu capital natural de alta vocação turística.
A Tabela 2 mostra um expressivo crescimento do turismo ao longo dos
últimos anos. E, analisando as estatísticas, dois fatos chamam a atenção: (1) o
turismo interno tem mantido sua intensidade desde 1998; (2) o fluxo de turistas
estrangeiros tem apresentado comportamento sempre crescente, onde no período
de 1998-2004 houve um incremento de 215,62% (IPECE, 2005).
TABELA 2: Demanda turística de Fortaleza entre 1998 a 2004 (adaptado do IPECE, 2005)
Anos
Meses 1998 1999 2000 2001 2002 2003 2004
Total 1.297.528 1.388.490 1.507.914 1.631.072 1.629.422 1.550.857 1.784.354
Os problemas ambientais têm se tornado cada vez mais críticos e freqüentes,
principalmente devido ao desmedido crescimento populacional e o aumento da
atividade industrial. Sendo a contaminação das águas naturais um dos grandes
problemas da sociedade moderna (Kunz et al., 2002).
Segundo dados das Nações Unidas, a população mundial tem expectativa
para crescer de 6,1 bilhões em 2000 para 8,3 bilhões em 2030. Em 2000, as
estimativas apontaram que 47% da população mundial já vivem em áreas urbanas e
a população urbana poderia exceder a 50% em 2007. No ambiente urbano, onde
atividades com emissão de metais e poluentes orgânicos são intensas,
inevitavelmente, o aumento da urbanização poderá acelerar a degradação e
contaminação dessas regiões (Wong et al., 2005).
A poluição de águas pluviais é um dos grandes problemas de áreas urbanas.
As cargas e concentrações de materiais em suspensão, nutrientes e outros
contaminantes são maiores em runoff de áreas urbanas que em áreas rurais ou
pouco impactadas. Assim, desde o início de 1970, muitos estudos têm sido
propostos para a modelagem da qualidade de águas pluviais. Os modelos atribuem a
poluição de águas pluviais a um processo de dois estágios: poluente estocado e
poluente lixiviado. O estoque é a acumulação do poluente na superfície do solo
durante o período de seca e a lixiviação é a remoção dos poluentes pela água da
chuva ou runoff urbano (Vaze & Chiew, 2002).
Recentemente, as águas pluviais de áreas urbanas têm sofrido bastante
atenção do público e da comunidade científica, devido às vastas fontes poluidoras
dos corpos d’água das regiões costeiras em todo o mundo. Mesmo com a separação
do sistema de drenagem pluvial do sanitário, o runoff de águas pluviais em áreas
urbanas tem contribuído como carga substancial dos poluentes aportados nos
corpos d’água (Schiff et al., 2002).
As fontes de contaminação das águas pluviais incluem runoff urbano e rural,
descargas de esgoto sem tratamento e excretas de animais de sangue quente. O
controle de qualidade das águas de áreas urbanas liberadas nos corpos d’água ao
longo da costa é muito importante. Por isso, pesquisas são essenciais para
identificar os tipos e as fontes poluidoras, bem como, o risco a exposição e impactos
potenciais à saúde (Cardonha et al., 2004).
O sistema de drenagem de áreas urbanas caracteriza-se pela passagem das
runoff depende da limpeza, intensidade e distribuição espacial e temporal das
chuvas, época do ano e utilização do espaço urbano (Vieira et al., 2002a).
Durante os primeiros eventos de chuvas, quantidades enormes de poluentes
são descarregadas nos corpos d’água. Runoff de águas pluviais tem sido identificado
como uma das causas de degradação da qualidade das águas, especialmente
durante as primeiras chuvas (Lee et al., 2002).
O runoff de águas pluviais urbanas pode ser altamente contaminado com
metais-traço e outros compostos tóxicos, representando uma significante fonte de
poluição não pontual dos corpos d’água urbanos e de localidades adjacentes.
Emissão em massa de runoff de águas pluviais urbanas podem ser tão
contaminadas quanto fontes pontuais, como por exemplo, efluentes de estações de
tratamento e descarga industrial. Fato que pode ser constatado em estudos
realizados no sul da Califórnia (Sabin et al., 2005).
1.3- Contaminação: Química e Biológica
1.3.1- Química
Metais-traço são os elementos químicos que ocorrem na natureza em pequenas
concentrações. Alguns desses metais como: Cu, Zn e Co são essenciais aos seres
vivos, ainda que em pequenas concentrações, tendo um importante papel no
metabolismo dos organismos aquáticos, pois participam de um grande número de
processos fisiológicos como, por exemplo, a cadeia respiratória (Cu). Outros
elementos-traço, como Hg, Cd, e Pb, não tem função biológica conhecida e são
geralmente tóxicos a uma grande variedade de organismos (Esteves, 1998;
Kucuksezgin et al., 2006). Sendo, importante salientar que, a remediação da
poluição por metais-traço é problemática devido à sua persistência e não
degradabilidade no ambiente (Yuan et al., 2004).
As atividades antrópicas figuram no rol das mais importantes entradas de
elementos traços tóxicos em águas, sedimento e biota. Elevadas concentrações de
cádmio (Cd), mercúrio (Hg), chumbo (Pb), estanho (Sn) e semi-metais, como o
arsênio (As), poderão produzir efeitos nocivos sobre os próprios organismos
aquáticos ou seus predadores, uma vez que podem ocorrer processos de
Em ambiente urbano, os metais-traço podem ser emitidos através de
numerosas fontes antropogênicas. Ações que causam notáveis impactos ao
ambiente urbano incluem atividades relativas ao tráfego (queima de combustíveis
fósseis, uso e desgaste de partes de veículos e escape de metais contidos no óleo
dos motores), atividades industriais específicas, destino dos resíduos municipais
(incineração ou aterros sanitários) e a corrosão de materiais de construção. A
utilização do carvão como fonte de energia pode ser uma importante causa de
emissão antropogênica de metais-traço, que são primariamente liberados para
atmosfera e, posteriormente, depositados nos solos e corpos hídricos (Councell et
al., 2004).
Os metais carreados pelo material particulado atmosférico permanecem no ar
até serem depositados no continente ou em corpos d’água. A dispersão e
distribuição geoquímica dos metais-traço dependem do tamanho das partículas e
das propriedades do substrato onde são depositados. A deposição em área urbana
pode ser removida e dispersada pelo vento, chuva e runoff superficial (Wong et al.,
2005).
Muitos rios e córregos em diversos países são fortemente poluídos devido às
descargas de efluentes industriais, domésticos e urbanos (Pekey et al., 2004). A
influência de esgoto doméstico e urbano promove a contaminação da região costeira
de forma significativa por metais, como exemplo, o mercúrio (Marins et al., 2004;
Mirlean et al., 2003).
As regiões costeiras são zonas de alta atividade reacional devido às rápidas
mudanças das condições ambientais decorrente da mistura das águas doces com as
águas salinas. O mercúrio, por exemplo, quando lançado no ambiente, sofre uma
série de transformações e interações com os constituintes ambientais, tais como:
oxidação do mercúrio metálico gasoso na atmosfera com posterior incorporação a
gotículas de água; conversão a derivados aquilmercurais de cadeia curta, com
acúmulo na cadeia alimentar; e deposição em sedimentos, que constituem
verdadeiros depósitos do metal (Marins et al., 2002).
Além da contaminação por metais-traço, os nutrientes são importantes fontes
de eutrofização dos corpos d’água. O fósforo (P) é um elemento essencial para a
vida dos organismos, sendo considerado um nutriente limitante na produtividade
deste elemento em processos fundamentais do metabolismo dos seres vivos como,
por exemplo, componente dos ácidos nucléicos e dos fosfolipídios (Esteves, 1998).
As fontes naturais de fósforo para os ambientes aquáticos são o intemperismo
de rochas fosfáticas (apatita), lixiviação dos solos e deposição atmosférica.
Enquanto, esgotos domésticos, efluentes industriais e agrícolas compreendem
aportes artificiais para os sistemas aquáticos. O aporte de compostos fosfatados
oriundos de fontes artificiais como os esgotos domésticos, efluentes industriais e o
uso de fertilizantes químicos na agricultura e aqüicultura representam sérios
problemas ambiental (Esteves, 1998; Paula-Filho, 2004).
A determinação do fósforo em matrizes ambientais assegura a saúde do
ecossistema, indica os processos biogeoquímicos (Paula-Filho, 2004) e monitora de
acordo com a legislação a presença do nutriente. O aporte do fósforo, através de
fontes pontuais e difusas, pode resultar no aumento da produtividade primária e
eutrofização dos corpos d’água, com potencial desenvolvimento sazonal de algas
tóxicas podendo ter grandes impactos na qualidade global das águas (Worsfold et
al., 2005; Smith et al., 2006).
Os esgotos urbanos, sem tratamento, contêm o fósforo principalmente como
ortofosfato e fosfatos inorgânicos condensados, oriundos de dejetos humanos e
efluentes domésticos. Um dos constituintes dos esgotos domésticos são os
polifosfatos presentes em produtos de limpeza cuja matéria-prima é o fosfato de
sódio (Na3PO4). E, estas cargas são lançadas diretamente nos cursos d’água na maioria das cidades brasileiras (Osório & Oliveira, 2001; Paula-Filho, 2004).
A matéria orgânica de origem antrópica guarda relações conhecidas de
carbono (C), nitrogênio (N) e fósforo (P). Concentrações dos compostos existentes
nos esgotos domésticos possuem razões C:N:P com pequenas variações
resultantes da especificidade regional. Por exemplo, em esgotos de cidades como
Belo Horizonte (região sul), essas razões são em média de 18:4:1, enquanto para as
concentrações dos esgotos da cidade de Fortaleza (região nordeste), as razões
encontradas foram de 20:5:1 (Abreu, 2004).
1.3.2- Biológica
A importância das bactérias em regiões costeiras é grande devido à entrada
mudanças quantitativas e qualitativas nas características ambientais devido à
influência antrópica (Kolm & Andretta, 2003). Esgotos são as maiores fontes de
contaminação fecal dos ecossistemas aquáticos que causam sérios distúrbios ao
funcionamento ecológico, apesar dos ecossistemas apresentarem grande
capacidade depurativa (George et al., 2002).
As bactérias do grupo coliforme são definidas como bastonetes
Gram-negativos, aeróbios ou anaeróbios facultativos, não formadores de esporos, que
fermentam lactose com produção de gás em 48 horas de incubação a 35 ºC
(Tortora, 2003). E, o grupo dos coliformes fecais é formado pelos coliformes que
fermentam lactose, com produção de gás dentro de 48 horas, em temperaturas entre
44,5 e 45,5 ºC. Podem ser recuperadas por este teste a Escherichia coli, Citrobacter
freudii e Enterobacter spp. (Vieira, 2004).
A Escherichia coli é um habitante normal do trato intestinal de humanos e
outros animais de sangue quente, sendo, considerada o tipo fecal de coliforme de
maior importância nos estudos onde se deseja constatar contaminação por esgotos
(Vieira et al., 2001a). Segundo a Agência de Proteção Ambiental do Estados Unidos
(EPA), a E. coli é o melhor indicador de poluição fecal para avaliar a qualidade de
corpos d’água. A presença da bactéria indica a contaminação da água por material
fecal humano ou de outros animais de sangue quente, e ainda, a presença potencial
de organismos patogênicos (An et al., 2002).
Fontes de contaminação por coliformes termotolerantes nas águas superfícies
incluem descargas de efluentes urbanos, fossas sépticas, runoff de agricultura e
chuva, poluição por animais e fontes não pontuais de resíduos antrópicos (An et. al.,
2002; Vieira et al., 2002a).
As águas de praias contaminadas pela descarga de esgotos domésticos
podem representar um risco à saúde dos banhistas e freqüentadores, sendo as
crianças e idosos, ou ainda, pessoas com baixa resistência, as mais suscetíveis à
exposição a bactérias, vírus e protozoários (CETESB, 1999).
As areias são regiões de transição entre o continente e o mar, estando
sujeitas a interferência de ambos os ecossistemas. A contaminação das areias das
praias pelo descarte de lixo, dejetos de animais ou poluição trazida pelas águas das
chuvas e marés um problema crescente, que colocam em risco a saúde da
costeiras, prejudicando o lazer de quem as usufrui e tornando-as potencialmente
perigosas para os habitantes locais (Vieira et al., 2001b).
O programa de monitoramento de balneabilidade das praias deve ser
estruturado para atender as especificações da Resolução 274/00 do Conselho
Nacional do Meio Ambiente (CONAMA), que define critérios para a classificação das
águas destinadas à recreação de contato primário. Desde 1978, o monitoramento
das praias de Fortaleza é realizado em 31 pontos de coleta distribuídos ao longo do
litoral, numa extensão de 25 km, entre os rios Cocó e Ceará, divididos em três
setores: Leste (Rio Cocó a Praia do Farol), Centro (Praia do Iate a Ponte Metálica) e
Oeste (Poço da Draga ao Rio Ceará) (Soares, 1999; SEMACE, 1992).
No setor Leste, de 1978 a 1987, quase todas as praias apresentaram
excelente qualidade (≤250 CF/100mL). No entanto, nos anos 1985 e 1986, as praias do Farol, Futuro e Caça e Pesca apresentaram contaminação um pouco maior (≥430 CF/100mL). Porém, nos anos de 1988 a 1997, a praia do Farol apresentou durante
esse período valores de coliformes fecais superiores aos padrões do CONAMA,
sendo o aumento da contaminação atribuída ao processo de urbanização
espontânea na área (Almeida et al., 1998).
No setor Centro, de 1978 a 1987, todas as praias foram próprias para banho.
Nos anos de 1985 a 1987 os resultados foram maiores que os preconizados pela
legislação nas praias da Estátua de Iracema, Náutico e Ideal com índices inferiores
ou iguais a 2300 CF/100mL. Contudo, nos anos de 1988 a 1997, houve um aumento
na presença de coliformes fecais nestas praias. Esta contaminação foi atribuída a
forte ocupação urbana, ligações clandestinas ao sistema de drenagem pluvial,
riachos poluídos e a maior concentração dos serviços hoteleiros e turísticos da
cidade (Almeida et al., 1998).
No setor Oeste, as praias são as mais poluídas devido à alta densidade
ocupacional, inexistência de rede de esgoto até 1996, riachos poluídos e presença
de lixo nas galerias pluviais ou mesmo em vias públicas próximas ao mar. As praias
das Goiabeiras e Leste-Oeste são as de melhor qualidade e as demais se
mostraram sempre impróprias. No período de 1988 a 1987, um retrato claro da
influência da ocupação urbana é evidenciado por um crescimento considerável da
contaminação fecal em quase todas as praias (Almeida et al., 1998).
A Secretaria de Meio Ambiente do Ceará (SEMACE) divulga semanalmente
escoamento superficial de águas pluviais ao longo da orla, riachos e rios poluídos
(Soares, 1999), alta densidade populacional, domicílios não integrados à rede
sanitária e falta de educação ambiental e sanitária às comunidades fazem o
programa de monitoramento pouco abrangente.
Outra questão que deve ser contemplada diz respeito à metodologia utilizada
no monitoramento. Molina et al. (2001), correlacionaram indicadores biológicos e
químicos na avaliação da qualidade de corpos d’água, sendo vantajoso a utilização
de parâmetros químicos por facilitar o controle da contaminação fecal, uma vez que,
requerem menor tempo de análise e não são senescentes. Além disso, a grande
variabilidade do parâmetro biológico demanda uma freqüência amostral maior, que
restringe e pontua a contaminação somente a eventos de emissão de esgoto
coincidentes a épocas de amostragem. Fato que onera o custo do monitoramento
ambiental e nem sempre quantifica as reais condições de contaminação de uma
área costeira.
1.4- Compartimentos Ambientais: Água e Sedimento
Os ciclos biogeoquímicos nas zonas costeiras têm sido alterados pelas
atividades humanas, devido à entrada de contaminantes, como por exemplo os
metais e nutrientes, oriundos de fontes pontuais e difusas.
Sedimentos são parte integrante destes ciclos que, dependendo da
composição química e características de adsorção, podem ter alta capacidade de
acumular contaminantes orgânicos e inorgânicos. Contudo, as mudanças das
condições ambientais podem facilmente disponibilizar os contaminantes para o
sistema aquático. Assim, os sedimentos podem atuar tanto como fonte ou
sumidouros dos contaminantes, tendo sido um tópico relevante nas pesquisas de
monitoramento ambiental ao longo de anos (Guevara-Riba et al., 2006).
A habilidade dos sedimentos para concentrar e reter elementos deve-se a
fatores como propriedades físicas, por exemplo, tamanho do grão, e área da
superfície do sedimento (Conrad & Chisholm-Brause, 2004). Metais-traço tendem a
ser aprisionados em ambientes aquáticos e acumulados nos sedimentos, onde
podem ser utilizados diretamente pela fauna bentônica ou voltar para coluna d’água
através de resuspensão do sedimento, reações de adsorção/desorção, reação de
importante salientar que a concentração total de um metal no sedimento não está
diretamente biodisponível aos organismos (Peltola et al., 2005).
Quando se enfoca a presença de contaminantes, como por exemplo, o
mercúrio em corpos hídricos, tem-se que imaginar dois sistemas distintos mas em
profunda interação: a água (fase líquida) e o sedimento (fase sólida). A partição do
Hg e de seus compostos nos compartimentos foi medida inicialmente por volta dos
anos 60, antes da presença do metal se tornar interesse de ambiental global. E, nos
estudos, dependendo da localização, a concentração variou de 10 a 200 µg/kg. A
grande maioria das análises indica que os sedimentos dos sistemas aquáticos têm
sido contaminados pelo Hg e que a taxa vem aumentado desde o século passado.
Em alguns locais, onde foram realizadas novas medições, a concentração do metal
aumentou de 5 a 10 vezes. E, nos ecossistemas aquáticos, houve um aumento de 2
a 5 vezes no nível de contaminação desde os tempos pré-industriais (Azevedo,
2003).
A toxidez dos metais traço reside principalmente na sua capacidade de
interferir em processos enzimáticos e na baixa mobilidade no organismo. Esta baixa
mobilidade faz com que os metais se acumulem, provocando modificações no
metabolismo, podendo causar a morte dos organismos afetados (Esteves, 1998).
Visto que os organismos aquáticos tendem a acumular metais-traço e
contaminantes orgânicos em seus tecidos, mesmo quando a água possui níveis
desses compostos abaixo da concentração máxima permitida pela legislação, há
riscos de contaminação dentro da cadeia trófica. No caso de peixes, a ingestão de
alimentos e água é a rota principal de entrada dos contaminantes nesses
organismos. Animais filtradores como mexilhões, filtram vários litros de água por
hora e conseqüentemente podem concentrar de 10 a 105 vezes mais metais em seus tecidos com relação à água do mar. Se a fração tóxica de um metal encontrada num
corpo d’água for alta o suficiente para inibir o crescimento de apenas uma parte da
comunidade fitoplanctônica, ou seja, pode acarretar o comprometimento de toda a
cadeia trófica, levando em conta a bioacumulação e os efeitos crônicos que o metal
pode causar (Campos et al., 2002). Pois, alguns são muito estáveis quimicamente,
podendo causar sérios danos aos organismos, sendo o sistema nervoso o alvo
principal (Malm, 2005).
O estudo dos ciclos biogeoquímicos dos elementos no solo, água e ar é de
ambientes. O monitoramento ambiental utiliza rotineiramente os coliformes fecais
para monitorar os sistemas aquáticos por contaminação de esgoto. Mas, pode-se
também fazer o monitoramento da contaminação por efluentes domésticos através
da avaliação dos teores de nutrientes e metais-traço, em sedimento e água, das
áreas afetadas (Wasserman & Queiroz, 2004).
E, vale salientar que, medir os teores de contaminantes em sedimento facilita
o monitoramento ambiental, visto que, este compartimento diferentemente da água e
sua dinâmica, possui um caráter integrador demonstrando com maior facilidade a
presença de contaminantes ao longo de ciclos temporais. Além disso, devido a esta
capacidade integradora, os teores de contaminantes em sedimento são em geral,
ordens de grandezas, maiores que os teores em água o que resulta em
barateamento e facilitação analítica do monitoramento ambiental. Entretanto, por
seus diferentes usos a monitoração de águas é imprescindível, pois integra as
preocupações do desenvolvimento sustentável, baseado nos princípios da função
ecológica da propriedade, de prevenção, da precaução, do poluidor-pagador, do
usuário pagador e da integração, bem como no reconhecimento do valor intrínseco à
4- MATERIAIS E MÉTODOS
4.1- Amostragem
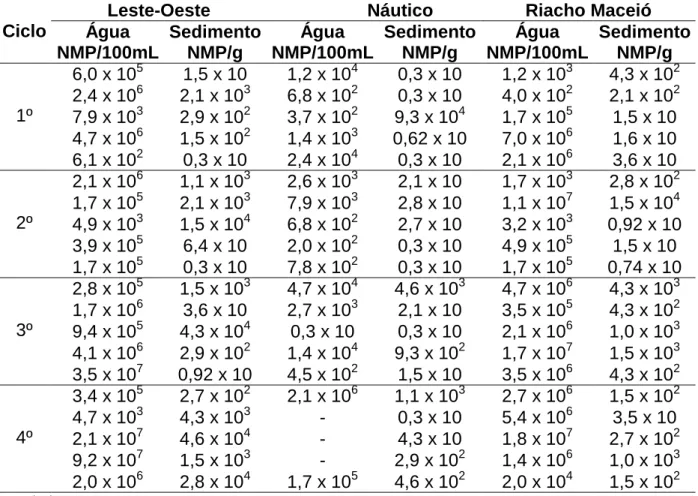
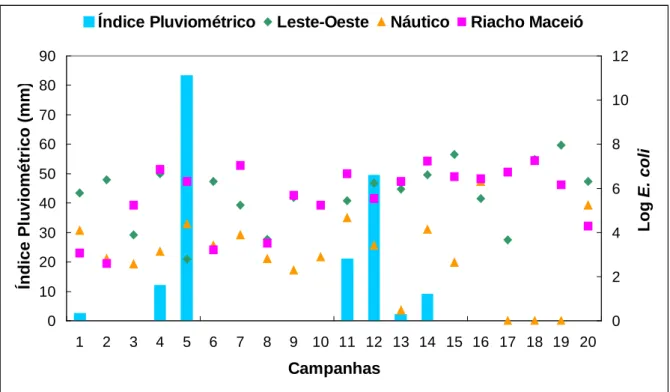
As coletas foram realizadas em quatro ciclos de amostragens (Tabela 4) nos
três pontos ao longo da costa de Fortaleza (Figura 1). Cada ciclo compreendeu um
período de cinco semanas consecutivas de coletas, a fim de atender as
especificações da Resolução 274/00 do CONAMA, quanto à determinação da
balneabilidade. A amostragem contemplou duas estações chuvosas (1º e 3º ciclos) e
duas estações secas (2º e 4º ciclos).
Todos os pontos foram amostrados durante as campanhas, onde foram
coletadas amostras de água e sedimento para análises químicas e microbiológicas.
Para as análises químicas, as amostras de sedimento foram coletadas com auxílio
de espátula e sacos plásticos e as amostras de água armazenadas em garrafas PET.
Para as análises microbiológicas, as amostras de sedimento foram coletadas em
recipientes estéreis e as amostras de água coletadas em garrafas âmbar estéreis.
Todas as amostras foram acondicionadas em caixa isotérmica até o laboratório.
TABELA 4: Os quatro ciclos de amostragens, com o início e término de cada período.
Ciclo Início Término
1º 24/05/04 28/06/04
2º 09/09/04 04/10/04
3º 23/05/05 20/06/05
4º 10/10/05 08/11/05
4.2- Caracterização Hidroquímica
As variáveis hidroquímicas temperatura, pH, oxigênio dissolvido e salinidade
foram medidas in situ, utilizando a sonda portátil YSI 85 - Oxygen, Conductivity,
Salinity and Temperature, previamente calibrada, e o pHmetro ORION modelo 250
4.3- Análise Bacteriológica
4.3.1- Coliformes Termotolerantes (CT) e Escherichia coli em Água
Para determinação de coliformes termotolerantes, as amostras de água foram
coletadas em frascos âmbar estéreis de 1 L e acondicionados em caixa térmica a
4ºC até a chegada ao laboratório.
O Número Mais Provável (NMP) de coliformes termotolerantes foi obtido
segundo estimativa quantitativa proposta por Hoskins (Garthright, 2001). Para a
prova presuntiva em água, a técnica consiste em baterias de cinco tubos de Caldo
Lauril inoculados com 1 mL da amostra em seis diluições seriadas. Para as diluições,
uma alíquota de 1 mL da amostra foi inoculada em 9 mL de Salina (solução de NaCl
a 0,85%), correspondendo à diluição 10-1. Então, 1 mL da diluição 10-1 foi retirado e inoculado em 9 mL de Salina a 0,85% para constituir a diluição 10-2. E, assim, sucessivamente até a diluição 10-6.
Após 48 h de incubação, em estufa bacteriológica a 35 ºC, as amostras
positivas foram repicadas para o Caldo EC a 44,5ºC por 24 h, em banho-maria,
sendo considerado positivo, o tubo com a turvação do meio e produção de bolha no
tubo de Durhan (Anexo A).
Conforme o número de tubos positivos no caldo EC consultava-se a tabela do
NMP para a estimativa da população de coliformes termotolerantes (CT),
caracterizando a prova confirmatória (Anexo B). Para o cálculo do NMP, de qualquer
série de inóculo, usa-se o número da tabela e multiplica-se pelo inverso da diluição
média da série crítica dos três tubos selecionados, sendo o resultado expresso em
NMP/100mL (Vieira, 2004).
4.3.2- Coliformes Termotolerantes (CT) e Escherichia coli em Sedimento
Para análise do sedimento foi utilizada uma bateria de 3 tubos. Sendo, 25g da
amostras pesadas e adicionado a 225 mL de Salina (solução de NaCl a 0,85%),
correspondendo a diluição 10-1, sendo as diluições seguintes similares as utilizadas para a água (Anexo C).
As demais etapas no sedimento são semelhantes ao procedimento das
multiplica-se pelo inverso da diluição média da série de três tubos selecionada,
sendo o resultado expresso em NMP/g (Anexo D). Para o cálculo é aplicada a
fórmula (NMP da tabela x fator de diluição média/100) (Vieira, 2004).
4.3.3- Provas Bioquímicas (Completa) – Isolamento de Escherichia coli
Depois de determinado o NMP dos coliformes termotolerantes, cada tubo
positivo do Caldo EC foi estriado em placa de Petri com ágar Eosina-Azul de
Metileno (EMB) e incubado a 35 ºC por 24 horas, em estufa bacteriológica. Após
crescimento, foram isoladas colônias típicas de E. coli de cada placa e inoculadas
em Ágar Tripticase de Soja (TSA) e, posteriormente, incubadas à 35ºC por 24 h. Os
testes bioquímicos foram realizados a partir dos inóculos do ágar TSA (Vieira, 2004) .
4.3.3.1- Teste da Produção de Indol
Com a utilização de uma agulha previamente flambada, retirou-se o inóculo
do ágar TSA e com uma leve picada foi transferido para o ágar Sulfeto Indol
Motilidade (SIM), o qual foi mantido em estufa por 48 horas a 35ºC. Um crescimento
para as laterais indica motilidade.
A bactéria E. coli utiliza o triptofano, para a produção de indol, que ao reagir
com 0,2 mL do reativo 4-dimetilaminobenzaldeído (KOVACS), que foi adicionado ao
meio, forma um anel vermelho, indicando prova positiva (Vieira, 2004).
4.3.3.2- Teste do Citrato de Simmons
O inóculo foi estriado sobre a superfície inclinada do ágar Citrato de
Simmons. Após 96 horas em estufa a 35ºC, algumas bactérias utilizaram o citrato
como única fonte de carbono provocando a elevação do pH do meio de cultivo
devido a metabolização do íon citrato. A utilização do citrato é indicada pela
mudança na coloração do meio, principalmente no ápice que se torna azul intenso.
4.3.3.3- Teste do Vermelho de Metila
Para a realização deste teste, o inóculo foi transferido para o Caldo Vermelho
de Metila-Voges Proskauer (VM-VP) e incubado por 96 horas a 35ºC. Após este
período de incubação, adicionou-se 5 gotas da solução de vermelho de metila. O
desenvolvimento de um anel de cor vermelha indica que o teste é positivo.
E. coli é positiva para essa prova (Vieira, 2004).
Esta prova testa a habilidade de certos microrganismos de produzirem e
manterem estáveis os produtos ácidos finais da fermentação da glicose.
4.3.3.4- Teste de Voges Proskauer
Este teste comprova a habilidade de certos microrganismos em produzirem
um composto neutro, acetilmetilcarbinol, durante a fermentação da glicose.
Para o teste, o inóculo retirado do TSA foi transferido para o caldo VM-VP,
posteriormente, incubado por 48 horas a 35ºC. Após o período de incubação, foi
adicionado para cada mililitro de cultura, 0,6 mL do reagente Barrit I (2,5 g de C10H8O em 50 mL de etanol (C2H6O)) e 0,2 mL do reagente Barrit II (40g de hidróxido de potássio (KOH) em 1L). O desenvolvimento de uma coloração rósea a vermelho
rubro, indica prova positiva. E. coli é negativa para esta prova (Vieira, 2004).
4.4- Determinação de Fósforo Total
4.4.1- Fosfato em Água
As amostras foram coletas em garrafas PET e acondicionadas em caixas
térmicas. No laboratório, alíquotas de 30 mL das amostras foram transferidas para o
tubo digestor e adicionado 4 mL do reagente de oxidação (RO), composto de
peroxodisulfato de potássio (K2S2O8) (5% p/v) e ácido bórico (H3BO3) (3% p/v) em
meio básico. As amostras foram autoclavadas por 30 minutos com uma pressão de
1.5-2 atm.
Após a autoclavagem, as amostras foram homogeneizadas para dissolução
de possíveis precipitados. Sendo, adicionado ao conteúdo do frasco de oxidação,
homogeneizado e descartado uma alíquota de 10 mL, com posterior adição de 0,7
mL da solução de ácido ascórbico (C6H8O6) e, 2 minutos depois, 0,5 da mistura de reagentes (heptamolibidato de amônio ((NH4)6Mo-O24.4H2O) e tartarato de antimônio e potássio (K(SbO)C4H4O6) com o volume ajustado para 1 L com ácido sulfúrico (H2SO4) 4,5 M) (UNESCO,1995).
O mesmo procedimento foi realizado para a duplicata dos brancos e solução
padrão para confecção da curva. Sendo, as leituras determinadas por
espectrofotometria de absorção molecular em comprimento de onda de 880 nm,
utilizando um espectrofotômetro MICRONAL modelo B582 (Anexo E).
4.4.2- Fósforo Total em Sedimento
As amostras de sedimento foram coletadas em sacos plásticos e
acondicionadas em caixas térmicas. No laboratório, foram previamente secas em
estufa à uma temperatura de 60ºC e peneiradas em malha de nylon na fração total
(< 2000 µm), para normalização do efeito da granulometria dos sedimentos sobre os
teores do elemento de interesse.
Para a determinação de fósforo total (PT), 2g de sedimento foi calcinado por
12 horas à 550ºC. Após calcinação, as amostras foram digeridas em 25 mL solução
de ácido clorídrico (HCl) 1,0M sob agitação por 16 horas. A elevada temperatura de
combustão promove a oxidação da matéria orgânica e dos carbonatos, liberando o
fósforo associado a estes carreadores geoquímicos (Berner & Rao, 1994).
Após lixiviação das amostras, uma alíquota dos extratos foi diluída em balões
volumétricos de 100 mL na proporção de 1:5, sendo adicionado em seguida 2 mL de
ácido ascórbico e 2 mL da mistura de regentes colorimétricos (Koroleff, 1976). Após
esta adição, os íons ortofostato e molibdato condensam-se em meio ácido para dar o
ácido molibdofosfórico, que sofre redução e origina um composto colorido, o azul de
molibdênio. A intensidade da cor azul é proporcional à quantidade de fosfato
incorporada inicialmente ao heteropoliácido (Vogel, 2002).
Após 10 minutos, as leituras foram determinadas por espectrofotometria de
absorção molecular em comprimento de onda de 880 nm, utilizando um
4.5- Metais-traço
4.5.1- Metais-traço (Cu, Hg e Pb) em Água
Para a determinação de Cu e Pb em água, as amostras foram coletas em
garrafas PET e congeladas. A digestão foi realizada com ácido nítrico (HNO3) concentrado suprapur, a frio, e determinadas por espectrofotometria de absorção
atômica utilizando a técnica de forno de grafite, segundo metodologia do Laboratório
PROTEE da Université du Sud Toulon et du Var, onde foram realizadas as análises.
As amostras de água para determinação de mercúrio total foram coletadas em
garrafas PET e refrigeradas à 4ºC. O Hg total inclui todas as espécies de mercúrio
dissolvidas e particuladas presente na amostra (Marins et al., 2002).
Para a análise do Hg total, alíquotas de 40 mL, depois de oxidadas com 10
mL de água-régia 50% (4H2O:3HCl:1HNO3) a 70-80 ºC por 1 hora, foram reduzidas com cloreto estanoso (SnCl2) a 10%, contendo 1% de ácido ascórbico (C6H8O6) em solução de 1% de acido clorídrico (HCl) 1% (Paraquetti et al., 2004).
A determinação do mercúrio nas amostras de água foi realizada por
espectrofotometria de fluorescência atômica usando a técnica de geração de vapor
frio (CVAFS), no comprimento de onda de 253,7 nm utilizando com equipamento
Tekran Modelo 2600.
4.5.2- Metais-traço em Sedimento
As amostras de sedimentos foram coletadas em sacos plásticos e
acondicionadas em recipiente térmico com temperatura de 4ºC. No laboratório, o
sedimento foi seco em estufa a uma temperatura de 60 a 70 ºC e peneirado em
malha de náilon de 0,6 mm para uniformizar as amostras pela retirada de grãos
maiores e fragmentos de concha. Sendo, estocados em frascos herméticos,
protegido de calor e luz (Machado et al., 2002) (Anexo G).
Para a digestão, foi pesado em erlenmeyer 4g da amostra previamente seca e
adicionado 10 mL de água-régia (3HCl: 1HNO3) diluída a 50% de água. Os erlenmeyers foram devidamente vedados, com dedo frio preenchido de água
destilada, e levados ao banho-maria na chapa aquecedora a uma temperatura 70 ºC,
repouso para retornar à temperatura ambiente e logo após acondicionados a 4 ºC,
até posterior leitura (Fiszman et al., 1984).
A digestão das amostras foi certificada através da digestão em paralelo do
padrão certificado NIST (Standart Reference Material 1646a-Estuarine Sediment) e
do branco, sendo todos em duplicata para cada batelada de análise.
Os metais-traço cobre (Cu) e chumbo (Pb) foram determinados a partir dos
extratos obtidos após digestão por espectrofotometria de absorção atômica utilizando
a técnica de chama (AAS), cujo equipamento utilizado foi o modelo AA-6200 da
Schimadzu. A chama para leitura dos extratos era a mistura do gás acetileno
(combustível) e o ar (oxidante), chegando a uma temperatura máxima de 2300 ºC.
Na análise de mercúrio em sedimento foi utilizado o aparelho de
espectrofotometria de absorção atômica Bacharah Modelo 2500. No borbulhador foi
adicionada uma alíquota de 2 mL do extrato ácido e 2 mL da solução de cloreto
estanoso (SnCl2), para a redução do mercúrio iônico presente para a forma elementar (Hg0 (V)). O vapor gerado foi carreado por um fluxo de ar para a célula de leitura (Marins, 1998).
Os equipamentos (AAS e Bacharah) foram calibrados a partir de curvas
analíticas construídas por soluções padrões de Cu, Pb e Hg, obtidas por diluições de
padrões de 1000 mg/L (Merck). As concentrações finais dos metais foram obtidas
através das equações de calibração, corrigidas pelos fatores de diluição dos
extratos, quando necessário, e pelo volumes dos extratos. Os resultados foram
expressos em µg.g-1 (Cu e Pb) e ng.g-1 (Hg).
O teor do metal [Me] analisado é dado pela seguinte expressão:
[Me] = (C x V x f) / m, onde:
C - concentração em µg/mL (Cu e Pb) e ng/g (Hg) obtida através da
curva de calibração do metal;
V - volume total do extrato;
f - fator de diluição;
4.6- Análise Estatística
No tratamento estatístico dos dados foram utilizadas a análise de variância
(ANOVA) e a correlação de Pearson através do programa StatSoft. Inc. (2001).
STATISTICA, versão 6 (www.statsoft.com).
A análise de variância é um teste para determinar se as médias de duas ou
mais populações são iguais. Este teste pode ser utilizado para determinar se as
médias amostrais sugerem diferenças efetivas entre as populações, ou se tais
diferença decorrem apenas da variabilidade amostral (Stevenson, 1981). A
metodologia ANOVA calcula a variabilidade total existente na característica ou
variável em análise, atribuindo essa variabilidade a uma causa determinista ou
aleatória. A ANOVA foi aplicada para identificar a variabilidade das concentrações
dos contaminantes no ponto de coleta em relação às semanas amostradas e a
variabilidade das concentrações dos contaminantes nos diferentes pontos de coleta.
A análise de correlação determina a força do relacionamento entre duas
observações emparelhadas. E o grau desse relacionamento entre duas variáveis
contínuas é sintetizado por um coeficiente de correlação (r de Pearson) (Stevenson,
1981). A correlação de Pearson foi aplicada a fim de identificar as correlações
existentes entre os contaminantes nos dois compartimentos (água e sedimento)
2- OBJETIVO
2.1- Objetivo Geral
Investigar a presença de metais-traço, fosfato, coliformes fecais
(termotolerantes) e Escherichia coli na água e sedimento de sistemas de drenagem
pluvial de Fortaleza, que freqüentemente encontram-se contaminados por esgoto
doméstico. Essa investigação tem como intuito aumentar a representatividade de
medidas de balneabilidade das praias de Fortaleza, a partir de outros parâmetros
além das medidas de coliformes termotolerantes.
2.2- Objetivos Específicos
Detectar a presença de cobre (Cu), chumbo (Pb) e mercúrio (Hg) na água e
sedimento de galerias pluviais, utilizando espectrofotometria de absorção
atômica (técnicas de chama, forno de grafite, vapor frio e fluorescência);
Determinar os teores de fósforo total (PT) em água e sedimento, através de
espectrofotometria de absorção molecular na região do visível;
Avaliar a qualidade bacteriológica de amostras de água e sedimento utilizando
o número mais provável (NMP/100mL e NMP/g) de coliformes fecais
(termotolerantes) e Escherichia coli na água e sedimento dos pontos
amostrados;
Correlacionar os parâmetros abióticos e bióticos analisados para qualificar
melhor a área de estudo visando simplificar as medidas de balneabilidade das
praias de Fortaleza (CE), através da determinação do parâmetro abiótico que
se correlacione significativamente com os NMPs de coliformes