Mestrado Integrado em Medicina Veterinária
Ciências Veterinárias
Anestro Pós-Parto em Bovinos
Ensaio farmacológico para a sua manipulação
Marlene Eduarda Álamo Ribeiro
Orientador: Professora Doutora Rita Payan Carreira Co-orientador: Dr. João Manuel Raposo Vidal
"To
accomplish great things
,
we must not only act
,
but also dream
;
not only plan
,
but also believe
."
Agradecimentos
Quero agradecer a todas as pessoas que directa ou indirectamente contribuíram para a realização deste trabalho, em especial:
À Professora Doutora Rita Payan Carreira por ter aceite ser minha orientadora, pelos conselhos, criticas ao longo de todo trabalho e principalmente pela sua infindável paciência. Aos veterinários e funcionários da Associação Agrícola de São Miguel, em especial ao Dr. João Vidal por ter orientado o meu estágio, por tudo o que me ensinou, pelo apoio que demonstrou ao longo de todo este percurso e pelo seu bom humor e à Sra. Lina Rebelo pela simpatia, disponibilidade e pela ajuda que me prestou na recolha dos dados.
Ao professor Doutor Jorge Colaço pela disponibilidade e ajuda que me prestou no decorrer deste trabalho.
À MSD Saúde Animal, através do seu director da área dos bovinos, o Dr. Tiago Teixeira pela cedência das hormonas utilizadas neste estudo, indispensáveis à realização deste trabalho. Aos produtores, o Sr. José Vidal, o Sr. Rui Ferreira, o Sr. Miguel Tomé, o Sr. Arlindo e Lázaro Silva Almeida e o Sr. Olávo Massa por terem permitido a realização deste estudo nas suas explorações.
A todos os meus amigos que, ao longo de todos estes anos, me apoiaram, me aturaram, me fizeram rir e que nunca desistiram de mim, nem como pessoa nem como amiga.
Aos meus pais, pois foi graças ao esforço e apoio de ambos que eu cheguei onde cheguei; em particular, agradeço à minha mãe, pois sempre me incentivou a seguir e a conquistar o meu sonho e que sempre acreditou na pessoa que sou hoje e na pessoa que serei amanhã.
À minha irmã, por ser como é, e por ter o dom de me chamar à “realidade” mesmo quando esta não é fácil de se aceitar.
Ao “Zorro” por ter sido, ao longo destes últimos anos, o meu fiel amigo. A todos o meu profundo e sentido agradecimento.
Resumo
Uma queixa frequente acerca das vacas de aptidão leiteira, em particular de genética Holstein-Frisian, é a dificuldade em retomarem a actividade cíclica regular após um parto de forma a permitir atingir a meta de um parto/ano, sobretudo quando se trata de fêmeas de produção mais elevada. Com o intuito de se encurtar o período de anestro pós-parto e aumentar a eficiência reprodutiva é frequente o recurso ao uso de hormonas, como a Prostaglandina F2α (PGF2α), a hormona libertadora de gonadotropina (GnRH) e a hormona
Coriónica Humana (hCG), que, em separado ou associadas, aceleram a involução uterina e sincronizam o momento do cio e ou/ovulação sem recurso à detecção de cio.
Com este trabalho pretendeu-se avaliar os efeitos da aplicação de duas doses de prostaglandina F2α (PGF2α; Estrumate®) na progressão da involução uterina após o parto
(Estudo 1) e avaliar o êxito de um protocolo de Ovsynch modificado, o hCG-synch (Estudo 2), em 5 explorações da ilha de São Miguel, através da análise comparativa das taxas de gestação entre grupos de animais tratados e não tratados. Em relação ao primeiro trabalho não se conseguiu encurtar, de modo significativo, a involução uterina, pois no momento da avaliação do tracto genital, a partir dos 65 dpp, todos os animais (n=45) tinham a involução uterina completa e retomado actividade ovárica, à excepção de 2 animais do grupo de controlo que se encontravam ainda em anestro. Relativamente ao estudo 2, com a introdução destes protocolos na exploração que mostrou melhor resposta ocorreu a redução do intervalo entre partos, intervalo parto-primeira IA, intervalo parto – IA fecundante, do número de IA por fecundação e uma melhoria das taxas de gestação. Os dois protocolos utilizados no estudo, o Ovsynch como o hCG-synch, influenciaram de forma significativa e muito significativa os parâmetros reprodutivos, mas no que diz respeito as taxas de gestação, estatisticamente as diferenças encontradas entre os 2 grupos não foram significativas. Em relação ao protocolo hCG-synch, tanto o grupo tratado com a primeira dose de Chorulon® de 1500 U.I como o grupo tratado com primeira dose de Chorulon® de 4500 U.I, influenciaram de forma significativa e muito significativa os parâmetros reprodutivos; as taxas de gestação decorrentes da aplicação do hCG-synch, independentemente da dose aplicada foram semelhantes e as diferenças encontradas entre os dois grupos foram estatisticamente não significativas.
Abstract
A frequent complaint about dairy cows, in particular from Holstein-Frisian genetics, is the difficulty in resuming postpartal regular cyclic activity and, particularly in high producing cows, to achieve a birth per year. In order to shorten the period of postpartum anestrus and increase reproductive efficiency is frequently necessary to use of hormones, like prostaglandin F2α (PGF2α), gonadotropin-releasing hormone (GnRH) and human chorionic hormone (hCG), in which alone or associated, to accelerate uterine involution and to synchronize the timing of estrus and / or ovulation without the use of heat detection, in an attempt to reduce the calving-fertilization interval.
This work aimed to further evaluate the effects of the application of two doses of prostaglandin F2α (Estrumate ®), in the progression of uterine involution after parturition (Study 1); and to compare the success of two synchronization protocols with fixed time insemination (the Ovsynch protocol, the hCG-synch) (Study 2) on 5 farms in the island of São Miguel, through comparative analysis of pregnancy rates between groups of treated and untreated animals. Regarding the treatment with Estrumate® we could not get to any real conclusion because during the evaluation, on 65 dpp, of the genital tract, all animals (n=45) had completed their uterine involution and resumed their ovarian activity, except for two animal in the control group, who were in anestrus.
For Ovsynch and hCG-synch protocols, they apparently reduced the following intervals: intercalving, calving to first IA, calving to conception, along with reduction of the number of IA per conception and improvement of the pregnancy rates. Theses protocols had a significant and a very significant influence in the reproductive parameters, but in terms of pregnancy rates, statistically the differences found between the two groups were not significant. And for the groups treated with the hCG-synch protocol with different doses of Chorulon®, both of them had a significant and a very significant effect on the reproductive parameters, and regardless of the applied dose, the pregnancy rates where similar and the differences found between the two groups were not statistically significant.
Índice Geral
Resumo ... iv
Abstract ... v
Índice de Figuras ... vii
Índice de Quadros ... vii
Listas de Siglas/Acrónimos, Abreviaturas e Sinais/ Símbolos ... ix
Parte I - Anestro Pós-Parto e Protocolos de Sincronização do Cio e da Ovulação .... xi
1.Introdução ... 1
2. Anestro Pós-Parto... 2
2.1. Involução Uterina ... 3
2.1.1.Mecanismos da Involução Uterina ... 4
2.1.2. Função da Prostaglandina F2alfa na Involução Uterina ... 7
2.1.3. Factores que Fazem Variar a Duração da Involução Uterina ... 12
2.2. Reinício da Actividade Ovárica e o Retomar da Ciclicidade... 13
2.2.1. Maturação do Eixo Hipotálamo-Hipófise ... 14
2.2.2. Desenvolvimento Folicular Após o Parto ... 16
2.2.2.1. Doença Ovárica Quística (DOQ) ... 18
2.2.3. A Primeira Ovulação Após o Parto ... 19
2.3. Factores Moduladores da Duração do Período de Anestro ... 19
2.3.1. Balanço Energético ... 19
2.3.1.1. Hormonas Metabólicas e Metabolitos no Balanço Energético Negativo ... 22
2.3.2. Produção Leiteira ... 23
2.3.3. Selecção Genética ... 24
2.3.4. Maneio Nutricional no Péri e Pós-Parto ... 25
2.3.5. Infecções Uterinas ... 25
3. Protocolos para o Encurtamento do Anestro Pós-Parto ... 26
3.1. A Prostaglandina F2alfa na Involução Uterina ... 26
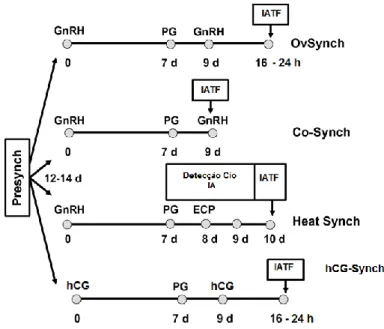
3.2. Protocolos de Sincronização da Ovulação a Tempo Fixo ... 27
3.2.1. Presynch com IATF ... 28
3.2.1.1. Targeted Breeding... 29
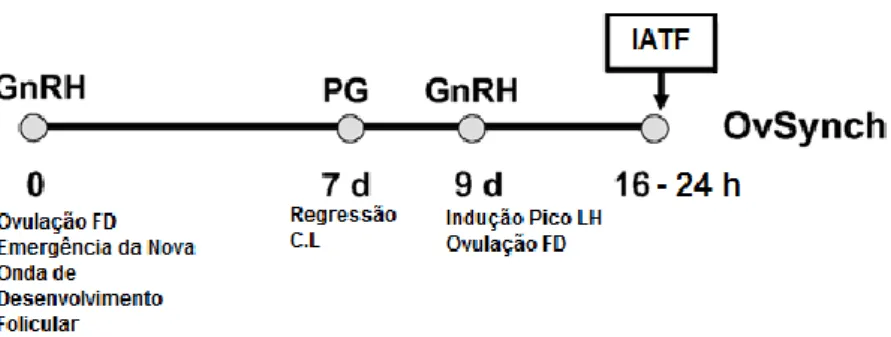
3.2.2. Ovsynch ... 30
3.2.3.1. Co-sincronização - Co-synch ... 33
3.2.3.2. Heat-synch ... 33
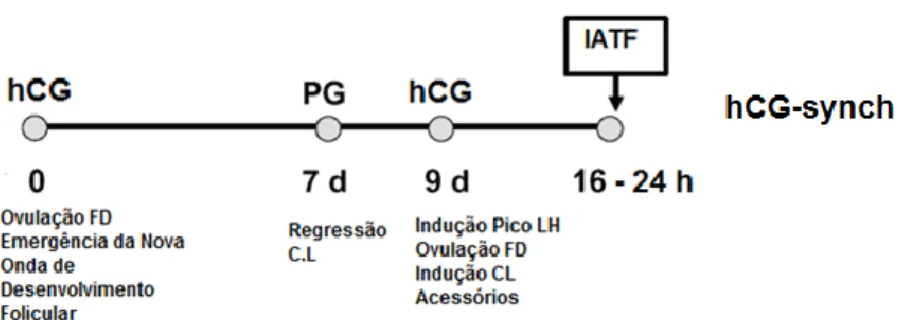
3.2.3.3. hCG-synch ... 34
Parte II - Manipulação farmacológica do período pós-parto em vacas de leite na região dos Açores ... 37
1. Introdução ... 38
2. Material e Métodos ... 40
2.1. Caracterização das explorações ... 40
2.2. Animais ... 41
2.3. Recolha de Dados e Análise Estatística ... 47
3. Resultados ... 48
3.1. Estudo 1 – Tratamento com o Estrumate ... 48
3.2. Estudo 2 – Tratamento com o Ovsynch e o hCG-synch ... 50
3.2.1. Taxas de Gestação ... 58
4. Discussão ... 55
5. Considerações finais ... 60
Índice de Figuras
Figura 1. Processos fisiológicos que levam à separação da placenta ... 10
Figura 2. Eixo hipotálamo-hipófise-ovário após a Maturação ... 14
Figura 3. Dinâmica Folicular ... 17
Figura 4. Frequências de Pulso de LH e o Efeito na Onda de Desenvolvimento Folicular ... 18
Figura 5. Protocolos de Sincronização da Ovulação ... 28
Figura 6. Protocolo Ovsynch ... 30
Figura 7. O protocolo hCG-synch... 34
Índice de Quadros
Quadro 1. As etapas da involução uterina, a sua duração, os mecanismos e os principais eventos. ... 6Quadro 2. Agentes bacterianos de maior prevalência no útero no pós-parto. ... 8
Quadro 3. Alguns factores que ocasionalmente podem condicionar a duração da involução uterina. ... 13
Quadro 4. Alguns efeitos do BEN na reprodução e no metabolismo. ... 21
Quadro 5. Resposta esperada da aplicação do Ovsynch em função dos dias do ciclo em que é aplicado. ... 32
Quadro 6. Caracterização geral das explorações quanto à produção média de leite (PML) aos 205d no ano de 2010 e ao PVE ... 40
Quadro 7. Caracterização dos animais utilizados no estudo, quanto à idade, ao número de lactações e à produção de leite aos 305 dias. ... 42
Quadro 8. Estudo 1 - Caracterização das explorações e animais tratados com Estrumate® . ... 43
Quadro 9. Quadro resumo para o Estudo 2 contendo a caracterização das explorações e animais tratados com o Ovsynch e o hCG-synch ... 45
Quadro 10. Protocolos de tratamento utilizados no estudo 2 ... 47
Quadro 11. Resumos dos resultados obtidos por exame transrectal do tracto genital nos animais do grupo tratamento e nos controlos ... 48
Quadro 12. Caracterização das explorações, dos grupos dos animais tratados com Estrumate® e dos grupos de controlo ... 49
Quadro 13.Comparação de alguns parâmetros reprodutivos respeitantes ao parto do ano anterior à realização dos estudos e ao parto anterior
ao arranque dos trabalhos para os grupos de controlo... 51 Quadro 14.Resposta ao tratamento no estudo 2 ... 54 Quadro 15.Resposta global aos tratamentos no estudo 2. ... 55
Listas de Siglas/Acrónimos, Abreviaturas e Sinais/ Símbolos
A – Cornos uterinos assimétricos
AASM – Associação Agrícola de São Miguel AGNE- Ácidos gordos não esterificados BE – Balanço Energético
BEN – Balanço Energético Negativo BVD- Vírus da diarreia bovina C – Ciclicidade ovárica CC- Condição corporal CL – Corpo Lúteo cm – Centímetro CO – Co-synch d- Dia dpp- Dias pós-parto
E – Tipo Edematoso [refere-se à consistência do útero]
E/N – Tipo Edematoso ou normal [refere-se à consistência do útero] ECP – Ciprionato de estradiol
FD – Folículo dominante FS- Folículo subordinado
FSH- Hormona folículo estimulante G+- Animais gestantes
G - - Animais não gestantes GH – Hormona de crescimento
GnRH – hormona libertadora de gonadotropina gr – Grama
h – Hora
IA – Inseminação artificial
IATF- Inseminação artificial a tempo fixo IGF-I – Insulin-like growth factor I
IGFBP – Proteínas transportadoras de insulin- like growth factor I IM – Intramuscular
IEP- Intervalo entre partos
IP – 1ª IA – Intervalo entre o parto e a primeira inseminação artificial IP- IA Fec – Intervalo entre o parto e a inseminação fecundante kg – Quilograma
LH – Hormona luteínizante M – Mês
MAO – Sistema enzimático mono amina oxidase Máx- Máximo
Min – Mínimo ml- Mililitro mm – Milímetro
mRNA – Ácido ribonucleico mensageiro n – Amostra (n.º de animais)
N - Normal N.º/n.º - Número
ng/ml – nanograma por mililitro OT – Ocitocina
p – valor de p
PG – Prostaglandina PGE2 - Prostaglandina E2 PGF2α - Prostaglandina F2 alfa
PGFM -13,14-dihydro-15-keto- prostaglandina F2 alfa pg/ml -Picograma por mililitro
P-IAF - Intervalo entre o parto e a inseminação artificial fecundante PML – Produção Média de Leite
PVE - Período voluntário de espera
P-1ªIA - Intervalo entre o parto e a primeira inseminação artificial RP – retenção de placenta ou placentária
S – Cornos uterinos simétricos spp – Espécie
T – Tipo tónico [refere-se à consistência do útero] UI - Unidade internacional 2 - Qui-quadrado ® - Marca registada % - Percentagem 1ª - Primeira <- Menor > - Maior
Parte I -
Anestro Pós-Parto e Protocolos de Sincronização do Cio e da
Ovulação
1. Introdução
A optimização da eficiência reprodutiva é essencial para a manutenção da rentabilidade nas explorações de leite (Fahey et al., 2002), permitindo obter um balanço positivo face a todos os encargos com os animais (alimentação, profilaxia e tratamento, apoio veterinário e acompanhamento reprodutivo), com a mão-de-obra (sazonal ou constante) e a amortização dos investimentos realizados em maquinaria. Para se atingir uma boa eficiência reprodutiva é necessário atingir vários objectivos entre os quais altas taxas de submissão a cada inseminação artificial (IA) e altas taxas de fecundação a cada serviço (Roche, 2006). Mas
muitas explorações de leite não conseguem atingir estes objectivos e isso acarreta perdas económicas substanciais (LeBlanc, 2008). As perdas económicas são agravadas pelas quebras na produção leiteira, a redução da fertilidade, o aumento da taxa de refugo, e os custos médico-veterinários (Melendez et al., 2004).
Ao longo dos anos a eficiência reprodutiva nas vacas leiteiras tem vindo a diminuir o que tem vindo a ser associado ao aumento dramático na produção de leite (Fahey et al., 2002). Fahey et al. (2002) não encontrou uma associação entre o aumento da produção de leite e a taxa de fecundação mas constatou que os efeitos negativos do aumento da produção de leite na eficiência reprodutiva podem ser ultrapassados através da realização de um bom maneio (Fahey et al., 2002). Este último passa pela alimentação da vaca, cujas necessidades nutricionais variam de acordo com o estado fisiológico e com as necessidades nutricionais específicas para a prevenção no péri-parto das desordens metabólicas do pós-parto (Roche, 2006).
A eficiência reprodutiva abaixo do limiar considerado como óptimo está também associada ao atraso na involução uterina, à incapacidade de obter uma ovulação, à deficiente manifestação do comportamento de cio ou à ineficiência na sua detecção, à incapacidade em atingir uma fecundação ou à morte embrionária precoce. Estes factores, entre outros, levam ao prolongamento do período de anestro, alongando o intervalo entre partos e reduzindo o nº de vitelos nascidos por vaca (e por conseguinte o nº de lactações) no final da vida produtiva do animal (Tallam et al., 2001; Alnimer et al., 2009). Com o intuito de encurtar o período de anestro pós-parto foram desenvolvidos vários protocolos de sincronização da ovulação visando induzir o crescimento folicular e posterior ovulação. A eficiência destes protocolos é muito variável, dependendo da condição sanitária e nutricional das vacas. Para a escolha do protocolo, devem ser analisadas as condições individuais de cada efectivo, levando em consideração as condições citadas anteriormente, além da relação custo/benefício do uso do protocolo (Rabassa et al., 2007).
Neste trabalho procura fazer-se uma revisão do período de Anestro Pós-Parto e dos factores que podem modular a sua duração, e ainda rever alguns dos protocolos propostos para o seu encurtamento farmacológico. Esta revisão será o ponto de partida para a discussão, na segunda parte deste trabalho, dos resultados obtidos num ensaio em que se administrou Prostaglandina F2alfa (Estrumate®) no pós-parto inicial com o objectivo de favorecer a involução uterina e outro em que se comparara a eficiência de dois protocolos de Ovsynch, um com GnRH e o outro com hCG, visando a sincronização das ovulações seguida de inseminação em tempo fixo. Este trabalho foi desenvolvido num grupo de vacas leiteiras da região dos Açores, mais concretamente da ilha de São Miguel.
2. Anestro Pós-Parto
O anestro é, por definição, um estadio de aciclia ovárica que se traduz num decréscimo da actividade ovárica e na inibição da actividade sexual (Ball e Peters, 2004; Montiel e Ahuja, 2005; Peter et al., 2009), durante a qual não há manifestação comportamental de cio. Nas vacas em anestro pós-parto os ovários estão inactivos e mesmo quando se verifica a existência de desenvolvimento folicular, os folículos adquirem capacidade para ovular (Carreira, 2007).
O anestro pós-parto tem uma duração variável (Ball e Peters, 2004) mas quando se prolonga por mais de 90 dias passa a ser considerado anormal (Montiel e Ahuja, 2005). O prolongamento do período de anestro após o parto é um dos principais problemas de infertilidade em bovinos de leite devido à sua grande incidência (Montiel e Ahuja, 2005), e resulta em perdas económicas por aumentar o intervalo parto-fecundação e consequentemente comprometer a eficiência reprodutiva do efectivo, impedindo assim que se cumpra o objectivo de um parto/vaca/ano. O aumento do intervalo entre partos leva à diminuição do número de lactações com consequente menor produção de leite na vida útil da vaca leiteira. O intervalo entre partos ideal para que se obtenha o máximo de eficiência reprodutiva é de 12 meses com intervalo parto - fecundação de cerca de 85 dias (Rabassa et al., 2007).
Os principais factores que afectam a duração do anestro pós-parto são o estado nutricional no péri-parto, a ocorrência do balanço energético negativo (BEN), a amamentação, o atraso na involução uterina e, já aquando do reinício da actividade ovárica, a raça, a idade, a paridade, a produção leiteira, a genética, a estação do parto e as doenças puerperais (Savio et al., 1990; Ball e Peters, 2004; Montiel e Ahuja, 2005; Rabassa et al., 2007; Peter et al., 2009). Estes factores influenciam o funcionamento do eixo hipotálamo-hipofisiário, pois interferem com a secreção da hormona libertadora de gonadotropinas (GnRH), pelo hipotálamo, e das gonadotropinas, pela adeno-hipófise. Estes factores actuam por um mecanismo de rectro-acção negativa, interrompendo o mecanismo endócrino que controla a manifestação de cio e
subsequente ovulação (Rabassa et al., 2007). Os vários mecanismos que actuam na regulação do anestro pós-parto podem actuar isoladamente ou de forma conjunta, podendo haver interacção entre mecanismos hormonais, sensoriais, nutricionais e comportamentais para a regulação da reprodução no período puerperal (Rabassa et al., 2007).
Durante o puerpério ocorre a involução do útero e a pulsatibilidade e ciclicidade do eixo hipotálamo-hipófise-ovário é restabelecido resultando nas primeiras ovulações após parto e no retomar de ciclos éstricos regulares. Num puerpério normal estes acontecimentos estão completos às 6 semanas após o parto. Cerca de 90% das vacas de leite têm a primeira ovulação neste período; no entanto o intervalo entre o parto e a ovulação nas vacas leiteiras actuais pode ser de mais 3 semanas (Peter et al., 2009).
Como objectivo de obter um parto/vaca/ano, exige-se o estabelecimento de uma gestação por volta dos 85 dias após o parto, o que por sua vez exige uma estreita cooperação entre a involução uterina, o hipotálamo, a hipófise e os ovários, culminando no reinício da actividade ovárica, a manifestação do estro e a fecundação (Peter et al., 2009).
2.1 Involução Uterina
Sendo o ideal económico numa exploração de leite a ocorrência, em média, de um parto por ano, torna-se necessário que a involução uterina decorra dentro da normalidade, pois a recuperação do útero ao seu estado funcional normal após o parto é indispensável ao restabelecimento da função reprodutiva (Slama et al., 1991). Em bovinos de leite, em particular, é também necessária uma elevada taxa de fecundação e uma boa capacidade de detecção de cio, de forma a que se obtenha um intervalo de 90 dias, ou menos, entre o parto e a primeira inseminação ou primeiro serviço (El-Din. Zain et al., 1995).
O tempo necessário para involução uterina varia de acordo com o tipo de parto (eutócico ou distócico), a existência ou não de complicações puerperais, a idade e paridade da fêmea, a estação do ano na qual o parto ocorreu, a existência de estímulo de amamentação (presença do vitelo), o nível de produção leiteira, o nível nutricional e condição corporal (CC) após o parto e o reinício da actividade ovárica (El-Din. Zain et al., 1995; Dobson-Hill, 2009).
A involução uterina condiciona a fertilidade futura da fêmea. Por um lado tem de estar completa antes que a nova gestação ocorra e por outro lado as alterações patológicas decorrentes da involução contrariam o desenvolvimento de um novo ciclo reprodutivo normal (Badinand, 1981). As doenças puerperais numa fase inicial do período pós-parto podem levar
aumento do intervalo parto - fecundação e ao aumento dos custos de produção (Bajcsy et al., 2005).
A involução uterina é definida como o retorno do útero, após o parto, a um estado pré-gravídico que permita uma nova fecundação (Kiracofe, 1980) e gestação (Badinand, 1981; Melendez et al., 2004). A involução uterina é um fenómeno complexo que envolve fenómenos como a expulsão do conteúdo uterino, a contracção, necrose e destacamento das carúnculas e a regeneração do endométrio (Badinand, 1981; Slama et al., 1991; Gustafsson et al., 2004; Sheldon et al., 2008; Dobson-Hill, 2009; Barros, 2010), a redução do fluxo sanguíneo ao útero e da vascularização do endométrio, e também a redução do volume do miométrio (Dobson-Hill, 2009). Acompanhando este processo, e em parte dele decorrente, observa-se ainda a eliminação da contaminação bacteriana (Slama et al., 1991; Melendez et al., 2004; Sheldon et al., 2008; Dobson-Hill, 2009).
A involução uterina inicia-se imediatamente após o parto (Slama et al., 1991; Bajcsy et al., 2005). Embora não haja concordância entre os autores, completa-se por volta dos dias 16-53 (Lindell et al., 1982; El-Din. Zain et al., 1995), 25-45 (Badinand, 1981) ou 18-50 (Hajurka et al., 2005).
O exame transrectal do útero é a prática mais frequentemente realizada para a avaliação do grau de involução uterina. O normal é o útero ser palpado em toda a sua extensão, entre os 9 e os 17dias após o parto. Se o útero não for palpado em toda a sua extensão ao 17º-18º dia após o parto deve considerar-se que a involução uterina está efectivamente atrasada (Badinand, 1981).
2.1.1 Mecanismo da involução uterina
Útero
A involução uterina integra diferentes etapas, como a redução do tamanho do útero, a perda de tecido e a reparação (Kiracofe, 1980). As áreas carunculares e as de para-placenta involuem a velocidades diferentes, sendo esta regeneração mais rápida nestas últimas. As áreas de para-placenta regeneram em 8 dias (Dobson-Hill, 2009), enquanto a re-epitelização das carúnculas tem, regra geral, uma duração mínima de 25 dias, e a das camadas mais profundas de 5-8 semanas após o parto (Sheldon et al., 2008; Dobson-Hill, 2009).
O miométrio tem um papel importante na expulsão dos conteúdos uterinos e na redução do tamanho do útero (Dobson-Hill, 2009; Barros, 2010). Em resultado da descamação das carúnculas, em conjunto com os fluidos fetais, placenta e sangue forma-se um corrimento,
geralmente designados por lóquia(s) (Dobson-Hill, 2009; Barros, 2010). Com o avançar da involução uterina ocorre uma diminuição progressiva do corrimento vaginal (Badinand, 1981; Dobson-Hill, 2009). Gradualmente, este corrimento muda de vermelho-acastanhado para um amarelo-esbranquiçado adquire uma consistência mucosa, podendo durar até cerca de quatro semanas após o parto em situações de uma involução uterina tardia (Barros, 2010). Em condições normais o útero encontra-se completamente limpo nas 3 semanas após o parto (Badinand, 1981).
No quadro 1 estão descritas as etapas da involução uterina, quanto à duração, mecanismo e principais eventos.
Cérvix
A cérvix é o segmento do tracto genital que leva mais tempo a atingir novamente as dimensões pré-gravídicas. Segundo Badinand (1981) a regressão da cérvix tem uma duração de cerca de 50 a 60 dias (Badinand, 1981). Ao parto a cérvix tem um diâmetro de cerca de 30 cm (Dobson-Hill, 2009) depois nos 20 a 33 dpp reduz para 3.5 a 5 cm e nos 34 a 47 dpp reduz para menos de 3.5 cm (Kasimanickam et al., 2004).
O diâmetro da cérvix é um bom indicador da existência de eventuais problemas reprodutivos. Kasimanickam et al. (2004) constatou que quanto maior for o diâmetro da cérvix após o parto, mais tempo levará a involução uterina. A maioria dos autores concorda que vacas com uma cérvix de maior diâmetro tendem a manter a cérvix aberta por mais dias, favorecendo a persistência de contaminação uterina, e consequentemente têm menos possibilidade de ficarem gestantes (Dobson-Hill, 2009).
O número de dias necessários para a involução da cérvix aumenta nos animais que tiveram um parto distócico ou retenção placentária. Se a cérvix se mantiver aberta por mais tempo as vacas terão maior risco de desenvolverem infecções uterinas pois existe mais oportunidade de haver a colonização bacteriana do útero (Dobson-Hill, 2009)
Quadro 1. As etapas da involução uterina, a sua duração, os mecanismos e os principais eventos.
Etapas da Involução Uterina
Componente Duração Mecanismo Principais eventos
Redução
do tamanho 18 a 56 dias.
A redução inicial das dimensões uterinas após o parto resulta da vasoconstrição e das contracções peristálticas que decorrem ao longo de vários dias (Kiracofe, 1980).
Redução do peso do útero de 9 para 3 kg nos primeiros 10dpp; reduzindo para 1kg entre os 20 a 30 dpp, e para 750gr até aos 50dpp (Kiracofe, 1980).
Diminuição a metade das dimensões do corno uterino, que imediatamente após o parto mede cerca de 1mx40cm (comprimento x diâmetro) (Badinand, 1981), em 5d (diâmetro) a 15d (comprimento) (Dobson-Hill, 2009).
Redução do conteúdo fluido do útero, que passa de 1000-1600ml aos 2dpp e para 100 ml no dia 8. O útero estará limpo de fluidos aos 14 a 24 dpp (Kiracofe, 1980).
Perda de
tecido Até 20 dias
Associado aos fenómenos de contractibilidade uterina e à redução de tamanho do órgão.
Desta
camento do tecido necrótico até ao 5ºdpp; ao dia 10 o útero encontra-se livre de tecido necrótico.
Regre
ssão do edema do endométrio por volta do dia 8 (Kiracofe, 1980).
Entre
os dias 10 e 15 do após parto ocorre o destacamento completo das carúnculas (Dobson-Hill, 2009).
No dia
19 as arteríolas desapareceram deixando as carúnculas relativamente lisas (Kiracofe, 1980).
Reparação Entre 30 a
60 dias
Dependente da activação de factores locais no endométrio (factores de actuação parácrina e/ou autócrina)
A re-epitelização das carúnculas completa-se em cerca de 25 dias.
Continua-se a observar uma redução do seu tamanho até aos 40 a 60dpp (Dobson-Hill, 2009).
No corno não gestante a re-epitelização é mais precoce, com uma duração de cerca de 10-20 dias, enquanto que no corno gestante tem uma duração de 20-30 dias (Kiracofe, 1980).
Dpp = dias pós-parto .
2.1.2 Função da Prostaglandina F2alfa na Involução Uterina
A 13,14-dihydro-15-keto-PGF2α (PGFM), um metabolito da PGF2α, tem o seu pico de
concentração ao dia 4 do pós-parto, e retoma a níveis basais entre os dias 10 e 20 após o parto (Del Vecchio et al., 1994; Risco et al., 1994; Santos et al., 2002). A involução uterina normal está associada a uma síntese massiva de PGF2α que se mantém do dia 7 ao 15
(Guilbault et al., 1988; Slama et al., 1991). Na segunda semana após o parto, observa-se a vasoconstrição e necrose das carúnculas, coincidente com a redução na produção de PGF2α,
sugerindo que esta seja produzida pelas carúnculas (Lindell et al., 1982).
Segundo alguns autores existe uma correlação positiva entre a duração da produção de PGF2α no pós-parto e o tempo necessário para se completar a involução uterina (Archbald et
al., 1990; Del Vecchio et al., 1994; Gustafsson et al., 2004). As concentrações de PGFM encontram-se correlacionadas com a taxa de involução uterina e cervical (Del Vecchio et al., 1994; Horta, 1995). A longa duração e a alta concentração de PGFM plasmática no pós-parto estão associadas a uma involução uterina mais rápida (Guilbault et al., 1988; Risco et al., 1994) .
Aumento da contractilidade do músculo liso
A PGF2α no útero funciona como um potente estimulador da contractilidade uterina, pois
aumenta a actividade eléctrica do miométrio (Melendez et al., 2004). A actividade mioeléctrica é maior no parto e diminui drasticamente perto dos 7 e 9 dpp (Melendez et al., 2004; Bajcsy et al., 2005). A PGF2α ao estimular a contractilidade do músculo liso aumenta consequentemente
o tónus uterino (Lindell et al., 1982; McClary et al., 1989). A redução considerável do tamanho uterino durante o período no qual a PGF2αse mantém a níveis elevados pressupõe-se que seja
uma componente importante na involução uterina (Lindell et al., 1982). A redução do tamanho do órgão tem um papel importante no escoamento de fluidos (Slama et al., 1991; Bajcsy et al., 2005) e na diminuição da contaminação bacteriana do útero no pós-parto (Archbald et al., 2006).
Em resposta à administração de substâncias uterotónicas exógenas, o miométrio contrai de forma intensa. Lindell e Kindahl (1982) demonstraram que a aplicação de PGF2α duas vezes
por dia, durante 10 dias consecutivos com início aos
3 dpp reduziu o tempo de involução uterina em uma semana. Estes resultados podem ser explicados pelo facto desta substância, quandoadministrada no pós-parto imediato, aumentar a actividade mioeléctrica e a contracção do útero (Lindell et al., 1982; Melendez et al., 2004).
Diminuição da contaminação bacteriana
Nos primeiros 21 dias pós-parto o útero é invadido por bactérias oportunistas. Na maioria dos casos estas bactérias são eliminadas nas primeiras 3 semanas após o parto. No entanto, quando isto não acontece, a persistência das bactérias no útero predispõe a infecções uterinas e a uma redução de eficiência reprodutiva (Archbald et al., 2006; Hendricks et al., 2006; Dobson-Hill, 2009). No quadro 2 listam-se os microrganismos com maior prevalência no útero em pós-parto (Dobson-Hill, 2009).
Quadro 2. Agentes bacterianos de maior prevalência no útero no pós-parto.
A maioria das vacas tem a capacidade de eliminar a contaminação bacteriana do útero nas primeiras 5 semanas após o parto; no entanto é frequente observar-se um desequilíbrio na flora microbiana, em particular em vacas de leite de elevadas produções, permitindo o crescimento excessivo de um determinado tipo bacteriano em detrimento dos outros, que está na origem das infecções bacterianas (Dobson-Hill, 2009).
O Arcanobacterium pyogenes, no útero pós-parto, é o agente mais importante no estabelecer da infecção uterina (Mateus et al., 2002), devido à sua resistência e ao sinergismo que estabelece com o anaeróbio gram negativos (Bacterioides spp. e Fusobacterium necrophorum).
Estudos recentes revelaram que concentrações elevadas de progesterona endógena (associada à luteogénese) aumentam a susceptibilidade do útero às infecções (Archbald et al., 2006). Uma luteólise induzida por PGF2α exógena em alturas específicas do período
pós-parto tardio resulta na consequente exposição do ambiente uterino a concentrações de progesterona em intervalos reduzidos, diminuindo assim a susceptibilidade do útero a infecções bacterianas (Hendricks et al., 2006). Além do mais, a PGF2α é uma molécula
pró-inflamatória, pois amplia a resposta imunitária (Hendricks et al., 2006; Sheldon et al., 2006). Os dados existentes sobre a eficácia da PGF2α exógena no aumento da taxa da
involução uterina, na eliminação da contaminação bacteriana do útero e na subsequente melhoria da taxa de fecundação são contraditórios (Archbald et al., 2006; Hendricks et al.,
Até 10 dpp > 10dpp Streptococcus Staphylococcus Bacillus Arcanobacterium pyogenes Bacterioides spp. Fusobacterium necrophorum
2006). Archbald et al. (2006) defendem que a PGF2α exógena não só é eficaz na
contractilidade e na eliminação da contaminação bacteriana quando o CL está presente no ovário, mas também que pode resolver as infecções uterinas na ausência do CL, pois estimula as contracções uterinas que expelem as bactérias do útero, reduzindo por meios mecânicos o seu número, melhorando a taxa de involução uterina e reduzindo o número de serviços por gestação. Estes autores são de opinião que estes efeitos são ser independentes da presença ou ausência do CL funcional no momento da administração da PGF2α(Archbald
et al., 1990). No entanto, LeBlanc (2008) afirma que a PGF2α tem mais eficácia quando os
níveis de progesterona estão altos ou o CL é palpável. Já Hendricks et al. (2006) refere que a administração de PGF2α em vacas com ou sem CL activo aos dias
14-28 do pós-parto, permitiu aumentar a taxa de fertilidade ao 1º serviço, ou seja teve um efeito positivo na eficiência reprodutiva (Hendricks et al., 2006).
Regressão do Corpo Lúteo
A PGF2α tem propriedades luteolíticas, ou seja, induz a regressão do corpo lúteo (CL)
fazendo diminuir as concentrações de progesterona (Lindell et al., 1982; Archbald et al., 2006). Ao fazer regredir o CL, a concentração de progesterona diminui, indirectamente permitindo o aumento dos teores de estradiol endógeno assim como a expressão de estro (Sheldon et al., 2006; LeBlanc, 2008). Com a diminuição da progesterona, o efeito imunodepressivo desta também diminui, havendo portanto um aumento da resposta imunitária às infecções bacterianas (Archbald et al., 2006).
Retenção Placentária
A retenção da placenta (RP) é uma das principais causas de perdas económicas numa exploração, pois vacas com RP podem desenvolver infecções uterinas puerperais e consequentemente apresentarem uma diminuição na produção leiteira. Nos animais com RP observa-se também um atraso na involução uterina, que se acompanha geralmente do aumento do intervalo entre partos (IEP) e de um decréscimo da fertilidade, tendo como consequência o aumento da taxa de refugo (Youngquist, 2007).
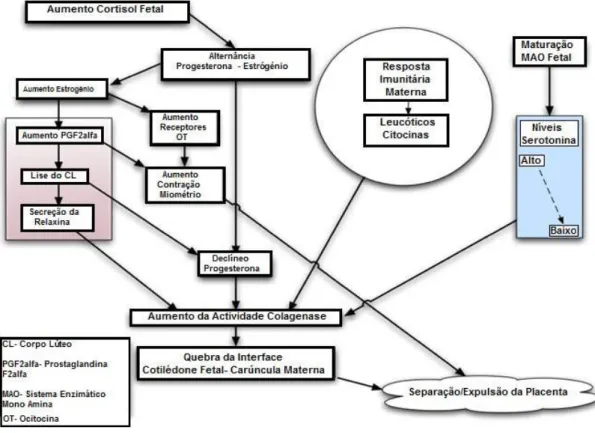
A separação e expulsão da placenta em bovinos implica a separação dos cotilédones fetais das carúnculas maternas, que juntos formam o placentoma. Nos ruminantes, uma camada de colagénio mantém a interface cotilédone-carúncula unida (Beagley et al., 2010). O
esquema seguinte traduz os processos fisiológicos normais que levam à separação/expulsão da placenta (Figura 1).
Figura 1. Processos fisiológicos que levam à separação da placenta. Adaptação Beagley et al. (2010).
No parto, observa-se a inversão dos teores de progesterona/estrogénios (Beagley et al., 2010; Hanafi et al., 2011), em consequência do que se observa um aumento do número de receptores para a ocitocina e a produção de PGF2α. A PGF2α induz a luteólise do CL, com o
decréscimo consequente de progesterona, e ainda promove o aumento da secreção de relaxina. Estes dois patamares concorrem para estimular a actividade da colagenase, o que provoca a lise do colagénio e a quebra da integridade do cimento de interface cotilédone-carúncula e, por consequência, a separação da placenta (Beagley et al., 2010). Depois de separada, a placenta é expulsa na sequência da contractibilidade do endométrio.
A serotonina parece ter um papel importante no controlo da fixação da placenta até ao momento do parto (Beagley et al., 2010), já que inibe a secreção de colagenases, e tem ainda efeito na secreção do cortisol (Youngquist, 2007). No parto, a maturação do sistema enzimático mono-amina-oxidase (MAO) fetal leva à metabolização da serotonina e ao subsequente decréscimo da sua concentração. Com a diminuição das concentrações de serotonina aumenta a actividade da colagenase e ocorre a separação da placenta (Beagley et al., 2010).
A activação da resposta imunitária materna também parece ter um papel importante na separação da placenta. Vacas com uma separação e consequente expulsão normal da placenta apresentam uma elevada quimiotaxia e um aumento da actividade dos leucócitos e das citoquinas. As citoquinas são agentes quimiotáticos responsáveis pelo recrutamento dos neutrófilos para o cotilédone no momento do parto. A existência de resposta inflamatória na interface cotilédone-carúncula aumenta a actividade da colagenase com consequente separação da placenta (Beagley et al., 2010).
Em bovinos leiteiros, a expulsão da placenta ocorre normalmente até as 6 horas após o parto. Embora o intervalo de tempo para que se considere ocorrer retenção placentária seja variável, é aceitável que a normal expulsão das membranas fetais se processe até às 6 ou 12 horas após o parto, e que se considere uma situação de retenção quando as membranas não são expulsas entre as 12 a 24 horas após o parto (Santos et al., 2002; Beagley et al., 2010) .
O factor mais importante na patogenia da RP é a falha na separação cotilédone-carúncula após o nascimento da cria (Youngquist, 2007; Hanafi et al., 2011). A não expulsão da placenta é comum em bovinos, com taxas de ocorrência que vão de 3% a 12% (Santos et al., 2002) ou 4% a 16% (Hanafi et al., 2011).
A probabilidade de RP aumenta na sequência de várias situações obstétricas, como sejam o parto prematuro (16,4%), o aborto (25,9%) ou em partos gemelares (43,8%) (Hanafi et al., 2011). Santos et al. (2002) e Gustafsson (2004) acrescentam que o parto induzido com PGF2α (Santos et al., 2002) e as situações de distócia (Gustafsson, 2004) também são factores
de risco que levam ao aumento da incidência de RP. A causa directa de RP em bovinos leiteiros permanece mal conhecida mas sabe-se que existem factores de risco que levam ao aumento da incidência de RP, entre os quais as doenças infecciosas como a BVD, as deficiências nutricionais (sobretudo em vitamina E e Selénio), factores ambientais (Verão) e factores de origem fisiológica ou genética (Santos et al., 2002; Beagley et al., 2010; Hanafi et al., 2011).
Nas vacas com RP, foram detectadas baixas concentrações de estrogénio e elevadas concentrações de cortisol e de progesterona. As baixas concentrações de estrogénio podem estar associadas ao facto de ocorrer uma deficiente produção de aromatase placentária, com consequente conversão insuficiente de progesterona em estrogénio. As elevadas concentrações de cortisol e de progesterona por sua vez têm um efeito imunodepressor e inibem a actividade dos leucócitos e dos neutrófilos (Hanafi et al., 2011) comprometendo deste modo a reactivação dos mecanismos de defesa maternos por decréscimo na quimiotaxia, na actividade fagocitária dos leucócitos e nas citoquinas (Beagley et al., 2010).
2.1.3 Factores que Fazem Variar a Duração da Involução Uterina
Vários factores, de ordem intrínseca ou extrínseca, podem modular a duração do processo de involução uterina após o parto.
Factores intrínsecos:
Tipo de Produção: Varia entre as vacas de aptidão leite e as de aptidão cárnica. A raças de carne têm uma involução uterina mais rápida do que as de leite, e dentro destas últimas sabe-se ainda que quanto maior for a produção leiteira mais prolongada é a involução uterina (Badinand, 1981).
Número de Parições: Para a maior parte dos autores, a involução uterina tende a ser mais rápida em fêmeas primíparas do que em vacas de mais idade (Kiracofe, 1980; Badinand, 1981; Hajurka et al., 2005). Por outro lado, o volume do útero aumenta com o número de gestações, permanecendo sempre um pouco maior depois de cada parto (Badinand, 1981).
Actividade Ovárica no Pós-Parto: As relações entre a actividade ovárica, (medida a partir do primeiro cio pós-parto) e a duração da involução uterina varia entre estudos, especialmente no que se refere aos critérios de involução utilizados por diferentes autores (Badinand, 1981). Parece que o início precoce do estro é inversamente proporcional a uma involução uterina rápida (Badinand, 1981), o que poderá estar associado ao efeito da existência de períodos de dominância de progesterona, que indirectamente contaria os fenómenos de eliminação de agentes microbianos que permanecem na cavidade uterina (Shrestha et al., 2004; Thatcher et al., 2006; Sheldon et al., 2009).
Factores Extrínsecos
Estação: Partos que ocorrem no verão ou no outono tendem a ser seguidos por um retorno mais rápido do útero ao estado pré-gravídico relativamente ao observado em partos que ocorrem no inverno e no início da primavera (Badinand, 1981; El-Din. Zain et al., 1995).
Alimentação:
É difícil estabelecer uma relação directa entre a alimentação e a função reprodutiva mesmo que o factor dietético seja essencial (Badinand, 1981). Os teores energéticos afectam ligeiramente a taxa de involução uterina (Kiracofe, 1980). Uma condição corporal aumentada ao parto, muitas vezes causada por uma alimentação excessivamente rica em energia durante o final da lactação e durante o período de seca atrasa a involução uterina (Badinand, 1981). Vacas alimentadas com dietas muito energéticas após o parto têm uma involução 3 dias mais cedo do que as vacas alimentadas com dietas com teores moderados de energia (Kiracofe, 1980). Os teores de proteína não afectam o tempo de involução uterina. Osteores energéticos e proteicos afectam dramaticamente o intervalo entre o parto o reinício da actividade ovárica (Badinand, 1981). Dietas com fosfato favorecem a involução ao contrário das dietas ricas em cálcio. Dietas pobres em magnésio também afectam negativamente a involução uterina (Badinand, 1981).
Outros Factores
No quadro 3 estão descritos os factores que, no momento do parto ou após o parto, podem interferir na duração da involução uterina.
Quadro 3. Alguns factores que ocasionalmente podem condicionar a duração da involução uterina (Badinand,
1981).
Não é afectada É afectada
Uma extracção forçada bem conduzida, sem lesões vaginais ou na cérvix.
Uma extracção manual completa da placenta retida não putrefacta ou a sua expulsão espontânea 10-15 dias após o parto. Uma hipocalcémia tratada rápida e
eficazmente.
A falta de assepsia no momento do parto. Cesariana.
Lesões no tracto genital no momento do parto. Retenção placentária que evolui para uma
metrite.
Desequilíbrios metabólicos no pós-parto, como por exemplo a cetose.
2.2 Reinício da Actividade Ovárica e o Retomar da Ciclicidade
O reinício da actividade ovárica e o retomar da ciclicidade no pós-parto são necessários para que se possa atingir o objectivo de um parto por ano, devendo existir um intervalo parto - primeiro serviço de 55 dias e um intervalo parto-fecundação de 85 dias (Savio et al., 1990). Para que a fecundação ocorra neste intervalo é indispensável que a actividade ovárica com desenvolvimento folicular surja nos 7 a 10 dias após o parto (Murphy et al., 1990) e que o primeiro folículo dominante (FD) ovule entre os 30 dpp (Gautam et al., 2010) e os 50 dpp (Shrestha et al., 2004). Alguns autores estabelecem as 3 semanas (45 dias) e outros as 4 semanas (60 dias) após o parto como o tempo limite para se considerar se o retorno da actividade ovárica está ou não atrasado (Gautam et al., 2010).
Um parto normal sem complicações favorece um reinício da actividade ovárica e o retomar da ciclicidade dentro do período de tempo considerado normal (Peter et al., 2009).
corporal, pela amamentação, pela produção leiteira, pela ocorrência de distócia, pela raça e idade, pela estação do ano, e pela co-existência de patologia uterina ou de uma qualquer doença crónica debilitante (Murphy et al., 1990; Savio et al., 1990).
Para que o retorno da actividade ovárica ocorra é necessário que a involução uterina se processe (Murphy et al., 1990) e que o eixo hipotálamo-hipófise-ovário retome a sua ciclicidade na produção de hormonas gonadotrópicas/gonadais (Peter et al., 2009).
2.2.1 Maturação do Eixo Hipotálamo-Hipófise
No final da gestação e no pós-parto imediato o eixo hipotálamo-hipófise está sob o efeito de rectro-acção negativa exercida pelos elevados níveis circulantes de estradiol e de progesterona (Yavas e Walton, 2000) e em consequência há um decréscimo na produção da GnRH que se reflecte numa pulsatibilidade insuficiente da FSH e da LH (Carreira et al., 2007)
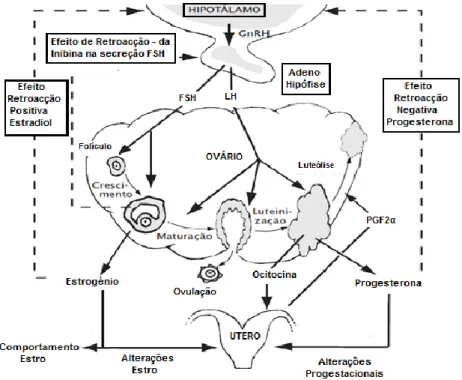
A figura 2 representa o eixo hipotálamo-hipófise-ovário depois de restabelecida a sua actividade normal.
Figura 2. Representação esquemática do eixo hipotálamo-hipófise-ovário. Adaptado Intervet (2007).
Hormona Foliculo-Estimulante (FSH)
A FSH necessita de uma estimulação mínima de GnRH e a sua libertação é principalmente controlada pelo efeito de rectro-acção negativa exercida pelo estradiol (Yavas e Walton, 2000).
Após o parto, as elevadas concentrações de estradiol deixam de exercer os efeitos da rectro-acção negativa (Roche, 2006) e em 2 a 4 dias após o parto (Yavas e Walton, 2000) a libertação pulsátil de FSH é retomada. Quaisquer alterações na libertação da FSH levam ao atraso do reinício do desenvolvimento folicular.
O papel da FSH após o seu pico envolve o crescimento contínuo e desenvolvimento dos folículos antes da divergência, e o desenvolvimento do folículo dominante (FD) após a divergência. A FSH também tem um papel importante na estimulação da produção de estradiol, da IGF-I, da activina-A e da inibina-A, factores muito importantes para o processo de divergência (Ginther et al., 2003).
Estradiol
O estradiol estimula a esteroidogénese nas células da granulosa e da teca, estimulando o crescimento e desenvolvimento folicular; tem ainda como funções potenciar a acção da FSH, inibir a secreção contínua de FSH, induzir da expressão dos receptores da LH e regular a actividade da aromatase (Ginther, 2000).
O aumento das concentrações circulantes de estradiol estão positivamente correlacionadas com as concentrações circulantes da LH. Antes da primeira ovulação após o parto, o aumento da síntese de estradiol pelo FD induz um efeito de rectro-acção positiva na libertação da LH, seguida de um pico pré ovulatório de LH, ovulação e retorno aos ciclos ovulatórios (Yavas e Walton, 2000).
Progesterona
No CL, a angiogénese intensa, a proliferação e luteinização das células da granulosa e da teca nos primeiros 5-6 dias pós-ovulação resultam num aumento progressivo das concentrações plasmáticas de progesterona. A progesterona atinge o pico entre o dia 10 e 14 após ovulação, e decresce a partir do dia 16 do ciclo sobre a influência da PGF2α secretada
pelo endométrio da vaca não gestante (Adams et al., 2008).
Hormona Luteínizante (LH)
A principal limitação endócrina do reinício da actividade ovárica cíclica é a incapacidade em retomar o padrão cíclico de LH essencial ao desenvolvimento final do folículo dominante (FD). Esta incapacidade está associada a sistemas centrais de supressão que se exercem
Ao parto, verifica-se a depleção de LH nas células da adeno-hipófise por efeito da rectro-acção negativa exercida pelos estrogénios de origem placentária. Este efeito termina no parto, pelo que as reservas hipofisárias da LH em vacas leiteiras estão restauradas até às 2-3 semanas (Carreira, 2007). Nem sempre no momento em que a repleção das reservas é atingida se consegue obter um padrão cíclico consistente da LH, pelo que o período anovulatório se pode prolongar. A incapacidade em se obter o padrão cíclico da LH consistente está relacionado com efeitos inibidores exercidos por vários factores exógenos sobre o(s) núcleo(s) gerador(es) de impulsos da GnRH, entre os quais o balanço energético, a condição corporal e o nível nutricional (Carreira, 2007).
No pós-parto as concentrações circulantes da LH são baixas e mantêm-se em níveis baixos até pouco antes do pico da LH e da ovulação, resultantes da baixa frequência de pulsos da LH. Em vacas leiteiras, a recuperação da pulsatibilidade ocorre entre os 13 a 19 dpp. O retorno da pulsatibilidade resulta num aumento gradual das concentrações circulantes da LH (Yavas e Walton, 2000).
2.2.2 Desenvolvimento Folicular Após o Parto
No desenvolvimento folicular normal, o folículo dominante (FD) passa por um processo de selecção e de divergência folicular, crescimento, maturação, ovulação e posterior luteinização para formar o corpo lúteo que, no final do ciclo, irá sofrer luteólise. Aduração do anestro pós-parto é determinada pelo processo de divergência e/ou pelo destino do FD. (Peter et al., 2009).
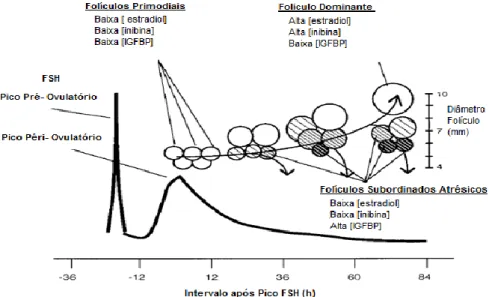
Após o parto, as elevadas concentrações de estradiol deixam de exercer os efeitos da rectro-acção negativa sobre a GnRH (Roche, 2006). Por consequência, nos 2 a 4 dias após o parto (Yavas e Walton, 2000) observa-se o retorno da pulsatibilidade da FSH e detecta-se um aumento transitório das suas concentrações circulantes (Bodensteiner et al., 1996; Mihm e Bleach, 2003; Ball e Peters, 2004). As concentrações da FSH atingem o pico 12-24h antes da emergência de cada onda folicular, ou quando o maior folículo da onda tem cerca de 3-4mm de diâmetro (Ginther et al., 1997; Kulick et al., 1999; Bergfelt et al., 2000; Ginther, 2000; Adams et al., 2008) (Figura 2). Com o aumento das concentrações de FSH após o parto emerge a primeira onda de desenvolvimento folicular (Bodensteiner et al., 1996; Mihm e Bleach, 2003; Roche, 2006).
Quando os folículos em crescimento atingem os 5mm de diâmetro adquirem a capacidade de suprimir a FSH até níveis basais, através da produção de estradiol e de inibina (Adams et al., 2008), esta supressão é necessária para inibir o crescimento dos folículos subordinados (Mihm e Bleach, 2003; Roche, 2006; Adams et al., 2008). Com o decréscimo das
concentrações de FSH para níveis basais inicia-se o processo de selecção do FD e o processo de divergência (Ginther et al., 1997; Kulick et al., 1999; Austin et al., 2001; Adams et al., 2008).
O FD caracteriza-se por apresentar o maior diâmetro, ter um crescimento contínuo, ter um aumento na expressão do mRNA para os receptores da LH nas células da granulosa, ter a capacidade de síntese de estradiol pelas células da teca e ser, relativamente, independente da FSH (Ginther et al., 1997; Kulick et al., 1999; Austin et al., 2001; Adams et al., 2008). A biodisponibilidade dos receptores de LH pelo folículo(s) dominante(s) permite-lhe manter o seu crescimento exponencial mesmo quando as concentração de FSH começam a decrescer. Os folículos subordinados (FS) por sua vez são FSH-dependentes e com a FSH a níveis basais deixam de crescer e sofrem atrésia (Bodensteiner et al., 1996; Ginther et al., 1997; Ginther, 2000; Ginther et al., 2003; Adams et al., 2008) (Figura 3).
Figura 3. Dinâmica Folicular. Adaptado Austin et al. (2001)
No processo de selecção e de divergência, o FD adquire as proteases das proteínas transportadoras de IGF (IGFBP), e receptores de LH (Mihm e Bleach, 2003). As proteases das IGFBP degradam as proteínas transportadoras de IGF-I, permitindo a manutenção intrafolicular de altos níveis desta substância (Roche, 2006). No folículo, a IGF-I tem efeito na libertação hipofisária de LH,
e promove, em sinergismo com o FSH, a síntese de estradiol e o aumento da
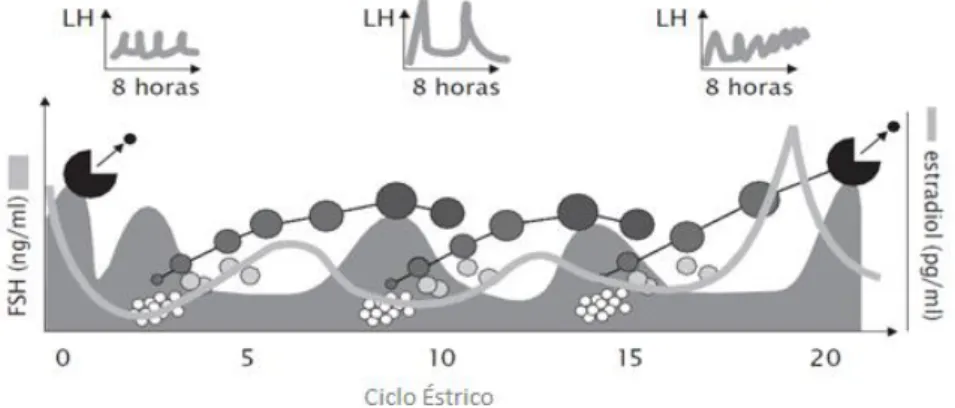
taxa de crescimento do FD (Fortune et al., 2004).O FD, ao adquirir receptores para a LH, torna-se dependente dos pulsos de LH para continuar o seu crescimento e para produzir estradiol (Ginther et al., 1997; Mihm e Bleach,
pulso de LH (Roche, 2006) (Figura 3). Ou seja, se ocorre um pulso de LH a cada 1-2 h durante a fase folicular no fim do ciclo éstrico, o FD termina a sua diferenciação, ovula e luteiniza. Se um pulso de LH ocorre a cada 3-4h durante a fase lútea, o FD sofre atrésia (Mihm e Austin, 2002) (Figura 4).
Figura 4. Efeito das frequências do pulso de LH na onda de desenvolvimento folicular. Adaptado de Intervet (2007).
2.2.2.1 . Doença Ovárica Quística
Os quístos ováricos, nas vacas leiteiras são uma importante causa de infertilidade, pois levam ao aumento do intervalo entre partos. Os quistos ováricos são estruturas de dimensões superiores a 2,5 cm que derivam de folículos que não ovularam; podem ocorrer em ambos os ovários em simultâneo e ou em apenas um ovário (Vanholder, 2005).
Os quístos ováricos podem ocorrer ao longo de toda a lactação, a sua incidência varia entre os 6 e 30%, e o seu diagnóstico normalmente é feito nos 60 dpp. Os quístos ováricos atrasam o retorno da ciclicidade normal, extendem o período parto-primeira IA e diminui as taxas de gestação. Cerca de 80% das vacas com doença ovárica quística (DOQ) estão em anestro e as restantes 20% apresentam sinais de “ninfomania” (Vanholder, 2005).
A DOQ ocorre quando há uma disfunção no eixo hipotálamo-hipófise-ovário. Esta disfunção tem uma etiologia multifactorial, estando envolvidos factores genéticos, fenotípicos e ambientais (Vanholder, 2005).
A formação dos quistos poderá ser explicada pela hipótese que há uma alteração no estímulo/libertação de LH pelo hipotálamo/ hipófise. Nesta hipótese considera-se que, o pico pré-ovulatório de LH não ocorre, ou se ocorre é de magnitude insuficiente ou ocorre no momento errado da maturação do FD, formando-se assim o quisto ovárico (Vanholder, 2005).
As infecções uterinas, a sazonalidade e o stress são factores de risco que podem levar a formação de quistos, pois levam a redução da secreção GnRH/LH (Vanholder, 2005).
2.2.3 A Primeira Ovulação Após o Parto
Em bovinos, é frequente a primeira ovulação após o parto não ser acompanhada por um comportamento visível de cio. Esta situação é normal pois as fêmeas desta espécie necessitam de uma exposição prévia à progesterona para manifestarem comportamento de cio em resposta ao aumento pré-ovulatório de estradiol antes da primeira ovulação (Roche, 2006).
Após a ovulação do FD, forma-se o CL. Em cerca de 78% das vacas com retorno precoce da actividade ovárica, o primeiro CL sofre uma regressão prematura nos dias 8-10 do ciclo éstrico, sendo a fase lútea encurtada. O encurtamento da fase lútea parece dever-se ao aumento prematuro de PGF2α induzido pelo aumento da produção de estradiol pelo FD da nova
onda de desenvolvimento folicular nos dias 5-8 do ciclo, e que induz a luteinização inadequada do CL (Roche, 2006). A segunda ovulação geralmente é acompanhada por comportamento de cio visível, uma fase lútea com a duração normal de 14 dias e um retorno ao cio em 18-24 dias (Noakes et al., 2001).
2.3 Factores Moduladores da Duração do Período de Anestro
2.3.1 Balanço Energético
O Balanço Energético é o resultado da diferença entre a energia consumida (input) e a energia usada (output) para manutenção e para a produção de leite (Peter et al., 2009). O estado nutricional ou o balanço energético, avaliados através da condição corporal, reflectem as reservas corporais disponíveis para o metabolismo basal, crescimento, e lactação. A presença de gordura corporal é um indicativo da energia armazenada para a manutenção da saúde, função reprodutiva e da capacidade produtiva. As vacas leiteiras têm de ter reservas corporais adequadas pois quando têm baixas reservas energéticas ou excesso têm maior probabilidade de virem a sofrer de distúrbios metabólicos, falha reprodutiva e redução da produção leiteira (Montiel e Ahuja, 2005).
O estado nutricional no péri- e pós-parto influencia a eficiência reprodutiva subsequente. Logo após o parto as vacas leiteiras experienciam uma diminuição no consumo de matéria seca, um aumento na produção leiteira, o que por sua vez levam a um aumento da mobilização do tecido adiposo e um aumento das necessidades em nutrientes para a produção leiteira, em consequência da qual a maioria das vacas entra em Balanço Energético Negativo (BEN) (Roche et al., 2000; Walters et al., 2002; Montiel e Ahuja, 2005). As vacas que entram em BEN
particular das novilhas ainda para o crescimento, nem para a manutenção e para produção no período do pós-parto (Montiel e Ahuja, 2005).
A vaca lida com a escassez de nutrientes através da mobilização das reservas corporais de gordura e de proteína (Roche et al., 2000). O período de balanço energético negativo (BEN) no inicio do pós-parto induz alterações metabólicas significativas que têm um impacto negativo na eficiência reprodutiva. A capacidade de cada vaca em se adaptar fisiologicamente a essas alterações e o limite da quantidade de tecido corporal mobilizado influenciam significativamente a fertilidade (Roche, 2006).
No quadro 4 estão resumidos o efeito do BEN na reprodução e no metabolismo com consequente atraso da ovulação e aumento período de anestro.
A subnutrição ou o consumo inadequado de nutrientes em relação às necessidades metabólicas é um dos principais factores de prolongamento do anestro pós-parto (Montiel e Ahuja, 2005). A restrição de energia influencia a função reprodutiva através da inibição da libertação GnRH, a qual estimula a libertação da LH a partir da adeno-hipófise, que por sua vez estimula o desenvolvimento folicular e a ovulação. Devido ao efeito de rectro-acção negativa exercido pelos estrogénios produzidos pela placenta até aos 10 dias após o parto (Carreira, 2007), as concentrações de LH e a frequência de pulso de LH estão diminuídas (Ferguson, 1996). Mas por volta dos 13 a 19 dias a frequência de pulso da LH e as concentrações da LH vão aumentando, levando assim à estimulação do desenvolvimento folicular (Yavas e Walton, 2000). As vacas retomam ao Balanço Energético Positivo nos 42 dpp e a primeira ovulação ocorre nos 8 a 24 dias antes da inversão do nadir do balanço energético negativo, o que nos indica que são necessários, no mínimo, 8 dias para que ocorra o crescimento e maturação folicular (Walters et al., 2002). Com a inversão do nadir do balanço energético negativo estão criadas as condições para que a primeira ovulação ocorra nos 30 dpp; no entanto, em situações de restrição no consumo energético, a frequência de pulso de LH encontra-se diminuída, o desenvolvimento folicular está impedido, a primeira ovulação atrasada, a função lútea está diminuída e eventualmente a função reprodutiva cessa. Quando há uma restrição nutricional acentuada o retorno da actividade ovárica poderá ser atrasado por várias semanas. A fertilidade fica afectada por 60 a 100 dias após o BEN (Ferguson, 1996).
Quadro 4. Alguns efeitos do BEN na reprodução e no metabolismo. Adaptado de Roche et al. (2000)
Reprodução Metabolismo
Diminuição da frequência de pulso de LH Diminuição do diâmetro do FD e
diminuição da produção de estradiol Diminuição do IGF-I sistémico e
intra-folicular de IGF-I
Diminuição das concentrações de progesterona
Aumento do intervalo parto-primeiro cio
Alta produção da GH, diminuição dos receptores da GH e com redução da produção de IGF-I Diminuição da condição corporal
Baixas concentrações de glucose e de insulina Elevadas concentrações de Ácidos Gordos Não
Esterificados (AGNE).
Em situação de doença ovárica quística (DOQ), a profundidade do BEN afecta a ocorrência quistos, quer a nível do hipotálamo/hipófise quer a nível ovárico/folicular, através de alterações hormonais e metabólicas. No BEN, com as concentrações circulantes de IGF-I, de insulina, de glucose, e de leptina diminuídas e com as concentrações dos AGNE aumentadas, o risco de formação de quistos encontra-se também acrescido (Vanholder, 2005).
A manutenção do balanço energético negativo em níveis controlados no início da lactação resulta numa melhoria da eficiência reprodutiva (Opsomer, 2011). Segundo Grummer (2007) o controlo do balanço energético não é fácil de se obter e a alteração da dieta no sentido de aumentar a sua densidade energética não se traduz geralmente numa melhoria significativa da eficiência reprodutiva. No entanto, segundo Opsomer (2011) o efeito do BEN pode ser limitado através do aumento do consumo de nutrientes, especialmente do consumo energético no pós-parto imediato.
O encurtamento da duração do período seco, reduzindo os riscos de uma condição corporal exagerada ao parto, poderá ser uma estratégia alternativa viável para superar de forma favorável as alterações associadas ao balanço energético (Grummer, 2007). Para Gautam et al. (2010) o maneio nutricional apropriado no período seco visando a manutenção de uma condição corporal óptima no momento do parto, e o aumento do consumo de matéria seca no início da lactação, contribuem para reduzir a incidência de atraso e prolongamento do intervalo inter-éstrico. Estes dados parecem sugerir que serão as alterações no maneio que terão uma maior influência no balanço energético (Grummer, 2007).
2.3.1.1 . Hormonas Metabólicas e Metabolitos No Balanço Energético Negativo.
Hormona de Crescimento (GH)
Após o parto, as concentrações da hormona de crescimento (GH) aumentam. O aumento das concentrações de GH promove a lipólise e o estado catabólico o que leva a uma perda da CC e de peso (Roche, 2006), e consequentemente ao aumento dos AGNE. Os AGNE resultam da mobilização dos ácidos gordos a partir do tecido adiposo (Walters et al., 2002) e suprimem a responsividade dos tecidos à insulina (Roche, 2006).
Insulina
A insulina, em sinergismo com o IGF-I, promove o recrutamento folicular e estimula a produção LH-dependente de androgénios pelas células da teca, que serão convertidos em estrogénios nas células da granulosa. A insulina exerce ainda um efeito modulador na libertação de LH (Carreira, 2007).
As baixas concentrações de insulina no início do pós-parto afectam o pico de LH, podendo levar à falha da ovulação e a uma consequente formação de quistos ováricos (Vanholder, 2005).
IGF-I
As concentrações circulantes de IGF-I estão positivamente correlacionadas com a condição corporal e o nível nutricional (Carreira, 2007).
No BEN, ainda que as concentrações de GH estejam aumentadas, o número de receptores para a GH no fígado encontram-se diminuídos, o que se reflecte num decréscimo das concentrações da IGF-I (Roche, 2006). O prolongamento de uma situação que mantenha baixos os teores circulantes de IGF-I está associado ao aumento do período de anestro. As concentrações elevadas de IGF-I podem estimular directamente a proliferação e a capacidade esteroidogénica das células tecais e da granulosa. No ovário, o IGF-I estimula a produção, pelas células da teca, de precursores para o estrogénio e aumenta os receptores para a LH, a qual por sua vez responde positivamente à estimulação estrogénica. Existem também indícios de que o IGF-I possa também afectar directamente a função hipotalâmica e hipofisária (Carreira, 2007). O IGF-I tem efeito na pulsatibilidade de GnRH (Veerkamp et al., 2003); consequentemente tem efeito na libertação de LH hipofisária e aumenta a produção do estradiol e da progesterona pelo ovário (Ball e Peters, 2004).