Ocorrência de Leishmaniose Visceral na região do Barreiro, Belo Horizonte, MG de 2001 a 2012
Daniela Tápias da Silva¹ Hudson Andrades de Souza²
Resumo 1
2
A Leishmaniose Visceral é uma zoonose de grande relevância na saúde 3
coletiva devido à sua heterogeneidade epidemiológica. Uma importante 4
mudança no padrão epidemiológico da LV tem sido verificada. 5
Caracterizada como uma doença rural que vem apresentando junto com 6
o processo de urbanização uma crescente expansão em cidades de 7
médio e grande porte. Na regional do Barreiro há diversas 8
características epidemiológicas que favorecem a transmissão de 9
leishmaniose visceral como: degradações ambientais, migração de 10
populações carentes a grandes centros, locais sem saneamento básico, 11
elevada população canina que tem contribuindo para o aumento da 12
prevalência da doença. O trabalho teve como objetivo verificar a 13
situação da Leishmaniose Visceral na regional Barreiro no período de 14
2001 a 2012. A LV no Barreiro no ano de 2001 até o ano de 2004 se 15
manteve estável, em 2004 e 2006 a doença volta a incidir e em 2010 16
observa-se a rápida elevação, com 89 casos humanos notificados, e 17
percentual de 12,3% de óbitos. Neste período a distribuição espacial, 18
apresentou uma homogeneidade numérica de ocorrência da doença, 19
mostrando uma correlação em que os casos caninos precedem os 20
humanos. De 149.813 amostras examinadas, 6,12% das mesmas 21
estavam positivas para os testes de ELISA e RIFI. Na área urbana, o 22
cão é a principal fonte de infecção, e vem sendo mais prevalente do que 23
no homem. Os resultados encontrados impõem a importância de serem 24
trabalhadas juntamente com a comunidade as medidas de controle 25
apropriadas, de forma a sensibilizar essa população sobre a importância 26
da preservação do ambiente, como forma de se evitar a proliferação dos 27
vetores e a retirada dos cães positivos. Os resultados encontrados 28
impõem a importância de serem trabalhadas juntamente com a 29
comunidade as medidas apropriadas, de forma a sensibilizar essa 30
população sobre a importância da preservação do ambiente, como forma 31
de se evitar a proliferação dos vetores e a retirada dos cães positivos. 32
33 34
Palavras-chaves: Leishmaniose Visceral, aspecto epidemiológico, e 35
urbanização. 36
1. Introdução 38
O termo leishmaniose refere-se à infecção de hospedeiros vertebrados 39
com os protozoários do gênero Leishmania. Segundo Torres (2006), existem 40
dezenas de espécies de Leishmania, que se agrupam em dois subgêneros 41
(Leishmania e Viannia). As leishmanioses são infecções, afetando várias 42
espécies além do homem, que pode ser envolvido secundariamente. A 43
transmissão ocorre pela picada das fêmeas de flebotomíneos, pertencentes 44
aos gêneros Phlebotomus e Lutzomyia, dependendo da localização geográfica 45
(NEVES, 2005). 46
As leishmanioses são um conjunto de doenças causadas por 47
protozoários do gênero Leishmania pertencente á família Trypanosomatidae. 48
De modo geral, essas enfermidades se dividem em Leishmaniose Tegumentar 49
(LT), uma doença infecciosa, não contagiosa que afeta a pele e as mucosas, e 50
Leishmaniose Visceral (LV) que é uma doença infecciosa generalizada 51
conhecida também como Calazar, que afeta os órgãos internos como fígado e 52
baço, causando esplenomegalia e hepatomegalia. 53
A LV é causada, na América, pela Leishmania (L.) chagasi (ROSS, 54
1903), (CUNHA & CHAGAS, 1937), (LAINSON & SHAW, 1987); (LAINSON & 55
SHAW, 1992); (WHO, 1998), tendo como vetores os flebotomíneos da espécie 56
Lutzomyia longipalpis (PEARSON e SOUSA, 1996; ALVAR et al 2004,
57
MATHIAS, 2004). 58
O protozoário, em seu ciclo de desenvolvimento, assume duas formas 59
evolutivas: amastigota encontrada nos tecidos dos vertebrados, como 60
lifonodos, fígado, baço e medula óssea, sem flagelo externalizado e 61
promastigota encontradas no tubo digestivo do inseto vetor que apresentam 62
forma flagelada. Das espécies encontradas no Brasil a Leishmania chagasi é o 63
agente etiológico da LV (CUNHA, 1942). 64
O primeiro caso no Brasil foi descrito no ano de 1913, por Migone em um 65
paciente imigrante italiano que morava a muitos anos em Santos, e após viajar 66
para Mato Grosso, adoeceu, tendo sido diagnosticada a doença no Paraguai 67
(ALENCAR, 1977). 68
Penna (1934), um patologista do Instituto Oswaldo Cruz, iniciou os 69
estudos sobre a distribuição geográfica da Leishmaniose Visceral nas 70
Américas, quando comprovou parasitologicamente, 41 casos dentre as 40.000 71
viscerotomias examinadas para febre amarela de pacientes provenientes de 72
vários estados do Brasil. 73
Em meados dos anos 80, constatou-se uma transformação drástica na 74
distribuição geográfica da LV, a doença que antes era restrita às áreas rurais 75
do nordeste brasileiro, avançou para outras regiões alcançando inclusive a 76
periferia de grandes centros urbanos (DEANE, 1956). 77
Segundo o Ministério da Saúde (MS) (2001), 19 dos 27 estados 78
brasileiros já foram registrados casos autóctones de LV, nos últimos cinco 79
anos, ocorreram em média 3.500 novos casos humanos, sendo a maioria na 80
região Nordeste do país. A doença gradualmente se espalhou e no estado de 81
Minas Gerais na Região Metropolitana de Belo Horizonte (RMBH), o primeiro 82
caso confirmado autóctone foi em 1989, no município de Sabará. 83
Inicialmente concentrada nos Distritos Leste e Nordeste da cidade, a 84
doença se espalhou geograficamente para as áreas vizinhas mostrando uma 85
distribuição por todo o município de Belo Horizonte, sendo identificado em 1994 86
o primeiro caso de LV no distrito sanitário Barreiro (SMSA, 2006). 87
No contexto epidemiológico, há dois processos de transmissão que 88
apresentam características que contribuem para a disseminação da LV, o 89
primeiro é o cão (Canis familiaris) considerado um importante reservatório no 90
ciclo doméstico devido à forte prevalência da infecção canina,e em segundo o 91
vetor Lutzomyia longipalpis, um díptero da família Psychodidae, subfamília 92
Phebotominae, conhecidas genericamente por flebotomíneos (GONTIJO e 93
MELO, 2004). 94
Desde o primeiro caso diagnosticado em 1913, a LV apresentava um 95
caráter eminentemente rural e vem se expandindo para as áreas periurbanas e 96
urbanas de médio e grande porte. Esse fato se deve a mudança de 97
comportamento do vetor, alterações ambientais, mobilidade das pessoas e o 98
adensamento populacional o que favorece o contato entre seres humanos, 99
vetores e outros animais (GOMES, 1994). 100
O principal mecanismo de transmissão da L. chagasi nas condições 101
naturais e de importância epidemiológica universal ocorre através do repasto 102
sanguíneo da fêmea de Lutzomyia longipalpis infectada. As fêmeas têm hábitos 103
ecléticos com referência à alimentação. Apesar de sua antropofilia, pode ser 104
encontrada fazendo repasto sanguíneo em várias espécies de animais no 105
ambiente doméstico e silvestre, sem que haja preferência evidente por uma 106
fonte alimentar determinada (REY, 1991). 107
A infecção do vetor ocorre quando as fêmeas, ao sugarem o sangue do 108
mamífero infectado, ingerem células do Sistema Fagocítico Mononuclear (SFM) 109
parasitados por formas amastigotas da Leishmania presentes na derme do 110
reservatório infectado, as quais passarão a evoluir no trato digestivo anterior do 111
inseto onde ocorrerá um rompimento dos macrófagos liberando as formas 112
amastigotas. No intestino do vetor as amastigotas se diferenciam em 113
promastigotas que se reproduzem por divisão binária simples. As 114
promastigotas migram então para a região anterior do inseto, sendo agora 115
infectantes ou promastigotas metacíclicas. O vetor infectante ao exercer um 116
novo repasto sanguíneo sobre um hospedeiro inocula as formas promastigotas 117
metacíclicas presentes em seu trato digestivo anterior. Na derme do 118
hospedeiro vertebrado as promatigotas são fagocitadas por macrófagos, 119
diferenciando-se em amastigotas e multiplicando-se intensamente, até o seu 120
rompimento e liberação dessas amastigotas que serão fagocitadas por novos 121
macrófagos em um processo contínuo. Ocorre assim à disseminação 122
hematogênica para outros tecidos ricos em células do SFM, como linfonodos, 123
fígado, baço e medula óssea (AMATO NETO, 2008). 124
A infecção causada por L. chagasi apresenta um aspecto clínico que 125
varia desde formas assintomáticas, passando por várias formas clínicas com 126
sintomatologia discreta até aquelas de apresentação mais grave e clássica da 127
doença. 128
Em pacientes que apresentam a forma clássica são observados as 129
seguintes manifestações clínicas: hepatomegalia, esplenomegalia, febre 130
prolongada, dor abdominal e tosse, que podem permanecer durante 3 a 6 131
meses, evoluindo para uma cura espontânea (BADARÓ e DUARTE, 1996). A 132
forma assintomática é mais comum em pacientes oriundos de áreas endêmicas 133
onde há evidência epidemiológica da infecção. Não apresentam nenhuma 134
manifestação clínica, entretanto tem sorologia positiva para LV. Estes 135
indivíduos não são notificados nem tratados (MS, 2003). 136
Segundo o MS (2006), nos últimos dez anos, apesar dos recursos de 137
tratamento intensivo e da rotina estabelecida para o tratamento específico da 138
LV constatou-se aumento na letalidade da doença em diversas regiões do 139
Brasil, sendo o diagnóstico tardio um dos principais fatores que contribuíram 140
para o aumento dessa letalidade. 141
O diagnóstico clínico é complexo, pois a doença no homem pode 142
apresentar sinais e sintomas que são comuns a outras patologias presentes 143
nas áreas onde incide a LV, como, por exemplo, Doença de Chagas, Malária, 144
Esquistossomose, Febre Tifóide e Tuberculose (GONTIJO, 2004). 145
O diagnóstico parasitológico da LV pode ser direto por meio da 146
visualização de amastigotas de L. chagasi em esfregaços de material colhido 147
por punção aspirativa de medula óssea, lifonodos, baço e fígado, corados por 148
Giemsa ou Panóptico (AMATO NETO, 2008). Quando obtidos por biopsia 149
podem ser elaborados cortes histológicos de fragmentos dos órgãos para 150
pesquisa do parasito por histopatologia (SUNDAR, 2002). 151
O ensaio imunoenzimático-ELISA é outra forma de diagnóstico trata-se 152
de uma metodologia que permite a realização de grande número de exames 153
em curto espaço de tempo. O teste de ELISA é o mais utilizado para 154
imunodiagnóstico de leishmaniose visceral. É um teste rápido, sensível, de fácil 155
execução e leitura, permitindo a detecção de baixos títulos de anticorpos, mas 156
é pouco preciso na detecção de casos subclínicos ou assintomáticos. Funciona 157
igualmente para o diagnóstico da LV canina. 158
Os antígenos utilizados nos testes de diagnósticos são quase sempre 159
derivados de promastigotas de cultura, parasitas intactos ou moléculas 160
solúveis. Estes antígenos apresentam reações cruzadas com outras espécies 161
da família Trypanosomatidae, e mesmo com microrganismos filogeneticamente 162
distantes. Portanto, no diagnóstico sorológico da LV é necessário considerar o 163
diagnóstico diferencial com outras doenças (SUNDAR, 2007). 164
O método de RIFI (Reação de Imunofluorescência Indireta) trata de um 165
método de simples execução e que apresenta uma sensibilidade alta na 166
detecção de casos de LV, onde se utiliza como antígeno formas promastigotas 167
fixadas em lâminas, porém fornece reações cruzadas com outro 168
tripanossomatídeos (SUNDAR, 2007). 169
Segundo Manual de Vigilância e Controle da Leishmaniose Visceral – 170
Ministério da Saúde (2010), no Brasil os medicamentos utilizados para o 171
tratamento da LV são: o antimonial pentavalente e a anfotericina b. A droga de 172
primeira escolha para tratamento humano de LV é o glucantime (antimoniato-n-173
metil glucamina), no entanto, a escolha de deverá considerar a faixa etária, 174
presença de gravidez e co-morbidades. Apesar de todas as medidas de 175
controle utilizadas, a doença continua se expandindo (MS, 2010). 176
Segundo Barata et al. (2005), a urbanização da LV se deve 177
possivelmente a mudança de comportamento do vetor, baseado em 178
modificações socioambientais, como o desmatamento, reduzindo a 179
disponibilidade de animais como fonte alimentar do flebotomíneo transmissor e 180
o processo migratório, atraindo para a periferia das cidades, populações 181
humana e canina originárias de áreas rurais onde a doença era endêmica. No 182
caso específico da introdução de cães infectados trazidos de regiões 183
endêmicas, tem se com o tempo, o estabelecimento oportunista da doença em 184
humanos (OLIVEIRA, 2001). 185
A atual situação faz pensar sobre as medidas viáveis que permitam 186
bloquear a propagação geográfica e diminuir o número de casos de LV em 187
grandes cidades com organização espacial semelhante a Belo Horizonte. De 188
acordo com o Ministério da Saúde do Brasil, a vigilância epidemiológica é um 189
dos pilares do Programa de Controle da Leishmaniose Visceral (PCLV) que 190
visa reduzir as taxas de morbidade e mortalidade através do diagnóstico e 191
tratamento precoce dos casos humanos, bem como diminuir os riscos de 192
transmissão mediante controle da população de reservatórios e vetores. As 193
áreas com maiores coeficientes de incidência humanos coincidem com os 194
distritos com maior prevalência da infecção canina (SILVA, 2000). 195
A vigilância da LV compreende a vigilância entomológica, de casos 196
humanos e casos caninos. No município de Belo Horizonte desenvolve-se a 197
análise da situação epidemiológica, com o objetivo de indicar as ações de 198
prevenção e controle a serem adotadas. 199
As ações de controle que são desenvolvidas nos distritos sanitários 200
incluindo o Barreiro são de forma sistemática e direcionada de acordo com a 201
estratificação das áreas de transmissão ou de risco, considerando os casos 202
humanos e também a incidência da doença na população da área. 203
Os percentuais de positividade canina e condições ambientais são 204
favoráveis à transmissão nas áreas com reincidência recente de casos 205
humanos. 206
São desenvolvidas ações de controle voltadas para o principal 207
reservatório urbano, o cão, com realização de exames laboratorial e retirada 208
dos cães soropositivos (MS, 2004). 209
Na Região Metropolitana de Belo Horizonte (RMBH), a região do 210
Barreiro apresenta características epidemiológicas que favorecem a 211
transmissão de leishmaniose visceral. Degradações ambientais, migração de 212
populações carentes a grandes centros, locais sem saneamento básico, 213
animais de estimação sem o acompanhamento do controle de zoonose, 214
contribuem para a elevada prevalência da doença (MS, 2001). 215
Com mais de 150 anos, contados a partir do registro da Fazenda 216
Barreiro, datado de 3 de agosto de 1855, a região tornou-se um pólo que 217
integra Belo Horizonte a municípios vizinhos, com grande potencial de 218
desenvolvimento. Seu território de 53 km² de extensão ainda possui muitas 219
áreas desocupadas que atraem novos moradores e empresas, impulsionando o 220
crescimento local. 221
O presente trabalho tem como objetivo verificar a ocorrência da LV na 222
regional Barreiro (RMBH, MG) no período de 2001 a 2012 e relacionar os 223
fatores ambientais e epidemiológicos que contribuem para sua expansão. 224
225
2. Material e Métodos 226
Foi realizada uma coleta de dados junto à equipe do controle de 227
zoonoses e da epidemiologia da regional Barreiro, da Prefeitura de Belo 228
Horizonte, sobre o número de casos de LV diagnosticada entre os anos de 229 2001 e 2012. 230 231 2.1. Local de estudo 232
Localizada a sudoeste de Belo Horizonte, a região do Barreiro faz limite 233
com os municípios de Contagem, Ibirité, Brumadinho e Nova Lima (fig. 1). Ela é 234
formada por cerca de 80 bairros, com 70 mil domicílios que abrigam 283.544 235
habitantes, segundo o levantamento do Censo de 2010. A partir de 2004 o 236
distrito Barreiro vem se caracterizando como uma das mais recentes áreas de 237
aumento da incidência de LV.Segundo critérios sócios econômicos sanitários 238
esta população ocupa áreas urbanas de risco, o que contribui com a expansão 239
da doença. 240
Figura 1: Mapa Regional Barreiro 241 242 Fonte: PBH/GEREPI, 2013. 243 244 245 2.2. Procedimento 246
Foi realizada uma coleta de dados junto à equipe do controle de 247
zoonoses e da epidemiologia da regional Barreiro, da Prefeitura de Belo 248
Horizonte, disponibilizados pela referência técnica da secretaria municipal de 249
saúde e pelo portal de serviço sobre vigilância epidemiológica disponível no 250
site da prefeitura.
*Telmo Ferreira (comunicação social), Coordenador da Equipe do Controle de Zoonoses - Barreiro, em 26-05- 2013.
3. Resultados e Discussões 252
253
Entre o período analisado (2001 a 2012) foram notificados 89 casos de 254
LV humana com considerável aumento no numero de notificações entre os 255
anos de 2004 e 2006. Observou-se uma queda no ano de 2007, sendo mais 256
intensificada em 2010 (Gráfico 1). Em relação ao número de óbitos observou 257
se que a situação é estável apresentando um total de 12,3% de óbitos 258
notificados nos últimos 12 anos, com média de 1,1% variando de 0 a 3 óbitos. 259
Esse resultado é sensivelmente menor, quando comparado com o distrito oeste 260
onde foram identificados 103 casos positivos, com 14,5 % de óbito. Dos óbitos 261
registrados, boa parte ocorreram em crianças entre 2 a 5 anos e em idosos, 262
conforme informado por Telmo Ferreira* nota-se ainda uma maior incidência da 263
doença no sexo masculino. 264
Gráfico1: Casos humanos e óbitos de Leishmaniose Visceral (LV) no município de Belo Horizonte/MG, no
265
distrito sanitário Barreiro 2001-2012
266
267
Fonte: SMSA-BH, 2013. 268
269
Segundo Teixeira (1986), a razão da maior susceptibilidade das crianças 270
é explicada pelo estado de relativa imaturidade imunológica celular agravada 271
pela desnutrição, tão comum nas áreas endêmicas, além de uma maior 272
exposição ao vetor no peridomicílio. Por outro lado, o envolvimento do adulto 273
tem repercussão significativa na epidemiologia da LV, pelas formas 274
assintomáticas. 275
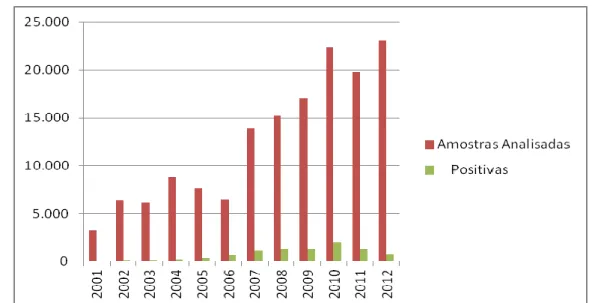
Com relação à Leishmaniose Visceral canina, observou-se uma ampla 276
distribuição de cães com sorologia positiva no Barreiro, de 149.813 amostras 277
examinadas, 9.179 (6,12%) estavam positivas pelas técnicas de ensaio 278
imunoenzimático (ELISA) como triagem e de imunofluorescência indireta (RIFI) 279
como confirmatório. A maior prevalência foi observada entre o ano de 2008 e 280
2010(Gráfico 2), onde 36,4% do total das amostras analisadas o que 281
corresponde a 3,6%, dos resultados positivos neste período, com um 282
decréscimo na positividade canina nos anos seguintes. 283
Gráfico 2: Amostras analisadas pelo controle de zoonoses no período de 2001-2012, positividade canina,
284
na regional Barreiro, BH.
285
286
Fonte: SMSA-BH, 2013. Total: 149.813 amostras analisadas, sendo positivas 9.179. 287
288
Na área urbana, o cão é a principal fonte de infecção para o vetor, e vem 289
sendo mais prevalente do que no homem. Até o momento, não foi verificada 290
predisposição racial, sexual ou etária relacionada com a infecção do animal 291
(SMSA, 2006). 292
Segundo Lopes (2009) a LV em cães tem ampla distribuição espacial, 293
estando presente nas nove regionais administrativas de Belo Horizonte e 294
apresenta tendência crescente dos coeficientes de incidência e de prevalência 295
em cães. O Barreiro apresenta uma das menores taxas de prevalência do 296
município, com média de 6,22%, entretanto suas taxas de soropositividade 297
crescem ao longo dos anos e atualmente seus números são tão preocupantes 298
quanto os das demais regionais. 299
Segundo o MS (2006) as ações de controle são desenvolvidas de forma 300
sistemática e direcionadas de acordo com a estratificação das áreas de 301
transmissão ou de risco, considerando os casos humanos, a positividade 302
canina e também condições ambientais favoráveis à transmissão da doença. 303
Gráfico 3: Boletim das atividades de campo realizadas pelo controle de zoonoses no período de
2001-304
2012, na regional Barreiro, BH. (amostra censitária, borrifação de imóveis em área de inquérito canino)
305
306
Fonte: SMSA-BH, 2013.
307
Observamos, conforme demonstrado no gráfico 2, que a partir do ano 308
de 2006 houve um aumento no número de casas borrifadas chegando a 5.979 309
imóveis de acordo com o inquérito canino censitário. Nos anos seguintes houve 310
um decréscimo nestes números, aumentando novamente no ano de 2009 e 311
2012, totalizando 13.132 imóveis. O controle do vetor é realizado por meio de 312
borrifações de imóveis com inseticida de ação residual para combate aos 313
insetos adultos, a fim de realizar controle. 314
O curioso é que, em 2010, período de maior prevalência canina (Gráfico 315
3), de 22.325 amostras analisadas, 2.000 eram positivas, com apenas 1.865 316
imóveis borrifados. Em 2006 foram analisadas 6.434 amostras, com 617 casos 317
positivos, o que pela a lógica no ano de 2010 o numero de imóveis borrifados 318
deveria ser maior de acordo com a positividade canina, representada neste 319
período, já que as ações são direcionadas de acordo com a realidade 320
epidemiológica existente. 321
Segundo relato da referência técnica do controle de zoonoses da 322
secretaria municipal de saúde (SMSA, 2012) a maioria dos casos notificados 323
ocorrem em áreas urbanas. 324
Durante o período de estudo os resultados mostram que os principais 325
aspectos responsáveis pela a expansão da doença nos bairros de Belo 326
Horizonte, em destaque no distrito Barreiro, nos últimos anos, são o aumento 327
de população de cães que hoje no barreiro chega a cerca de 35.240 cães 328
(GECOZ, 2012), muito destes sem um acompanhamento e cuidado adequado. 329
O processo de urbanização crescente, adaptação da Lutzomyia ao 330
ambiente urbano, que já adequou sua sobrevivência ao que pesquisadores 331
denominam de peridomicílio (as regiões ao redor das casas, como jardins, 332
bosques, hortas ou quintais), como demonstrado no Gráfico 4 resultado de um 333
levantamento feito em toda BH, das espécies de flebotomíneos capturados nas 334
áreas verdes do município. A L. longipalps foi encontrada em pequeno número, 335
o que reforça a mudança de seu habitat natural para as áreas urbanizadas. 336
São esses aspectos epidemiológicos que acarretam a expansão das 337
áreas endêmicas e também o aparecimento de novos focos (BRASIL, 2006). 338
339
Gráfico 4: Flebotomíneos capturados com armadilha de Shannon nos parques e reservas 340
florestais de Belo Horizonte.
341
Fonte: GECZO/SMSA, 2011. 342
Segundo a Vigilância Epidemiológica SMSA, (2006), os primeiros relatos 343
da ocorrência da LV no Barreiro ocorreram no ano de 1994, e até o ano de 344
2004, a doença se manteve estável. Em 2004 e 2006 as doenças voltam a 345
incidir e em 2010 observam-se a rápida elevação das notificações. Neste 346
período as distribuições espaciais apresentam uma homogeneidade numérica 347
de ocorrência da doença. Observam-se a correlação que os casos caninos 348
precedem os humanos e que a doença canina é um dos responsáveis pelo 349
avanço da doença humana (FEITOSA, 2000). 350
Conclusão 351
Os resultados encontrados impõem a importância de serem trabalhadas 352
juntamente com a comunidade as medidas de controle apropriadas, de forma a 353
sensibilizar essa população sobre a importância da preservação do ambiente, 354
como forma de se evitar a proliferação dos vetores e a retirada dos cães 355
positivos 356
O serviço da vigilância epidemiológica do distrito sanitário deveria ter 357
uma maior atenção a essa região, pois em períodos em que ocorreu grande 358
parte de infecção canina não houve a atenção adequada por parte do serviço 359
de borrifação nos imóveis. 360
Para sanar tal situação, devemos encarar o problema da leishmaniose 361
visceral como alta prioridade, reconhecendo como um problema de saúde 362
pública. 363
Referências 364
365
ALENCAR, J.E. Leishmaniose Visceral no Brasil. Revista de Medicina da Universidade 366
Federal do Ceará. 17/18: 129-148. 367
368
Alvar J, Cañavate C, Molina R, Moreno J, J. Nieto. Leishmaniose Canina. 369
Adv Parasitol 2004; 57:1-88. 370
371
AMATO NETO, VICENTE et.al; GRYSCHEK, RONALDO CÉSAR BORGES; 372
Parasitologia: uma abordagem clínica. 434p, Rio de Janeiro: Elsevier, 2008. 373
374
ANTONIO C. PASTORINO, CRISTINA M.A. JACOBE, GABRIEL W. OSELKA, 375
MAGDA M.S. CARNEIRO. Leishmaniose Visceral: aspectos clínicos e laboratoriais. 376
Arq. Bras. Med. Vet. Zootec., v.56, n.1, p.119-122, 2004. 377
378
BADARÓ, R, DUARTE, M.I.S. VERONESI, R. FOCACCIA, R. Leishmaniose visceral 379
(Calazar). Tratado de infectologia. São Paulo: Atheneu, v. 2, cap. 97,1996,p.12341259. 380
381
BARATA RA, FRANÇA-SILVA JC, MAYRINK W, SILVA JC, PRATA A, LORORA ES, 382
ET AL. Aspectos da ecologia e do comportamento de flebotomíneos em área 383
endêmica de leishmaniose visceral, Minas Gerais. Rev Soc Bras Med Trop 2005; 384
38:421-425. 385
386
BRASIL, Manual de Vigilância e Controle de Leishmaniose Visceral. Ministério da 387
Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância 388
Epidemiológica; Brasilia-DF, 2004, 120pp. (Série A. Normas e Manuais Técnicos). 389 Disponível em 390 <portal.saude.gov.br/portal/arquivos/pdf/manual_leishmaniose_visceral.pdf> Acessado 391 em 23 maio,2013. 392 393
DEANE, LM. Leishmaniose Visceral no Brasil. Estudos sobre Reservatórios e 394
Transmissores Realizados no Estado do Ceará, Serviço Nacional de Educação 395
Sanitária, Rio de Janeiro, 1956, 162 pp. 396
397
FEITOSA MM, IKEDA FA, LUVIZOTTO MCR, PERRI SHV. Aspectos clínicos de cães 398
com leishmaniose visceral no município de Araçatuba – São Paulo (Brasil). Clin Vet. 399
2000; 28(5): 36-44. 400
401
GONTIJO, CÉLIA MARIA FERREIRA; MELO MARIA NORMA. Leishmaniose visceral 402
no Brasil: quadro atual, desafios e perspectivas. Rev. bras. epidemiologia, São Paulo, 403
v 7, n. 3, definido. 2004. Disponível em <http://www.scielo.br/scielo. 404 php?script=sci_arttext&pid=S1415-790X2004000300011&lng=pt&nrm=iso>. Acesso 405 em 15 maio 2013. 406 407
LAINSON, Ralph. Espécies neotropicais de Leishmania: uma breve revisão histórica 408
sobre sua descoberta, ecologia e taxonomia. Rev Pan-Amaz Saude, Ananindeua, v. 409
1, n. 2, jun. 2010. Disponível em
410
<http://scielo.iec.pa.gov.br/scielo.php?script=sci_arttext&pid=S2176-411
62232010000200002&lng=pt&nrm=iso>. Acesso em 24 maio 2013. 412
413
LOPES, E.G.P., MAGALHÃES, D.F., SILVA, J.A., HADDAD, J.P.A., & MOREIRA, E.C. 414
(2010). Distribuição temporal e espacial da leishmaniose visceral em humanos e cães 415
em Belo Horizonte - MG, 1993 a 2007. Arquivo Brasileiro de medicina veterinária e 416
zootecnia, 62(5), 1062-1071. Disponível em:
<http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-418
09352010000500007&lng=en&nrm=iso>. Acesso em 25 de abril de 2013. 419
420
MAIA-ELKHOURY, ANA NILCE SILVEIRA, ALVES, WANESKA A., SOUSA-GOMES, 421
MÁRCIA LEITE DE, DE SENA, JOANA MARTINS DE, & LUNA, A. EXPEDITO. 422
Leishmaniose visceral no Brasil: tendências e desafios. Cad. Saúde Pública, Rio de 423
Janeiro, v.24, n. 12, Dezembro de 2008. Disponível em: 424
<http://www.scielosp.org/scielo.php?script=sci_arttext&pid=S0102-425
311X2008001200024&lng=en&nrm=iso>. Acesso em 24 de maio de 2013. 426
427
MINISTÉRIO DA SAÚDE DO BRASIL. Secretaria de Vigilância em Saúde. 428
Departamento de Vigilância Epidemiológica. Manual de Vigilância e Controle da 429
Leishmaniose Visceral. Série A. Normas e Manuais Técnicos. Brasília, DF; 2003. 430
431
MINISTÉRIO DA SAÚDE. Fundação Nacional de Saúde. Centro Nacional de 432
Epidemiologia. Leishmaniose Visceral no Brasil: situação atual, principais aspectos 433
epidemiológicos, clínicos e medidas de controle. Boletim Epidemiológico 2001. 434
435
MINISTÉRIO DA SAÚDE. Secretaria de Vigilância em Saúde. Departamento de 436
Vigilância Epidemiológica. Manual de vigilância e controle da leishmaniose visceral 437
Ministério da Saúde, Secretaria de Vigilância em Saúde, Departamento de Vigilância 438
Epidemiológica. – Brasília: Editora do Ministério da Saúde, 2006. 120 p. (Série A. 439
Normas e Manuais Técnicos) 440
441
NEVES, David Pereira. Parasitologia humana. 11. ed. São Paulo: Atheneu, 2005. 494 442
p. 443 444
OLIVEIRA, CLAUDIA DI LORENZO; MORAIS, MARIA HELENA FRANCO E 445
MACHADO-COELHO, GEORGE LUIZ LINS. Leishmaniose visceral em grandes 446
cidades brasileiras: desafios para controle. Cad. Saúde Pública [online]. 2008, vol.24, 447
n.12, pp 2953-2958. 448
449
PORTAL DE SERVIÇOS DA SAÚDE, Prefeitura de Belo Horizonte, Disponível em 450
<http://portalpbh.pbh.gov.br> acesso: 15 de maio, 2013. 451
452
PENNA HA. Leishmaniose visceral no Brasil. Bras Méd. 1934; 48: 949-50. 453
454
REY, L. Parasitologia. 2 ed. Rio de Janeiro: Guanabara Koogan, 1991. 455
456
SILVA, EDUARDO, GONTIJO CMF, PACHECO RS, FIUZA VOLP. Leishmaniose 457
Visceral na Região Metropolitana de Belo Horizonte, Estado de Minas Gerais, Brasil. 458
Mem. Inst. Oswaldo Cruz, Rio de Janeiro, v 96, n. 3, abril de 2001. Disponível em: 459
<http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0074-460
02762001000300002&lng=en&nrm=iso>. Acesso em 20 de maio de 2013. 461
462
SILVA ES, GONTIJO CMF, PACHECO RS, FIUZA VOP, BRASIL RP. Leishmaniose 463
Visceral na Região Metropolitana de Belo Horizonte, Estado de Minas Gerais, Brasil. 464
Mem Inst. Oswaldo Cruz 2001; 3: 285-91. 465
466
SABROZA, Paulo Chagastelles. Novas Perspectivas nas análises de padrões de 467
desgaste de grupos populacionais. Inf. Epidemiol. Sus [online]. 2001, vol.10, n.4, pp 468
145-146. ISSN 0104-1673. Disponível em: <ttp://dx.doi.org/10.5123/S0104-469
16732001000400001> Acesso em 09 Março, 2013. 470
TORRES, F.D. Epidemiologia da leishmaniose visceral no município de Paulista, 471
Estado de Pernambuco, nordeste do Brasil. Mestrado em Saúde Pública. FIOCRUZ – 472
Recife, 2006. 473
474
XAVIER-GOMES LUDMILA MOURÃO, COSTA WAGNER BARRETO, PRADO 475
PATRÍCIA FERNANDES, OLIVEIRA-CAMPOS MARYANE, LEITE MAISA TAVARES 476
DE SOUZA. Características clínicas e epidemiológicas da leishmaniose visceral em 477
crianças internadas no Hospital Universitário de Referência no norte de Minas Gerais, 478
Brasil. Rev. bras. epidemiologia, São Paulo, v 12, n. 4, Dezembro de 2009. Disponível 479
em <http://www.scielo.br/scielo.php?script=sci_arttext&pid=S1415-480
790X2009000400005&lng=en&nrm=iso>. Acesso em 15 de maio, 2013. 481