Faculdade de Ciências e Tecnologia
Nanotecnologias Aplicadas ao
Diagnóstico e Tratamento do
Cancro da Mama
Joana de Oliveira Martins
Dissertação para a obtenção do Grau de Mestre em Ciências
Farmacêuticas
Trabalho efetuado sob orientação do Professor Doutor Luis Braz
ii
Universidade do Algarve
Faculdade de Ciências e Tecnologia
Nanotecnologias Aplicadas ao
Diagnóstico e Tratamento do
Cancro da Mama
Joana de Oliveira Martins
Dissertação para a obtenção do Grau de Mestre em Ciências Farmacêuticas
Trabalho efetuado sob orientação do Professor Doutor Luis Braz
iii
Nanotecnologias Aplicadas ao Diagnóstico
e Tratamento do Cancro da Mama
Declaração da autoria de trabalho
Declaro ser o autor deste trabalho, que é original e inédito. Autores e trabalhos consultados estão devidamente citados no texto e constam da listagem de referências incluída.
____________________________________________________________
Copyright © 2017 Joana de Oliveira Martins. Todos os direitos reservados.
A Universidade do Algarve tem o direito, perpétuo e sem limites geográficos, de arquivar e publicitar este trabalho através de exemplares impressos reproduzidos em papel ou de forma digital, ou por qualquer outro meio conhecido ou que venha a ser inventado, de o divulgar através de repositórios científicos e de admitir a sua cópia e distribuição com objetivos educacionais ou de investigação, não comerciais, desde que seja dado crédito ao autor e editor.
iv
ÍNDICE
Índice de Figuras ...vi
Índice de Tabelas ... vii
Siglas ... viii
Resumo ... 1
ABSTRACT ... 2
Capítulo 1- Contextualização ... 3
Capítulo 2 – Cancro da Mama ... 5
Capítulo 2.1 – Características do tecido tumoral. ... 6
Capítulo 2.2 – Fatores de risco do Cancro da Mama ... 7
Capítulo 2.3 – Classificação do Cancro da Mama ... 9
Capítulo 2.3.1 - Sistema TNM ... 9
Capítulo 2.3.2 - Tipo Histológico ... 13
Capítulo 2.3.3 – Classificação molecular (Subtipos intrínsecos) ... 13
Capítulo 3 – Tratamento e diagnóstico do cancro da mama convencional ... 15
Capítulo 3.1 Diagnóstico do cancro da mama ... 15
Capítulo 3.1.1 – Mamografias ... 15
Capítulo 3.1.2-Tomossíntese ... 16
Capítulo 3.1.3 - Ecografia ... 16
Capítulo 3.1.4 – Ressonância Magnética... 17
Capítulo 3.1.5 – Tomografia por Emissão de Positrões... 17
Capítulo 3.1.6 – Biopsia ... 18
Capítulo 3.2 – Tratamento do Cancro da Mama ... 19
Capítulo 3.2.1 – Tratamento Cirúrgico ... 19
Capítulo 3.2.2 – Radioterapia ... 20
Capítulo 3.2.3 – Terapêutica Sistémica ... 21
Capítulo 3.2.3.1- Hormonoterapia ... 21
Capítulo 3.2.3.2 – Quimioterapia antineoplásica ... 23
Capítulo 3.2.4 -Terapêutica direcionada ... 24
Capítulo 4 - Nanotecnologia ... 26
Capítulo 4.1 Nanotecnologia aplicada ao tratamento e diagnóstico do cancro da mama ... 26
v
Capítulo 4.1.2- Nanopartículas transportadoras ... 29
Capítulo 4.1.2.1 -Lipossomas ... 30
Capítulo 4.1.2.2 – Nanopartículas lipídicas sólidas ... 31
Capítulo 4.1.2.3 – Nanoemulsões ... 32
Capítulo 4.1.2.4 – Micelas... 33
Capítulo 4.1.2.5 – Dendrímeros ... 34
Capítulo 4.1.2.6 – Nanopartículas Poliméricas ... 36
Capítulo 4.1.2.7 – Nanopartículas de sílica mesoporosas ... 37
Capítulo 4.1.2.8 – Nanopartículas de Ouro ... 38
Capítulo 4.1.2.9 – Quantum Dots ... 40
Capítulo 4.1.2.10 – Nanopartículas de Oxido de Ferro Superparamagnéticas ... 41
Capítulo 4.1.2.11 – Nanotubos de carbono ... 42
Capítulo 4.1.3 – Terapia Fotodinâmica ... 42
Capítulo 4.1.4 – Terapia Termal ... 43
Capítulo 4.1.5 – Surface-Enhanced Raman Spectroscopy (SERS) ... 44
Conclusão ... 46
vi
ÍNDICE DE FIGURAS
Figura 2.1- Representação da constituição mamária. ... 5
Figura 2.2- Representação dos nódulos linfáticos mamários. ... 5
Figura 2.3 Representação do microambiente tumoral. ... 7
Figura 4.1- Efeito de aumento da permeabilidade vascular e retenção. ... 27
Figura 4.2- Mecanismos de endocitose. ... 28
Figura 4.3- Nanopartículas mais utilizadas como transportadoras. ... 29
Figura 4.4- Estrutura e composição de um lipossoma. ... 30
Figura 4.5- Lipossoma modificado transportador de doxorubicina. ... 31
Figura 4.6- Mecanismo de incorporação de fármaco. ... 34
Figura 4.7- Estrutura dos dendrímeros. ... 35
Figura 4.8- Representação de nanoesferas e nanocapsulas. ... 36
Figura 4.9- Nanopartículas de Sílica Mesoporosas. ... 38
Figura 4.10- Nanopartículas de Ouro. ... 39
vii
ÍNDICE DE TABELAS
Tabela 2.1- Classificação tumoral em relação ao tamanho ... 9
Tabela 2.2 Classificação tumoral em relação ao estado de metastização. ... 10
Tabela 2.3- Resumo dos estadios tumorais. ... 12
Tabela 2.4- Representação dos diferentes subtipo de cancro da mama e as suas caraterísticas ... 14
viii
SIGLAS
18F-FDG Fluorodesoxiglicose Marcada com Flúor-18
CTI Células Tumorais Isoladas
DNA Ácido Desoxirribonucleico
EGFR Recetor do Fator de Crescimento Epidérmico
FDA Food and Drug Administration
HE Teste de Coloração Padrão da Hematoxilina e Eosina
HER-1 Recetor Tipo 1 do Fator de Crescimento Epidérmico Humano
HER-2 Recetor Tipo 2 do Fator de Crescimento Epidérmico Humano
IHQ Testes Imunohistoquímicos
Mi Micrometástases
NOFS Nanopartículas de Oxido de Ferro Superparamagnetico
NS Nanopartículas de Sílica Mesoporosa
PET Tomografia por Emissão de Positrões
RE Recetor de estrogénio
RP Recetor de Progesterona
SERD Selective Estrogen Recetor Downregulator
SERS Surface Enhanced Raman Spectroscopy
NLS Nanopartículas Lipídicas Solidas
TAC Tomografia Computorizada
TOPOII Topoisomerase II
1
RESUMO
O cancro é definido como uma proliferação anormal das células, estando o cancro da mama localizado no tecido mamário. Este é o tipo de cancro mais comum entre as mulheres, estimando-se que cerca de 508 000 mulheres tenham morrido em 2011 a nível mundial. Só em Portugal são detetados anualmente aproximadamente 6000 novos casos, levando à morte cerca de 1.500 pessoas.
O cancro da mama pode ser classificado de acordo com diversos parâmetros, tais como, o estadio, a sua invasividade, histologia, organização do crescimento, diferenciação e o seu subtipo molecular. Através da análise desses parâmetros é estipulada a melhor terapêutica para cada tipo de cancro. A terapêutica do cancro da mama baseia-se em 5 abordagens específicas, a cirurgia, a radioterapia, a quimioterapia, a terapia endócrina e a terapia direcionada. As técnicas usadas no diagnóstico são a mamografia, ecografia, ressonância magnética, tomografia por emissão de positrões, biopsias, e HER-2.
O uso de nanotecnologias no diagnóstico e tratamento do cancro da mama veio revolucionar as técnicas utilizadas, permitindo colmatar as maiores lacunas dos tratamentos e diagnósticos convencionais, nomeadamente a sua toxicidade, seletividade e farmacocinética. As nanotecnologias tiram vantagens do fraco desenvolvimento vascular no tumor e do seu tamanho para melhorar a aceitação do tratamento e diagnóstico. A utilização de nanopartículas transportadoras permite o uso de agentes terapêuticos e de diagnóstico que de outro modo não poderiam ser utilizados. Proteínas, péptidos, pequenas moléculas orgânicas ou anticorpos seletivos a certos recetores específicos, anexadas às nanopartículas, permite aumentar a seletividade e diminuir a toxicidade. Novos métodos terapêuticos e de diagnóstico, tais como a terapia fotodinâmica, a terapia termal e a Surface-Enhanced Raman
Spectroscopy demonstram uma melhor capacidade e eficiência no tratamento e
diagnóstico.
2
ABSTRACT
Cancer is defined as an abnormal proliferation of cells, breast cancer is located in the breast tissue. This is the most common type of cancer between woman, believing that 508000 women died in 2011 worldwide. Only in Portugal about 6000 new cases are detected annually, leading to the death of approximately 1500 people.
The breast cancer can be classified with different parameters like stage, invasiveness, histology, organization of growth, differentiation e molecular subtype. Through analyses of these parameters can be selected the best therapeutic to the different type of cancer. Breast cancer therapy has 5 kinds of technics, surgery, radiotherapy, chemotherapy, endocrine therapy and targeted therapy. The technics used on the diagnosis are echography, magnetic resonance, positron emission tomography, biopsy and HER-2 detection test.
The use of nanotechnologies in breast cancer diagnosis and treatment revolutionized the techniques used. Nanotechnologies allow to fill the gap present in conventional treatments and diagnostics, as their toxicity, selectivity and pharmacokinetics. Nanotechnologies take advantage of poor vascular development of the tumor and size to improve treatment acceptance and diagnosis. Nanoparticles delivery system allows the use of therapeutic agents and diagnose that can´t be use by their own. The use of proteins, peptides, small organic molecules or specific receptors selective antibodies attached to nanoparticles increase the selectivity and decrease toxicity. New therapeutic and diagnostic methods as photodynamic or thermal therapy and Surface-Enhanced Raman Spectroscopy reveal better capacity and efficiency in treatment and diagnosis.
3
1
CAPÍTULO 1- CONTEXTUALIZAÇÃO
O cancro é definido como a proliferação descontrolada, excessiva e indefinida das células que não são adequadamente controladas pelos mecanismos de regulação que operam nos tecidos normais.1 A divisão celular é controlada pela própria célula e pelas células vizinhas. O controlo celular promove o equilíbrio entre a apoptose das células envelhecidas e a renovação celular. Quando as células estão envelhecidas os genes que codificam as proteínas que promovem a apoptose são ativados.2 As células cancerígenas têm a capacidade de superar os limites dos órgãos e invadir os tecidos em seu redor ou disseminarem-se pelo resto do organismo, fenómeno este conhecido como metastização. No cancro da mama, as células anómalas encontram-se normalmente nos ductos ou nos lóbulos mamários, disseminando-se geralmente para os gânglios linfáticos mais próximos, como os da axila ou pescoço.3
O cancro da mama é o cancro mais comum em mulheres estimando-se que cerca de 508 000 mulheres tenham morrido em 2011 a nível mundial.4 Só em Portugal são detetados anualmente aproximadamente 6000 novos casos, levando à morte cerca de 1.500 pessoas.5 O cancro da mama manifesta-se maioritariamente num grupo etário mais velho, no entanto estima-se que 1 em cada 4 mulheres diagnosticadas têm menos de 50 anos, sendo que, mulheres com menos de 35 anos representam menos de 5% de todos os cancros da mama.3 O cancro da mama não é específico das mulheres e cerca de 1% dos casos diagnosticados são homens.5
O cancro da mama pode ser classificado de acordo com diversos parâmetros, tais como, o estadio, a sua invasividade, histologia, organização do crescimento, a sua diferenciação e o seu subtipo molecular. Através da análise desses parâmetros é estipulada a melhor terapêutica para cada tipo de cancro. A terapêutica do cancro da mama baseia-se em 5 abordagens específicas, a cirurgia, a radioterapia, a quimioterapia, a terapia endócrina e a terapia direcionada.3 As técnicas usadas no diagnóstico são a mamografia, imagem de ressonância magnética, imagem molecular mamária, biopsias e testes de deteção de recetor tipo 2 do fator detestes de deteção do recetor tipo 2 do fator de crescimento epidérmico humano (HER-2).6 Alguns destes
4 métodos de diagnóstico e tratamento têm inúmeros efeitos nocivos e riscos para a saúde, tornando indispensável o estudo de substitutos e/ou aperfeiçoamento dos mesmos.7
A aplicação das nanotecnologias no tratamento e diagnóstico do cancro da mama proporciona uma alternativa aos métodos tradicionais. O objetivo do uso das nanotecnologias é diminuir a toxicidade, aumentar o efeito farmacológico e eficácia dos métodos de diagnóstico, através do uso de técnicas que aumentam a seletividade, melhoram a biodistribuição e previnem o aparecimento de resistências.8
5
2
CAPÍTULO 2 – CANCRO DA MAMA
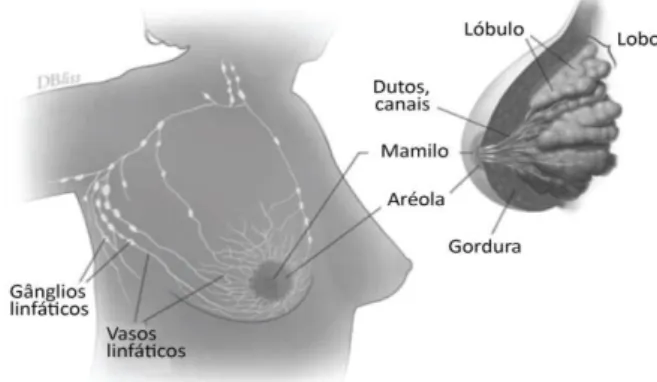
O cancro da mama é definido pelo cancro que se encontra no tecido mamário, sendo mais comum desenvolver nos ductos ou nos lóbulos.3 A mama é constituída por tecido glandular com um estroma fibroso denso. O tecido glandular é composto por lóbulos que se agrupam em conjuntos de 15 a 25 lobos. Os dutos formam um sistema de transporte do leite materno desde os lóbulos até ao mamilo, como está representado na figura 2.1. A parte superior da mama tem uma maior percentagem do tecido glandular, consequentemente metade dos cancros da mama são aí desenvolvidos.9 Os principais nódulos linfáticos envolvidos no cancro da mama são os axilares, representados na figura 2.2 com os números 1 ,2 e 3, os supraclaviculares, na mesma figura correspondente ao número 4, e os nódulos mamarios interiores, numero 5.9
Figura 2.1- Representação da constituição mamária.3
6
2.1 Capítulo 2.1 – Características do tecido tumoral
Os inúmeros estudos desenvolvidos ao longo dos anos sobre o cancro permitiram uma melhor compreensão do microambiente e composição do mesmo. Através destes estudos foi possível desenvolver terapêuticas e diagnósticos direcionados às características específicas dos tecidos neoplásicos.10
O tecido cancerígeno é composto por uma parte não celular, vascular e intersticial, e outra parte celular que diferem as células normais das células neoplásicas.10
No contexto da parte não celular, a vascularização não é homogénea por todo o tumor, existindo áreas com uma vasta vascularização e um grande aporte de oxigénio e nutrientes, e outras em que tal não acontece, sendo que são caracterizadas pelos baixos níveis de oxigénio e de nutrientes. O tumor vai produzir novos vasos sanguíneos, num processo denominado angiogénese. Os novos vasos vão apresentar anomalias estruturais sinuosas, pericitos deficientes e membrana basal imperfeita com várias fendas numa escala nanométrica.7 A permeabilidade vascular vai depender de vários componentes, como os fatores de crescimento endotelial vascular (VEGF), a bradiquinina, a prostaglandina e o óxido nítrico, aumentando a permeabilidade.7
O espaço intersticial do tumor vai diferir dos tecidos normais pois vai apresentar uma quantidade acrescida de colagénio e de fibra elástica.10
As características referidas anteriormente e uma fraca drenagem linfática proporcionam uma amplificação da permeabilidade e da retenção tumoral. Este efeito melhora a biodistribuição das substâncias ativas e dos agentes de diagnóstico na parte vascularizada do tumor, enquanto que a distribuição até à área menos vascularizada é afetada.7
Na figura 2.3 estão representados os diferentes elementos que afetam o microambiente tumoral.
7 Figura 2.3 Representação do microambiente tumoral.7
Em adição aos fatores referidos anteriormente, há que ter em conta a heterogeneidade celular tumoral, a capacidade de adaptação celular que leva às resistências terapêuticas, e a acidificação do microambiente devido à carência de oxigénio. Se por um lado estes fatores dificultam a eficiência do tratamento convencional, por outro lado podem ser explorados por novas formulações para aumentar a eficácia.7,8
2.2 Capítulo 2.2 – Fatores de risco do Cancro da Mama
Os fatores de risco são comportamentos ou condições que aumentam o risco de uma doença se desenvolver. A presença de um fator de risco não implica obrigatoriamente o aparecimento do cancro da mama e este até se pode desenvolver em indivíduos que não apresentem nenhum fator de risco.11
8 Os principais fatores de risco associados ao cancro da mama são:3,5,11
• Idade - o envelhecimento aumenta as probabilidades de aparecimento de cancro;
• Antecedentes familiares - cerca de 10% dos casos de cancro da mama possuem um caracter genético hereditário. Quando vários membros da mesma família desenvolvem cancro da mama e/ou cancro do ovário deve-se por a hipótese de uma predisposição genética;
• Antecedentes pessoais - pessoas com historial de cancro, seja cancro da mama ou outro cancro benigno, tem um risco acrescido de desenvolvimento do cancro da mama;
• Exposição a estrogénio e progesterona - as mulheres que tiveram a primeira menstruação antes dos 12 anos e a ultima depois dos 55 anos tem um risco acrescido. As mulheres que tiveram a primeira gravidez depois dos 30 anos ou não tiveram filhos apresentam também um risco aumentado;
• Terapêutica hormonal de substituição - O uso de terapia hormonal, na menopausa, por períodos superiores a 5 anos aumenta o risco de desenvolvimento do cancro da mama;
• Raça - o cancro da mama desenvolve-se com uma maior frequência em mulheres caucasianas, comparativamente com as outras raças;
• Radioterapia no peito - o uso de radioterapia na zona do peito antes dos 30 anos proporciona um risco mais elevado;
• Densidade mamária - mulheres mais velhas que apresentem, essencialmente, tecido denso numa mamografia, têm risco aumentado;
• Obesidade após a menopausa - a obesidade influencia o nível de estrogénio corporal, uma vez que o tecido adiposo produz estrogénio o que provoca um acréscimo do risco de desenvolvimento de cancro da mama. O estrogénio pode também potenciar o crescimento do tumor, dependendo do tipo de cancro; • Inatividade física - a prática de desporto e um estilo de vida ativo diminui o
risco de desenvolvimento do cancro da mama;
9
2.3 Capítulo 2.3 – Classificação do Cancro da Mama
O cancro, nomeadamente o cancro da mama, tem diferentes classificações sendo os mais importantes o sistema TNM, o tipo histológico e classificação molecular.12
2.3.1 Capítulo 2.3.1 - Sistema TNM
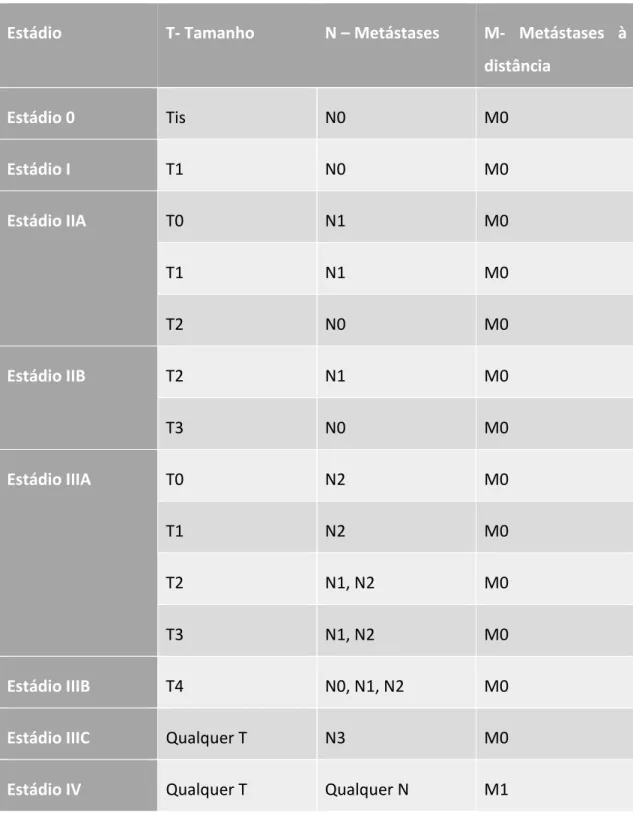
O sistema TNM baseia-se no tamanho do tumor primário (T), estado de metastização dos nódulos linfáticos (N) e metástases à distância (M).12
Na tabela 2.1 estão sintetizadas as diferentes classificações tumorais em relação ao tamanho.
Tabela 2.1- Classificação tumoral em relação ao tamanho12,9
Tis Carcinoma ductal in situ
Tx Carcinoma que o tumor primário não consegue ser classificado
T0 Carcinoma que não apresenta evidencia de tumor primário
T1 Carcinoma com uma lesão com um tamanho inferior a 2cm
• T1mic - lesão com um tamanho inferior a 0.1 cm • T1a- lesão com um tamanho entre 0.1cm a 0.5 cm • T1b – lesão com um tamanho entres 0.5cm a 1 cm • T1c – Lesão com um tamanho entre 1 a 2 cm
T2 Carcinoma com uma lesão com um tamanho entre os 2 cm e os 5 cm
T3 Carcinoma com uma lesão com um tamanho superior a 5 cm
10 Tabela 2.1- Classificação tumoral em relação ao tamanho(continuação) 12,9
• T4a - A lesão estende-se até à cavidade torácica não atingindo os músculos peitorais
• T4b – Lesão com edema, apresenta pele de laranja, ulcerações da pele ou nódulos de pele satélite
• T4c – Lesão com as características do T4b com uma extensão à cavidade torácica
T4d – Carcinoma inflamatório
O (N) estado de metastização dos nódulos linfáticos é muito importante para determinar o prognóstico e plano de tratamento mais adequado. Na tabela 2.2 encontra-se resumida a classificação em relação ao estado de metastização.9
Tabela 2.2 Classificação tumoral em relação ao estado de metastização.9
N0 Não apresenta metastização ganglionar
N1 Apresenta metástases ipsilaterais movíveis no nódulo linfático axilar
N2 • N2a – Metástases fixas ou aderidas a um nódulo linfático axilar
• N2b – Metástases ipsilaterais dos nódulos mamários internos
N3 • N3a - Metástases ipsilaterais no nódulo linfático infraclavicular
com envolvimento do nódulo linfático axilar
• N3b – Metástases ipsilaterais no nódulo linfático mamário interno com evidencia clinica de metástases no nódulo linfático axilar • N3c – Metástases ipsilaterais dos nódulos linfáticos
11 O uso de biopsias dos nódulos linfáticos sentinela e testes imunohistoquímicos (IHQ) permitiram uma classificação mais específica das metástases dos nódulos linfáticos. O pN0(i-) significa que não há metástases nos nódulos linfáticos regionais através do teste de coloração padrão da hematoxilina e eosina (HE) e tem um IHQ negativo. O pn0(i+) apresenta um resultado negativo pelo teste HE e o teste IHQ positivo com um agrupamento celular inferior a 0,2 mm, este agrupamento celular e denominado por células tumorais isoladas (CTI). Micrometástases tem um diâmetro entre 0,2 a 2 mm. O pN1 designa que existe metástases em 1 até 3 nódulos linfáticos axilares ou metástases microscópicas nos nódulos linfáticos mamários internos.13 O pN1 desdobra-se em três subgrupos, o pN1a, o pN1b e o pN1c, sendo que corresponde a 1 até 3 metástases nos nódulos linfáticos axilares, metástases no nódulo linfático mamário interno com identificação através da dissecção de nódulos linfáticos sentinela e 1 a 3 metástases nos nódulos linfáticos axilares mais micrometástases num nódulo linfático mamário interno, respetivamente.13 As metástases em 4 até 9 nódulos linfáticos axilares ou metástases nos nódulos linfáticos mamário interno sem o envolvimento dos nódulos linfáticos axilares são considerados pN2. O pN2a corresponde a metástases em 4 até 9 nódulos linfáticos axilares com pelo menos uma das metástases com um tamanho mínimo de 2 mm. O pN2b classifica metástases no nódulo linfático mamário interno sem o envolvimento dos nódulos linfáticos axilares.13 O termo pN3 corresponde a 10 ou mais nódulos linfáticos axilares com metástases, metástases nos nódulos linfáticos infraclaviculares, ou metástases nos nódulos linfáticos mamários internos com envolvimentos de um ou mais nódulos linfáticos axilares, ou metástases em 3 ou mais nódulos linfáticos axilares mestatisados com micrometástases nos nódulos linfáticos mamários internos ou metástases ipsilaterais nos nódulos linfáticos supraclaviculares. Quando já existem metástases em 10 ou mais nódulos linfáticos axilares com pelo menos uma metástase com um tamanho superior a 2mm ou metástases que envolvam o nódulo linfático infraclavicular são classificados de pN3a. O pN3b corresponde as metástases ipsilaterais dos nódulos linfáticos mamários internos com 1 ou mais nódulos linfáticos axilares envolvidos ou metástases em 3 ou mais nódulos linfáticos axilares com o envolvimento de micrometástases de nódulos linfáticos mamários internos. O pN3c classifica metástases ipsilaterais de nódulos linfáticos supraclaviculares.13
12 A classificação das metástases à distância divide-se em M0, quando não existe presença de metástases à distância e M1 quando existem metástases à distância. 9
Na tabela 2.3 estão resumidos os estadios tumorais.
Tabela 2.3- Resumo dos estadios tumorais.14
Estádio T- Tamanho N – Metástases M- Metástases à distância Estádio 0 Tis N0 M0 Estádio I T1 N0 M0 Estádio IIA T0 N1 M0 T1 N1 M0 T2 N0 M0 Estádio IIB T2 N1 M0 T3 N0 M0 Estádio IIIA T0 N2 M0 T1 N2 M0 T2 N1, N2 M0 T3 N1, N2 M0 Estádio IIIB T4 N0, N1, N2 M0
Estádio IIIC Qualquer T N3 M0
13
2.3.2 Capítulo 2.3.2 - Tipo Histológico
O cancro da mama a nível histológico divide-se em dois grupos, os carcinomas invasivos e os carcinomas não invasivos ou in situ.15
Os carcinomas não invasivos são compostos por células cancerígenas que se encontram nos canais ductais e que não se expandem para tecidos adjacentes. 15
Os carcinomas invasivos dividem-se em várias categorias consoante as suas categorias histológicas, sendo que o mais comum é o carcinoma invasivo de tipo não específico.16
2.3.3 Capítulo 2.3.3 – Classificação molecular (Subtipos intrínsecos)
Com o estudo do ácido desoxirribonucleico (DNA) do cancro foi possível desenvolver uma classificação que se divide em subtipos que representam entidades biológicas distintas baseadas no padrão e expressão genómica. Existem 5 subtipos intrínsecos, luminal A, luminal B, luminal B enriquecido em HER-2, HER-2 positivo não luminal e triplo negativo.12 O estudo destes subtipos permite um prognóstico mais exato e um planeamento terapêutico mais eficiente. Os subtipos dividem-se baseados em diferentes parâmetros, nomeadamente a existência de recetores hormonais de estrogénio e progesterona, o estado de HER-2 e o ki-67, que serão abordados mais à frente. O perfil de expressão de múltiplos genes também pode ser analisado pois permite uma previsão de recidiva e o beneficio da quimioterapia.3
As células tumorais podem apresentar recetores de estrogénio e de progesterona à sua superfície ou mesmo no interior das mesmas. Quando 1% ou mais das células neoplásica tem recetores de estrogénio ou de progesterona são consideradas positivas e vão reagir à terapêutica hormonal.12 Estas hormonas estimulam o crescimento e multiplicação das células neoplásicas quando estas apresentam estes recetores.3 O HER-2 é uma proteína que costuma estar localizada à superfície da célula. Há 3 formas para analisar este fator, por imunohistoquimica, por hibridização in situ com uma
14 sonda fluorescente ou por hibridização in situ cromogénica. Considera-se um tumor HER-2 positivo quando o teste imunohistoquimico é 3+ (marcação completa, circunferencial e intensa em mais de 10% das células) ou quando o teste de hibridização in situ com uma sonda fluorescente e por hibridização in situ cromogénica tem resultados positivos. O HER-2 está presente em 20% dos casos de cancro da mama, sendo que esta envolve-se no crescimento e migração celular.3
O índice de ki-67 corresponde à expressão da proteína ki-67, o ki-67 é uma proteína que codifica o anticorpo monoclonal ki-67 que está associado à proliferação celular nomeadamente à transcrição ribossomal de RNA, e é analisada através de imunohistoquímica. Este índice estima a fração de células que se encontram em proliferação.12 O nível de proliferação influencia a sensibilidade que o tumor tem à quimioterapia, um tumor com um alto índice ki-67 é mais sensível a este tipo de tratamento.3
Na tabela 2.4 estão representados os diferentes subtipos de cancro da mama e as suas diferentes características.
Tabela 2.4- Representação dos diferentes subtipo de cancro da mama e as suas caraterísticas3
Subtipos de cancro da mama
Estado do recetor de hormonas
Estado do HER-2 Estado do Ki-69
Luminal A RE+ e/ou RP + Negativo Baixo (<14%)
Luminal B HER-2 negativo
RE+ e/ou RP + Negativo Alto
Luminal B HER-2 positivo
RE+ e/ou RP + Positivo Qualquer
HER-2 positivo não luminal
RE- e RP - Positivo Qualquer
15
3
CAPÍTULO 3 – TRATAMENTO E DIAGNÓSTICO CONVENCIONAL DO CANCRO
DA MAMA
O cancro da mama tem que ser abordado por uma equipa multidisciplinar que englobe desde médicos oncológicos a técnicos de imagiologia, os quais se devem reunir antes de começar a terapêutica. A decisão terapêutica deve ter em conta exames imagiológicos, laboratoriais, relatório anátomo-patológico e os dados da historia clinica. A decisão só é comunicada ao paciente quando é aprovada por todos os membros da equipa. Após o diagnóstico, tem que se agir o mais rápido possível, sendo que o intervalo máximo entre o diagnóstico e o inicio da terapêutica deve ser de 4 semanas, podendo em casos extremos alongar-se às 12 semanas.17
As normas existentes servem de guia ao tratamento, não sendo obrigatório segui-las, e a equipa deve planear a terapêutica consoante o caso e adaptá-la. A equipa tem que se manter atualizada sobre os progressos a nível da terapêutica.17
3.1
Capítulo 3.1 Diagnóstico do cancro da mama
O cancro da mama pode ser diagnosticado após um teste de rastreio ou de profilaxia. O diagnóstico é geralmente feito a partir de mamografias, ecografias, tomossíntese, ressonância magnética, tomografia de emissão de positrões ou biopsia.14
3.1.1 Capítulo 3.1.1 – Mamografias
A mamografia baseia-se na exposição de uma pelicula fotográfica a raio-x. A imagem pode ser armazenada em formato analógico, digitalização indireta e digitalização
16 direta. Com a mamografia digital é possível utilizar software que deteta o cancro através algoritmos, permitindo assim uma redução dos erros de diagnóstico.3,18,19
Este é o principal método de diagnóstico do cancro da mama.3
3.1.2 Capítulo 3.1.2-Tomossíntese
A tomossíntese, também conhecida como mamografia 3D ou tomografia computorizada (TAC), consiste na realização de imagens tomográficas contínuas da mama.12 Esta técnica é realizada num equipamento semelhante ao da mamografia mas preparado para a realização de imagens sucessivas com diferentes ângulos, produzindo imagens de cortes finos, geralmente de 1mm de espessura.18 Este método permite contornar algumas das limitações da mamografia, nomeadamente a ocultação de anomalias por sobreposição de estruturas. As mamografias em mamas com elevada densidade têm uma sensibilidade diminuída sendo que o método da tomossíntese é o mais indicado.12,18
3.1.3 Capítulo 3.1.3 - Ecografia
A ecografia é um método que permite complementar a informação obtida através da mamografia, de modo a confirmar a presença de anomalias.12 Este método é a primeira escolha em jovens, grávidas e lactentes, também sendo muito utilizado para distinguir e caracterizar nódulos sólidos e cistos que possam ter sido identificados na mamografia, avaliar nódulos palpáveis em mamas muito densas e analisar implantes mamários. A resposta ao tratamento quimioterápico pode ser monitorizada através de ecografia mamária.19
A ecografia baseia-se no uso de ultrassons e das suas propriedades, nomeadamente a sua reflexão nas estruturas do organismo. Os ultrassons têm uma reflexão diferente
17 conforme a densidade e a composição das estruturas criando uma imagem que pode ser utilizada para diagnóstico.20
3.1.4 Capítulo 3.1.4 – Ressonância Magnética
A ressonância magnética utiliza um campo magnético de modo a gerar imagens das estruturas do organismo. Durante esta técnica de diagnóstico, o corpo está envolvido num campo magnético potente e sujeito a ondas de radio. A imagem é criada com base nos movimentos dos átomos de hidrogénio que se encontram no organismo, quando estes estão sujeitos ao campo magnético e as ondas radio. Através de programas computacionais é possível gerar imagens tridimensionais.21
A ressonância magnética destaca-se das restantes técnicas devido ao seu nível de sensibilidade, sendo uma das técnicas mais precisas na deteção do carcinoma maligno da mama.18 A especificidade desta técnica varia, sendo que nas mulheres mais jovens pode originar falsos positivos. O aumento da especificidade deve-se à melhoria da técnica, desenvolvimento tecnológico e formação dos técnicos especializados.3
3.1.5 Capítulo 3.1.5 – Tomografia por Emissão de Positrões
A tomografia por emissão de positrões (PET) é uma técnica que utiliza moléculas radioativas para obter uma imagem. Normalmente é utilizado um derivado da glicose marcado com um radiofármaco, sendo o mais utilizadoa fluorodesoxiglicose marcada com Flúor-18 (18F-FDG).22 A tomografia por emissão de positrões é extremamente sensível, permitindo detetar precocemente alterações metabólicas e funcionais que antecipam alterações estruturais tornando possível diagnosticar carcinomas em estados mais iniciais. 23
18 A biodistribuição dos radiofármacos permite obter uma imagem clara de onde o radiofármaco está distribuído no organismo. O radiofármaco vai-se acumular onde existe um maior gasto energético, ou seja, as células com grande capacidade proliferativa, nomeadamente as células tumorais. A atividade metabólica das células cancerígenas permite fazer o diagnóstico de tumores, classificar o seu estádio, deteção de recidivas, metástases e o prognóstico do carcinoma.22,24
3.1.6 Capítulo 3.1.6 – Biopsia
Uma biopsia consiste num exame em que é retirado uma pequena amostra de tecido ou liquido da mama, de modo a auxiliar o diagnóstico médico após análises histológicas.17
Este exame pode ser orientado de 3 maneiras sendo estas, ecografia, estereotaxia (mamografia) e ressonância magnética.25 O tecido para amostra pode ser recolhido utilizando diferentes métodos, nomeadamente:25,26
• Biopsia aspirativa ou punção aspirativa por agulha fina - é utilizado uma agulha fina que aspira o tecido a analisar;
• Biopsia “Core” ou Microbiopsia - é utilizada uma agulha de maior calibre para a obtenção da amostra;
• Biopsia assistida por vácuo - é uma biopsia em que é necessário um corte e é associado a aspiração por vácuo de modo a ter a maior quantidade possível de tecido. É o método preferencial em lesões de pequenas dimensões ou em situações que a lesão está muito dispersa e mal delineada. No último caso, por vezes é utilizado um clip de titânio de modo a marcar a região para uma avaliação mais detalhadamente da evolução do mesmo;
• Biopsia cirúrgica - é uma biopsia incisional em que é removido uma amostra de um nódulo ou de uma zona anormal. Se a biopsia é excisional, é removido por completo o nódulo ou zona anormal.
19 Através deste processo é possível classificar o tumor em relação aos seus subtipos. 25
3.2
Capítulo 3.2 – Tratamento do Cancro da Mama
O tratamento do cancro da mama divide-se em 3 vertentes: tratamento cirúrgico, tratamento sistémico e radioterapia. A utilização destas 3 técnicas não é obrigatória, sendo que o tratamento varia consoante o tamanho da mama, o volume tumoral, o estadiamento, e a sua histologia.12,17
3.2.1 Capítulo 3.2.1 – Tratamento Cirúrgico
A evolução do tratamento do cancro da mama é notória, a abordagem utilizada tem tendência a ser menos invasiva. Com o aumento generalizado dos rastreios é possível a deteção de pequenas lesões e lesões não palpáveis o que permite o uso de uma terapêutica menos agressiva.12
O diagnóstico histológico por biopsia é muito importante, sendo necessário obtê-lo antes de iniciar a terapêutica. Quando os resultados das biopsias não são concordantes com os estudos de imagem, hiperplasias atípicas ou de tumores papilares é necessário fazer uma biopsia excisional. As biopsias excisionais têm como objetivo a ressecção da lesão com uma margem preferencialmente de 1cm, sendo que em alguns casos pode ser um tratamento local definitivo.17
Nas cirurgias conservadoras pretende-se a excisão do carcinoma com margens livres de tumor e com o melhor resultado estético possível. E necessário efetuar radioterapia após esta cirurgia para minimizar recidivas. Em comparação com a mastectomia, a cirurgia conservadora proporciona taxas de sobrevivência
20 equiparáveis, as recidivas a longo prazo são mais frequentes, sendo necessário manter uma maior vigilância na mama operada.12,17
Nos tumores de maiores dimensões é necessário a redução do seu tamanho através de radioterapia e de terapêutica sistémica de modo a ser possível efetuar cirurgia conservadora.17
O uso da mastectomia, remoção da mama por inteiro, está associada a uma maior morbilidade cirúrgica e maiores sequelas psicossociais. A mastectomia só deve ser realizada quando não é possível a realização de radioterapia adjuvante, por deliberação do doente, nos carcinomas multicêntricos, nos carcinomas inflamatórios, em microcalcificações malignas diagnosticadas por biopsia com uma distribuição muito extensa e na impossibilidade de obter margens livres apos varias tentativas de cirurgia conservadora.12,17
Após a realização da mastectomia é necessário analisar a possibilidade da reconstrução mamária. A reconstrução mamária pretende que o doente fique com aparência simétrica. Esta pode ser imediata ou diferida, sendo que a imediata permite evitar as sequelas psicossociais, e o doente tem apenas uma intervenção cirúrgica e um período de hospitalização. Existem duas técnicas de reconstrução sendo uma efetuada com tecidos autólogos (retalhos) e a outra com tecidos heterólogos (próteses).12,17
3.2.2 Capítulo 3.2.2 – Radioterapia
A radioterapia consiste na utilização de radiação semelhante ao Raio-x convencional, mas com fotões de alta energia. A radiação utilizada é geralmente gerada num acelerador linear.27
A radioterapia danifica o DNA das células tumorais o que leva a uma diminuição da proliferação celular das células tumorais e à sua morte.28
21 A radioterapia é utilizada como um tratamento adjuvante, e utilizado após as cirurgias conservadoras para evitar as recidivas, após mastectomia para redução das recidivas loco-regional e aumentar a sobrevivência, e usada nos tumores avançados de modo a diminuí-lo ou como tratamento loco-regional definitivo.17
A realização de TAC é obrigatória para planeamento do local que vai ser irradiado e proceder ao estudo da dosimetria através da técnica computorizada 3D.17
A radioterapia pode ser externa (fotões ou eletrões) ou pode ser braquiterapêutica intersticial (radioterapia interna), sendo neste caso fundamental que o cirurgião delimite o local com clips cirúrgicos de titânio.17
3.2.3 Capítulo 3.2.3 – Terapêutica Sistémica
Com a evolução da tecnologia foi possível classificar os tumores em relação as suas características, o que permitiu que a terapêutica se tornasse mais adequada e individualizada. A análise das características tumorais tornou-se indispensável para seleção e planeamento do tratamento. Um tumor que apresente recetores hormonais não tem uma resposta tão eficaz à quimioterapia em comparação com os tumores que não apresentam estes recetores. Um tumor que apresente uma sobreexpressão de HER-2 é previsível que tenho uma resposta ao anticorpo monoclonal anti-HER-2, o trastuzumab.29
3.2.3.1 Capítulo 3.2.3.1- Hormonoterapia
A hormonoterapia esta indicada sempre que há uma expressão de recetores
hormonais, nomeadamente no cancro da mama luminal.12
22 • os modeladores seletivos dos recetores de estrogénio, nomeadamente o
tamoxifeno;
• redutores do nível de estrogénio na circulação, como supressão ovárica, agonistas da hormona libertadora de hormona luteinizante e os inibidores da aromatase;
• antagonistas dos recetores de estrogénio, como o fulvestrant.
O tamoxifeno atua por inibição competitiva na ligação do estrogénio aos recetores, o que permite uma inibição da expressão dos genes que regulam o estrogénio. Estes genes estão responsáveis pela segregação dos fatores de crescimento e angiogénicos, pelo que a sua inibição provoca um bloqueio na fase G1 prevenindo a proliferação celular e podendo também reduzir a apoptose.17,29
A redução do nível de estrogénio circulante é diferente na mulher pré-menopáusica e pós-menopáusica. Para uma mulher pré-menopáusica é possível através de duas técnicas, a supressão ovárica que é um procedimento definitivo, ou, através da administração de agonistas da hormona libertadora de luteinizante. Os agonistas da hormona libertadora de luteinizante inibem a produção de estrogénio pelo ovário através da inibição do eixo hipotálamo-hipófise-ovário.29
Na mulher pós-menopáusica são usados, geralmente, os inibidores da aromatase, que vão inibir a aromatase, uma enzima do citocromo P-450 que catalisa a conversão de androgénios, como é o caso da testosterona e androstenediona, em estrogénios. Nas mulheres pós-menopáusica a aromatase é produzida nos músculos e no tecido adiposo. Os inibidores da aromatase podem atuar por dois mecanismos, o tipo I ou inativadores e o tipo II ou inibidores competitivos. Os inibidores da aromatase tipo I são esteroides que provocam uma inativação irreversível da aromatase enquanto que os inibidores tipo II são não-esteroides e produzem uma inativação reversível. O inibidor tipo I é o exemestano e do tipo II e o anastrazol e o letrozol.29
O fulvestrant é um antagonista dos recetores de estrogénios, como acontece com o tamoxifeno, mas vai atuar de modo diferente. A ativação da transcrição pelos recetores de estrogénio tem dois modos, a função de ativação 1 e a função de ativação
23 2. O tamoxifeno apenas inativa a função de ativação 2 enquanto que o fulvestrant consegue inativar as duas. Esta capacidade do fulvestrant vai permitir uma supressão completa da expressão dos genes dependentes de estrogénio, também descrito como
selective estrogen recetor downregulator (SERD).12,29
Capítulo 3.2.3.2 – Quimioterapia antineoplásica
A quimioterapia pode ser usada de duas formas distintas, como terapia neo-adjuvante e como terapia adjuvante. A terapia neo-adjuvante pretende reduzir um tamanho tumoral para um posterior tratamento cirúrgico e radioterapêutico. O uso de quimioterapia pré-operatoria permite a avaliação individual da quimiossensibilidade tumoral e permite o uso de técnicas cirúrgicas conservadoras. A quimioterapia adjuvante pretende prevenir a recorrência por micrometástases existentes no momento do diagnóstico, prevenindo assim que ocorra uma metastização para outros órgãos.29
A quimioterapia neo-adjuvante utiliza antraciclinas que são antibióticos com ação antitumoral (doxorrubicina, epirrubicina e daunorrubicina) e taxanos (paclitaxel e docetaxel).
As antraciclinas tem um mecanismo de ação que permite inibir a enzima topoisomerase II (Topo II) através de complexos estabilizadores de Topo II-DNA, estes compostos formam também lesões tipo adutos, pontes intercadeias de DNA e espécies reativas de oxigénio. A enzima topoisomerase tem uma função fundamental na replicação, reparação e transcrição do DNA.30
Os taxanos tem uma ação sobre a fase M das células, impossibilitam a formação do fuso mitótico como a sua separação e migração dos cromossomas, parando a divisão celular.31
24 A ciclofosfamida pertence ao grupo dos agentes alquilantes, é bastante reativa e consegue introduzir grupos alquilo em locais nucleófilos das moléculas de DNA, formando ligações covalentes, parando o crescimento celular. A ciclofosfamida é um pró-fármaco, necessitando de ser metabolizada pelo fígado na enzima p450 para se tornar ativa.32
O metotrexato é um antagonista dos folatos. Os folatos são indispensáveis para a síntese de DNA e RNA pois são um cofator da biossíntese das purinas e pirimidinas. O acido fólico liga-se a à enzima dihidrofolato redutase levando à síntese de timidina. O metotrexato tem mais afinidade que o ácido fólico para a enzima dihidrofolato redutase inibindo-a e consequentemente bloqueia a síntese de timidina e do DNA e RNA.33
O 5-fluorouracilo é um análogo das pirimidinas, que vai inibir as enzimas que produzem timina de inúmeras formas, de modo a inibir a síntese de DNA e RNA impedindo a replicação celular.33
3.2.4 Capítulo 3.2.4 -Terapêutica direcionada
A terapêutica direcionada baseia-se no uso de imunoterapia de modo a interagir com alvos específicos. Esta terapêutica foi possível desenvolver devido à evolução da tecnologia que permite caracterizar os diferentes tipos de tumor.3
A terapêutica direcionada atua em alvos moleculares de modo a impedir a disseminação e proliferação tumoral. Esta terapêutica utiliza proteínas, nomeadamente anticorpos monoclonais tais como o trastuzumab, o pertuzumab, o lapatinib e o bevacizumab.12
O trastuzumab é um anticorpo monoclonal recombinante humanizado com anti-HER2 que é utilizado nos tumores com sobreexpressão de HER-2. O trastuzumab demonstrou inibir a proliferação das células tumorais deste tipo de tumores ao ligar-se aos HER-2. Este tratamento pode potenciar cardiotoxicidade, principalmente
25 combinado com antraciclinas, sendo necessário que os doentes sejam monitorizados durante o tratamento.29
O pertuzumab é um anticorpo monoclonal que se liga ao HER-2, como o trastuzumab, inibindo o crescimento tumoral e podendo provocar a apoptose das células cancerígenas.34 Tem um mecanismo de ação complementar diferente do trastuzumab, o que permite um bloqueio de HER-2 superior. Este fármacos foi o primeiro agente oncológico a ter o seu processo de aprovação acelerado pela FDA (Food and Drug Administration).35
O lapatinib é uma terapêutica de segunda linha, este é utilizado em tumores que têm uma sobreexpressão de HER-2 que evoluíram após o uso de trastuzumab. O lapatinib é um inibidor da tirosinocinase, que pode ser administrado por via oral, sendo um inibidor reversível do HER-2 e HER-1.29
O bevacizumab é um anticorpo monoclonal usado nos cancros com uma sobreexpressão de VEGF. O bevacizumab vai inibir a ligação do VEGF aos recetores das células endoteliais vasculares. O VEGF é um mediador da angiogénese que atua no processo de proliferação celular do tumor.29
26
4
CAPÍTULO 4 - NANOTECNOLOGIA
O uso da nanotecnologia no tratamento e diagnóstico do cancro da mama tem vindo a aumentar pois oferece vantagens relativamente aos métodos tradicionais. Através do recurso às nanotecnologias é possível aumentar a biodisponibilidade dos fármacos, melhorar a especificidade e absorção dos compostos, aperfeiçoar a distribuição e a sua farmacocinética, aumentar a sua eficiência e diminuir a toxicidade sistémica. Uma das nanotecnologias mais utilizadas são as nanopartículas.36
As nanopartículas podem ser definidas como partículas de diâmetro ou comprimento igual ou inferior a 100 nm e igual ou superior a 1 nm, sendo que há autores que defendem que devem ser definidas como partículas com um tamanho inferior a 1000 nm e superior a 1 nm.37,38
Capítulo 4.1 Nanotecnologia aplicada ao tratamento e diagnóstico do cancro
da mama
As células tumorais desenvolvem mecanismos de quimioresistência, o que provoca uma redução da eficácia do fármaco. Estes mecanismos podem ser uma redução da absorção do fármaco, aumento do metabolismo, excreção do fármaco ou uma fraca difusão na massa tumoral. As nanotecnologias têm vindo a demonstrar uma capacidade de superar esses mecanismos.39
As nanopartículas podem ser aperfeiçoadas de modo a criar nanopartículas “inteligentes” que conseguem atravessar as barreiras biológicas, entrar em células alvo e desta forma entregar fármacos de modo controlado. Estas partículas podem ser produzidas utilizando metais, óxidos de metais, carbono, polímeros, lípidos, proteínas, ácidos nucleicos, etc.40
O uso de pequenas moléculas com um tamanho aproximado de 1 nm nas técnicas de diagnóstico é recorrente, como no caso do PET em que é utilizado 18F-FDG. No entanto, o uso de pequenas moléculas tem desvantagens, como a sua baixa
27 estabilidade, sinal de fraca intensidade, pequena sensibilidade e especificidade, rápida eliminação pelo organismo. Deste modo foi necessário encontrar uma maneira de eliminar estas desvantagens o que levou ao aperfeiçoamento das nanotecnologias.8
Capítulo 4.1.1 -Passive targeting e Active targeting
As nanotecnologias podem ser usadas para aumentar a especificidade do tratamento e diagnóstico do cancro da mama de duas maneiras, através de passive targeting e
active targeting.40
O passive targeting utiliza as propriedades das nanopartículas de modo a atuar de modo mais seletivo nos tumores.40
Como já foi referido, os vasos sanguíneos que irrigam os tumores estão mal estruturados, apresentando falhas com dimensões entre os 600 nm e os 800 nm. Desta forma, as nanopartículas podem passar por essas falhas, acumulando-se no interior dos tecidos tumorais, como representado na figura 4.1.8
28 Este tipo de targeting apresenta algumas desvantagens tal como uma concentração de nanopartículas não homogénea, levando a que partes do tumor apresentem uma concentração muito elevada de nanopartículas enquanto que outras não apresentam nanopartículas, a acumulação de nanopartículas no tumor pode variar com muitos fatores, nomeadamente, o tamanho do tumor, a superfície tumoral, a angiogénese e a semi-vida da partícula.8
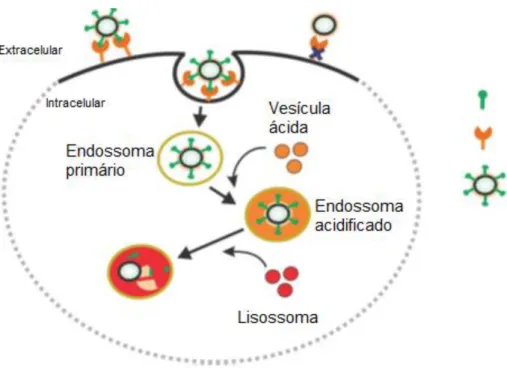
No active targeting o principal objetivo é melhorar a seletividade. São utilizados segmentos como proteínas, péptidos, pequenas moléculas orgânicas ou anticorpos, que se conjugam às nanopartículas ou moléculas de modo a se tornarem específicos a um determinado tipo de recetores que se encontra com sobreexpressão no tumor. Podem também ser utilizados suplementos necessários para a proliferação celular ligados às nanopartículas, como é o caso do acido fólico, visto que o tumor apresenta uma expressão do seu transportador. No active targeting as nanopartículas conjugadas conseguem entrar para a célula principalmente pela via da endocitose, mecanismo este demonstrado na figura 4.2.1,36
29 Capítulo 4.1.2- Nanopartículas transportadoras
As nanopartículas transportadoras são classificadas em 3 grupos consoante o material que as constitui, podendo ser nanopartículas transportadoras à base de lípidos, poliméricas e inorgânicas.41
Estas partículas têm que apresentar certas características mesmo pertencendo a grupos diferentes. As nanopartículas têm que utilizar material biocompatível, ser facilmente funcionalizadas, estar bem caracterizadas, ter uma boa estabilidade, permanecer na circulação por tempo suficiente, não apresentar agregação e ser seletivas para as células alvo.36
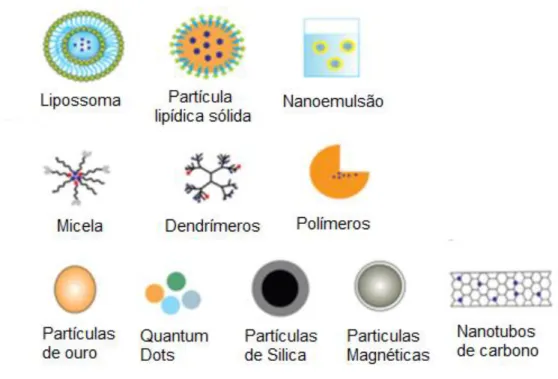
As nanopartículas transportadoras mais utilizadas estão representadas na figura 4.3.
30
Capítulo 4.1.2.1 -Lipossomas
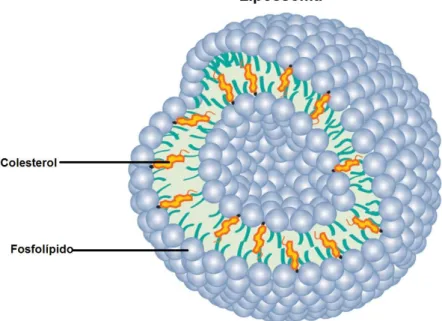
Os lipossomas pertencem ao grupo das nanopartículas transportadoras à base de lípidos. Estas estruturas são vesiculas esféricas compostas por camadas lipídicas bilaterais. O colesterol e fosfolípidos costumam ser os constituintes dos lipossomas, estes compostos formam estruturas vesiculares, como representado na figura 4.4.42
Figura 4.4- Estrutura e composição de um lipossoma.43
As características lipofílicas e hidrofílicas destas partículas permitem que transportem quer moléculas hidrofílicas como hidrofóbicas. As moléculas hidrofóbicas usualmente ficam armazenadas entre as camadas lipídicas bilaterais enquanto que as moléculas hidrofílicas permanecem no interior do compartimento aquoso.44
O uso de lipossomas apresenta varias vantagens: estas partículas possuem uma grande eficiência, alta estabilidade em circulação, cinética de libertação controlada e biocompatibilidade. Estas vantagens tornam os lipossomas ótimos transportadores com uma melhor farmacocinética e elevada biodisponibilidade.44
Os lipossomas vão ajudar no transporte de fármacos e agentes de diagnóstico pois providenciam uma camada protetora, evitando a sua degradação e diminui a
31 toxicidade para o organismo, facilitam a entrada do fármaco na célula pois têm a capacidade de se fundir com a membrana celular e realizar endocitose.44
De modo a melhorar as especificidades dos lipossomas têm sido adicionados glicolípidos e polietilenoglicol de modo a aumentar o tempo de semivida no sangue, conseguindo-se assim uma maior concentração do fármaco no tumor. Para aumentar a sua sensibilidade utiliza-se a técnica de active targeting fazendo com que o lipossoma se ligue a recetores específicos.7,8
Os lipossomas já são utilizados no tratamento do cancro da mama metastizados, sendo o Doxil®, um lipossoma modificado com polietilenoglicol que transporta doxorubicina, comercializado e aprovado pela FDA.7,8
Figura 4.5- Lipossoma modificado transportador de doxorubicina.45
Capítulo 4.1.2.2 – Nanopartículas lipídicas sólidas
As nanopartículas lipídicas sólidas (NLS) normalmente apresentam um formato esférico. São formadas electrostaticamente por uma camada de fosfolípidos e um centro matriz lipídico hidrofóbico. As NLS são mais estáveis que os lipossomas e como são biodegradáveis apresentam uma toxicidade baixa. É possível utilizar técnicas de
active targeting nas NLS.7,46
As nanopartículas lipídicas sólidas são geralmente formadas por triglicéridos ou glicéridos parciais, lípidos peguilhados, ácidos gordos esteroides ou ceras num estado sólido, uma componente liquida e tensioativos. As NLS são sistemas transportadores
32 coloidais, são bastante semelhantes às nanoemulsões diferindo o tipo de lípido utilizado.7,39
Como a produção de NLS pode ser manipulada facilmente, é possível produzir NLS com uma camada exterior enriquecida com fármaco, com um centro matriz enriquecido
com fármaco ou com um centro matriz homogéneo.7
As desvantagens mais comuns destas partículas são o facto de ter uma capacidade de incorporação de fármacos baixa e a sua sensibilidade a mudanças de temperatura no armazenamento, podendo provocar transformações polimórficas e por sua vez a prematura expulsão do fármaco.7
Têm sido estudadas maneiras de incorporar o tamoxifeno, docetaxel e outros agentes terapêuticos nas NLS para serem usadas no tratamento do cancro da mama.47
Capítulo 4.1.2.3 – Nanoemulsões
Nanoemulsões consistem na mistura de duas fases imiscíveis, uma fase aquosa e uma fase oleosa. Para esta mistura ser termodinamicamente estável é necessário o uso de tensioativos, permitindo desta forma a dispersão de uma das fases na outra. As emulsões podem ter uma base oleosa ou uma base aquosa sendo que nas emulsões de base oleosa a fase aquosa está dispersa na fase oleosa e nas emulsões de base aquosa é o inverso. No transporte de moléculas são usualmente utilizadas as emulsões com base aquosa. Os agentes terapêuticos costumam ser transportados na fase oleosa da emulsão.48 Apresentam uma aparência transparente ou translucida com gotículas de um diâmetro entre 0,5 - 100 nm. Estas emulsões são extremamente estáveis devido ao pequeno tamanho das gotículas, não apresentando os problemas das macro emulsões como coalescência, sedimentação ou floculação.49
As nanoemulsões são boas transportadoras de agentes terapêuticos pois ajudam a ultrapassar as barreiras que o microambiente tumoral apresenta aos fármacos antineoplásicos tradicionais. Transportam grandes quantidades de agentes
33 terapêuticos sem que haja uma toxicidade adjacente, e aumentam a biodistribuição e a seletividade da medicação.49 Com a melhoria da farmacocinética do fármaco, utilizando nanoemulsões como transportadores, é possível reduzir a quantidade necessária de fármaco a administrar para o tratamento ser eficaz, o que diminui a toxicidade do tratamento e a dor associada ao mesmo.49
Estudos demonstram que as nanoemulsões associadas ao tamoxifeno melhoram a eficácia deste fármaco.49
Capítulo 4.1.2.4 – Micelas
As micelas são compostas por blocos de copolímeros anfifílicos que formam uma estrutura esférica com um núcleo central, sendo que parte dos copolímeros que está em contacto com o ambiente liquido está à volta do núcleo.50,51 Quando expostas a um meio aquoso os copolímeros anfifílicos formam espontaneamente micelas com uma estrutura que engloba um núcleo e um revestimento, o que permite o transporte de agentes terapêuticos insolúveis em água.52
As micelas podem incorporar o fármaco por duas formas, quimicamente ou fisicamente, como está demonstrado na figura 4.6. A incorporação física depende da natureza dos blocos e da natureza do fármaco. Na incorporação química o fármaco é conjugado aos blocos. Neste método a micela apresenta uma maior estabilidade, o
34 Figura 4.6- Mecanismo de incorporação de fármaco.51
Como as micelas formam um revestimento em volta do fármaco tornam-se bastante estáveis pois não reagem com o meio fisiológico e assim podem ser administradas por via intravascular. É possível incorporar vários agentes terapêuticos na mesma solução micelar.52
Micelas que incorporam docetaxel epaclitaxel já estão aprovadas para o tratamento do cancro da mama, sendo que micelas incorporadas com docetaxel já são comercializadas na Coreia do Sul.36
Capítulo 4.1.2.5 – Dendrímeros
Os dendrímeros são moléculas poliméricas simétricas tridimensionais com um enorme número de braços que se estendem a partir do núcleo formando uma estrutura semelhante a uma árvore com um núcleo multifuncional.36,50,53
Os dendrímeros têm uma estrutura bem definida com 3 compostos principais, como se pode observar na figura 4.7. Um núcleo com um ou dois grupos repetidos ligados ao núcleo chamado geração, grupos funcionais periféricos que vão determinar as
35 propriedades físico-químicas do dendrímero e uma camada periférica final que pode ser modificada de modo a tornar o dendrímero lipofílico ou hidrofílico.36
Figura 4.7- Estrutura dos dendrímeros.54
Os dendrímeros podem ser compostos por elementos naturais ou sintéticos como por exemplo aminoácidos, açúcares e nucleótidos. Os dendrímeros podem ser sintetizados com diferentes tamanhos, peso molecular e composição química de modo a obter caraterísticas físicas, biodistribuição e active targeting mais favoráveis no transporte de agentes terapêuticos.55
Os dendrímeros são bons transportadores porque podem incorporar tanto agentes
terapêuticos/diagnóstico hidrofílicos como lipofílicos, são biocompatíveis,
biodegradáveis, são solúveis em água, tem uma toxicidade reduzida e conseguem permear as barreiras membranares biológicas.55
Dendrímeros transportadores de metotrexato demonstraram ter um efeito 10 vezes maior na redução do tamanho tumoral em comparação com o tratamento tradicional com metotrexato. Apesar dos bons resultados, devido aos altos custos de síntese dos dendrímeros em comparação com outras nanopartículas, apresentam um desafio para a produção em larga escala.36
36
Capítulo 4.1.2.6 – Nanopartículas Poliméricas
Uma nanopartícula polimérica é um termo dado a todos os tipos de nanopartículas poliméricas, mas é usado normalmente para definir nanoesferas e nanocápsulas. 7
As nanoesferas são, geralmente, esféricas e solidas com moléculas ligadas ou adsorvidas à sua superfície. As nanocápsulas são sistemas vesiculares que consistem numa cápsula sólida que rodeia um núcleo líquido que pode ser aquoso ou oleoso. Estas diferenças estão representadas na figura 4.8.7
Figura 4.8- Representação de nanoesferas e nanocapsulas.56
Através da manipulação da síntese de nanopartículas poliméricas é possível alterar as suas propriedades de modo a melhorar a biodistribuição, farmacocinética e incorporação dos agentes terapêuticos. Alterando o revestimento destas com polímeros hidrofílicos é possível evitar a captura das nanopartículas pelos macrófagos, o aumento da hidratação também torna as nanopartículas menos sensíveis a degradação enzimática, melhorando a biodistribuição. 8
Existem dois tipos de polímeros, os naturais e os sintéticos. Os polímeros naturais, como por exemplo albuminas, heparina e quitosano, provêm de plantas ou animais ou outro tipo de organismo vivo. Os polímeros naturais podem ser modificados
tornando-37 os semissintéticos. Os polímeros sintéticos são sintetizados quimicamente e são projetados para garantir uma boa biocompatibilidade e biodegradabilidade.1
Várias nanopartículas poliméricas foram aprovadas para o tratamento do cancro, nomeadamente a albumina ligada ao paclitaxel, que é utilizada no tratamento do cancro da mama.7
Capítulo 4.1.2.7 – Nanopartículas de sílica mesoporosas
A sílica é uma substância que se encontra no organismo, especialmente nos ossos, cartilagens e tecidos de suporte. Este tipo de material é considerado seguro e já é utilizado na formulação de medicamentos e suplementos vitamínicos para fortalecer o cabelo, pele e unhas.57
As nanopartículas de sílica mesoporosas (NSM), que estão representadas na figura 4.9, têm ganho um grande interesse na comunidade cientifica devido às suas potencialidades e características, principalmente como transportadores de agentes terapêuticos e agentes de diagnóstico.7,58
As NSM apresentam uma estrutura e morfologia muito estáveis, mesmo em tamanho nanométrico, uma boa biodisponibilidade, farmacocinética e toxicidade. As NSM apresentam uma grande área de superfície, uma distribuição de poros uniforme, grande volume de poros, boa biocompatibilidade e a sua superfície pode-se modificar quimicamente de modo a melhorar as suas propriedades.57,58
As características mesoscópicas proporcionam uma capacidade de incorporar uma maior quantidade de fármaco /agente de diagnóstico de modo uniforme, permite uma proteção contra a degeneração ou desnaturacão dos agentes e uma libertação controlada. O uso de NSM com uma cobertura reversível permite que os agentes sejam apenas libertados no alvo, ou seja, não há libertação precoce, permitindo o uso de agentes que são impermeáveis nas membranas no tratamento e diagnóstico do cancro. 7,57
38 Estudos demonstram que as NSM podem ser utilizadas no diagnóstico e tratamento do cancro, utilizando-se as NSM para incorporar componentes radioativos de modo a ser possível imagens PET mais claras e como transportador de agentes radioterapêuticos. 58
Figura 4.9- Nanopartículas de Sílica Mesoporosas.59
Capítulo 4.1.2.8 – Nanopartículas de Ouro
As nanopartículas de ouro são das partículas mais estudadas, sendo que o primeiro artigo publicado foi no seculo XIX por Michael Faraday, que descreveu a produção de ouro coloidal.60
As nanopartículas de ouro têm propriedades únicas, sendo que a sua produção é simples e o seu tamanho facilmente controlado. Estas nanopartículas podem ser modificadas através de técnicas de active targeting o que melhora a cinética da molécula, aumenta a semivida e amplifica a biocompatibilidade.36
A estabilidade destas partículas é uma das suas melhores características, e a sua superfície é facilmente alterada de modo a aumentar as suas funcionalidades. Estas partículas são bastante resistentes e não oxidam em ambiente fisiológico e de armazenamento.36 A penetração das nanopartículas de ouro na membrana celular não
39 está completamente compreendida, o que leva a opiniões contraditórias entre estudos sobre a sua toxicidade.60
As nanopartículas de ouro podem ter vários formatos, nomeadamente, nanoesferas, nanofios, nanocapsulas, nanocubos e nanopartículas com boas propriedades de
surface enhanced Raman (SERS), uma técnica que será abordada mais à frente.61
Figura 4.10- Nanopartículas de Ouro.61
As utilidades destas partículas são variadas, podendo ser usadas para vários fins, tais como, transportadores, terapia termal, agentes de contraste e agentes de radiossensibilidade.60
As nanopartículas de ouro usadas como transportador apresentam um grande potencial. O seu pequeno tamanho providencia um bom passive targeting, a possibilidade de ligação a anticorpos monoclonais como o tratuzumab e ao fator de crescimento epidérmico humano permite uma melhor interação entre o fármaco e a célula, o que aumenta o efeito terapêutic.o.60
As nanocapsulas de ouro são as moléculas mais usadas a nível da terapia termal, esta técnica será abordada adiante.61
A potencialidade como agentes de contraste das nanopartículas de ouro é elevada, devido às suas propriedades, como o seu pequeno tamanho, biocompatibilidade e numero atómico alto. Estas nanopartículas podem aumentar o contraste na tomossíntese, na ressonância magnética e PET. É possível que as nanopartículas de ouro possam ser usadas de modo a monitorizar a atividade metabólica e a expressão dos marcadores moleculares in vivo através de imagiologia molecular.60
As nanopartículas de ouro podem ser utilizadas para aumentar a sensibilidade da célula cancerígena à radioterapia, não sendo este mecanismo ainda conhecido.60