AVALIAÇÃO DE HIDROCARBONETOS
POLICÍCLICOS AROMÁTICOS EM AZEITES
PORTUGUESES
Rute Isabel Pires Mota
Dissertação para a obtenção do Grau de Mestre em
Engenharia Alimentar
Orientadores: Doutora Maria Suzana Leitão Ferreira Dias Vicente
Mestre Ana Helena de Almeida Leitão Alegre
Júri:
Presidente: Doutora Margarida Gomes Moldão Martins, Professora Associada com Agregação do Instituto Superior de Agronomia da Universidade de Lisboa.
Vogais:
Doutora Maria Suzana Leitão Ferreira Dias Vicente, Professora Associada com Agregação do Instituto Superior de Agronomia da Universidade de Lisboa, orientadora; Doutora Carla Sofia Ramos Tecelão, Professora Adjunta Convidada da Escola Superior de Turismo e Tecnologia do Mar do Instituto Politécnico de Leiria.
II À memória dos meus avós
III
AGRADECIMENTOS
Qualquer realização humana, mesmo que seja individual, é sempre a consequência de um conjunto diferenciado de contextos, de ações e especialmente de pessoas.
Não poderia deixar de expressar a minha gratidão para com as pessoas que contribuíram para o meu crescimento pessoal e profissional.
Em primeiro lugar, gostaria de agradecer à Doutora Suzana Ferreira Dias, minha orientadora, pela amabilidade de me aceitar como sua orientanda. Pela disponibilidade, generosidade, sabedoria, visão, apoio e dedicação incondicional ao longo deste trabalho nesta instituição, assim como o espírito crítico pelas correções e sugestões feitas durante a orientação.
Agradeço a todos os profissionais do Laboratório de Estudos Técnicos do Instituto Superior de Agronomia. Destaco aqui o papel da minha coorientadora, Engenheira Helena Alegre e destaco também o papel da Engenheira Paula Vasconcelos por toda a disponibilidade e apoio demostrados.
Agradeço à Doutora Fátima Peres do Instituto Superior de Castelo Branco, pela cedência de algumas amostras de azeite e pela determinação dos parâmetros de qualidade dos mesmos.
Por último, um agradecimento especial à minha família e ao meu namorado que me apoiaram de forma incondicional, que me estimulam a crescer científica e pessoalmente, pelo carinho, paciência e compreensão durante todo este longo percurso.
A todos, reitero o meu apreço e a minha eterna gratidão.
“Ninguém escapa ao sonho de voar, de ultrapassar os limites do espaço onde nasceu, de ver novos lugares e novas gentes. Mas saber ver em cada coisa, em cada pessoa, aquele algo que a define como especial, um objeto singular, um amigo, - é fundamental. Navegar é preciso, reconhecer o valor das coisas e das pessoas, é mais preciso ainda.” Antoine de Saint-Exupéry
IV
RESUMO
Os hidrocarbonetos policíclicos aromáticos (PAHs) são poluentes ambientais omnipresentes gerados principalmente durante a combustão incompleta de materiais orgânicos. A Agência Internacional para a Investigação do Cancro, da Organização Mundial da Saúde, determinou que o benzo[a]antraceno (BaA), o criseno (Chr) e o benzo[b]fluoranteno (BbF) estão no grupo 2B, possivelmente carcinogénico para os seres humanos enquanto o benzo[a]pireno (BaP) foi incluído no Grupo 1A, carcinogénico para animais e seres humanos. O azeite é obtido a partir das azeitonas exclusivamente por extração mecânica. Embora o Azeite Virgem deva ser naturalmente livre de PAHs, a contaminação pode ocorrer diretamente durante a extração ou indiretamente devido à contaminação da pele da azeitona por fontes ambientais. Os PAHs presentes no pó e partículas de fumo e poluição atmosférica podem contaminar as azeitonas através de precipitação atmosférica e esta contaminação superficial pode ser transferida para o produto final. Os limites jurídicos da União Europeia para os PAHs no Azeite Virgem são: benzo[a]pireno 2,0 μg/kg e a soma de benzo[a]pireno, benzo[a]antraceno, benzo[b]fluoranteno e criseno 10,0 μg/kg. Em 2017, mais de 442,000 hectares de floresta e arbustos foram destruídos em Portugal pelos incêndios, durante a temporada de verão e principalmente no centro-norte do país. Neste estudo, 22 amostras de azeites portugueses (anos 2017 e 2018) de diferentes regiões foram analisadas diretamente dos produtores, relativamente aos seus teores de PAHs, benzo[a]pireno, criseno, benzo[a]antraceno e benzo[b]fluoranteno), por HPLC com detetor de fluorescência programável. Quatro das amostras de azeite analisadas tinham níveis de PAHs superiores aos limites jurídicos da União Europeia. Estas amostras foram da Beira Interior, o que pode ser explicado pelos altos níveis de PAHs na atmosfera devido aos incêndios florestais ocorridos nesta região em 2017.
Palavras-chave: Azeite, azeite virgem, hidrocarbonetos policíclicos aromáticos, incêndios, PAHs.
V
ABSTRACT
Polycyclic aromatic hydrocarbons (PAHs) are ubiquitous environmental pollutants generated primarily during the incomplete combustion of organic materials. The International Agency for Research on Cancer of World Health Organization has determined that benzo[a]anthracene (BaA), chrysene (Chr), benzo[b]fluoranthene (BbF) are in the Group 2B, possibly carcinogenic to humans, while benzo[a]pyrene (BaP) was included in the Group 1A, carcinogenic to animals and humans. Olive oil is obtained from the olives exclusively by mechanical extraction. Although virgin olive oil should be naturally free of PAHs, contamination may occur either directly during the extraction or indirectly due to olive skin contamination by environmental sources. The PAHs present in dust and particles from smoke and air pollution can contaminate olives via atmospheric fallout and this superficial contamination can be transferred to the final product. The European Union legal limits for PAHs in virgin olive oil are: Benzo[a]pyrene 2,0 μg/kg and the sum of benzo[a]pyrene, benzo[a]anthracene, benzo[b]fluoranthene and chrysene 10,0 μg/kg. In 2017, more than 442,000 hectares of forest and bushes were destroyed in Portugal by the fires, during Summer season and mainly in the North-Center of the country. In this study, 22 samples of Portuguese olive oils (crops 2017 and 2018) from different regions were directly obtained from the producers and analyzed for their heavy PAHs contents (Benzo[a]pyrene, chrysene, benzo[a]pyrene, benzo[a]anthracene, and benzo[b]fluoranthene), by HPLC with a programmable fluorescence detector. Four of the analyzed samples of olive oil had PAHs levels higher than the European Union legal limits. These samples were from Beira Interior which may be explained by the high levels of PAHs in the atmosphere due to the forest fires occurred in this region in 2017.
VI
INDÍCE GERAL
AGRADECIMENTOS ... III RESUMO ... IV ABSTRACT ... V INDÍCE GERAL ... VI INDÍCE DE FIGURAS ... VIII INDÍCE DE TABELAS ... IX LISTA DE ABREVIATURAS ... X1. INTRODUÇÃO GERAL ... 1
1.1. Enquadramento do Tema e Objetivos ... 1
2. REVISÃO BIBLIOGRÁFICA ... 2 2.1. A História da Oliveira ... 2 2.2. A Azeitona ... 3 2.3. O Azeite ... 4 2.3.1. Extração do Azeite ... 4 2.3.2. Legislação ... 8
2.3.3. Controlo de Qualidade do Azeite ... 8
2.3.4. Categorias de Azeite ... 8
2.3.5. Denominação de Origem Protegida ... 10
2.3.6. Valor Nutricional do Azeite ... 11
2.3.7. Benefícios do Azeite para a Saúde ... 13
2.3.8. Enquadramento do Mercado Mundial e Nacional ... 14
2.3.8.1. Produção ... 14
2.3.8.2. Consumo ... 15
2.3.8.3. Exportação ... 16
2.4. Hidrocarbonetos Policíclicos Aromáticos ... 17
2.4.1. Constituição ... 17
2.4.2. Formação ... 19
2.4.3. Toxicidade ... 19
2.4.4. Exposição ... 20
2.4.5. Fontes de Contaminação de Alimentos ... 22
2.4.6. Ocorrência de PAHs no Azeite ... 23
2.4.7. Legislação ... 24
VII 3. PARTE EXPERIMENTAL ... 27 3.1. Materiais e Métodos ... 27 3.1.1. Azeites Virgens ... 27 3.1.2. Materiais ... 30 3.1.3. Reagentes ... 30 3.1.4. Equipamentos ... 31 3.1.5. Métodos ... 31 3.1.5.1. Determinação da Acidez ... 31
3.1.5.2. Determinação do Índice de Peróxidos ... 32
3.1.5.3. Determinação do Índice de Espectrofotometria ... 33
3.1.5.4. Determinação de Hidrocarbonetos Policíclicos Aromáticos ... 34
4. RESULTADOS E DISCUSSÃO ... 39
4.1. Determinação dos parâmetros químicos de qualidade dos azeites ... 39
4.2. Hidrocarbonetos Policíclicos Aromáticos ... 44
5. CONCLUSÕES GERAIS ... 55
VIII
INDÍCE DE FIGURAS
Figura 1 - Oliveira com 3000 anos na Grécia ... 2
Figura 2 - Diagrama do processo da extração de azeite em sistema contínuo de 3 e 2 fases ... 7
Figura 3 - Denominações de origem protegida em Portugal ... 10
Figura 4 - Produção de Azeite em Portugal ... 15
Figura 5 - Consumo de Azeite em Portugal ... 16
Figura 6 - Área ardida em Portugal no ano de 2017 ... 25
Figura 7 - Área ardida em Portugal no ano de 2018 ... 26
Figura 8 - Mapa de Portugal com a origem das amostras analisadas ... 28
Figura 9 - Etapa de Pré-Concentração de PAH ... 35
Figura 10 – Extração e purificação dos PAHs ... 36
Figura 11 - HPLC constituído por desgaseificador, bomba, forno e detetor de fluorescência ... 37
Figura 12 - Cromatograma do Padrão. ... 45
Figura 13 - Cromatograma da Amostra O ... 51
Figura 14 - Concentração de BaA por amostra ... 52
Figura 15 - Concentração de Chr por amostra ... 52
Figura 16 - Concentração de BbF por amostra ... 53
Figura 17 - Concentração de BaP por amostra ... 53
IX
INDÍCE DE TABELAS
Tabela 1 - Categorias de Azeite ... 9
Tabela 2 - Informação nutricional do azeite por 100 gramas ... 12
Tabela 3 - Percentagem dos diferentes ácidos gordos no azeite ... 12
Tabela 4 - Lista de Hidrocarbonetos Policíclicos Aromáticos como principais contaminantes em componentes alimentares ... 18
Tabela 5 - Propriedades carcinogénicas e mutagénicas de PAHs ... 20
Tabela 6 - Género alimentício óleos e gorduras e respetivos teores máximos ... 24
Tabela 7 - Códigos das amostras e respetiva região de origem. ... 29
Tabela 8 - Comprimentos de onda de excitação e de emissão do programa ... 38
Tabela 9 - Resultados da acidez. ... 39
Tabela 10 - Resultados do índice de peróxidos. ... 40
Tabela 11 - Resultados do índice de espectrofotometria. ... 41
Tabela 12 - Classificação comercial de azeites virgens segundo os valores de acidez, índice de peróxidos e análise espectrofotométrica ... 42
Tabela 13 - Classificação comercial das amostras de azeite analisadas com base nas determinações dos parâmetros químicos de qualidade. ... 43
Tabela 14 - Teores de PAHs (BaA, Chr, BbF e BaP) das amostras de azeite analisadas ... 49
X
LISTA DE ABREVIATURAS
ADN - Ácido desoxirribonucleico APA - Agência de Proteção Ambiental
ATSDR - Agência de Substâncias Tóxicas e Registo de Doenças BaA - Benzo[a]antraceno (Benzo[a]anthracene)
BaP - Benzo[a]pireno (Benzo[a]pyrene)
BbF - Benzo[b]fluoranteno (Benzo[b]fluoranthene) CAS - Chemical American Society
CCAH - Comité Científico da Alimentação Humana CEE - Comunidade Económica Europeia
Chr – Criseno (Chrysene)
COI - Conselho Oleícola Internacional DOP - Denominação de Origem Protegida ETG - Especialidade Tradicional Garantida
HPLC - Cromatografia Líquida de Alta Eficiência em Fase Reversa (High Performance Liquid Chromatography)
IARC - Agência Internacional para a Investigação do Cancro (International Agency for Research on Cancer)
IGP - Indicação Geográfica Protegida LET – Laboratório de Estudos Técnicos
MUFA - Ácidos Gordos Monoinsaturados (Monounsaturated fatty acids)
PAHs - Hidrocarbonetos Policíclicos Aromáticos (Polycyclic aromatic hydrocarbons) PUFA - Ácidos Gordos Polinsaturados (Polyunsaturated fatty acids)
SFA - Ácidos Gordos Saturados (Saturated fatty acids) UE – União Europeia
1
1. INTRODUÇÃO GERAL
1.1.
Enquadramento do Tema e Objetivos
Em Portugal, os contaminantes alimentares são regidos pelo Regulamento (UE) Nº 835/2011 da Comissão de 19 de agosto de 2011, que apresenta os teores máximos de hidrocarbonetos aromáticos policíclicos presentes nos géneros alimentícios. No género alimentício de óleos e gorduras (com exceção da manteiga de cacau e da gordura de coco) destinados ao consumo humano direto ou à utilização como ingredientes alimentares, o limite máximo do Benzo[a]pireno é 2,0 μg/kg e o limite máximo para a soma de Benzo[a]pireno, Benzo[a]antraceno, Benzo[b]fluoranteno e Criseno é 10,0 μg/kg.
Nos últimos anos, os hidrocarbonetos policíclicos aromáticos (PAHs) têm vindo a alcançar um papel de elevado destaque na área alimentar, devido ao facto de serem poluentes originados pela combustão incompleta de material orgânico. Estão amplamente distribuídos pelo ambiente e possuem carácter carcinogénico e mutagénico, razões pela qual constituem uma ameaça potencialmente fatal para a saúde humana. Este trabalho surgiu pelo interesse em estudar a eventual relação entre os inúmeros incêndios florestais que deflagraram em Portugal nos últimos anos, principalmente em 2017 e a concentração dos PAHs em Azeite Virgem Extra e Azeite Virgem.
O trabalho baseou-se na análise dos teores de PAHs de 22 amostras de azeites portugueses referentes aos anos 2017 e 2018 de diferentes regiões com maior incidência de incêndios e obtidas diretamente dos produtores.
A parte experimental deste trabalho foi desenvolvida no Laboratório de Estudos Técnicos (LET), do Instituto Superior de Agronomia.
2
2. REVISÃO BIBLIOGRÁFICA
2.1.
A História da Oliveira
Há evidências de fósseis, que remontam ao período Terciário e que provam a existência de um ancestral da oliveira na Itália e que confirmam a presença de uma planta semelhante à oliveira no Sul da Europa (Aparicio-Ruiz & Harwood, 2000).
As primeiras provas documentadas do cultivo da Oliveira remontam a 4000 a.C., quando surgiu nas regiões orientais da atual Síria e Irão (Díaz, 2012; Boskou, 2015). As Placas Ebla, pequenas tábuas de barro minoicas, datam de 2500 a.C., e apresentavam as oliveiras e o uso do azeite na corte do Rei Minos (Díaz, 2012; Román et al., 2019).
A riqueza do Império Minóico é dita ter sido baseada no cultivo de oliveiras e as guerras foram travadas sobre olivais e rotas de comércio. Grinaldas de ramos de Oliveira selvagem, Kallistefanos olea, eram colocadas sobre as cabeças dos vencedores dos Jogos Olímpicos antigos (Kapellakis et al., 2008; Román et al., 2019).
O grande historiador Plínio escreveu, “Exceto a videira, não há nenhuma planta que tenha um fruto de tão grande importância como a azeitona” (Román et al., 2019).
A Oliveira, Olea europaea L., é uma árvore subtropical pertencente à família Oleaceae, à subfamília Oleoideae, à tribo Oleeae, o género Olea e ao subgénero Olea (Díaz, 2012; Rugini et al., 2016).
A Figura 1 exibe um exemplar da espécie oliveira com 3000 anos na Grécia.
3 O cultivo de oliveiras, a colheita de azeitonas e a subsequente extração de azeite têm sido intrinsecamente ligados à história e à cultura das populações mediterrânicas, servindo de base para a alimentação indígena das populações residentes na região (Cabrera-Bañegil et al., 2017; Foscolou et al., 2018). Esta atividade económica expandiu-se em torno do Mediterrâneo para incluir a África do Norte e a Península Ibérica (Ramos-Román et al., 2019).
Na área mediterrânica, onde as temperaturas mínimas do inverno não descem geralmente abaixo de −7ºC, o cultivo da oliveira ocupa 12 milhões hectares, representando aproximadamente 95% da área cultivada azeitona total do mundo, sendo que as árvores com 500 anos de idade ainda frutificam (Aparicio-Ruiz & Harwood, 2013; Rugini et al., 2016)
2.2.
A Azeitona
Atualmente, a azeitona é reconhecida como fruto para consumo direto e pelo óleo alimentar de alta qualidade. No entanto, o azeite foi originalmente utilizado como medicamento, combustível para lâmpadas, lubrificantes para atletas e guerreiros e em rituais religiosos (Connor & Fereres, 2004; Román et al., 2019).
Do ponto de vista botânico, o fruto da azeitona é classificado como uma drupa, mas difere de outras drupas porque contém um menor teor de açúcar e uma maior concentração de óleo (Calabriso et al., 2015). São de tonalidade verde no início, tornando-se negras quando estão totalmente maduras (Rabiei & Enferadi, 2012).
A massa total dos frutos compreende 70–90% de mesocarpo, 9–27% de endocarpo e 2–3% de semente. No momento da colheita para a extração de azeite, o mesocarpo contém cerca de 60% de água, 30% de óleo, 4% de açúcares, 3% de proteína, e o resto é maioritariamente fibra e cinzas. O endocarpo contém 10% de água, 30% de celulose, 40% de glúcidos e cerca de 1% de óleo. A semente tem 30% de água, 27% de óleo, 27% de glúcidos e 10% de proteína (Conde et al., 2008).
A colheita da azeitona é realizada no final do outono, apesar de nalgumas variedades e em determinadas áreas, a colheita ser feita no mês de dezembro dependendo das condições edafoclimáticas que determinam o grau de maturação da azeitona. A maturação e a variedade da azeitona, o tipo de colheita, o transporte e o armazenamento são fatores que influenciam a qualidade do azeite (Pérez-Rodrigo & Aranceta, 2016).
As cultivares mais populares são: Cordovil, Galega, Cobrançosa, Maçanilha Algarvia, Redondil, Picual, Verdeal, Madural e Carrasquenha em Portugal (DRAP, 2019); Picual, Arbequina, Cornicabra, Hojiblanca e Empeltre em Espanha; Frantoio,
4 Moraiolo, Leccino, Coratina e Pendolino em Itália; Koroneiki na Grécia; Chemlali na Tunísia; Ayvalik na Turquia; Nabali, Suori e Barnea em Israel e na Cisjordânia e Picholin na França (Rabiei & Enferadi, 2012).
2.3.
O Azeite
Na Ilíada, Homero refere-se ao azeite como “ouro líquido” (Román et al., 2019). Em conformidade com o Decreto-Lei Nº 348/88, entende-se por azeite, “a gordura líquida à temperatura de 20ºC diretamente obtida do fruto da oliveira, Olea europea L., unicamente por processos físicos, em condições, nomeadamente térmicas, que não provoquem alteração do azeite. Não é permitida a extração por solvente, nem a reesterificação ou mistura com óleos de outra natureza” (Decreto-Lei Nº 348, 1988).
Na bacia mediterrânica, o azeite assumiu uma relevância extraordinária na alimentação. Constituiu mesmo uma das principais gorduras consumidas, superando claramente o recurso a outras substâncias de análoga função de origem vegetal ou animal (Böhm, 2013).
O teor de compostos fenólicos no azeite é um fator importante a considerar para avaliar a qualidade do Azeite Virgem, dado que os benefícios nutricionais e de saúde são universalmente reconhecidos (Zullo et al., 2014).
O azeite tem sido utilizado ao longo dos séculos pelas suas propriedades preventivas e terapêuticas, bem como um precioso e valioso ingrediente dietético lipídico (Gómez-Caravaca et al., 2016).
2.3.1.
Extração do Azeite
A etapa primordial para realizar a extração do azeite é a colheita da azeitona, que deve estar em excelente estado fitossanitário e no estado de maturação pretendido. A colheita pode ser de forma mecânica ou manual. O transporte da azeitona do campo até ao lagar deve ser efetuado em caixas cuja forma permita a circulação de ar. Quando a azeitona é descarregada, é efetuada uma separação criteriosa desta, por variedade e qualidade. A laboração deve ser realizada até às 48h após a colheita, demorando o menor tempo possível de forma a evitar alterações químicas, físicas e biológicas com repercussões nas características químicas e organoléticas do produto final (Ferraz, 2012).
Segundo o Decreto-Lei 76/2010, na extração e depuração do azeite são admitidas as seguintes operações tecnológicas:
5 o Moenda da azeitona, que visa destruir a estrutura celular da azeitona
libertando gotículas de azeite;
o Batedura e aquecimento da massa que pretendem a coalescência das gotículas de azeite em gotas de maiores dimensões de forma a possibilitar uma separação mais eficiente entre a fase aquosa e a oleosa; o Extração apenas por processos físicos de ação mecânica e de tensão
superficial;
o Depuração, mediante operações de decantação, lavagem, filtração e centrifugação, que permitem a separação das fases através da força centrifuga (bagaço húmido e azeite nos sistemas de duas fases ou bagaço, águas russas e azeite, nos sistemas de centrifugas de três fases);
o O armazenamento é a última etapa do processo, sendo fundamental para a qualidade do azeite. Os depósitos devem ser opacos, devem ser colocados a temperatura controlada entre os 15 e 18ºC, com o intuito de permitir a decantação das impurezas em suspensão no azeite, sem favorecer a sua oxidação.
No método tradicional de prensa para a extração de azeite, as azeitonas são esmagadas e é processada uma pasta, que é posteriormente espalhada em capachos. A pressão é aplicada para extrair o óleo e as águas russas, deixando um material sólido, denominado bagaço, nos capachos. O óleo e as águas residuais são separados por densidade (Pérez-Rodrigo & Aranceta, 2016).
O processo de extração contínuo inclui moenda, termobatedura, decantação, centrifugação, filtração e sedimentação que foram introduzidos com a finalidade de aumentar o rendimento da extração (Seçmeler & Galanakis, 2015).
Após o processo de extração, o azeite é caracterizado pelo seu aspeto opalescente. A negligência deste processo favorece uma perda considerável de qualidade (Pérez-Rodrigo & Aranceta, 2016; Ciafardini & Zullo, 2018).
Durante o armazenamento, as características físico-químicas do azeite melhoram graças à sedimentação do material suspenso e à hidrólise de moléculas fenólicas complexas (Ciafardini & Zullo, 2018).
A ausência de processos de refinação ajuda a preservar as características organoléticas e as propriedades nutricionais que distinguem o Azeite Virgem de outros óleos comestíveis (Vichi et al., 2007).
O sector da produção de azeite enfrenta questões cruciais no que diz respeito à gestão de resíduos, cerca de 80% da massa de azeitonas é composta pela polpa e por
6 caroço. A composição dos produtos residuais depende das tecnologias de extração, que incluem sistemas de prensa, de duas ou três fases (Espadas-Aldana et al., 2019).
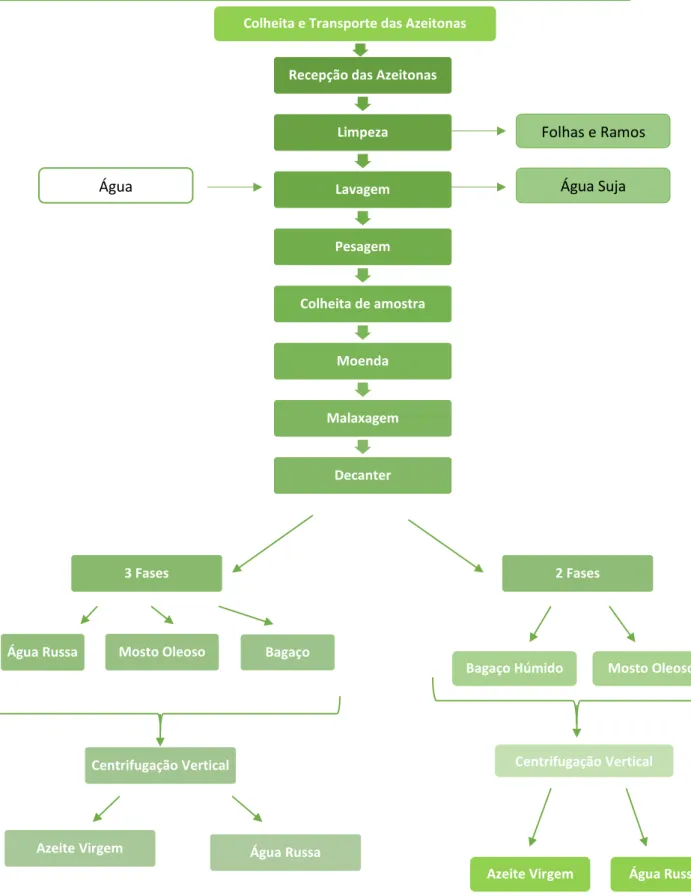
Na Figura 2 encontram-se os fluxogramas da extração do azeite em sistemas contínuos de três e de duas fases.
7
Figura 2 - Diagrama do processo da extração de azeite em sistema contínuo de 3 e 2 fases (Adaptado de Ferraz, 2012).
Recepção das Azeitonas
Limpeza Lavagem Pesagem Colheita de amostra Moenda Malaxagem Decanter 3 Fases 2 Fases
Água Russa Mosto Oleoso Bagaço
Centrifugação Vertical
Azeite Virgem Água Russa
Bagaço Húmido Mosto Oleoso
Centrifugação Vertical húmido Azeite Virgem húmido Água Russa húmido Colheita e Transporte das Azeitonas
húmido
Folhas e Ramos
8
2.3.2.
Legislação
O Regulamento (UE) Nº 1308/2013 do Parlamento Europeu e do Conselho de 17 de Dezembro de 2013 é a base de toda a legislação da União Europeia sobre o azeite, para este ser classificado deve corresponder a uma série de características estabelecidas no regulamento mencionado.
Além dos parâmetros físico-químicos que podem determinar a qualidade do azeite, este também é classificado de acordo com a análise sensorial dos defeitos e atributos positivos (Conte et al., 2019; Salesa et al., 2019).
2.3.3.
Controlo de Qualidade do Azeite
O Conselho Oleícola Internacional (COI), foi fundado em Madrid, Espanha, em 1959, com o apoio das Nações Unidas e é uma chave decisiva para contribuir para o desenvolvimento sustentável e responsável do cultivo da azeitona (International Olive Council, 2019).
Em Portugal, com a finalidade de garantir a segurança alimentar dos consumidores e a autenticidade dos produtos, o Laboratório de Segurança Alimentar permite uma caracterização físico-química e sensorial do azeite de acordo com o estabelecido no Regulamento (CEE) nº 2568/1991 e as suas alterações (ASAE, 2019).
2.3.4.
Categorias de Azeite
De acordo com o Regulamento (CE) Nº 1234/2007, as designações e definições dos azeites encontram-se na Tabela 1.
9 Tabela 1 - Categorias de Azeite (Adaptado de Regulamento (CE) N.º 1234, 2007).
Azeites Virgens
Azeites obtidos a partir do fruto da oliveira exclusivamente por processos mecânicos ou outros processos físicos, em condições que não alterem o azeite, e que não tenham sofrido outros tratamentos além da lavagem, da decantação, da centrifugação e da filtração, com exclusão dos azeites obtidos com solventes, com adjuvantes de ação química ou bioquímica ou por processos de reesterificação, bem como de qualquer mistura com óleos de outra natureza.
Azeite Virgem Extra
Azeite virgem com uma acidez livre, expressa em ácido oleico, não superior a 0,8 g por 100 g, estando as outras características conformes com as previstas para esta categoria. Azeite Virgem Azeite virgem com uma acidez livre, expressa em ácido oleico, não superior a 2 g por 100 g, estando as outras características conformes com as previstas para esta categoria. Azeite Lampante Azeite virgem com uma acidez livre, expressa em ácido oleico, superior a 2 g por 100 g e/ou estando as outras características conformes com as previstas para esta categoria.
Azeite Refinado
Azeite obtido por refinação de azeite virgem, com uma acidez livre expressa em ácido oleico não superior a 0,3 g por 100 g, estando as outras características conformes com as previstas para esta categoria.
Azeite — Composto Por Azeite Refinado E Azeite Virgem
Azeite obtido por loteamento de azeite refinado e de azeite virgem, com exclusão do azeite lampante, com uma acidez livre, expressa em ácido oleico, não superior a 1 g por 100 g, estando as outras características conformes com as previstas para esta categoria.
Óleo De Bagaço De Azeitona
Bruto
Óleo obtido de bagaço de azeitona por tratamento com solventes ou por processos físicos, ou óleo correspondente, com exceção de certas características específicas, a um azeite lampante, com exclusão dos óleos obtidos por processos de reesterificação e qualquer mistura com óleos de outra natureza, e com as outras características conformes com as previstas para esta categoria.
Óleo De Bagaço De Azeitona
Refinado
Óleo obtido por refinação de óleo de bagaço de azeitona bruto, com uma acidez livre, expressa em ácido oleico, não superior a 0,3 g por 100 g, estando as outras características conformes com as previstas para esta categoria.
Óleo De Bagaço De Azeitona
Óleo obtido por loteamento de óleo de bagaço de azeitona refinado e de azeite virgem, com exclusão do azeite lampante, com uma acidez livre, expressa em ácido oleico, não superior a 1 g por 100 g, estando as outras características conformes com as previstas para esta categoria.
Além dos parâmetros físico-químicos que podem determinar a qualidade do azeite este também pode ser classificado de acordo com a análise sensorial dos defeitos e atributos positivos (Salesa et al., 2019).
10
2.3.5.
Denominação de Origem Protegida
O Regulamento Nº 2081/92 criou os sistemas de denominação de origem protegida (DOP), indicação geográfica protegida (IGP) e especialidade tradicional garantida (ETG), possibilitando aos produtores aumentar, promover e proteger o valor dos seus produtos alimentares, fornecendo aos consumidores informações claras sobre a origem do produto ou carácter especial ligado à região. Um azeite DOP requer informações sobre a definição precisa do modo de cultivo, consequente prática agronómica e tecnologia de produto, origem geográfica e qualidades organoléticas. Assim, os consumidores podem comprar produtos garantidos de qualidade, com base na origem. A confiança e o conhecimento do produto são fatores fundamentais para os consumidores, permitindo nos produtos com esta categoria rastreabilizar e certificar a sua qualidade (Alves et al., 2005; Rabiei & Enferadi, 2012; Likudis, 2016).
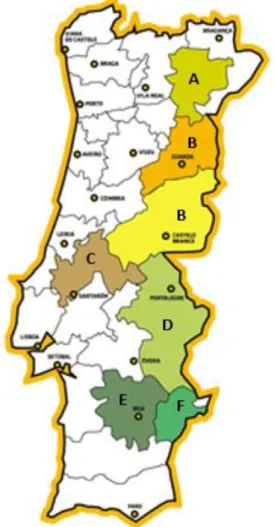
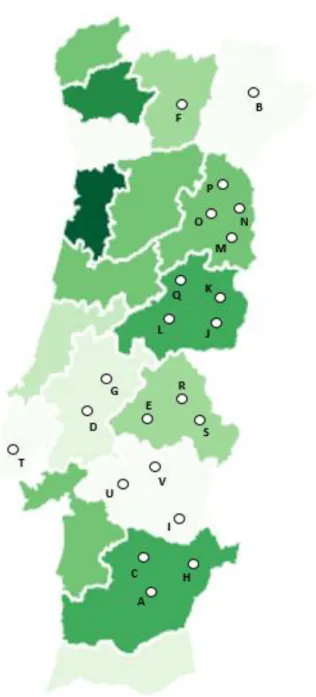
Em Portugal existem seis denominações de origem protegida.
Na Figura 3, é possível observar a área reservada a cada uma das seis denominações de origem protegida.
11 Legenda: A - DOP Azeites de Trás-os-Montes; B - DOP Azeites da Beira Interior; C - DOP Azeites do Ribatejo; D - DOP Azeites do Norte Alentejano; E - DOP Azeites do Alentejo Interior; F - DOP Azeites de Moura.
2.3.6.
Valor Nutricional do Azeite
Os compostos fenólicos são metabolitos de plantas secundárias, com grande diversidade estrutural e ampla distribuição filogenética. A classe mais importante de compostos fenólicos na azeitona inclui ácidos fenólicos, álcoois fenólicos, flavonóides e secoiridóides (Vinha et al., 2005).
A sua riqueza em compostos fenólicos, alfa-tocoferol, clorofilas e carotenoides, bem como o seu adequado perfil em ácidos gordos, em que o ácido oleico é maioritário (55-83%), torna-o facilmente digestível e metabolizável (Ramalhosa et al., 2014).
A composição química do azeite é caracterizada por apresentar componentes maioritários e minoritários. O conjunto de compostos maioritários é constituído principalmente por triglicéridos que contêm maioritariamente o ácido oleico, um ácido gordo monoinsaturado, seguido de ácidos gordos polinsaturados, nomeadamente o ácido linoleico e α-linoleico e também por ácidos gordos saturados (8-26,89%) sendo estes o palmítico e esteárico. O conjunto de compostos minoritários forma um grupo amplo e heterogéneo de compostos como hidrocarbonetos, tocoferóis, compostos fenólicos, esteróis, clorofila, carotenoides, ácidos terpénicos, ésteres e outros voláteis (Ramírez-Tortosa et al., 2006; García-González et al., 2009; Peri, 2014; Capurso et al., 2018).
A poluição tem um impacto negativo na estabilidade oxidativa e no valor nutricional do azeite, particularmente no decréscimo do teor de compostos antioxidantes e alteração da composição de ácidos gordos (Rekik et al., 2019).
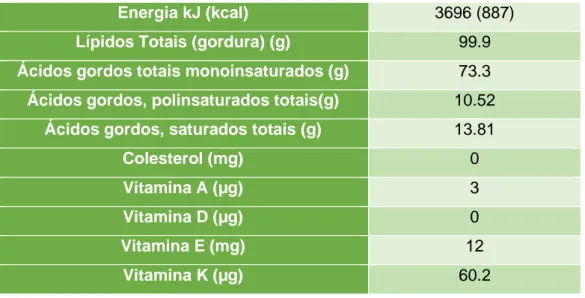
Nas Tabela 2 e 3, encontram-se a informação nutricional do azeite e a percentagem dos diferentes ácidos gordos no azeite, respetivamente.
12 Tabela 2 - Informação nutricional do azeite por 100 gramas (Adaptado de Pérez-Rodrigo & Aranceta, 2016).
Energia kJ (kcal) 3696 (887)
Lípidos Totais (gordura) (g) 99.9 Ácidos gordos totais monoinsaturados (g) 73.3 Ácidos gordos, polinsaturados totais(g) 10.52
Ácidos gordos, saturados totais (g) 13.81
Colesterol (mg) 0
Vitamina A (µg) 3
Vitamina D (µg) 0
Vitamina E (mg) 12
Vitamina K (µg) 60.2
Tabela 3 - Percentagem dos diferentes ácidos gordos no azeite (Adaptado de Calabriso et al., 2015). Ácidos Gordos SFA Mirístico (14:0) 0.0–0.05 % Palmítico (16:0) 7.5–20 % Margárico (17:0) 0–0.3 % Esteárico (18:0) 0.5–5 % Araquídico (20:0) 0–0.6 % Beénico (22:0) 0–0.2 % Linocérico (24:0) 0–0.2 % Total Saturados 8 - 26.8 % MUFA Palmitoléico (16:1n7) 0.3–3.5 % Margárico (17:1) 0–0.3 % Oleico (18:1n9) 55–83 % Gadoléico (20:1n9) 0–0.4 % Total Monoinsaturados 55.3 - 87.2 % PUFA Linoleico (18:2n6) 3.5–21 % Alfa-linolénico (18:3n3) 0–0.9 % Total Polinsaturados 3.5 - 21.9 %
13
2.3.7.
Benefícios do Azeite para a Saúde
Ao longo do tempo, os polifenóis presentes no azeite têm sido associados a diversos benefícios para a saúde cardiovascular. O consumo de azeite rico em polifenóis pode diminuir a pressão arterial e melhorar a função endotelial em mulheres jovens com pressão arterial alta-normal ou na primeira fase de hipertensão (Moreno-Luna et al., 2012). Fornece também pequenos efeitos benéficos sobre a pressão arterial sistólica e o estado oxidativo sérico (Hohmann et al., 2015). O azeite tem benefícios para a saúde em relação à obesidade e lipotoxicidade (Bell, 2019).
Há dados que sugerem que alguns componentes do azeite são responsáveis pela estimulação dos mecanismos neuroprotetores na doença de Huntington, e que podem ser consideradas como ferramentas terapêuticas potenciais de controlo desta doença (Ferreira et al., 2015). O consumo de Azeite Virgem Extra potencializa a prevenção potencial de Alzheimer (Visioli et al., 2018; Román et al., 2019).
Outros resultados demonstram que o azeite consegue exercer efeitos benéficos na função endotelial contribuindo para a proteção cardiovascular (Visioli et al., 2005; Martínez-González et al., 2014; Schwingshackl et al., 2015; Visioli et al., 2018; Schwingshackl et al., 2019). Para além de estar associado à redução do risco de doença cardiovascular, uma maior ingestão de azeite está associada a uma menor probabilidade de ter qualquer tipo de cancro (Tyrovolas & Panagiotakos, 2010; Psaltopoulou et al., 2011; Visioli et al., 2018). O azeite apresenta uma atividade analgésica, anti-inflamatória e anticancerígena (Justino et al., 2012; Fezai et al., 2013; Banksa et al., 2016).
O oleocantal é um composto fenólico minoritário do azeite. Este composto é capaz de eliminar células cancerígenas sem afetar as células normais (LeGendre et al., 2015; Cusimano et al., 2017).
O consumo de azeite, de acordo com ensaios in vitro sugerem exercer um papel positivo na saúde óssea, principalmente na prevenção da osteoporose (Villarroya et al., 2015; García-Gavilán et al., 2018).
O ácido oleico, o principal ácido gordo monoinsaturado do azeite, pode suprimir o HER2 (ErbB-2), (Human Epidermal growth factor Receptor-type 2), um oncogene vastamente conhecido, desempenhando um papel fundamental na etiologia, progressão e metástase invasoras em diversos cancros (Menendez & Lupu, 2006). As azeitonas e o azeite contêm quantidades substanciais de compostos considerados anticancerígenos como o esqualeno, terpenóides, e o ácido oleico (Owen et al., 2004). O ácido oleico detém ainda um efeito antienvelhecimento (Sabatini et al., 2018).
14 No campo da Diabetes mellitus tipo 2, doença metabólica crónica, há estudos que sugerem que a uma maior ingestão de azeite está associada um risco ligeiramente menor de diabetes (Guasch-Ferré et al., 2015; Visioli et al., 2018; Basterra-Gortari et al., 2019).
Os estudos em animais indicam que o azeite pode atenuar sinais induzidos pelo stress do envelhecimento na pele do rato (Romana-Souza & Monte-Alto-Costa, 2019).
2.3.8.
Enquadramento do Mercado Mundial e Nacional
2.3.8.1.
Produção
A produção de azeite a nível mundial encontra-se restringida a duas zonas do globo que se localizam entre os paralelos 30 e 45 dos Hemisférios Norte e Sul, devido a razões edafoclimáticas (Casa do Azeite, 2019).
Atualmente, cerca de 95% da superfície oleícola mundial está concentrada na Bacia Mediterrânica, sendo que os países Espanha, Itália, França, Grécia, Portugal, Chipre, Croácia, Eslovénia e Malta representam 71% da produção a nível mundial. Por outro lado, os outros principais países produtores são a Tunísia, a Turquia, a Síria, Marrocos e a Argélia representam 4%, 6%, 3%, 6% e 2%, respetivamente (Casa do Azeite, 2019).
A produção de azeite é um sector agroindustrial relevante em termos de produção e consumo na Europa. De acordo com o Conselho Internacional do Azeite, a produção tem vindo a aumentar nas últimas décadas atingindo 2,3 milhões na campanha de 2015 – 2016 (Guarino et al., 2019).
A produção de azeite em Portugal é uma atividade de relevância económica e social, não só pela quantidade de azeite produzido, como também pela empregabilidade que cria e peso económico que apresenta, principalmente no Alentejo e Trás-os-Montes (Ramalhosa et al., 2014).
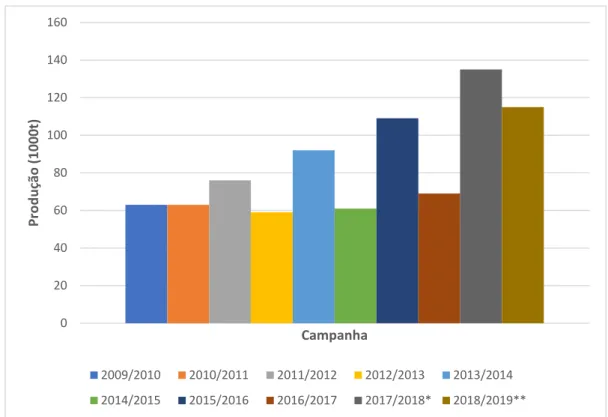
Na Figura 4 encontra-se um gráfico referente à produção de azeite nos últimos anos em Portugal.
15 Figura 4 - Produção de Azeite em Portugal (Fonte: International Olive Council, 2019).
Legenda: * - Valor provisório; ** - Valor estimativo.
2.3.8.2.
Consumo
O consumo de azeite encontra-se em crescimento constante a nível mundial, devido à divulgação do conhecimento sobre os efeitos benéficos do consumo de azeite em comparação com o das gorduras e outros óleos vegetais, ao seu alto valor dietético e nutricional, conduzindo a uma alteração profunda dos padrões de consumo (Tsagaraki et al., 2007; Reis, 2014).
A União Europeia é o principal produtor e também o consumidor e, surpreendentemente, o exportador número um e o importador número dois (García-González et al., 2009).
O mercado de importação na União Europeia é significativamente menor do que a exportação e manteve-se flutuando sobre valores semelhantes ao longo dos anos, com um padrão semelhante comparando-se com as variações na produção (Guarino et al., 2019).
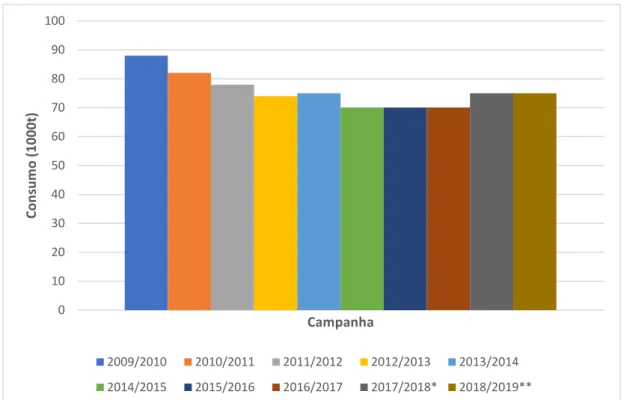
O consumo de azeite em Portugal encontra-se ilustrado na Figura 5. 0 20 40 60 80 100 120 140 160 Pr o d u ção (10 00t ) Campanha 2009/2010 2010/2011 2011/2012 2012/2013 2013/2014 2014/2015 2015/2016 2016/2017 2017/2018* 2018/2019**
16 Figura 5 - Consumo de Azeite em Portugal (Fonte: International Olive Council, 2019).
Legenda: * - Valor provisório; ** - Valor estimativo.
2.3.8.3.
Exportação
Ao nível das trocas internacionais, que se situam atualmente a níveis próximos das 845 mil toneladas, os principais países exportadores são, naturalmente, os principais produtores, ou seja, a União Europeia, com 68% e a Tunísia, com 15% (Casa do Azeite, 2019).
O mercado de exportação na União Europeia é considerável, uma vez que o total dos fluxos de exportação ascendeu a mais de 600.000 toneladas em 2015/2016, sendo o maior contribuinte Espanha com 289,700 toneladas e Itália com 233,300 toneladas (Guarino et al., 2019).
O mercado brasileiro recebe cerca de 30% do total das exportações nacionais de azeite, fazendo com que este produto seja igualmente o produto português mais exportado para aquele país (Casa do Azeite, 2019).
Os países responsáveis pelas importações mundiais foram no ano de 2018, por ordem decrescente: os Estados Unidos com 35%, o Brasil com 9%, o Canadá com 5%, o Japão com 6%, a China com 5% e por último, a Austrália com 3% (Casa do Azeite, 2019). 0 10 20 30 40 50 60 70 80 90 100 Co n su m o (1000t) Campanha 2009/2010 2010/2011 2011/2012 2012/2013 2013/2014 2014/2015 2015/2016 2016/2017 2017/2018* 2018/2019**
17
2.4.
Hidrocarbonetos Policíclicos Aromáticos
2.4.1.
Constituição
Os PAHs constituem uma classe de compostos de dois a seis anéis aromáticos fundidos (Gharbi et al., 2017), que são compostos apenas por átomos de carbono e hidrogénio (Hayakaw, 2018; Wenzl & Zelinkova, 2019). São altamente estáveis e resistentes à degradação e apresentam um caráter lipofílico elevado (Arrebola et al., 2006; Rose, 2010). De um modo geral, a sua hidrofibicidade aumenta com o aumento dos anéis de benzeno (Gao et al., 2018).
A taxa principal de formação destes compostos ocorre linearmente entre 500-750ºC (Purcaro et al., 2016). A altas temperaturas, os compostos orgânicos são parcialmente decompostos em pequenos fragmentos instáveis (pirólise), formando os radicais, que se recombinam para dar origem a PAHs relativamente estáveis (Dost & Ideli, 2012). Usufruem duma baixa atividade de água, o que resulta numa alta solubilidade em solventes não-polares, tais como óleos comestíveis, e também em altos pontos de ebulição e de fusão em virtude da sua estrutura (Rascón et al., 2018).
Os PAHs que contêm até quatro anéis de benzeno são denominados PAHs leves e aqueles que contêm mais de quatro anéis de benzeno são intitulados PAHs pesados. Os PAHs pesados são mais estáveis e mais tóxicos do que os leves (Wenzl et al., 2006). Somente os PAHs pesados são genotóxicos e carcinogénicos (Gharbi et al., 2017).
Os PAHs leves estão presentes no ambiente principalmente na forma de vapor, enquanto os PAHs pesados são predominantemente materiais particulados orgânicos, geralmente em partículas pequenas inferiores a 2,5 µm (Purcaro et al., 2016).
Alguns PAHs são facilmente degradados através de processos bióticos (aeróbios e anaeróbios) e abióticos. Todavia, os PAHs pesados são recalcitrantes e podem perdurar no solo indefinidamente. A degradabilidade destes compostos parece estar inversamente relacionada com o número de anéis aromáticos (Moret et al., 2007). Devido à sua volatilidade, os PAHs podem ser transportados longinquamente das suas fontes originárias acumulando-se posteriormente em várias matrizes ambientais (Gao et al., 2018).
Na Tabela 4 encontra-se uma lista de importantes hidrocarbonetos policíclicos aromáticos como principais contaminantes em componentes alimentares.
18 Tabela 4 - Lista de Hidrocarbonetos Policíclicos Aromáticos como principais contaminantes em componentes alimentares (Adaptado de Bansal & Kim, 2015).
PAHs Fórmula Química Nº CAS Massa Molecular
(g/mol) Estrutura Antraceno C14H10 120-12-7 178,23 Benzo[a]antraceno C18H12 56-55-3 228 Benzo[a]pireno C20H12 50-32-8 252 Benzo[b]fluoranteno C20H12 205-99-2 252 Benzo[e]pireno C20H12 192-97-2 252,31 Benzo[j]fluoranteno C20H12 205-82-3 252 Benzo[k]fluoranteno C20H12 207-08-09 252 Criseno C18H12 218-01-9 228 Dibenzo[a,h]antraceno C22H14 53-70-3 278 Dibenzo[aL]pireno C24H14 191-30-0 302 Fenantreno C14H10 85-01-8 178,23 Fluoranteno C16H10 206-44-0 202,26 Fluoreno C13H10 86-73-7 166,22 Indo[123-cd]pireno C22H12 193-39-5 276 Naftaleno C10H8 91-20-3 128,17 Pireno C16H10 129-00-0 202,25
19
2.4.2.
Formação
Os PAHs são substâncias omnipresentes e semivoláteis. Originam-se de fontes naturais e antropogénicas. São produzidos através da combustão incompleta ou pirólise de matéria orgânica e por processos geológicos (Pulcaro et al., 2013). Com base nos seus processos de formação, podem ser classificados em pirogénicos, petrogénicos e biogénicos (Gao et al., 2018).
As fontes naturais de emissões de PAHs podem ser erupções vulcânicas, incêndios florestais e processos hidrotérmicos. As fontes antropogénicas compreendem processos de combustão, produção de alumínio e coque, carvão, gás e carvão vegetal, incineração de resíduos, combustão de biomassa industrial, sector siderúrgico, queima aberta de detritos agrícolas, fumo do tabaco, alcatrão, derramamentos de produtos petrolíferos, emissões de motores de combustão, estradas asfaltadas e locais de resíduos perigosos (Rodríguez-Acuña et al., 2008; Alomirah et al., 2010; IARC, 2012; Bansal & Kim, 2015; Abdel-Shafy & Mansour, 2016; Purcaro et al., 2016; Hayakaw, 2018; Wenzl & Zelinkova, 2019).
Os PAHs podem ser transformados em PAHs oxigenados por fotoxidação, fotólise, oxidação química e reações microbianas e enzimáticas. Estes compostos têm elevadas toxicidades que podem até superar as dos PAHs correspondentes (Zhao et al., 2018).
2.4.3.
Toxicidade
A Organização Mundial da Saúde (WHO) reconhece que a poluição atmosférica é um fator de risco crítico para a saúde humana. Todos os anos morrem sete milhões de pessoas por razões diretamente relacionadas com a poluição, uma vez que, os níveis de contaminação permanecem perigosamente elevados em várias regiões do mundo (WHO, 2019).
A Agência Internacional para a Investigação do Cancro (IARC), a Agência de Substâncias Tóxicas e Registo de Doenças (ATSDR), a Agência de Proteção Ambiental (APA) e a União Europeia (UE) referiram os PAHs na lista de poluentes prioritários (Singh et al., 2016). Devido à capacidade destes compostos químicos se ligarem ao DNA, quer diretamente ou após a ativação metabólica, tal confere-lhes potencial mutagénico e carcinogénico (Xue & Warshawsky, 2005; Błaszczyk & Mielżyńska-Švach, 2017).
20 Na Tabela 5 encontram-se as propriedades carcinogénicas e mutagénicas de alguns PAHs.
Tabela 5 - Propriedades carcinogénicas e mutagénicas de PAHs (Adaptado de Singh et al., 2016).
PAHs Genotoxicidade Classificação IARC
Acenafteno Questionável Ainda não avaliado
Acenaftileno Questionável Ainda não avaliado
Antraceno Negativo 3 – Não classificável
Benz[a]antraceno Positivo 2B – Possivelmente carcinogénico
Benzo[a]pireno Positivo 1 - Carcinogénico
Benzo[b]fluoranteno Positivo 2B – Possivelmente carcinogénico
Benzo[g,h,i]perileno Positivo 3 – Não classificável
Benzo[k]fluoranteno Positivo 2B – Possivelmente carcinogénico
Criseno Positivo 2B – Possivelmente carcinogénico
Dibenzo[a,h]antraceno Positivo 2A – Provavelmente carcinogénico
Fenantreno Questionável 3 – Não classificável
Fluoranteno Positivo 3 – Não classificável
Fluoreno Negativo 3 – Não classificável
Indeno[1,2,3-cd]pireno Positivo 2B – Possivelmente carcinogénico
Naftaleno Positivo 2B – Possivelmente carcinogénico
Pireno Questionável 3 – Não classificável
O processo de avaliação de riscos consiste em várias etapas, incluindo identificação de perigos, caracterização de perigos, avaliação da exposição e caracterização de riscos (Pulcaro et al., 2013).
2.4.4.
Exposição
Os seres humanos podem ser expostos a PAHs através de três vias principais: inalação, contacto com a pele e ingestão (IARC, 2012; Pulcaro et al., 2013; Duijn, 2014). Contudo, a exposição dietética é a via dominante, contribuindo em mais de 90% das exposições totais de PAHs (Alomirah et al., 2010).
A exposição humana aos PAHs é inevitável, o que levanta uma importante preocupação de saúde pública (Teixeira et al., 2007). Foi epidemiologicamente
21 associada a um aumento de casos de cancro dado que a ação combinada de diferentes contaminantes químicos com modos de ação semelhantes e/ou diferentes pode ter influência na toxicidade uns dos outros e, assim, levar a inúmeros efeitos sinergéticos, aditivos ou antagonistas em diversas reações biológicas (Xue & Warshawsky, 2005; Wang et al., 2018).
A interação de diferentes PAHs encontra-se associada aos efeitos mencionados anteriormente em termos de formação de adutos de PAH-DNA, resultado de uma ligação covalente entre substâncias eletrofílicas reativas e os locais nucleofílicos do DNA e proteínas, e da atividade carcinogénica resultante de alterações na ativação metabólica de intermediários reativos e alteração do ADN causando erros na replicação do DNA e mutações (Mafra et al., 2010; Banks et al., 2014; Bansal & Kim, 2015; Błaszczyk & Mielżyńska-Švach, 2017; Silva et al., 2018).
Como referenciado anteriormente, os PAHs detêm carácter lipofílico pelo que tendem a ser armazenados em tecidos gordurosos, incluindo gordura mamária e médula óssea (Tamakawa, 2004). Historicamente, foram documentados diversos casos resultantes da exposição humana e animal a estes compostos. O primeiro caso conhecido foi descrito por Sir Percival Pott no ano de 1775, onde relatou o aumento da incidência de cancro testicular entre os limpa-chaminés que dado a sua profissão foram expostos à fuligem e ao alcatrão (Tamakawa, 2008).
Outros estudos demonstram efeitos dos PAHs relativamente ao stress oxidativo em seres humanos (Wang et al., 2015), ao aumento do risco de diabetes (Yang et al., 2017), ao aumento do cancro de pele e pulmão (Teixeira et al., 2007), ao aumento da inflamação e estresse oxidativo, alterações nos perfis de bioindicadores angiogénicos, em gestantes durante o 3º trimestre de gestação (Ferguson et al., 2017), ao aumento de riscos de infertilidade idiopática masculina (Xia et al., 2009), ao peso pré-natal reduzido, diminuição do ganho de peso pós-natal, menor circunferência da cabeça e comprometimento do desenvolvimento cognitivo (Sexton et al., 2011); atividade para gerar tumores, bem como os riscos de mal formações em embriões (Silva et al., 2018), diarreia, inflamação, irritação da pele, irritação ocular, náuseas e vómitos, diminuição da função imunológica, cataratas, problemas respiratórios, problemas renais, danos no fígado e sintomas de asma (Abdel-Shafy & Mansour, 2016).
No que concerne à área animal, existem estudos realizados em ratos que apontam para a origem de cancros a nível do trato respiratório, fígado e estômago (IARC, 2010).
22
2.4.5.
Fontes de Contaminação de Alimentos
Os PAHs surgem como contaminantes em diferentes categorias alimentares, como açúcar, café, chá, frutas, legumes, peixes, óleos e gorduras, pão e produtos alimentares fumados (Tfouni et al., 2014). A contaminação dos PAHs nos alimentos deve-se às características lipofílicas e hidrofóbicas dos PAHs que têm tendência a acumular-se na cadeia alimentar (Bansal & Kim, 2015).
A ocorrência de PAHs em alimentos advém do processamento tecnológico e confeção dos alimentos (temperatura elevada, fonte de calor e deposição do fumo sobre o produto alimentar), embalagens contaminadas e poluição ambiental (Purcaro et al., 2007; Ciecierska & Obiedzinski, 2013; Pulcaro et al., 2013; Alamprese, 2014; Tfouni et al., 2014; Wenzl & Zelinkova, 2019).
A poluição ambiental compreende poeiras e partículas com elevadas concentrações de PAHs, que contaminam as plantas através de precipitação atmosférica durante o período de crescimento resultando num produto final contaminado. Este fator é mais significativo em áreas industriais e perto de estradas do que em áreas rurais, onde a contaminação dos alimentos pode ser 10 vezes maior (Rodríguez-Acuña et al., 2008). A precipitação atmosférica é uma importante causa de contaminação em plantas, hortaliças e cereais (Pulcaro et al., 2013). Estas podem absorver os PAHs através da água, do ar ou do solo. A água pode conter determinadas concentrações de PAHs caso esteja em contacto com efluentes industriais ou provenha de locais onde houve derramamento de petróleo nos oceanos (Duedahl-Olesen, 2013; Abdel-Shafy & Mansour, 2016). Os peixes e crustáceos podem igualmente ser expostos a PAHs através de água e sedimentos (Duedahl-Olesen, 2013). Os PAHs encontrados nos sedimentos são resistentes à degradação bacteriana num ambiente anóxico, estes compostos serão liberados para a água ameaçando o ecossistema aquático através da bioacumulação em cadeias alimentares (Dong et al., 2012).
No que refere aos óleos vegetais, devido à aceitabilidade deste alimento pelos consumidores existe uma necessidade iminente de diminuir estes compostos, sendo uma importante fonte de exposição humana e contaminação (Arrebola et al., 2006; Kiralan et al., 2019).
Os óleos vegetais originalmente livres de PAHs, podem sofrer a contaminação principal com estes compostos através da poluição ambiental da matéria-prima vegetal e das etapas de processamento que precedem a refinação, como a contaminação na secagem de sementes, a extração com solvente, fumos de combustão, o material de embalagem, os resíduos de óleos minerais e a migração de águas subterrâneas
23 contaminadas transportadas dentro de um aquífero (Teixeira et al., 2007; Rodríguez-Acuña et al., 2008; Ballesteros & Ramos-Martos, 2010; Ciecierska & Obiedzinski, 2013; Yebra-Pimentel et al., 2015; Silva et al., 2018).
A taxa e a extensão da biodegradação dos PAHs no solo são afetadas por fatores ambientais como as características da população microbiana, as concentrações de oxigénio e de PAHs, contaminação do solo, teor de matéria orgânica, estrutura e granulometria do solo, nutrientes, pH, presença de contaminantes, propriedades físicas e químicas do PAHs, temperatura e tipo de solo (Yebra-Pimentel et al., 2015; Abdel-Shafy & Mansour, 2016).
A concentração dos PAHs nos óleos alimentares pode ser reduzida consideravelmente tanto no processo de refinação recorrendo a terras de diatomáceas, argilas e ao carvão ativado durante a operação de descoloração como nas etapas de neutralização e desodorização melhorando a qualidade de lotes altamente contaminados (Guillén & Sopelana, 2004; Ballesteros & Ramos-Martos, 2010; Duijn, 2014; Rascón et al., 2018; Kiralan et al., 2019; Wenzl & Zelinkova, 2019). A desodorização tem uma elevada eficiência na remoção dos PAHs leves, enquanto que a descoloração com carvão ativado é uma estratégia eficaz para reduzir os PAHs pesados (Pulcaro et al., 2013).
2.4.6.
Ocorrência de PAHs no Azeite
Devido à ubiquidade dos PAHs no ambiente e à sua natureza lipofílica, os azeites podem ser facilmente contaminados com essas substâncias. O Azeite Virgem e o Azeite Virgem Extra deveriam ser naturalmente livres de PAHs uma vez que não sofrem qualquer tipo de processo que introduza contaminação como é o caso dos processos de refinação, secagem ou aquecimento (Rascón et al., 2018). Todavia, a contaminação das azeitonas pode ocorrer diretamente durante a apanha mecânica, onde estas estão expostas aos fumos de escape do equipamento utilizado ou indiretamente devido à contaminação da azeitona durante o seu crescimento nomeadamente da sua pele por fontes ambientais através de precipitação atmosférica, por deposição de partículas de poeira na pele da azeitona, azeitonas que caem ao chão durante a colheita e armazenagem no lagar. Esta contaminação superficial transfere-se para o produto final posto que o nível de poluição atmosférica está relacionado com as imediações do olival (Rodríguez-Acuña et al., 2008; Mafra et al., 2010; Taghvaee et al., 2015; Rascón, et al., 2018).
24 A contaminação por PAHs em Azeite Virgem Extra e Azeite Virgem somente pode ser reduzida recorrendo à lavagem de azeitonas com água potável antes da extração do azeite (Rascón et al., 2018). É frequente encontrar maiores concentrações de PAHs leves do que os pesados em Azeite Virgem Extra e Azeite Virgem (Vichi et al., 2007).
2.4.7.
Legislação
A falta de uma legislação europeia harmonizada sobre os limites dos hidrocarbonetos policíclicos aromáticos e respetivos métodos de determinação tornou-se uma questão prioritária após o ano de 2001, quando foi detetado na República Checa um óleo de bagaço de azeitona altamente contaminado. Desencadeou-se uma ação de alerta máximo para a troca de informações entre os membros da União Europeia de forma a evitar a venda de produtos sinalizados como perigosos para os seres humanos (Pulcaro et al., 2013).
Atualmente, encontra-se em vigor o Regulamento (UE) Nº 835/2011 da Comissão de 19 de Agosto de 2011 que veio alterar o Regulamento (CE) Nº 1881/2006, que diz respeito aos teores máximos de PAHs presentes nos géneros alimentícios.
Com base num parecer científico do antigo Comité Científico da Alimentação Humana (CCAH), o benzo[a]pireno é utilizado como marcador relativamente à ocorrência e ao efeito de PAHs cancerígenos nos géneros alimentícios (Regulamento (UE) Nº 835, 2011).
Na Tabela 6, encontra-se a informação correspondente aos géneros alimentícios óleos e gorduras e respetivos teores máximos permitidos.
Tabela 6 - Género alimentício óleos e gorduras e respetivos teores máximos (Adaptado de Regulamento (UE) Nº 835, 2011).
Géneros alimentícios Teores máximos (μg/kg)
Óleos e gorduras
(com exceção da manteiga de cacau e da gordura de coco) destinados ao consumo humano direto ou à utilização
como ingredientes alimentares
Benzo[a]pireno - 2,0 μg/kg Soma de Benzo[a]pireno,
Benzo[a]antraceno, Benzo[b]fluoranteno e Criseno – 10,0 μg/kg
25
2.5.
Incêndios em Portugal
Os incêndios resultam na combustão incompleta de matérias orgânicas e como consequência originam hidrocarbonetos policíclicos aromáticos.
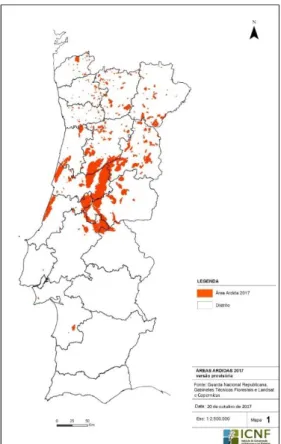
Em Portugal, o Sistema de Gestão de Informação de Incêndios Florestais registou no ano de 2017, entre o dia 1 de Janeiro e 31 de Outubro, um total de 16.981 ocorrências especificamente 3.653 incêndios florestais e 13.328 fogachos que resultaram em 442.418 hectares de área ardida de espaços florestais. As áreas ardidas localizavam-se principalmente no Centro-Norte do País (Departamento de Gestão de Áreas Públicas e de Proteção Florestal, 2017).
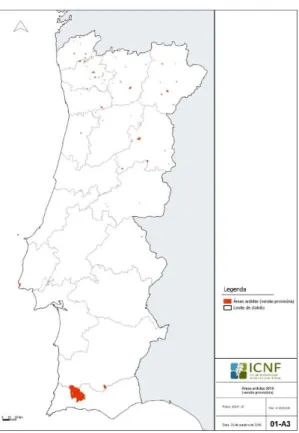
No ano de 2018, entre dia 1 de Janeiro e dia 15 de Setembro, foi registado um total de 9725 incêndios rurais que resultaram em 38223 hectares de área ardida (Departamento de Gestão de Áreas Públicas e de Proteção Florestal, 2018).
Nas Figuras 6 e 7 observam-se as áreas ardidas em Portugal no ano de 2017 e 2018, respetivamente.
Figura 6 - Área ardida em Portugal no ano de 2017 (Fonte: Departamento de Gestão de Áreas Públicas e de Proteção Florestal, 2017).
26 Figura 7 - Área ardida em Portugal no ano de 2018 (Fonte: Departamento de Gestão de Áreas Públicas e de Proteção Florestal, 2018).
27
3. PARTE EXPERIMENTAL
A parte experimental deste trabalho foi realizada no Laboratório de Estudos Técnicos (LET) do Instituto Superior de Agronomia.
O LET é um laboratório reconhecido internacionalmente pelo COI desde 1992 para a execução de ensaios químicos e sensoriais de azeites. Este laboratório, participa em reuniões internacionais do Conselho Oleícola Internacional, na qualidade de perito químico em ensaios de azeites e óleos de bagaço de azeitona e de perito em análise sensorial de Azeite Virgem.
O desenvolvimento do presente trabalho resultou do interesse em estudar a eventual influência dos incêndios de enormes dimensões que arrebataram Portugal em 2017 e 2018 na presença de hidrocarbonetos policíclicos aromáticos nos azeites de olivais próximos das zonas florestais ardidas.
3.1.
Materiais e Métodos
3.1.1.
Azeites Virgens
Neste estudo foram recolhidas 22 amostras de azeites virgens portugueses referentes aos anos 2017 e 2018 de diferentes regiões, obtidas diretamente dos produtores.
Na Figura 8, é possível observar a origem de cada uma das amostras.
28 Figura 8 - Mapa de Portugal com a origem das amostras analisadas.
29 Tabela 7 - Códigos das amostras e respetiva região de origem.
Código da Amostra Região de Produção Ano
A Baixo Alentejo 2017
B Trás-os-Montes e Alto Douro 2017
C Baixo Alentejo 2017
D Ribatejo 2017
E Alto Alentejo 2017
F Trás-os-Montes e Alto Douro 2017
G Ribatejo 2017 H Baixo Alentejo 2017 I Alto Alentejo 2017 J Beira Baixa 2017 K Beira Baixa 2017 L Beira Baixa 2018 M Beira Alta 2017 N Beira Alta 2017 O Beira Alta 2017 P Beira Alta 2017 Q Beira Baixa 2017 R Alto Alentejo 2017 S Alto Alentejo 2018 T Lisboa 2018 U Alto Alentejo 2017 V Alto Alentejo 2017
30
3.1.2.
Materiais
Os principais materiais utilizados para a concretização do presente trabalho prático foram os seguintes:
→ Balões aferidos de 25 mL; → Cápsulas de vidro de 3 mL; → Cartuchos C18; → Cartuchos Florisil; → Erlenmeyers de 250 mL; → Microseringa de 250 μL; → Pipetas graduadas de 2, 5 e 10 mL; → Pipetas de Pasteur; → Seringa de vidro de 1000 μL;
→ Tubos cónicos de 11 mL de capacidade;
→ Tubos de centrifuga de 100 mL de capacidade.
3.1.3.
Reagentes
Os reagentes utilizados para a execução do presente trabalho prático foram os seguintes:
→ Acetona HPLC, da Fisher Scientific;
→ Acetonitrilo HPLC, da Fisher Scientific;
→ Ácido acético glacial p.a., da Chem-Lab;
→ Água HPLC, da Fisher Scientific;
→ Água destilada;
→ Clorofórmio p.a., da Riedel-de Haën;
→ Diclorometano HPLC, da Fisher Scientific;
→ Etanol 95%, da AGA;
→ Éter dietílico p.a., da Riedel-de Haën;
→ Fenolftaleína, da Himedia;
→ Hidróxido de sódio 0,1N da Panreac Applichem;
→ Iodeto de potássio p.a., da Fisher Scientific;
31
→ Metanol HPLC, da Fisher Scientific;
→ n-hexano HPLC, Panreac Applichem;
→ Solução de amido p.a., Panreac Applichem;
→ Tiossulfato de sódio p.a., Panreac Applichem;
→ Tolueno HPLC, da Fisher Scientific.
3.1.4.
Equipamentos
Os principais equipamentos utilizados para a execução do presente trabalho prático foram os subsequentes:
→ Balança analítica com a aproximação de 0,0001 g, Sartorius BA2103;
→ Banho ultrassónico, J.P. Selecta 6000385;
→ Bureta automática, Burette Digital III Z324078;
→ Centrífuga, J.P. Selecta Mixtasel-PL;
→ Espetrofotómetro, Perkin-Elmer - Lambda 40 UV/VIS;
→ HPLC: forno da Perkin-Elmer Serie 200; coluna de sílica gel RP18; bomba binária da Younglin e desgaseificador vinculado da Perkin-Elmer;
→ Vortex IKA Yellow Line TTS 2.
O laboratório foi mantido à temperatura ideal de 20º C.
3.1.5.
Métodos
3.1.5.1. Determinação da Acidez
A acidez foi determinada em conformidade com o Regulamento de Execução (UE) 2016/1227 da Comissão de 27 de Julho de 2016 por titulação dos ácidos gordos livres com uma solução de hidróxido de sódio.
Os reagentes utilizados são de qualidade analítica reconhecida e todas as amostras foram analisadas em duplicado.
32 𝑽 𝒙 𝒄 𝒙 𝑴 𝟏𝟎𝟎𝟎 𝒙 𝟏𝟎𝟎 𝒎 = 𝑽 𝒙 𝒄 𝒙 𝑴 𝟏𝟎 𝒙 𝒎 Em que:
▪ V - volume gasto de solução titulada de hidróxido de sódio; expresso em mililitro;
▪ c - concentração exata da solução titulada de hidróxido de sódio, em mol por litro;
▪ M = 282 g/mol, expressa em grama por mole de ácido oleico;
▪ m - massa da amostra, em grama.
Toma-se como resultado a média aritmética de duas determinações.
3.1.5.2. Determinação do Índice de Peróxidos
O índice de peróxidos foi determinado em harmonia com o Anexo III do Regulamento (CEE) Nº 2568/91 da Comissão de 11 De Julho de 1991.
Os reagentes utilizados foram de qualidade analítica reconhecida.
Foram realizados ensaios em branco e cada amostra foi analisada em duplicado. O índice de peróxidos, expresso em miliequivalentes de oxigénio activo por kg, é dado por:
𝑽 𝒙 𝑵 𝒙 𝟏𝟎𝟎𝟎 𝒎 Onde:
▪ V - volume da solução de tiossulfato de sódio gasta no ensaio, com a correção alusiva ao ensaio em branco;
▪ N - normalidade exata da solução de tiossulfato de sódio;
33 Toma-se como resultado a média aritmética de duas determinações.
3.1.5.3. Determinação do Índice de Espectrofotometria
A análise por espectrofotometria foi determinada de acordo com o Anexo IX do Regulamento (CEE) Nº 2568/91 da Comissão de 11 De Julho de 1991.
Os reagentes usados foram de qualidade analítica reconhecida e todas as amostras foram analisadas em duplicado.
As leituras de absorvância foram efetuadas num espectrofotómetro Lambda 40 UV/VIS da marca Perkin-Elmer.
Os coeficientes de extinção registados nos diferentes comprimentos de onda são pela seguinte fórmula:
𝑲𝝀= ( 𝑬𝝀 𝒄 . 𝒔) Em que:
▪ Κ λ - extinção específica no comprimento de onda λ;
▪ Ε λ - extinção medida no comprimento de onda λ;
▪ c - concentração da solução, em g/100 mL;
▪ s - espessura das células de quartzo, em cm.
As leituras de absorvância foram realizadas com λ = 232 nm e λ = 270 nm.
A determinação da variação do valor absoluto da extinção específica (ΔΚ), dada por:
𝜟𝑲 = |𝑲𝒎− (
𝑲𝒎−𝟒 + 𝑲𝒎+𝟒
𝟐 )|