Junho 2018
Clínica Universitária de Gastrenterologia
Carcinoma
Pavimentocelular
do
Esófago: Artigo de Revisão a propósito
de um Caso Clínico
Clínica Universitária de Gastrenterologia
Carcinoma
Pavimentocelular
do
Esófago: Artigo de Revisão a propósito
de um Caso Clínico
Ana Marta Algéos Tibério de Almeida
Orientadora da Tese:
Resumo:
O artigo de revisão baseou-se num caso clínico de carcinoma do esófago num jovem de 21 anos, natural da Guiné Bissau. O doente foi transferido para o Hospital de Santa Maria, em Lisboa por disfagia total e alimentação com recurso a Gastrostomia Endoscópica Percutânea
(
PEG). No internamento foi realizada uma endoscopia digestiva alta que detetou uma massa vegetante no 1/3 inferior do esófago, de onde foram colhidas amostras para biópsia, sendo feito o diagnóstico de carcinoma Pavimentocelular do esófago (CPCE). O carcinoma primário do esófago afeta normalmente indivíduos do sexo masculino, entre 60-80 anos. Este carcinoma é o 8ª mais frequente no mundo e o 5ª nos países em desenvolvimento, assumindo-se alguns locais, como Norte da China, Irão, India e África subsaariana como regiões de alto risco para carcinoma do esófago. Quando abordadas estas populações concluiu-se que apresentavam características, fatores de risco e suscetibilidades diferentes, que levavam a que a doença se expressasse de forma mais precoce e abrangente. Apesar de ainda não ter sido identificado nenhum fator preponderante, parece que a exposição a nitrosaminas, hidrocarbonetos policíclicos aromáticos e baixos níveis de antioxidantes e vitaminas na dieta, aliados a uma maior sensibilidade ao efeito nefasto do tabagismo e alcoolismo, serão os responsáveis por esta maior incidência.Abstract:
This review article introduces a case of oesophagus cancer present in a 21 years old male, born in Guiné Bissau. He was transfered to Lisbon after developing a serious dysphagia that involved into feeding him by a Percutaneous Endoscopic Gastrostomy (PEG). After an upper GI endoscopy with tissue biopsy, the diagnosis was Esophageal Squamous Cell Carcinoma (ESCC), according with the pathologist’s report. The primary oesophagus cancer is more common in males between 60-80 years old. This carcinoma is the 8th most frequent carcinoma in the world and the 5th in developing countries. Some regions, like Northern China, Iran, India and sub-Saharan Africa have been considered as high-risk regions for oesophagus cancer. Populations of high-risk sites have different clinical features, risk factors and susceptibilities, which led them to a higher incidence and younger patients. The etiology of ESCC is still unclear, but epidemiologic studies made some strong associations between nitrosamines, polycyclic aromatic hydrocarbons, low levels of antioxidants and vitamins in diet and a greater vulnerability to some well-known risk factors, such as smoking and alcoholism.
Palavras Chave:
•
CPCE; Tabagismo; Álcool; Nitrosaminas; Anti-EGFR.Este trabalho exprime a opinião do autor e não da Faculdade de Medicina de Lisboa
Key Words:
•
ESCC; Smoking; Alcohol; Nitrosamines; Anti-EGFR.Índice
Resumo: ... 3
Acrónimos: ... 6
Caso Clínico ... 7
Introdução ... 10
Fatores de Risco para Carcinoma Pavimentocelular do Esófago ... 12
Marcha Diagnóstica ... 17
Estadiamento, Prognóstico e Medidas Terapêuticas ... 17
Medidas terapêuticas ... 18 Tratamentos Paliativos ... 21 “Novos Horizontes” ... 22 Ideias Finais ... 23 Anexos ... 24 Agradecimentos ... 25 Referências Bibliográficas: ... 26
Acrónimos:
• ADH - Álcool desidrogenase
• AJCC - American Joint Committee on Cancer • ALDH - Aldeído desidrogenase
• CMV – Citomegalovírus
• CROSS - Dutch Chemoradiotherapy for Oesophageal Cancer followed by Surgery Study
• CTFF – Capacidade Total de Fixação de Ferro • EBV – Vírus Epsteinn-Barr
• ECG – Electrocardiograma
• EGFR - Receptor do fator de crescimento epidérmico • CPCE - Carcinoma Pavimentocelular do esófago
• ESGE - European Society of Gastrointestinal Endoscopy • EUA - Estados Unidos da América
• EUS - Ultra-sonografia endoscópica • Hb - Hemoglobina
• HPV – Vírus do Papilomavirus humano • HSM - Hospital Santa Maria
• MCDT – Métodos Complementares de Diagnóstico e Terapêutica • NCCN - National Comprehensive Cancer Network
• PAH - Hidrocarbonetos policíclicos aromáticos • PEG - Gastrostomia Endoscópica Percutânea • PET - Tomografia por emissão de positrões • QT – Quimioterapia
• RQT - Radioquimioterapia • RT – Radioterapia
• SET - Salvage endoscopic treatment • STS - Society of Thoracic Surgeons • TNM - Tumor, nódulos e metástases
• UICC - Union for International Cancer Control • VHS – Vírus Herpes Simplex
Caso Clínico
Data de admissão HSM: 09/09/2017
Q.B., 21 anos, nascido a 11/01/1996, natural da Guiné Bissau, melanodérmico, iniciou quadro de disfagia 10 meses antes, rapidamente progressiva, primeiro para sólidos e posteriormente para líquidos, até atingir disfagia total. A disfagia era sentida alguns segundos após a deglutição, sem engasgamento, sensação de asfixia ou refluxo de líquidos pelas vias respiratórias superiores. Na Guiné Bissau o doente realizou um exame radiográfico com bário que mostrava estenose do 1/3 inferior do esófago. Desde o início dos sintomas refere perda ponderal de mais de 20 kg, astenia nos últimos 6 meses e odinofagia desde há 5 meses, avaliada pelo doente em 5/10, com regurgitação alimentar desde há 2 meses, aquando da disfagia total.
Nega sintomatologia relativa a DRGE, como pirose ou sensação de enfartamento, febre, calafrios, suores noturnos, lesões nas mucosas, adenopatias, disfonia, tosse, infeções respiratórias recentes ou repetidas, nega espessamento das palmas das mãos e pés, nega dores articulares, secura das mucosas, síndrome de Raynaud ou espessamento da pele, nega sintomas neurológicos, como perda de força ou sensibilidade, tremor, queda palpebral, alterações da visão ou presença de nistagmo. Nega igualmente infeção recente ou que condicionasse estado de imunossupressão, nega toma de medicamentos ou sintomatologia semelhante anterior.
Doente nega hábitos tabágicos, alcoólicos ou toxicofílicos. Nega toma de medicação usual ou antecedentes de toma de agentes caústicos.
Doente natural e residente na Guiné Bissau, desempregado, solteiro, vive com 15 elementos da sua família. Nega familiares doentes ou com sintomas semelhantes. Desconhece história familiar dos avós e tios.
Evolução Clínica e Marcha Diagnóstica no Hospital Santa Maria
O doente Q.B. foi evacuado da Guiné Bissau e deu entrada no Hospital Santa Maria a 9 de Setembro 2017 por afagia há 2 meses, com alimentação com recurso a PEG, por diagnóstico provável de estenose esofágica por neoplasia. Na primeira avaliação o doente não apresentava alterações no exame objetivo, exceto a caquexia.
Por estabilidade clínica, o doente foi internado no Serviço de Gatroenterologia para investigação da etiologia da disfagia e alívio sintomático. Para tal foram executados os
seguintes MCDT: Avaliação laboratorial, Endoscopia Digestiva Alta (EDA) com biópsia, TC toracoabdominopelvica, mielograma e biópsia de adenopatia no base esquerda do pescoço.
Na avaliação laboratorial, a destacar anemia associada a doença crónica, com Hb de 9,1 g/dL, VGM 88 fL, HGM 29 pg, CMHC 33g/L, ferro 28 ug/dL, ferritina 727 ng/mL, CTFF 128 e saturação de Transferrina 21,8%. Subida das enzimas hepáticas, com valores de AST, ALT 134 e 184 U/L respetivamente, pesquisa de hepatites virais com: Anti-VHA positivo, Anti-VHC negativo, AgHBs negativo, Anti-HBs e Anti-HBc positivos e ADN VHB não detetado (Imune após Infeção pelo VHB). Para pesquisa de possível
imunodepressão foi avaliado o HIV 1 e 2 e ambos foram negativos. Por suspeita de tuberculose foi efetuado o teste de IGRA, com resultado negativo.
O exame endoscópico efetuado mostrou uma lesão vegetante ulcerada a partir de 30 cm da arcada dentária, que impedia a passagem aos 32 cm, sem observação do estômago ou duodeno, tendo sido realizadas várias biópsias à lesão.
Na TC toracoabdominopelvica objectivou-se a existência de uma volumosa massa sólida no mediastino posterior subcarinal, com envolvimento circunferencial da metade distal do esófago até ao cárdia e pequena curvatura do estômago (com dilatação esofágica a montante). No tórax a lesão envolvia o espaço subcarinal e região traqueobrônquica inferior direita e esquerda (52x33mm eixo axial), condicionando moldagem da artéria pulmonar direita e aurícula esquerda. No abdómen envolvia o ligamento gastrohepático e território do tronco celíaco, com encarceramento do tronco e ramos, principalmente a artéria gástrica esquerda. Existia ainda contacto e perda do plano de clivagem com o bordo posterior do fígado. Pâncreas, baço, suprarrenais e rins sem alterações.
As alterações a nível da TC deixaram em aberto um possível diagnóstico de linfoma ou tuberculose, tendo o doente realizado mielograma, biópsia osteomedular e biópsia a uma adenopatia na base do pescoço.
Figura 1: Imagens referentes à EDA do doente, realizada no HSM no dia 21/09/2017
No mielograma não foram registadas alterações morfológicas, maturativas ou proporcionais nas séries eritrocítica e granulócitica. Medula Óssea normocelular com 19% de linfócitos, 2% plasmócitos e megacariócitos dentro do normal. Os resultados da biópsia osteomedular revelaram hipocelularidade de ligeira a moderada, devido à transformação gelatinosa da medula, mas com elementos das 3 séries hematopoiéticas em maturação e sem infiltração maligna por neoplasia.
Por fim, a biópsia à lesão esofágica esclareceu quanto à etiologia da lesão, com características histológicas de carcinoma Pavimentocelular do esófago moderadamente queratinizante, com presença de doença metastática na adenopatia da base esquerda do pescoço, na qual a biópsia revelou células pavimentosas diqueratóticas e atípicas, também compatível com carcinoma Pavimentocelular queratinizante, corroborando com o diagnóstico.
Diagnóstico Final: Carcinoma Pavimentocelular do Esófago estadio IV
Introdução
O carcinoma primário do esófago é a principal neoplasia maligna que afeta este órgão, representando 95% dos casos, sendo as restantes neoplasias de manifestação rara, como linfoma, sarcoma ou metástases. Este carcinoma tem uma incidência muito variável, assumindo a 8ª posição nos carcinomas mais frequentes no mundo e a 5ª nos países em vias de desenvolvimento, sendo a sua prevalência mais preponderante no Norte da China, Irão, India e África subsaariana, principalmente África do Sul e Ocidental, contrastando com a prevalência nos Estados Unidos da América (USA), onde é responsável por apenas 1% dos cancros diagnosticados. Em Portugal não existem dados sobre a incidência deste tumor, mas o seu comportamento deve assemelhar-se aos restantes países europeus. Este carcinoma é extremamente agressivo e sem tratamento eficaz, sendo o 6º cancro mais mortal, com uma taxa de sobrevivência a 5 anos de 18,4%.1,2
O carcinoma primário do esófago divide-se fundamentalmente em dois tipos histológicos, o Carcinoma Pavimentocelular (CPCE) e o Adenocarcinoma. A sua incidência aumenta com a idade, sendo mais frequente na 7ª década de vida e raro nos jovens. Nas regiões de alto risco afeta igualmente homens e mulheres, enquanto nas de baixo risco são os homens os mais afetados.3 O carcinoma mais comum do esófago continua a ser o carcinoma Pavimentocelular, representando 90% dos casos, contudo, o perfil epidemiológico deste carcinoma está a mudar. É notável a crescente incidência do adenocarcinoma e a diminuição de CPCE nos últimos anos
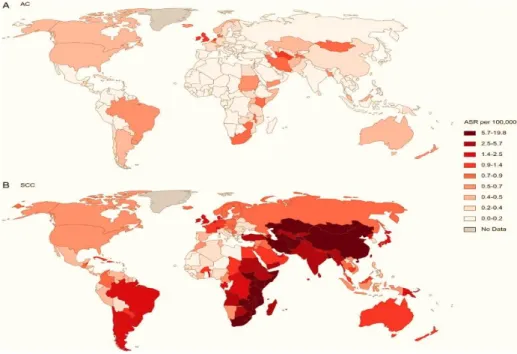
Figura 2: Melina Arnold, Isabelle Soerjomataram, Jacques Ferlay DF. Global incidence of oesophageal cancer by histological subtype in 2012. Gut. 2015;64:381-387.
nos EUA, Europa e Austrália.4 No caso dos EUA, destaca-se como população de risco os Afroamericanos.3,5
Pensa-se que esta inversão epidemiológica em alguns países desenvolvidos se deva aos agentes causais responsáveis pelos dois tipos histológicos, que no caso do adenocarcinoma está relacionado com alteração dos hábitos alimentares e obesidade, que leva a aumento da pressão intra-abdominal e doença do refluxo gastroesofágico (DRGE), patologias muito frequentes no mundo ocidental e responsáveis pela alteração do epitélio escamoso do esófago para colunar e evolução para a lesão pré-maligna, o esófago de Barret.6 Quanto ao CPCE, a esofagite parece
ser o passo inicial para que ocorram lesões a nível do DNA das células do esófago, levando a formação da lesão inicial, designada displasia escamosa. Este processo fisiopatológico é iniciado por um agente que provoca irritação e inflamação crónica da mucosa. Os principais fatores de risco associados são o tabaco e o álcool, sendo o seu efeito sinérgico. A diminuição do seu consumo parece ser a justificação para a diminuição da incidência deste carcinoma nos países desenvolvidos.4
Os principais fatores de risco de ambos são os expressos na tabela 1, contudo a sua importância varia caso se esteja a estudar uma região de baixo ou alto risco.
Tabela 1 - Fatores de Risco:
Carcinoma Pavimentocelular Adenocarcinoma
Tabagismo Refluxo gastroesofágico
Álcool Obesidade
Tilose
(hiperqueratose congénita palmoplantar)
Esófago de Barret
Lesão da mucosa por agentes físicos:
• Bebidas quentes • Soda cáustica
• Estenose induzidos por radiação
Sexo masculino Nitrosaminas e Hidrocarbonetos Policíclicos Aromáticos (PAH) Tabagismo Acalásia
Dieta pobre em fruta e vegetais (baixos níveis de antioxidantes e vitaminas) Dieta rica em carnes vermelhas, lípidos e comida processada
Fatores de Risco para Carcinoma Pavimentocelular do Esófago
Nos países desenvolvidos a agressão pelo tabaco e álcool representa mais de 90% dos casos, sendo sem dúvida os fatores de risco mais preponderantes, existindo um efeito sinérgico no uso de ambas as substâncias. Os mesmos dois fatores também estão implicados no carcinoma da cabeça e pescoço, pelo que existem 10-15% de co-expressão de ambos os carcinomas.
Consumo de álcool
O consumo crónico de bebidas alcoólicas é o fator de risco mais associado a este carcinoma. O consumo de 3 ou mais bebidas alcoólicas por dia aumenta 3 a 5 vezes o risco de CPCE.
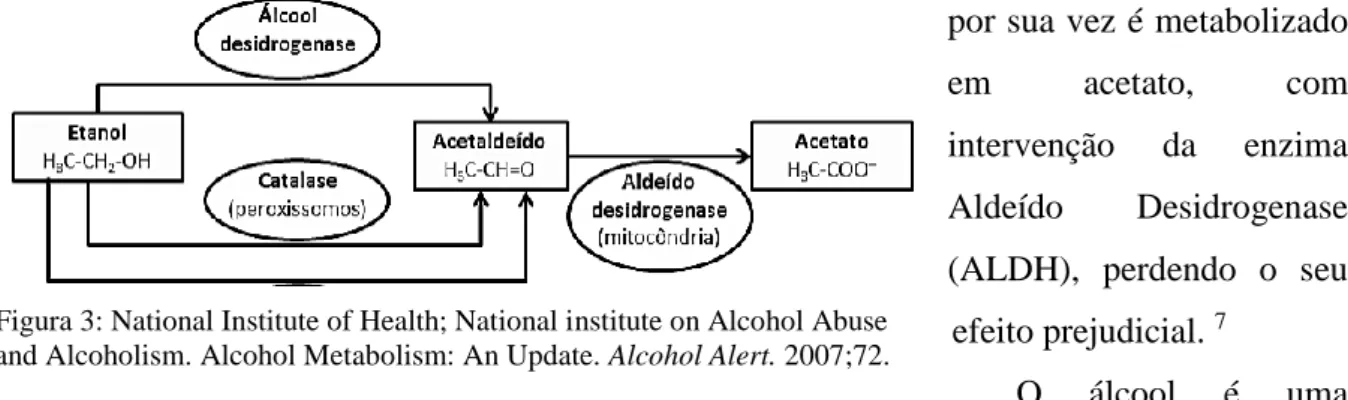
Os dois agentes responsáveis pela lesão celular são o etanol e um dos seus metabolitos, o acetaldeído. O metabolismo do etanol depende de duas enzimas, a Álcool Desidrogenase (ADH), que leva à formação de um metabolito intermédio, altamente tóxico, o acetaldeído, que por sua vez é metabolizado
em acetato, com
intervenção da enzima Aldeído Desidrogenase (ALDH), perdendo o seu
efeito prejudicial. 7
O álcool é uma
substância com elevada capacidade de difusão nos tecidos e como tal, quando ingerida, vai difundir-se facilmente para o interior das células. A mucosa esofágica é mais sensível a esta agressão do que a mucosa gástrica, pois a nível celular contém maior quantidade de ADH e menor de ALDH, que leva a maior acumulação de acetaldeído.
Ambas as substâncias, etanol e acetaldeído, trabalham em conjunto para o efeito carcinogénico final. O etanol tem potencial para alterar o padrão de metilação do DNA, pondo em causa a regulação da transcrição génica e o acetaldeído irá alterar a regulação do ciclo celular, levando a uma amplificação da ciclina D1, permitindo a passagem do checkpoint fase G1 para a fase S, acelerando a replicação celular.8
Figura 3: National Institute of Health; National institute on Alcohol Abuse and Alcoholism. Alcohol Metabolism: An Update. Alcohol Alert. 2007;72.
Tabagismo
O tabagismo também está implicado na génese do CPCE através de vários mecanismos que lesam o DNA. Estas alterações ocorrem num momento muito precoce do desenvolvimento de CPCE. A via carcinogénica principal é a formação de ligações covalentes entre bases do DNA e os carcinogéneos do tabaco, tais como a nitrosamina e PAH. Estas ligações alteram a expressão genética, comprometendo o curso normal da célula e levam à expressão de oncogenes e supressão de genes supressores de tumores. A nicotina também está associada ao desenvolvimento de CPCE, pois promove um estado de inflamação crónica local nos tecidos, com ativação do EGFR (receptor do fator de crescimento epidérmico) das células escamosas, inibindo vias de apoptose e modulando os checkpoints controlo da replicação celular, com aumento da divisão celular. Foram também destacados aumentos dos níveis de acetaldeído na saliva associados a tabagismo crónico.9
Os mesmos Fatores de Risco, mas diferentes “fragilidades”
O consumo de álcool, como já mencionado acima, é dos fatores de risco mais importantes no desenvolvimento de CPCE, sendo em grande parte associado ao seu metabolismo e acumulação de acetaldeído. Contudo, existe alguma incongruência entre diferentes populações, pois algumas mostravam maiores índices de CPCE, com consumos de álcool inferiores.
A população do leste asiático é 36% homozigótica para o alelo ALDH2 Glu487Lys, mutação que diminui a atividade da enzima ALDH, pelo que apresentam uma baixa tolerância ao álcool devido à elevada concentração de acetaldeído que se acumula, condicionando uma resposta fisiológica que se expressa por flushing facial, náuseas e taquicardia, o que impede o seu consumo.
Os indivíduos que são heterozigóticos para o alelo ALDH2 não são completamente intolerantes ao álcool, pois ainda apresentam função enzimática, contudo, são os que estão mais sujeitos as alterações carcinogénicas, pois não cessam o consumo de etanol e estão mais expostos aos malefícios do acetaldeído que a restante população. Os polimorfismos nos alelos do ADH1B e ADH7, do qual advém aumento de função, também estão associados a uma alteração do metabolismo do álcool e a maior propensão para CPCE.7
“Contradições” nos países com alta incidência de CPCE
Na Europa e EUA, o álcool e tabagismo foram fortemente associados com o desenvolvimento do carcinoma do esófago, tanto que a diminuição do seu consumo levou a um
decréscimo da sua prevalência nestes países. No entanto, a importância dos fatores de risco continua pouco esclarecida nos países de alta incidência e parece existir uma maior suscetibilidade a este tipo de cancro que não se relaciona somente com fatores de risco tradicionais, já que em geral ocorre em populações com menor exposição ao tabagismo e alcoolismo, sendo nesses países o risco entre o sexo masculino e feminino similar.10
Nestes países a associação nutricional parece assumir grande importância, como o consumo de produtos mal conservados, contaminados com fungos e com baixo teor em antioxidantes e vitaminas.
Na população africana ocorrem casos em idades extremamente jovens, o que parecem indicar uma predisposição genética conjugada com uma exposição precoce e intensa a fatores de risco, que permite em 2 a 3 décadas de vida a desenvolver o carcinoma.
Um estudo realizado no Uganda, que visava demonstrar os efeitos dos fatores de risco para aparecimento do CPCE, concluiu que caso o tabaco e o álcool fossem eliminados de uma área rural do Uganda, apenas 13% dos novos casos de carcinoma do esófago seriam evitados. Estes dados remetem para uma importância muito menor dos fatores de risco tradicionais nesta população do que seria de esperar.11
Estes dados são corroborados por outros estudos, realizados no Nordeste da China, na região de Linxian, onde foi realizado um estudo de Cohort com 29584 adultos, dos quais 1958 desenvolveram CPCE. Ao contrário do que acontece nas populações de baixo risco, a incidência entre o sexo masculino e feminino foi similar a 1:1. Nesta população o consumo de tabaco não foi associado como preponderante no desenvolvimento do CPCE. Nesta população apenas 60% dos pacientes homens mantinha hábitos tabágicos e cerca de metade dos CPCE foram diagnosticados em mulheres, das quais < 1% fumava.12
“Novos” fatores de Risco
Em diferentes países já foi estudada a influência genética e o papel dos fatores de risco no desenvolvimento do CPCE. Tal como existem doenças genéticas associadas a um maior risco de cancro esofágico, como síndrome de Tilose, Síndrome de Bloom e Anemia de Fanconi têm-se efetuados esforços para estudar alterações genéticas que pudestêm-sem estar implicadas no desenvolvimento CPCE.13
Na Suécia foi estudado o risco familiar de cancro esofágico e os resultados foram surpreendentemente elevados, mesmo não se tratando de um local de alta incidência. Antecedentes familiares em 1º grau com carcinoma do esófago têm um risco 3,91 vezes maior
para desenvolver carcinoma do esófago. Ao analisar apenas os casos de CPCE, o risco é ainda maior, 4,91 vezes mais. Contudo, a importância destes casos na incidência de carcinoma do esófago contribuiu apenas para 0,7% dos casos na Suécia, indicando que a etiologia genética seria uma minoria da população.13
Na China sequenciaram o genoma de células de uma amostra de CPCE que revelou a mutação de 8 genes, 6 deles reconhecidos como genes supressores de tumores ou oncogenes, tais como TP53, RB1, CDKN2A, PIK3CA, e NFE2L2.14 A história familiar de carcinoma do
esófago também mostrou um padrão genético particular, associado a uma hereditariedade autossómica recessiva, sugerindo que existe uma complexa interação entre a genética e ambiente no CPCE, pois os portadores de um gene mutado não expressariam a doença até mutação somática no segundo alelo.14
Também nos EUA foram publicados por uma equipa liderada pelo médico Agrawal, 12 sequencias genéticas associadas ao CPCE. As mutações mais frequentes no CPCE ocorrem no TP53 (92%), NOTCH1 (33%), NOTCH3 (25%).15 Este tipo de mutações está associada a alterações no ciclo celular, levando a uma desregulação e proliferação não controlada das células escamosas. Em 19% dos casos há uma amplificação de recetor EGFR.
Estudos demonstraram que parece existir uma herança genética e um aumento do risco em caso de familiar direto com carcinoma do esófago, contudo a sua expressividade varia consoante se trate de um país de alta ou baixa incidência e a associação de um componente genético e a existência de um clustering familiar continua dúbia.11
Países em Desenvolvimento têm maior incidência de CPCE
Os países com maior incidência de CPCE são também os países subdesenvolvidos, pelo que parece existir um terreno genético mais propício que os torna mais sensíveis aos fatores de risco. Alguns dos fatores que estão a ser estudados e a ganhar relevo são o papel da má nutrição com deficiência em antioxidantes e vitaminas, a má conservação de alimentos, o consumo de bebidas muito quentes, a exposição à biomassa e o efeito das nitrosaminas e PAH.
Na Ásia foram implicados no CPCE os alimentos que contêm na sua composição percursores de nitrosaminas.16 Estes compostos exercem o seu papel mutagénico induzindo a formação de adutos de alquilo no ADN.17 Estes compostos são facilmente encontrados em
alimentos de conserva e alimentos mal conservados, que leva ao crescimento de fungos, produtores de toxinas (por exemplo, aflatoxina).18 Também parece estar implicada a forma
como os alimentos são preparados, com exposição a toxinas resultantes da combustão de carvão e madeira em locais pouco ventilados, com inalação de PAH.9
As deficiências de micronutrientes, incluindo ferro, betacaroteno, vitamina E, selénio, riboflavina, niacina, retinol e zinco, foram documentadas como associadas a um maior risco de CPCE, especialmente em pacientes de alto risco. A teoria proposta defende que o consumo de fruta fresca aumenta os níveis de ácido ascórbico e outros antioxidantes, exercendo um efeito protetor para o organismo, ao inibir a ação das nitrosaminas e dos hidrocarbonetos policíclicos aromáticos.19,20
A relação entre o estado nutricional com esofagite ou carcinoma do esófago ainda não foi totalmente elucidada, o mais provável é que a condição de desnutrição deixe o organismo mais suscetível ao desenvolvimento de doença, do que funcione como fator primário de lesão da mucosa. No entanto, continua a ser uma área de estudo, pois é um fator de risco passível de mudança e prevenção primária do carcinoma do esófago, proporcionando uma oportunidade de reduzir a incidência desta doença mortal.
Agentes infeciosos e o seu papel no CPCE
A inflamação e irritação da mucosa é o passo inicial para que ocorram lesões a nível do DNA das células do esófago, por esse motivo foram também considerados agentes infeciosos no desenvolvimento do CPCE, tais como fungos Fusarium verticilliodes e Fusarium
moniliforme, responsáveis pela contaminação da comida e formação de maiores quantidades de
nitritos (como abordado acima) e também de vírus, em particular Epstein-Barr (EBV) e o Vírus do Papiloma Humano (HPV)1
O HPV foi dos vírus mais estudados, visto estar comprovado como fator de risco importante para o carcinoma da cabeça e pescoço e como já referido, há uma sobreposição de casos com os dois tipos de cancro. Além desta sobreposição de fatores de risco, parece existir uma concordância entre os países que têm uma alta incidência de infeção por HPV e os que são considerados como regiões de alta incidência de CPCE. Ademais, seria uma área de prevenção possível através de campanhas de vacinação, sendo os subtipos mais associado o 16 e o 18. 8
Contudo, apesar dos esforços na área, a associação da infeção HPV e o CPCE do esófago demonstrou-se inconsistente e pouco satisfatória, sendo necessários mais estudos na áreas e uniformização da técnica utilizada, para maior apuramento de dados.21
Marcha Diagnóstica
O CPCE possui uma forma de apresentação bastante inespecífica, com sintomas tardios que normalmente surgem num estadio muito avançado, pelo que 50% dos casos tem doença metastática no momento do diagnóstico.
O sintoma mais comum é a disfagia, que surge inicialmente para sólidos e posteriormente para líquidos, quando o lúmen do esófago se estreita mais do que 13 mm de diâmetro. Este sinal indica que o carcinoma está localmente avançado e possivelmente atinge as estruturas envolventes. O 2º sintoma mais comum, presente em metade dos casos, é a perda de peso, seja relacionado com a disfagia ou com a própria evolução do tumor. Os outros sinais e sintomas são hemorragia, que se pode expressar por anemia ferropénia, dor epigástrica, que não alivia com terapêutica antirrefluxo, dor óssea (presente em caso de doença avançada), tosse ou rouquidão persistente (por invasão do nervo laríngeo recorrente) e pneumonias de repetição (seja por aspiração de restos alimentares retidos no local de estenose do lúmen ou por doença invasiva e comunicação direta com a árvore respiratória).22
O exame objetivo não apresentará alterações até um estadio avançado da doença, quando começa a apresentar invasão dos nódulos linfáticos circundantes e a serem palpáveis as linfoadenopatias laterocervicais, supraclaviculares ou a hepatomegalia. Sinais de doença à distância são sempre de mau prognóstico e muitas vezes constituem contraindicação à ressecção do tumor. No caso de disfagia, o primeiro procedimento a seguir é realizar uma endoscopia digestiva alta e biópsia, sendo que o diagnóstico final só é estabelecido com biópsia, já que 17% das lesões que pareciam ser benignas à endoscopia revelaram-se malignas após avaliação anatomopatológica.23
Estadiamento, Prognóstico e Medidas Terapêuticas
O prognóstico e tratamento do doente vão depender do tamanho do tumor e se há invasão dos nódulos linfáticos adjacentes ou metástases à distância. Anteriormente era utilizada a TC para estadiamento, mas esta técnica foi substituída pela técnica de ultrassonografia endoscópica (EUS) e tomografia por emissão de positrões (PET), sendo a primeira útil para avaliação loco regional do tumor (T e N) e a segunda para deteção de metástases à distância (M), normalmente nos nódulos linfáticos supraclaviculares e retroperitoneais.4
Assim, a TC deixou de ser utilizada como 1ª linha, visto a maior sensibilidade do PET para a deteção de doença metastática ocultas, sendo custo benefício mais favorável, pois evita-se medidas terapêuticas curativas cirúrgicas desnecessárias. 24,25
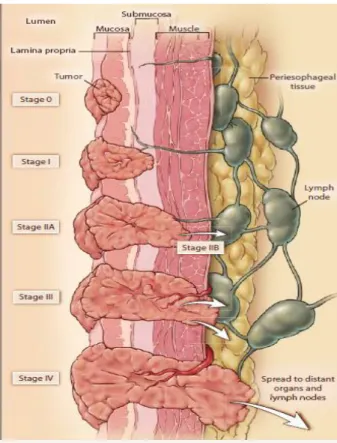
Para estadiar o CPCE é utilizado o sistema TNM (tumor, nódulos e metástases), sendo a localização um dos novos critérios incluídos na 8ª edição (2017) da classificação de TMN (vide anexos). A localização do tumor no terço superior do esófago é das que possui a taxa mais elevada de mortalidade pós-operatória, portanto merece maior ponderação na hora de escolher a terapêutica. Se o carcinoma está apenas confinado na mucosa designa-se de T1a; se envolve a camada muscular própria, mas sem invasão da parede esofágica designa-se T2; caso ultrapasse a adventícia designa-se T3; e se existir invasão de estruturas do mediastino, como pericárdio, aorta, brônquios ou pleura designa-se T4.26
A espessura máxima da massa esofágica
também pode prever a extensão
extraesofágica, sendo os tumores T3-T4 significativamente mais espessos do que os tumores T1-T2 (16 versus 8,2 mm) 27. Esta característica foi mais precisa no estadiamento tumoral do que a identificação da rotura da camada muscular própria por EUS. Pelo que se discute a possibilidade de a incorporar no atual sistema de estadiamento, como forma de estabelecer o prognóstico e predizer a probabilidade de sobrevivência a longo prazo, identificando pacientes de alto risco para terapia pós-operatória.28
Medidas terapêuticas
O CPCE assume o 6º lugar na lista de mortalidade por cancro e mesmo com vários incentivos e estudos nesta área, o tratamento ideal ainda não foi alcançado e continua a ser uma questão controversa. O tratamento vai depender do estadio em que o tumor é encontrado, principalmente se N+ e metástases à distância.
Figura 4: Anil K. Rustgi, M.D., and Hashem B. El‑Serag, M.D. MPH. Esophageal Carcinoma. NEJM.
Historicamente, o tratamento standard era a cirurgia, só aplicável a tumores ressecáveis, que correspondiam apenas a 30-40% dos doentes ao diagnóstico. Ademais, esta estratégia terapêutica era pouco eficaz com taxas de sobrevivência a 5 anos de 15-20% dos doentes.29
Este baixo outcome levou ao desenvolvimento de outras estratégias terapêuticas, apostando no uso combinado da quimioradioterapia neoadjuvante (QRT) e cirurgia (terapêutica trimodal) em prol do uso de apenas uma das vertentes.
Os dois grandes estudos desenvolvidos nesta temática foram o CALGB 9781, em 2008 e o CROSS (Dutch Chemoradiotherapy for Oesophageal Cancer followed by Surgery Study) publicado em 2012, que continua a decorrer com atualizações recentes. Desde que os seus resultados foram publicados, o esquema de terapêutica foi alterado em muitos locais do Mundo.30
No estudo CALGB 9781, apesar de o estudo ter sido interrompido precocemente por apenas 56 dos planeados 475 terem completado o esquema terapêutico, foi um estudo bem desenhado e desenvolvido e os resultados da taxa de sobrevivência a 5 anos também foram muito satisfatórios, com 39% dos pacientes vivos na terapêutica trimodal vs 16% nos submetidos apenas à cirurgia.31
No estudo CROSS foi feita a comparação entre a cirurgia isolada e a cirurgia 4-6 semanas depois de completarem o ciclo de quimioradioterapia (utilizando semanalmente paclitaxel, carboplatina e radioterapia (41.4 Gy durante 5 semanas). O efeito no CPCE foi particularmente impressionante, com aumento da sobrevivência a curto e longo prazo, de 47% versus 33% a 5 anos, quando comparado com os doentes que apenas realizaram cirurgia, com ou sem QRT adjuvante, com melhor controlo locoregional e de metástases à distância. Quanto à tolerância e toxicidade da QRT neoadjuvante, o estudo CROSS também demonstrou que a terapêutica neoadjuvante é segura e bem tolerada em 95% dos doentes, sem alterações a nível de mortalidade e morbilidade pós-cirurgia.32
As vantagens de QRT isolada ou inserida na terapêutica trimodal também foram avaliadas, e apesar de não se ter conseguido demonstrar superioridade quanto a sobrevivência, os métodos com cirurgia foram aqueles com melhores resultados no controlo locorregional da doença e os que menos necessitaram de cuidados paliativos posteriores. 33,34
Apenas os carcinomas ressecáveis, estadio I, II e III (T4a - tumor ressecáveis que invadem a pleura, pericárdio ou diafragma), são candidatos a cirurgia.
Os tumores são não ressecáveis se: presença de metástases à distância (peritoneu, pulmão, osso, glândula suprarrenal, SNC e fígado), em caso de invasão de estruturas adjacentes, como
aorta, coluna vertebral ou traqueia (T4b) ou se linfadenopatias extrarregionais, com afeção dos gânglios paraaórticos ou mesentéricos.
Outras contraindicações para cirurgia são a localização cervical, devido a diminuição da qualidade de vida pelos défices associados no status pós-cirúrgico, sem ganho aparente na taxa de sobrevivência ou no caso de doente com outras coomorbilidades, como doenças do foro cardiorrespiratório, que impossibilitem a cirurgia.35
Outro método terapêutico aplicável é a ressecção endoscópica da mucosa em doentes que apresentam displasia de alto grau ou cancro esofágico superficial, T1a e T1b, com baixo risco de afeção dos nódulos linfáticos adjacentes. Esta técnica conseguiu resultados equivalentes à esofagectomia, principalmente se em conjunto com QRT.36 Além disso, também é uma opção
eficaz de tratamento em caso de lesão superficial que não responde à QRT, a salvage
endoscopic treatment (SET).37
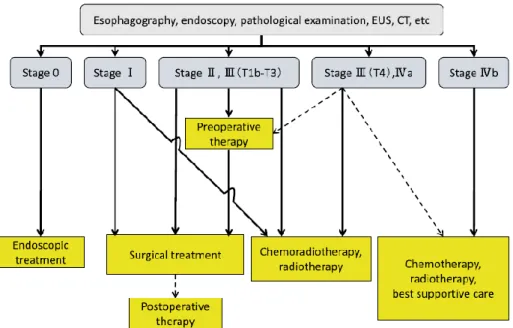
A National Comprehensive Cancer Network (NCCN) aconselha o tratamento de CPCE de Tis ou T1a através de ressecção endoscópica da mucosa, acima de T1b avalia-se a localização e extensão do tumor, se se tratar de tumor in situ localmente ressecáveis aconselha-se esofagectomia, caso seja N+ adiciona-se QRT neoadjuvante. No caso se localização cervical ou tumor irressecável (T4b) aconselha-se QRT. Se após o primeiro tratamento curativo se atingir margens livres, R0, não é recomendado qualquer tratamento posterior, no caso de doença residual após cirurgia, com margens R1 ou 2 a QRT deve ser utilizada para reduzir a expressão da doença.38
Em 2014 a Society of Thoracic Surgeons (STS) definiu que a QRT neoadjuvante deveria ser utilizada em todos os CPCE localmente avançados, sendo que o PET scan essencial a seguir a terapêutica neoadjuvante como modo de rastrear a existência de doença metastática.39
Recomendações no tratamento baseado no estadio do tumor:
• Estadio 0 a I: Indicado ressecção do tumor por cirurgia. Possibilidade de realizar ressecção endoscópica da mucosa.
• Estadio II: Cirurgia seguida de QRT adjuvante ou QRT neoadjuvante seguida de cirurgia. • Estadio III: Último estadio possível de ser ressecável, QRT com ou sem cirurgia.
Tratamentos Paliativos
O carcinoma do esófago é caracterizado por sintomas inespecíficos e tardios, por esse motivo 60% dos doentes apresenta doença localmente avançada ou metastizada ao diagnóstico, o que impossibilita a resseção tumoral, ficando com indicação para realizar terapêutica paliativa.41
O tratamento paliativo pretende evitar ou corrigir sintomas, como disfagia, dor e prevenir hemorragias, sendo as técnicas disponíveis as seguintes: RT (com ou sem QT), dilatação esofágica com uso de stent, terapia fotodinâmica, ablação a laser e ablação química. Normalmente é necessário utilizar mais do que uma estratégia para atingir um controlo ideal dos sintomas e dar conforto ao doente.
Em doentes com doença metastática é aconselhado iniciar quimioterapia sistémica, que nos casos de tumor sensível, irá prolongar o tempo livre de disfagia. As diferenças entre a QT e a QRT ainda não foram avaliadas.
A European Society of Gastrointestinal Endoscopy (ESGE) recomenda o uso de
self-expandable metal stent para cuidados paliativos em casos de disfagia, sendo superior às outras
terapêuticas. Em doentes em que se espera um tempo de vida mais prolongado, a braquiterapia isolada ou em conjunto com o stent são uma opção válida, podendo oferecer vantagens e melhor qualidade de vida. A combinação de stent e RT externa já não é aconselhado, pela alta
Figura 5: Shimoda T. Japanese classification of esophageal cancer, the 10th edition-Pathological part Nihon rinsho. 69 Suppl 6. 109-20. Japanese J Clin Med. 2011;69 Suppl6:109-120.
incidência de efeitos adversos, como fístulas traqueobrônquicas ou estenoses esofágicas pós-RT que leva a sintomas de disfagia de novo.22
“Novos Horizontes”
A terapêutica para o cancro do esófago continua a ser alvo de constante procura e inovação com vista a melhorar taxas de sobrevivência, principalmente a longo prazo. Os novos alvos terapêuticos a serem estudados baseiam-se nas alterações celulares características deste carcinoma, como recetores intracelulares ou de membrana, tentando assim atuar sobre o mecanismo potencialmente carcinogénico. No caso do CPCE, o epidermal growth factor
receptor (EGFR) está sobreexpressado, alterando as vias de sinalização celular e desregulando
as vias de replicação, apoptose e angiogénese, sendo que a sua sobrexpressão associada a mau prognóstico.
Assim, foram implementados ciclos terapêuticos com inibidores de EGFR juntamente com a QRT e foram já estudados o uso do Erlotinib, Cetuximab e Nimotuzumab.
Estudos com Erlotinib deram sinais promissores, comparado com a utilização isolada da QRT convencional, com aumento da taxa de sobrevivência na população chinesa estudada. Decorrem estudos em fase III para conseguir dar uma resposta definitiva sobre a utilidade deste fármaco no carcinoma do esófago. Este inibidor do EGFR apresentou alguns efeitos adversos, devido à sua afinidade com recetores também presentes na pele e intestino, que se revelaram pela presença de rash (54%), desidratação (27%), diarreia (18%) e esofagite grau 4 (9%).42,43
O Nimotuzumab também teve resultados promissores associado com QRT em altas doses, durante mais de 6 semanas, obtendo efeitos benéficos a nível de sobrevivência em doentes com CPCE em fase avançada, sem aumento de efeitos adversos.44
Por fim, o Cetuximab foi primariamente estudado para no carcinoma de cabeça e pescoço onde obteve bons resultados num estudo de fase III. Pelas semelhanças entre os dois carcinomas foi avaliado também no carcinoma do esófago, mas até agora os dados foram contraditórios e inconclusivos. Neste momento há um estudo de fase III a decorrer, RTOG 0436, que incluiu uma população mais alargada, com CPCE ou adenocarcinoma em estadio T1N1M0, T2-4, qualquer N, M0; qualquer T, qualquer N, M1a, contudo a adição doCetuximab não aumentou a sobrevivência face à QRT já utilizada, apenas conferindo um pequeno benefício, que poderia ser superior se o seu uso fosse criterioso, pelos que os autores aconselham estudo de biomarcadores preditivos de resposta antes de avançar para este tipo de terapêutica..45,46
Ideias Finais
Nesta revisão debatemos dois tipos de CPCE: um associado a países desenvolvidos, que tem sofrido um decréscimo nos últimos anos, pelas medidas antitabágicas e diminuição do consumo de bebidas alcoólicas; e outro associado zonas endémicas de CPCE, onde a exposição ao tabagismo não parece ter um papel principal, já que em muitos estudos a maioria dos doentes não eram fumadores e a prevalência de outros cancros associados ao tabaco (como bexiga, pulmão e cabeça e pescoço) também era baixa.
Contudo, mesmo excluindo o tabagismo, existe nos países de alta incidência uma elevada prevalência de inalação de fumo oriundo da combustão da madeira e carvão, utilizado para cozinhar e aquecimento, em locais fechados e com má circulação do ar. Este fumo contém, tal como o tabaco, PAH e apresenta alta capacidade mutagénica. Esta hipótese explicaria o porquê da igualdade de prevalência entre ambos os sexos nessas populações.
Existe evidência que o padrão genético tem influência no desenvolvimento do CPCE, tendo sido reportado vários casos de história familiar de CPCE. Foram identificados 16 loci de risco na população asiática, tais como os polimorfismos no ADH1B, ADH7 e ALDH2, que são conhecidos por alterarem o metabolismo do etanol, com aumento dos níveis do acetaldeído, tornando-o ainda mais tóxico, podendo ser uma das justificações para a elevada incidência de CPCE mesmo sem grande consumo de etanol. A população africana é também muito fustigada por esta neoplasia, incindindo em idades mais jovens, entre os 20-30 anos, o que parece indicar um efeito combinado de predisposição genética com exposição constante e precoce a fatores de risco. Sobre este agente ambiental mutagénico, ainda por identificar, têm-se desenvolvido diversos estudos sobre possíveis causas, como défices em micronutrientes, o baixo consumo de fruta rica em antioxidantes, o papel das nitrosaminas e dos PAHs.
O diagnóstico deste tipo de cancro é muitas vezes tardio, pois os sintomas são inespecíficos e surgem num momento avançado da doença em que apenas é possível oferecer uma opção paliativa. Sempre que possível é realizado uma terapêutica com fins curativos. Desde 2012 que é privilegiada a terapêutica trimodal, cirurgia e QRT neoadjuvante, com maior numero de casos de remissão e anos livres de doença, contudo pela ainda elevada taxa de mortalidade continua a ser um foco de estudo, tanto a nível de estratégias preventivas como inovações terapêuticas, sendo os maiores impulsionadores dos ensaios clínicos nesta área os países de alta incidência, em particular a China, enquanto que nos países em que se assiste a uma inversão da incidência do tipo histológico mais comum de carcinoma do esófago, como países europeus e EUA pode haver um desincentivo no estudo do CPCE em prol do adenocarcinoma.
Agradecimentos
Gostaria de agradecer aos meus pais, Maria Tibério e Jorge Almeida, por nunca me cortarem as asas e me deixarem perseguir este sonho, mesmo quando isso implicou abdicar de 2 ano em Ciências Farmacêuticas, viver 2 anos na Madeira e aguentarem incontáveis fases de exame.
Ao meu irmão, Miguel Almeida, por suportar o meu “mau humor” e disponibilidade para todos os favores que lhe peço.
Um especial obrigado à minha avó, Maria Manuela Almeida, que tem sido um exemplo de amizade, resiliência, bondade e dedicação.
Ao doente que foi a inspiração para este trabalho e que apesar da barreira linguística, gentilmente me facultou toda a informação necessária.
À minha tutora e professora Drª Paula Moura do Santos, pela paciência para a minha natural desorganização mental e por todos os conselhos e críticas construtivas.
Ao Tiago Tomás, Interno de Oncologia no Hospital Fernando da Fonseca, que amavelmente se prontificou a corrigir a primeira versão da minha tese de mestrado.
E por fim, aos meus amigos, os de antes e os de agora, que tornaram esta jornada tão especial e gratificante, e sem os quais seria muito mais difícil chegar até aqui.
Referências Bibliográficas:
1. Kachala R. Systematic review : epidemiology of Oesophageal Cancer in SubSaharan Africa .
Malawi Med J. 2010;22(3):65-70.
2. Jain S, Dhingra S. Pathology of esophageal cancer and Barrett’s esophagus. 2017;6(3):99-109. 3. L. Franco E, E. Rohan T. Esophagus. In: Cancer Precursors: Epidemiology, Detection and
Prevention. 1st ed. Springer; 2002:96-116.
4. Anil K. Rustgi, M.D., and Hashem B. El‑Serag, M.D. MPH. Esophageal Carcinoma. NEJM. 2014;371:2499-2509.
5. Melina Arnold, Isabelle Soerjomataram, Jacques Ferlay DF. Global incidence of oesophageal cancer by histological subtype in 2012. Gut. 2015;64:381-387.
6. Hashem El-Serag. Role of obesity in GORD-related disorders. Gut. 2008;57:281-284.
7. National Institute of Health; National institute on Alcohol Abuse and Alcoholism. Alcohol Metabolism: An Update. Alcohol Alert. 2007;72.
8. Radojicic, Jelena; Zaravinos, Apostolos; A Spandidos D. HPV, KRAS mutations, alcohol consumption and tobacco smoking effects on Sophageal squamous-cell carcinoma carcinogenesis.
Int J Biol Markers. 2012;27(1):1-12.
9. Abnet CC, Arnold M, Wei W. Epidemiology of Esophageal Squamous Cell Carcinoma.
Gastroenterology. 2018;154(2):360-373.
10. Stemmermann G, Heffelfinger SC, Noffsinger A HY, Miller MA F-PC. The molecular biology of esophageal and gastric cancer and their precursors: oncogenes, tumor suppressor genes, and growth factors. Hum Pathol. 1994;25:968-981.
11. Okello S, Churchill C, Owori R, et al. Population attributable fraction of Esophageal squamous cell carcinoma due to smoking and alcohol in Uganda. BMC Cancer. 2016;16:7-12.
12. Tran GD, Sun X, Abnet CC, et al. Prospective Study of Risk Factors for Esophageal and Gastric Cancers in the Linxian General Population Trial Cohort in China. Int J Cancer. 2005;113:456-463. 13. Emminki KH, Iang YJ. Familial and second esophageal cancers : a nation-wide epidemiologic
study from sweden. Int J Cancer. 2002;98(1):106-109.
14. Hashibe M, Mckay JD M et al. Multiple ADH genes are associated with upper aerodigestive cancers. Nat Genet. 2008;40(6):707-709.
15. Agrawal N, Jiao Y, Bettegowda C, Hutfless SM, Wang Y, David S, Cheng Y, Twaddell WS, Latt NL, Shin EJ, Wang LD, Wang L, Yang W, Velculescu VE, Vogelstein B, Papadopoulos N, Kinzler KW MS. Comparative genomic analysis of esophageal adenocarcinoma and squamous cell carcinoma. Cancer Discov. 2012;2(10):899-905.
16. Lu SH, Montesano R, Zhang MS, Feng L, Luo FJ, Chui SX, Umbenhauer D, Saffhill R RM. Relevance of N-nitrosamines to esophageal cancer in China. J Cell Physiol Suppl. 1986;4:51-58. 17. Wang L, Zhu D, Zhang C, Mao X, Wang G, Mitra S, Li BF, Wang X WM. Mutations of
O6-methylguanine-DNA methyltransferase gene in esophageal cancer tissues from Northern China. Int
J Cancer. 1997;71(5):719-723.
18. Siddiqi M, Tricker AR PR. The occurrence of preformed N-nitroso compounds in food samples from a high risk area of esophageal cancer in Kashmir, India. Cancer Lett. 1988;39(1):37-43. 19. CS Y. Research on esophageal cancer in China: a review. Cancer Res. 1980;40(8 Pt1):2633-2644.
20. Yang CS, Chen X, Tu S. Etiology and Prevention of Esophageal Cancer. Gastrointest Tumors. 2016;3(1):3-16.
21. International Agency for Research on Cancer. Monographs on the Evaluation of Carcinogenic
Risks to Hymans. Vol 100.; 2009.
22. Dumonceau J, Conio M, Ceglie A De, Skowronek J. Esophageal stenting for benign and malignant disease : European Society of Gastrointestinal Endoscopy ( ESGE ) Clinical Guideline. Endoscopy. 2016;48(10):939-948.
23. Graham DY, Schwartz JT, Cain GD GF. Prospective evaluation of biopsy number in the diagnosis of esophageal and gastric carcinoma. Gastroenterology. 1982;82(2):228-231.
24. TW R. Clinical staging of esophageal carcinoma. CT, EUS, and PET. Chest Surg Clin N Am. 2000;10(3):471-485.
25. Wallace MB, Nietert PJ, Earle C, Krasna MJ, Hawes RH, Hoffman BJ RC. An analysis of multiple staging management strategies for carcinoma of the esophagus: computed tomography, endoscopic ultrasound, positron emission tomography, and thoracoscopy/laparoscopy. Ann Thorac Surg. 2002;74(4):1026-1032.
26. Edge SB, Byrd DR, Compton CC et al (Eds). The American Join Committee on Cancer: the 7th edition of the AJCC cancer Staging manual and the future of TNM. Ann Surg Oncol. 2010;17(6):1471-1474.
27. Brugge WR, Lee MJ, Carey RW MD. Endoscopic ultrasound staging criteria for esophageal cancer.
Gastrointest Endosc. 1997;45(2):147-152.
28. Yendamuri S, Swisher SG, Correa AM, et al. Esophageal Tumor Length Is Independently Associated with Long- term Survival. Cancer. 2009;115(3):508-516.
29. O’Reilly S FA. Is surgery necessary with multimodality treatment of oesophageal cancer. Ann
Oncol. 1995;6(6):521.
30. Shapiro J, van Lanschot JJ, Hulshof MC et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial. Lancet Oncol. 2015;16(9):1090-1098.
31. Tepper J, Krasna MJ, Niedzwiecki D, et al. Alone for Esophageal Cancer : CALGB 9781. J Clin
Oncol. 2008;26(7):1086-1092.
32. Wong I, Law S. The CROSS road in neoadjuvant therapy for esophageal cancer: long-term results of CROSS trial. Div Esophageal Up Gastrointest Surgery, Dep Surgery, Univ Hong Kong, Queen
Mary Hosp Hong Kong, China. 2015;5(Suppl 3):415-419.
33. Stahl M, Stuschke M, Lehmann N, Meyer HJ, Walz MK, Seeber S, Klump B, Budach W, Teichmann R, Schmitt M, Schmitt G, Franke C WH. Chemoradiation with and without surgery in patients with locally advanced squamous cell carcinoma of the esophagus. J Clin Oncol. 2005;23(10):2310-2317.
34. Bedenne L, Michel P, BouchéO, Milan C, Mariette C, Conroy T, Pezet D, Roullet B, Seitz JF, Herr JP, Paillot B, Arveux P, Bonnetain F BC. Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol. 2007;25(10):1160-1168.
35. Schomas DA, Quevedo JF, Donahue JM, Nichols FC 3rd, Romero Y MR. The prognostic importance of pathologically involved celiac node metastases in node-positive patients with carcinoma of the distal esophagus or gastroesophageal junction: a surgical series from the Mayo Clinic. Dis Esophagus. 2010;23(3):232-239.
36. Shimizu Y1, Kato M, Yamamoto J, Nakagawa S, Tsukagoshi H, Fujita M, Hosokawa M AM. EMR combined with chemoradiotherapy: a novel treatment for superficial esophageal squamous-cell
carcinoma. Gastrointest Endosc. 2004;59(2):199-204.
37. T. Yano , M. Muto , S. Hattori , K. Minashi , M. Onozawa , K. Nihei , S. Ishikura , A. Ohtsu SY. Long-term results of salvage endoscopic mucosal resection in patients with local failure after definitive chemoradiotherapy for esophageal squamous cell carcinoma. Endoscopy. 2008;40(9):717-721.
38. Dorothy A. Shead M, Laura J. Hanisch P, Corrigan A. NCCN Clinical Practice Guidelines in
Oncology: Esophageal and Esophagogastric Junction Cancers. 1.2016.; 2016.
https://www.nccn.org/professionals/physician_gls/pdf/esophageal.pdf. Accessed November 5, 2017.
39. Little AG, Lerut AE, Harpole DH, Hofstetter WL, Mitchell JD, Altorki NK et al. The Society of Thoracic Surgeons practice guidelines on the role of multimodality treatment for cancer of the esophagus and gastroesophageal junction. Ann Thorac Surg. 2014;98:1880-1885.
40. Shimoda T. Japanese classification of esophageal cancer, the 10th edition-Pathological part Nihon rinsho. 69 Suppl 6. 109-20. Japanese J Clin Med. 2011;69 Suppl6:109-120.
41. Besharat S, Jabbari A, Semnani S, Keshtkar A, Marjani J. Inoperable esophageal cancer and outcome of palliative care. World J Gastroenterol. 2008;14(23):3725-3728.
42. Neuner G, Patel A, Suntharalingam M. Chemoradiotherapy for Esophageal Cancer. Gastrointest
Cancer Res. 2009;3(2):57-65.
43. Shi Xiu Wu, Honglei Luo, Lvhua Wang, Xuebang Zhang, Bing Xia, Congying Xie, Ming Chen CX et al. Phase III randomized study of elective nodal irradiation plus erlotinib combined with chemotherapy for esophageal squamous cell carcinoma. J Clin Oncol. 2016;34:15 supp:4048-4048. 44. Lai X1, Gu Q1, Zheng X1, Liu G2, Feng W1, Lin X1 MW. Combined nimotuzumab with chemoradiotherapy in patients with locally advanced or metastatic esophageal squamous cell carcinoma: A retrospective study. J Cancer Res Ther. 2016;12(5):89-95.
45. Digklia A, Voutsadakis IA. Targeted treatments for metastatic esophageal squamous cell cancer.
World J Gastrointest Oncol 2013. 2013;5(5):88-96.
46. Suntharalingam M, Winter K, Ilson D, et al. Effect of the Addition of Cetuximab to Paclitaxel, Cisplatin, and Radiation Therapy for Patients With Esophageal Cancer The NRG Oncology RTOG 0436 Phase 3 Randomized Clinical Trial. JAMA Oncol. 2017;3(11):1520-1528