UNIVERSIDADE FEDERAL DO CEARÁ FACULDADE DE MEDICINA
DEPARTAMENTO DE SAÚDE COMUNITÁRIA PÓS-GRADUAÇÃO EM SAÚDE PÚBLICA
DOUTORADO EM SAÚDE PÚBLICA
MARTA CRISTHIANY CUNHA PINHEIRO
ECOEPIDEMIOLOGIA DA ESQUISTOSSOMOSE MANSONI EM ÁREAS DA TRANSPOSIÇÃO DO RIO SÃO FRANCISCO NO ESTADO DO CEARÁ
MARTA CRISTHIANY CUNHA PINHEIRO
ECOEPIDEMIOLOGIA DA ESQUISTOSSOMOSE MANSONI EM ÁREAS DA TRANSPOSIÇÃO DO RIO SÃO FRANCISCO NO ESTADO DO CEARÁ
Tese apresentada ao Programa de Pós-Graduação em Saúde Pública da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Doutor em Saúde Pública. Área de concentração: Epidemiologia e Vigilância de Doenças Transmissíveis.
Orientador: Prof. Dr. Alberto Novaes Ramos Junior.
Coorientador: Prof. Dr. Fernando Schemelzer de Moraes Bezerra.
MARTA CRISTHIANY CUNHA PINHEIRO
ECOEPIDEMIOLOGIA DA ESQUISTOSSOMOSE MANSONI EM ÁREAS DA TRANSPOSIÇÃO DO RIO SÃO FRANCISCO NO ESTADO DO CEARÁ
Tese apresentada ao Programa de Pós-Graduação em Saúde Pública da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Doutor em Saúde Pública. Área de concentração: Epidemiologia e Vigilância de Doenças Transmissíveis.
Data da aprovação: ____/____/________.
BANCA EXAMINADORA
________________________________________________________ Prof. Dr. Alberto Novaes Ramos Júnior (Orientador)
Universidade Federal do Ceará (UFC)
________________________________________________________ Prof. Dr. Fernando Schemelzer de Moraes Bezerra (Coorientador)
Universidade Federal do Ceará (UFC)
________________________________________________________ Prof.ª Dra. Maria de Fátima Oliveira
Universidade Federal do Ceará (UFC)
________________________________________________________ Prof. Dr. José Mauro Peralta
Universidade Federal do Rio de Janeiro (UFRJ)
________________________________________________________ Prof. Dr. Naftale Katz
Fundação Oswaldo Cruz (FIOCRUZ)
________________________________________________________ Prof.ª Dra. Regina Helena Saramago Peralta
À Deus, toda honra e toda glória.
Aos meus pais amados Ideuzuila e Prodamy (in memorian).
À minha irmã adorada Rayanne.
Aos meus filhos amorosos Gabrielly e Prodamy Neto.
AGRADECIMENTOS
A Deus Todo Poderoso, por Sua infinita misericórdia. Tua destra é que me sustenta.
Ao Prof. Dr. Alberto, por ter aceitado ser meu orientador nesse processo de doutoramento. Agradeço por todo o apoio, incentivo e principalmente pela paciência. Obrigada por entender minhas dúvidas e limitações, pelo exemplo de pesquisador e ativista dedicado às causas sociais. Agradeço pela sensibilidade e compreensão que teve comigo nos meus piores momentos, em especial na perda de meu amado pai.
Ao Prof. Dr. Fernando, por ter me apresentado a pesquisa científica, abrindo as portas de seu laboratório. Obrigada por todo o conhecimento dividido comigo durante praticamente toda a minha vida acadêmica (boa parte da Graduação, o Mestrado – orientação e agora o Doutorado – coorientação). Agradeço principalmente por toda a confiança depositada, pelos projetos de pesquisa que me confiou à elaboração e execução.
Aos professores participantes da Banca Examinadora: Dra. Fátima, Dr. Naftale, Dr. Peralta e Dra. Regina pelo tempo que dedicaram, colaborando com valiosas sugestões, para o meu crescimento e na melhoria dessa Tese.
Aos professores do Programa de Pós-Graduação em Saúde Pública da UFC que mudaram a minha visão de mundo, mostrando que as doenças são frutos de complexos processos bio-psico-sócio-econômico. Em especial à Dra. Raquel Rigotto por seu exemplo de sensibilidade com as populações rurais vulneráveis.
À atual equipe do Laboratório de Pesquisa em Parasitologia e Biologia de Moluscos e a todos que passaram por lá. De alguma forma, nos ajudaram a construir uma história. Em especial, ao meu amigo José Damião ("Júnior") por sua valiosa ajuda, apoio, amizade e companhia nos momentos bons e ruins.
Aos meus colegas do Departamento de Análises Clínicas/FFOE/UFC pelo incentivo. Em especial ao Afrânio, Coelho e Roxyane.
AGRADECIMENTO ESPECIAL
Ao meu pai (in memorian), por ter me incentivado com toda a admiração que tinha por cada pequena conquista que eu conseguia alcançar.
À minha mãe, a quem devo absolutamente tudo, sem ela eu jamais teria tido condições de me dedicar aos estudos e a minha vida profissional.
Ao meu marido, por nunca ter me deixado desacreditar da vida e por me apoiar em tudo sempre.
Aos meus filhos, pelo amor incondicional e pela compreensão de todo o nosso tempo de convívio que precisou ser sacrificado para realização desse trabalho.
À minha irmã que sempre foi uma grande incentivadora, exemplo de garra e determinação.
A toda minha família materna e paterna pelo apoio e incentivo. Em especial aos meus avós Ataíde, Airton e Francila que olham por mim lá dos céus. E minha avó Zuleide que me cobre de carinho e me deixa a par das novidades de minha amada terra natal Umirim, todas as vezes que vou visitá-la.
“Eu sou de uma terra que o povo padece Mas não esmorece e procura vencer.
Da terra querida, que a linda cabocla De riso na boca zomba no sofrer Não nego meu sangue, não nego meu nome Olho para a fome, pergunto o que há? Eu sou brasileiro, filho do Nordeste, Sou cabra da Peste, sou do Ceará”.
RESUMO
apresentaram tendência de declínio a nível nacional no período global. O leste e sul da Região Nordeste, assim como o norte da Região Sudeste, mantiveram-se como áreas potenciais de risco de morte. Levantamento malacológico identificou Biomphalaria sp.; Drepanotrema sp.; Melanoides sp.; Physa sp.; e Pomacea sp. Todos os municípios apresentaram coleção hídrica com presença de Biomphalaria sp., sendo identificados Biomphalaria straminea e Biomphalaria kuhniana. Nenhum escolar foi positivo e a taxa geral de positividade entre os trabalhadores foi 2,88%. A esquistossomose ainda é uma causa negligenciada de mortalidade no Brasil, com diferenças regionais consideráveis. Os municípios sob influência do PISF avaliados representam áreas com potencial para transmissão da esquistossomose. O PISF pode amplificar a dinâmica de transmissão, sendo importante reforçar ações de vigilância e controle. São necessárias medidas estruturais que possam reverter determinantes sociais da doença, evitando disseminação, ocorrência de formas graves e mortes associadas.
ABSTRACT
sp., Physa sp., and Pomacea sp. All the counties presented waters collections with presence of Biomphalaria sp., being identified Biomphalaria straminea and Biomphalaria kuhniana. None scholar was positive and the general rate of positivity among the workers were 2,88%. The schistosomiasis still is a neglected mortality cause in Brazil, with considerable regional differences. The counties under PSIF influence evaluated represents areas with potential for schistosomiasis transmission. The PSIF can amplify the transmission dynamics, being important reinforce actions of vigilance and control. Structural measures that can reverse the disease's social determinants are necessary, avoiding dissemination, occurrence of severe forms and associated deaths.
LISTA DE ILUSTRAÇÕES
Figura 1 - Distribuição global dos países onde a esquistossomose humana
é transmitida, por agente etiológico ... 25 Figura 2 - Ciclo de vida de Schistosoma mansoni... 26 Figura 3 - Distribuição da esquistossomose no mundo ... 27 Figura 4 - Número estimado de indivíduos, por país, que necessitavam de
quimioterapia preventiva para esquistossomose anualmente,
2016 ... 29 Figura 5 - Número de indivíduos tratados em todo o mundo, 2016 ... 30 Figura 6 - Cobertura global de tratamento para a esquistossomose, 2016 .... 30 Figura 7 - Expansão da esquistossomose mansoni no Brasil ... 31 Figura 8 - Áreas endêmicas para Schistosoma mansoni no Brasil ... 33 Figura 9 - Distribuição dos hospedeiros intermediários de S. mansoni no
Brasil ... 34 Figura 10 - Positividade por esquistossomose mansoni no Ceará ... 36 Figura 11 - Resposta global ao controle de vetores ... 40 Figura 12 - Localização e delimitação institucional do semiárido brasileiro e
das capitais estaduais ... 48 Figura 13 - A Bacia do Rio São Francisco ... 49 Figura 14 - Eixos do Projeto de Integração do Rio São Francisco ... 51 Figura 15 - Projeto Cinturão de Águas do Ceará. Canais e Eixos de
Integração de Bacias no Ceará ... 53
ARTIGO 1
Tabela 1 - Número de mortes, coeficientes brutos e padronizados por idade de mortalidade relacionada à esquistossomose (por 100 000 habitantes) estratificada por sexo, faixa etária, raça/cor e Região de residência no Brasil, 2000-2015 ... 87 Figura 1 - Distribuição espacial dos coeficientes brutos médios anuais (não
2015 ... Figura 2 - Distribuição espacial dos coeficientes médios anuais de mortalidade suavizados pelo método Bayesiano (por 100.000 habitantes) por município de residência no Brasil, 2000-2015 ... 91 Figura 3 - Análise de agrupamento espacial e espaço-temporal de
coeficientes de mortalidade relacionada à esquistossomose (por 100.000 habitantes) por município de residência no Brasil,
2000-2015 ... 92 Figura 4 - Análise espacial e espaço-temporal de áreas quentes (Getis-Ord
Gi *) dos coeficientes de mortalidade relacionadas à esquistossomose (por 100.000 habitantes) por município de residência no Brasil, 2000-2015 ... 93
ARTIGO 2
Figura 1 - Distribuição espacial dos coeficientes médios de mortalidade relacionada à esquistossomose (por 100.000 habitantes) por
estados de residência no Brasil, 2000-2015 ... 111 Figura 2 - Tendências dos coeficientes ajustados por idade de mortalidade
relacionada à esquistossomose (por 100.000 habitantes) no
Brasil e regiões, 2000-2015 ... 112 Tabela 1 - Análise por regressão Joinpoint dos coeficientes de mortalidade
relacionada à esquistossomose no Brasil, 2000-2015 ... 113 Figura 3 - Análise de clusters espacial e espaço-temporal por varredura
espaço-tempo dos coeficientes de mortalidade relacionada à esquistossomose (por 100.000 habitantes) por município de
residência no Brasil, 2000-2015 ... 115 Tabela 2 - Clusters espaço-temporais significantes de mortes relacionadas à
esquistossomose, definidas utilizando estatísticas de varredura
ARTIGO 3
Tabela 1 - Número de escolares elegíveis e examinados das escolas selecionadas para participar do estudo, por zona e municípios da
área diretamente afetada pelo PISF no Estado do Ceará ... 136 Tabela 2 - Dados socioeconômicos e de contato com águas naturais dos
escolares participantes do estudo, por municípios da área
diretamente afetada pelo PISF no Estado do Ceará ... 137 Tabela 3 - Resultados das análises físico-químicas das coleções hídricas
estudadas e presença de Biomphalaria sp., por coleção hídrica de cada município pesquisado na área diretamente afetada pelo
PISF no Estado do Ceará ... 139 Figura 1 - Distribuição espacial das escolas trabalhadas e das coleções
hídricas onde foram investigadas a presença de Biomphalaria sp.
nos seis municípios pesquisados ... 141
ARTIGO 4
Tabela 1 - Moluscos de água doce (Classe Gastropoda – Cuvier, 1795) distribuídos por município, na área diretamente afetada pela Transposição do Rio São Francisco, Estado do Ceará, Brasil,
coletados de fevereiro de 2015 a outubro de 2016 ... 159 Tabela 2 - Características ecológicas das coleções hídricas pesquisadas na
área de influência do Projeto de Transposição do Rio São Francisco no estado do Ceará – Brasil ... 161 Figura 1 - Biomphalaria sp. em coleções hídricas nas áreas de influência do
Projeto de Integração do Rio São Francisco no estado do Ceará -
Brasil ... 164 Figura 2 - Gel de poliacrilamida corado com prata a 6% mostrando os perfis
de restrição, após digestão da região ITS do DNA ribossômico com DdeI, dos caramujos de referência e dos caramujos
ARTIGO 5
Figura 1 - Circuito do projeto de transposição do rio São Francisco – Eixo Norte, com ênfase no Estado do Ceará e no município de Brejo
Santo ... 177 Figura 2 - Positividade para esquistossomose mansoni em trabalhadores
dos canteiros de obra do Projeto de Integração do Rio São Francisco no município de Brejo Santo – Ceará, de acordo com técnicas de Kato-Katz (uma, duas e três lâminas) e teste
POC-CCA ... 182 Tabela 1 - Comparação entre os métodos Kato-Katz e POC-CCA na
LISTA DE ABREVIATURAS E SIGLAS
AAPC Average Annual Percent Change (Variação Percentual Média Anual)
ACS Agentes Comunitários de Saúde
ADA Área Diretamente Afetada
AID Área de Influência Direta
AII Área de Influência Indireta
APC Annual percent change (Variação Percentual Anual)
APHA American Public Health Association (Associação Americana de Saúde Pública)
AWWA American Water Works Association (Associação Americana de Trabalhadores da Água)
CAA Circulating Anodic Antigen (Antígeno Anódico Circulante)
CAC Projeto Cinturão de Águas do Ceará
CCA Circulating Cathodic Antigen (Antígeno Catódico Circulante)
CDC Centers for Disease Control and Prevention (Centros de Controle e Prevenção de Doenças)
CID Código Internacional de Doenças
COPROM Coordenação de Promoção e Proteção à Saúde
CPqAM Centro de Pesquisa Aggeu Magalhães
DALY Disability-Adjusted Life Year (Anos de Vida Ajustados por Incapacidade)
DATASUS Departamento de Informática do SUS
DNA Deoxyribonucleic Acid (Ácido Desoxirribonucleico)
DO Declaração de Óbito
DTN Doenças Tropicais Negligenciadas
EA Eixão das Águas
FE Farmácia Escola
FIOCRUZ Fundação Oswaldo Cruz
FUNASA Fundação Nacional de Saúde
GBD Global Burden of Disease (Carga Global da Doença)
GPS Global Positioning System (Sistema De Posicionamento Global)
HIV Human Immunodeficiency Virus (Vírus da Imunodeficiência Adquirida)
kM Kilometro
IBAMA Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis
IBGE Instituto Brasileiro de Geografia e Estatística
IC Intervalo de Confiança
IDHM Índice de Desenvolvimento Humano Municipal
IEC/MC Informação, Educação, Comunicação e Mobilização Comunitária
IMF Fundo Monetário Internacional
INCRA Instituto Nacional de Colonização e Reforma Agrária
INPEG Inquérito Nacional de Prevalência da Esquistossomose e Geo-helmintoses
ITS Internal Transcribed Spacer (região espaçadora transcrita interna)
LACEN Laboratório Central de Saúde Pública
LPBM Laboratório de Parasitologia e Biologia de Moluscos
mM Milímetro
MS Ministério da Saúde
MW Megawatt
OMS Organização Mundial de Saúde
ONGs Organizações Não-Governamentais
OPG Ovos por Grama de Fezes
PAC Programa de Aceleração do Crescimento
PCDEN Programa de Controle de Doenças Endêmicas
PCE Programa de Controle da Esquistossomose
PCR Polymerase Chain Reaction (Reação em Cadeia da Polimerase)
PECE Programa Especial de Controle da Esquistossomose
PIB Produto Interno Bruto
PISF Projeto de Integração do Rio São Francisco
PNAD Pesquisa Nacional por Amostra de Domicílios
PNUD Programa das Nações Unidas para o Desenvolvimento
POC-CCA Point-of-care CCA (Ponto de cuidado CCA)
PSF Programa e Saúde da Família
RFLP Restriction Fragment Length Polymorphism (Polimorfismono Comprimento do Fragmento de Restrição)
RIMA Relatório de Impacto Ambiental
RMF Região Metropolitana de Fortaleza
SCORE Schistosomiasis Consortium for Operational Research and Evaluation (Consórcio de esquistossomose para pesquisa e avaliação
operacional)
SESA-CE Secretaria de Saúde do Estado do Ceará
SIH Sistema de Informações Hospitalares
SIM Sistema de Informações sobre Mortalidade
SINAN Sistema de Informação de Agravos de Notificação
SISPCE Sistema de Informação do Programa de Vigilância e Controle da Esquistossomose
SNIS Sistema Nacional de Informações sobre Saneamento
SRH Secretaria dos Recursos Hídricos
SUCAM Superintendência de Campanhas de Saúde Pública
SUS Sistema Único de Saúde
TCLE Termo de Consentimento Livre e Esclarecido
TSD Sólidos Totais Dissolvidos
UF Unidade da Federação
UFC Universidade Federal do Ceará
UTM Universal Transversa de Mercator
VPRs Vilas Produtivas Rurais
WEF Water Environment Federation (Federação do Ambiente Aquático)
WHO World Health Organization (Organização Mundial de Saúde)
YLLs Years of Life Lost (Anos de Vida Perdidos)
SUMÁRIO
1 APRESENTAÇÃO ... 22
2 INTRODUÇÃO ... 24
2.1 Aspectos Gerais ... 24
2.1.1 Schistosoma mansoni ... 25
2.2 Epidemiologia da esquistossomose no mundo ... 28
2.3 Situação epidemiológica da esquistossomose no Brasil ... 31
2.4 Situação epidemiológica da esquistossomose no Ceará ... 35
2.5 Estratégias globais de prevenção e controle da esquistossomose 37 2.6 Programa de Controle da Esquistossomose no Brasil ... 40
2.7 Ações de controle da esquistossomose no Ceará ... 43
2.8 Projeto de Integração do Rio São Francisco (PISF) ... 47
3 JUSTIFICATIVA ... 55
4 OBJETIVOS ... 59
4.1 Objetivo geral ... 59
4.2 Objetivos específicos ... 59
5 MATERIAL E MÉTODOS ... 60
5.1 Eixos 1 e 2 ... 60
5.1.1 Desenho do estudo ... 60
5.1.2 Área do estudo – Brasil ...... 60
5.1.3 Base de dados do estudo .... 61
5.1.4 Fontes de dados ... 61
5.1.5 Processamento e Análise dos dados – Eixo 1 .... 62
5.1.6 Processamento e Análise dos dados – Eixo 2 ... 64
5.1.7 Aspectos éticos ... 66
5.2 Eixo 3 ... 66
5.2.1 Desenho do estudo ... 66
5.2.2 Área do estudo ... 66
5.2.4 Análises físico-químicas da água ... 68 5.2.5 Análises microbiológicas da água ... 68 5.2.6 Processamento dos dados ... 69
5.3 Eixo 4 ... 69 5.3.1 Desenho do estudo ... 69 5.3.2 Área do estudo ... 69 5.3.3 Coleta das amostras de caramujos ... 70 5.3.4 Classificação morfológica ... 70 5.3.5 Identificação molecular ... 71 5.3.6 Pesquisa de cercárias de Schistosoma mansoni ... 72 5.3.7 Análises estatísticas e processamento dos dados geoespaciais .... 72
5.4 Eixo 5 ... 73 5.4.1 Desenho do estudo ... 73 5.4.2 Área do estudo ... 73 5.4.3 Populações de estudo ... 75 5.4.4 Coleta e Processamento de amostras biológicas em campo ... 75 5.4.5 Procedimentos laboratoriais ... 75 5.4.6 Tratamento parasitológico ... 76 5.4.7 Análises estatísticas ... 76
5.5 Aspectos éticos - Eixos 3, 4 e 5 ... 77
6 RESULTADOS ... 78
6.1 Eixo 1: Padrões epidemiológicos e tendências temporais de
mortalidade relacionadas à esquistossomose no Brasil ... 78 6.1.1 Artigo 1: Esquistossomose no Brasil: padrões epidemiológicos
de mortalidade, 2000-2015 ... 78
6.2 Eixo 2: Padrões de presença e distribuição de aglomerados espaço-temporais de elevado risco para mortalidade relacionada
à esquistossomose no Brasil ... 103 6.2.1 Artigo 2: Esquistossomose no Brasil: uma análise de dezesseis
anos das tendências de mortalidade e padrões espaciais... 103
6.3 Eixo 3: Fatores físico-químicos e microbiológicos das coleções hídricas de importância epidemiológica em áreas de influência do
6.3.1 Artigo 3: Fatores condicionantes relacionados à
esquistossomose em área diretamente afetada pelo projeto de transposição de água em grande escala do Rio São Francisco no
Nordeste do Brasil ... 125
6.4 Eixo 4: Caracterização da fauna malacológica límnica das coleções hídricas de importância epidemiológica em áreas de influência do PISF no Ceará e os padrões espaciais de sua distribuição ... 150 6.4.1 Artigo 4: Biomphalaria sp. e outros caramujos de água doce em
áreas diretamente afetadas pelo projeto de transposição de água
em grande escala do Rio São Francisco no Nordeste do Brasil ... 150
6.5 Eixo 5: Schistosoma mansoni em populações sentinelas das
áreas de influência do PISF no Ceará ... 172 6.5.1 Artigo 5: Detecção de esquistossomose em uma área diretamente
afetada pelo projeto de transposição de água em grande escala
do rio São Francisco no Nordeste do Brasil ... 172
7 CONSIDERAÇÕES FINAIS ... 193
REFERÊNCIAS ... 196
APÊNDICE A – PRODUÇÕES TÉCNICO-CIENTÍFICAS AO LONGO
DO DOUTORAMENTO ... 213
APÊNDICE B – PARTICIPAÇÃO EM PROJETOS DE PESQUISA E EM EVENTOS CIENTÍFICOS AO LONGO DO DOUTORAMENTO ... 216
ANEXO A – PARECER E APROVAÇÃO DO COMITÉ DE ÉTICA EM
PESQUISA DE EMENDA AO PROJETO ORIGINAL ... 218
ANEXO B – PARECER E APROVAÇÃO DO COMITÉ DE ÉTICA EM
PESQUISA DO PROJETO ORIGINAL ... 219
ANEXO C – TERMO DE CONSENTIMENTO LIVRE E
ESCLARE-CIDO (TCLE) – ESCOLARES ... 220
ANEXO D – TERMO DE CONSENTIMENTO LIVRE E
ESCLARE-CIDO (TCLE) – TRABALHADORES ... 222
1 APRESENTAÇÃO
A presente tese de doutorado teve como objeto de estudo a esquistossomose no Estado do Ceará, em cenários de transposição do Rio São Francisco, quer seja como Bacias Receptoras ou como Bacias de Transferência. As principais áreas endêmicas no Brasil com transmissão registrada se sobrepõem às áreas que serão impactadas. A esquistossomose representa uma doença parasitária de veiculação hídrica com elevada carga de morbimortalidade, com estreita relação com condições de pobreza e de insalubridade do ambiente, bem como com aspectos organizacionais dos sistemas de saúde. Apesar dos avanços tecnológicos alcançados nos últimos anos, com diretrizes internacionais constantemente atualizadas, e das agendas internacionais reiterando a relevância de seu controle, a esquistossomose segue mantendo o caráter de doença endêmica negligenciada.
A partir do referencial da epidemiologia crítica no Campo da Saúde Coletiva, procurou-se integrar diferentes perspectivas epidemiológicas e operacionais de controle da esquistossomose em áreas no Estado do Ceará que serão diretamente afetadas por esse grande empreendimento hídrico. Diferentes técnicas analíticas foram utilizadas para avaliar a mortalidade relacionada à esquistossomose dentro da perspectiva espaço & tempo, no contexto amplo e desigual do território nacional. A proposta foi partir de um olhar global no País para um olhar mais acurado voltado para o Estado do Ceará. Após esta perspectiva mais ampliada, o recorte geográfico no estado teve como objetivo analisar fatores ambientais envolvidos na transmissão em áreas afetadas pelas obras do Projeto de Integração do Rio São Francisco (PISF) com as Bacias Hidrográficas do Nordeste Setentrional, de forma a estabelecer parâmetros com vistas a acompanhar possíveis modificações, de forma comparativa.
ocorrência da esquistossomose nas áreas que serão impactadas pelo PISF (no estado do Ceará).
2 INTRODUÇÃO
2.1 Aspectos gerais
A esquistossomose (CID 10: B65) é uma doença infecciosa, adquirida por meio do contato com água doce contaminada por cercárias (forma larval) de um parasito multicelular, pertencente à classe Trematoda, família Schistomatidae, e gênero Schistosoma. Estes vermes apresentam como características principais serem delgados de coloração leitosa, digenéticos (organismos que completam seu ciclo evolutivo passando pelo menos por dois hospedeiros), dioicos (animais de sexos separados), com nítido dimorfismo sexual, onde a fêmea adulta é mais alongada e encontra-se alojada em uma fenda do corpo do macho – denominada de canal ginecóforo (BRASIL, 2014a).
Segundo a Organização Mundial de Saúde (WHO, 2016) as principais espécies envolvidas na transmissão dessa doença aos seres humanos no mundo são: Schistosoma haematobium – agente etiológico da esquistossomose urogenital, comum na África, Oriente Médio e Córsega (França); Schistosoma mansoni – agente etiológico da esquistossomose intestinal, característico das Américas (Caribe, Brasil, Venezuela e Suriname), presente também na África e Oriente Médio; Schistosoma japonicum – agente etiológico da esquistossomose intestinal, encontrado na Ásia (principalmente na China, Indonésia e Filipinas); Schistosoma mekongi – agente etiológico da esquistossomose intestinal, encontrado no Sudeste Asiático (vários distritos do Camboja e da República Democrática Popular do Laos); e Schistosoma guineensis e Schistosoma intercalatum – agentes etiológicos da esquistossomose intestinal, encontrados em áreas da floresta tropical na África Central.
Além destes vermes relacionados a seres humanos, outras espécies de Schistosoma parasitam, principalmente, outros mamíferos e pássaros, causando geralmente apenas dermatite cercariana na população humana (CDC, 2012).
Figura 1 – Distribuição global dos países onde a esquistossomose humana é transmitida, por agente etiológico.
Fonte: GRYSEELS et al. (2006).
Nota: Adaptado de DOUMENGE & MOTT (1984).
2.1.1 Schistosoma mansoni
De todas as espécies de Schistosoma que parasitam o homem, apenas S. mansoni está presente nas Américas. Desenvolve-se em estádios no hospedeiro intermediário (moluscos do gênero Biomphalaria) e no hospedeiro definitivo (homem), conforme ilustrado na Figura 2.
cercárias perdem suas caudas bifurcadas e rapidamente transformam-se em esquistossômulos, que migram pela circulação sanguínea até pontos diversos do organismo, sendo o fígado o órgão preferencial. Neste local as formas jovens dão início a organogênese e o sistema reprodutor se diferencia da grande maioria dos demais trematódeos digenéticos, ocorrendo a formação do canal ginecóforo. Após o completo amadurecimento sexual, acasalam e migram pela veia porta até o plexo mesentérico. Nos ramos terminais das vênulas da submucosa intestinal ocorre a postura dos ovos que, progressivamente, movimentam-se em direção ao lúmen do intestino grosso (através dos vasos e paredes deste órgão), sendo excretados juntamente com as fezes do hospedeiro. Essa migração provoca microhemorragias e áreas de inflamação que juntas são responsáveis pelo aparecimento de diarreia muco-sanguinolenta e outros distúrbios gastrointestinais (COLLEY, 2014).
Figura 2 – Ciclo de vida de Schistosoma mansoni.
Fonte: Adaptado de dpd.cdc.gov.
semanas após a infecção e, sem tratamento, podem manter-se por um período de seis a dez anos, normalmente. Entretanto, já foram relatados casos em que indivíduos com mais de vinte anos de infecção ainda estavam eliminando ovos viáveis (BRASIL, 2014b).
A esquistossomose mansoni é classificada em duas fases: aguda e crônica. As formas agudas podem ser assintomáticas ou sintomáticas. Inicialmente, pode passar despercebida (maioria das pessoas) ou ser confundida com outras doenças parasitárias na fase aguda. A doença pode ser sugerida apenas por alterações encontradas nos exames laboratoriais de rotina como eosinofilia, em hemograma, e presença de ovos de S. mansoni em exames coproscópicos (SOUSA et al., 2011). A fase crônica é menos frequentemente diagnosticada, manifestando-se geralmente com hepatoesplenomegalia e outros sinais de hipertensão portal (ANDRADE & BINA, 1985).
A dermatite cercariana corresponde à fase de penetração das larvas (cercarias) através da pele. Esta lesão caracteriza-se por micropápulas eritematosas e pruriginosas, semelhantes a picadas de inseto e eczema de contato, com duração de até cinco dias após a infecção. Após 3 a 7 semanas de exposição, a resposta imune à doença é basicamente via atividade T-helper do tipo 1 (Th1), podendo ocorrer a síndrome toxêmica que possui sinais e sintomas característicos dessa fase, porém inespecíficos como: astenia, febre, dor abdominal difusa, diarreia, calafrios, mialgia, tosse seca e, com menor frequência, dispneia, edema, elevação de enzimas hepáticas, insuficiência respiratória e pericardite (RIBEIRO DE JESUS et al., 2004). Estas duas últimas alterações estão associadas à presença de complexos imunes circulantes, sugerindo que esses sintomas podem ser causados pela deposição de complexos imunes nos tecidos. Em residentes de áreas endêmicas geralmente não há manifestações clínicas nessa fase, sendo estes sintomas mais comumente apresentados por indivíduos de áreas não endêmicas que por ventura entrem em contato com coleções hídricas naturais contaminadas, principalmente os viajantes de turismo ecológico (PRATA, 1991; CLERINX & VAN GOMPEL, 2011).
imunopatológicas, principalmente a reação granulomatosa periovular, induzem um processo inflamatório contínuo que leva a manifestações como doença intestinal obstrutiva, inflamação hepatoesplênica e fibrose hepática, que caracterizam a fase crônica da doença (ANDRADE & PEIXOTO, 1992). A hipertensão portal leva ao hiperesplenismo e a citopenias, principalmente trombocitopenia e neutropenia (ROSS et al., 2002).
Essa parasitose causa síndromes clínicas sistêmicas não específicas, mas incapacitantes, incluindo anemia, desnutrição e prejuízos ao desenvolvimento infantil, ao metabolismo do ferro, à aptidão física e à função cognitiva (BUSTINDUY et al., 2011). Ademais, podem ocorrer quadros clínicos inesperados devido à deposição ectópica dos ovos ou migração dos parasitos para o Sistema Nervoso Central, com sintomas de compressão espinhal ou encefalopatia (FERRARI et al., 1993; ROSS et al., 2002).
O padrão de morbidade da doença, representado principalmente pelas formas mais graves, está associado à intensidade e duração da infecção e à resposta imune do hospedeiro aos antígenos do parasito, entre outros fatores (COELHO et al., 1996; SANTOS, SOUZA & ANDRADE, 2000). A carga parasitária, por sua vez, é influenciada pelo grau de contato com a água, reflexo das condições socioeconômicas e culturais da população (COURA, CONCEICAO & PEREIRA, 1984; PRATA, 1991).
2.2 Epidemiologia da esquistossomose no mundo
A transmissão da esquistossomose é resultado da interação de fatores ambientais, climáticos, biológicos, demográficos, econômicos, sociais, culturais e políticos. As mudanças ecológicas resultantes de alterações nos recursos hídricos e/ou os movimentos populacionais também são importantes determinantes da epidemiologia da esquistossomose (BRUUN & AAGAARD-HANSEN, 2008).
Figura 3 – Distribuição da esquistossomose no mundo.
Fonte: WHO (2012).
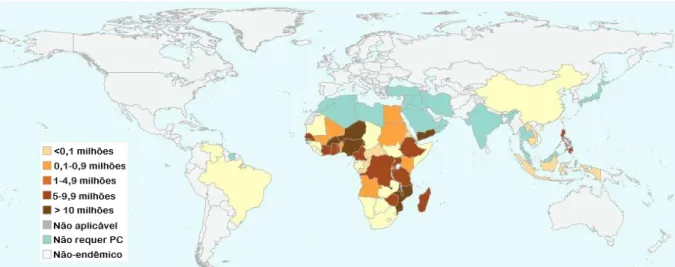
Segundo dados da Organização Mundial de Saúde (WHO, 2017a), em 2015, aproximadamente 218,8 milhões de pessoas necessitavam de tratamento para a esquistossomose, em 52 países, dos quais mais de 118,5 milhões eram crianças em idade escolar (5-14 anos). Foi estabelecida a meta de tratar pelo menos 75% dessas crianças, em todos os países endêmicos, até 2020. O número de pessoas que receberam quimioterapia preventiva foi de mais de 66,5 milhões (28,2% de cobertura global), sendo mais de 53 milhões de crianças em idade escolar (42,2% da meta específica) (Figuras 4, 5 e 6).
Figura 4 – Número estimado de indivíduos, por país, que necessitavam de quimioterapia preventiva para esquistossomose anualmente, 2016.
Figura 5 – Número de indivíduos tratados em todo o mundo, 2016.
Fonte: Adaptado de WHO (2017a).
Figura 6 – Cobertura global de tratamento para a esquistossomose, 2016.
Fonte: Adaptado de WHO (2017a).
2.3 Situação epidemiológica da esquistossomose no Brasil
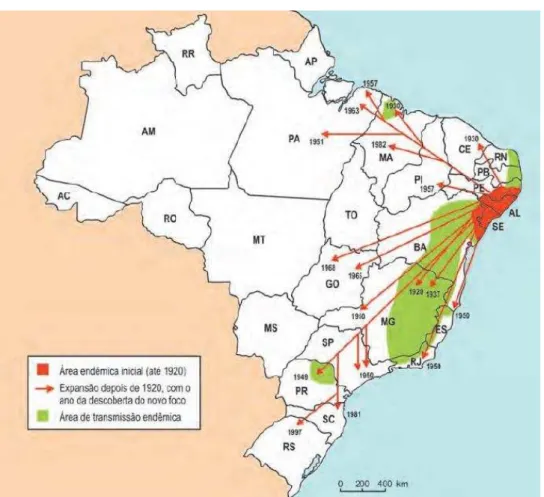
A entrada da esquistossomose no Brasil deu-se principalmente por meio do tráfico de escravos, trazidos da costa ocidental da África, e que estavam doentes. Os africanos, muitos com esquistossomose, chegaram principalmente pelos portos das cidades de Recife e Salvador para trabalhar nas lavouras de cana de açúcar do Nordeste brasileiro (restrito inicialmente às áreas mais litorâneas), posteriormente seguiram fluxos migratórios internos que ocorreram por conta de novos ciclos econômicos (ciclo do ouro e pedras preciosas; ciclo da criação de gado; ciclo da borracha e industrialização), conforme evidenciado na Figura 7 (BRASIL, 2014b).
Figura 7 – Expansão da esquistossomose mansoni no Brasil.
Fonte: BRASIL, 2014b.
Nota: Adaptado por Heloisa M. N. Diniz do mapa original publicado em BRASIL, 1998.
podem propiciar novos e amplos habitats para os moluscos hospedeiros, favorecendo, além disso, o contato estreito e frequente da população humana com a água contaminada, o que culmina com a disseminação da doença (BRASIL, 2008).
O Brasil é o responsável em grande parte pelas elevadas taxas de detecção de Doenças Tropicais Negligenciadas (DTN) verificadas na América Latina e abriga a maior parte dos casos de esquistossomose: esquistossomose (96%), leishmaniose visceral (93%), hanseníase (86%), dengue (40%), leishmaniose cutânea (39%) e doença de Chagas (25%), dentre outras (HOTEZ e FUJIWARA, 2014).
Dados do Inquérito Nacional de Prevalência da Esquistossomose e Geo-helmintoses (INPEG), promovido pelo Ministério da Saúde (MS), entre 2011 e 2014, estimou em cerca de 1,5 milhões de pessoas infectadas por S. mansoni no Brasil. Os estados com os maiores índices de positividade geral foram Sergipe (8,1%), Minas Gerais (3,8%), Alagoas (2,3%), Bahia (2,1%), Pernambuco (2,1%) e Rio de Janeiro (1,6%) (KATZ et al., 2014). Nos últimos anos casos novos da doença continuam sendo registrados em todas as regiões do Brasil, principalmente em 18 estados da federação e no Distrito Federal. Conforme mostra a Figura 8, as principais áreas endêmicas situam-se nos estados de Alagoas, Bahia, Espírito Santo, Minas Gerais e Pernambuco, enquanto as principais áreas focais ainda se localizam no Ceará, Distrito Federal, Maranhão, Pará, Rio Grande do Norte, Rio de Janeiro e São Paulo (BRASIL, 2014b).
Figura 8 – Áreas endêmicas para Schistosoma mansoni no Brasil.
Fonte: SCHOLTE et al., 2014.
Segundo dados do Departamento de Informática do SUS (Sistema Único de Saúde) – DATASUS, no ano de 2015, foram realizados 709.169 exames para diagnóstico da esquistossomose em todo o território nacional, por meio do Programa de Controle da Esquistossomose (PCE). Foram identificados 22.434 infectados, representando uma positividade de 3,2%. Foram notificados 12.815 casos de esquistossomose, detectados em áreas não endêmicas no Sistema de Informação de Agravos de Notificação (SINAN) – esses dados incluem a notificação de formas graves em áreas endêmicas. A taxa de internações hospitalares relacionadas à esquistossomose a partir do Sistema de Informações Hospitalares (SIH) foi de 0,10 internações por 100.000 habitantes, com redução de 78% quando comparado aos dados de 2006. A taxa bruta de mortalidade relacionada à esquistossomose pelo Sistema de Informação de Mortalidade (SIM) foi de 0,22 óbitos por 100.000 habitantes, correspondendo a 459 óbitos nesse referido ano (DATASUS, 2016).
preventivos foram realizados no país correspondendo a uma cobertura nacional de 0,2% e, destes, 3.643 eram crianças em idade escolar (WHO, 2016).
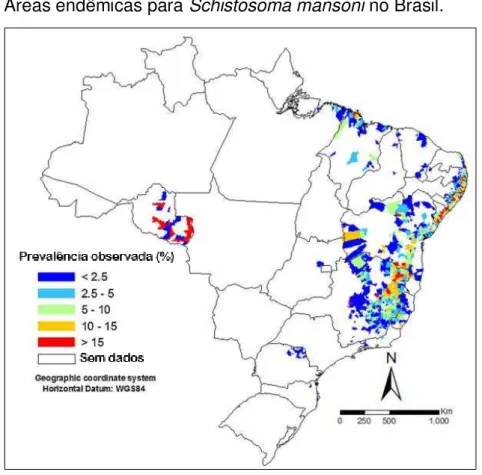
No Brasil existem dez espécies e uma subespécie do gênero Biomphalaria: B. amazônica (Paraense, 1976), B. glabrata (Say, 1818), B. intermedia (Paraense & Deslandes, 1962), B. kuhniana (Clessin, 1883), B. occidentalis (Paraense, 1981), B. oligoza (Paraense, 1974), B. peregrina (Orbigny, 1835), B. schrammi (Crosse, 1864), B. straminea (Dunker 1848), B. tenagophila (Orbigny, 1835) e B. tenagophila guaibensis (Paraense, 1984). Contudo, somente três destas espécies são infectadas naturalmente por S. mansoni: B. glabrata, B. tenagophila e B. straminea. Além disso, B. amazônica, B. peregrina e B. cousini são consideradas potenciais hospedeiras, pois infectam-se experimentalmente pelo parasita (BRASIL, 2008).
Figura 9 – Distribuição dos hospedeiros intermediários de S. mansoni no Brasil.
Fonte: Adaptado de BRASIL, 2014b.
esquistossomose no estado de São Paulo e pelos focos da doença no estado de Santa Catarina (BRASIL, 2008).
2.4 Situação epidemiológica da esquistossomose no Ceará
Os principais marcos históricos da esquistossomose no Ceará (ALMEIDA, 1999; ALENCAR, ROUQUAYROL & BEZERRA, 1978) foram:
Primeiro relato de casos positivos (2,8%) entre os 141 marinheiros cearenses estudados por Maciel em 1925 e 1936;
Davis (1934) relatou a presença de S. mansoni em amostras de fígado colhidas para diagnóstico de febre amarela; tendo encontrado uma positividade de 5,20% para Juazeiro, 2,25 % para Baturité e 0,22% para Fortaleza;
Evandro Chagas foi o primeiro pesquisadoe a realizar levantamento de casos dessa doença no município do Crato (sul do estado), em 1938;
Alencar (1940 e 1947) foi o pioneiro no Ceará na realização de diagnóstico por exame parasitológico de fezes, com 12,2% de positividade para o município de Redenção e 11,7% para Pacoti;
Pará (1946) identificou 0,48% de viscerectomias com presença de S. mansoni, provenientes dos municípios de Aracoiaba, Barbalha, Baturité, Juazeiro do Norte, Maranguape, Pacoti e Redenção;
Durante o primeiro inquérito helmintológico escolar do Brasil, coordenado por Pellon e Teixeira, entre 1947 a 1950, os exames no Ceará foram realizados no ano de 1948. A positividade geral para o estado foi de aproximadamente 1%, com casos detectados em 19 municípios, sendo três na região litorânea, cinco na região das serras, três no Vale do Cariri, um no Sertão do Cariri, um no Vale do Jaguaribe, dois no Baixo Jaguaribe, um no Médio Jaguaribe e três no Sertão;
Freitas (1972), a partir de revisão das informações existentes no Brasil, estimou que a doença afetava 27 municípios, dos quais cinco (Juazeiro do Norte, Pacatuba, Pacoti, Quixadá e Redenção) apresentavam taxas superiores a 4%.
Alencar (1940 e 1947), examinando-se moluscos em Redenção e Pacoti, encontrou-se índice de positividade de 17,9% e 14,7% respectivamente. Porém, outros pesquisadores encontraram índices bem mais baixos de positividade, como 0,25% e 0,08% apresentados por Bezerra, nas mesmas localidades (1955).
Segundo dados do Sistema de Informação do Programa de Vigilância e Controle da Esquistossomose – SISPCE, a taxa global de positividade para a doença no estado do Ceará foi de 0,75% em 2015. Foram realizados 15.727 exames nesse ano, em 18 municípios, onde apenas nove apresentaram casos positivos, com taxas mais elevadas em Jati (10,40%), Mauriti (8,87%) e Maranguape (2,25%). Conforme demonstra a Figura 10, as principais áreas endêmicas do estado para esse agravo são: Região do Cariri, Maciço de Baturité e Serra da Ibiapaba (SESA-CE, 2016).
Figura 10 – Positividade por esquistossomose mansoni no Ceará.
Fonte: SESA-CE, 2015
em 90% (441/448) das amostras analisadas e 68% dos casos identificados eram do sexo masculino (332/448). De 1996 a 2016, o estado registrou 100 óbitos onde a esquistossomose foi relatada como causa básica de morte, distribuídos em 45 municípios (CEARÁ, 2016).
A Secretaria de Saúde do estado, em colaboração estreita com o grupo de pesquisa do Laboratório de Parasitologia e Biologia de Moluscos (LPBM) da Universidade Federal do Ceará (UFC), vêm detectando casos de esquistossomose entre os trabalhadores dos canteiros de obras da transposição do Rio São Francisco nos municípios de Brejo Santo (9,1% - 45/352); Mauriti (5,5% – 23/416) e Penaforte (1,21% – 3/247) desde o ano de 2010 (CEARÁ, 2016).
Todos os 184 municípios do estado apresentam B. straminea, sendo esta a espécie responsável por manter o ciclo de transmissão local da esquistossomose. Foram encontrados exemplares liberando cercárias de S. mansoni nos municípios de Aurora, Baturité, Brejo Santo, Jaguaretama, Mauriti, Missão Velha e Orós. Outros hospedeiros intermediários do gênero foram detectados, como B. scharammi crosse em Aracati e Baturité; e B. kuhniana em Baturité e Icó. Entretanto, estes não são infectados naturalmente pelo parasito e nem atuam na manutenção do ciclo dessa parasitose (CEARÁ, 2016). Gomes e colaboradores (2011) relataram o encontro de dois exemplares de B. glabrata no município de Aurora, em área próxima a uma criação comercial de peixes. Porém, nenhum exemplar dessa espécie foi encontrado durante amplo inquérito malacológico límnico realizado nesse município por pesquisadores do LPBM/UFC, onde foram avaliadas 19 coleções hídricas nos meses de outubro/2011, março/2012 e agosto/2012 (SOUSA et al., 2013).
2.5 Estratégias globais de prevenção e controle da esquistossomose
infecção. Uma das principais recomendações da OMS era de que entre 5% e 10% do orçamento do programa de controle fosse reservado para monitoramento e avaliação, principalmente do indicador da cobertura de tratamento (WHO, 2001). No período de 2006 a 2010 o número de pessoas tratadas para a esquistossomose quase triplicou, porém representava apenas 13% dos que necessitavam de quimioterapia preventiva. Com base nessa experiência positiva de alguns países, a OMS estabeleceu como meta o controle progressivo da doença, visando a eliminação da mesma como problema de saúde pública e até a interrupção da sua transmissão (WHO, 2013).
A frequência de tratamento é determinada pela prevalência de infecção em crianças em idade escolar. Mesmo que a reinfecção possa ocorrer após o tratamento, o risco de desenvolver doença grave é diminuído e mesmo revertido quando o tratamento é iniciado e repetido na infância. Assim, em áreas de alta transmissão, o tratamento deve ser repetido todos os anos por vários anos. Segundo diretrizes da OMS, os grupos-alvo para o tratamento são (WHO, 2016):
- crianças em idade escolar de áreas endêmicas;
- adultos considerados sob risco em áreas endêmicas e pessoas com ocupações envolvendo contato com água contaminada, como pescadores, agricultores, trabalhadores de áreas irrigadas e mulheres cujas tarefas domésticas as colocam em contato com água contaminada;
- comunidades inteiras que vivem em áreas altamente endêmicas.
Vários países endêmicos possuem limitações que precisam ser superadas para alcançar o controle a partir da eliminação da esquistossomose (WHO, 2013). Os principais fatores identificados foram:
- compromisso político – destinar recursos financeiros adequados ao programa e melhorar o acesso ao tratamento;
- coordenação do programa – melhorar a coordenação nos países e implementar a coordenação internacional;
- comunicação – mostrar a importância da esquistossomose como problema de saúde pública e sensibilizar os gestores e as comunidades afetadas;
- monitoramento e avaliação – definir e utilizar indicadores e relatórios padronizados; melhorar os métodos de monitoramento e avaliação;
- orientação operacional – quanto a ferramentas de diagnóstico adequado; controle de caramujos e gestão da água; além de atenção à grupos com maior vulnerabilidade como crianças em idade escolar, pessoas infectadas por HIV, pacientes com hematúria.
Dados da OMS já demonstraram que esforços contínuos possibilitam controle de morbidade a partir do tratamento em massa das populações sob risco em nível nacional. Porém, a eliminação é um desafio muito maior, mais demorado e que requer uma complexa combinação de fatores, além do tratamento em massa (controle de caramujos, água, saneamento, mudança de comportamento, etc). O principal desafio na atualidade é identificar quais combinações são mais efetivas para o mínimo de dinheiro disponibilizado pelos governos e em um curto espaço de tempo.
Frente a isso, surge o programa chamado Consórcio de esquistossomose para pesquisa operacional e avaliação (SCORE - Schistosomiasis Consortium for Operational Research and Evaluation), financiado pela Fundação Bill e Melinda Gates. Esse consórcio é formado por mais de 55 pesquisadores que realizam projetos em 19 países, com a participação de 26 instituições diferentes. O objetivo principal é desenvolver pesquisas operacionais que norteiem quais as melhores estratégias de controle devem ser adotadas para o efetivo controle e eliminação da esquistossomose causada por S. mansoni e S. haematobium (COLLEY, 2014).
Figura 11 – Resposta global ao controle de vetores.
OBJETIVOS MARCOS ALVOS
2020 2025 2030
Reduzir a mortalidade por doenças transmitidas por vetores globalmente em
relação a 2016 Pelo menos 30% Pelo menos 50% Pelo menos 75%
Reduzir a incidência de casos por doenças transmitidas por vetores
globalmente em relação a 2016 Pelo menos 25% Pelo menos 40% Pelo menos 60%
Prevenir epidemias de doenças transmitidas por vetores *
Em todos os países sem transmissão em
2016
Em todos os países
* Rápida detecção e redução de surtos para evitar propagação além do país. Fonte: Adaptado de WHO, 2017c.
2.6 Programa de Controle da Esquistossomose no Brasil
esquistossomose tiveram uma redução de 50%: de 0,65 para 0,30 óbitos por 100.000 habitantes, no período de 1977 a 1993; enquanto as internações hospitalares foram de 3 internações por 10.000 em 1989 para 1,5 por 10.000 em 1995 (KATZ, 1998).
Na década de 1990 muitas mudanças aconteceram, e esse programa foi incluído nas atividades do Programa de Controle de Doenças Endêmicas (PCDEN) em 1989, a SUCAM foi incorporada à FUNASA em 1991 e em 1999 ocorreu oficialmente a descentralização das ações de controle e vigilância da esquistossomose, por meio de convênios com os municípios, inicialmente aumentando a área de cobertura do programa. Além das medidas de controle que priorizavam o tratamento e as atividades malacológicas, ainda em 1993 foram iniciadas obras de saneamento básico nas áreas com prevalência acima de 30% (COURA e AMARAL, 2004).
O PCE iniciou sua informatização em 1994 a partir da implementação do Sistema de Informação do Programa de Vigilância e Controle da Esquistossomose – SISPCE, implantado em julho de 1995, primeiramente em Minas Gerais e nos anos seguintes foi expandido para os demais estados. Esse sistema era de responsabilidade da FUNASA, por intermédio dos Distritos Sanitários e Coordenações Regionais, e posteriormente passou a ser operacionalizado e gerenciado pelas Secretarias de Saúde de Estados e Municípios. Os formulários de campo anteriormente utilizados foram adequados ao novo sistema, permitindo o registro de informações operacionais relativas a inquéritos coproscópicos, epidemiológicos e de malacologia (FARIAS et al., 2007).
Em 1996, estimou-se que ainda poderiam existir 7,4 milhões de pessoas com a doença no Brasil (KATZ e PEIXOTO, 2000), sendo a perspectiva de controle da doença ainda um imenso desafio, pois não foram alcançados os objetivos de redução da prevalência a níveis inferiores a 25% (em algumas áreas focais); supressão das formas graves da doença; eliminação das áreas focais e prevenção da expansão para áreas vulneráveis indenes (AMARAL, 2006).
municipais. Apesar da mudança de modelo, os objetivos do programa não foram alcançados por insuficiência de recursos financeiros e humanos (BRASIL, 2014b).
Após os grandes inquéritos realizados até a década de 1970 apenas trabalhos isolados se seguiram, dificultando a estimativa do número de pessoas infectadas a nível nacional e o estabelecimento de novas diretrizes técnicas de controle principalmente por conta da diversidade geográfica, social, econômica e cultural do país. Em 2003, Katz e Almeida realizaram uma análise crítica do possível número de portadores da esquistossomose e apontaram a necessidade da realização de um inquérito nacional, a fim de mostrar a real situação da doença no Brasil. Destaca-se a importância de um dimensionamento correto do tamanho amostral, visando adequada representatividade das populações de todos os estados do país, visto que a doença não apresenta distribuição regular no território, mas sim de expressão focal (KATZ e PEIXOTO, 2000). Em 2010, o governo aprovou o Inquérito Nacional de Prevalência da Esquistossomose e Geo-helmintoses (INPEG), por sugestão de especialistas, cujo principal objetivo era conhecer a prevalência da esquistossomose, ascaridíase, tricuríase e ancilostomíase em crianças, em idade escolar, no âmbito do território nacional.
A esquistossomose passou a ser doença de notificação compulsória nas áreas não endêmicas em 2014, conforme a Portaria de número 1.271, da Secretaria de Vigilância em Saúde, do Ministério da Saúde, porém recomendava-se que todas as formas graves, em área endêmica, fossem notificadas. Deveriam ser notificados também todos os casos de esquistossomose diagnosticados nas áreas indenes e vulneráveis, bem como nas áreas focais dos estados do Pará, Piauí, Rio de Janeiro, São Paulo, Paraná, Santa Catarina, Goiás, Rio Grande do Sul e Distrito Federal. Os casos notificados deveriam ser investigados a partir da ficha específica de investigação de caso de esquistossomose, disponibilizada pelo Sistema de Informação de Agravos de Notificação – SINAN (BRASIL, 2014b).
para a eliminação da transmissão de forma duradoura e sustentável. Portanto, é de extrema importância a integração de suas atividades à Rede de Atenção Básica à Saúde e a implantação de medidas complementares como educação em saúde, saneamento ambiental e controle de hospedeiros intermediários, com melhorias reais das condições de vida da população (ROLLEMBERG et al., 2015).
A ineficiência do PCE nos moldes atuais, mesmo após décadas de sua implantação, foi muito bem explicada por Katz, ainda em 1986, onde afirmava que essa abordagem puramente médica no controle da doença estava fadada ao insucesso, pois a esquistossomose não pode ser entendida como um fenômeno individual, mas como um fenômeno complexo, que ocorre dentro de contextos sociais, políticos, econômicos e sanitários (CARDIM, 2011).
2.7 Ações de controle da esquistossomose no Ceará
Rio Jaguaribe, expandindo-se para os municípios de Barbalha, Crato, Juazeiro do Norte e Missão Velha (PONTES et al., 1999).
As ações do PECE foram divididas em três etapas: Fase Preparatória (delineamento das áreas endêmicas – reconhecimento geográfico, levantamento malacológico, levantamento coproscópico, realização de obras de saneamento básico e educação sanitária), Fase de Ataque (tratamento em massa da população de acordo com os índices de prevalência encontrados, tratamento com moluscicidas das coleções hídricas de importância epidemiológica, acompanhamento de medidas de melhorias sanitárias e educação sanitária) e Fase de Vigilância (levantamentos coproscópico periódicos, tratamentos e retratamentos das populações selecionadas, controle de caramujos nas coleções hídricas de importância epidemiológica, conservação das obras de melhoria sanitária e manutenção das atividades de educação sanitária) (PONTES et al., 1999).
No Ceará a Fase Preparatória foi realizada entre 1977 a 1979 integralmente nas Regiões Hidrográficas I e II, a Região Hidrográficas III tendo sido trabalhada parcialmente (70%) e apenas os municípios de Itapiúna e Mulungu foram considerados não endêmicos. Na Fase de Ataque, os municípios da Região Hidrográficas III não foram operacionalizados por insuficiência do número de servidores nessa área. Em todas as áreas positivas, independente dos níveis de prevalência, foi realizado o tratamento universal da população de 1 a 70 anos, por opção da coordenação estadual do programa, sob alegação da existência de medicamentos em quantidade suficiente. O controle da fauna planorbídea foi efetuada com a aplicação de Bayluscid® nas coleções hídricas de importância
biológica. A Fase de Vigilância iniciou-se a partir de 1980, onde as reavaliações coproscópicas foram realizadas a cada semestre até 1982, nas áreas trabalhadas anteriormente e a partir de 1983 a periodicidade passou a ser anual. No entanto, os municípios de Aracoiaba e Baturité permaneceram com avaliações semestrais até 1984 por manutenção de altos índices da doença (PONTES et al., 1999).
responsáveis pela execução dessas atividades referiram que continuaram adotando basicamente as diretrizes do PECE. Em 1989, os municípios foram categorizados em área endêmica (26 municípios) e área com potencial endêmico (16 municípios), com periodicidade de trabalho bienal e anual, respectivamente. Entre 1989 e 1994, na Região Hidrográfica I foram trabalhados 70% (1.818/2.597) das localidades endêmicas, examinando-se em média 65% da população residente, com 21% (379/1.805) dessas localidades apresentando casos da doença. Na Região Hidrográfica IV trabalhou-se 87% (1.142/1.313) das localidades, examinando 53% da população residente e encontrando 39% das localidades positivas. Foi trabalhada também a Bacia Hidrográfica do Rio Parnaíba, na Região da Serra de Ibiapaba, onde foram trabalhas 62% das localidades, com 27% delas positivas (PONTES, 1996).
No período de 1997 a 2011, a taxa de positividade era de 0,82% (12.665 portadores de S. mansoni em 1.041.880 exames coproscópico realizados). Atualmente o PCE atua em 71 municípios de áreas endêmicas, localizadas em três regiões do estado do Ceará: Cariri, Maciço de Baturité e Serra da Ibiapaba (SESA-CE, 2011).
No Ceará, após a descentralização das ações do programa de controle, a realização de lâminas para diagnóstico da esquistossomose passou a ser de responsabilidade dos técnicos das secretárias estaduais e municipais de saúde, com apoio de servidores da FUNASA. Porém, grande parte do pessoal da Fundação sofreu desvio de função, ao ser cedida para prefeituras municipais, situação que foi agravada com o passar dos anos quando muitos destes profissionais se aposentaram. Este fato comprometeu de forma significativa a execução das ações de vigilância, em especial o diagnóstico parasitológico, onde o número de exames passou de 100.000 anuais para 40.000. Como forma de compensação a Coordenação de Promoção e Proteção à Saúde – COPROM, responsável pelo PCE no estado, firmou parceria com o Laboratório Central de Saúde Pública – LACEN, desenvolvendo uma rede de diagnóstico com apoio de farmacêuticos-bioquímicos do LACEN central e regional. O controle de qualidade desses exames tem sido atualmente realizado pelo serviço de referência do Centro de Pesquisa Aggeu Magalhães – CPqAM (SESA-CE, 2015).
que apresentam casos suspeitos e fatores ambientais (coleções hídricas, insuficiência de saneamento básico e presença do hospedeiro), mas que contribuem fortemente para transmissão e dispersão de casos. Tal medida de vigilância tem proporcionado a descoberta de novos focos potencialmente endêmicos no estado em áreas que não eram trabalhadas pelo programa, a exemplo dos municípios de Aquiraz (5 casos, no ano de 2013), Itapipoca (21 casos, no ano de 2014) e Martinópole (12 casos, no ano de 2010) (SESA-CE, 2017).
Em parceria com o Grupo de Pesquisa em Esquistossomose da UFC, algumas áreas foram trabalhadas em termos de ampliação das ferramentas diagnósticas e de ações de educação em saúde. No período de 2007 a 2008 foi desenvolvido projeto de pesquisa na localidade de Caititú de Cima, em Pacoti, onde foram oferecidos a população exame coproscópico (técnica de Kato-Katz) e sorológicos (ELISA IgG), com positividade de, respectivamente, 3,8% e 33,8%. Foi realizado ainda o método de Lutz, detectando 65,2% de positividade para outros parasitos intestinais (FROTA et al., 2011). No período de 2009 a 2010 foi desenvolvido projeto de pesquisa na localidade de Planalto do Cajueiro, em Maranguape, com realização de diagnóstico para esquistossomose por ELISA-IgG (47,2% reativos), Kato-Katz (8,8% – com leitura de três lâminas e 1,3% – com leitura de uma lâmina, segundo rotina do PCE), Gradiente salínico (18,0%), Helmintex (47,1%), PCR (37,5%) (PINHEIRO, 2010; PINHEIRO et al., 2012; CARNEIRO et al., 2013). Entre 2010 a 2011, nessa mesma área, foram desenvolvidos ainda projetos de pesquisa envolvendo a presença de marcador de dano à função renal causada por esquistossomose (HANEMANN et al., 2013) e avaliação de resposta alérgica entre portadores desse agravo (OLIVEIRA et al., 2014). Na localidade de Bananeiras, em Capistrano no ano de 2013, foi desenvolvido o primeiro estudo no Brasil utilizando as novas ferramentas de diagnóstico da esquistossomose por detecção de antígenos circulantes (CCA e CAA), com positividade respectivamente de 6,2% e 34,4% (desconsiderando os resultados irresolutos), em contraste com 1,6%de positivos encontrados pelo método de Kato-Katz (SOUSA, 2015).
iniciam-se as atividades de diagnóstico da esquistossomoiniciam-se e ações de educação em saúde nas áreas a serem diretamente afetadas pelo PISF com risco para esquistossomose no Ceará, estudo esses que deram origem à presente Tese de Doutorado.
2.8 Projeto de Integração do Rio São Francisco (PISF)
A crise hídrica tem despontado cada vez mais como uma problemática agravada por um contexto adverso de natureza social, econômica e ambiental no século XXI (TUNDISI, 2008). Diante disso, nas últimas décadas, a construção de represas tem sido uma alternativa na gestão e na utilização das águas, de forma a possibilitar o desenvolvimento econômico e social de muitos países. Porém, essas intensas ações antrópicas com transformações das paisagens naturais, vêm ocasionando mudanças de diferentes naturezas no solo, na água, na atmosfera, na biodiversidade e na população humana, contribuindo para o desenvolvimento e a disseminação de diversas endemias (TUBAKI et al., 2004; TUNDISI, 2008). Além disto, têm suscitado grandes debates sobre o acesso às águas, em virtude dos conflitos gerados por priorização a objetivos relativos ao “desenvolvimento econômico” em detrimento das populações locais, tradução de desenvolvimento humano e social (BACCI& PATACA, 2008).
No Brasil, este movimento também tem sido observado. A crescente demanda de energia, associada à grande disponibilidade de recursos hídricos favoráveis, estimularam a construção de barragens e hidrelétricas nas últimas décadas (BRONZATTI; IAROZINSKI NETO, 2008). Já a Região Nordeste do país possui outro grande agravante que reforça ainda mais a necessidade de um amplo número de reservatórios: a seca. Essa região tem 1,56 km² (18,2% do território nacional), com mais de 47 milhões de habitantes (quase 28% da população brasileira). O semiárido nordestino (Figura 12) caracteriza-se por ser uma região que possui apenas 3% da disponibilidade de água do país, com precipitações médias anuais muito irregulares (200 a 700mm por ano), o que provoca grande irregularidade na distribuição desse recurso natural (BRASIL, 2006). Essa característica causa uma forte dependência da intervenção do homem sobre a natureza no sentido de garantir o armazenamento de água para abastecimento humano e demais usos produtivos (BUAINAIN e GARCIA, 2013).
Figura 12 – Localização e delimitação institucional do semiárido brasileiro e das capitais estaduais.
Fonte: Adaptado de BUAINAIN & GARCIA, 2013.
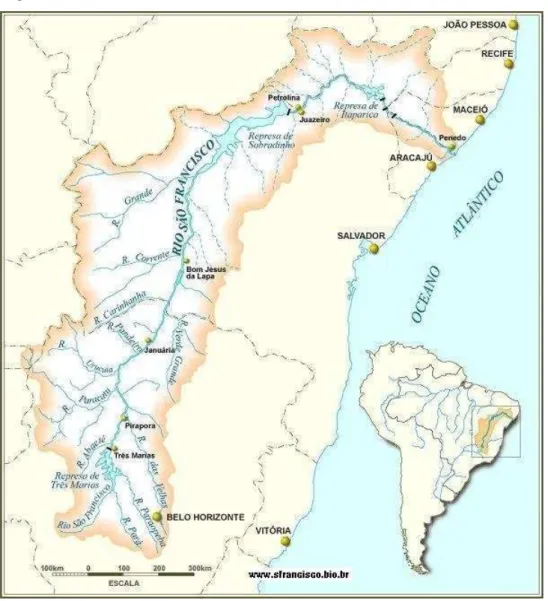
Alagoas e Sergipe (Figura13). Outros rios permanentes são encontrados no Maranhão, no Piauí e na Bahia, com destaque para o Rio Parnaíba. Os rios de regime temporário são encontrados na porção nordestina que se estende desde o Ceará até a região setentrional da Bahia. Entre esses, destaca-se o Jaguaribe, no Ceará, pela sua extensão e potencial de aproveitamento, pois em sua bacia hidrográfica encontram-se alguns dos maiores reservatórios do Nordeste, como o Açude Castanhão e o Açude Orós (CIRILO et al., 2003).
Figura 13 – A Bacia do Rio São Francisco.
Fonte: Plano Nascente São Francisco (Brasil, 2016a).
tecnológicos suficientes para isso. A ideia vai sendo melhor elaborada e discutida durante diversos governos (Getúlio Vargas, João Batista Figueiredo, Itamar Franco e Fernando Henrique Cardoso), até que no primeiro mandato do Presidente Lula são finalizados estudos e relatórios de impactos ambientas (CAMELO FILHO, 2007). Sobre fortes protestos de Organizações Não Governamentais (ONGs), de alguns políticos e até mesmo da Igreja Católica, o Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA) aprova o projeto que posteriormente ficaria conhecido como “Projeto de Integração do Rio São Francisco com as Bacias Hidrográficas do Nordeste Setentrional” (AVEIRO, 2014; RUFINO, 2013; CAPPIO, 2008; MOREIRA, 2007), que a partir deste ponto será identificado nesse texto apenas como PISF.
O PISF é um empreendimento do Governo Federal, sob a responsabilidade do Ministério da Integração Nacional, dividido em dois eixos: o Eixo Norte que levará água para os sertões de Pernambuco, Ceará, Paraíba e Rio Grande do Norte; e o Eixo Leste que beneficiará parte do sertão e das regiões agrestes de Pernambuco e da Paraíba (Figura14). O objetivo principal é solucionar a deficiência hídrica dessa região até 2025 por meio da transferência de aproximadamente 1,4% de água da vazão média do Rio São Francisco por canais para abastecer açudes e perenizar rios menores. Dessa forma, o acesso à água seria garantido a cerca de 12 milhões de habitantes em mais de 390 municípios, entre pequenas, médias e grandes cidades do Nordeste Setentrional (BRASIL, 2005).
Figura 14 – Eixos do Projeto de Integração do Rio São Francisco.
Fonte: Editoria de Arte/Folhapress, 2017.
Dentre as ações socioambientais, incluiu-se a previsão de construção de 18 Vilas Produtivas Rurais (VPRs) que se destinam ao reassentamento de moradores que viviam na área de implantação das estruturas do PISF. Sendo constituídas por um setor residencial e um setor produtivo, conta com redes de abastecimento de água, rede de esgoto e energia elétrica, posto de saúde, escola, estrutura de lazer (campo de futebol e praça) e áreas destinadas ao comércio e à construção de espaços religiosos. Cada família recebe um setor produtivo, com no mínimo cinco hectares, sendo um (1) hectare destinado à irrigação. Essa política de compensação prevê contemplar 848 famílias nos quatros estados abrangidos pela obra, 16 já foram concluídas e restam duas a serem entregues no Ceará (BRASIL, 2014c). A despeito destas ações, o impacto gerado nas pessoas, suas famílias e comunidades destes territórios em virtude destas obras e/ou de sua remoção deve ser considerado (BRASIL, 2004a).