Universidade de Trás-os-Montes e Alto Douro
Comparação do doseamento da Tirotropina e da Tiroxina Livre
por dois métodos laboratoriais (CMIA e ECLIA)
Dissertação de Mestrado em Biologia Clínica Laboratorial
Marta Isabel do Souto Teixeira
Orientador: Dr.ª Joana Mesquita
Coorientador: Professora Dr.
aRita Payan Carreira
II
Universidade de Trás-os-Montes e Alto Douro
Comparação do doseamento da Tirotropina e da Tiroxina Livre
por dois métodos laboratoriais (CMIA e ECLIA)
Dissertação de Mestrado em Biologia Clínica Laboratorial
Marta Isabel do Souto Teixeira
Orientador Científico: Dr.ª Joana Mesquita
Endocrinologista, Centro Hospitalar de Trás-os-Montes e Alto Douro, CHTMAD
Coorientador Científico:
Professora Dr.a Rita Payan Carreira
Universidade de Trás-os-Montes e Alto Douro, UTAD
III
DECLARAÇÃO DE AUTOR
Dissertação de Mestrado em Biologia Clínica Laboratorial, submetida à Universidade de Trás-os-Montes e Alto Douro, para o cumprimento dos requisitos necessários à obtenção de grau de Mestre em Biologia Clínica Laboratorial, elaborado sob a orientação da Dr.ª Joana Mesquita e da Professora Dr.ª Rita Payan Carreira.
IV
DEDICATÓRIA
Aos meus pais, que através de muito esforço e sacrifício, permitiram chegar a este momento tornando-me na pessoa que sou hoje.
V
AGRADECIMENTOS
Esta Dissertação marca o final de uma etapa da minha vida, pela qual lutei com muito esforço e dedicação. Agradeço a todos os que me apoiaram e acreditaram em mim, nomeadamente: À Dr.ª Joana Mesquita, minha Orientadora, que me honrou de forma contínua com a partilha dos seus vastos conhecimentos científicos, agradeço pela revisão cuidadosa desta Dissertação, e o tempo que generosamente me dedicou com paciência, lucidez e confiança, por isso, estou- -lhe muito grata.
À Professora Dr.ª Rita Payan, Coorientadora Institucional, pela generosa disponibilidade que mostrou em me aceitar como sua orientanda. Pela ajuda e incentivo sempre presentes na realização desta dissertação.
Ao Dr. Carlos Caldas, Técnico Superior no serviço de Imunologia do CHTMAD, Orientador no laboratório, agradeço a ajuda dispensada na elaboração do meu trabalho, a disponibilidade no acompanhamento deste, assim como as críticas, correções e sugestões relevantes feitas durante a orientação. Agradeço também pelo companheirismo ao longo deste ano.
Ao Professor Doutor Jorge Colaço, docente na Universidade de Trás-os-Montes e Alto Douro, pela disponibilidade imediata para apoiar a realização do tratamento estatístico de dados.
Ao Dr. José António Carvalho, Diretor do Serviço de Patologia Clínica do CHTMAD, pelo acolhimento e colaboração na realização desta dissertação.
À Dra. Carla Simões, Técnica Superior no serviço de Imunologia do CHTMAD, pela
disponibilidade na iniciação do trabalho laboratorial, pelo acolhimento e pela amizade.
À Ilda Clara, minha amiga, pela orientação, incentivo e ajuda para conseguir concretizar a realização desta dissertação.
Ao Engenheiro José Estrela, representante da casa comercial Abbott, pela sua rápida disponibilidade em me facultar os reagentes para a realização do meu trabalho experimental.
À Professora Dr.ª Maria dos Anjos Pires, docente na Universidade de Trás-os-Montes e Alto Douro, pela sua disponibilidade, ajuda e aconselhamento sempre manifestados.
VI
À Professora Ana Sampaio, diretora do Mestrado de Biologia Clinica Laboratorial, pelo apoio manifestado.
À “Mikas”, minha melhor amiga, pelo carinho, pela amizade, pela companhia ao longo destes anos, pela sinceridade e por todo o incentivo e ajuda que me dedicou ao longo deste difícil percurso.
Aos meus pais e irmão, pelo incentivo recebido ao longo destes anos, e por toda a força que me deram para a realização do mestrado e por todos os conselhos que me valeram para atingir os meus objetivos.
A todos os meus amigos que me acompanharam neste percurso académico, os meus agradecimentos.
VII
RESUMO
A glândula tiróide produz as hormonas tiroxina (T4) e triiodotironina (T3) sob estimulação pela
hormona tirotropina (TSH). Existem situações de disfunção tiroideia (hipotiroidismo e hipertiroidismo) cujo diagnóstico e monitorização dependem dos exames laboratoriais efetuados, além da avaliação clínica.
O objetivo deste estudo foi proceder ao doseamento das hormonas TSH e T4 livre (FT4) em 111
doentes com patologia tiroideia já diagnosticada, utilizando dois equipamentos com metodologias semelhantes (Abbott ARCHITECT® i2000 - Quimioluminescência e Roche
Cobas® 6000 – Eletroquimioluminescência) baseadas respetivamente, em reações químicas e
reações elétricas, ambas geradoras de luminescência. Obteve-se concordância para as duas metodologias no doseamento da hormona TSH e inexistência de concordância para o doseamento de FT4.
Palavras-Chave: tirotropina; tiroxina livre; quimioluminescência e eletroquimioluminescência.
VIII
ABSTRACT
Thyroid gland produces thyroxine (T4) and triiodothyronine (T3) hormones upon stimulation
by thyrotropin (TSH) hormone. There are situations of thyroid dysfunction (hypothyroidism and hyperthyroidism) which diagnosis and monitoring rely on laboratory tests performed beyond clinic evaluation.
The objective of this study was to proceed to the measurement of TSH and free T4 (FT4)
hormones in 111 patients with thyroid disease already diagnosed, using two equipments with similar methodologies (Abbott ARCHITECT® i2000 - Chemiluminescence and Roche Cobas® 6000 - Electrochemiluminescence) based respectively, in chemical reactions and electrical reactions, both giving rise to luminescence. It was obtained agreement for the two methodologies in the determination of TSH hormone and no agreement for the determination of FT4.
IX
ÍNDICE GERAL
I – INTRODUÇÃO ... 15 II - REVISÃO DA LITERATURA ... 16 1. Sistema Endócrino ... 16 1.1. Glândulas Endócrinas ... 16 1.2. Glândula Tiróide ... 161.3. Ação das Hormonas Tiróideias ... 17
1.4. Tiroxina Livre (FT4) ... 18
2. Patologias da Tiróide ... 18
3. Diagnóstico das patologias tiroideias ... 19
4. Tratamento das patologias tiroideias ... 20
5. Metodologias laboratoriais para determinação de hormonas da tiróide ... 20
II – OBJETIVOS ... 24
III - METODOLOGIA ... 25
1. Caraterização e obtenção da amostra para o estudo... 25
2. Algorítmo de diagnóstico ... 25
4. Procedimento Laboratorial no Equipamento ARCHITECT® i2000 ... 26
4.1. Princípio biológico do procedimento ... 26
4.2. Manuseamento dos reagentes ... 27
4.3. Calibrações e controlos ... 28
4.4. Conservação e armazenamento de amostras ... 28
4.5. Apresentação dos resultados do equipamento ... 29
5. Procedimento laboratorial no equipamento COBAS® 6000... 29
5.1. Princípio biológico do procedimento ... 29
5.2. Manuseamento dos reagentes ... 30
5.3. Calibração e Controlos... 31
5.4. Conservação e armazenamento de amostras ... 31
5.5. Apresentação dos resultados do equipamento ... 31
6. Metodologia Estatística ... 31
IV – RESULTADOS ... 33
1. Caracterização do grupo de estudo ... 33
2. Análise estatística dos resultados dos doseamentos de TSH e FT4 ... 33
X
2.2. Análise dos resultados dos valores de FT4 nos dois equipamentos ... 34
V – DISCUSSÃO ... 36
VI - CONCLUSÃO ... 40
XI
ÍNDICE DE FIGURAS
Figura 1:Esquema representativo das patologias da tiróide, com os resultados laboratoriais esperados. Fonte: Adaptado de (7)
. --- 26
Figura 2: Apresentação do Gráfico I correspondente ao método de Bland-Altman e do Gráfico II correspondente ao diagrama de dispersão da concordância de Kendall. Ambos mostram as diferenças entre as medições do doseamento da TSH, pelos métodos CMIA-Abbott e ECLIA-Roche. --- 34
Figura 3: Apresentação do Gráfico III correspondente ao método de Bland-Altman e do Gráfico IV correspondente ao diagrama de dispersão da concordância de Kendall, ambos mostram as diferenças entre as medições do doseamento da FT4, pelos métodos
XII
ÍNDICE DE QUADROS
Quadro 1: Composição das rackpacks de reagentes utilizados para o doseamento das hormonas TSH e FT4 no equipamento ARCHITECT® i2000. --- 27
Quadro 2: Composição das rackpacks de reagentes utilizados para o doseamento das hormonas TSH e FT4 no equipamento Cobas® 6000. --- 30
Quadro 3: Armazenamento e estabilidade das rackpacks de reagentes utilizados para o doseamento das hormonas TSH e FT4 no equipamento Cobas® 6000 --- 30
XIII
ABREVIATURAS E SIGLAS
AMPc Monofosfato Cíclico de Adenosina APTO [Anticorpo] Anti-peroxidase da Tiróide ATg [Anticorpo] Anti-tiroglobulina
ATPases Adenilpirofosfatase
Ca2+ Cálcio
CHTMAD Centro Hospitalar de Trás-os-Montes e Alto Douro CLIA Imunoensaio Quimioluminescente
CMIA Imunoensaio de Micropartículas por Quimioluminescência CQI Controlo de Qualidade Interno
DIT Diiodotirosina
dL Decilitro
E.P.E. Entidade Pública Empresarial
ECLIA Imunoensaio de Micropartículas por Eletroquimioluminescência ELISA Ensaios Imunoenzimáticos
ESS Euthyroid Sick Syndrome ou Síndrome do Doente Eutiróideu
et al e outros
FT3 Triiodotironina Livre
FT4 Tetraiodotironina ou Tiroxina Livre
IgG Imunoglobulina G
IRMA Ensaios Imunoradiométricos
L Litro
MEIA Imunoensaio Enzimático de Micropartículas MIT Monoiodotirosina
mU Unidade de Medida
NaCl Cloreto de Sódio
ng Nanograma(s)
ºC Graus Celcius
p Valor de significância pH Potêncial de Hidrogénio r.p.m. Rotações por Minuto RIA Radioimunoensaios
XIV
RLUs Unidades Relativas de Luz
Ru Ruténio
SD Desvio Padrão
T3 Triiodotironina total
T3r Triiodotironina reversa
T4 Tetraiodotironina ou Tiroxina Total
Tampão MES Ácido (2-[N-Morfolino] etanosulfônico) Tampão TRIS Tris-hidroximetilaminometano
TBA Thyroxine Binding Prealbumin
TBG Thyroxine Binding Globulin
TRAb [Anticorpo] Anti-recetor da Hormona Estimuladora da Tiróide TRH Hormona Libertadora de Tirotropina
TSH Tirotropina
UTAD Universidade de Trás-os-Montes e Alto douro W Coeficiente de concordância de Kendall
α Alfa
β Beta
μg Micrograma(s)
15
I – INTRODUÇÃO
A glândula tiróide tem como principal função produzir as hormonas Tiroxina (T4),
Triiodotironina (T3) e Calcitonina. A T4 e a T3 estimulam diversas funções do organismo e o
metabolismo, sendo que a sua secreção depende da hormona Tirotropina (TSH) (1). Para que haja uma produção adequada de hormonas é necessário um desenvolvimento, funcionamento e regulação normais da glândula tiróide e um normal aporte de Iodo, principal constituinte das hormonas tiroideias (2)(3). As disfunções da tiróide estão relacionadas com um funcionamento anormal da glândula, que pode produzir hormonas em excesso ou defeito dando origem a situações de hipertiroidismo ou hipotiroidismo, respetivamente (4).
Apesar da suspeita clínica de patologia da tiróide, o diagnóstico só é conclusivo após serem efetuados testes laboratoriais que também são importantes para a monitorização da patologia e respetiva terapêutica (5) (6) (7).
O objetivo do trabalho realizado foi proceder ao doseamento das hormonas TSH e Tiroxina Livre (FT4) em 111 pacientes da consulta de Endocrinologia, do Centro Hospitalar de
Trás-os-Montes e Alto Douro E.P.E. (CHTMAD), com patologia tiroideia já diagnosticada. Para tal recorreu-se a reagentes de duas casas comerciais, Abbott e Roche. Os doseamentos hormonais foram realizados no Serviço de Patologia Clínica, setor de Imunologia do CHTMAD, utilizando metodologias semelhantes, Quimioluminescência e Eletroquimioluminescência. Estas metodologias fundamentam-se em imunoensaios para a determinação quantitativa in vitro da TSH e FT4 em soro humano e baseiam-se em processos de reações químicas e reações elétricas,
respetivamente, que geram luminescência.
16 II - REVISÃO DA LITERATURA
1. Sistema Endócrino
O sistema endócrino tem como função coordenar e integrar a atividade das células do organismo sendo fundamental na manutenção da homeostasia durante toda a vida (8).
É constituído por um conjunto de glândulas que libertam as suas secreções hormonais na corrente sanguínea para posteriormente interagirem com os recetores específicos a nível das células alvo (9) (10).
Os órgãos endócrinos estão distribuídos por todo o corpo e a integração da produção de hormonas pelos mesmos é regulada pelo hipotálamo (1).
1.1. Glândulas Endócrinas
Entre as glândulas endócrinas refere-se a hipófise, as paratiróides, as supra-renais, os ilhéus pancreáticos, as gónadas (ovários na mulher e testículos no homem) e, claro, a tiróide (11). As hormonas produzidas nas glândulas endócrinas durante o seu percurso na corrente sanguínea até aos recetores nas células-alvo têm de ser transportadas, variando o mecanismo de transporte, de acordo com as suas caraterísticas químicas (10). As hormonas esteróides necessitam de ser transportadas por glicoproteínas específicas, tais como a globulina transportadora de tiroxina, a globulina transportadora das hormonas sexuais, a globulina transportadora de corticoesteróides, bem como a albumina. Estes complexos hormona-proteínas de transporte servem de reservatórios, asseguram uma distribuição hormonal ubiquitária e protegem as pequenas moléculas da sua degradação. À medida que há necessidade de uma hormona ativa, esta liberta-se do seu transportador, atuando no seu recetor como a fração hormonal livre (12).
As concentrações hormonais são influenciadas pelos estímulos a que o organismo está exposto e são regidas por mecanismos complexos de retrorregulação. Quando as hormonais já saturaram os órgãos-alvo e provocaram a ação desejada, produz-se um retrocontrolo a nível do hipotálamo/hipófise que diminui/inibe a sua secreção (1).
1.2. Glândula Tiróide
17
A glândula tiróide é constituida por dois lobos situados no pescoço, a nível pré-traqueal, ligados por uma camada fina de tecido denominada de ístmo, que lhe confere o formato de uma “borboleta” (1). Pode ainda ocorrer a formação de um terceiro lobo, denominado lobo piramidal,
que se prolonga acima do ístmo (5).
Os lobos são constituídos por estruturas esféricas denominadas de folículos, que são células epiteliais arranjadas sobre uma membrana basal, circundando um material amorfo denominado de colóide. O colóide é composto principalmente por tiroglobulina (8)(13) que armazena e liberta a T4 e a T3 (8).
A glândula tiróide capta ativamente o Iodo para formar as hormonas tiroideias e armazena-as unidas à tiroglobulina, nos folículos tiróideus (2). Considera-se como ideal para o ser humano uma ingestão de Iodo entre 150 a 300 μg/dia (5).
A T4 é a principal hormona produzida pela tiróide e circula no plasma ligada a proteínas de
transporte (14).
Os níveis sanguíneos das hormonas tiroideias são mantidos dentro de uma gama estreita de valores (15).
A TSH estimula a síntese e secreção das hormonas tiroideias pela tiróide. É uma glicoproteína que consiste das subunidades α e β, as quais se ligam aos recetores de membrana da glândula tiroideia (13)(16).
A secreção de TSH é controlada pela Hormona Libertadora de Tirotropina (TRH) proveniente do hipotálamo e pelas hormonas produzidas na glândula tiroideia. Assim, por exemplo, quando os níveis das hormonas tiroideias diminuem, a hipófise aumenta a libertação de TSH; quando aumentam, observa-se o inverso. Alterações neste equilíbrio acompanham várias doenças associadas à disfunção tiroideia (17).
1.3. Ação das Hormonas Tiróideias
Os recetores das hormonas da tiróide são encontrados nos núcleos da maioria das células do corpo, ao contrário dos recetores de outras hormonas, cuja distribuição é mais limitada. Por conseguinte, as suas ações são dessiminadas e afetam muitos órgãos e tecidos. Os recetores estão localizados no núcleo e podem ligar-se tanto à T3 quanto à T4, porém exibem uma maior
18
afinidade para a T3. Como a maior parte da T4 que entra nas células sofre desiodação a T3, os
sítios de ligação dos recetores estão, na sua maioria, ocupados pela T3 (10).
1.4. Tiroxina Livre (FT4)
A fracção livre da T4 (FT4) corresponde à fração não ligada às proteína. Como não se modifica
com alterações na concentração das proteínas transportadoras, a determinação da FT4 é superior
à da T4 total para a avaliação da função tiroideia (14).
A T4 circula no sangue como uma mistura em equilíbrio de hormona livre e hormona ligada à
proteína sérica. A Globulina Transportadora de Tiroxina (TBG), a albumina e a pré-albumina transportam a T4 total circulante. Este transporte é de tal forma que existe uma pequena
percentagem de FT4 na circulação (18) (19).
Uma vez absorvida a FT4 pelas células alvo, o equilíbrio restabelece os níveis circulantes de
FT4, havendo um nível mais ou menos constante de FT4 quando ocorrem alterações quer na
concentração, quer na afinidade das proteínas de ligação séricas. Os valores de FT4 podem,
assim, fornecer a indicação mais correta relativamente à disfunção tiroideia, uma vez que a FT4
é menos sensível às alterações nas proteínas de ligação séricas (3) (10) (13).
2. Patologias da Tiróide
As patologias tiroideias são frequentes na população em geral, sendo a maior parte passível de tratamento médico ou cirúrgico. Incluem o Hipotiroidismo, Hipertiroidismo e o Síndrome do Doente Eutiróideu ou Euthyroid Sick Syndrome (ESS) (7). Este último está associado a doentes com problemas graves de saúde, condições clínicas de inanimação, doenças agudas e crónicas, cirúrgias, traumas, transplantes de medula óssea, entre outros (20).
O hipotiroidismo é a mais comum das disfunções da glândula tiróide, levando à produção diminuída das hormonas da tiróide (21). A forma mais prevalente é a doença tiroideia primária, denominada de hipotiroidismo primário, que é uma deficiência hormonal causada pela incapacidade, parcial ou total, da glândula tiróide produzir as hormonas tiroideias. No entanto, o hipotiroidismo pode resultar de patologias hipofisárias em que a secreção de TSH está diminuída (4). E pode ser permanente ou transitório (22).
19
Em zonas não endémicas, onde o Iodo é suficiente, o hipotiroidismo autoimune crónico, conhecido comumente por Tiroidite de Hashimoto é responsável pela maioria dos casos de hipotiroidismo (23).
Os sinais e sintomas do hipotiroidismo no adulto incluem pele seca, obstipação, dislipidemia, letargia, depressão, irregularidades menstruais, infertilidade, bócio, mialgias e anemia (7). Por seu lado, o hipertiroidismo consiste num estado hipermetabólico causado pelo aumento da função da glândula tiróide e consequente aumento dos níveis circulantes das hormonas tiroideias. As causas mais comuns são a doença de Graves, bócio multinodular tóxico e o adenoma tóxico (24).
As manifestações clínicas do hipertiroidismo incluem alterações associadas ao estado hipermetabólico induzido pelo excesso de hormonas tiroideias, bem como alterações relacionadas com o sistema nervoso simpático. As manifestações cardíacas estão entre as manifestações mais precoces e mais consistentes do hipertiroidismo. É comum a ocorrência de taquicardia e palpitações, podendo ocorrer arritmias, particularmente fibrilação atrial, sobretudo em doentes idosos (25). Pode ainda haver tremor, hiperatividade, labilidade emocional,
ansiedade, incapacidade de concentração e insónia. A pele tende a ser quente, húmida e ruborizada, devido ao aumento do fluxo sanguíneo e a vasodilatação periféric (26) a. A perda de peso é causada primariamente pelo aumento da calorigénese e depois pelo aumento da motilidade intestinal devido à maior atividade simpática. Esta ocorre, apesar de haver do aumento do apetite e hiperfagia (26).
3. Diagnóstico das patologias tiroideias
Perante a suspeita clínica de patologia tiróideia, o diagnóstico clínico deve ser apoiado por doseamentos laboratoriais, doseando os níveis séricos das hormonas FT4 e TSH, e se necessário,
recorrer a técnicas de imagem como a ecografia ou a cintigrafia da tiróide. Segundo a Norma n.º 039/2011 da Direção Geral da Saúde, atualizada em 26 de Dezembro de 2012, as indicações para a avaliação laboratorial da função tiroideia são as seguintes: doentes com bócios e indivíduos com nódulos da tiróide não palpáveis detetados por métodos de imagem; doentes com quadro clínico de hipotiroidismo ou de hipertiroidismo; doentes tiroidetomizados ou submetidos a irradiação cervical; doentes sob medicação suscetível de alterar a função tiroideia; doentes com alterações hipotálamo-hipofisária; doentes com hipotiroidismo congénito; REVISÃO DA LITERATURA
20
crianças com atraso de crescimento; doentes com anemia de causa inexplicada, hipercolesterolémia, variações ponderais, doenças autoimunes, arritmias, osteoporose, irregularidades menstruais, infertilidade; mulheres grávidas que apresentem alto risco de desenvolverem doenças da tiróide ou tenham antecedentes de disfunção tiroideia; clínica sugestiva de disfunção tiroideia; tiroidectomia prévia; história familiar de doença tiroideia; anticorpos antitiróideus elevados; diabetes tipo 1 ou outras doenças autoimunes; irradiação cervical ou abortos de repetição. A avaliação da função tiroideia é realizada pelo doseamento da TSH juntamente com a FT4. Em casos complexos (maior dificuldade diagnosticada ou maior
gravidade clínica) avalia-se com a determinação da TSH, FT4 e T3 (7).
4. Tratamento das patologias tiroideias
Existem vários tratamentos possíveis dependendo da patologia da tiróide e da gravidade, sendo que devem ser usados de forma individualizada. O tratamento do hipotiroidismo faz-se utilizando uma versão sintética da hormona tiroideia T4, a levotiroxina (27) (28).
No caso do hipertiroidismo são utilizados fármacos conhecidos como anti-tiroideus (metimazol e o propiltiouracilo) que diminuem a quantidade de hormonas da tiróide em circulação, bem como o iodo radioactivo ou a cirurgia (29) (30).
5. Metodologias laboratoriais para determinação de hormonas da tiróide
No universo laboratorial existem diversas metodologias, associadas a equipamentos específicos, que permitem dosear o mesmo analíto recorrendo a técnicas diferentes.
O método de Radioimunoensaio (RIA) utiliza a competição entre um antigénio marcado com um radioisótopo de concentração conhecida e um antigénio não marcado para o local de ligação do anticorpo com a produção de complexos antigénio-anticorpo. A concentração do antigénio em análise será inversamente proporcional à radiação emitida. As limitações deste método resultam da ocorrência de reatividade cruzada com outros analítos de estrutura semelhante ao analíto em estudo. Trata-se de uma técnica de elevado custo e de grande risco operacional por manipular material radioativo (31).
Os ensaios Imunoradiométricos (IRMA) consistem na incubação de um antigénio e dois anticorpos monoclonais, um deles marcado com um radioisótopo de iodo 125, formando REVISÃO DA LITERATURA
21
complexos em sandwich. Ocorre uma lavagem para retirar o excesso de marcador e há a medição de radioatividade que vai ser diretamente proporcional ao nível de analíto em estudo na amostra (31).
Os ensaios Imunoenzimáticos (ELISA) são um método específico e muito sensível que permite a deteção qualitativa e quantitativa de anticorpos ou antigénios. É um método para a deteção de proteínas específicas no material analisado com o uso de anticorpos policlonais ou monoclonais conjugados com uma enzima adequada. A essência do teste consiste na introdução de material biológico contendo anticorpos ligados à enzima específica para o antigénio imobilizado, produzindo um complexo imune. Após a adição do substrato adequado, a enzima ligada ao anticorpo específico catalisa a reação e o produto pode ser determinado espetrofotometricamente. É um método com alta sensibilidade na deteção de TSH (32) (33). Um avanço na metodologia para o doseamento de analítos, como por exemplo hormonas, é o desenvolvimento de testes de terceira geração, tal com os Imunoensaios de Micropartículas Enzimáticos (MEIA), a Quimioluminescência por Micropartículas (CMIA) e a Eletroquimioluminescência (ECLIA).
Os Imunoensaios MEIA são uma técnica que utiliza micropartículas ligadas em suspensão líquida e que vão formar complexos em sandwich com os antigénios. Os complexos antigénio-anticorpo vão ser detetados e quantificados por análise de fluorescência a partir da interação enzima-substrato (32) (33).
No presente trabalho procedeu-se ao doseamento do valor circulante de duas hormonas tiroideias, a TSH e a FT4, com recurso a metodologias semelhantes mas com equipamentos
diferentes, nomeadamente: CMIA (ARCHITECT® i2000-Abbott) e ECLIA (COBAS® 6000-Roche).
CMIA – Imunoensaio de Quimioluminescência por Micropartículas
A metodologia associada ao equipamento ARCHITECT® i2000 (Abbott) consiste num Imunoensaio CMIA, que permite determinar a presença de antigénios, anticorpos ou analitos nas amostras. Os reagentes necessários neste tipo de metodologia incluem (34):
- micropartículas paramagnéticas revestidas com moléculas de captura (antigénio, anticorpo ou partícula viral) específicas para o analito que se pretende dosear;
22
- conjugado marcado com acridina; - solução ativadora e pré-ativadora.
A sequência de reação do CMIA inclui um conjunto de interações entre o analito presente na amostra e os reagentes referidos anteriormente. Esta sequência é específica a cada um dos protocolos de ensaio. Os princípios básicos da metodologia são ilustrados por uma reação de dois passos. Em primeiro lugar, as micropartículas (micropartículas paramagnéticas revestidas com as moléculas de captura) são dispensadas na cuvete de reação que contém já a amostra. O
vortex agita a cuvete, que é posteriormente incubada, permitindo que o analito presente na
amostra se ligue às moléculas de captura correspondentes existentes nas micropartículas, formando um complexo imune. Um magneto atrai as micropartículas paramagnéticas que se encontram ligadas ao analito específico para a parede da cuvete de reação. Na zona de lavagem 1 ocorrem múltiplas lavagens da mistura de reação por forma a remover todas as moléculas não ligadas (34).
No segundo passo da reação, o conjugado quimioluminescente marcado com acridina é adicionado à cuvete de reação, e vai ligar-se ao complexo imune, completando a mistura de reação (34).
Após a incubação da solução formada, na zona de lavagem 2 a mesma é lavada múltiplas vezes com o objetivo de remover os compostos não ligados. É então adicionada a solução pré-ativadora (Peróxido de Hidrogénio) e o sistema ótico CMIA faz uma primeira leitura. Esta solução pré-ativadora possui várias funções, por criar um ambiente ácido que previne a libertação precoce de energia (emissão de luz) e impede a aglutinação das micropartículas. Depois, a solução ativadora é dispensada (Hidróxido de Sódio) na solução de reação, provocando a oxidação da acridina por exposição ao peróxido em meio alcalino. Este passo produz a reação de quimioluminescência pela formação de N-metilacridina que liberta energia (emissão de luz) quando retorna ao seu estado inicial. O sistema ótico CMIA mede a emissão de quimioluminescência durante um tempo predefinido por forma a quantificar a concentração do analito (34).
ECLIA – Imunoensaio de Eletroquimioluminescência
23
A metodologia associada ao equipamento Cobas® 6000 (Roche) consiste num imunoensaio ECLIA, processo no qual espécies altamente reativas são geradas a partir de percursores na superfície de um elétrodo; estas espécies altamente reativas reagem umas com as outras produzindo luz (35).
O mecanismo subjacente aos Imunoensaios de Eletroquimioluminescência estabelece-se pela utilização de um quelato de ruténio para o desenvolvimento de luz, em que as reações de quimioluminescência que conduzem à emissao de luz a partir do complexo de ruténio são iniciadas elétricamente em vez de químicamente. Isto acontece através da aplicação de voltagem aos complexos imunológicos que estão ligados às micropartículas revestidas por estreptavidina. A vantagem da reação eletroquimioluminescente ser iniciada de forma elétrica é o facto que toda a reação pode ser controlada com precisão (35).
No ECLIA existem três metodologias que podem ser utilizadas para dosear os analítos e anticorpos presentes numa determinada amostra: o princípio competitivo, para analítos extremamente pequenos, de baixo peso molecular, como é o caso da FT4; o princípio de sandwich para analítos maiores, como o caso da TSH e o princípio de Bridging que é usado
para detetar anticorpos na amostra (35).
No ensaio competitivo, para moléculas de baixo peso molecular, em vez de um anticorpo monoclonal específico para cada analito há um derivado do analito marcado com o complexo de ruténio, o qual compete diretamente com o analito da amostra do paciente testada pelo sítio do anticorpo marcado (36) (37).
No princípio de sandwich são utilizadas micropartículas revestidas de estreptavidina, um anticorpo biotinilado e um anticorpo monoclonal específico para cada analito, marcado com quelato de ruténio, os quais reagem entre si formando um complexo tipo sandwich (moléculas de alto peso molecular) (36) (37).
Em ambos os ensaios, a mistura é fixada magnéticamente na superfície do elétrodo e o que não se fixar é removido. Por fim, há uma aplicação de corrente elétrica no elétrodo que induz uma emissão quimioluminescente, medida por um fotomultiplicador. O tempo de incubação é de 18 minutos (36) (37).
24
II – OBJETIVOS
Os objetivos propostos para o trabalho realizado durante o estágio em ambiente profissional incluíram:
1- O doseamento das hormonas TSH e FT4 em amostras de pacientes do serviço de
Endocrinologia do Centro Hospitalar de Trás-os-Montes e Alto Douro, E.P.E. (CHTMAD), com patologia tiroideia já diagnosticada;
2- A comparação dos resultados obtidos para a mesma amostra utilizando dois equipamentos com metodologias semelhantes (Abbott ARCHITECT® i2000 -
Quimioluminescência e Roche Cobas® 6000 – Eletroquimioluminescência).
.
25
III - METODOLOGIA
1. Caraterização e obtenção da amostra para o estudo
No presente trabalho procedeu-se ao doseamento laboratorial das hormonas TSH e FT4 em
pacientes da consulta de Endocrinologia do Centro Hospitalar de Trás-os-Montes e Alto Douro, E.P.E. (CHTMAD), com diagnóstico clínico de patologia tiroideia, num período compreendido entre Novembro de 2014 e Maio de 2015. O estudo englobou uma amostra sanguínea de 111 pacientes, dos quais 98 eram do sexo feminino e 13 do sexo masculino, com idades compreendidas entre os 19 e os 86 anos, e com diagnóstico de hipotiroidismo primário, hipertiroidismo primários e outras patologias tiroideias.
2. Algorítmo de diagnóstico
O diagnóstico clínico das patologias da tiróide deve incluir a história clínica do doente, exame físico minucioso e a avaliação laboratorial. No que respeita a avaliação laboratorial, na Figura 1 seguida resume-se o contúdo do anexo II da Norma da Direção Geral da Saúde, N.º 039/2011, atualizada a 26 de Dezembro de 2012 (7), que indica quais os exames laboratoriais recomendados para cada patologia e quais os resultados esperados (Figura 1).
26
Figura 1: Esquema representativo das patologias da tiróide, com os resultados laboratoriais esperados. Fonte: Adaptado de (7)
.
3. Processamento Pré-analítico das amostras
Existe um conjunto de procedimentos clínicos e laboratoriais que antecedem o doseamento das hormonas tiroideias TSH e FT4. Estes procedimentos incluem a recolha da amostra sanguínea
e o respetivo processamento pré-analitico e precedem a colocação das amostras nos equipamentos responsáveis pelos doseamentos hormonais.
Os doentes realizaram a colheita de sangue no Laboratório de Patologia Clínica, após a consulta de rotina de Endocrinologia. As amostras foram recolhidas por punção venosa, realizada por um profissional qualificado (Técnico de Análises Clínicas), para um tubo seco com gel separador (gel promotor da coagulação). Os tubos foram devidadamente identificados com os dados dos pacientes e posteriormente encaminhados para o setor de Imunologia. Depois da retração do coágulo, as amostras foram centrifugadas a 4500 r.p.m., durante dez minutos, para a obtenção de soro, no qual se realizam os doseamentos laboratoriais. A presença de eritrócitos, hemólise, fibrina ou partículas em suspensão no soro poderá influenciar os resultados obtidos. O doseamento das hormonas tiroideias em estudo, TSH e FT4, foi realizado utilizando dois
equipamentos com metodologias semelhantes (Abbott ARCHITECT® i2000 - Quimioluminescência e Roche Cobas® 6000 – Eletroquimioluminescência).
4. Procedimento Laboratorial no Equipamento ARCHITECT® i2000
4.1. Princípio biológico do procedimento
O equipamento determina a presença das hormonas TSH e FT4 em soro utilizando a tecnologia
do Imunoensaio de Micropartículas por Quimioluminescência (CMIA). No primeiro passo, a amostra e as micropartículas paramagnéticas revestidas de anticorpos anti-subunidades β da TSH ou anti-T4 são combinadas. A FT4 ou a TSH, presente na amostra, vão-se ligar a
micropartículas revestidas de anticorpos respetivamente anti-T4 ou anti-TSH. Após a lavagem,
é adicionado o conjugado de anticorpos anti-subunidades da TSH ou da FT4 marcado com
acridina. Posteriormente é adicionada a solução Pré-Ativadora e a solução Ativadora à mistura de reação. A reação quimioluminescente resultante é medida em Unidades Relativas de Luz (RLUs) existindo uma relação direta entre a quantidade de TSH ou a quantidade de FT4 presente
na amostra e as RLUs detetadas pelo sistema ótico do ARCHITECT® i2000 (38) (39).
27 4.2. Manuseamento dos reagentes
Os kits de reagentes ARCHITECT TSH e ARCHITECT FT4 são constituídos por dois e três
frascos, respetivamente (Quadro 1). O reagente de micropartículas, em qualquer dos testes, deve ser homogeneizado (por inversão, cerca de trinta vezes) antes de ser colocado no equipamento, com o objetivo de suspender as micropartículas que se encontram depositadas. Quando as micropartículas se encontram devidamente suspensas retira-se e elimina-se a tampa substituindo esta por uma tampa septo, que evita a evaporação e a contaminação do reagente e ainda permite assegurar a integridade do mesmo. O equipamento antes de processar qualquer amostra faz também uma ressuspensão automática das micropartículas (38) (39).
Os kits de reagentes ARCHITECT TSH e ARCHITECT FT4 após serem introduzidos no
equipamento podem ser conservados durante um período máximo de 30 dias; após este tempo o kit deve ser eliminado (38) (39).
Quadro 1: Composição das rackpacks de reagentes utilizados para o doseamento das hormonas TSH e FT4 no
equipamento ARCHITECT® i2000.
TSH FT4
Micropartículas
Anticorpos anti subunidade β da TSH revestidos de micropartículas em tampão TRIS com
estabilizadores de proteínas (bovino)
Conservante: agentes antimicrobianos
Micropartículas revestidas de anticorpos anti-T4 (ovelha) em
tampão TRIS com estabilizadores de IgG de ovelha
Conservante: azida sódica
Conjugado
Conjugado de anticorpos anti subunidade α da TSH marcado com acridina em tampão MES com estabilizadores de proteínas (bovino)
Conservante: agentes antimicrobianos
Conjugado de T4 marcado com
acridina em tampão MES com estabilizadores NaCl e Triton X-100
Conservante: ProClin
Diluente
Diluente de ensaio TSH em tampão TRIS
Conservante: agentes anti microbianos
_
Fonte: adaptado de (38) (39).
Os reagentes podem ser conservados quer dentro quer fora do equipamento. Se forem retirados do sistema devem ser conservados a 2-8ºC, com tampas septo e tampas de armazenamento, na posição vertical nas suas placas e caixas originais. Caso isto não aconteça os kits devem de ser eliminados (38) (39).
28 4.3. Calibrações e controlos
Antes da utilização dos calibradores e dos controlos do ensaio, estes devem ser homogeneizados por inversão cuidadosa. Os procedimentos de calibração para os reagentes TSH e FT4 têm
ligeiras diferenças (38) (39).
Na calibração da TSH processam-se dois calibradores (calibradores 1 e 2) em duplicado. Para avaliar a calibração do ensaio avalia-se uma única amostra de todos os níveis dos controlos do ensaio TSH e deve-se assegurar que os valores de controlo do ensaio se situam dentro dos intervalos de concentração especificados (intervalo de calibração: 0,0000 – 100,0000 μUl/ml)
(38).
Para efetuar uma calibração da FT4, devem-se processar vários calibradores (calibradores de A
a F) em duplicado. Para avaliar a calibração do ensaio processa-se uma única amostra de todos os níveis de controlos FT4 e deve-se assegurar que os valores do controlo do ensaio se situam
dentro dos intervalos de concentração especificados (intervalo do calibrador: 0,0 – 6,0 ng/dl)
(39).
Em ambos os casos, TSH e FT4, uma vez aceite e memorizada a calibração pode realizar-se o
ensaio de todas as amostras. A necessidade de efetuar uma nova calibração prende-se com a mudança de lote de um novo reagente ou quando se verifica que o controlo de qualidade interno se situa fora dos intervalos definidos para cada parâmetro (38) (39).
O Controlo de Qualidade Interno (CQI) visa identificar e eliminar erros inerentes ao processo diário e garantir a repetibilidade dos resultados, devendo, por isso, ser usado com uma frequência diária. A avaliação do CQI é feita com base nas mensurações diárias dos controlos, pela análise dos gráficos Levey-Jennings que o próprio equipamento disponibiliza. Um valor de CQI situado fora do intervalo especificado (dois desvios padrões – 2SD) pode ser preditivo de deterioração dos reagentes, da necessidade de ajustar a curva de calibração, ou de erros na técnica (36).
4.4. Conservação e armazenamento de amostras
As amostras podem ser conservadas a 2-8ºC durante um período máximo de 6 dias antes de serem analisadas. Se o teste for adiado por mais de 6 dias, as amostras devem ser congeladas a uma temperatura inferior ou igual a -10ºC. Devem evitar-se vários ciclos de congelação/descongelação; após a descongelação, as amostras devem ser completamente homogeneizadas no vortex a baixa velocidade ou por inversão cuidadosa, e centrifugadas antes METODOLOGIA
29
da utilização, de forma a eliminar glóbulos vermelhos ou partículas em suspensão e a assegurar resultados consistentes (38) (39).
4.5. Apresentação dos resultados do equipamento
O ensaio, como já foi referido, utiliza um método de regressão logística de quatro parâmetros para gerar uma curva de calibração. A unidade de resultados predefinida para o ensaio da hormona TSH é µUl/mL e a unidade de resultado predefinida para a hormona FT4 é ng/dL. São
as chamadas unidades convencionais. Se pretendermos utilizar o sistema internacional de unidades, deverá ser selecionada a unidade de resultados alternativa para a FT4 - pmol/L (o
fator de conversão utilizado pelo sistema é 12,87). Para a TSH em que a unidade do SI é mUI/L, e o fator de conversão é 1 (38) (39).
5. Procedimento laboratorial no equipamento COBAS® 6000
5.1. Princípio biológico do procedimento
O equipamento determina a concentração das hormonas TSH e FT4 em soro utilizando a
tecnologia do Imunoensaio de Micropartículas por Eletroquimioluminescência (ECLIA) (40) (41). No princípio do teste para o doseamento da hormona FT4, ocorre a primeira incubação com a
junção da amostra e dos anticorpos específicos anti-T4, marcados com um complexo de ruténio.
Posteriormente há uma segunda incubação após a incorporação de T4 biotinilada e das
micropartículas revestidas com estreptavidina, os locais de fixação ainda livres do anticorpo marcado são ocupados, formando-se um complexo anticorpo-hapteno. O complexo formado liga-se à fase sólida pela interação da biotina e da estreptavidina (41).
No princípio do teste para o doseamento da hormona TSH, ocorre a primeira incubação onde se junta à amostra, um anticorpo monoclonal biotinilado específico anti-TSH e um anticorpo monoclonal específico anti-TSH marcado com complexo de ruténio reagem entre si e formam um complexo sandwich. Na segunda incubação após a adição das micropartículas revestidas de estreptavidina, o complexo formado liga-se à fase sólida pela interação da biotina e da estreptavidina (40).
Posteriormente, tanto para o FT4 como para a TSH, a mistura de reação é aspirada para a célula
de leitura, onde as micropartículas são fixadas magnéticamente à superfície do elétrodo. Os METODOLOGIA
30
elementos não ligados são removidos com solução de lavagem (ProCell/ProCell M). A aplicação de uma corrente elétrica ao elétrodo induz uma emissão quimioluminescente que é medida por um fotomultiplicador (40) (41).
5.2. Manuseamento dos reagentes
Os regentes são introduzidos no equipamento e este faz a leitura dos códigos de barras para introduzir os parâmetros específicos dos testes no sistema, fazendo também a ressuspensão das micropartículas automaticamente antes de usar os reagentes (40) (41).
O Quadro 2 mostra a composição da rackpack de reagentes do equipamento Cobas® 6000, utilizados para o doseamento das hormonas TSH e FT4, ambos os kits são constituídos por
micropartículas, e os anticorpos R1 e R2.
Quadro 2: Composição das rackpacks de reagentes utilizados para o doseamento das hormonas TSH e FT4 no
equipamento Cobas® 6000.
TSH FT4
M
Micropartículas revestidas de estreptavidina: Micropartículas revestidas de estreptavidina, 0.72 mg/mL; conservante
Micropartículas revestidas de estreptavidina: Micropartículas revestidas de estreptavidina, 0.72 mg/mL; conservante
R1
Anticorpo anti-TSH~biotina:
Anticorpo monoclonal biotinilado anti-TSH (ratinho) 2.0 mg/L; tampão fosfato 100 mmol/L, pH 7.2; conservante.
Anti-T4-Ab~Ru (bpy)32+:
Anticorpo policlonal anti-T4 (carneiro) marcado com complexo de ruténio 75 ng/mL; tampão fosfato 100 mmol/L, pH 7.0; conservante.
R2
Anticorpo anti-TSH~Ru(bpy)32+:
Anticorpo monoclonal anti-TSH
(ratinho/humano) marcado com complexo de ruténio 1.2 mg/L; tampão fosfato 100 mmol/L, pH 7.2; conservante.
T4~biotina:
T4 biotinilada 2.5 ng/mL; tampão fosfato
100 mmol/L, pH 7.0; conservante.
Fonte: adaptado de (40) (41).
As rackpacks de reagentes utilizadas no equipamento devem cumprir regras de armazenamento e estabilidade mencionadas no Quadro 3.
Quadro 3: Armazenamento e estabilidade das rackpacks de reagentes utilizados para o doseamento das hormonas TSH e FT4 no equipamento Cobas® 6000
Hormonas Armazenamento e Estabilidade
TSH
- Fechado: 2-8ºC até ao fim do prazo de validade indicado - Após abertura: 2-8ºC durante 12 semanas
- No equipamento: 6 semanas
FT4
- Fechado: 2-8ºC até ao fim do prazo de validade indicado - Após abertura: 2-8ºC durante 12 Semanas
- No equipamento: 4 semanas ou 8 semanas quando armazenado alternadamente no frigorífico e no equipamento, desde que o tempo total no analisador não ultrapasse as 120horas.
Fonte: adaptado de (40) (41).
31 5.3. Calibração e Controlos
Cada dispositivo de reagentes contém um código de barras com informações específicas para a calibração do lote de reagentes. A curva principal, pré-definida, é adaptada ao analisador utilizando o conjunto de calibradores - CalSet - adequado. A calibração tem de ser realizada uma vez por cada lote de reagentes utilizando um reagente recém-colocado (máximo de 24 horas após o dispositivo de reagentes ter sido registado no analisador) (40) (41).
Para o controlo de qualidade é utilizado um kit PeriControl Universal que permite com uma mesma solução estabelecer os controlos para várias hormonas, incluindo a TSH como para a FT4. Os controlos devem ser executados a diário, quando o teste estiver a ser utilizado, uma vez
por dispositivo de reagentes e após cada calibração. Os valores obtidos devem situar-se dentro dos limites definidos (2 SD) (40) (41).
5.4. Conservação e armazenamento de amostras
As amostras têm uma estabilidade de 7 dias a 2-8ºC ou um mês a -20ºC, podendo ser congeladas apenas uma vez; antes da determinação terão de ficar à temperatura ambiente, entre 20 e 25ºC. Devem ser centrifugadas antes da realização do ensaio, devido a possíveis efeitos de evaporação e devem ser analisadas/medidas no prazo de duas horas (40) (41).
5.5. Apresentação dos resultados do equipamento
Os resultados são determinados com base numa curva de calibração gerada especificamente pelo analisador, através de uma calibração de dois pontos e numa curva principal incluída no código de barras do reagente. O analisador calcula automaticamente a concentração de analito de cada amostra em pmol/l, ng/dl ou ng/l (40) (41).
6. Metodologia Estatística
A análise estatística foi realizada através do software SPSS. A metodologia estatística utilizada para a análise dos resultados, em particular para a comparação dos resultados obtidos através das duas metodologias, foi o método de Bland-Altman e a concordância de Kendall.
O método de Bland-Altman visa verificar se duas técnicas de medição são concordantes nos resultados que emitem, e utiliza-se para comparar duas medidas da mesma natureza. Os gráficos METODOLOGIA
32
de Bland-Altman permitem investigar a existência de uma diferença sistemática entre as mensurações (i.e., o viés fixo) e identificar eventuais outliers. O gráfico de Bland-Altman é um diagrama de dispersão em que o eixo das abcissas mostra a média de cada par de resultados e o eixo das ordenadas a diferença entre os valores do mesmo par. As linhas horizontais representam a média das diferenças e permitem estimar se um dos dois métodos sobreavalia uma amostra em relação a outra, enquanto as outras duas linhas representam o intervalo de confiança. Se os pontos do gráfico estão dentro das duas linhas é considerado que os dois métodos proporcionam resultados concordantes, enquanto os pontos fora das duas linhas são casos em que os dois métodos não são compatíveis. Se a variação da média dentro do intervalo de confiança não é clinicamente importante, os dois métodos podem ser considerados permutáveis (42) (43) (44).
Além do método de Bland-Altman, utilizou-se também o coeficiente de correlação de Kendall, designada por uma medida de concordância entre dois conjuntos de classificações relativas a um conjunto de experiências, utilizado para avaliar a fiabilidade de resultados obtidos por diferentes instrumentos. Este é um teste não paramétrico e exige o recurso a ordenações de resultados para efetuar os seus cálculos. O valor de coeficiente de Kendall assume valores reais entre -1 e 1, sendo os valores próximos de 1 correspondentes a correlações fortes e os valores próximos de 0 refletem correlações fracas; os valores negativos indicam associações negativas ou decrescentes e os positivos associações positivas ou crescentes (45).
33
IV – RESULTADOS
1. Caracterização do grupo de estudo
Das 111 amostras séricas representando doentes pertencentes à consulta de Endocrinologia, com patologia tiroideia já diagnosticada, verificou-se que 98 (88.3%) dos doentes pertenciam ao sexo feminino e 13 (11.7%) ao sexo masculino.
Os doentes integrados no estudo apresentavam uma média de 53 anos de idade (19 a 86 anos), enquadrando-se a maioria na faixa etária superior a 40 anos (73%), 26% enquadravam-se na faixa etária compreendida entre os 20 e os 39 anos e apenas 1% tinham idade inferior a 20 anos.
Tabela 1: Caracterização da amostra do estudo. Sexo Faixa Etária (anos) Número de amostras Percentagem
(%) Média Mediana Máximo Mínimo SD
Feminino >40 72 65 60 62 86 40 11,4 20-39 25 23 32 33 39 22 4,6 <20 1 1 19 19 19 19 0,0 Masculino >40 9 8 67 72 78 51 9,8 20-39 4 4 38 31 37 22 7,4 <20 0 0 0 0 0 0 0
No que respeita á patologia tiroideia, verificou-se que 66 doentes (60%) tinham hipotiroidismo primário, 26 (23%) tinham hipertiroidismo primário e 19 (17%) tinham outras patologias tiroideias.
2. Análise estatística dos resultados dos doseamentos de TSH e FT4
Após o doseamento das hormonas TSH e FT4 nas 111 amostras dos doentes, fez-se uma análise
estatística com o software SPSS, utilizando o método de Bland-Altman e a concordância de
Kendall, para verificar se existem diferenças estatisticamente significativas entre os
doseamentos das hormonas nos dois equipamentos, ARCHITECT® i2000 (Abbott) e Cobas® 6000 (Roche). Para tal analisaram-se alguns pontos essenciais no estudo estatístico.
2.1. Análise dos resultados dos valores de TSH nos dois equipamentos
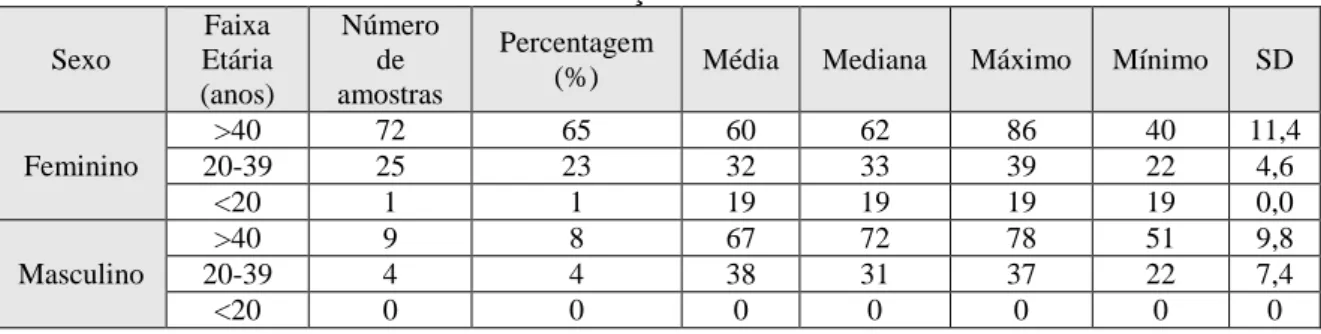
A Figura 2 apresenta o Gráfico I com os resultados obtidos pelo método estatístico de
Bland-Altman alusivo à diferença entre o doseamento da hormona TSH (Rochee Abbott),
constatando-se que 7,2% (8 de 111) dos dados são discrepantes; 7 dos resultados obtidos excedem o limite de concordância superior e um situa-se abaixo do limite de concordância inferior.
34
O viés médio é de 0,44, indicando que a medição através do equipamento Cobas® 6000 da Roche é ligeiramente superior à do equipamento ARCHITECT® i2000da Abbott (97,3% das observações através do equipamento da Roche foram superiores à do equipamento da Abbott). O Gráfico I e o Gráfico II (correspondente à concordância de Kendall) sugerem que com o aumento da TSH as diferenças são maiores entre os dois métodos e que a partir do valor 6 da TSH a diferença se mantém estável. A análise através da concordância de Kendall revelou níveis elevados de concordância entre ambos os equipamentos (W = 0,877; p <0,001). O gráfico relativo a este teste (Figura 2-gráfico II) mostra que existem muitos pontos em que a diferença entre os dois testes ultrapassa em valor unitário (µUI/mL) o intervalo de valores de referência para esta hormona (Roche 0,27 – 4,20 e Abbott 0,35 – 4,94) correspondendo ao valor ≈ 4 (no eixo dos X, no gráfico II, figura 2).
Figura 2: Apresentação do Gráfico I correspondente ao método de Bland-Altman e do Gráfico II correspondente ao diagrama de dispersão da concordância de Kendall. Ambos mostram as diferenças entre as medições do doseamento da TSH, pelos métodos CMIA-Abbott e ECLIA-Roche.
2.2. Análise dos resultados dos valores de FT4 nos dois equipamentos
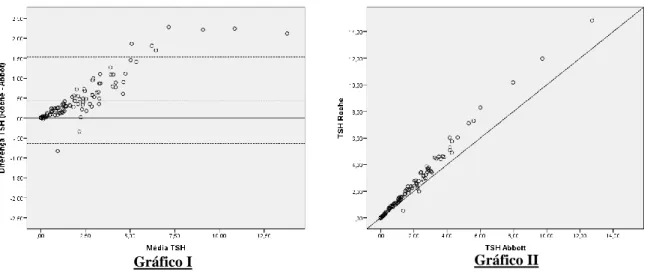
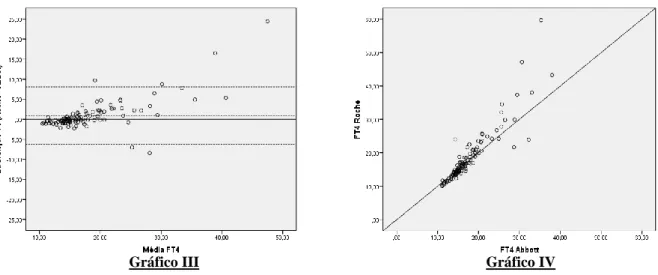
A Figura 3 apresenta o Gráfico III de Bland-Altman referente à diferença entre as medições de FT4 (Roche-Abbott), permitindo observar que 5,4% (6 de 111) dos dados são discrepantes,
sendo que 4 resultados excedem o limite de concordância superior e dois localizam-se abaixo do limite de concordância inferior.
O viés médio é de 0,90, indicando que a medição através do equipamento da Roche é superior à do equipamento da Abbott: 50,5% das observações através do equipamento da Rocheforam superiores à do equipamento da Abbott.
Gráfico I Gráfico II
35
A análise de concordância de Kendall (Gráfico IV) revelou a inexistência de concordância entre ambos os equipamentos (W = 0,000; p <0,924). De facto, a observação deste gráfico aponta para uma diferença mínima de 10 unidades entre os dois testes, existindo pontos de diferença próximos de 60.
Figura 3: Apresentação do Gráfico III correspondente ao método de Bland-Altman e do Gráfico IV correspondente ao diagrama de dispersão da concordância de Kendall, ambos mostram as diferenças entre as medições do doseamento da FT4, pelos métodos CMIA-Abbott e ECLIA-Roche.
Gráfico IV Gráfico III
36
V – DISCUSSÃO
Neste estudo a maioria dos doentes eram do sexo feminino (88.3%) e tinham mais de 40 anos de idade. Está descrito na literatura que as patologias da tiróide são altamente prevalentes sobretudo em mulheres idosas, por exemplo, como referem Bensenor et al (46) num estudo efetuado em 2012 sobre hipotiroidismo no idoso.
Num tutorial escrito por DeRuiter (47) sobre as hormonas e as patologias da tiróide, o autor refere que a prevalência e incidência dos distúrbios da tiróide são influenciados principalmente pelo sexo e pela idade. E que os distúrbios da tiróide são mais comuns em mulheres do que em homens e em grupos etários com mais idade.
Também Morganti et al (48) , num artigo sobre doenças da tiróide em idosos, mencionam que as
doenças da tiróide são mais prevalentes em mulheres principalmente com idade superior a 60 anos.
Em comunidades sem défice de iodo, a prevalência de hipotiroidismo espontâneo é de 1 a 2%, sendo mais comum em mulheres idosas e 10 vezes mais frequente em mulheres do que em homens, facto confirmado pelos estudos feitos pelo autor Vamderpump (49), sobre a epidemiologia das doenças da tiroide.
No que respeita à patologia da tiróide, verificou-se que 60% dos doentes tinham hipotiroidismo primário sendo a principal causa a tiroidite autoimune, tal como seria de esperar.
Está citado na literatura, por exemplo pelo autor Gilman (23) em “As bases farmacológicas da terapêutica” 11ª edição, que em zonas não endémicas, onde o iodo é suficiente, o hipotiroidismo autoimune crónico, conhecido comumente por Tiroidite de Hashimoto é responsável pela maioria dos casos de hipotiroidismo.
Os autores Eaton et al (50) e Ngo et al (51), citam também que a maioria das doenças autoimunes são mais frequentes nas mulheres.
Neste trabalho comparamos os resultados obtidos no doseamento das hormonas TSH e FT4 em
dois equipamentos diferentes, ARCHITECT® i2000 e Cobas® 6000, respetivamente pelos
métodos CMIA e ECLIA.
Após a análise dos resultados do doseamento da hormona TSH, verificou-se que os dois métodos, CMIA (ARCHITECT-Abbott) e ECLIA (Cobas-Roche), apresentaram níveis elevados DISCUSSÃO
37
de concordância (W = 0.877 e p <0.001). No entanto, para o doseamento da hormona FT4
verificou-se uma inexistência de concordância entre as metodologias (W = 0.000 e p <0.924). Existem vários estudos na literatura que comparam estes métodos laboratoriais, não só na avaliação da função tiroideia, mas também na determinação de outros doseamentos, tendo sido alguns deles realizados no âmbito da Veterinária. De seguida faz-se uma breve referência a alguns deles.
Hendriks, Kortlandt e Verweij (52), compararam o desempenho analítico de cinco equipamentos para imunoensaios, incluindo o equipamento Architect i2000 que utiliza o método CMIA e o
Elecsys 2010 que utiliza ECLIA, para treze analitos, incluindo as hormonas TSH e FT4, em
amostras de soro humano. A maioria dos testes apresentou boa reprodutibilidade com algumas exceções e foram determinados bons coeficientes de correlação na maior parte das comparações entre os métodos.
Rawlins & Roberts (53), avaliaram as caraterísticas de desempenho de seis ensaios de terceira
geração, para o doseamento da hormona TSH em soro humano. Um dos analisadores era o
ARCHITECT i2000 com o método CMIA, também utilizado no presente trabalho e os autores
concluíram com o estudo que este analisador era o que tinha maior precisão para concentrações baixas de TSH.
Polymerou, et al (54), fizeram uma avaliação dos anticorpos da hepatite C por três métodos (ECLIA, MEIA e CMIA) em 320 doentes e concluíram que têm excelente sensibilidade e quase idêntica especificidade elevada, pelo que qualquer um pode ser usado na prática de rotina.
Cheng, et al (55), compararam os resultados dos marcadores do vírus da hepatite B obtidos com dois sistemas automatizados (CMIA - Abbott e ECLIA - Roche) e encontraram diferenças substanciais nos resultados obtidos pelos dois métodos, especialmente na determinação anti-HBs e HBeAg em baixas concentrações.
Um estudo feito por Eshratkhah, et al (56), em 2011, que comparou o nível de FT3 pelos métodos
CLIA e ECLIA em vacas, não encontrou diferenças significativas entre ambos apesar de a média dos valores ser mais elevada pelo método CLIA. A análise de regressão revelou uma correlação significativa entre eles. Os autores concluíram que estes métodos podem ser usados como alternativa aos métodos utilizados anteriormente para a determinação da concentração de FT3 em Veterinária.
38
Em 2012 Eshratkhah (57) fez outro estudo comparativo da concentração das hormonas tiroideias plasmáticas em ovelhas usando RIA, CLIA e ECLIA. Concluiu que a CLIA e ECLIA podem ser usados como métodos alternativos para a determinação da T4 e T3 em ovelhas.
Zhang, Chen, Lin & Lin (58), compararam dois imunoensaios, CMIA e ELISA, para a deteção de α-fetoproteína em soro humano. Foi utilizado no estudo como método de controlo a ECLIA. O método CMIA apresentou melhor linearidade, precisão, sensibilidade em relação ao método ELISA.
Matyjaszek-Matuszek, Pyzik, Nowakowski & Jarosz (59), reviram a utilização de vários métodos laboratoriais, tais como RIA, IRMA, CPB, RRA, EIA, ELISA, MEIA, FIA e ECLIA para a determinação de TSH. De entre os métodos laboratoriais de terceira geração, usados atualmente para o doseamento de TSH, o mais frequentemente recomendado é o imunoensaio por ECLIA, caracterizado por alta sensibilidade e especificidade. No entanto os autores ainda referem que se deve ter em conta fatores como a idade, medicamentos administrados, gravidez e algumas patologias que podem afetar os níveis de TSH.
Inan, et al (60), em 2014, compararam o desempenho técnico da CMIA e da ECLIA para a
deteção do antigénio HBs no soro de dadores de sangue e amostras clínicas de rotina. Encontraram uma correlação significativa entre os dois métodos.
Sarkar (61), comparou a CMIA no equipamento ARCHITECT® com a ECLIA no equipamento
Cobas® para a determinação de TSH, numa população indiana. Após o doseamento da TSH por CMIA e ECLIA verificou que os resultados de ECLIA foram mais elevados, mas a maioria dos valores estavam dentro dos limites de acordo com os valores de CMIA.
Os investigadores Xiao-yan et al (62), fizeram um estudo para avaliação do imunoensaio por ECLIA para determinação de gonadotrofina coriónica humana. Concluíram com o estudo que ECLIA pode ser a escolha ideal para a determinação de gonadotrofina coriónica humana. Outros autores que também se podem referenciar são Kazerouni & Amirrasouli (63), que avaliaram as caraterísticas de desempenho de três imunoensaios automáticos para a determinação de hormonas tiroideias, com três metodologias, respetivamente ECLIA, RIA e IRMA. Concluíram que o equipamento com a metodologia ECLIA é fiável, eficiente e tecnicamente excelente para o doseamento de TSH, T3 e T4 séricos.
39
Relativamente a este trabalho, não foi possível, no decorrer do estudo, encontrar justificação para a discordância verificada entre os métodos no doseamento da FT4. Podem levantar-se
algumas questões que poderão servir de base à continuação deste estudo: a discordância entre os dois métodos seria significativa se a amostra em estudo fosse maior? Apesar de discordantes, estarão os valores obtidos dentro do intervalo de referência para o parâmetro em estudo? Será esta discrepância relevante em termos clínicos?
40
VI - CONCLUSÃO
Concluiu-se com este estudo que ambas as metodologias são opções alternativas para o doseamento da hormona TSH. Devido às discrepâncias entre os métodos para o doseamento da hormona FT4, sugere-se que se deve aumentar o número de amostras em estudo e repetir as
amostras efetuando um estudo de reprodutibilidade de modo a confirmar os resultados. CONCLUSÃO
41
VI - REFERÊNCIAS BIBLIOGRÁFICAS
1. Ramé, A. e Thérond, S. Anatomia e Fisiologia. s.l. : Climepsi Editores, 2012.
2. Guyton, A. C., & Hall, J. E. (2012). Tratado de Fisiologia Médica (12ª ed.). ELSEVIER.
3. Kronenberg, H. M., Larsen, P. R., Polonsky, K., & Melmed, S. (2011). Williams textbook of
endocrinology (12ª ed.). Philadelphia: Saunders ELSEVIER.
4. Muller, A. F., Berghout, A., Wiersinga, W. M., Kooy, A., Smits, J. W., & Hermus, A. R. (2008). Thyroid function disorders - guidelines of the Netherlands Association of Internal Medicine. Journal Medicine,
66(3), 134-142.
5. Dunlop, D. B. (2002). Thyroid funtion tests. Em H. K. Walker, W. D. Hall, & J. W. Hurst, Clinical
methods: the history, physical, and laboratory examinations (3ª ed., pp. 1-30). Boston: Butterworth
Publishers.
6. Wu, A. H. (2006). Tietz Clinical Guide to Laboratory Tests (4ª ed.). Philadelphia: Saunders Elsevier. 7. Direção Geral da Saúde. (26 de Janeiro de 2012). Prescrição de Exames Laboratoriais para Avaliação e
Monitorização da Função Tiroideia. Diário da República Portuguesa.
8. Molina, P. E. (2007). Endocrine Physiology (4ª ed.). México: McGraw-Hill Interamericana Editores, S.A. 9. Greenspam, F. S., & Gardener, D. G. (2007). Basic & Clinical endocrinology. MacGrawHill.
10. Widmaer, E. P., Raff, H., & Strang, K. T. (2013). Vander - Fisiologia das funções corporais (12ª ed.). Guanabara Koogan.
11. Kierszenbaum, A. L., & Tres, L. L. (2012). Histology and Cell Biology (3ª ed.). Rio de Janeiro: ELSEVIER.
12. Pinto, A. M. (2013). Fisiopatologia (2ª ed.). Lisboa, Portugal: LIDEL - Edições Técnicas, Lda.
13. Seeley, R. R., Stephens, T. D., & Tate, P. (2005). Anatomia & Fisiologia (6ª ed.). Lusociência - Edições Técnicas e Científicas, Lda.
14. Caquet, R. (2001). Le vademecum des examens de laboratoire. Paris: MMI.
15. Guedes, E. P., Moreira, R. O., & Benchimol, A. K. (2006). Endocrinologia. Rio de Janeiro: Editora RUBIO.
16. Rivolta, C. M., & Targovnik, H. M. (2006). Molecular advances in thyroglobulin disorders. ELSEVIER - Clinica Chimica Acta, 374, 8-24.
17. Rusthon, L. (2009). The human body: how it works - the endocrine system. New York: Chelsea House Publishers.
18. Ekins, R. P. (1990). Measurement of free hormones in blood. Endocr Rev, 11 (1), 5-46.
19. Souza, C. A. D. Relatório de estágio do mestrado em análises clínicas. Patologia Clínica, Laboratório Cliniva. Coimbra : Universidade de Coimbra, 2012.
20. Umpierrez, G. E. (2002). Euthyroid sick syndrome. Revista Brasileira de Medicina, 95(5), 506-513. 21. Almeida, M. M., Kuwae, A. S., Quirino, C. M., Gondim, L. V., & Silva, D. O. (2013). Depression and
its relationship with hypothyroidism. Revista de Medicina e Saúde de Brasilia, 2 (3), 164-168.
22. Perrone, D., Teixeira, S. S., Clara, S. A., Santos, D. C., & Nogueira, C. R. (2004). Aspetos Genéticos do hipotiroidismo Congénito. Arquivo Brasileiro de Endocrinologia & Metabologia, 48 (1), 62-69. 23. Gilman, A. G. (2006). As bases farmacológicas da terapêutica (11ª ed.). McGraw Hill.