Artigo de revisão bibliográfica
Dissertação de Mestrado Integrado em Medicina
Doença Óssea no Mieloma Múltiplo
João Pedro Madeira Ribeirinho Soares
1 Nome: João Pedro Madeira Ribeirinho Soares Afiliação: Instituto de Ciências Biomédicas Abel Salazar Universidade do Porto
Doença Óssea no Mieloma Múltiplo
Dissertação de candidatura ao grau de Mestre em Medicina submetido ao Instituto de Ciências Biomédicas Abel Salazar
Área: Hematologia e Oncologia Orientador: Dr.a Maria Alexandra dos Santos Mota da Silva Categoria: Assistente Hospitalar Graduada de Hematologia Afiliação: Serviço de Hematologia do Centro Hospitalar do Porto
2 Agradecimentos
À minha orientadora Dr.a Alexandra Mota pelo incentivo, disponibilidade e orientação prestados.
3 Resumo
O mieloma múltiplo é uma doença rara e incurável que se caracteriza pela proliferação neoplásica de plasmócitos que se vão acumular na medula óssea, afectando de forma particular o tecido ósseo. O mieloma é a neoplasia que mais frequentemente envolve o osso e a morbilidade óssea é a principal complicação desta patologia.
A doença óssea está relacionada com um aumento da actividade dos osteoclastos e uma inibição da actividade dos osteoblastos, o que determina um aumento da reabsorção e uma diminuição da formação óssea, respectivamente.
O exame mais utilizado para o diagnóstico da doença óssea é o raio-X, existindo também outros métodos mais sensíveis, como a ressonância magnética, que também podem ser utilizados.
O tratamento tem como componente essencial os bifosfonatos, no entanto, o seu uso prolongado está associado a efeitos laterais graves, o que levou ao desenvolvimento de novos fármacos.
Para além da terapêutica farmacológica, pode ser necessário recorrer a outras modalidades como a radioterapia, cifoplastia ou, com menos frequência, cirurgia.
Palavras-chave: mieloma múltiplo, doença óssea, osteoclasto, osteoblasto, raio-X, bifosfonatos
4 Abstract
Multiple myeloma is a rare, incurable disease, where plasma cells go on a malignant proliferation that takes place in the bone marrow. Myeloma is the most frequent malignancy that implicates the bone tissue and bone disease is the most important complication of this condition.
Bone disease is related with an increase in osteoclast activity and a decrease in osteoblast activity, accounting for an increase in bone resorption and a decrease in bone formation, respectively.
The diagnostic test more commonly used is the x-ray, but there are other tests more sensible, like magnetic ressonance image, that can also be used.
The mainstay of treatment is bisphosphonates, but their prolonged use is associated with serious complications, which led to the development of new drugs.
Besides medical therapy, it may be necessary to use other approaches like radiotherapy, ciphoplasty or, less frequently, surgery.
Key words: multiple myeloma, bone disease, osteoclast, osteoblast, x-ray, bisphosphonates
5 Índice
Introdução ... 7
Anatomia Histologia e Fisiologia Óssea ... 8
Patogénese ...12 Manifestações Clínicas ...16 Diagnóstico ...18 Raio-X ... 18 Ressonância Magnética (RM) ... 19 FDG-PET/CT ... 20
Outros exames de imagem ... 20
Marcadores Ósseos ... 21 Tratamento ... 22 Analgesia ... 23 Controlo da Hipercalcemia ... 23 Bifosfonatos ... 24 Denosumab ... 27 Novos agentes ... 27 Radioterapia ... 29 Cifoplastia e vertebroplastia ... 29 Cirurgia ... 30 Conclusão ... 31 Bibliografia ... 32
6 Abreviaturas
RANKL- ligando do receptor activador do factor nuclear κ B.
RANK- receptor activador do factor nuclear κ B.
PTH- hormona paratiroideia.
BMP- proteína morfogenética do osso.
M-CSF- factor estimulador da colónia de macrófagos. OPG- osteoprotegerina.
SDF- factor derivado das células do estroma. MIP- proteína inflamatória do macrófago. IL-interleucina.
VEGF- factor de crescimento endotelial vascular. TNF- factor de necrose tumoral.
VEGFR- receptor do factor de crescimento endotelial vascular. sFRP- proteínas secretadas frizzled-related.
DKK- proteína dickkopf.
LRP- receptor relacionado com as lipoproteínas de baixa densidade. HGF- factor de crescimento do hepatócito.
VCAM- molécula de adesão célular vascular. BAFF- factor activador de células B.
TGF- factor de crescimento tumoral.
TRAIL- ligando indutor de apoptose relacionado com o factor de necrose tumoral. PTHrp- péptido relacionado com a hormona paratiroideia.
RM- ressonância magnética.
FDG-PET/CT- tomografia computorizada associada a tomografia de emissão de positrões
com uso de fluordesoxiglicose.
NTX- telopeptídeo terminal N de colagénio tipo 1. CTX- telopeptídeo terminal C de colagénio tipo 1.
ICTP- telopeptídeo terminal C de colagénio tipo 1 gerado por metaloproteínases. DPD- desoxipirinidolina.
PINP- propeptídeo N de procolagénio tipo 1. PINC- propeptídeo C de procolagénio tipo 1. TRACP-fosfatase ácida tartarato resistente. FAOS- fosfatase alcalina óssea.
AINE- anti-inflamatório não esteroide. Ig- Imunoglobulina.
7
Introdução
O mieloma múltiplo é uma doença rara, incurável e que se caracteriza pela proliferação neoplásica de plasmócitos que produzem uma imunoglobulina monoclonal e que se vão acumular na medula óssea (1-3).
O mieloma apenas engloba 1% de todas as neoplasias, no entanto é a segunda neoplasia hematológica mais comum depois dos linfomas, compreendendo 10% das mesmas. A sua incidência na Europa é de 6/100.000 por ano com uma mortalidade de 4.1/100.000 e com uma idade média ao diagnóstico compreendida entre os 63 e os 70 anos, sendo que apenas 2% dos casos se verificam antes dos 40 anos (2, 4). Foi também verificado que a sua incidência é duas vezes superior nos indivíduos de raça negra quando comparados com os caucasianos (1).
Os pacientes normalmente apresentam-se com hipercalcemia, insuficiência renal, anemia e lesões ósseas, sendo que estas manifestações estão incluídas nos critérios de diagnóstico do mieloma múltiplo sintomático, juntamente com a infiltração da medula óssea por plasmócitos e a presença de uma proteína monoclonal no soro ou urina. A proteína monoclonal pode estar ausente em casos de mieloma não secretores (5).
O mieloma múltiplo é a neoplasia que mais frequentemente envolve o osso e a doença óssea é um evento comum, já que ao diagnóstico aproximadamente 80% dos pacientes apresentam alterações da estrutura óssea que estão associadas a dor óssea incapacitante, fracturas patológicas, hipercalcemia e síndromes de compressão medular (6). O conhecimento da patogénese deste envolvimento ósseo no mieloma múltiplo tem sofrido uma grande evolução nas últimas décadas que está relacionada com o melhor entendimento da patofisiologia óssea, sendo que a descrição do RANK e respectivo ligando na década de 90 foi um dos avanços mais importantes neste ramo.
De modo a contrariar a doença óssea no mieloma os bifosfonatos têm tido um papel preponderante e continuam a ser uma componente importante do tratamento, no entanto os efeitos adversos do seu uso prolongado, nomeadamente a osteonecrose da mandíbula, exigiram que se desenvolvesse novas terapêuticas com eficácia semelhante e menores efeitos laterais (7).
8
Anatomia Histologia e Fisiologia Óssea
O osso é um tipo especial de tecido conjuntivo que é formado por um componente celular e um componente extracelular que corresponde à matriz óssea.
Componente celular. As células presentes incluem os osteoblastos, osteócitos e
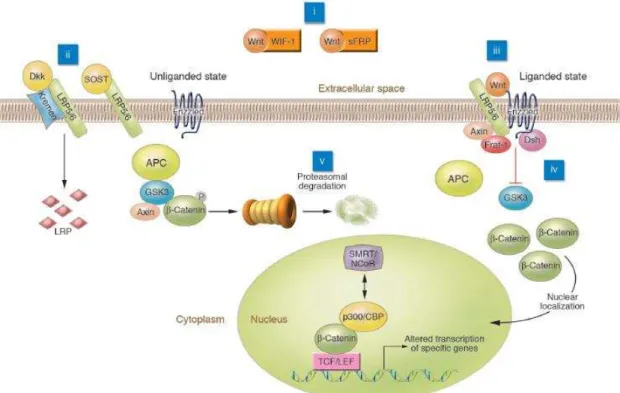
osteoclastos. Os osteoblastos são células especializadas na formação óssea que expressam receptores para a PTH e que vão ter um papel importante na remodelação óssea através da expressão de factores osteoclastogénicos, produção de proteínas da matriz óssea e mineralização óssea (8). A sua origem deriva de células mesenquimatosas pluripotentes que se vão diferenciar em osteoblastos por vários mecanismos, sendo que os de maior relevância serão a via canónica Wnt e a via das BMPs (8, 9). A activação da via canónica Wnt vai depender da ligação das proteínas Wnt ao receptor “Frizzled” e ao co-receptor LRP-5/6 (Figura 1) (10, 11).
Figura 1: Representação esquemática da via canónica Wnt e seus inibidores. A ligação da
proteína Wnt ao receptor Frizzled e ao co-receptor LRP5/6 vai inibir a actividade da GSK3, impedindo a degradação das β-cateninas. As β-cateninas vão-se acumular e sofrer uma translocação para o núcleo, onde vão alterar a transcrição genética. A sinalização pode ser bloqueada pela interacção das Wnts com factores inibitórios como a sFRP ou a WIF-1, ou através da interacção do co-receptor LRP5/6 com a DKK ou a esclerostina (SOST).
Krishnan V, Bryant HU, Macdougald OA. Regulation of bone mass by Wnt signaling. The Journal of clinical investigation. 2006;116(5):1202-9.
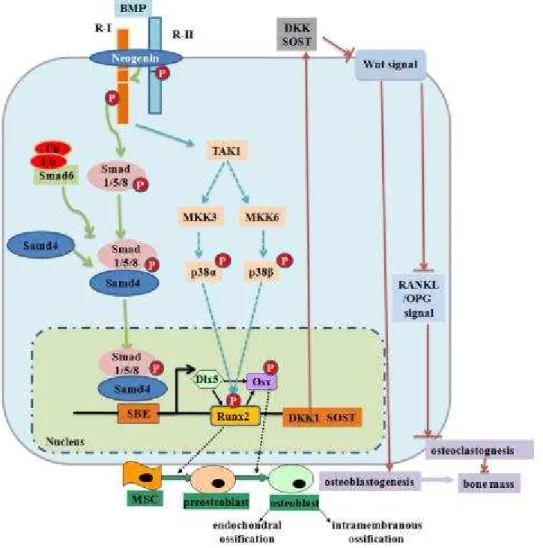
9 A via das BMPs implica a ligação destas proteínas aos receptores tirosina cinase I e II, presentes na superfície celular que, por sua vez, vão desencadear a activação das Smads 1,5 e 8 que vão formar um complexo com a Smad 4 e sofrer uma translocação para o núcleo das células. Uma vez no núcleo este complexo vai interagir com outras proteínas, de modo a regular os factores de transcrição envolvidos na diferenciação osteoblástica. Os factores de transcrição envolvidos na diferenciação dos osteoblastos são o Runx2 e o Osterix, sendo que o Runx2 está envolvido na diferenciação de células mesenquimatosas em pré-osteoblastos e o Osterix está envolvido na diferenciação de pré-osteoblastos em osteoblastos maduros (Figura 2) (9).
Figura 2: Representação esquemática da via BMP na diferenciação osteoblástica. A BMP
liga-se ao receptor tipo I e II e o sinal é traduzido para as Smads 1/5/8 que vão formar um complexo com a Smad4 e sofrer uma translocação para o núcleo. Uma vez no núcleo este complexo vai regular uma série de factores de transcrição importantes na diferenciação osteoblástica como o Runx2 e o Osterix (Osx).
Chen G, Deng C, Li YP. TGF-beta and BMP signaling in osteoblast differentiation and bone formation. International journal of biological sciences. 2012;8(2):272-88.
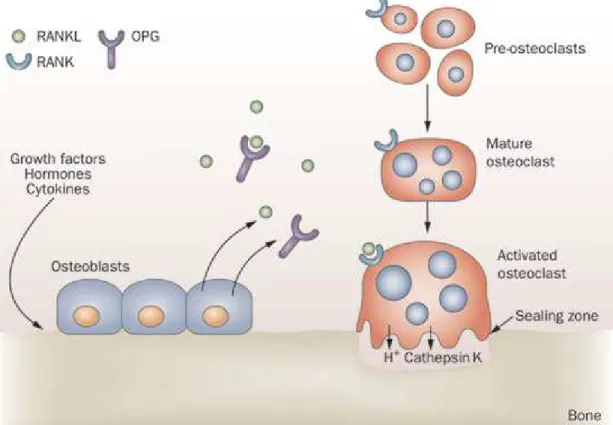
10 Os osteócitos formam-se a partir de osteoblastos durante o processo de formação óssea, quando estes ficam embutidos na matriz óssea, em cavidades denominadas lacunas, com os seus prolongamentos citoplasmáticos estendendo-se através de canalículos na matriz óssea (8). Por fim, os osteoclastos são células multinucleadas, adaptadas para remover matriz óssea mineralizada, estando portanto envolvidos no processo de reabsorção óssea. Este tipo celular tem origem na linhagem mieloide e a sua sobrevivência, expansão e diferenciação depende de citocinas críticas como o M-CSF-1 e o RANKL (8, 12). O RANKL é um membro da família TNF, expresso por osteoblastos e células do estroma da medula óssea, cuja interacção com o seu receptor RANK, presente na superfície dos precursores dos osteoclastos, vai estimular a formação e activação dos osteoclastos que é fundamental para a reabsorção óssea (12, 13). Esta acção pode ser inibida pela OPG, um receptor solúvel, secretado principalmente por osteoblastos e células do estroma da medula óssea, que se vai ligar ao RANKL, prevenindo deste modo a sua interacção com o RANK que é essencial para a maturação e activação dos osteoclastos (Figura 3) (14, 15).
Figura 3: Representação do sistema RANK/RANKL/OPG na modulação da reabsorção óssea. A ligação do RANKL ao RANK vai ser essencial para a maturação e activação dos
osteoclastos. A OPG vai-se ligar ao RANKL e inibir este processo. A secreção de OPG e RANKL pelos osteoblastos vai modular o processo de reabsorção óssea.
Lewiecki EM. New targets for intervention in the treatment of postmenopausal osteoporosis. Nature reviews Rheumatology. 2011;7(11):631-8.
11 Matriz óssea. A matriz óssea é composta por uma parte inorgânica, composta essencialmente por cálcio e fosfato que vão formar cristais de hidroxiapatite e, uma parte orgânica, composta maioritariamente por colagénio tipo I e uma pequena quantidade de proteoglicanos e glicoproteínas. A associação de hidroxiapatite e colagénio confere ao osso a sua rigidez e resistência (16).
Macroscopicamente, o osso pode ser dividido em osso compacto e osso esponjoso. O osso compacto é denso e sólido sem cavidades visíveis, enquanto que o osso esponjoso é formado por várias cavidades que comunicam entre si, formando uma rede trabecular com aspecto em favo de mel. A medula óssea vai-se situar no osso esponjoso, ocupando o espaço deixado pelas cavidades e, também, no canal medular dos ossos longos, sendo revestida por osso compacto. O osso compacto é composto de osteons ou sistemas de Havers que consistem em estruturas lamelares concêntricas em torno de um canal vascular, ou canal de Haver. Os osteons comunicam entre si através de canais de Volkmann. O osso esponjoso é também composto por uma estrutura lamelar, no entanto as trabéculas são finas e geralmente não são penetradas por vasos. O osso é revestido externamente pelo periósteo, uma camada de tecido conjuntivo fibroso que contém vasos sanguíneos, fibras nervosas e células osteoprogenitoras e cuja adesão à superfície óssea é feita através de fibras de Sharpey. A superfície interna do osso compacto, trabecular e canais vasculares é revestida pelo endósteo, sendo este constituído por uma camada de células osteogénicas (17).
12
Patogénese
O mieloma múltiplo é uma neoplasia com uma afinidade particular pela medula óssea, sendo que é nesse ambiente que as células neoplásicas vão exercer a sua acção que posteriormente irá levar a uma série de alterações no metabolismo ósseo. O
microambiente da medula óssea consiste numa série de componentes celulares, como células hematopoiéticas, células imunes, células do estroma, osteoclastos, osteoblastos e células endoteliais, envolvidos numa matriz extracelular (18).
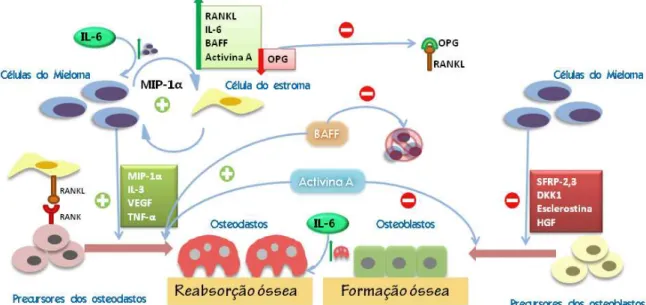
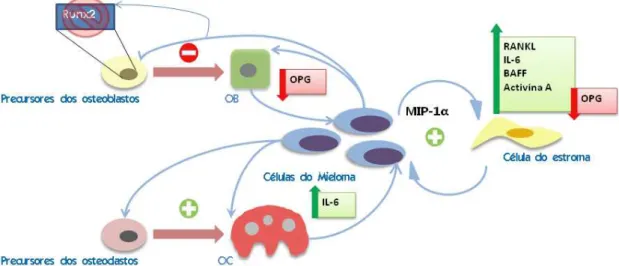
A patogenia do mieloma múltiplo inicia-se com a migração e fixação das células do mieloma na medula óssea, o que é conseguido através da expressão de SDF-1 pelas células do estroma que se vão ligar ao receptor CXCR4 das células do mieloma e induzir o seu sequestro na medula óssea (19). Uma vez na medula óssea, as células do mieloma vão introduzir diversas alterações na sua homeostasia que vão provocar um aumento da reabsorção óssea e uma inibição da sua formação (figura 4).
Figura 4: Representação esquemática das acções das células do mieloma na medula óssea.
As células do mieloma vão ser capazes de secretar moléculas que promovem a diferenciação osteoclástica e moléculas que inibem a diferenciação osteoblástica. A interacção com as células do estroma, potenciada pela MIP-1α, vai aumentar os níveis de RANKL, IL-6, BAFF e Activina A e diminuir os de OPG pelas mesmas. A ligação do RANKL ao RANK vai estimular a maturação e activação dos osteoclastos, a Activina A vai estimular a diferenciação osteoclástica e inibir a diferenciação osteoblástica, o BAFF vai estimular a diferenciação osteoclástica e inibir a apoptose das células do mieloma e a IL-6 vai promover a proliferação das células do mieloma e osteoclastos. Os baixos níveis de OPG e os elevados níveis de RANKL vão inibir a ligação OPG RANKL. Como resultado, vai haver um aumento da reabsorção óssea e uma diminuição da sua formação.
13
Reabsorção óssea. De modo a promover a activação osteoclástica e consequente
reabsorção óssea, as células do mieloma são capazes de produzir várias moléculas como a MIP-1α, IL-3, VEGF e TNF-α. A MIP-1α é uma quimiocina que vai estimular directamente a formação e diferenciação osteoclástica através da ligação aos receptores CCR1 e CCR5 que são expressos pelos percursores dos osteoclastos (20). A IL-3 é uma citocina que induz a formação osteoclástica, actuando em fases precoces da diferenciação, ao promover o aumento do número dos precursores dos osteoclastos que, posteriormente, serão diferenciados em osteoclastos maduros pela acção da MIP-1α e RANKL (21). O VEGF é também uma citocina secretada pelas células do mieloma que se vai ligar ao receptor VEGFR1 presente nos osteoclastos, estimulando a sua sobrevivência e reabsorção óssea (22). Foi também observado que o VEGF pode substituir o M-CSF na indução da diferenciação osteoclástica (23). Por fim, as células do mieloma são também capazes de secretar TNF-α que é capaz de induzir a formação osteoclástica, através da estimulação da produção de RANKL pelas células do estroma e, também, pela acção directa sobre os precursores dos osteoclastos, potenciando o efeito do RANKL sobre estas células (24). Existe também a possibilidade das células do mieloma expressarem RANKL, mas ainda não existe consenso relativamente a este assunto (25, 26). No entanto, apesar da expressão de RANKL ser incerta, sabe-se que as células do mieloma têm a capacidade de diminuir a acção da OPG através de dois mecanismos, sendo que o primeiro é a sua capacidade de interiorizar e degradar a OPG e o segundo é a ligação da OPG ao syndecan-1, expresso na superfície das células do mieloma, que vai impedir a sua interacção com o RANKL (27).
Inibição da formação óssea. Para além de factores envolvidos na reabsorção
óssea, as células do mieloma são também capazes de produzir moléculas envolvidas na inibição da formação óssea como as sFRP-2 e 3, a DKK1, a esclerostina e o HGF. As sFRP-2 e 3, a DKK1 e a esclerostina são todas moléculas envolvidas na inibição da via canónica Wnt. As sFRPs vão inibir as Wnts, interferindo com a ligação das proteínas Wnt ao receptor frizzled, enquanto que a DKK1 e a esclerostina se vão ligar ao co-receptor LRP-5/6 (11, 28). Deste modo, as proteínas Wnt não serão capazes de se ligar às células e inibir a degradação das β-cateninas que, sendo assim, não serão translocadas para o núcleo onde iriam activar os factores de transcrição para a diferenciação osteoblástica (Figura 2). O HGF parece estar envolvido na via de sinalização das BMPs, actuando através de uma série de mecanismos que vão impedir a translocação do complexo das Smads para o núcleo, inibindo a osteoblastogénese (29).
14
Contacto celular directo. As células do mieloma são também capazes de interagir
com os vários tipos celulares através de contacto directo (Figura5).
Figura 5: Representação das interacções entre as células do mieloma e os diferentes tipos celulares da medula óssea. As células do mieloma vão interagir com as células do estroma e
promover o aumento de RANKL, IL-6, BAFF e Activina A e a diminuição de OPG. Vão também interagir com os osteoblastos, diminuindo a produção de OPG, e com os seus precursores, inibindo a sua diferenciação através do bloqueio do RunX2. A sua interacção com os osteoclastos vai aumentar os níveis de IL-6 e o envolvimento com os seus precursores vai promover a diferenciação osteoclástica.
A adesão das células do mieloma às células do estroma através da integrina α 4-β1 e VCAM-1, respectivamente, vai regular positivamente vários factores como o RANKL, IL-6, BAFF e activina A e também inibir a produção de OPG, sendo que esta interação entre os dois tipos celulares é favorecida pela MIP-1α (30). A IL-6 é uma citocina produzida pelas células do estroma que actua como factor de crescimento para osteoclastos e células do mieloma, estimulando a sua proliferação e prevenindo a apoptose (31). Para além disso, verificou-se que a IL-6 era também responsável pela diferenciação do subtipo celular Th17 produtor de IL-17 e que, esta citocina, estava envolvida na activação osteoclástica e correlacionava-se directamente com as lesões líticas, independentemente da carga tumoral, sugerindo que a carga imunológica possa ser mais importante que a carga tumoral para a destruição óssea (32). O BAFF é um membro da super família TNF envolvido na manutenção da homeostasia e desenvolvimento normal das células B, tendo-se observado que promove a sobrevivência das células do mieloma e a osteoclastogénese, por um processo independente do RANKL (33, 34). Para finalizar, a activina A é um membro da família TGF-β que actua como modeladora da remodelação óssea, promovendo a diferenciação osteoclástica e
15 inibindo a diferenciação osteoblástica e cujos níveis elevados estão associados a doença óssea avançada (35).
Para além da interacção com as células do estroma, as células do mieloma vão também aderir directamente aos osteoclastos numa relação recíproca, em que as células do mieloma promovem a diferenciação osteoclástica e, os osteoclastos promovem o crescimento e sobrevivência das células do mieloma, através da secreção de factores como a IL-6. (36). Foi também sugerido que as células do mieloma se pudessem mesmo fundir com os osteoclastos, formando células híbridas com uma capacidade erosiva superior (37).
As células do mieloma vão também exercer a sua acção sobre os osteoblastos, diminuindo a sua produção de OPG (26). Para além disso, também vão impedir a sua diferenciação ao inibirem o Runx2 nos seus precursores, por contacto directo e secreção de IL-7 (38).
Para finalizar, observou-se que, de forma peculiar, apesar das células do mieloma estarem relacionadas com a diminuição dos níveis de OPG, este receptor pode ser benéfico para a sua sobrevivência, já que tem a capacidade de se ligar ao TRAIL, um membro da família TNF que está envolvido na apoptose de células neoplásicas, inibindo a sua acção (39).
16
Manifestações Clínicas
As alterações provocadas pelas células neoplásicas no ambiente da medula óssea, referidas anteriormente, vão ter diversas implicações no metabolismo ósseo e criar diversas complicações como dor óssea incapacitante, hipercalcemia, fracturas patológicas e síndromes de compressão medular.
A dor óssea é a apresentação clínica mais comum, ocorrendo em 67% dos casos ao diagnóstico (40). A origem da dor pode ter vários mecanismos, incluindo uma pressão intraóssea aumentada provocada pelas células neoplásicas, microfracturas, irritação do periósteo, espasmos musculares ou compressão nervosa por vértebras colapsadas. Para além disso, pode também estar relacionada com uma acção directa dos plasmócitos sobre os tecidos neurais ou resultar de comorbilidades como osteoporose ou artrite degenerativa. A dor é intensa e tem um caracter crónico e contínuo com localização preferencial na região dorsal, afectando de forma significativa a qualidade de vida dos doentes(41).
As fracturas patológicas são também um evento comum e estão muitas vezes associadas a dor óssea. De facto, dois terços das fracturas que ocorrem no mieloma múltiplo são patológicas, enquanto que na população em geral a percentagem de fracturas patológicas é de 2%. O esqueleto axial é o mais afectado, acometendo cerca de 78% das fracturas, o que pode estar relacionado com a ausência de medula hematopoiética nas regiões periféricas do esqueleto na população mais idosa. As fracturas patológicas devido a lesões osteolíticas são mais comuns que as osteoporóticas, no entanto estas também têm uma incidência aumentada em pacientes com mieloma. A ocorrência de fracturas patológicas prévias, o tratamento com corticoides e quimioterapia são factores de risco para o aparecimento de fracturas (42).
A hipercalcemia ocorre em 15-30% dos casos juntamente com a insuficiência renal (43). A sua principal causa é a destruição óssea provocada pelo mieloma com consequente reabsorção óssea aumentada e efluxo de cálcio para o fluido extracelular. Como os pacientes com mieloma frequentemente têm disfunção renal e uma reabsorção tubular de cálcio aumentada, a capacidade dos rins para eliminar o excesso de cálcio é comprometida, provocando um aumento dos seus níveis séricos. No entanto, nem todos os doentes com doença óssea significativa desenvolvem hipercalcemia, sendo que esta ocorre com mais frequência em fases avançadas da doença e com volume tumoral elevado. Raramente, a hipercalcemia também pode ser devida à secreção de PTHrP pelas células tumorais, no entanto este mecanismo é muito mais comum em tumores sólidos (44). Os sintomas de hipercalcemia estão essencialmente relacionados com a depleção de volume e disfunção neuromuscular, no entanto, geralmente os sintomas só
17 se tornam evidentes com valores acima de 12 mg/dl. O aumento dos níveis de cálcio vai provocar uma incapacidade de concentração da urina com consequente perda de água e depleção de volume que vai provocar os sintomas iniciais de poliúria e sede. A depleção de volume vai diminuir a taxa de filtração glomerular, o que dificulta a excreção de cálcio, perpetuando deste modo a hipercalcemia num ciclo vicioso. A disfunção neurológica é proeminente e pode manifestar-se como confusão, agitação, estupor e coma. Para além disso, a hipercalcemia vai também cursar com uma série de sintomas gastrointestinais, secundários à hipotonicidade do músculo liso, como obstipação, náuseas, vómitos e dor abdominal, sendo que os vómitos podem agravar a depleção de volume. Efeitos a nível cardíaco, como bradiarritmias e bloqueios, nefrolitíase e pancreatite são também eventos frequentes na hipercalcemia (45).
Os síndromes de compressão medular ocorrem mais raramente que as entidades descritas até aqui, no entanto o mieloma múltiplo é uma das neoplasias que mais frequentemente causa compressão medular (46). O mecanismo mais comum é o colapso vertebral devido à destruição óssea com consequente compressão medular. O sintoma mais frequente e mais precoce é dor na região dorsal que pode ser localizada à coluna vertebral ou ser uma dor radicular envolvendo um trajecto nervoso, podendo afectar um ou ambos os lados do corpo. A dor normalmente é incapacitante, sendo descrita uma intensidade média de 8 em 10. A fraqueza dos membros é o segundo sintoma mais comum e frequentemente é precedida por dor. Os sintomas sensoriais são também comuns e incluem parestesias e hipoestesias. Numa fase mais tardia pode surgir disfunção autonómica que raramente ocorre sem sintomas e manifesta-se através de retenção e incontinência urinária e obstipação. A maioria dos casos ocorre ao nível da coluna torácica, o que pode estar relacionado com o facto do canal vertebral ser mais estreito nessa região (47).
18
Diagnóstico
Raio-X
O raio-X convencional é o método mais utilizado para avaliar a doença óssea no mieloma. As lesões líticas nos ossos planos do crânio e na região pélvica são tipicamente lesões escavadas ou recortadas, sem esclerose reactiva do osso envolvente, enquanto que nos ossos longos há varias apresentações possíveis, desde uma série de erosões no endósteo, lesões líticas pequenas e grandes lesões destrutivas (Figura 6) (48, 49).
Figura 6: Fractura patológica do úmero direito com evidência de múltiplas lesões líticas.
Nair SR, Pearson SB. Images in clinical medicine. Pathologic fracture and lytic lesions in multiple myeloma. The New England journal of medicine. 2004;351(18):1874.
19 Estas lesões correspondem a uma substituição nodular da medula óssea por plasmócitos com completa destruição óssea (50).
Uma inspecção óssea completa deve incluir incidências posteroanterior, anteroposterior e lateral da coluna cervical (incluindo com a boca aberta), torácica, lombar, úmero e fémur, anteroposterior e lateral do crânio e anteroposterior da pélvis. Numa inspecção óssea, quase 80% dos pacientes diagnosticados pela primeira vez com mieloma múltiplo, apresenta evidência radiológica de envolvimento do esqueleto em que as zonas mais afectadas são as vértebras (65%), costelas (45%), crânio (40%), ombros (40%), pélvis (30%) e ossos longos (25%) (48).
No entanto, apesar da sua utilidade o raio-X apresenta várias limitações, sendo que a de maior relevância é a sua baixa sensibilidade, já que as lesões líticas apenas são visíveis quando há perda de 30% do osso trabecular (50). Para além disso, também não é possível avaliar de modo preciso a osteopenia que pode ser a única manifestação do mieloma em 15% dos pacientes e está associada a um risco aumentado de colapso vertebral (48, 50). Outra limitação do exame radiográfico é a sua incapacidade para avaliar a resposta à terapêutica, já que as lesões ósseas líticas raramente mostram evidência de cura e, novas fracturas de compressão, nem sempre indicam progressão da doença e podem ocorrer devido à perda óssea contínua ou redução da massa tumoral que suportava o córtex ósseo (50). Para finalizar, o raio-X ainda apresenta como inconvenientes falta de acuidade para a visualização de algumas áreas, especificidade reduzida devido a causas benignas de osteopenia e um período longo na sala de exame que pode não ser bem tolerado por pacientes com dores intensas e doença lítica extensa (48).
Posto isto, apesar da radiografia continuar o procedimento padrão de diagnóstico para a doença óssea lítica no mieloma múltiplo, pode ser necessário recorrer a outros exames.
Ressonância Magnética (RM)
A RM tem sido amplamente utilizada e é um exame mais sensível que a radiografia na detecção de lesões osteolíticas, tendo-se verificado que a RM identifica anormalidades da medula em 30-50% dos pacientes com exame radiológico normal. Esta sensibilidade aumentada está associada à possibilidade da RM identificar infiltração da medula que é classificada de acordo com cinco padrões, sendo que o primeiro implica apenas uma infiltração microscópica mínima de plasmócitos, o segundo um envolvimento focal, o terceiro uma infiltração difusa homogénea, o quarto uma combinação de
20 infiltração focal e difusa e o quinto é caracterizado por um padrão sal e pimenta em que há uma medula heterógenea intercalada com ilhas de gordura (51). Foi observado que um padrão difuso está associado a doença mais grave e com pior prognóstico, devendo-se suspeitar de uma carga tumoral elevada na predevendo-sença de alterações difusas hipointensas em T1, hiperintensas em T2 e que são intensificadas pela injecção de gadolínio (52).
Para além disso, a RM também vai permitir avaliar a resposta à terapêutica, contrariamente à radiografia, tendo sido verificado que uma resposta completa ao tratamento implicava uma resolução completa da anormalidade prévia na RM e uma resposta parcial era demonstrada pela conversão do padrão da RM de difuso para focal (53).
Para além disso, foi também verificado que pacientes com um exame radiológico normal, mas achados anormais na RM magnética, têm um risco maior de progressão para mieloma múltiplo sintomático, suscitando a hipótese deste exame poder ter um papel mais activo na definição da doença (54).
FDG-PET/CT
O FDG-PET/CT é mais um dos recursos disponíveis para avaliar a doença óssea no mieloma múltiplo.
O FDG captado pode ser facilmente localizado anatomicamente, a actividade hipermetabólica intramedular e extramedular é facilmente distinguível e a destruição óssea pode ser reconhecida em pacientes com mieloma. É um exame com uma sensibilidade de 85% e uma especificidade de 92% (55). Foi também observado que a RM era mais sensível que a PET/CT em certas áreas, no entanto o contrário também se verifica em que a PET/CT consegue ser mais sensível que a RM em certas zonas, o que sugere que a combinação da PET/CT e da RM possa alcançar uma sensibilidade bastante elevada na detecção de lesões ósseas. No entanto, ainda são necessários mais estudos previamente à utilização alargada desta associação (56).
Outros exames de imagem
A cintigrafia óssea consegue detectar lesões líticas em 35-60% dos pacientes com mieloma múltiplo, no entanto a sua sensibilidade e especificidade para o diagnóstico e seguimento da doença são inferiores ao exame radiográfico, não sendo, portanto, um exame recomendado para os pacientes com mieloma múltiplo (48).
21
Marcadores Ósseos
Os marcadores bioquímicos de turnover ósseo podem fornecer informação dinâmica acerca da velocidade do turnover ósseo e podem ser medidos através de amostras de sangue ou urina, sendo que a formação e a reabsorção óssea podem ser avaliadas separadamente.
Os marcadores ósseos podem ser divididos em duas categorias, podendo ser fragmentos de colagénio, libertados durante a destruição da estrutura em hélix tripla constituinte do osso, ou enzimas libertadas pelos osteoblastos ou osteoclastos.
Os fragmentos de colagénio incluem telopeptídeos de colagénio tipo 1, nomeadamente o NTX, CTX, ICTP e DPD que são produtos derivados da degradação do colagénio mediada pela acção osteoclástica e, por isso, são marcadores de reabsorção óssea. Os marcadores de formação óssea incluem o PINP e o PINC que são produtos da clivagem de procolagénio em colagénio, logo os seus níveis irão reflectir a quantidade de matrix óssea formada de novo.
As enzimas vão incluir a TRACP-5b, a FAOS e a osteocalcina, sendo que a TRACP-5b é secretada pelos osteoclastos e é usada como um marcador do seu número e actividade, enquanto que a FAOS e a osteocalcina são produzidas pelos osteoblastos e permitem medir o número e actividade dos osteoblastos (7).
Verificou-se que os níveis dos marcadores ósseos estão relacionados com o grau de reabsorção ou formação óssea e que os marcadores de reabsorção diminuem com fármacos que bloqueiam a reabsorção óssea (57). No entanto, ao utilizar marcadores bioquímicos é importante considerar que existem diversos factores que influenciam os seus níveis como a idade, género, fármacos, função renal e hepática e a dieta, especialmente os marcadores de colagénio que são particularmente sensíveis à ingestão de alimentos (7).
Apesar das características atractivas dos marcadores ósseos para a gestão da doença óssea no mieloma múltiplo, ainda não existe consenso sobre a sua utilização para monitorização da doença e resposta ao tratamento.
22
Tratamento
O mieloma múltiplo, apesar de parecer morfologicamente semelhante, é uma doença heterogénea, com diversos subtipos identificados, a nível molecular e genético, que vão determinar diferentes evoluções da doença e resposta ao tratamento. Posto isto, torna-se essencial uma estratificação do risco que permita abordagens adaptadas e um tratamento individualizado, com vista a alcançar o melhor resultado terapêutico possível. Para além disso, é também necessário diferenciar a possibilidade ou não de se realizar transplante, o que irá depender de diversos factores, como a idade e as comorbilidades do paciente, e irá ter implicações no tratamento a utilizar. Os agentes mais utilizados no tratamento do mieloma incluem fármacos imunomoduladores, como a talidomida e lenalidomida, inibidores dos proteossomas, como o bortezomibe, corticoides, onde se inclui a dexametasona e agentes alquilantes, nomeadamente o melfalan, no entanto este agente só deve ser utilizado em pacientes que não são candidatos a transplante, já que este fármaco compromete a reserva de células estaminais (58). No entanto, independentemente do esquema terapêutico utilizado, o mieloma continua a ser uma doença incurável em que o tratamento concomitante das comorbilidades associadas é essencial, nomeadamente o da doença óssea que é particularmente exuberante nesta neoplasia.
O tratamento da doença óssea no mieloma múltiplo implica o controlo das diversas complicações já referidas como a dor, hipercalcemia, fracturas patológicas e síndromes de compressão medular. No tratamento da dor vai ser importante uma analgesia adequada, o uso de bifosfonatos e também o uso de terapêuticas não farmacológicas como a radioterapia ou ciflopastia, em caso de colapso vertebral. O tratamento da hipercalcemia vai-se basear essencialmente na hidratação e vai também beneficiar do uso de bifosfonatos. A abordagem das fracturas patológicas e dos síndromes de compressão medular vai-se basear na sua prevenção que mais uma vez será feita através do uso de bifosfonatos, no entanto, caso se verifique a sua ocorrência o tratamento será baseado na radioterapia ou cifoplastia, sendo que o tratamento cirúrgico tem sido cada vez menos utilizado. Pode-se então constatar que os bifosfonatos são um componente essencial do tratamento, actuando a todos os níveis da doença óssea, no entanto o seu uso prolongado acarreta algumas limitações o que levou ao desenvolvimento de novos fármacos como o denosumab.
23
Analgesia
O controlo da dor deve-se iniciar com uma avaliação do grau de dor que pode ser feita através de uma escala numérica de 0-10 em que o 0 corresponde a ausência de dor e o 10 ao nível máximo de dor (41). Os pacientes com mieloma normalmente apresentam uma dor moderada ou grave pelo que a terapêutica opióide será a mais indicada. Os AINEs, apesar de poderem ser benéficos na dor óssea, devem ser utilizados com precaução devido à disfunção renal associada aos pacientes com mieloma e risco de agravar esta condição. Na dor moderada podem ser utilizados opióides fracos como a codeína ou o tramadol, no entanto para a dor grave devem ser utilizados opióides mais fortes como a morfina, oxicodona, hidromorfona ou fentanil (41, 59).
Os opióides devem ser administrados de forma oral, excepto nas exacerbações agudas em que a via preferencial é a endovenosa ou subcutânea, caso não seja possível obter um acesso venoso. A dose dos opióides deve ser titulada até se alcançar a analgesia desejável com efeitos laterais toleráveis.
No tratamento com opióides é importante a prevenção e controlo dos efeitos laterais como obstipação, náuseas, sedação, confusão, delírio ou mioclonias. A falência respiratória é rara na utilização crónica de opióides se o aumento da dose for gradual, no entanto, é necessário precaução em pacientes com patologia respiratória de base em que a falência respiratória pode ocorrer mesmo com doses baixas (41).
No caso da analgesia desejada não ser alcançada ou do paciente não tolerar os efeitos laterais, deve-se considerar a substituição para um opióide alternativo, tendo sempre em conta a dose equivalente devido às diferentes potências dos vários opióides (41, 59).
Controlo da Hipercalcemia
O componente essencial do tratamento da hipercalcemia é a reposição de volume que deve ser feita em função da perda de volume do paciente em questão, no entanto em caso de crises hipercalcémicas, com valores séricos acima dos 14 mg/dl, deve ser realizada através da administração de 500-1000ml de solução salina 0,9% durante a primeira hora e 2-6 litros nas primeiras 24 horas. Se houver o risco de compromisso da função cardíaca, deve-se considerar a utilização de um diurético de ansa, como a furosemida que apenas deve ser administrado após a reposição de volume.
Os bifosfonatos são também um componente importante da terapia da hipercalcemia e os mais utilizados são o pamidronato e o ácido zoledrónico. Em casos de
24 hipercalcemia grave a sua administração deve ser feita o mais precocemente possível, já que existe um período de latência de 2 a 5 dias até se verificar o seu efeito (45).
Contrariamente aos tumores sólidos, a hipercalcemia dos pacientes com mieloma responde muito prontamente ao tratamento com corticoides devido à rápida supressão tumoral (44).
Bifosfonatos
Os bifosfonatos são análogos sintéticos do pirofosfato e têm uma alta afinidade para a hidroxiapatite no osso. Após administração são rapidamente eliminados do sangue e incorporados na matrix óssea ou excretados pelos rins. Existem três gerações de bifosfonatos que podem ser diferenciadas pela presença ou ausência de um átomo de nitrogénio (60). Quando o osteoclasto degrada o osso, o bifosfonato é captado através de endocitose e causa apoptose quer por incorporação na adenosina trifosfato não funcional, no caso dos bifosfonatos sem nitrogénio, quer por inibição da sintetase farnesil pirofosfato, no caso de bifosfonatos com nitrogénio (61).
Classes de bifosfonatos. As diferentes classes de bifosfonatos vão então incluir o
etidronato e o clodronato que não possuem nitrogénio, o ibandronato e o pamidronato com um atómo de nitrogénio e o ácido zoledrónico com dois átomos de nitrogénio (62).
O etidronato não foi associado a melhoria na prevenção de novas fracturas, hipercalcemias episódicas ou dor óssea, não tendo, portanto, nenhum benefício clínico na doença óssea no mieloma múltiplo (63, 64).
O clodronato foi avaliado em doses orais diárias de 2,4g e de 1,6g, sendo que o seu efeito mais consistente foi a redução de lesões líticas (65-68). No entanto, foi também observado que a administração diária de 1,6g de clodronato oral podia melhorar a hipercalcémia, diminuir a progressão de fracturas não vertebrais e aos 24 meses de tratamento podia também oferecer benefícios ao nível da dor óssea e estado funcional. Para além disso, nos pacientes que inicialmente não apresentavam fracturas vertebrais houve uma melhoria da sobrevida de 22 meses (67, 68).
O pamidronato foi avaliado como formulação oral e endovenosa, sendo que a administração oral de 300mg diários não apresentou benefícios na diminuição de eventos ósseos, apesar de ter reduzido o número de episódios de dor grave (69). A administração endovenosa de pamidronato foi avaliada através da infusão mensal de 90mg que obteve resultados positivos com uma diminuição de eventos ósseos, melhoria da dor e da qualidade de vida (70, 71). Não se observou uma melhoria no tempo de sobrevida com excepção de um subgrupo que apresentava doença mais avançada (71).
25 O Ibandronato foi avaliado em administrações endovenosas de 2 e 4mg. A infusão mensal de 2mg não apresentou resultados satisfatórios, não havendo redução da morbilidade óssea ou melhoria da sobrevida (72). Com a dose aumentada de 4mg obteve resultados semelhantes ao pamidronato na redução de eventos ósseos mas o pamidronato revelou-se superior em reduzir os níveis dos marcadores de reabsorção óssea, IL-6 e microglobulinas-β2 (73).
O ácido zoledrónico é também administrado de forma endovenosa e foram estudadas diferentes doses e tempos de infusão, tendo-se observado que a administração que apresentava maior benefício dentro de parâmetros de segurança aceitáveis seria a de 4mg com um tempo de infusão de 15 minutos cada 3 a 4 semanas (74, 75). Nesta formulação o ácido zoledrónico apresentou resultados semelhantes ao pamidronato à excepção da melhoria da hipercalcemia maligna em que se revelou superior (75-77). Existe muita controvérsia em relação à possibilidade dos bifosfonatos terem efeito na sobrevida, no entanto observações recentes indicam que ainda não foi comprovado um efeito significativo, mas pensa-se que este efeito poderá estar relacionado com a potência do fármaco, o que torna o ácido zoledrónico o agente com maior probabilidade de o conseguir, tendo em conta que é o bifosfonato mais potente (78).
Efeitos adversos. Para além dos efeitos benéficos sobre a doença óssea, os bifosfonatos também apresentam efeitos adversos como hipocalcemia, hipofosfatemia, distúrbios gastrointestinais na administração oral e reacções de fase aguda na administração endovenosa. A disfunção renal e a osteonecrose da mandíbula são consequências raras, mas as que apresentam maior gravidade (79).
A hipocalcemia geralmente é ligeira e assintomática, no entanto já foram observados casos de hipocalcemia graves (79, 80).
A disfunção renal é dependente da concentração do bifosfonato na circulação, observando-se um risco mais elevado após administrações de doses altas ou infusões rápidas (79).
No entanto, a complicação mais temida do uso de bifosfonatos é a osteonecrose
da mandíbula. Esta patologia, na maioria dos casos (70%) ocorre após procedimentos
dentários, no entanto, também pode ocorrer espontaneamente (30%) (81). A etiologia da osteonecrose da mandíbula permanece controversa, mas foram sugeridas várias hipóteses, como a acumulação de microfracturas provocadas pela inibição osteoclástica ou falta de aporte sanguíneo devido à acção antiangiogénica dos bifosfonatos (82). A incidência da osteonecrose da mandíbula aumenta com a duração do tratamento e com a potência do bifosfonato, sendo que o ácido zoledrónico é o que apresenta maior risco de desenvolver a patologia (83, 84). Assim que se estabelece, a osteonecrose da mandíbula
26 é bastante difícil de tratar e o tratamento cirúrgico pode até agravar a situação, pelo que foram surgindo várias modalidades de tratamento como terapia com laser, oxigénio hiperbárico, antibioterapia prolongada, transplante de medula óssea autólogo ou terapia com ozono(85-90).
Quem tratar. Após analisar os benefícios e limitações do uso dos bifosfonatos
concluiu-se que o seu uso está recomendado para todos os pacientes com lesões ósseas líticas visíveis no raio-X ou osteoporose, sendo também recomendado, com menor grau de evidência, o seu uso em pacientes com osteopenia ou que não tenham lesões líticas visíveis por radiografia (79). A evidência para o tratamento em pacientes com mieloma assintomático é muito precária (91, 92).
Escolha do bifosfonato. Em relação ao bifosfonato a utilizar o pamidronato e o ácido zoledrónico foram os que mostraram maior benefício, como referido anteriormente, mas ainda não existe consenso sobre qual deva ser utilizado, ficando ao critério do clínico. Ambos têm eficácia semelhante, no entanto a utilização do pamidronato parece ter menor associação com o desenvolvimento de osteonecrose da mandíbula, mas tem um tempo de infusão mais longo. Por outro lado, o ácido zoledrónico, apesar de apresentar um risco superior em relação ao desenvolvimento de osteonecrose da mandíbula, tem um tempo de infusão mais curto e existe a possibilidade de apresentar uma vantagem relativamente à sobrevida.
Duração do tratamento. A duração do seu tratamento é um assunto de maior
controvérsia, não havendo um nível de evidência elevado para as recomendações actuais, sendo que se defende que, caso não haja uma resposta completa ou uma boa resposta parcial ao tratamento para o mieloma, o ácido zoledrónico deve ser administrado para além de dois anos até à progressão da doença e mantido nas recaídas, devido ao possível benefício na sobrevida. Em relação ao pamidronato as recomendações são diferentes, ficando ao critério do clínico a manutenção do pamidronato em doentes com doença activa que não obtêm resposta ao tratamento. Para pacientes que obtiveram uma resposta completa ou uma boa resposta parcial defende-se que os bifosfonatos devem ser administrados pelo menos durante um ano e não mais de dois, devido à ausência de benefício na sobrevida e ao risco de osteonecrose da mandíbula com o prolongamento do tratamento (79, 93).
Prevenção dos efeitos adversos. A hipocalcemia pode ser controlada através de
suplementos de cálcio e vitamina D3, no entanto nos pacientes com insuficiência renal esta administração deve ser feita com precaução. A depuração de creatinina deve ser avaliada antes de cada infusão de bifosfonatos e, caso se verifique uma disfunção renal ligeira ou moderada, a dose de ácido zoledrónico e pamidronato deve ser reduzida e o tempo de infusão do pamidronato prolongado. Na disfunção renal grave a administração
27 de pamidronato e ácido zoledrónico não está recomendada. Estratégias para reduzir a incidência de osteonecrose da mandíbula incluem uma avaliação dentária previamente ao tratamento seguida de uma avaliação periódica. Os problemas dentários que surgirem durante o tratamento devem ser abordados de forma conservadora e, caso não seja possível, deve-se interromper o tratamento durante 90 dias antes e depois do procedimento dentário invasivo (79).
Denosumab
O denosumab é um anticorpo humano com alta afinidade para o RANKL que vai simular a OPG fisiológica e bloquear a estimulação osteoclástica pela via NF-κB (7). O denosumab é administrado de forma subcutânea e verificou-se que induz uma inibição sustentada dos marcadores de reabsorção óssea por um período mais longo que os bifosfonatos (35). Foi demonstrado que a administração subcutânea mensal de denosumab, quando comparada com a administração endovenosa de ácido zoledrónico, tem resultados semelhantes relativamente à redução de eventos ósseos, diminuição da dor e melhoria da qualidade de vida (94). No entanto, foi responsável por uma redução superior no marcador de reabsorção óssea NTX (95). Para além disso, também se revelou eficaz em pacientes refractários ao tratamento com bifosfonatos (96).
O denosumab, contrariamente aos bifosfonatos, não apresenta toxicidade renal já que é eliminado por catabolismo intracelular pela acção de fagócitos. No entanto, verificou-se que a incidência de osteonecrose da mandíbula era igual à ocorrida no tratamento com ácido zoledrónico (95).
O denosumab ainda não é um fármaco aprovado para o tratamento da doença óssea no mieloma múltiplo, mas pode vir a ter uma aplicação futura, em especial em doentes com insuficiência renal que não tolerem o uso de bifosfonatos.
Novos agentes
O tratamento da doença óssea no mieloma continua a apresentar limitações, principalmente no seu uso a longo prazo devido aos efeitos laterais que acarreta, sendo necessário o desenvolvimento de novos fármacos mais específicos e com maior segurança e eficácia. Os avanços realizados ao nível da patofisiologia do mieloma permitiram a descoberta de novas moléculas envolvidas na doença, com potencial para alvo terapêutico, o que levou ao início de vários ensaios clínicos para o desenvolvimento de novos fármacos como o BHQ880, ACE011, MLN3897, LY2127399 (Figura 7)(97).
28 Figura 7: Esquema representativo do efeito dos diversos agentes terapêuticos sobre as acções do mieloma.
Agarwal A, Mahadevan D. Novel targeted therapies and combinations for the treatment of multiple myeloma. Cardiovascular & hematological disorders drug targets. 2013;13(1):2-15.
O BHQ880 é um anticorpo humano IgG1 com capacidade para neutralizar o DKK1 que, como referido anteriormente, é responsável pela inibição da via canónica Wnt, inibindo desta forma a proliferação osteoblástica. Este anticorpo tem revelado efeitos promissores nos ensaios clínicos com melhorias na função basal dos osteoblastos e deposição de cálcio, assim como um aumento no número de osteoblastos, osteocalcina e osso trabecular. Para além disso, verificou-se também um efeito anti-mieloma por diminuição dos níveis de IL-6, cuja produção é diminuída ao nível das células do estroma e medula óssea. O BHQ880 ainda apresenta a vantagem de poder contrariar o aumento de DKK1 que se verifica com a utilização de dexametasona que é parte integrante do tratamento do mieloma (98).
O ACE011 é um inibidor da activina A, formado através da fusão do domínio extracelular do receptor de activina IIA e do dominíno constante da IgG1 humana. A sua acção tem sido testada em animais e tem revelado resultados promissores a nível do aumento da formação e inibição da destruição óssea (35).
29 O MLN3897 é um antagonista oral do receptor CCR1, impedindo a sua ligação à MIP-1α e respectivas consequências, nomeadamente diferenciação osteoclástica e indução do crescimento e sobrevivência das células do mieloma. O bloqueio desta interacção tem revelado efeitos benéficos, impedindo a diferenciação osteoclástica e eliminando a sobrevivência e vantagem proliferativa conferida às células do mieloma pelos osteoclastos (99).
Para finalizar o LY2127399 é um anticorpo dirigido ao BAFF que parece ter um efeito anti-mieloma directo com redução da carga tumoral e aumento da sobrevida, assim como um efeito sobre a diferenciação dos osteoclastos, diminuindo o seu número assim como o número de lesões líticas (100).
Radioterapia
A radioterapia tem sido um componente essencial da terapia e dos cuidados paliativos em pacientes com mieloma múltiplo. Alguns estudos demonstraram um efeito curativo para pacientes com plasmacitoma solitário do osso, no entanto a indicação mais comum para o uso desta terapia é uma lesão dolorosa. Numa grande maioria dos pacientes verifica-se um alívio significativo da dor com radioterapia local de 30Gy administrada em 10 a 15 fracções (101).
Outras indicações para o uso de radioterapia incluem o tratamento de fracturas patológicas actuais ou iminentes, compressão da espinal medula, tumor associado a problemas neurológicos e tumores grandes dos tecidos moles. Esta modalidade também se revelou útil na prevenção do desenvolvimento de novas fracturas vertebrais em doentes com mieloma (79, 101, 102).
No entanto, a utilização da radioterapia deve ser feita com moderação, já que provoca danos permanentes na medula óssea, o que é particularmente relevante em pacientes que dependem de agentes que causam perda de função da medula óssea, como a quimioterapia, sendo por isso aconselhável que se irradie a menor porção possível, de modo a preservar o máximo de medula óssea (79, 103).
Cifoplastia e vertebroplastia
A cifoplastia deve ser considerada para fracturas de compressão vertebrais e é o procedimento de eleição para melhorar a qualidade de vida em pacientes com fracturas dolorosas desta natureza (79). Observou-se que a cifoplastia estava associada a
30 melhorias clínicas significativas no alívio da dor, funcionalidade física e capacidade de realizar actividades diárias (104).
A utilização da vertebroplastia no mieloma múltiplo não se encontra tão bem fundamentada, não tendo mostrado benefícios relativamente à terapia conservadora(105). Para além disso, a cifoplastia revelou-se superior no alívio da dor com um risco inferior de extravasamento de cimento (79).
Cirurgia
A intervenção cirúrgica pode ser necessária em pacientes com uma fractura de ossos longos actual ou iminente, compressão óssea da medula ou uma coluna instável, no entanto, é uma modalidade que é cada vez menos utilizada no mieloma múltiplo(79).
31
Conclusão
O mieloma múltiplo continua a ser uma doença incurável que, acomete
principalmente a população idosa, e é responsável por uma grande morbilidade que está associada em grande parte às manifestações ósseas. No entanto, têm sido feitos vários avanços ao nível do entendimento da doença óssea, tendo-se descoberto várias relações entre as células do mieloma e os constituintes da medula óssea, como osteoclastos, osteoblastos e células do estroma que estabelecem relações de reciprocidade com as células do mieloma, promovendo o crescimento e sobrevivência das mesmas, assim como uma destruição do tecido ósseo. A descoberta de novos mecanismos responsáveis pela doença óssea, permitiu também identificar novos alvos terapêuticos que têm sido explorados no desenvolvimento de novos fármacos e têm apresentado resultados promissores nos ensaios clínicos.
A radiografia convencional continua a ser o método de eleição para a avaliação da doença óssea no mieloma múltiplo, no entanto a RM pode fornecer informação adicional dada a sua sensibilidade superior, podendo também ser utilizada para avaliar a resposta à terapêutica.
Os bifosfonatos continuam a ser o tratamento de primeira linha para a doença óssea e estão recomendados para todos os pacientes com mieloma múltiplo,
independentemente da presença ou não de lesões ósseas identificáveis por radiografia. Os bifosfonatos que apresentam maior benefício são o pamidronato e o ácido
zoledrónico, no entanto o único que pode estar associado a um aumento da sobrevida é o ácido zoledrónico. Geralmente os bifosfonatos são bem tolerados, no entanto devem ser adoptadas medidas preventivas no sentido de evitar o desenvolvimento de disfunção renal ou osteonecrose da mandíbula.
A radioterapia deve ser considerada para lesões ósseas dolorosas e a cifoplastia está indicada para o tratamento de fracturas compressivas das vertebras, havendo pouca utilidade para o tratamento cirúrgico que cada vez é menos utilizado no mieloma múltiplo.
32 Bibliografia
1. Blade J, Cibeira MT, Fernandez de Larrea C, Rosinol L. Multiple myeloma. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2010;21 Suppl 7:vii313-9.
2. Dimopoulos MA, Terpos E. Multiple myeloma. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2010;21 Suppl 7:vii143-50. 3. Al-Farsi K. Multiple myeloma: an update. Oman medical journal. 2013;28(1):3-11. 4. Blade J, Kyle RA, Greipp PR. Presenting features and prognosis in 72 patients with multiple myeloma who were younger than 40 years. British journal of haematology. 1996;93(2):345-51.
5. Chou T. Multiple myeloma : recent progress in diagnosis and treatment. Journal of clinical and experimental hematopathology : JCEH. 2012;52(3):149-59.
6. Kyle RA, Gertz MA, Witzig TE, Lust JA, Lacy MQ, Dispenzieri A, et al. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clinic proceedings Mayo Clinic. 2003;78(1):21-33.
7. Hinge M, Lund T, Delaisse J-M, Plesner T. Bone Disease in Multiple Myeloma. 2013.
8. Raggatt LJ, Partridge NC. Cellular and molecular mechanisms of bone remodeling. The Journal of biological chemistry. 2010;285(33):25103-8.
9. Chen G, Deng C, Li YP. TGF-beta and BMP signaling in osteoblast differentiation and bone formation. International journal of biological sciences. 2012;8(2):272-88. 10. Miller JR, Hocking AM, Brown JD, Moon RT. Mechanism and function of signal transduction by the Wnt/beta-catenin and Wnt/Ca2+ pathways. Oncogene.
1999;18(55):7860-72.
11. Krishnan V, Bryant HU, Macdougald OA. Regulation of bone mass by Wnt signaling. The Journal of clinical investigation. 2006;116(5):1202-9.
12. Lacey DL, Timms E, Tan HL, Kelley MJ, Dunstan CR, Burgess T, et al. Osteoprotegerin ligand is a cytokine that regulates osteoclast differentiation and activation. Cell. 1998;93(2):165-76.
13. Hsu H, Lacey DL, Dunstan CR, Solovyev I, Colombero A, Timms E, et al. Tumor necrosis factor receptor family member RANK mediates osteoclast differentiation and activation induced by osteoprotegerin ligand. Proceedings of the National Academy of Sciences of the United States of America. 1999;96(7):3540-5.
14. Simonet WS, Lacey DL, Dunstan CR, Kelley M, Chang MS, Luthy R, et al.
Osteoprotegerin: a novel secreted protein involved in the regulation of bone density. Cell. 1997;89(2):309-19.
15. Lewiecki EM. New targets for intervention in the treatment of postmenopausal osteoporosis. Nature reviews Rheumatology. 2011;7(11):631-8.
16. Viguet-Carrin S, Garnero P, Delmas PD. The role of collagen in bone strength. Osteoporosis international : a journal established as result of cooperation between the European Foundation for Osteoporosis and the National Osteoporosis Foundation of the USA. 2006;17(3):319-36.
17. Clarke B. Normal bone anatomy and physiology. Clinical journal of the American Society of Nephrology : CJASN. 2008;3 Suppl 3:S131-9.
18. Ferrarini M, Mazzoleni G, Steimberg N, Belloni D, Ferrero E. Innovative Models to Assess Multiple Myeloma Biology and the Impact of Drugs. 2013.
19. Alsayed Y, Ngo H, Runnels J, Leleu X, Singha UK, Pitsillides CM, et al.
Mechanisms of regulation of CXCR4/SDF-1 (CXCL12)-dependent migration and homing in multiple myeloma. Blood. 2007;109(7):2708-17.
20. Oba Y, Lee JW, Ehrlich LA, Chung HY, Jelinek DF, Callander NS, et al. MIP-1alpha utilizes both CCR1 and CCR5 to induce osteoclast formation and increase adhesion of myeloma cells to marrow stromal cells. Experimental hematology. 2005;33(3):272-8.
33 21. Lee JW, Chung HY, Ehrlich LA, Jelinek DF, Callander NS, Roodman GD, et al. IL-3 expression by myeloma cells increases both osteoclast formation and growth of
myeloma cells. Blood. 2004;103(6):2308-15.
22. Terpos E, Dimopoulos MA. Myeloma bone disease: pathophysiology and management. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2005;16(8):1223-31.
23. Niida S, Kaku M, Amano H, Yoshida H, Kataoka H, Nishikawa S, et al. Vascular endothelial growth factor can substitute for macrophage colony-stimulating factor in the support of osteoclastic bone resorption. The Journal of experimental medicine.
1999;190(2):293-8.
24. Lam J, Takeshita S, Barker JE, Kanagawa O, Ross FP, Teitelbaum SL. TNF-alpha induces osteoclastogenesis by direct stimulation of macrophages exposed to permissive levels of RANK ligand. The Journal of clinical investigation. 2000;106(12):1481-8.
25. Farrugia AN, Atkins GJ, To LB, Pan B, Horvath N, Kostakis P, et al. Receptor activator of nuclear factor-kappaB ligand expression by human myeloma cells mediates osteoclast formation in vitro and correlates with bone destruction in vivo. Cancer research. 2003;63(17):5438-45.
26. Giuliani N, Bataille R, Mancini C, Lazzaretti M, Barille S. Myeloma cells induce imbalance in the osteoprotegerin/osteoprotegerin ligand system in the human bone marrow environment. Blood. 2001;98(13):3527-33.
27. Standal T, Seidel C, Hjertner O, Plesner T, Sanderson RD, Waage A, et al. Osteoprotegerin is bound, internalized, and degraded by multiple myeloma cells. Blood. 2002;100(8):3002-7.
28. Colucci S, Brunetti G, Oranger A, Mori G, Sardone F, Specchia G, et al. Myeloma cells suppress osteoblasts through sclerostin secretion. Blood cancer journal.
2011;1(6):e27.
29. Standal T, Abildgaard N, Fagerli UM, Stordal B, Hjertner O, Borset M, et al. HGF inhibits BMP-induced osteoblastogenesis: possible implications for the bone disease of multiple myeloma. Blood. 2007;109(7):3024-30.
30. Oyajobi BO, Franchin G, Williams PJ, Pulkrabek D, Gupta A, Munoz S, et al. Dual effects of macrophage inflammatory protein-1alpha on osteolysis and tumor burden in the murine 5TGM1 model of myeloma bone disease. Blood. 2003;102(1):311-9.
31. Cheung WC, Van Ness B. Distinct IL-6 signal transduction leads to growth arrest and death in B cells or growth promotion and cell survival in myeloma cells. Leukemia. 2002;16(6):1182-8.
32. Noonan K, Marchionni L, Anderson J, Pardoll D, Roodman GD, Borrello I. A novel role of IL-17-producing lymphocytes in mediating lytic bone disease in multiple myeloma. Blood. 2010;116(18):3554-63.
33. Tai YT, Li XF, Breitkreutz I, Song W, Neri P, Catley L, et al. Role of B-cell-activating factor in adhesion and growth of human multiple myeloma cells in the bone marrow microenvironment. Cancer research. 2006;66(13):6675-82.
34. Hemingway F, Taylor R, Knowles HJ, Athanasou NA. RANKL-independent human osteoclast formation with APRIL, BAFF, NGF, IGF I and IGF II. Bone. 2011;48(4):938-44. 35. Raje N, Roodman GD. Advances in the biology and treatment of bone disease in multiple myeloma. Clinical cancer research : an official journal of the American
Association for Cancer Research. 2011;17(6):1278-86.
36. Abe M, Hiura K, Wilde J, Shioyasono A, Moriyama K, Hashimoto T, et al. Osteoclasts enhance myeloma cell growth and survival via cell-cell contact: a vicious cycle between bone destruction and myeloma expansion. Blood. 2004;104(8):2484-91. 37. Andersen TL, Soe K, Sondergaard TE, Plesner T, Delaisse JM. Myeloma cell-induced disruption of bone remodelling compartments leads to osteolytic lesions and generation of osteoclast-myeloma hybrid cells. British journal of haematology. 2010;148(4):551-61.
34 38. Giuliani N, Colla S, Morandi F, Lazzaretti M, Sala R, Bonomini S, et al. Myeloma cells block RUNX2/CBFA1 activity in human bone marrow osteoblast progenitors and inhibit osteoblast formation and differentiation. Blood. 2005;106(7):2472-83.
39. Shipman CM, Croucher PI. Osteoprotegerin is a soluble decoy receptor for tumor necrosis factor-related apoptosis-inducing ligand/Apo2 ligand and can function as a paracrine survival factor for human myeloma cells. Cancer research. 2003;63(5):912-6. 40. Kariyawasan CC, Hughes DA, Jayatillake MM, Mehta AB. Multiple myeloma: causes and consequences of delay in diagnosis. QJM : monthly journal of the Association of Physicians. 2007;100(10):635-40.
41. Ozyuvaci E, Akyol O, Sitilci T. Pain and Multiple Myeloma. 2013.
42. Melton LJ, 3rd, Kyle RA, Achenbach SJ, Oberg AL, Rajkumar SV. Fracture risk with multiple myeloma: a population-based study. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research.
2005;20(3):487-93.
43. Angtuaco EJ, Fassas AB, Walker R, Sethi R, Barlogie B. Multiple myeloma: clinical review and diagnostic imaging. Radiology. 2004;231(1):11-23.
44. Oyajobi BO. Multiple myeloma/hypercalcemia. Arthritis research & therapy. 2007;9 Suppl 1:S4.
45. Carroll R, Matfin G. Endocrine and metabolic emergencies: hypercalcaemia. Therapeutic advances in endocrinology and metabolism. 2010;1(5):225-34.
46. Prasad D, Schiff D. Malignant spinal-cord compression. The lancet oncology. 2005;6(1):15-24.
47. National Collaborating Centre for C. National Institute for Health and Clinical Excellence: Guidance. Metastatic Spinal Cord Compression: Diagnosis and Management of Patients at Risk of or with Metastatic Spinal Cord Compression. Cardiff (UK): National Collaborating Centre for Cancer (UK)
National Collaborating Centre for Cancer.; 2008.
48. Dimopoulos M, Terpos E, Comenzo RL, Tosi P, Beksac M, Sezer O, et al.
International myeloma working group consensus statement and guidelines regarding the current role of imaging techniques in the diagnosis and monitoring of multiple Myeloma. Leukemia. 2009;23(9):1545-56.
49. Nair SR, Pearson SB. Images in clinical medicine. Pathologic fracture and lytic lesions in multiple myeloma. The New England journal of medicine. 2004;351(18):1874. 50. Collins CD. Multiple myeloma. Cancer imaging : the official publication of the International Cancer Imaging Society. 2010;10:20-31.
51. Baur-Melnyk A, Buhmann S, Durr HR, Reiser M. Role of MRI for the diagnosis and prognosis of multiple myeloma. European journal of radiology. 2005;55(1):56-63.
52. Moulopoulos LA, Gika D, Anagnostopoulos A, Delasalle K, Weber D, Alexanian R, et al. Prognostic significance of magnetic resonance imaging of bone marrow in previously untreated patients with multiple myeloma. Annals of oncology : official journal of the European Society for Medical Oncology / ESMO. 2005;16(11):1824-8.
53. Moulopoulos LA, Dimopoulos MA, Alexanian R, Leeds NE, Libshitz HI. Multiple myeloma: MR patterns of response to treatment. Radiology. 1994;193(2):441-6. 54. Hillengass J, Fechtner K, Weber MA, Bauerle T, Ayyaz S, Heiss C, et al. Prognostic significance of focal lesions in whole-body magnetic resonance imaging in patients with asymptomatic multiple myeloma. Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2010;28(9):1606-10.
55. Bredella MA, Steinbach L, Caputo G, Segall G, Hawkins R. Value of FDG PET in the assessment of patients with multiple myeloma. AJR American journal of
roentgenology. 2005;184(4):1199-204.
56. Shortt CP, Gleeson TG, Breen KA, McHugh J, O'Connell MJ, O'Gorman PJ, et al. Whole-Body MRI versus PET in assessment of multiple myeloma disease activity. AJR American journal of roentgenology. 2009;192(4):980-6.