Estudo Retrospetivo da Endocardite Infeciosa
em cães
Dis
sertação de Mestrado Integrado em Medicina Veterinária
Ana Sofia dos Reis Ferreira
Orientador:
Professora Doutora Maria João Miranda Pires
Coorientador:
Professor Doutor Luís Lima Lobo
ii
DECLARAÇÃO
NOME: Ana Sofia dos Reis Ferreira C.C: 14152065
TELEMÓVEL: (+351) 919977296
CORREIO ELECTRÓNICO: anasf.reis@gmail.com
TÍTULO DA DISSERTAÇÃO DE MESTRADO EM MEDICINA VETERINÁRIA: Estudo
Retrospetivo da Endocardite Infeciosa em cães
ORIENTADOR: Professora Doutora Maria João Miranda Pires ANO DE CONCLUSÃO: 2016
DESIGNAÇÃO DO MESTRADO: Mestrado Integrado em Medicina Veterinária
DECLARO QUE ESTA DISSERTAÇÃO DE MESTRADO É RESULTADO DA MINHA PESQUISA E TRABALHO PESSOAL E DAS ORIENTAÇÕES DO MEU SUPERVISOR. O SEU CONTEÚDO É ORIGINAL E TODAS AS FONTES CONSULTADAS ESTÃO DEVIDAMENTE MENCIONADAS NO TEXTO, E NA BIBLIOGRAFIA FINAL. DECLARO AINDA QUE ESTE TRABALHO NÃO FOI APRESENTADO EM NENHUMA OUTRA INSTITUIÇÃO PARA OBTENÇÃO DE QUALQUER GRAU ACADÉMICO.
VILA REAL, SETEMBRO DE 2016
iii
RESUMO
A Endocardite Infeciosa (EI) é uma doença causada por microrganismos que colonizam o endocárdio, provocando lesões com características proliferativas e erosivas no endocárdio valvular e/ou mural. É uma doença muitas vezes mortal sendo a sua prevalência baixa. A EI é diagnosticada recorrendo à utilização de critérios de diagnóstico que incluem a visualização ecocardiográfica de uma lesão vegetativa oscilante numa válvula cardíaca. É necessário tratamento a longo prazo com antibióticos bactericidas de amplo espectro, incluindo pelo menos uma semana de tratamento intravenoso. O prognóstico é grave e em muitos casos o tempo de sobrevivência é curto, mesmo com tratamento médico agressivo. Este trabalho teve como objetivo estudar a EI em cães, na sua índole epidemiológica e clínica. Neste estudo fez-se uma análise retrospetiva das características clinicopatológicas de 26 cães diagnosticados com EI no Hospital Veterinário do Porto, de 2009 a 2016, e no Hospital Veterinari Molins, de 2004 a 2015.
A presença de EI foi mais prevalente em raças puras, de médio e grande porte com representação igual de ambos os sexos. Na maioria dos animais ao exame físico foi verificada febre e um sopro cardíaco. As alterações hematológicas e bioquímicas mais frequentes foram anemia, hipoalbuminemia, trombocitopenia, leucocitose e azotemia. O estudo ecocardiográfico foi fundamental na confirmação do diagnóstico. As válvulas do lado esquerdo foram as afetadas, sendo que houve uma incidência ligeiramente superior de afeção da válvula mitral em relação à válvula aórtica. Nas imagens radiográficas a principal alteração foi a presença de padrão pulmonar alveolar e as arritmias mais frequentemente identificadas foram as de origem ventricular. Todos os agentes etiológicos identificados foram bactérias, sendo num cão identificada Bartonella spp.. O pilar do tratamento foram antibióticos bactericidas e apenas 29% dos cães sobreviveram num período igual ou superior a dois anos. A importância clínica desta doença reside no desafio diagnóstico que apresenta ao médico veterinário, nas consequências nefastas que esta doença impõe nos animais afetados e nos inúmeros obstáculos que são interpostos no seu tratamento.
iv
ABSTRACT
Infective Endocarditis (EI) is a disease, often deadly, caused by the invasion of a microbe into the endothelium of the heart’s valves, resulting in proliferative or erosive lesions in the valvar or mural endocardium. It is not a frequent disease, therefore the prevalence in dogs is low. EI is diagnosed using diagnostic criteria that include the echocardiographic visualization of a vegetative, oscillating lesion on a cardiac valve. It is required long term treatment with bactericide antibiotics of broad spectre, with at least one week of intravenous treatment. The prognostic is grave and in many cases the survival time is short, even with aggressive medical treatment. The aim of this work is the study of EI in dogs, in its clinical and epidemiologic nature.
In this study was made a retrospective analysis of the clinicopathological characteristics of 26 dogs diagnosed with EI, both in Hospital Veterinário do Porto, from 2009 to 2016, and Hospital Veterinari Molins, from 2004 to 2015.
There was a higher prevalence of EI in pure breads, medium to large-breed dogs, with equal representation of both genders. In the physical exam, most of the dogs presented fever and a cardiac murmur. Abnormal laboratory findings included anemia, hypoalbuminemia, thrombocytopenia, leucocytosis and azotemia. The echocardiographic study was fundamental on the confirmation of the diagnosis. The left-side valves were affected and the mitral valve was slightly more injured than the aortic valve. All the etiologic agents identified were bacteria, and Bartonella spp. was isolated in one dog. The most commonly identified arrhythmias were ventricular arrhythmias. The thoracic radiography revealed a pulmonary alveolar pattern in most dogs. The cornerstone of the treatment were bactericide antibiotics and only 29% of the dogs survived a two-year period.
The clinical importance of infective endocarditis resides in the diagnostic challenge it presents to the clinician, the formidable consequences it imposes on its victims, and the obstacles confronted in treating and preventing this often catastrophic disease.
v ÍNDICE GERAL 1. – Endocardite Infeciosa ... 1 1.1 – Definição ... 1 1.2 – Patologia ... 1 1.2.1 – Alterações macroscópicas ... 2 1.2.2 – Alterações microscópicas ... 3 1.3 – Patogenia ... 3 1.3.1 – Envolvimento valvular ... 6 1.4 – Fisiopatologia ... 6 1.5 – Epidemiologia ... 8 1.6 – Factores predisponentes ... 8 1.7 – Agentes etiológicos ...10 1.7.1 – Bartonella spp. ...10 1.8 – Apresentação clínica ...11 1.8.1 – Exame físico ...13 1.8.1.1 – Febre ...13 1.8.1.2 – Frequência Respiratória ...13 1.8.1.3 – Sopro cardíaco ...13 1.8.1.4 – Pulso ...14 1.8.1.5 – Outros ...14 1.9 – Diagnóstico ...15 1.9.1 – Exames complementares ...17 1.9.1.1 – Avaliação Laboratorial ...17 1.9.1.2 – Hemocultura ...18 1.9.1.2.1 – Obtenção de hemoculturas ...18
1.9.1.3 – Testes para Bartonella spp. ...19
1.9.1.4 – Reação em cadeia da Polimerase (PCR)...20
1.9.1.5 – Radiografia torácica ...20
1.9.1.6 – Electrocardiografia ...21
1.9.1.7 – Ecocardiografia ...22
1.9.1.8 – Outros ...25
1.9.1.8.1 – Análise de urina ...25
1.9.1.8.2 – Análise ao líquido sinovial e cultura ...26
1.9.1.8.3 – Ecografia abdominal ...26
1.9.1.8.4 – Histopatologia ...26
vi 1.10 – Tratamento...27 1.10.1 – Tratamento antibiótico ...27 1.10.2 – Tratamento antitrombótico ...28 1.10.3 – Tratamento de suporte ...29 1.11 – Monitorização ...30
1.12 – Profilaxia de Endocardite Infeciosa ...31
1.13 – Prognóstico ...32
2 – Objetivos ...35
3 – Materiais e Métodos ...37
3.1 – Animais admitidos ao estudo ...37
3.2 – Análise estatística ...37
4 – Resultados ...39
4.1 – Caracterização da amostra em estudo ...39
4.2 – Apresentação clínica ...41
4.3 – Comorbilidades ...42
4.4 – Alterações hematológicas e bioquímicas ...43
4.5 – Análises de Urina ...46
4.6 – Electrocardiografia ...46
4.7 – Diagnóstico por Imagem ...47
4.8 – Hemocultura ...48 4.9 – Tratamento...49 4.10 – Necrópsia ...50 4.11 – Sobrevivência ...51 5 – Discussão ...53 6 – Conclusão ...59 7 – Referências Bibliográficas ...61
vii
ÍNDICE DE FIGURAS
Figura 1 – Imagem macroscópica de endocardite na válvula mitral. Presença de
vegetações na face atrial do folheto valvular. O folheto encontra-se hemorrágico. Imagem gentilmente cedida pelo Hospital Veterinari Molins………...2
Figura 2 - Imagem macroscópica de endocardite na válvula aórtica. Presença de
vegetações na válvula aórtica. Imagem gentilmente cedida pelo Hospital Veterinari Molins………..2
Figura 3 – Patogenia da Endocardite Infeciosa. O desenvolvimento de
Endocardite Infeciosa é desencadeado por uma lesão endotelial, seguido por deposição de fibrina e plaquetas que funcionam como substrato para a colonização e adesão bacterianas. Adaptado de MacDonald, 2010………5
Figura 4 – Frascos com meios de cultura de transporte para hemocultura. Frasco
da esquerda – meio para microrganismos aeróbios; frasco da direita – meio para microrganismos anaeróbios………...19
Figura 5 - Radiografia de tórax, projeção lateral direita. Presença de padrão
alveolar compatível com edema pulmonar. Imagem gentilmente cedida por Hospital Veterinário do Porto……….21
Figura 6 - Radiografia de tórax, projeção ventrodorsal. Presença de padrão
alveolar compatível com edema pulmonar. Imagem gentilmente cedida por Hospital Veterinário do Porto……….21
Figura 7 – Electrocardiograma. Presença de bloqueio atrioventricular de 2º grau
e de bloqueio atrioventricular de 1º grau. Imagem gentilmente cedida por Hospital Veterinari Molins………22
Figura 8 – Ecocardiografia bidimensional, corte paraesternal direito de eixo longo.
Presença de massa de grandes dimensões, hiperecoica, vegetativa na válvula aórtica (seta branca). Imagem gentilmente cedida pelo Hospital Veterinari Molins………..23
Figura 9 – Ecocardiografia bidimensional em modo Doppler de cor, corte
paraesternal direito de eixo longo. Visualização de um fluxo turbulento no trato de saída do ventrículo esquerdo. Imagem gentilmente cedida pelo Hospital Veterinari Molins…………...24
Figuras 10A e 10B – 10A: Ecocardiografia em modo M (movimento) da válvula
mitral, demonstrando o flutter diastólico do folheto da válvula mitral (seta) devido à regurgitação aórtica; 10B: Ampliação da imagem anterior com evidência para o flutter diastólico do folheto anterior da válvula mitral (seta). Imagens gentilmente cedidas pelo Hospital Veterinari Molins………...24
viii
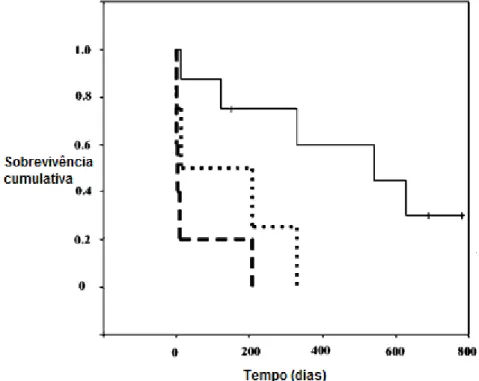
Figura 11 – Curva de sobrevivência de Kaplan-Meier em cães com EI. Linha a
tracejado – cães com EI da válvula aórtica devido a Bartonella spp.; linha com pontos – cães com EI da válvula aórtica em cães sem Bartonella spp.; linha a cheio – cães com EI na válvula mitral sem Bartonella spp.. Adaptado de MacDonald et al., 2004……….33
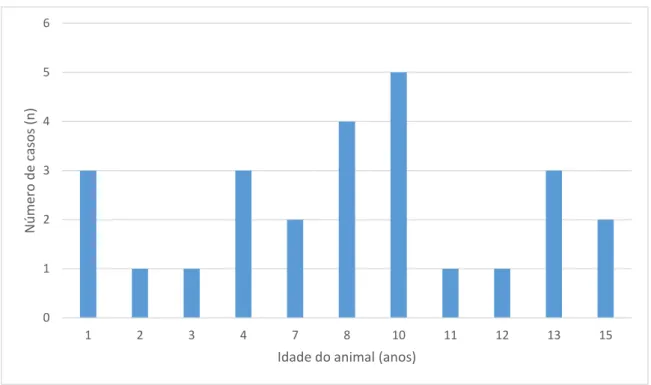
Figura 12 – Gráfico de barras relativo à distribuição de idade dos animais na
amostra……….41
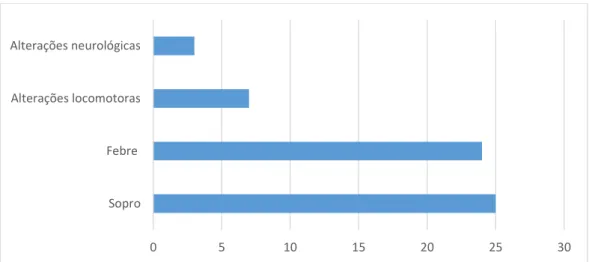
Figura 13 – Gráfico de barras representativo da distribuição dos cães pelos
diferentes sinais clínicos……….42
Figura 14 – Gráfico de barras representativo das frequências das comorbilidades
observadas………...43
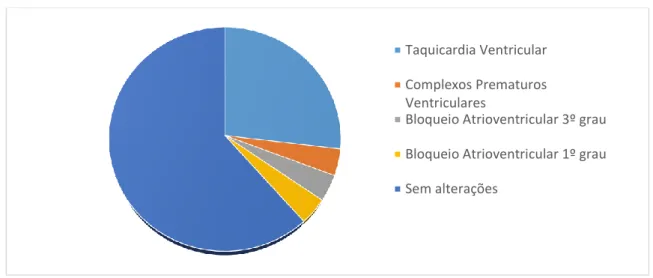
Figura 15 – Gráfico circular representativo das frequências observadas
relativamente às arritmias cardíacas………47
Figura 16 – Gráfico circular representativo das frequências observadas das
alterações às radiografias torácicas………..47
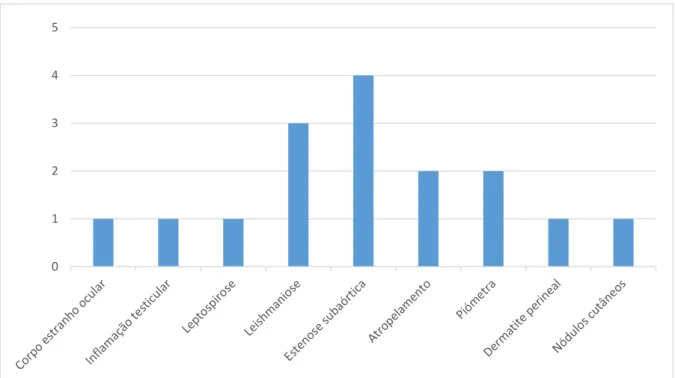
Figura 17 – Gráfico de barras representativo da frequência da afeção de cada
válvula cardíaca………...48
Figura 18 – Gráfico de barras representativo das frequências das alterações
ix
ÍNDICE DE QUADROS
Quadro 1 – Possíveis sequelas da EI. Adaptado de Ware, 2014………..12 Quadro 2 – Critérios maiores e menores para o diagnóstico de EI. Adaptado de
MacDonald, 2014 ………16
Quadro 3 – Parâmetros propostos para o diagnóstico da endocardite infeciosa em
cães. Adaptado de MacDonald, 2014………..16
Quadro 4 – Doses sugeridas de antibióticos para Bartonelose Canina. Adaptado de
Breitschwerdt, et al., 2012………..28
Quadro 5 – Doses sugeridas de fármacos de suporte para a EI. Adaptado de Calvert
et al., 2012……….30
Quadro 6 – Estatística descritiva relativa à raça, sexo e peso dos animais………….40 Quadro 7 – Parâmetros estatísticos relativos às análises hematológicas e associação
entre estas e a sobrevivência a dois anos (p) ………45
Quadro 8 – Associação entre as análises hematológicas e bioquímicas e a
sobrevivência a dois anos (p)……….46
Quadro 9 – Descrição das alterações visualizadas no exame ecocardiográfico de 8
animais………..48
Quadro 10 – Perfis de sensibilidade e resistência das bactérias isoladas nas
hemoculturas………49
Quadro 11 – Microrganismos isolados nas hemoculturas, perfil de sensibilidade e
x
LISTA DE SIGLAS E ACRÓNIMOS
% – Percentagem ® – Registo Comercial AD – Átrio direito AE – Átrio esquerdo
ALT – Alanina aminotransferase
BAPGM – meio de crescimento de Bartonella (Bartonella alpha – proteobacteria growth
medium )
DDMVM – Doença degenerativa mixomatosa da válvula mitral DP – Desvio padrão
EI – Endocardite Infeciosa ESA – Estenose subaórtica FA – Fosfatase alcalina
ICC – Insuficiência Cardíaca Congestiva
IECA – Inibidor da Enzima conversora da Angiotensina Kg - Quilogramas
mmHg – Milímetros de mercúrio Modo M – Modo movimento
MSCRAMMS – Componentes da superfície microbiana que reconhecem moléculas adesivas da matriz (microbial surface componentes recognizing adhesive matriz molecules)
PCR – Reação em cadeia da polimerase VE – Ventrículo esquerdo
xi
AGRADECIMENTOS
Começo por agradecer a todos os docentes e colaboradores do curso de Mestrado Integrado em Medicina Veterinária da Universidade de Trás-os-Montes e Alto Douro, por todos os conhecimentos partilhados durante este meu percurso académico.
Agradeço à Prof. Dra. Maria João, orientadora deste trabalho, por toda a sua dedicação e competência científica na realização e correção desta tese.
Ao Prof. Dr. Luís Lobo, coorientador desta dissertação, por me ter recebido no Hospital Veterinário do Porto. Agradeço o vasto conhecimento transmitido, por estar sempre disponível para ajudar e pela competência e rigor científicos empregues na correção desta dissertação.
A toda a equipa do Hospital Veterinário do Porto o meu sincero obrigada, por me terem recebido tão bem, pelos conhecimentos partilhados, pela amizade, pela paciência e pelos bons momentos passados durante o estágio. Aos meus companheiros de estágio e em especial à minha Cátia.
A toda a equipa do Hospital Veterinari Molins, principalmente ao Dr. Laín García, ao Dr. Jordi Marubens e à Dra. Catarina Sá Borges, por me terem recebido no serviço de Cardiologia e pelo fornecimento de dados para a minha dissertação.
Aos amigos, sobretudo aquele grupo incomparável que me acompanhou ao longo destes anos académicos, agradeço por todos os momentos incríveis que passámos. Levo-vos no coração.
Ao Pontinha por estar sempre presente e à família Pontinha Fernandes por todo o apoio.
Acima de tudo, agradeço ao meu avô Albano pela paixão pela medicina veterinária e por toda sabedoria transmitida. À minha família, especialmente aos meus pais e irmã, pela paciência, amor e apoio incondicional sem os quais não seria possível chegar aqui.
1
1. – Endocardite Infeciosa
1.1 – Definição
O termo endocardite infeciosa (EI) designa a inflamação da superfície endocárdica do coração resultante da invasão por um agente infecioso (Kittleson, 1998). Esta é uma doença pouco frequente, muitas vezes mortal, que é provocada pela colonização de um microrganismo no endotélio das válvulas cardíacas, e raramente no endocárdio mural, resultando em lesões proliferativas ou erosivas e consequente insuficiência valvular (MacDonald, 2014).
As bactérias são os agentes etiológicos predominantemente isolados, motivo pelo qual endocardite bacteriana ou endocardite vegetativa são termos frequentemente usados para denominar esta doença (Peddle et al., 2007). Contudo, em raras situações, os fungos também podem causar EI (Kittleson, 1998; MacDonald, 2014).
1.2 – Patologia
Em cães, a maioria das lesões desenvolvem-se na válvula mitral (Figura 1), aórtica (Figura 2) ou em ambas, com uma incidência ligeiramente superior na válvula mitral comparada com a válvula aórtica em alguns estudos (Calvert, 1982; Sykes et al., 2006a). A afeção das válvulas do lado direito é rara, sendo a válvula tricúspide afetada ocasionalmente e a válvula pulmonar ainda com menos frequência. A infeção do endocárdio mural é muito rara (Miller et al., 2004).
Quando ocorre a colonização e a invasão bacterianas de uma válvula cardíaca são produzidas lesões proliferativas (vegetativas). Estas lesões compreendem essencialmente 3 camadas: uma grande interior, formada por plaquetas, fibrina, eritrócitos, leucócitos e bactérias; uma intermédia com bactérias; e uma externa composta por fibrina (Sisson, 1987). A colonização bacteriana não ocorre à superfície, deste modo a infiltração por células fagocíticas é mínima. Na matriz de plaquetas, as bactérias encontram-se frequentemente em baixo estado metabólico (Calvert et al., 2012). Este ambiente protegido permite o desenvolvimento de altas concentrações bacterianas, de 109 a 1011 bactérias por grama de
tecido (Bashore et al., 2006). As alterações patológicas variam com a virulência do microrganismo, com a duração da infeção e com a resposta imunológica (Olsen et al., 2010).
2
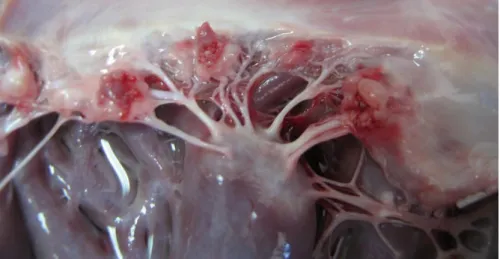
1.2.1 – Alterações macroscópicas
Os folhetos afetados encontram-se macroscopicamente deformados, podendo encontrar-se hemorrágicos, ulcerados ou perfurados. Em alguns casos de EI aguda, as vegetações podem ser poliplóides e de grandes dimensões. As vegetações diferem no tamanho e forma, apresentando marcada variabilidade. O tecido adjacente à válvula pode estar distorcido, edemaciado e hiperémico (Miller et al., 2004).
As margens livres das vegetações são friáveis e podem soltar-se e embolizar, conferindo uma aparência irregular (Sisson, 1987). As vegetações podem estender-se de folheto a folheto, das cúspides aórticas ao folheto adjacente da valva mitral ou das margens de uma válvula à superfície endocárdica adjacente. Adicionalmente, as lesões podem
Figura 1 – Imagem macroscópica de endocardite na válvula mitral. Presença de vegetações na face
atrial do folheto valvular. O folheto encontra-se hemorrágico. Imagem gentilmente cedida pelo Hospital Veterinari Molins.
Figura 2- Imagem macroscópica de endocardite na válvula aórtica. Presença de vegetações na válvula
3
estender-se para o septo interventricular ou interatrial, para as cordas tendinosas ou para a íntima da aorta. Também pode ocorrer a rutura completa das cordas tendinosas e o desenvolvimento de úlceras perfurantes miocárdicas. Com o tempo e particularmente com o tratamento antibiótico, as lesões vegetativas tornam-se mais pequenas, menos friáveis, mais organizadas, mais fibróticas e parcialmente calcificadas (Sisson, 1987; Miller et al., 2004).
1.2.2 – Alterações microscópicas
A aparência histológica da EI varia com a cronicidade das lesões e com a administração de tratamento antimicrobiano (Miller et al., 2004). Estes factores influenciam a quantidade de material necrótico, de coágulos sanguíneos, de fibrina e de células inflamatórias que compõem as vegetações. Geralmente, as mudanças histológicas representam a progressão da resposta inflamatória. Assim, as vegetações valvulares agudas são formadas por plaquetas, fibrina, eritrócitos, leucócitos polimorfonucleados com algumas células mononucleares e com aglomerados dispersos de bactérias. Por outro lado, nas endocardites subagudas, observa-se um predomínio de células mononucleares em detrimento das polimorfonucleadas. As vegetações mais antigas apresentam diversos graus de organização, incluindo tecido de granulação, cicatrizes e deposição de cálcio (Sisson, 1987; Miller et al., 2004).
1.3 – Patogenia
A patogenia da EI é complexa e para que se desenvolva uma EI as bactérias têm que ter capacidade de adesão ao endocárdio (Peddle et al., 2007; Abbot, 2016). Deste modo, a lesão do endotélio é um passo importante neste processo pois é mais provável que nesta região ocorra a deposição de plaquetas e fibrina, formando um trombo não infecioso (Abbot, 2016). Neste local, estes agentes patogénicos podem aderir e iniciar uma EI antes que o sistema imunitário do animal os possa eliminar (Calvert et al., 2012). O termo endocardite trombótica não bacteriana foi usado para descrever a formação de trombos estéreis de plaquetas, fibrina e eritrócitos em válvulas cardíacas normais ou com lesões de superfície (Lopez et al., 1987). Está comprovado experimentalmente que o porco e o gambá são animais capazes de desenvolver EI sem lesão endotelial prévia e afere-se que o mesmo seja verdade para o cão (Tunkel et al., 1992).
Em condições normais, o endocárdio é resistente à aderência e colonização bacteriana (Peddle et al., 2007). Este facto é demonstrado pela baixa ocorrência da EI comparada à elevada frequência de episódios de bacteriemia persistente ou transitória (Calvert et al., 1989).
4
Em medicina humana, uma bacteriemia transitória está associada a ações como escovar os dentes, defecar ou a uma mastigação vigorosa (Korzeniowski et al., 1992).
Para o desenvolvimento de EI tem que se verificar bacteriemia persistente ou transitória (Calvert et al., 1989; Ware, 2014). Estes episódios de bacteriemia podem provocar a infeção do trombo e o começo de um processo inflamatório de agressividade variável, resultando na distorção e destruição dos folhetos valvares e estruturas associadas (Abbot, 2016). Uma bacteriemia de baixo grau, crónica, aumenta o risco de EI (Calvert et al., 2012). A probabilidade da bacteriemia se tornar numa infeção cardíaca aumenta quando os organismos são virulentos e/ou a carga bacteriana é alta (Ware, 2014). As rotas possíveis para as bactérias acederem e colonizarem o endocárdio podem ser ou por contato direto via corrente sanguínea ou a partir de capilares dentro da válvula (vasculite) (Olsen et al., 2010).
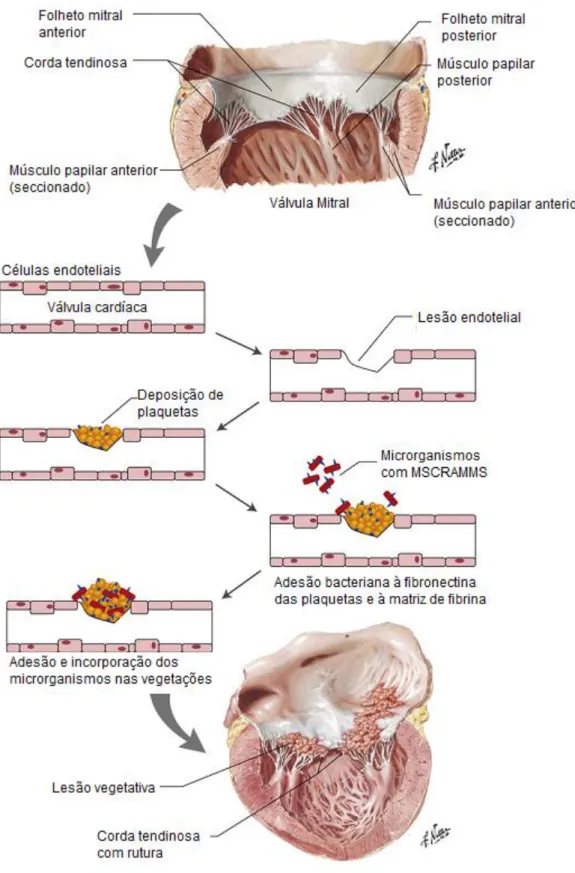
Os organismos que causam a EI têm a capacidade de aderir a uma matriz composta por plaquetas e fibrina. A produção de factores de aderência pelas bactérias facilita o processo. Estes factores incluem o dextran e a proteína de ligação à fibronectina (Peddle et
al., 2007; Calvert et al., 2012). A aderência é mediada por componentes da superfície
microbiana que reconhecem moléculas adesivas da matriz (microbial surface componentes
recognizing adhesive matriz molecules – MSCRAMMS). Os organismos que causam mais
frequentemente EI possuem estes recetores especiais, os MSCRAMMS, e têm uma maior capacidade de aderência a válvulas danificadas (Figura 3). Estes organismos incluem os
Staphylococcus spp. e os Streptococcus spp.. Ambos também têm a capacidade de
desencadear a produção de factor tissular e induzir a agregação plaquetária, originando uma vegetação de maiores dimensões (Moreillon et al., 1995; MacDonald, 2014).
Uma vez instaladas nas válvulas cardíacas as bactérias são obrigadas a evadir as defesas locais, incluindo as proteínas microbicidas das plaquetas e os leucócitos (Calvert et
al., 2012). As bactérias como Bartonella spp. e Staphylococcus aureus podem internalizar-se
dentro das células endoteliais e escapar à deteção pelo sistema imunitário, sendo que a primeira pode também evadir o sistema imune através da colonização de eritrócitos sem causar hemólise. A progressão das lesões varia com as características dos microrganismos invasores, sendo que as bactérias excretam enzimas que levam à destruição de tecido valvular e rutura de cordas tendinosas (Macdonald, 2010).
5
Figura 3 – Patogenia da Endocardite Infeciosa. O desenvolvimento de Endocardite Infeciosa é
desencadeado por uma lesão endotelial, seguido por deposição de fibrina e plaquetas que funcionam como substracto para a colonização e adesão bacterianas. Adaptado de MacDonald, 2010. MSCRAMMS – Componentes da superfície microbiana que reconhecem moléculas adesivas da matriz.
6
1.3.1 – Envolvimento valvular
As válvulas cardíacas estão sujeitas a agressões constantes sempre que abrem e encerram. A válvula aórtica e a válvula mitral são as mais frequentemente afetadas, podendo ambas estar implicadas. A tricúspide e a pulmonar raramente estão envolvidas (Calvert, 1982; Calvert et al., 1989; Calvert et al., 2012).
A incidência de EI parece que está diretamente relacionada com a força aplicada em cada válvula. As lesões estão geralmente localizadas onde ocorre a maior pressão e a maior velocidade de passagem de sangue (Calvert et al., 2012). Em medicina humana há evidência que existe uma relação direta entre a pressão normal das válvulas cardíacas fechadas e a incidência de endocardite valvular (mitral> aórtica> tricúspide> pulmonar). Este facto pode indicar que as bactérias aderem mais facilmente ao endotélio das válvulas que apresentam pressões altas em repouso (Peddle et al., 2007).
Por outro lado, a presença de um fluxo de elevada velocidade justifica a distribuição das vegetações. As vegetações são frequentemente observadas a jusante de um fluxo turbulento (Ware, 2014). Assim, as lesões são geralmente encontradas na face ventricular da válvula aórtica quando há estenose subaórtica (ESA), na face atrial da válvula mitral quando há regurgitação mitral e no ventrículo direito quando existe um defeito do septo interventricular (Peddle et al., 2007; Ware, 2014).
1.4 – Fisiopatologia
As manifestações de EI são resultado de diversos fenómenos, sejam a destruição valvular ou a circulação de êmbolos e de imunocomplexos na corrente sanguínea. A presença de insuficiência cardíaca congestiva costuma ser frequente, devido à insuficiência valvular e consequente sobrecarga de volume (Ware, 2014). Como as válvulas aórtica e mitral são geralmente afetadas, os sinais de insuficiência cardíaca esquerda são os mais frequentes, como o edema pulmonar (Brown, 2004; Ware, 2014).
É frequente a ocorrência de embolismo de fragmentos da lesão endocárdica conduzindo a enfartes em diversos órgãos e à propagação da infeção cardíaca para outros locais (Calvert, 1982; Ware, 2014). O embolismo é uma causa frequente de sinais clínicos e deterioração do estado clínico do animal (Calvert, 1982; Calvert et al., 1989). Em medicina humana, as vegetações com maiores dimensões e com mais mobilidade, observadas através de ecocardiografia, estão associadas a uma maior incidência de eventos de embolismo. Pode-se aferir que o mesmo ocorrerá em cães (Ware, 2014). Os sítios mais frequentes de enfarte são os rins e o baço, seguidos pelo enfarte do miocárdio, cérebro e artérias periféricas (Macdonald, 2010). A encefalopatia vascular com manifestações clínicas ocorre em
7
aproximadamente 15 a 30% (Habib et al., 2015) de pessoas com EI, sendo rara em cães (Cook et al., 2005). As complicações relacionadas com tromboembolismo foram reportadas em 44% dos cães afetados com EI (Sykes et al., 2006a). Noutro estudo, em 84% dos cães durante a realização da necrópsia foram observados sinais de embolismo sistémico, e a presença de glomerulonefrite foi identificada em 16% de 44 cães com EI (Calvert, 1982). Tal como em medicina humana, os cães têm uma maior predisposição de padecer de doença tromboembólica se a endocardite afetar a válvula mitral (Sykes et al., 2006a). A propagação da infeção através dos êmbolos causa manifestações clínicas como artrite séptica, discoespondilite, infeções do trato urinário e formação local de abcessos que contribuem para a bacteriemia recorrente e febre (Ware, 2014).
Na EI, são por vezes observadas sequelas da bacteriemia relacionadas com a estimulação antigénica crónica e a consequente deposição de imunocomplexos. Isto deve-se ao desenvolvimento de títulos de anticorpos elevados contra o agente etiológico pelos doentes, resultando deste modo na formação contínua de imunocomplexos circulantes. Os imunocomplexos consistem em Imunoglobulinas M, Imunoglobulinas G e C3 (complemento). Existem factores, tal como o factor reumatoide, que podem impedir a capacidade do complemento em solubilizar os imunocomplexos. Este fenómeno pode levar à formação de imunocomplexos de grandes dimensões (MacDonald et al., 2004; MacDonald, 2014). A deposição destes imunocomplexos origina manifestações de doença extracardíaca e ativação adicional do complemento. As consequências incluem a destruição de tecidos como as membranas glomerulares, as cápsulas articulares, a derme, entre outros (Macdonald, 2010; Calvert et al., 2012). Os testes ao factor reumatoide e aos anticorpos antinucleares (ANA) podem ser positivos (Ware, 2014).
A fisiopatologia da claudicação e da manifestação de dor articular em cães com endocardite varia. Tanto podem ser causadas pela artrite secundária à deposição de imunocomplexos nas articulações, como por embolismo ou por osteopatia hipertrófica (Calvert
et al., 2012). Os êmbolos sépticos que se alojam em ramos vasculares de músculos do
esqueleto apendicular podem causar claudicação focal. Um sítio frequente de embolismo é na artéria subclávia direita que causa claudicação do membro torácico direito (Peddle et al., 2007). Em cães, a osteopatia hipertrófica é uma sequela rara da EI. Esta é causada pelo aumento do fluxo sanguíneo nas extremidades, desencadeando um crescimento excessivo de tecido conjuntivo vascular. Outro mecanismo que provavelmente ocorrerá envolve os fragmentos de plaquetas que se destacam das vegetações e obstruem artérias periféricas. As plaquetas libertam factores promotores da permeabilidade vascular que resultam num aumento do tecido conjuntivo e metaplasia fibrocondróide (Dunn et al., 2007).
8
1.5 – Epidemiologia
A EI não é uma doença frequente e crê-se que é subdiagnosticada. Ocasionalmente é observada em cães e raramente em gatos (Abbot, 2016). A incidência em cães varia entre menos de 0,1% em hospitais universitários veterinários e cerca de 1% dos casos examinados por cardiologistas veterinários (Sykes et al., 2006a; Ware, 2014). Os machos são mais predispostos (Calvert, 1982; Sykes et al., 2006a; Ware, 2014), facto que se associou possivelmente à prevalência de prostatites bacterianas crónicas (Calvert, 1982). A maioria dos cães têm mais do que 4 anos de idade (MacDonald, 2014). Há um risco superior em raças de médio/grande porte, com maior destaque para as raças puras nomeadamente o Boxer, o Pastor Alemão, o Golden e Labrador Retriever e o Rottweiler (Calvert, 1982; Kittleson, 1998; Sykes et al., 2006a; Ware, 2014; Abbot, 2016).
1.6 – Factores predisponentes
Existem múltiplos factores que predispõem ao desenvolvimento de bacteriemia e EI. Os factores predisponentes para a circulação de microrganismos na corrente sanguínea incluem procedimentos invasivos que envolvam tanto as gengivas, orofaringe, trato gastrointestinal ou tecidos infetados. As portas de entrada para agentes causadores de EI são providenciadas por feridas, locais de biópsias, cirurgias e cateteres (DeFrancesco, 2014; MacDonald, 2014). Assim, quaisquer alterações que sejam associadas tanto a bacteriemia crónica (gengivites, infeções prostáticas e urinárias, piodermas e feridas), como a debilitação das defesas do organismo (neoplasias, diabetes mellitus, hiperadrenocorticismo, administração exógena de corticosteroides, tratamentos imunossupressores), aumentam o risco de EI (Pekarkova et al., 2008; Calvert et al., 2012; DeFrancesco, 2014). Contudo, na maioria das vezes a causa da bacteriemia permanece desconhecida (Ware, 2014; Abbot, 2016), e é provada em menos de 50% dos cães com EI (Calvert, 1982; Calvert et al., 2012).
Certas lesões pré-existentes aumentam o risco do desenvolvimento de endocardite. Em medicina humana estas lesões incluem: prolapso da válvula mitral, ducto arterioso persistente, regurgitação aórtica, estenose aórtica, regurgitação mitral, estenose mitral e defeitos do septo ventricular (Miller et al., 2004). Contudo, a EI em cães está raramente associada a doenças cardíacas congénitas, com a exceção da ESA (Kienle et al., 1994). Um animal que tenha este defeito possui um fluxo de sangue turbulento de alta velocidade no trato de saída do ventrículo esquerdo que pode produzir micro traumas nos folhetos valvulares e facilitar a colonização microbiana. As raças Golden Retriever, Rottweiller e Boxer têm altas incidências de EI e ESA (Calvert, 1982; Kienle et al., 1994). Menos de 10% de cães com ESA desenvolvem EI e uma minoria de cães com EI têm ESA. A confirmação ou eliminação de um
9
diagnóstico de ESA com EI da válvula mitral é por vezes difícil de fazer devido à existência de vegetações que podem obscurecer esta lesão (Calvert, 1982; Kienle et al., 1994).
A EI já foi descrita em cães com ducto arterioso persistente (Aoki et al., 2015) e defeitos ventriculares septais, contudo não há informação inerente ao risco relativo para estas lesões (Thomas, 2005; Quintavalla et al., 2007; Winter et al., 2014). Adicionalmente, a endocardite da valva tricúspide é uma complicação rara da implantação transvenosa do elétrodo na colocação de pacemaker (Miller et al., 2004).
Como foi referido anteriormente, o prolapso da válvula mitral em humanos é uma alteração cardíaca predisponente para o desenvolvimento de EI. Em contraste, os cães com a maior incidência de doença degenerativa mixomatosa da válvula mitral (DDMVM), prolapso valvular e regurgitação (seniores, raças pequeno porte) têm uma incidência muito baixa de EI. Em medicina veterinária, a DDMVM não possui nenhuma associação conhecida com a EI. Apesar da prevalência de doença do foro dental em cães com regurgitação mitral causada por DDMVM, a EI não é frequente neste grupo (Peddle et al., 2007; Abbot, 2016).
De facto, a possibilidade de que haja uma associação entre a doença periodontal canina e a EI tem sido sistematicamente estudada. Num estudo retrospetivo com 59296 casos foi identificada uma relação entre a doença periodontal canina e a EI. Contudo, a ausência de confirmação ecocardiográfica dos diagnósticos efetuados põe em causa a conclusão deste estudo (Glickman et al., 2009). Num estudo com uma amostra de 76 casos, no qual todos foram rigorosamente identificados e documentados não foi encontrada tal associação (Peddle
et al., 2009). Num estudo recente foi observada uma associação entre doença periodontal
causada por Enterococcus spp. e a EI, visto terem sido identificadas bactérias pertencentes a este género com perfis de resistência e virulência semelhantes, tanto na boca como no coração dos animais estudados (Semedo-Lemsaddek et al., 2016).
O desenvolvimento de bacteriemia devido a procedimentos na cavidade oral e periodontites tem sido controvérsia em humanos. Por conseguinte, é sempre feita profilaxia antibiótica em doentes considerados “em risco” para estes procedimentos (Peddle et al., 2007).
Outros factores predisponentes são as infeções bacterianas generalizadas ou focais, os implantes de dispositivos como pacemakers e as alterações de coagulação (Peddle et al., 2007). Uma das complicações associadas à substituição da válvula tricúspide em cães é a EI (Arai et al., 2011).
10
1.7 – Agentes etiológicos
A grande maioria dos casos de EI são causados por bactérias, sendo a presença de rickettsias ocasionalmente identificada. A endocardite causada por fungos é rara em cães (Calvert, 1982; Calvert et al., 2012).
Embora o espectro de espécies microbianas passíveis de causar EI seja vasto, apenas algumas espécies de bactérias são as responsáveis pela maioria dos casos. Assim, os organismos geralmente identificados como agentes de endocardite bacteriana incluem
Staphylococcus spp. (S. aureus, S. intermedius, coagulase-positivos e coagulase-negativos), Streptococcus spp. (S. canis, S. bovis e beta-hemolíticos), Bartonella spp. e Escherichia coli
(Macdonald, 2010; Ware, 2014).
Os isolados bacterianos menos frequentes incluem Pasteurella multocida,
Enterobacter spp., Pseudomonas aeruginosa, Corynebacterium spp., Proteus spp. e Erysipelothrix rhusiopathiae (Macdonald, 2010).
Os agentes etiológicos raros incluem Erysipelothrix tonsillarum (Takahashi et al., 1993), Streptococcus agalactiae (Messier et al., 1995), Bordetella avium-like (Ramirez et al., 2003), Actinomyces turicensis (Junius et al., 2004), Citrobacter freundii, Enterococcus spp.
Klebsiella spp., Pasteurella canis, Salmonella arizonae, (Sykes et al., 2006b), Providencia spp.
(Silva et al., 2009), Staphylococcus lugdunenses (Nakamura et al., 2012) e Actinomyces
canis-like (Balakrishnan et al., 2016).
Em modelos experimentais, a probabilidade de desenvolvimento de EI varia com o serotipo de Staphylococcus aureus (Calvert et al., 2012). Também se associou que uma bacteriemia gram-negativa resulta frequentemente numa manifestação clínica aguda enquanto que uma bacteriemia gram-positiva numa subaguda ou crónica (Olsen et al., 2010). A EI causada por fungos é rara em cães. A maioria do conhecimento clínico relacionado com esta etiologia é extrapolado de medicina humana (Costa et al., 2014). Em humanos, as infeções fúngicas representam 1-6% do total de casos e com taxas de mortalidade superiores a 50%, mesmo submetidos a um tratamento agressivo antifúngico e cirúrgico (Habib et al., 2015). Os organismos Candida e Aspergillus são responsáveis pela maioria das endocardites fúngicas (Pasha et al., 2016). Estes estão associadas a factores predisponentes como substituição de próteses de válvulas, abuso de fármacos intravenosos, tratamentos imunossupressores e antibacterianos crónicos (Tattevin et al., 2014).
1.7.1 – Bartonella spp.
Recentemente tem-se assistido a um interesse pela comunidade científica nos microrganismos intracelulares pertencentes ao género Bartonella, implicados cada vez mais
11
em infeções zoonóticas (Breitschwerdt et al., 2012). As infeções causadas por este agente estão a ser identificadas com maior frequência, resultado do uso de técnicas de diagnóstico cada vez mais sofisticadas. Esta é uma bactéria intracelular, fastidiosa, gram-negativa, aeróbica que reside maioritariamente nos eritrócitos e nas células endoteliais (Chomel et al., 2009). Esta bactéria tem vários vetores artrópodes documentados que incluem moscas, piolhos e carraças (Billeter et al., 2008) e está associada com várias doenças semelhantes em medicina veterinária e humana, como miocardite, arritmias cardíacas, poliartrite, meningoencefalite, peliose hepática e endocardite (Breitschwerdt et al., 1999; Mellor et al., 2006; Diniz et al., 2009; Breitschwerdt et al., 2012).
Provavelmente, a prevalência desta bactéria, tal como acontece com outros microrganismos, varia com a localização geográfica. No Sul de Portugal foi realizado um estudo com 1010 cães no qual se tentou determinar a prevalência de Bartonella spp. através de PCR (reação em cadeia da polimerase) do sangue. Porém, nesse trabalho não foi detetado nenhum animal com esta bactéria (Maia et al., 2015).
Recentemente, Bartonella vinsonii ssp. Berkhoffii (Breitschwerdt et al., 1995),
Bartonella clarridgeiae (Chomel et al., 2001), Bartonella washoensis (Chomel et al., 2003), Bartonella henselae (Goodman et al., 2005), Bartonella quintana (Kelly et al., 2006), Bartonella rochalimae (Henn et al., 2009) e Bartonella koehlerae (Ohad et al., 2010) foram identificados
como agentes que efetivamente causam endocardite em cães e que não cresciam em hemoculturas (Calvert et al., 2012). Num estudo composto por 18 cães realizado na Califórnia, a Bartonella spp. foi identificada como agente etiológico da EI em 28% dos casos e em 45% dos casos com culturas negativas (MacDonald et al., 2004). Este microrganismo afeta primariamente a válvula aórtica (MacDonald et al., 2004) e de forma menos habitual a mitral (Pesavento et al., 2005) causando lesões caracterizadas por fibrose, mineralização, proliferação endotelial e neovascularização (Sykes et al., 2006b; Peddle et al., 2007).
1.8 – Apresentação clínica
A EI partilha muitas características clínicas com um processo de bacteriemia sem endocardite. Deste modo, pode mimetizar qualquer doença sistémica com diversas sequelas (Quadro 1), de forma que já foi referida como o “grande imitador” (Calvert et al., 2012; Ware, 2014). A apresentação clínica de um cão com EI costuma ser subaguda. Nestes casos, o factor predisponente para esta doença, muitas vezes, não é encontrado. Também pode ser observada na sua forma aguda (Abbot, 2016).
12
Quadro 1 – Possíveis sequelas da Endocardite Infeciosa. Adaptado de Ware, 2014.
Coração
Insuficiência valvular ou estenose ●Sopro ●ICC Embolização Coronária ●Enfarte miocárdio ●Abcesso no miocárdio ●Miocardite ●Diminuição da contractilidade ●Arritmias
Miocardite (invasão direta por microrganismos) ●Arritmias
●Alterações de condução atrioventricular ●Diminuição da contractilidade
Pericardite (invasão direta pelos microrganismos)
●Derrame pericárdico ●Tamponamento
Rim
Enfarte
●Redução da função renal Formação de abcesso e pielonefrite ●Redução da função renal ●Infeções trato urinário ●Dor renal
Glomerulonefrite (imunomediada) ●Proteinúria
●Redução da função renal
Musculoesqueléticos
Artrite séptica
●Dor e tumefação articular ●Claudicação
Poliartrite imunomediada ●Dor Muscular
●Claudicação intermitente ●Dor e tumefação articular Osteomielite sética ●Dor óssea ●Claudicação Miosite Cérebro e Meninges Abcessos ●Sinais neurológicos Encefalite e meningite ●Sinais neurológicos Sistema vascular Vasculite ●Trombose
●Petéquias e pequenas hemorragias Obstrução
●Isquemia dos tecidos dependentes
Pulmões Êmbolos pulmonares Pneumonia Inespecíficos Septicemia Febre Anorexia Depressão Tremores Dor inespecífica Leucograma inflamatório Anemia moderada
ICC – Insuficiência cardíaca congestiva
Os cães que desenvolvem endocardite geralmente apresentam um conjunto de sinais inespecíficos de doença sistémica extracardíaca, como depressão, febre, fraqueza, letargia,
13
perda de peso, anorexia, claudicação intermitente e possíveis sinais neurológicos (Cook et
al., 2005; Sykes et al., 2006a; Sykes et al., 2006b; Peddle et al., 2007; Calvert et al., 2012). A
presença de taquipneia, dispneia e tosse também podem ser observadas e podem refletir insuficiência cardíaca congestiva, que é uma sequela frequente devido às alterações associadas com a endocardite como lesão estrutural e funcional valvular, visto que as vegetações originam uma fraca coaptação dos folhetos e consequentemente regurgitação de sangue (Peddle et al., 2007).
Um cão que apresente febre e um sopro cardíaco que não existia (ou agravamento de um previamente diagnosticado) é classicamente considerado suspeito de uma endocardite, embora alguns autores considerem que a estas alterações é dada uma importância sobrestimada (Peddle et al., 2007). Assim, este novo sopro pode ser apenas uma manifestação de uma doença adquirida não infeciosa como a DDMVM ou alterações fisiológicas como febre ou anemia (Ware, 2014).
1.8.1 – Exame físico
1.8.1.1 – Febre
A presença de febre é uma alteração frequente mas não necessariamente consistente, sendo documentada a sua presença em 50 a 90% de cães com EI (Calvert, 1982; Sykes et
al., 2006a). A ausência de febre é associada a casos de EI em que a válvula aórtica está
implicada, uma alteração que pode ser atribuível a infeções por Bartonella spp., que foi reportada ser mais frequente em animais afebris (Sykes et al., 2006a; Sykes et al., 2006b). Outros factores que podem contribuir para a não manifestação de pirexia incluem: animais com uma EI crónica, com ICC, com insuficiência renal, com idade avançada e que tenham recebido tratamento antibiótico (Calvert et al., 2012) e anti-inflamatório (Peddle et al., 2007).
1.8.1.2 – Frequência Respiratória
A frequência respiratória pode estar aumentada e os animais com edema pulmonar apresentam-se sobretudo dispneicos (Macdonald, 2010).
1.8.1.3 – Sopro cardíaco
Um sopro cardíaco é identificado em cerca de 75% dos casos em que há uma infeção valvular estabelecida uma vez que esta destrói o tecido valvular, interferindo com a sua função (Sykes et al., 2006a). A gravidade da destruição varia com a cronicidade e a virulência do microrganismo. As lesões na válvula mitral que resultam em regurgitação de sangue para o
14
átrio esquerdo são detetadas no exame físico como sopros sistólicos com origem no apex cardíaco esquerdo (Peddle et al., 2007; Abbot, 2016).
Por outro lado, quando a EI afeta a válvula aórtica ausculta-se um sopro diastólico decrescente que é tipicamente detetado na base do coração do lado esquerdo. O aumento do volume sistólico do ventrículo esquerdo resultante da regurgitação de sangue pode originar concomitantemente um sopro sistólico, resultando assim na auscultação de um sopro sistólico e um diastólico, designado “to- fro” (Macdonald, 2010). Este tipo de sopro também pode ocorrer em animais que apresentem defeitos do septo ventricular com regurgitação aórtica simultânea, podendo ainda ser confundido com um sopro contínuo característico de ducto arterioso persistente (Peddle et al., 2007).
Um elemento que corrobora o diagnóstico de EI é a auscultação de um sopro diastólico devido ao número limitado de doenças que causam este tipo de sopro (Calvert, 1982; Peddle
et al., 2007). Porém este tipo de sopros são normalmente suaves, podendo facilmente não
ser identificados (Calvert, 1982). Em contraste, os sopros sistólicos são fracos indicadores de EI visto que ocorrem frequentemente em cães com outras doenças como a DDMVM (Olsen
et al., 2010). Nos cães com EI, um sopro diastólico está quase sempre presente em
associação com um sopro sistólico (69%) e raramente sozinho (8%) (Sykes et al., 2006a). É de salientar que num estudo, em 26% dos cães com EI não foi identificado nenhum sopro que fosse audível na exploração física (Calvert, 1982).
1.8.1.4 – Pulso
A frequência de pulso é geralmente elevada devido a algum grau de disfunção cardíaca presente aquando o diagnóstico. Na EI da válvula mitral o pulso femoral é tipicamente normal. Em contraste, se for afetada a válvula aórtica pode verificar-se um pulso oscilante devido ao aumento da pressão arterial sistólica pela regurgitação aórtica, causando uma sobrecarga de volume e consequente aumento do volume de ejeção. A pressão arterial diastólica é baixa devido ao refluxo de sangue arterial para o ventrículo esquerdo durante a diástole (Macdonald, 2010). Devido a este fenómeno, não só a pressão diastólica pode estar baixa mas também a duração da onda da pressão sistólica pode estar diminuída (Calvert et
al., 2012).
1.8.1.5 – Outros
Outras alterações possíveis no exame físico incluem a observação de membranas mucosas congestivas ou pálidas, dor muscular ou abdominal (Olsen et al., 2010). As alterações neurológicas são ocasionais e incluem ataxia, défices de propriocepção, alteração
15
dos nervos cranianos e ainda sinais vestibulares (Sykes et al., 2006a). Se ocorrer tromboembolismo arterial nos membros podem detetar-se alterações como extremidades frias, cianose do leito ungueal, dor e claudicação, ausência de pulso e rigidez dos músculos afetados (Macdonald, 2010).
1.9 – Diagnóstico
O diagnóstico da EI é desafiante e deve incluir as alterações clínicas e laboratoriais compatíveis, hemocultura, ecocardiografia com evidência de lesões vegetativas numa válvula cardíaca e insuficiência valvular. O diagnóstico pode ser facilmente negligenciado visto que os sinais clínicos refletem frequentemente as complicações relacionadas com a doença e não propriamente a infeção intracardíaca (Olsen et al., 2010). Em medicina humana, o sistema de classificação modificado de Duke é usado para quantificar a probabilidade de o doente ter uma endocardite (Habib et al., 2015). Foram propostos critérios em medicina veterinária baseados nos de Duke (Durack et al., 1994) e são um recurso importante para identificar casos prováveis e definitivos de EI (Quadro 2 e 3) (MacDonald, 2014).
16
Quadro 2 - Critérios maiores e menores para o diagnóstico de EI. Adaptado de MacDonald, 2014.
Critérios Maiores Critérios Menores
●Ecocardiografia positiva para EI Massa oscilante/vegetação Lesão erosiva
Abcesso
●Hemocultura positiva
Mais de duas hemoculturas com resultados positivos
Mais de 3 hemoculturas positivas para um organismo que seja frequentemente
contaminante da pele
●Regurgitação valvular nova
Mais do que insuficiência aórtica moderada na ausência de estenose subaórtica ou ectasia anulo-aórtica ●Febre ●Estenose subaórtica ●Doença tromboembólica ●Doença imunomediada Poliartrite Glomerulonefrite
●Cão médio a grande (> 15 kg)
●Evidência microbiológica: hemoculturas positivas que não vão de encontro aos critérios maiores
●Titulação de Bartonella spp.> 1:1024* ●PCR positivo para o ADN de Bartonella spp. de sangue, fluidos corporais ou tecidos*
*Criterio menor de diagnóstico proposto, não é oficialmente aceite como critério nem avaliado prospectivamente; EI – Endocardite Infeciosa; Kg – quilograma; PCR – Reação em cadeia da polimerase.
Quadro 3 – Parâmetros propostos para o diagnóstico da endocardite infeciosa em cães. Adaptado de
MacDonald, 2014.
Diagnóstico da EI Definitivo:
●Lesões valvulares
●2 Critérios maiores ou 1 maior e 2 menores
Possível:
●1 Critério maior e 1 menor ou 3 menores
Excluído:
●Alternativa diagnóstica para as manifestações clínicas
●Resolução das manifestações de EI com 4 ou menos dias de antibiótico ●Sem evidência patológica de EI
17
1.9.1 – Exames complementares
1.9.1.1 – Avaliação Laboratorial
Na maioria dos casos o hemograma revela um leucograma inflamatório que pode indicar um desvio à esquerda ligeiro, moderado ou ausente dependendo da cronicidade (Abbot, 2016). Tipicamente há uma neutrofilia madura com monocitose, o que pode indicar inflamação crónica de baixo grau (Calvert et al., 2012; Ware, 2014). Porém, as alterações hematológicas de inflamação sistémica estão por vezes ausentes, o que pode ser resultado de administrações anteriores de antibióticos, de anti-inflamatórios ou de bacteriemia crónica de baixo grau (Calvert et al., 2012).
Em cerca de 50 a 60% dos casos é identificada anemia geralmente normocítica normocrómica e não regenerativa e a presença de trombocitopenia também é frequente (Sykes et al., 2006a; Calvert et al., 2012). Esta última pode ser atribuída à presença de vasculite sistémica e imune ou pelo consumo plaquetário inerente aos mecanismos de coagulação (Calvert et al., 2012).
Na bioquímica sérica, as alterações são inespecíficas e refletem alterações secundárias à doença. Uma “tríade séptica” composta por hipoalbuminemia, aumento da atividade sérica da fosfatase alcalina (FA) e/ou aumento da bilirrubina e hipoglicemia pode ser observada em cães com bacteriemia e endocardite (Ware, 2014). O aumento da atividade sérica da FA e da bilirrubina são devido, provavelmente, à presença de toxinas bacterianas no fluxo biliar. Nestes casos, certos mediadores da resposta inflamatória alteram a expressão de transportadores na membrana sinusal e canalículos dos hepatócitos, levando a uma colestase intra-hepática ocorrendo o aumento da bilirrubina e da FA. A hipoglicemia é causada pelo efeito das bactérias ou das suas toxinas no mecanismo da glucose (Calvert et al., 2012). A diminuição da função hepática pode explicar a presença de hipoalbuminemia (Calvert et al., 1989). A azotemia está muitas vezes presente, resultante de factores que incluem a diminuição da perfusão renal, enfartes renais e glomerulopatias (Calvert et al., 2012; Abbot, 2016). Os níveis da proteína C-reactiva estão geralmente elevados, mas esta é uma alteração não específica, podendo estar associada com qualquer forma de doença valvular crónica (Rush et al., 2006).
Há evidência de um estado de pró-coagulabilidade em alguns cães, pois apresentam um aumento dos níveis normais de dímero D ou de produtos de degradação da fibrina. No estudo de Sykes et al. (2006a) foi observado que em 87% dos cães, numa amostra de 15 animais, estes parâmetros apresentavam-se aumentados e verificou-se a presença de hiperfibrinogenemia em 83% (Sykes et al., 2006a).
18
1.9.1.2 – Hemoculturas
A realização de hemoculturas antes do tratamento com antibióticos é um exame complementar importante na corroboração do diagnóstico e no auxílio da seleção apropriada de antibióticos (Olsen et al., 2010). Em cães com EI até 70% das hemoculturas realizadas, são negativas (Sisson et al., 1984; MacDonald et al., 2004). Este número contrasta com o valor de 31% reportado em medicina humana (Habib et al., 2015) e pode ser explicado porque muitos destes cães se encontram a receber tratamento antibiótico antes da hemocultura (MacDonald et al., 2004). Também poderão contribuir outros factores como: baixas concentrações de bactérias na corrente sanguínea, factores bactericidas endógenos (complemento e células fagocíticas), bacteriemia intermitente, endocardite estéril (apenas fibrina e plaquetas nas vegetações), EI crónica com lesões vegetativas encapsuladas ou infeções por organismos de crescimento difícil como a Bartonella spp. (Olsen et al., 2010). A
Bartonella spp. é um organismo fastidioso que raramente cresce em meios de cultura,
reduzindo desta forma a possibilidade de uma cultura positiva (Macdonald, 2010).
As amostras devem ser encaminhadas para cultura de aeróbios e anaeróbios (Ware, 2014). Os tubos de lise e centrifugação podem ser empregues e podem aumentar a probabilidade diagnóstica (Macdonald, 2010). Devem ser recolhidos volumes de sangue adequados (baseados no tamanho do animal) visto que a concentração de bactérias no sangue é muito baixa, cerca de 5-10 bactérias/mL (Peddle et al., 2007). Quando os resultados das culturas se mantêm negativos após 2 a 3 dias de incubação, deve pedir-se ao laboratório para prolongar a sua incubação até 3 semanas e/ou realizar subculturas em meios enriquecidos (Calvert et al., 2012; Ware, 2014).
As recolhas de sangue em cães que estão a receber tratamento com antibiótico devem ser feitas quando este atinge os níveis mais baixos no organismo (Macdonald, 2010). Em 30 a 50% dos indivíduos positivos é possível a obtenção da identificação dos agentes que causaram a EI (Calvert et al., 2012). É importante avaliar se o microrganismo identificado é compatível com o diagnóstico de EI (Olsen et al., 2010).
1.9.1.2.1 – Obtenção de hemoculturas
O laboratório deverá ser contactado antes da colheita para a escolha do meio de cultura indicado porque existem aditivos específicos no caso de terem sido administrados antibióticos (Olsen et al., 2010).
As amostras de sangue venoso devem ser retiradas de 3 a 4 locais diferentes, com volume aproximado de 10 mL cada. As colheitas devem ser feitas em condições de assepsia, sendo que o intervalo entre elas deverá ser de 30 minutos a 1 hora (Macdonald, 2010), ou
19
segundo outros autores idealmente mais de 1 hora (Ware, 2014). Num caso de uma apresentação aguda é aceitável a obtenção de apenas 2 colheitas com intervalo de 15 minutos (Calvert et al., 2012). Também se encontra descrita a colheita de 3 amostras de sangue num período de 12 a 24 horas através de uma veia central (Abbot, 2016). De modo geral, devem ser realizadas 3 colheitas com uma hora de intervalo entre elas (Calvert et al., 2012). Durante a mesma, antes de transferir a amostra de sangue para o frasco com o meio de cultura, deve-se desinfetar o topo deste bem como trocar a agulha da recolha. Também deve-se deve evitar a injeção de ar na transferência do sangue e o frasco deve ser invertido suavemente, para ocorrer a mistura entre ambos (Ware, 2014). O tubo deve ser aquecido e mantido a 37º, antes e após a recolha (Olsen et al., 2010).
O tamanho do frasco com o meio de cultura (Figura 4) é relevante, visto que um rácio de 1:10 de sangue para o meio de cultura é recomendado para minimizar os efeitos bactericidas inerentes ao plasma do animal (Ware, 2014).
1.9.1.3 – Testes para Bartonella spp.
O principal método que permite determinar se a EI é causada por Bartonella spp. é a realização de uma serologia (Macdonald, 2010). Por ser uma bactéria intracelular fastidiosa, mesmo com a utilização de meios de cultura específicos, como o Bartonella alpha –
proteobacteria growth medium (BAPGM), e com longos períodos de incubação a sua cultura
é difícil (DeFrancesco, 2014). Assim, o diagnóstico está limitado ao uso de PCR de sangue (obtenção de falsos negativos) ou da válvula cardíaca no postmortem (gold standard) ou é
Figura 4 – Frascos com meios de cultura de transporte para hemocultura. Frasco da esquerda – meio
20
determinada causa provável se o título serológico de Bartonella spp. estiver significativamente elevado (Macdonald, 2010).
Estudos epidemiológicos sugerem que carraças e pulgas podem ser vetores para
Bartonella spp.. De facto, serorreactividade concomitante a Ehrlichia canis, Anaplasma phagocytophilum, e Rickettsia rickettsi foi identificada em cães em EI causada por Bartonella
spp. (MacDonald et al., 2004).
A bibliografia sugere que uma alta serorreactividade (> 1:1024) a Bartonella spp. seja considerada um critério menor para o diagnóstico de EI em cães (Macdonald, 2010). Foi verificado também que a obtenção de um título elevado de Bartonella spp. (> 1:1024) em conjugação com lesões ecocardiográficas características é uma ferramenta de diagnóstico altamente específica antemortem para cães com EI devido a este agente (MacDonald et al., 2004). Para se realizar o diagnóstico de EI em medicina humana, é considerado um critério menor de diagnóstico a evidência serológica de infeção ativa com um organismo consistente com EI, como a Bartonella spp. (Habib et al., 2015).
1.9.1.4 – Reação em cadeia da Polimerase (PCR)
Recentemente, há evidência que o uso de PCR para ácidos nucleicos bacterianos pode ser uma ferramenta de diagnóstico útil adjuvante às hemoculturas convencionais. Foi sugerido que a associação da hemocultura à extração dos ácidos nucleicos do sangue e posterior amplificação por PCR é especialmente útil para deteção de bacteriemia em casos de infeção com agentes fastidiosos ou de hemoculturas negativas (Duncan et al., 2007; Heaney et al., 2009; Meurs et al., 2011). Porém, outros autores indicam que a realização de PCR a partir de sangue não aporta nenhum benefício na identificação do agente etiológico (Heilmann et al., 2013).
Em medicina humana, nos casos em que tal é possível, a colheita de tecido valvular
postmortem ou durante a cirurgia para processamento e PCR aumenta a deteção e
identificação de organismos com culturas negativas em indivíduos com endocardites (Podglajen et al., 2003).
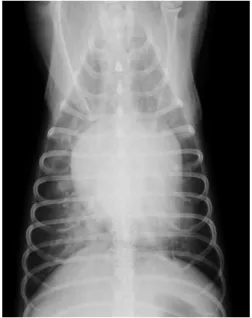
1.9.1.5 – Radiografia torácica
As alterações são variáveis e em alguns casos as radiografias não aportam informação substancial ao clínico. É possível visualizar sinais compatíveis com ICC em cerca de 50% dos cães com EI, como a presença de um padrão pulmonar compatível com edema pulmonar (Figura 5 e 6), em localização sobretudo peri-hilar a caudodorsal (Sykes et al., 2006a). As
21
radiografias também podem evidenciar envolvimento de outros órgãos como por exemplo, discoespondilite (Calvert et al., 2012; Abbot, 2016).
Quando o lado esquerdo do coração apresenta dimensões normais radiograficamente e há suspeita de edema pulmonar, o clínico deve considerar o diagnóstico de ICC, visto que um aumento significativo das câmaras cardíacas pode não ter tido tempo de se desenvolver, principalmente em casos agudos (Calvert et al., 2012).
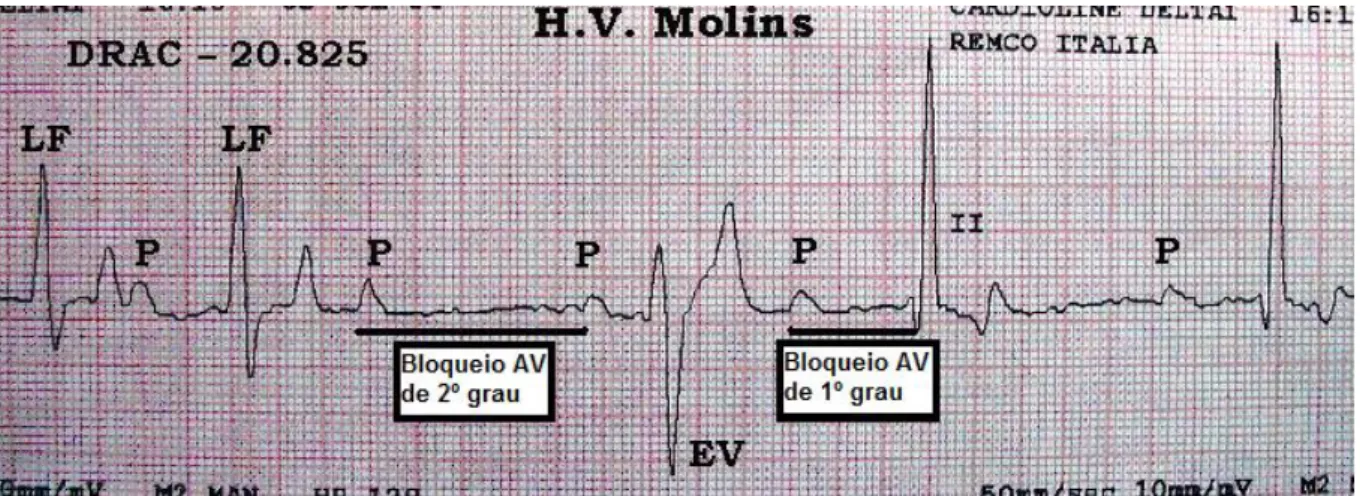
1.9.1.6 – Electrocardiografia
Não há alterações electrocardiográficas que sejam diagnósticas de EI (Abbot, 2016). Estas estão presentes em 50 a 75% dos cães afetados (Calvert, 1982; Sykes et al., 2006a), e são melhor avaliadas com recurso a monitorização contínua na jaula ou com Holter (Calvert
et al., 2012). O ECG pode ser normal ou documentar, por ordem de incidência, arritmias
ventriculares, taquicardia supraventricular, bloqueio atrioventricular de 3º grau e fibrilhação atrial (Ware, 2014).
Existe uma associação entre a EI e o bloqueio atrioventricular de 3º grau. Ocasionalmente, uma lesão agressiva na válvula aórtica invade o septo interventricular ou emboliza a artéria coronária nodal, resultando deste modo na destruição do nó atrioventricular (Ware, 2014). Esta complicação é relativamente invulgar, mas bloqueios atrioventriculares de 1º e 2º grau (Figura 7) ou atrasos na condução intraventricular como o bloqueio de ramo Figura 5 - Radiografia de tórax, projeção lateral direita.
Presença de padrão alveolar compatível com edema pulmonar. Imagem gentilmente cedida por Hospital Veterinário do Porto.
Figura 6 - Radiografia de tórax, projeção
ventrodorsal. Presença de padrão alveolar compatível com edema pulmonar. Imagem gentilmente cedida por Hospital Veterinário do Porto.
22
esquerdo, são mais frequentes (Boswood, 1996; Abbot, 2016). Pode-se também observar evidência de aumento das câmaras cardíacas em doentes que sobrevivam tempo suficiente para que a sobrecarga de volume de sangue cause dilatação/hipertrofia das câmaras (Abbot, 2016).
1.9.1.7 – Ecocardiografia
A ecocardiografia é a ferramenta mais importante no diagnóstico de EI (Macdonald, 2010). O termo endocardite vegetativa é usado para referir casos em que há um trombo macroscópico infetado associado ao folheto valvular (Figura 8) (Abbot, 2016). Este é identificado como uma massa hiperecoica, com forma irregular, oscilante e aderente, mas distinta da superfície endocárdica (Olsen et al., 2010). O termo oscilante refere-se ao facto de ter movimento com alta frequência independente da estrutura valvular adjacente, o que suporta favoravelmente o diagnóstico ecocardiográfico de vegetação (Macdonald, 2010).
Nas lesões mais recentes pode observar-se um espessamento ligeiro das válvulas e/ou um aumento da sua ecogenicidade (Ware, 2014). Em lesões mais crónicas podem-se observar as válvulas hiperecogénicas o que pode ser resultado de calcificação distrófica (Ware, 2014). À medida que a destruição valvular progride pode visualizar-se rutura das cordas tendinosas, não coaptação dos folhetos valvulares e outras alterações do movimento valvular normal (Ware, 2014). Quando estas alterações ocorrem na valva aórtica, o diagnóstico está normalmente assegurado (Abbot, 2016).
Figura 7 - Electrocardiograma. Presença de bloqueio atrioventricular de 2º grau e de bloqueio
atrioventricular de 1º grau. AV – atrioventricular. Imagem gentilmente cedida por Hospital Veterinari Molins.
23
As vegetações que afetam os folhetos mitrais têm menos especificidade diagnóstica principalmente na fase inicial da EI, visto que o diagnóstico diferencial principal para EI ecocardiograficamente é a DDMVM (Calvert et al., 2012). Classicamente, as vegetações resultantes de uma EI são irregulares, com distorção valvular nodular enquanto que a DDMVM é associada com um espessamento valvular uniforme (Ware, 2014). A identificação correta do animal deve ser feita previamente visto que os cães com DDMVM são geralmente de raça pequena, que raramente desenvolvem EI. Os cães com EI costumam ser de porte médio a grande que habitualmente não desenvolvem um espessamento valvular marcado resultante de degeneração mixomatosa. Contudo, os animais de grande porte também desenvolvem esta alteração, mas a sua manifestação é mais subtil, menos proliferativa e com menos prolapso valvular. Contrariamente à EI, a DDMVM não causa a aparência de uma lesão tipo massa oscilante de formato irregular que se move de forma independente do endocárdio (Linde, 2005; Macdonald, 2010). Os resultados devem ser considerados tendo em conta a história e os sinais clínicos dos animais (Calvert et al., 2012; Abbot, 2016).
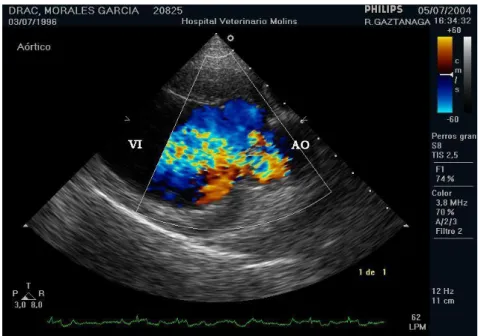
Os estudos com recurso ao Doppler ilustram as alterações ao fluxo normal de sangue (Ware, 2014). A insuficiência valvular da válvula afetada está sempre presente, sendo frequentemente moderada ou grave (Figura 9). A insuficiência aórtica grave é diagnosticada tanto pelo encerramento diastólico prematuro da válvula mitral como também pelo flutter diastólico do folheto anterior mitral (Abbot, 2016). O flutter (Figura 10A e 10B) é causado pelo fluxo regurgitante da válvula aórtica que atinge o folheto anterior mitral quando aberto, em diástole (Calvert et al., 2012). O flutter da válvula mitral é provavelmente a alteração mais Figura 8 - Ecocardiografia bidimensional, corte paraesternal direito de eixo longo. Presença de massa
de grandes dimensões, hiperecoica, vegetativa na válvula aórtica (seta branca). VI – ventrículo esquerdo; Ao – aorta. Imagem gentilmente cedida pelo Hospital Veterinari Molins.