Universidade de Taubaté
Departamento de Engenharia Mecânica
Ciência e Tecnologia de Materiais
Professor
–
Dr. Carlos Antonio Vieira
Unidade I
Introdução a Ciência e Tecnologia dos Materiais
Conteúdo
Introdução: O átomo e a Tabela Periódica
Ligações Químicas e os materiais metálicos, cerâmicos e poliméricos Estruturas Cristalinas
Método de Difração de Raio X
Imperfeições Cristalinas, pontuais, em linha e superficiais
Objetivos Gerais da Ciência e Tecnologia de Materiais
Realçar a parcela da ciência dos materiais, no sentido de entender a natureza dos materiais, estabelecendo teorias ou descrições que relacione a estrutura com a composição, propriedades e comportamento;
Compreender e prever propriedades e características dos principais materiais usados em engenharia;
Identificar ensaios mecânicos e químicos necessários a seleção, caracterização e qualificação de materiais.
Objetivos Específicos de Estruturas e Propriedades dos Metais Puros.
Rever os conceitos atuais do átomo, relacionando-os com as propriedades atômicas; Esclarecer que as propriedades de um material dependem de sua estrutura;
Relacionar as imperfeições cristalinas com o comportamento dos semi-condutores, da ductilidade de metais, da resistência das ligas metálicas e da condutividade elétrica;
1. INTRODUÇÃO
“As propriedades dos materiais originam-se na sua estrutura interna”
As propriedades dos materiais dependem:
do tipo de ligação química; da energia de ligação; da sua composição química;
da sua microestrutura (quais as fases presentes, arranjo geométrico entre as fases presentes e o seu tamanho de grão; os defeitos cristalinos presentes no material)
da estrutura cristalina que se forma no sólido;
Conclui-se que alterações desejadas ou não, sempre ocorrerão quando a estrutura interna do material processado sofrer alterações.
Os tipos básicos de materiais disponíveis aos engenheiros têm seu sistema de classificação segundo a natureza de suas ligações atômicas.
Propriedades também dependem do tipo de estrutura atômica dos materiais, sejam elas amorfas ou cristalinas; nas estruturas cristalinas encontram-se as imperfeições típicas: pontuais, em linha, superficiais e volumétricas, todas elas a nível atômico.
Os processos de fabricação levam a modificação da estrutura atômica dos materiais e geram defeitos microscópicos e macroscópicos os quais influem nas propriedades dos materiais aplicados tecnologicamente.
Para exemplificar pode-se citar:
Propriedades que dependem da estrutura nos metais: condutividade elétrica, propriedades semicondutoras e propriedades mecânicas.
Propriedades que independem da estrutura nos metais: constantes elásticas, ponto de fusão, massa específica, calor específico, coeficiente de expansão térmica.
1.1 O ATUAL MODELO ATÔMICO.
Entender o atual modelo atômico e as interações atômicas é essencial para o entendimento das propriedades dos materiais.
Figura 01 - Representação Esquemática do átomo. Figura 02 – O átomo segundo BOHR
Tabela 01 – Algumas constantes das partículas Atômicas
Partícula Massa Carga em Coulomb
Prótons 1,67x10-27 kg + 1,6 x 10-19
Nêutrons 1,67x10-27 kg Nula
Elétrons 9,11x10-31 kg + 1,6 x 10-19
1.2 MODELO ATÔMICO DE BOHR
1.2.1 A energia dos elétrons é “QUANTIZADA”
• Cada elétron tem valor definido de energia.
• Um elétron pode mudar sua energia através de saltos quânticos:
Nível energético maior: ABSORÇÃO DE ENERGIA; Nível energético menor: EMISSÃO DE ENERGIA.
• Estados energéticos não variam continuamente:
Estados ou níveis adjacentes são separados por valores finitos de energia; Níveis estão associados às órbitas eletrônicas;
Quando o elétron passa de uma órbita de nível maior absorve energia; Quando o elétron passa de uma órbita de nível menor emite energia;
1.2.2.HIPÓTESES DE BOHR.
• Elétrons nas órbitas não emitem energia
• Mudança de órbita implica em emissão ou absorção de energia, sofrendo uma variação dada por:
∆E = variação de energia = h.f.
h = constante de Planck = 6,63.10-34 J.s = 4,14.10-15 eV.s f = frequência
• No caso de radiação eletromagnética c = .f
c = Velocidade da luz = 3,0x108m/s e = Comprimento de onda
• Orbitas estáveis são determinadas por condições quânticas
• Orbitas existem quando o momento angular de um elétron, com órbita circular de raio r, é igual ao múltiplo inteiro, n(h/2p), onde n é um inteiro (1, 2, 3....)
• O momento do fóton p = h / , a energia do fóton está relacionada à frequência.
• Modelo de BOHR descreve a estrutura do átomo de hidrogênio satisfatoriamente
• Descrição da estrutura de outros átomos não é satisfatória
• Mecânica quântica possibilita descrever a estrutura desses átomos com eficiência
• Princípio fundamental da mecânica quântica, um elétron pode ter dois comportamentos:
UMA ONDA OU UMA PARTÍCULA
1.3 DE BROGLIE (1924) associou a matéria a uma onda. • Energia da partícula: E = m c2
• Energia de um fóton: E = h.f
• Momento da partícula: p = m c = E / c = (h.f) / c = c / f
p = h / a energia está relacionada à freqüência
DE BROGLIE propôs então que a matéria teria um comprimento de onda associado a ela:
Massa m;
Velocidade v;
Momento Linear p = m.v;
“Conclui-se por estes modelos que cada elemento químico tem um comprimento de onda típico e único, análogo a uma impressão digital, tornando possível sua identificação por alguns processos de espectrometria”
1.4 O MOVIMENTO DO ELÉTRON EM TORNO DO NÚCLEO E SUA ENERGIA É
DESCRITOS POR QUATRO NÚMEROS QUÂNTICOS
• n = Número quântico principal (interpretado como camadas no espaço)
• l = Número quântico secundário (subcamadas: s, p, d, f..)
• ml = Número quântico magnético (associado ao comportamento sob ação de um campo magnético externo)
• ms = Número quântico spin (associado à rotação do elétron em torno de seu próprio eixo)
Segundo o princípio de exclusão de Linus Pauling os elétrons preenchem os orbitais em ordem crescente de energia.
Segundo este princípio os elementos químicos em seu estado fundamental terão em sua última camada de valência de 1 a 8 elétrons, determinando a reatividade entre elementos e os possíveis tipos de ligações atômicas e os diversos tipos de materiais.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
REATIVIDADE QUÍMICA
Reatividade química depende dos elétrons mais externos
Elementos mais estáveis e menos reativos são os gases nobres: He; Ar; Kr; Xe; Rn
Com exceção do He, com configuração 1s2, os outros têm camada mais externa com configuração s2p6
Elementos eletropositivos têm natureza metálica e perdem elétrons em reações químicas, produzindo íons positivos: CÁTIONS
Maioria dos elementos eletropositivos situa-se no lado esquerdo da tabela periódica
Elementos eletronegativos têm natureza não-metálica e recebem elétrons em reações químicas, produzindo íons negativos: ÂNIONS
1.5 A Tabela Periódica
Segundo a configuração eletrônica de cada elemento químico foi proposto a atual Tabela Periódica, a qual ilustra as características fundamentais dos elementos químicos como:
Metais, Não Metais, Semi-metais, Gases nobres e o Hidrogênio.
Por que os átomos formam ligações?
átomos ligados são termodinamicamente mais estáveis; átomos ligados exibem diminuição da energia potencial;
formação de ligações depende da reatividade química, dos átomos envolvidos, constituição da última camada;
elétrons mais externos são os que participam das ligações;
Átomos se ligam:
2 LIGAÇÕES QUÍMICAS
LIGAÇÕES PRIMÁRIAS IÔNICA; METÁLICA E COVALENTE.
LIGAÇÕES SECUNDÁRIAS OCORREM A PARTIR DE FORÇAS
ELETROSTÁTICAS OU DE VAN DER WALLS POR: EFEITO DE DISPERSÃO,
DIPOLO-DIPOLO E PONTES DE HIDROGÊNIO.
2.1 LIGAÇÃO IÔNICA
ELEMENTO ELETROPOSITIVO (METAL) +
ELEMENTO ELETRONEGATIVO (NÃO-METAL) (Cerâmicos)
Propriedades dos compostos iônicos;
São sólidos nas condições ambiente;
Apresentam altos pontos de fusão e ebulição;
São condutores de eletricidade quando no estado líquido (fundidos) ou quando dissolvidos em água;
2.2 LIGAÇÃO METÁLICA
ELEMENTO ELETROPOSITIVO (METAL) +
ELEMENTO ELETROPOSITIVO (METAL) (Metálicos)
Representação das ligações metálicas entre os cátions positivos e a nuvem de elétrons livres.
Propriedades
Alta condutividade elétrica e térmica: os elétrons podem se mover em presença de uma f.e.m. ou de um gradiente de temperatura;
Permitem grande deformação plástica, pois as ligações são móveis, ou seja, não são rígidas como as iônicas e as covalentes;
Possuem o brilho metálico, como os elétrons são muito móveis trocam de nível energético com facilidade emitindo fótons;
São sempre opacos: pela mesma razão acima, mas nesse caso absorvendo a luz incidente.
“As propriedades típicas dos metais devem-se fundamentalmente a presença da nuvem de elétrons livres em sua estrutura”
2.3 LIGAÇÃO COVALENTE
ELEMENTO ELETRONEGATIVO (NÃO-METAL) +
ELEMENTO ELETRONEGATIVO (NÃO-METAL)
Propriedades dos compostos moleculares:
São sólidos, líquidos ou gasosos nas condições ambiente;
Apresentam baixos pontos de fusão e ebulição (comparados aos iônicos);
São maus condutores de eletricidade, alguns podem conduzir quando em meio aquoso (ionização);
A maioria dos compostos é solúvel em solventes orgânicos.
“As propriedades típicas dos materiais orgânicos devem-se fundamentalmente as ligações secundárias de Van der Waals e suas massas moleculares”
2.4 Ligações secundárias de Van der Waals.
São ligações fracas devidas às: forças entre dipolos permanentes nas moléculas polares; forças de London, também chamada de forças de dispersão causadas em baixas temperaturas; ou ainda por dipolos por hidrogênio.
(a) (b) (c)
3 A ESTRURURA DOS MATERIAIS SÓLIDOS
Em função da natureza das ligações atômicas, os materiais sólidos exibem três tipos de estruturas atômicas:
a) Estrutura Cristalina
Sólidos Metálicos - Ex.: Au, Pb, Cu. Sólidos Iônicos - Ex.: NaCl, MgO. Sólidos Covalentes - Ex.: Diamante, Si.
Definição de Cristal
Sólidos cristalinos: Uma substância pode ser considerada cristalina quando os átomos (ou moléculas) que a constitui estão dispostos segundo uma rede tridimensional bem definida e que é repetida por milhões de vezes. (Ordem de longo alcance). Exemplos: Todos os metais e a maior parte das cerâmicas
b) Estrutura Amorfa
Materiais Cerâmicos - Ex.: vidro.
Materiais Poliméricos - Ex.: cadeias complexas.
Materiais Metálicos Solidificados Rapidamente - Ex.: ligas complexas.
Sólidos amorfos ou não-cristalinos: em geral, não apresentam regularidade na distribuição dos átomos e podem ser considerados como líquidos extremamente viscosos. Exemplos: Vidro, piche e vários polímeros.
c) Estrutura Molecular
Materiais Poliméricos - Ex.: polietileno, borracha natural.
3.1 ESTRUTURAS CRISTALINAS
Exemplos de sistemas cristalinos
Cúbico Simples Cúbico de Corpo Centrado
Cúbico de Fase Centrada Tetragonal de corpo Centrado
a) Características do sistema cúbico de corpo centrado – CCC
Fator de empacotamento atômico = 068 Parâmetro do retículo a = 4r/ √3
b) Características do sistema cúbico de fase centrada – CFC
c) Características do sistema hexagonal Compacto – HC
Fator de empacotamento atômico = 0,72 Parâmetro do retículo a = 2r
“A única diferença entre o sistema CFC e o HC é a sequência de empilhamento”
d) Sequência de Empilhamento do Sistema Hexagonal Compacto
3.2 Método de Difração de Raio X
A análise e estudo da estrutura cristalina pode ser feito pelo Método de Difração de Raio X.
• A estrutura de um cristal pode ser determinada pela análise de um feixe de Raio X refletido com interferência construtiva quando o ângulo de incidência é igual ao ângulo de reflexão.
• É baseado no princípio de interferência de raios difratados de acordo com a lei de Bragg: n = 1, 2, 3 ....
= comprimento de onda
n = 2dsen
= 0,1541nm ( Cu K)d = distância entre planos
Representação da Difração de raios X Exemplo de um Difratograma (Intensidade relativa x ângulo de Difração 2)
No estudo da estrutura cristalino é importante observar os aspectos volumétricos dos interstícios, ou seja, dos espaços entre os átomos.
Interstícios octaédricos (esquerda) e tetraédricos (direita) em uma célula CFC.
Relação entre o tamanho do átomo de carbono e o interstício octaédrico em uma estrutura CCC
[Van Vlack]
Relação entre o tamanho do átomo de carbono e o interstício octaédrico em uma estrutura CFC
[Van Vlack]
DIREÇÕES E PLANOS CRISTALINOS
No estudo das estruturas cristalinas é muito importante reconhecer as direções e os planos cristalinos, pois eles podem explicar alguns comportamentos dos materiais metálicos.
Os sistemas cristalinos possuem direções de alta densidade atômicas lineares e planos atômicos densos e outros menos densos.
Representação dos Planos no Sistema Cubico. a) Planos Frontais (100), (010) e (001), Plano (011) e plano diagonal (111)
Exemplos de representação dos planos no Sistema Hexagonal.
4 IMPERFEIÇÕES CRISTALINAS
O entendimento sobre as imperfeições cristalinas permite-se compreender comportamentos e procedimentos tecnológicos possíveis para a modificação de propriedades dos materiais metálicos.
4.1 Imperfeições Pontuais
As Lacunas são caracterizadas pela ausência de um ou mais átomos no retículo cristalino. Impurezas, átomos diferentes ao da matriz, que podem ser intersticiais ou substitucionais.
“A presença de lacunas na estrutura cristalina explica o principal mecanismo para a
A DIFUSÃO ATÔMICA é definida como o transporte de átomos através da matéria. A Difusão tem como principal o mecanismo a presença das lacunas ou vacâncias. É o mecanismo responsável por processos importantes em materiais:
Endurecimento de aços e ligas Tratamentos como a solubilização.
A difusão pode ser denominada por autodifusão se ocorrer movimento de átomos do próprio material ou por interdifusão se ocorrer movimento de impurezas ou elementos de liga
Defeito pontual: átomo de impureza ou elemento de liga pode ser considerado como uma solução sólida substitucional ou intersticial.
Átomo substitucional maior e átomo menor que os átomos da matriz
As soluções sólidas também são reconhecidas como fases nas ligas metálicas
Fatores que influem na formação de soluções sólidas substitucionais.
Regras de Hume-Rothery
• Raio atômico deve ter uma diferença de no máximo 15 %
• Estrutura cristalina deve ser a mesma do metal matriz e do soluto
• Eletronegatividade próximas
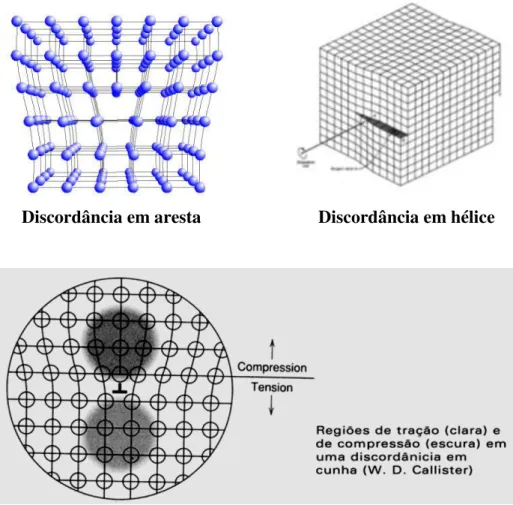
4.2 Imperfeições em Linha – Discordâncias
Discordância em aresta Discordância em hélice
Campos de tensões em uma Linha de Discordância em Aresta
Ilustração esquemática da movimentação de uma linha de discordância
Deformação plástica
• Nos materiais amorfos consiste no escoamento viscoso.
O mecanismo de deformação plástica é diferente para materiais cristalinos e materiais amorfos.
é o ângulo entre o vetor normal ao plano de deslizamento e a direção de tração
é o ângulo entre a direção de deslizamento e a direção de tração. Equação de Schmid
= (P/A).cos .cos = . cos .cos
Máx. = 0,5
Importante:
O principal mecanismo de deformação plástica nos metais é explicado pela movimentação das linhas de discordâncias.
As discordâncias movem-se nos planos de deslizamentos na direção do seu vetor de Burgers.
Observa-se que as discordâncias movem preferencialmente nos planos e direções densas, o que explica a anisotropia do cristal.
A movimentação das linhas de discordâncias produz a deformação plástica, que quando executada a frio, produz o endurecimento do metal:
Encruamento.
4.3 Defeitos planares
• Superfícies livres
• Fronteiras de grão
• Maclas
• Falhas de empilhamento
Ilustração esquemática de Contornos de Grãos
A macla é um tipo de defeito cristalino que pode ocorrer durante a solidificação, deformação plástica, recristalização ou crescimento de grão.
Maclação mecânica em metais CFC
Influência da temperatura de recozimento na resistência à tração e na ductilidade de uma liga de Cu-Zn.
Resumo:
• A condutividade elétrica dos metais depende do seu tipo típico de ligação atômica, do nível de impurezas, do grau de encruamento, entre outros fatores.
• As propriedades mecânicas dependem da estrutura dos metais.
• O encruamento ocorre quando a deformação plástica e realizada abaixo da temperatura de recristalização.
• A deformação plástica a quente ocorre acima da temperatura de recristalização, quando o processo de recuperação e recristalização da estrutura deformada ocorre.
• A permanência de um metal a temperatura acima da temperatura de recristalização, promove o crescimento de grãos, fator na maioria das vezes indesejáveis as propriedades mecânicas dos metais.
Bibliográfica
CALLISTER, D. W. Jr. Ciência e Engenharia de Materiais: Uma introdução. 4.ed. Livros Técnicos e Científicos Editora S.A. Rio de Janeiro 2002.
SHACKELFORD,J. F. Ciências dos Materiais. 6.ed. Ed. Pearson Prentice Hall, São Paulo, 2008. ASHBY, M. F; JONES, D. R. Engenharia de Materiais. 3.ed.; v.I e II, Elsevier Editora Ltada, São Paulo, 2007.
REED-HILL, R.E. Princípios de metalurgia Física. 2.ed. Ed. Guanabara Dois, Rio de Janeiro, 1982.
Unidade II
Transformações de Fases e Diagramas de Fases
Conteúdo
Transformações de Fases; Solução sólida e compostos;
Solidificação: A nucleação homogênea e nucleação heterogênea; Influência do resfriamento na estrutura bruta de solidificação; Segregações e poros;
Tipos de precipitados, coerentes e incoerentes, sua relação com a formação da microestrutura e propriedades mecânicas;
Diagramas de fase;
Definição: tipos de elementos de liga e residuais; Tipos de ligas ferrosas e não ferrosas;
Diagramas ternários; Diagrama Fe-C;
Influência genérica dos elementos de liga sobre o diagrama Fe-C;
Mecanismos de endurecimento (por solução sólida, por encruamento, por precipitação) e relação dos mecanismos de endurecimento com a microestrutura e propriedades mecânicas; Envelhecimento (e super-envelhecimento) por deformação e por aquecimento;
Influência do processamento termo-mecânico na estrutura da liga
Objetivos Gerais:
Dominar os fundamentos de metalurgia e siderurgia clássica;
Compreender e prever propriedades e características dos principais materiais usados em engenharia;
Objetivos Específicos do Módulo
Abordar os mecanismos da solidificação e de outras transformações de fases estudadas no decorrer do curso;
Mostrar a utilidade dos diagramas de fases para;
Demostrar que os diagramas de fases são ferramentas indispensáveis para o projeto de materiais para uso específico e que necessitam da previsão de suas estabilidades nas diferentes situações de serviços;
Familiarizar o aluno com os mecanismos de aumento da resistência mecânica dos materiais metálicos.
1. Transformações de Fases.
Uma fase é definida como um corpo macroscopicamente homogêneo de matéria.
O significado de uma fase é termodinamicamente exato, porém o termo é frequentemente usado, de maneira geral, para denominar uma solução sólida ou não.
As fases nas ligas são em geral soluções: sólidas, líquidas ou gasosas.
As fases sólidas se formam algumas vezes em intervalos de composição tão estreitos que são verdadeiros compostos.
Os compostos podem também ser considerados como soluções com solubilidade muito limitada.
Os metais polimórficos (alotrópicos) são aqueles que cristalizam-se em estruturas diferentes e estáveis em faixas distintas de temperatura, cada uma das estruturas cristalinas serão definidas como uma fase, as quais são designadas por letras gregas: α, β, , δ, etc.
1.1 Relembrando a Termodinâmica
1) Energia interna ou potencial de uma fase metálica:
Inclui-se na energia interna de uma fase metálica todas as formas de energias presentes em sua estrutura, tais como:
energia química de ligações interatômicas ;
energia térmica devido a vibrações atômicas, de difusão atômica ; energia superficial de contorno de grãos;
energia de deformação armazenada; energia de linhas de discordâncias ;
2) Nas transformações de fases e nas reações químicas encontram-se dois tipos de reações: Reações exotérmicas (libera calor), a soma das energias internas das fases a se transformar é
maior que a soma das energias internas das fases resultantes da transformação. Reações endotérmicas (recebe calor), inversa da anterior.
3) O calor é a energia térmica que flui entre sistemas e sua vizinhança como consequência da diferença de temperatura existente entre eles.
A energia pode também ser transferida entre um sistema e sua vizinhança por meio de trabalho.
Tanto o calor quanto o trabalho representam energia em trânsito entre sistemas e sua vizinhança.
O calor e o trabalho, ao contrário da temperatura, da pressão e do volume, não são propriedades intrínsecas de um sistema. Eles têm significado somente enquanto descrevem transferência de energia para dentro do sistema ou para fora, adicionando-se ou subtraindo-se da quantidade de energia interna do sistema.
Unidades de Calor: 1J = 0,239 cal = 9,48.10-4 BTU (British Thermal Unit)
Absorção de calor em sólidos e líquidos:
- Capacidade Térmica Q = C (Tf - Ti)
- Calor Específico Q = c.m (Tf - Ti)
- Calor Latente ou de transformação Q = L.m
Leis da Termodinâmica:
Lei Zero = Cada corpo tem uma propriedade chamada Temperatura.
1a Lei da Termodinâmica: ∆U = Q - τ ∆U = variação da energia interna Q = quantidade de calor transferido
Entalpia
1a Lei da Termodinâmica: ∆U = Q -
τ
∆U = variação da energia interna Q = quantidade de calor transferido
τ =
trabalhoA transferência de calor no processo será:
Q = ∆U +
τ
Se a transferência de calor ocorrer num processo quase estático à pressão constante, a transferência de calor do processo pode ser definida como uma propriedade extensiva chamada entalpia.
A propriedade termodinâmica entalpia
Em um sistema que sofra um processo quase estático à pressão constante, que não haja variação de energia cinética ou potencial e que o único trabalho realizado seja o associado ao movimento de fronteira.
Aplica-se a 1a lei da termodinâmica:
∆U = Q –
τ
⇒τ = F x d1-2 ⇒ F = P x A; tem-se τ = P x A x d1-2
Conclui-se que a transferência de calor durante o processo será: Q1 - 2 = ∆U +
τ.
Como todos os elementos dessa expressão são propriedades termodinâmicas, função apenas do estado do sistema, torna-se conveniente definir uma nova propriedade, a entalpia.
Lembrando ainda:
1- Calor específico a volume constante Cv = (∂u / ∂T)v. 2- Calor específico a pressão constante Cp = (∂h / ∂T)p.
A primeira lei da termodinâmica não é por si só suficiente para determinar o sentido de um
processo (transformação de fase ou reação química) é necessário entender a Entropia
Na natureza observa-se que um processo caminha espontaneamente para uma situação de
"maior desordem", ou seja, a transformação ocorre para uma situação onde haja uma distribuição cada vez mais uniforme de matéria e energia.
Para avaliar o "grau de desordem" de um sistema utiliza-se a grandeza denominada Entropia. Deve-se ao conceito da entropia a formulação da 2a lei da termodinâmica, não existe um sistema termodinâmico 100 % eficiente.
Conclui-se:
Uma transformação é espontânea quando há aumento de entropia.
Pelo terceiro princípio da termodinâmica, admite-se arbitrariamente uma situação em que a entropia seria igual à zero. A partir desta referência têm-se os valores da entropia das substâncias em quaisquer temperaturas.
Uma substância, na forma de um cristal perfeito, a zero Kelvin, tem entropia igual à zero.
A energia livre de Gibbs
Um processo libera calor ele é espontâneo Um processo aumenta a desordem ele é espontâneo
As transformações de fases podem ocorrer, ativadas pela energia livre de Gibbs.
A Energia de Ativação, energia necessária para que um átomo possa atingir o ponto crítico (Pt), figura 01.
Figura 01– Energia de Ativação
A Figura 02 mostra a energia livre de uma fase liquida e outra sólida, a variação de energia livre G, pode agir como energia de ativação para uma transformação de fase.
Figura 02 - Energia livre de Gibbs
1.2 Solidificação
O processo de solidificação, como quase todos os outros processos de transformações de fases, passa por um processo de nucleação e crescimento.
Figura 03– Curva de resfriamento de uma substância pura
Na sequência da transformação na região do patamar, tem-se líquido e sólido, na mesma temperatura e o processo de crescimento, ou seja, a transformação de fase.
Neste caso a solidificação.
A temperatura permanece constante porque há liberação de calor latente pelo sólido formado. Então o sólido formado tem energia menor que o líquido que lhe deu origem.
O sólido contribui então para o abaixamento da energia do sistema.
No processo de nucleação da nova fase, no caso o sólido, uma barreira de energia associada à superfície da interfase sólido/líquido, tem que ser vencida para que possa ter a nucleação da nova fase, a sólida.
Como a solidificação é um processo espontâneo, o sólido formado terá a forma que contribuirá para o máximo abaixamento de energia livre de Gibbs.
A forma geométrica que têm o máximo de volume com um mínimo de superfície é a esfera. Os primeiros sólidos formados, chamados embriões, terão então o formato esférico e a partir deles deverá ocorrer à nucleação. Condição necessária para que a transformação se inicie e continue.
1.2.1 Nucleação Homogênea.
A nucleação homogênea ocorre teoricamente sem influência do meio
Imagine um Embrião em uma temperatura próxima a temperatura de transformação, no caso a fusão.
Figura 04– Ilustração de um embriao em equilibrio
A transformação terá início quando houver a ativação, ou seja, o sistema tiver energia suficiente para vencer o ganho de energia superficial da nova fase, no caso o sólido, descrito a seguir:
Variação de energia livre de Gibbs na Nucleação
∆G = - ∆Gvolume + ∆GSuperfície
- ∆Gvolume = - (4/3)πr3 [ L.( ∆T/Tf)]
L = Calor latente de Fusão
∆T = Super-resfriamento
Tf = Ponto de Fusão
∆GSuperfície = 4πr2
σ
SL = 4πr2σ
SL = Energia superficial, também representado por Na Figura 05 observa-se que a energia livre de Gibbs do sistema cresce, passa por um máximo e em seguida decresce.
No processo o qual a energia livre aumenta, tem-se o efeito do acréscimo de energia proveniente da superfície do embrião.
Quando a transformação é ativada, através de uma energia de ativação, tem-se um decréscimo de energia livre maior, resultante da formação do volume sólido, do que ao aumento da energia superficial da nova fase sólida. Nesta condição tem-se a nucleação.
Qualquer embrião com raio menor que o crítico dissolve.
Qualquer embrião com raio maior ao critico nucleará e crescerá.
Figura 06 - (a) Representação da energia Superficial e Volumétrica (b) Representação da Energia Livre no sistema.
Para:
rc = ε [Tf/ ∆T] onde ε = [σSL/ L] = 0,4 e ∆T = 0,2 Tf
Tem-se uma ordem de grandeza de 200 átomos por núcleo. [GARCIA, A. 2001]
Efeito do super-resfriamento (∆T) sobre o tamanho do raio crítico (rc).
Com o aumento do ∆T, menor será o rc necessário para a nucleação da nova fase.
1.2.2 Nucleação heterogênea
Quando o sólido é formado dentro do próprio líquido com o auxílio de algum tipo de estimulante ativador da nova fase sólida, diz-se que a nucleação é heterogênea, com a presença de:
• Impurezas;
• Inclusões sólidas;
• Paredes do recipiente;
Os agentes estranhos ao sistema são denominados substratos, e atuam como elementos facilitadores do processo de nucleação.
A presença de um substrato faz com que haja a redução da energia de superfície. Como consequência haverá um menor raio crítico e uma menor energia crítica, implicando numa facilitação da nucleação e, por conseguinte surgindo um maior número de núcleos, elevando o processo de nucleação.
A Figura 07 mostra o ângulo de molhamento de um substrato.
Figura 07– Ângulo de molhamento de um substrato
O ângulo θ denominado de molhamento, traduz a afinidade físico/química entre o embrião e o
substrato. Quanto θ = 180º tem-se uma condição similar à nucleação homogênea.
A eficiência do agente nucleante é quantificada pelo o parâmetro δ. Onde se tem um forte efeito nucleante à condição de δ < 0,15
δ = (aT - aS)/ aS ; onde aS = parâmetro de rede do núcleo sólido aT = parâmetro de rede do agente nucleante.
1.2.3 Crescimento
Metal Puro
Para gradientes de temperatura no metal fundido normal, ou positivo, crescimento facetado, o crescimento ocorre uniformemente e é planar.
Para gradiente invertido, ou negativo, crescimento colunar e dendritico, figura 08.
Ligas Monofásicas:
Superesfriamento constitucional, representado na figura 09.
Figura 09– Superesfriamenro Constitucional (SRC)
a) Solidificação de uma liga de composição Co nas condições de equilíbrio, b) Superesfriamento constitucional, curva de concentração do soluto em função da distância à interface sólido/líquido; c) temperatura liquidus (1) e gradiente de temperatura correspondente (2) em função da distância à interface.
A Figura 10 mostra esquematicamente o efeito do superesfriamento sobre a morfologia da estrutura solidificada.
Figura 10 - Visualização do efeito do superesfriamento constitucional
Na Figura 11, observa-se o efeito do soluto e do inoculante sofre a estrutura de um lingote solidificado.
• Grãos equiaxiais
– Crescimento de cristais aproximadamente igual em todas as direções
– Solidificação rápida
– Usualmente adjacentes a parede fria do molde, (zona Chill, ou coquilhada) mas podem aparecer no centro do lingote também dependendo do tamanho do molde e da velocidade de resfriamento.
• Grãos colunares
– Longos, finos, grosseiros
– Solidificação relativamente lenta em gradiente de temperatura
– Perpendiculares à parede fria do molde
A Figura 12 mostra os efeitos da contração e segregação durante a solidificação.
Figura 12 - Ilustração esquemática do fenômeno de contração e segregaçao durante a solidificação.
1.2.4 A precipitação de uma nova fase.
A precipitação de uma nova fase tem seu mecanismo de transformação baseado nos fenômenos de nucleação e crescimento, conforme vistos anteriormente.
O primeiro estágio de precipitação é a formação de pequenas regiões contendo principalmente átomos de soluto, conhecidas como zonas GP (Guinier-Preston) na rede da matriz, seguida da formação de uma fase de transição (como θ”) estruturalmente semelhante ao precipitado de
equilíbrio θ. Uma importante característica da fase de transição e sua coerência, mostrada na figura 13.
2 Diagramas de Fases
Os metais são geralmente utilizados na forma de ligas, ou seja; consistem em “misturas” de
dois ou mais elementos químicos. Nas ligas metálicas, pelo menos um dos elementos é metal e a liga resultante apresenta características metálicas. Os diagramas de fase permitem obter informação sobre uma liga como:
Temperatura de fusão
Fases presentes em função da temperatura Composição química das fases
Proporção das fases Limite de Solubilidade Distribuição de fases
As fases em um diagrama são na realidade soluções sólidas substitucionais e soluções sólidas intersticiais, a figura 14 mostra esquematicamente em (a) uma solução sólida substitucinal e em (b) uma solução sólida intersticial.
(a) (b)
Figura 14 – (a) Solução sólida substitucinal (b) Solução sólida intersticial.
Construção de um Diagrama de Equilíbrio
1. Tomemos os elementos A e B, no exemplo os elementos são insolúveis. 2. Determinam-se as temperaturas de fusão dos elementos A e B.
3. Determinam-se as temperaturas de início e de fim de solidificação de misturas de A + B. A Figura 15 ilustra as curva de fusão de cada uma das Misturas de A+B e posteriormente o diagrama de equilíbrio para o sistema AB.
Os diagramas de equilíbrio podem ser constituir de elementos que se solubilizam mutuamente, ou seja, atende as 4 Regras de Hume-Rothery e formam os sistemas isomorfos conforme ilustrado na figura 16.
Figura 16– Diagrama Cobre-Níquel, sistema isomorfo.
A Figura 1.17 mostra um diagrama Cobre-Prata com solubilidade parcial entre os elementos e com um Eutético.
A Tabela 01 mostra as várias reações dos diagramas de fases
Tabela 01 – Reações dos invariantes em Diagramas de Fases
A Figura 1.18 ilustra esquematicamente as transformações de fase durante a solidificação de uma liga 60Pb40Sn.
3 O envelhecimento
As zonas GP responsável pelo endurecimento
A precipitação de uma nova fase.
O primeiro estágio de precipitação é a formação de pequenas regiões contendo principalmente átomos de soluto, conhecidas como zonas GP (Guinier-Preston) na rede da matriz, seguida da formação de uma fase de transição (como θ”) estruturalmente semelhante ao precipitado de equilíbrio θ. Uma importante característica da fase de transição e sua coerência.
Zonas Guinier-Preston (GP): homenagem aos cientistas que revelaram a estrutura dessas zonas através de estudos de difração de raios-x. Por exemplo, no sistema Al-Cu, os átomos de Cu precipitam paralelos aos planos {100} da matriz de alumínio, então o contraste entre as fases depende muito da espessura da amostra
O mecanismo de endurecimento por precipitação envolve a formação de conjuntos coerentes de átomos de soluto (os átomos de soluto estão unidos em um conjunto que ainda tem a mesma estrutura cristalina como a fase solvente). Isto causa uma grande deformação devido ao desencontro entre os átomos de solvente e do soluto. Consequentemente, a presença de partículas precipitadas e mais importante ainda os campos de tensão na matriz circundando as partículas coerentes, fornecem altas resistências por obstrução e retardo do movimento das discordâncias.
A Figura 1.19 mostra uma sequência de tratamentos de solubilização e envelhecimento para uma liga de Alumínio.
O superenvelhecimento é caracterizado pela redução da resistência mecânica com o tempo de envelhecimento. Quando o tempo de envelhecimento é superior ao ponto de resistência máxima, os
precipitados coerentes de fase θ aumentam de tamanho e tornam-se incoerentes, diminuindo a
resistência mecânica, a figura 1.20 ilustra o tratamento de Superenvelhecimento.
Figura 1.20– representação do tratamento de superenvelhecimento.
Alumínio e suas ligas
O alumínio é um metal caracterizado por sua baixa densidade, baixa resistência mecânica, embora tratamentos térmicos e mecânicos, particularmente para certas ligas de Al, possam levar a níveis razoavelmente elevados de resistência mecânica, boa resistência à corrosão e elevadas condutividades térmica e elétrica.
Existe um grande número de ligas de alumínio que podem apresentar um amplo espectro de propriedades. Estas ligas são classificadas geralmente por um sistema de quatro dígitos desenvolvido pela Aluminum Association:
Alumínio comercialmente puro (>99,0%Al) 1XXX
Cobre 2XXX
Manganês 3XXX
Silício 4XXX
Magnésio 5XXX
Magnésio/Silício 6XXX
Zinco 7XXX
As ligas de alumínio, principalmente dos grupos 1XXX, 3XXX, 4XXX e 5XXX, não são tratáveis termicamente enquanto as dos grupos 2XXX, 6XXX e 7XXX podem ser tratadas termicamente.
As ligas não endurecíeis por tratamento térmico podem ser endurecidas por solução sólida e por encruamento.
Para as ligas tratáveis termicamente, o principal tratamento é o de solubilização e envelhecimento para causar endurecimento por precipitação. Este tratamento pode ser combinado com um encruamento antes do envelhecimento para maximizar o ganho de resistência mecânica.
A condição ou estado da liga de alumínio pode ser indicado por um conjunto de letras e números colocados ao final de sua classificação. A designação da condição para ligas não tratáveis termicamente é mostrada, de forma resumida, na tabela 2.
Tabela 2– Designação da condição de ligas não tratáveis termicamente.
A designação para ligas tratáveis é mostrada de forma resumida, na tabela 3.
A seguir será apresentada a relação de classificação de tipos de tratamentos, adotada pela Aluminum Association:
F = como fabricado: aplica-se aos produtos resultantes de conformação mecânica (laminação, extrusão e outros)
O = recozido: aplica-se aos produtos inicialmente trabalhados e depois recozidos para obter a resistência mecânica mais baixa, e aos produtos fundidos que são recozidos com o objetivo de aumentar a dutilidade e a estabilidade dimensional. A letra O pode ser seguida por um número diferente de zero.
W = solubilizado: uma têmpera instável aplicável somente às ligas que envelhecem espontaneamente na temperatura ambiente (envelhecimento natural) após solubilização. Esta designação é especificamente usada quando o período de envelhecimento natural é indicado, como por exemplo no caso de W ½ h.
T = termicamente tratado para produzir têmperas estáveis diferentes de F, O ou H: aplica-se aos produtos que são termicamente tratados, com ou sem deformação suplementar, para produzir têmperas estáveis.
A letra T é sempre seguida por um ou mais dígitos. Um período de envelhecimento natural pode ocorrer entre as operações relacionadas para as têmperas T. Sempre que for necessário do ponto de vista metalúrgico, deve haver um controle rigoroso desse período. Números de 1 a 10 indicam sequências de tratamentos específicas:
T1 = resfriado de uma temperatura elevada em um processo de conformação e envelhecido naturalmente até uma condição substancialmente estável. Aplica-se a produtos que não são trabalhados a frio após resfriamento de uma temperatura elevada em um processo de conformação a quente, ou nos quais o efeito do trabalho a frio no endireitamento ou na planificação é reconhecido nos limites de propriedades mecânicas.
T3 = solubilizado, trabalhado a frio e envelhecido naturalmente até uma condição substancialmente estável. Aplica-se a produtos que são trabalhados a frio para aumentar a resistência mecânica após solubilização, ou nos quais o efeito do trabalho mecânico no endireitamento ou na planificação é reconhecido nos limites de propriedades mecânicas.
T4 = solubilizado e envelhecido naturalmente até uma condição substancialmente estável. Aplica-se a produtos que não são trabalhados mecanicamente após solubilização, ou nos quais o efeito do trabalho a frio no endireitamento ou a planificação pode não ser reconhecido nos limites de propriedades mecânicas.
T5 = resfriado de uma temperatura elevada em um processo de conformação e envelhecido naturalmente. Aplica-se a produtos que não são trabalhados a frio após resfriamento de uma temperatura elevada em um processo de conformação a quente, ou nos quais o efeito do trabalho a frio no endireitamento ou a planificação pode não ser reconhecido nos limites de propriedades mecânicas.
T6 = solubilizado e envelhecido artificialmente. Aplica-se a produtos que não são trabalhados a frio após solubilização, ou nos quais o efeito do trabalho a frio no endireitamento ou a planificação pode não ser reconhecido nos limites de propriedades mecânicas.
T7 = solubilizado e estabilizado. Aplica-se a produtos que são estabilizados após solubilização para levá-los além do ponto de máxima resistência mecânica, de modo a permitir o controle de alguma característica especial.
T8 = solubilizado, trabalghado a frio, e então envelhecido artificialmente. Aplica-se a produtos que são trabalhados a frio para aumentar a resistência mecânica, ou nos quais o efeito do trabalho mecânico no endireitamento ou na planificação é reconhecido nos limites de propriedades mecânicas.
T9 = solubilizado, envelhecido artificialmente e trabalhado a frio. Aplica-se a produtos que são trabalhados a frio para aumentar a resistência mecânica.
na planificação é reconhecido nos limites de propriedades mecânicas.
O tratamento de solubilização consiste em aquecer um produto, fundido ou trabalhado mecanicamente a uma temperatura adequada, manter a liga nessa temperatura por tempo suficiente para que os átomos de soluto se difundam de modo que se dissolvam na matriz, e resfriar rapidamente o material de modo a manter os elementos de liga dissolvidos na matriz. Algumas ligas da séria 6XXX atingem as mesmas propriedades quando solubilizadas em forno ou resfriadas de uma elevada temperatura de trabalho a quente, desde que o resfriamento seja rápido o suficiente para manter todo soluto em solução sólida. Neste caso as denominações de têmpera T3, T4, T6, T7, T8 e T9 podem ser mantidas e podem ser aplicadas em ambos os casos.
As denominações seguintes, envolvendo dígitos adicionais são usadas para o caso de materiais submetidos a alívios de tensões de produtos trabalhados:
T-51 = submetido a alívio de tensões por estiramento. Aplica-se aos seguintes produtos quando estirados, sendo indicado o grau de estiramento (em %), após solubilização ou resfriamento a parir de trabalho a quente:
Placas: 1,5 a 3 % de ajuste permanente. Vergalhões, barras, perfis e tubos extrudados: 1 a 3 % de ajuste permanente. Tubos trefilados: 0,5 a 3 % de ajuste permanente. Aplica-se diretamente a placas e barras e vergalhões laminados ou acabados a frio. Esses produtos não sofrem nenhum endireitamento adicional após o estiramento. Aplica-se a vergalhões, barras, tubos e perfis extrudados e também tubos trefilados, quando denominados de maneira mostrada a seguir:
T-510: produtos não sofrem endireitamento adicional após estiramento.
T-511: produtos que podem sofrer um pequeno endireitamento após o estiramento, de modo a se enquadrar nas tolerâncias padronizadas.
T-52 = submetido a alívio de tensões por compressão. Aplica-se aos produtos que foram submetidos a alívio de tensões por compressão após solubilização ou resfriamento a partir do trabalho a quente de modo a produzir um ajuste permanente de 1 a 5 %.
Os mesmos dígitos (51, 52 e 54) podem ser adicionados à designação W para indicar um produto solubilizado instável e submetido a alívio de tensões. As seguintes designações são usadas para classificar produtos trabalhados e termicamente tratados das têmperas O ou F, para manifestar resposta a tratamentos térmicos:
T42 = solubilizado a partir das têmperas O ou F para demonstrar resposta ao tratamento térmico e envelhecido naturalmente até uma condição suficientemente estável.
T62 = solubilizado a partir das têmperas O ou F para demonstrar resposta ao tratamento térmico e envelhecido artificialmente.
As denominações de têmpera T42 e T62 também podem ser aplicadas a produtos trabalhados e termicamente tratados a partir de qualquer têmpera, quando esses tratamentos resultam em propriedades mecânicas compatíveis com essas têmperas.
A seguir são apresentadas temperaturas consideradas ideais para alguns tipos de tratamento térmico de algumas ligas de alumínio:
Tabela 4– Temperaturas de recozimento completo
Liga Temperatura (ºC)
1060, 1100, 1350 345
2014, 2017, 2024, 2117, 2124, 2219 415
2036 385
3003, 3004, 3105 345
5005, 5050, 5052, 5056, 5083, 5086, 5154, 5182, 5254, 5454, 5456, 5457, 5652 345
6005, 6009, 6010, 6053, 6061 6063, 6066 415
7005 345
7001, 7049, 7050, 7075, 7079, 7178, 7475 415
Tabela 5– Temperaturas de solubilização e envelhecimento (série 2XXX).
Liga T solubilização (ºC) T envelhecimento (ºC)
2011 525 160
2025 515 170
2219 535 175
2018 495 170
2024 495 190
2036 500 190
2038 540 205
2218 510 170
2008 510 205
2014 500 160
2017, 2117 500 170
2618 530 200
2090 540 165
2091 530 120
Tabela 6– Temperaturas de solubilização e envelhecimento (série 6XXX).
Liga T solubilização (ºC) T envelhecimento (ºC)
6005 530 175
6009 555 205
6010 565 205
6053 520 170
6061 530 175
6063 520 175
6013 570 190
6066 530 175
6070 545 160
6111 560 175
6151 515 170
6262 540 175
6463 520 175
Tabela 7– Temperaturas de solubilização e envelhecimento (série 7XXX).
Liga T solubilização (ºC) T envelhecimento (ºC)
7001 465 120
7050 475 120 e 160 (2 etapas)
7075 480 120
7175 470 120
7475 510 120
Alclad 7475 495 120
Tabela 8– Temperaturas de solubilização e envelhecimento (ligas fundidas).
Liga T solubilização (ºC) T envelhecimento (ºC)
201.0 525-530 155
204.0 530 140-180
206.0 525-530 155
222.0 510 155
295.0 515 155
296.0 510 155
328.0 515 155
333.0 505 155
336.0 515 155
355.0 525 155
356.0 540 155
Ligas de titânio
Comparação do Ti com aços:
A densidade deste metal é de aproximadamente 56% da maioria dos aços liga. Módulo de elasticidade e expansão térmica do Ti é de aproximadamente 50% dos
aços.
Três principais razões para aplicações:
Alta resistência mecânica e baixa densidade: motor a jato, estrutura aeronáutica, componentes tubulares, válvulas de pressão, transporte automotivo, presilhas, equipamentos esportivos, construção civil, ligas com memória de forma;
Alta resistência a corrosão: indústria química e petroquímica, tubulações marinhos, reatores, trocador de calor, estação nuclear, relógios, computadores, sistemas ópticos; Biocompatibilidade: implantes cirúrgicos.
Classificação das ligas de Ti conforme a microestrutura
Conforme a presença das fases α e β na microestrutura, as ligas são classificadas em cinco
tipos conforme mostra quadro 01.
Quadro 01– Classificação das ligas de titânio conforme microestrutura.
Bibliográfica
CALLISTER, D. W. Jr. Ciência e Engenharia de Materiais: Uma introdução. 4.ed. Livros Técnicos e Científicos Editora S.A. Rio de Janeiro 2002.
SHACKELFORD,J. F. Ciências dos Materiais. 6.ed. Ed. Pearson Prentice Hall, São Paulo, 2008.
ASHBY, M. F; JONES, D. R. Engenharia de Materiais. 3.ed.; v.I e II, Elsevier Editora Ltada, São Paulo, 2007.
REED-HILL, R.E. Princípios de metalurgia Física. 2.ed. Ed. Guanabara Dois, Rio de Janeiro, 1982.
UNIDADE III
Processamento Térmico de ligas Metálicas
Conteúdo
Solidificação do ferro e transformações de líquido para o estado sólido; Diagrama Fe-C; microestruturas da liga Fe-C (perlita, ledeburita, etc.); Influência genérica dos elementos de liga sobre o diagrama Fe-C; Ligas ferrosas com campo predominante gamagênico crescente;
Diagramas Tempo Temperatura Transformação (TTT) e de transformação com resfriamento contínuo (TRC);
Técnicas de levantamento de diagramas;
Influência dos elementos de liga e tamanho de grão sobre os digramas TRC; Elementos formadores de carbonetos e nitretos;
Temperabilidade (definição e métodos utilizados para avaliar a temperabilidade), Classificação dos métodos de tratamentos térmicos.
Objetivo
Entender os mecanismos de transformações de fases do Sistema Fe-C.
Conhecer e aplicar tecnologicamente os fatores de influência sobre as propriedades das ligas Fe-C.
Interpretar os diagramas de transformações fase para a correta especificação dos tratamentos térmicos dos aços
Conhecer os fenômenos que interferem negativamente na aplicação dos aços.
Solidificação dos aços
Após a etapa de refino, o aço está pronto para ser “vazado” e solidificado. A
solidificação ocorre por nucleação e crescimento. Esta etapa de solidificação chama-se lingotamento, o qual pode ser convencional ou contínuo.
No lingotamento contínuo, o aço líquido é vazado em um grande reservatório chamado distribuidor. Do distribuidor, o aço líquido segue por dois moldes metálicos de cobre na forma de tubos que são refrigerados com água.
Quando saem destes moldes, o aço já solidificado recebe “sprays” de água para
completar o resfriamento. Durante o resfriamento, o aço é cortado com dimensões padronizadas por tesouras, recebendo o nome de tarugo.
Tanto o lingote quanto o tarugo são, então, levados para a etapa de laminação, onde serão transformados em uma série de produtos, tais como barras, perfis, chapas, fio máquina entre outros.
O aço líquido é homogêneo, mas durante a solidificação surgem defeitos que tornam o material sólido heterogêneo.
Alguns defeitos são eliminados durante a fabricação do produto final (acabado) outros defeitos são tornam-se até mais evidentes no produto final.
Defeitos de solidificação
Alguns defeitos são removíveis com tratamento térmicos e ou termomecânicos, outros podem persistir e até evidenciarem-se no produto final.
Os defeitos comuns devidos à solidificação após fabricação:
Gotas frias, pequenas gotas respingam contra as paredes da lingoteira, resfriando-se e oxidando-se, quando presas a parede não aderem muito bem ao lingote;
Inclusão da areia do molde nas paredes internas ou externas da peça. Isso causa problemas de usinagem: os grãos de areia são abrasivos e, por isso, estragam a ferramenta. Além disso, causam defeitos na superfície da peça usinada.
Defeitos de composição da liga metálica que causam o aparecimento de partículas duras indesejáveis no material. Isso também causa desgaste da ferramenta de usinagem.
Bolhas, vazios oriundos de gases dissolvidos no líquido e que ficaram retidos no lingote fundido. Para se evitar as bolhas utilizam-se, desoxidantes.
Trincas, ocasionadas pelas tensões excessivas que se desenvolvem durante o resfriamento ou ainda devido ao formato desigual das peças, impedindo o resfriamento uniforme.
Segregação, ao solidificar um metal, as impurezas como: fósforo e enxofre, não são tão solúveis no estado sólido como no líquido, portanto são segregadas para o líquido quando a solidificação se propaga. A solidificação caminha da periferia para o centro, portanto é no centro que as impurezas se acumulam, esse fenômeno é denominado segregação.
do estado líquido para o sólido diminui seu volume, portanto aparecerá uma região central no lingote ou peça que se chama rechupe.
Diagrama Fe-C e microestruturas típicas
Os Aços e Ferros Fundidos são ligas fundamentalmente compostas por Ferro e Carbono, a figura 01 mostra a alotropia do Ferro puro.
Figura 01- Formas alotrópicas do Ferro Puro
A Figura 02 mostra o diagrama Fe-C, na qual pode-se visualizar as fase presentes para as composições químicas das ligas que caracterizam os aços e os ferros fundidos na temperatura ambiente até as temperaturas de fusão, e ainda, observar as reações peritética a 1493º C, a reação eutética a 1147º C e a reação eutetóide a 727º C.
Os aços são ligas Fe-C com teores de até 2,14% de Carbono e os ferros fundidos com teores acima de 2,14% de C.
As fases típicas do diagrama Fe-C são:
AUSTENITA (do nome do metalurgista inglês Robert Austen) - Consiste em uma solução sólida intersticial de C (com até 2,14%) no ferro CFC. Em aços ao carbono e aços baixa liga só é estável acima de 727°C. Apresenta resistência mecânica em torno de 150 MPa e elevada ductilidade e tenacidade. A austenita não é magnética.
FERRITA (do latim "ferrum") - Consiste em uma solução sólida intersticial de C (com até 0,022%) no ferro CCC. A Ferrita é magnética e apresenta baixa resistência mecânica, cerca de 300 MPa, excelente tenacidade e elevada ductilidade.
CEMENTITA (do latim "caementum") - Denominação do carboneto de ferro Fe3C contendo 6,7% de C e estrutura cristalina ortorrômbica. Apresenta elevada dureza, baixa resistência, baixa ductilidade e baixa tenacidade.
PERLITA (nome derivado da estrutura da madre pérola observada ao microscópio) Consiste na mistura mecânica das fases ferrita (88% em peso) e cementita (12% em peso) formada pelo crescimento cooperativo destas fases. Apresenta propriedades intermediárias entre a ferrita e a cementita dependendo do tamanho e espaçamento das lamelas de cementita.
A Tabela 01 mostra as propriedades das fases do diagrama Fe-C para os aços
Tabela 01 - Propriedades das fases do diagrama Fe-C para os aços
Nas composições dos aços encontra-se a reação eutetóide, o que permite classifica-los como: Aços hipoeutetóides, Carbono inferior a 0,77%;
Aço eutetóide com 0,77% de C;
Aços hipereutetóides, Carbono superior a 0,77% até 2,14%.
Na Figura 03, pode-se observar a micrografia da Ferrita ampliada 90x em (a) e a Austenita ampliada 325x.
[Callister, 2002]
A Figura 04 ilustra a transformação da Austenita em Perlita, formam-se os primeiros núcleos de Ferrita, a qual não solubiliza mais do que 0,022% de Carbono, o Carbono então é segregado, e quando atinge a percentagem igual a 6,7% de Carbono (em peso), formam-se as lamelas de Cementita.
[Callister, 2002]
Figura 04 –Ilustração esquemática da transformação da Austenita em Perlita
A Figura 05 demonstra a transformação de um aço hipoeutetóide durante sua solidificação, em regime de equilíbrio, ou seja, a velocidade de resfriamento não interfere nas transformações das fases resultantes.
[Callister, 2002]
A Figura 06 mostra a micrografia de um aço hipoeutetóide com 0,38% de C.
[Callister, 2002]
Figura 06 - Micrografia de um aço hipoeutetóide com 0,38% de C
A Figura 07 demonstra a transformação de um aço Eutetóide durante sua solidificação, em regime de equilíbrio.
[Callister, 2002]
Figura 07 - Transformação de um aço Eutetóide durante sua solidificação
A Figura 08 mostra a micrografia de um aço Eutetóide com 0,76% C.
[Callister, 2002]
A Figura 09 demonstra a transformação de um aço Hipereutetóide durante sua solidificação, em regime de equilíbrio.
[Callister, 2002]
Figura 09 - Transformação de um aço Hipereutetóide durante sua solidificação.
A Figura 10 mostra a micrografia de um aço hipereutetóide com 1,4% C ampliada 1000x.
[Callister, 2002]
Figura 10 - Micrografia de um aço hipereutetóide com 1,4% C
Austenita transforma-se em Perlita. Os Ferros Fundidos podem se classificarem em Hipoeutéticos, Eutético e Hipereutético designados Ferros Fundidos Brancos e com aplicações tecnológicas limitadas, a figura 11 mostra uma micrografia de um Ferro Fundido Branco Eutético tendo como estrutura a Ledeburita (glóbulos de perlita c/ fundo de cementita).
Figura 11– Ferro Fundido Branco Eutético
A Figura 12 mostra a estrutura de um Ferro Fundido Branco hipoeutético, com a perlita envolvida pela ledeburita.
Figura 12– Ferro Fundido Branco Hipoeutético
A Figura 13 mostra a estrutura de um Ferro Fundido Branco hipereutético, com cristais de cementita envolvida pela ledeburita.
A obtenção dos ferros fundidos com uma ampla gama de aplicações tecnológicas exige a adição de elementos de ligas específicos os quais não são representados no diagrama Fe-C apresentado, pode-se exemplificar a adição do Silício, elemento grafitizante, na formação do Ferro Fundido Cinzento, a figura 14 mostra a estrutura de um ferro fundido cinzento.
Figura 14 - Estrutura de um ferro fundido cinzento.
O Ferro Fundido Cinzento apresenta a grafita em forma de veios, classificados segundo a ASTM em: A irregular desorientada, B em roseta, C desigual irregular, D interdendrítica desorientada e E interdendrítica orientada, de maneira geral é frágil sob tensão de tração, apresenta boa resistência sob compressão, ao desgaste e excelente capacidade absorção de vibrações.
Para diminuir a fragilidade do Ferro Fundido Cinzento, adiciona-se o magnésio (Mg) ou o cério (Ce) elementos nodulorizantes da grafita, obtendo-se assim o Ferro Fundido Nodular, com uma matriz perlitica, mais dúctil e a grafita nodular, a figura 15 mostra uma estrutura de um Ferro Fundido Nodular
A influência dos elementos de ligas sobre o Diagrama Fe-C.
Efeito sobre a Temperatura Eutetoide.
Os elementos Ti, Mo, Si, W e Cr aumentam a Temperatura Eutetóide e são estabilizadores da ferrita, assim são chamados alfagênios.
Os elementos Ni e Mn baixa a Temperatura Eutetóide, são estabilizadores da austenita e chamados de gamagêneos, a figura 16 ilustra o efeito dos elementos de ligas sobre a Temperatura Eutetóide, os efeitos são mostrados na figura 16.
Figura 16 - Efeito dos elementos de ligas sobre a Temperatura Eutetóide.
Efeito sobre a Composiçao Eutetoide.
Os elementos de ligas influenciam também a composição do ponto Eutetóide do diagrama Fe-C, conforme pode-se observar na figura 17.
Figura 17 –Efeito dos Elementos de ligas sobre a composição Eutetóide do diagrama Fe-C.
Diagramas Tempo Temperatura Transformação (TTT)
A Figura 1.18, mostra a relação do diagrama Fe-C com os diagramas TTT de um aço eutetóide e um hipoeutetóide.
Figura 1.18 - Relação do diagrama Fe-C com os diagramas TTT de um aço eutetóide em (b) e um hipoeutetóide em (c)
Os Diagramas TTT e TRC apresentam as estruturas resultantes das transformações de fases levando em consideração o efeito da cinética dessas transformações e são de fundamental importância para o entendimento e especificação dos tratamentos térmicos dos aços.
A temperatura desempenha um papel importante na taxa da transformação da Austenita em Perlita. A dependência em relação à temperatura para um aço Eutetóide (0,76% C) está indicada na figura 19.
Lembrando-se que a temperatura eutetóide de 727º C do diagrama de equilíbrio Fe-C, ponto de equilíbrio da Austenita e Perlita está acima das temperaturas indicadas na figura 19, o que
permite concluir que quanto maior for o superesfriamento (T) mais rápida acontece a
transformação da Austenita em Perlita, curva vermelha T = 127ºC, curva azul T = 77ºC e a curva
verdeT = 52ºC.
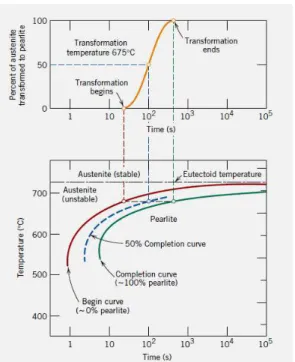
Entre as técnicas de levantamento de diagramas TTT, está a técnica de plotagem dos resultados das transformações de várias isotérmicas para o diagrama TTT, conforme ilustrado na figura 20 para a isotérmica a 675ºC.
Figura 20– Plotagem do resultado da isoterma 675ºC para o diagrama TTT de um aço eutetóide.
Os Diagramas TTT preveem a transformação da austenita em outras estruturas, como perlita, ferrita, bainita e martensita, um exemplo dessa curva pode ser visto na Figura 21 diagrama TTT para um aço Eutetóide, onde pode-se observar que acima do cotovelo da curva ocorre formação de perlita, uma transformação controlada pela baixa nucleação, abaixo do cotovelo da curva a austenita transforma-se em bainita, cuja transformação é controlada pela baixa difusão atômica. Quando o resfriamento for rápido suficiente para não tocar a curva a Austenita transforma-se em Martensita, transformação transforma-sem ocorrer difusão atômica.
A transformação Martensítica é muito importante para o entendimento do tratamento térmico de Têmpera dos aços e ela pode ser descrita por três deformações básicas: Distorção de Bain, Cisalhamento e Rotação.
a) Distorção de Bain – Forma o reticulado da martensita a partir do reticulado da fase matriz, mas em geral, não produz um plano não distorcido que possa ser associado ao plano de hábito da deformação, a distorção de Bain é ilustrada na figura 22.
b) Deformação por cisalhamento – Mantém a simetria do reticulado, não alterado a estrutura do cristal e em combinação com a distorção de Bain produz um plano não distorcido.
c) Rotação do reticulado transformado – Rotação que ocorre de modo que o plano não distorcido tenha a mesma orientação espacial nos cristais da fase matriz (Austenita) e a fase Martensitica, demonstrado na figura 23, na qual se pode verificar que os planos representados por A’C’ e B’D’ são comuns as duas fases, Austenita/Martensita.
Figura 23– Demonstração da distorção por rotação, o sistema CFC simbolizado antes da distorção de Bain pela esfera (e) e, após a distorção, pela elipse (h).
Transformação com Resfriamento Contínuo (TRC)
Para o resfriamento contínuo, o tempo necessário para o início e de fim uma reação uma reação sofre um atraso. Assim, as curvas isotérmicas são deslocadas para tempos mais longos e temperaturas mais baixas, tal como indicado na Figura 24 para uma liga de ferro-carbono de composição eutetóide.
Na prática os processos tecnológicos quase sempre são realizados com resfriamento continuo logo as especificações e os efeitos dos tratamentos térmicos serão mais precisos se elaborados nos diagramas TRC, a figura 25 ilustra curvas de resfriamentos em diagramas TRC para o aço Eutetóide e a figura 25 e para um aço ABNT 4340 na figura 26
Figura 25 - Curvas de resfriamentos em diagramas TRC para o aço Eutetóide