J
ournal of
E
nvironmental
A
nalysis and
P
rogress
Journal homepage: www.ufrpe.br/jeap
http://dx.doi.org/10.24221/jeap.1.1.2016.1001.96-105
ISSN: 2525-815X
Caracterização anatômica e histoquímica das folhas de Eugenia uniflora L.
Anatomical and histochemical characterization of leaves of Eugenia uniflora L.
Rafaela Damasceno Sáa, Asaph Santos Cabral de Oliveira Santanaa, Karina Perrelli Randaua
a Universidade Federal de Pernambuco, Departamento de Ciências Farmacêuticas, Laboratório de Farmacognosia, Av.
Prof. Arthur de Sá, S/N, CDU, 50740-521, Recife, PE, Brasil. krandau@hotmail.com.
A R T I C L E I N F O
Recebido 06 Oct 2016 Aceito 13 Oct 2016 Publicado 13 Oct 2016
A B S T R A C T
Eugenia uniflora L., popularly known as “pitangueira”, is an important fruitful
widely used in Brazilian traditional medicine for the treatment of diarrhea and dysentery, flu, intestinal parasites, fever, hypertension, and as a calming and diuretic. This work aims to perform the anatomical and histochemical characterization of the leaves of E. uniflora Due to his great popular interest and to expand the pharmacobotanical information of the species. They were prepared and analyzed, through light microscopy, semipermanent slides containing transversal sections of petiole and leaf blade, and paradermal sections of the leaf blade aiming the characterization of the anatomy and histochemistry. It was also conducted histochemical tests in cross-sections of the leaf. The microscopic analysis allowed the identification of important structures to be used in the diagnosis of this species: secretory cavities in the petiole and leaf blade; prismatic crystals in the phloem of the petiole and leaf blade, as well as in the mesophyll and the parenchyma and collenchyma of the midrib; druses only into the parenchyma cells of the petiole and in the mesophyll, parenchyma, and collenchyma of the leaf blade; thick cuticle in the petiole and leaf blade; bicollateral vascular bundle; and dorsiventral mesophyll, with biseriate palisade parenchyma. Through the histochemistry, it was evidenced the presence of phenolic compounds, tannins, lignin, lipophilic substances, essential oils, triterpenes and steroids and calcium oxalate crystals. These results are useful for the accurate identification of this species.
Keywords: Myrtaceae, pitanga, metabolites. R E S U M O
Eugenia uniflora L., popularmente conhecida como pitangueira, é uma importante
frutífera muito utilizada na medicina tradicional brasileira para o tratamento de diarreia e disenteria, gripe, parasitas intestinais, febre, hipertensão e como calmante e diurético. Devido ao seu amplo interesse popular e com o intuito de ampliar as informações farmacobotânicas da espécie, este trabalho tem como objetivo realizar a caracterização anatômica e histoquímica das folhas de E. uniflora. Foram confeccionadas e analisadas, em microscópico de luz, lâminas semipermanentes contendo secções transversais de pecíolo e lâmina foliar, além de secções paradérmicas de lâmina foliar, objetivando a caracterização da anatomia e histoquímica. A análise microscópica permitiu a identificação de estruturas importantes na diagnose da espécie: cavidades secretoras no pecíolo e na lâmina foliar; cristais prismáticos no floema do pecíolo e da lâmina foliar, bem como no mesofilo e nas células parenquimáticas e colenquimáticas da nervura central; drusas estão presentes apenas no parênquima do pecíolo e no mesofilo, parênquima e colênquima da lâmina foliar; presença de cutícula espessa no pecíolo e na lâmina foliar; feixes vasculares bicolaterais e mesofilo dorsiventral, com parênquima paliçádico bisseriado. Através da histoquímica evidenciou-se na lâmina foliar a
presença de compostos fenólicos, taninos, lignina, compostos lipofílicos, óleos essenciais, triterpenos e esteroides e cristais de oxalato de cálcio. Os resultados apresentados são úteis para a identificação correta da espécie.
Palavras-Chave: Myrtaceae, pitanga, metabolites.
Introdução
Eugenia uniflora L. (pitangueira) é uma
árvore frutífera de 4 a 10 m de altura, nativa do Brasil e encontrada desde o Planalto Meridional até as áreas de restinga no litoral do Nordeste (Lorenzi & Matos, 2002). É amplamente cultivada em pomares domésticos de todo o país para a produção de frutos. Estes são conhecidos como pitanga, apresentam polpa suculenta e são consumidos frescos ou em sucos, bem como na forma de geleia, sendo muito populares em todo o território brasileiro (Lorenzi, Lacerda & Bacher, 2015).
A planta pertence à família Myrtaceae, a qual compreende, aproximadamente, 3.500 espécies, distribuídas em cerca de 140 gêneros (APG III, 2009). No Brasil, a família Myrtaceae aparece entre as famílias mais comuns na maioria das formações vegetais (Souza & Lorenzi; 2005). O gênero Eugenia é um dos maiores da família e é representado por 379 espécies (Sobral et al., 2016). As folhas e os frutos de E. uniflora são empregados na medicina popular em várias regiões do país (Lorenzi & Matos, 2002) no tratamento de diarreia e disenteria (Conde et al., 2014; Messias et al., 2015; Silva et al., 2015; Teixeira et al., 2016), gripe (Lima, Magalhães & Santos, 2008; Borges & Peixoto, 2009; Neto et al., 2014), parasitas intestinais (Lozano et al., 2014; Messias et al., 2015), febre (Santos, Lima & Oliveira, 2014), hipertensão (Santos, Lima & Oliveira, 2014; Vásquez, Mendonça & Noda, 2014) e como calmante e diurético (Alves et al., 2008).
Encontram-se, na literatura, estudos que reportam efeitos antidiarreico (Almeida et al., 1995), antidiabético (Arai et al., 1999), antimicrobiano (Silva et al., 2012; Biasi-Garbin et al., 2016), antioxidante (Sobral-Souza et al., 2014; Schumacher et al., 2015), hepatoprotetor (Victoria et al., 2013), antinociceptivo e hipotérmico (Amorim et al., 2009), anti-Trypanosoma cruzi (Santos et al., 2012; Azeredo et al., 2014) e
anti-Leishmania (Rodrigues et al., 2013) para as folhas
de E. uniflora.
Quanto à sua composição química, de acordo com Auricchio & Bacchi (2003), os óleos essenciais presentes nos frutos e nas folhas foram os metabólitos inicialmente estudados na espécie. As investigações mais recentes abordam, principalmente, a composição química das folhas, nas quais foram identificados flavonoides, cumarinas, taninos, antraquinonas, terpenos,
esteroides e saponinas (Fiuza et al., 2008; Cecílio et al., 2012).
Segundo Almeida, Faria & Silva (2012), esta ampla variedade de compostos mostra que E.
uniflora tem um grande potencial para exploração
medicinal e cosmética. A espécie está presente na Relação Nacional de Plantas Medicinais de Interesse ao Sistema Único de Saúde (RENISUS) (Brasil, 2009). Assim, objetivando ampliar as informações científicas a respeito desta espécie, o estudo objetivou a caracterização anatômica e histoquímica das folhas de E. uniflora.
Material e Métodos
Folhas de espécimes adultos de Eugenia
uniflora L. foram coletadas na cidade de
Camaragibe, Pernambuco, Brasil. A exsicata n. 88149 foi depositada no Herbário Dárdano de Andrade Lima, do Instituto Agronômico de Pernambuco (IPA).
Para a caracterização anatômica, o material foi fixado em FAA50 (formaldeído, ácido acético e álcool etílico 50%, 1:1:18 v/v) (Johansen, 1940). Secções transversais de lâminas foliares e pecíolos foram obtidas à mão livre, usando lâminas de aço e medula do pecíolo de embaúba (Cecropia sp.) como material de suporte. Para as lâminas foliares também foram realizadas secções paradérmicas, nas faces adaxial e abaxial. Em seguida, as secções foram submetidas a uma solução de hipoclorito de sódio (50%) para descoloração (Kraus & Arduin, 1997). Após lavagem em água destilada, as secções transversais foram coradas segundo técnica descrita por Bukatsch (1972), com safranina e azul de Astra; as secções paradérmicas foram coradas com azul de metileno (Krauter, 1985). Posteriormente, todas as secções foram montadas em lâminas semipermanentes, seguindo procedimentos usuais em anatomia vegetal (Johansen, 1940; Sass, 1951).
Realizou-se a maceração das folhas utilizando fragmentos que foram submetidos a uma mistura de ácido nítrico 10% e ácido crômico 10% (1:1), de acordo com o método de Jeffrey (Johansen, 1940) para o isolamento das células, permitindo a descrição de seus detalhes estruturais. Testes histoquímicos foram realizados em secções transversais de lâminas foliares frescas, obtidas pelo mesmo método usado para a caracterização anatômica. Os seguintes reagentes foram utilizados para indicar a presença das
fenólicos (Johansen, 1940); DMACA (p-dimetilaminocinamaldeído) para flavonoides (Feucht & Schmid, 1983); vanilina clorídrica para taninos (Mace & Howell, 1974); Sudan III para compostos lipofílicos (Sass, 1951); Nadi para óleos essenciais e oleoresinas (David & Carde, 1964); tricloreto de antimônio para triterpenos e esteroides (Mace, Bell & Stipanovic, 1974); Dragendorff para alcaloides (Brasil, 2010); Lugol para amido (Johansen, 1940); floroglucinol para lignina (Johansen, 1940) e ácido clorídrico (10%) para estabelecer a natureza dos cristais (Jensen, 1962). Controles foram realizados em paralelo aos testes histoquímicos e lâminas semipermanentes foram preparadas contendo secções transversais (Johansen, 1940; Sass, 1951).
A análise das lâminas histológicas preparadas para a caracterização anatômica, maceração e histoquímica foi conduzida em imagens, usando o software Toup View Image,
obtidas por uma câmera digital acoplada a um microscópio óptico de luz (Alltion).
Resultados
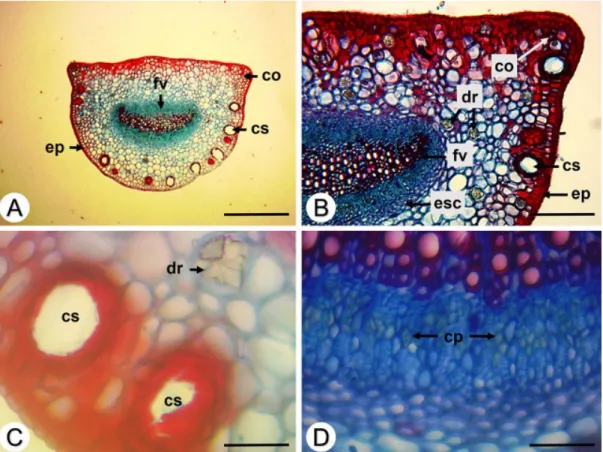
O pecíolo de Eugenia uniflora, em secção transversal, apresenta formato biconvexo, com duas pequenas projeções laterais na face adaxial (Figura 1A). A epiderme é composta por uma única camada de células e é recoberta por cutícula lisa e espessa (Figura 1AB).
Adjacente à epiderme encontra-se o colênquima (Figura 1AB) e cavidades secretoras (Figura 1ABC). Na região central encontra-se um feixe vascular bicolateral disposto na forma de arco (Figura 1AB), envolvido por fibras de esclerênquima (Figura 1B).
No parênquima cortical são encontrados diversos idioblastos contendo drusas (Figura 1BC), enquanto que no floema estão presentes cristais prismáticos (Figura 1D).
Figura 1. Secções transversais do pecíolo de Eugenia uniflora L. A e B. Aspecto geral; C. Detalhe das cavidades secretoras e da drusa; D. Detalhe dos cristais prismáticos no floema. Abreviaturas: co – colênquima; cp – cristal prismático; cs – cavidade secretora; dr – drusa; ep – epiderme; esc – esclerênquima; fv – feixe vascular. Barras: A = 500 µm; B = 200 µm; C e D = 50 µm.
A lâmina foliar, em vista frontal, apresenta células de contorno sinuoso em ambas as faces, porém, na face abaxial, a sinuosidade é mais acentuada (Figura 2AB). A lâmina é hipoestomática, com estômatos anomocíticos
(Figura 2AB). Observa-se, tanto na face adaxial quanto na face abaxial, a presença de cavidades secretoras, drusas e cristais prismáticos (Figura 2AB).
Figura 2. Secções paradérmicas da lâmina foliar de Eugenia uniflora L. A. Face adaxial; B. Face abaxial. Abreviaturas: cp – cristal prismático; cs – cavidade secretora; dr – drusa; ep – epiderme; est – estômato. Barras: A e B = 50 µm.
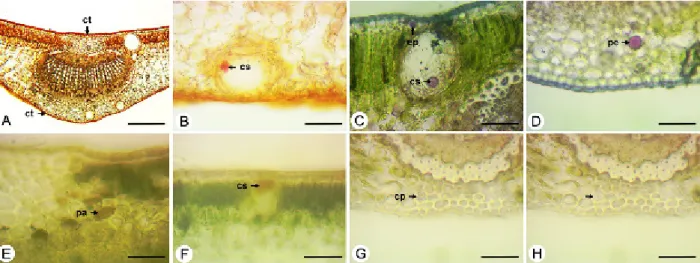
Em secção transversal, a nervura central exibe um contorno biconvexo (Figura 3A). A epiderme é unisseriada e está recoberta por cutícula lisa e espessa (Figura 3AB). O colênquima é composto por cerca de 3 a 4 camadas, localizado na face adaxial (Figura 3AB). Assim como no pecíolo, o feixe vascular é bicolateral, disposto na forma de um arco, e está envolvido por fibras de esclerênquima (Figura 3A).
Drusas e cristais prismáticos são visualizados no parênquima e no colênquima
próximos à nervura central (Figura 3BC), como também no mesofilo (Figura 3EF). No floema são encontrados apenas cristais prismáticos (Figura 3D). Cavidades secretoras também estão presentes na região da nervura central (Figura 3G) e no mesofilo (Figura 3A e H), situadas próximas à epiderme, em ambas as faces da lâmina. O mesofilo é dorsiventral, com parênquima paliçádico bisseriado e parênquima esponjoso constituído de várias camadas de células (Figura 3H).
Figura 3. Secções transversais da lâmina foliar de Eugenia uniflora L. A e B: nervura central; C. Drusa e cristal prismático na nervura central; D. Cristais prismáticos no floema; E. Drusa no mesofilo; F. Cristal prismático no mesofilo; G. Cavidade secretora na nervura central; H. Mesofilo. Abreviaturas: co – colênquima; cp – cristal prismático; cs – cavidade secretora; ct – cutícula; dr – drusa; ep – epiderme; esc – esclerênquima; fv – feixe vascular; pe – parênquima esponjoso; pp – parênquima paliçádico. Barras: A e H = 200 µm; B e G = 50 µm; C-F = 20 µm.
Através da maceração foi possível verificar alguns dos caracteres observados nos cortes paradérmicos e transversais, como células epidérmicas de contorno sinuoso (Figura 4A),
apenas uma face (Figura 4B), drusas e cristais prismáticos (Figura 4B), além de permitir a identificação de elementos de vaso do tipo helicoidal (Figura 4C).
Figura 4. Macerado de folhas de Eugenia uniflora L. A. Face adaxial; B. Face abaxial. C. Detalhe de elemento de vaso do tipo helicoidal. Abreviaturas: cp – cristal prismático; cs – cavidade secretora; dr – drusa; ep – epiderme; est – estômato; ev – elemento de vaso. Barras: A-C = 50 µm.
A Figura 5A mostra a secção transversal da lâmina foliar sem adição de nenhum reagente. Após a utilização do cloreto férrico (10%), os compostos fenólicos foram encontrados nos parênquimas paliçádico e esponjoso (Figura 5B), nas células epidérmicas (Figura 5B) e no floema (Figura 5C). O reagente DMACA demonstrou que os flavonoides são os compostos fenólicos que aparecem no floema (Figura 5D), em algumas
células epidérmicas (Figura 5E) e em cavidades secretoras (Figura 5D e 5E). Nesses mesmos locais, os taninos foram revelados com a vanilina clorídrica (Figura 5F e 5G), além de também serem visualizados nos parênquimas paliçádico e esponjoso (Figura 5F e 5G). A lignina, presente no xilema e no esclerênquima, foi evidenciada com o uso do floroglucinol (Figura 5H).
Figura 5. Histoquímica na lâmina foliar de Eugenia uniflora L. A. Controle; B e C. Cloreto férrico (10%); D e E. DMACA; F e G. Vanilina clorídrica; H. Floroglucinol. Abreviaturas: cs – cavidade secretora; ep – epiderme; esc – esclerênquima; fl – floema; pe – parênquima esponjoso; pp – parênquima paliçádico; xi - xilema. Barras: A, B, D, F e H = 200 µm; C, E e G = 50 µm.
O Sudan III indicou a presença de compostos lipofílicos na cutícula (Figura 6A) e em cavidades secretoras (Figura 6B). Óleos essenciais foram encontrados em células epidérmicas (Figura 6C), cavidades secretoras (Figura 6C) e em células parenquimáticas (Figura 6D). Com o tricloreto de
antimônio visualizaram-se triterpenos e esteroides no parênquima (Figura 6E) e nas cavidades secretoras (Figura 6F). O ácido clorídrico (10%) confirmou que os cristais são de oxalato de cálcio, após a dissolução dos mesmos (Figura 6GH). Os testes para alcaloides e amido foram negativos.
Figura 6. Histoquímica na lâmina foliar de Eugenia uniflora L. A e B. Sudan III; C e D. Nadi; E. Floroglucinol; F e G. Ácido clorídrico (10%). Abreviaturas: cp – cristal prismático; cs – cavidade secretora; ct – cutícula; ep – epiderme; pa – parênquima; pe – parênquima esponjoso. Barras: A = 200 µm; B-H = 50 µm.
Discussão
Segundo Fontenelle, Costa & Machado (1994), o formato do pecíolo de 11 espécies de
Eugenia estudadas é côncavo-convexo. Cortadi, Di
Sapio & Gattuso (1996), Brasil (2003) e Fiuza et al. (2008) também citam este tipo de formato para o pecíolo de E. uniflora. Entretanto, no presente estudo, o formato do pecíolo encontrado para a espécie diverge da literatura, onde foi registrado como biconvexo. O sistema vascular envolvido por esclerênquima divergiu de Fontenelle, Costa & Machado (1994) para espécies de Eugenia; estes autores observaram que o sistema vascular pode estar envolto por uma bainha esclerenquimática, parenquimática ou uma mistura de ambas.
Com relação à presença de cristais no pecíolo de E. uniflora, Cortadi, Di Sapio & Gattuso (1996) encontraram drusas e cristais prismáticos no parênquima, enquanto Fiuza et al. (2008) encontraram drusas apenas no parênquima e cristais prismáticos no floema, sendo os resultados desses últimos autores similares àqueles obtidos no presente estudo.
Tricomas tectores foram visualizados nos pecíolos e lâminas foliares de E. biflora, E.
flavescens, E. patrisii e E. tapacumensis (Alvarez
& Silva, 2012), bem como nas lâminas foliares de
E. badia, E. maricaensis, E. nitida (Fontenelle,
Costa & Machado, 1994) e E. pyryformis (Lorca, Amat & González, 1995). De acordo com Metcalfe & Chalk (1950), a presença de tricomas tectores é comum na família Myrtaceae. Na espécie estudada não foram encontrados tricomas, fato também citado por Alves, Tresmondi & Longuii (2008) e Dias et al. (2012). No entanto, Jorge et al. (1994) mencionaram a presença de raros tricomas tectores simples na lâmina foliar de E. uniflora. Fontenelle, Costa & Machado (1994) também reportam a
outras 10 espécies de Eugenia, porém, afirmam que os estas estruturas estão presentes apenas nas folhas jovens. Os tricomas permanecem apenas nas folhas adultas de E. badia, E. maricanesis e E.
nitida.
A análise anatômica do pecíolo de E.
uniflora revelou, ainda, a presença de
características gerais da família Myrtaceae (Metcalfe & Chalk, 1950; Fontenelle, Costa & Machado, 1994), como epiderme unisseriada, feixe vascular bicolateral e cavidades secretoras próximas à epiderme. Para a lâmina foliar também foram identificadas características comuns na família Myrtaceae (Metcalfe & Chalk, 1950; Fontenelle; Costa & Machado, 1994), como epiderme unisseriada com células de contorno sinuoso, cavidades secretoras localizadas próximas à epiderme, em ambas as faces, feixe vascular bicolateral e mesofilo dorsiventral.
Entretanto, alguns caracteres apresentaram divergência com relação à literatura. A cutícula espessada recobrindo a lâmina foliar observada neste estudo, por exemplo, também foi encontrada no estudo de Fiuza et al. (2008). Porém, Cortadi, Di Sapio & Gattuso (1996), Brasil (2003) e Dias et al. (2012) observaram uma cutícula delgada. Fontenelle, Costa & Machado (1994) encontraram três diferentes tipos de cutícula em espécies de
Eugenia: lisa, estriada e ondulada. Para E. uniflora,
os autores descrevem uma cutícula lisa, assim como foi encontrado neste estudo.
Há uma grande controvérsia nos estudos realizados com E. uniflora a respeito do tipo de estômato presente na lâmina foliar. De acordo com Metcalfe & Chalk (1950), o tipo de estômato característico da família Myrtaceae é o anomocítico, corroborando o encontrado aqui e nos estudos de Cortadi, Di Sapio & Gattuso (1996),
Fontenelle, Costa & Machado (1994) e Dias et al. (2012) relatam a presença de estômatos anomocíticos e paracíticos e Jorge et al. (1994), Lorca, Amat & González (1995) e Alves, Tresmondi & Longuii (2008) descrevem apenas a presença de estômatos paracíticos.
A localização do colênquima também mostrou-se divergente da literatura. Assim como Fiuza et al. (2008), no presente estudo, este tecido só foi visualizado adjacente à epiderme adaxial. Nas investigações de Jorge et al. (1994), Lorca, Amat & González (1995), Cortadi, Di Sapio & Gattuso (1996), Brasil (2003) e Dias et al. (2012), o colênquima foi encontrado adjacente à ambas as faces da epiderme.
A quantidade de camadas de parênquima paliçádico pode variar nas espécies de Eugenia. No estudo de Fontenelle, Costa & Machado (1994), cinco espécies de Eugenia apresentaram apenas uma camada de parênquima paliçádico, enquanto que outras seis espécies do gênero apresentaram duas camadas deste tecido, sendo E. uniflora umas dessas seis representantes. Os estudos de Fiuza et al. (2008) e Dias et al. (2012) também mostraram a presença de duas camadas de parênquima paliçádico em E. uniflora. Lorca, Amat & González (1995), Cortadi, Di Sapio & Gattuso (1996) e Alves, Tresmondi & Longuii (2008) encontraram apenas uma camada deste tecido.
A presença de drusas e cristais prismáticos no mesofilo e na nervura central também é relatada por Jorge et al. (1994) e Fiuza et al. (2008). Lorca, Amat & González (1995) e Dias et al. (2012) mencionam a presença de drusas no floema, o que não foi encontrado no presente estudo. De acordo com Franceschi & Nakata (2005), a morfologia dos cristais produzidos pode ser de um único tipo em toda a planta, ou vários tipos, sendo cada um específico para um determinado órgão ou, ainda, vários tipos dentro de um mesmo órgão, mas em diferentes tecidos.
Nos estudos prévios sobre a espécie não foram encontrados dados sobre a maceração, mas sobre a descrição microscópica do pó (Brasil, 2003). Neste, também são encontradas células epidérmicas de contorno sinuoso, cavidades secretoras e estômatos na face abaxial.
Corroborando os resultados deste estudo, compostos fenólicos também foram histolocalizados nos parênquimas paliçádico e lacunoso por Fiuza et al. (2008). Quercetina e quercetrina são alguns desses compostos identificados nas folhas da espécie (Schmeda-Hirschmann et al., 1987). Taninos também foram isolados das folhas de E. uniflora (Lee et al., 1997). Vários estudos abordam a composição química do óleo essencial das folhas de E. uniflora, pois seus
constituintes variam de acordo com o local de coleta, com a idade da planta, dentre outros fatores (Santos, Braz-Filho & Costa, 2015). Com o resultado da histoquímica foi possível identificar que os cristais são de oxalato de cálcio, o que, de acordo com Franceschi & Nakata (2005), são o tipo mais comum encontrado nas plantas.
Conclusão
Apesar de existirem vários estudos publicados com esta espécie, essas análises microscópicas forneceram mais informações anatômicas úteis para a padronização farmacobotânica, visto que existe uma variabilidade nos caracteres de diagnose. A maceração auxiliou na identificação do tipo estrutural do xilema. Os testes histoquímicos possibilitaram a caracterização dos locais de acúmulo dos metabólitos presentes na lâmina foliar da espécie, bem como determinou a natureza dos cristais. O conjunto de informações farmacobotânicas apresentadas corroboram aquelas anteriormente descritas para a espécie estudada.
Referências
ALMEIDA, C. E.; KARNIKOWSKI, M. G. O.; FOLETO, R.; BALDISSEROTTO, B. 1995. Analysis of antidiarrhoeic effect of plants used in popular medicine. Rev. Saúde Pública, v.29, n.6, p.428-433.
ALMEIDA, D. J.; FARIA, M. V.; SILVA, P. R. 2012. Biologia experimental em Pitangueira: uma revisão de cinco décadas de publicações científicas. Ambiência Guarapuava, v.8, n.1, p.177-193.
ALVAREZ, A. S.; SILVA, R. J. F. 2012. Anatomia foliar de espécies de Eugenia L. (Myrtaceae) oriundas da restinga de Algodoal/Maiandeua-Pará. INSULA Revista de Botânica, v.41, p.83-94. ALVES, E. O.; MOTA, J. H.; SOARES, T. S.; VIEIRA, M. C.; SILVA, C. B. 2008. Levantamento etnobotânico e caracterização de plantas medicinais em fragmentos florestais de Dourados-MS. Ciênc. Agrotec., v.32, n.2, p.651-658.
ALVES, E. S.; TRESMONDI, F.; LONGUII, E. L. 2008b. Análise estrutural de folhas de Eugenia
uniflora L. (Myrtaceae) coletadas em ambientes
rural e urbano, SP, Brasil. Acta Bot. Bras., v.22, n.1, p.241-248.
AMORIM, A. C. L.; LIMA, C. K. F.; HOVELL, A. M. C.; MIRANDA, A. L. P.; REZENDE, C. M.
2009. Antinociceptive and hypothermic evaluation of the leaf essential oil and isolated terpenoids from
Eugenia uniflora L. (Brazilian Pitanga).
Phytomedicine, v.16, p.923-928.
APG III. 2009. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III. Bot. J. Lin. Soc., v.161, n.2, p.105-121.
ARAI, I.; AMAGAYA. S.; KOMATSU, Y.; OKADA, M.; HAYASHI, T.; KASAI, M.; ARISAWA, M.; MOMOSE, Y. 1999. Improving effects of the extracts from Eugenia uniflora on hyperglycemia and hypertriglyceridemia in mice. J. Ethnopharmacol., v.68, p.307-314.
AURICCHIO, M. T.; BACCHI, E. M. 2003. Folhas de Eugenia uniflora L. (pitanga): revisão. Rev. Inst. Adolfo Lutz, v.62, n.1, p.55-61.
AZEREDO, C. M. O.; SANTOS, T. G.; MAIA, B. H. L. N. S.; SOARES, M. J. 2014. In vitro biological evaluation of eight different essential oils against Trypanosoma cruzi, with emphasis on
Cinnamomum verum essential oil. BMC
Complement. Altern. Med., v.14, n.309.
BIASI-GARBIN, R. P.; DEMITTO, F. O.; AMARAL, R. C. R.; FERREIRA, M. R. A.; SOARES, L. A. L.; SVIDZINSKI, T. I. E.; BAEZA, L. C.; YAMADA-OGATTA, S. F. 2016. Antifungal potential of plant species from Brazilian Caatinga against dermatophytes. Rev. Inst. Med. Trop. São Paulo, v.58, n.18.
BORGES, R.; PEIXOTO, A. L. 2009. Conhecimento e uso de plantas em uma comunidade caiçara do litoral sul do Estado do Rio de Janeiro, Brasil. Acta Bot. Bras., v.23, n.3, p.769-779.
BRASIL. 2003. Farmacopeia Brasileira. Agência Nacional de Vigilância Sanitária, Brasília.
BRASIL. Ministério da Saúde. 2009. Plantas de interesse ao SUS. Disponível em: http://bvsms.saude.gov.br/bvs/sus/pdf/marco/ms_r elacao_plantas_medicinais_sus_0603.pdf. Acesso em: 28 Setembro, 2016.
BRASIL. 2010. Farmacopeia Brasileira. Agência Nacional de Vigilância Sanitária, Brasília.
BUKATSCH, F. 1972. Bemerkungen zur Doppelfärbung Astrablau-Safranin. Mikrokosmos,
CECÍLIO, A. B.; FARIA, D. B.; OLIVEIRA, P. C.; CALDAS, S.; OLIVEIRA, D. A.; SOBRAL. M. E. G.; DUARTE, M. G. R.; MOREIRA, C. P. S.; SILVA, C. G.; ALMEIDA, V. L. 2012. Screening of Brazilian medicinal plants for antiviral activity against rotavirus. J. Ethnopharmacol., v.141, p. 975-981.
CONDE, B. E.; SIQUEIRA, A. M.; ROGÉRIO, I. T. S.; MARQUES, J. S.; BORCARD, G. G.; FERREIRA, F. M.; CHEDIER, L. M.; PIMENTA, D. S. 2014. Synergy in ethnopharmacological data collection methods employed for communities adjacent to urban forest. Rev. Bras. Farmacogn., v.24, p.425-432.
CORTADI, A.; DI SAPIO, O.; GATTUSO, M. 1996. Caracteres anatómicos de tres espécies medicinales de la familia Myrtaceae. Acta Farm. Bonaerense, v.15, n.2, p.109-123.
DAVID, R.; CARDE, J. P. 1964. Coloration différentielle des inclusions lipidiques et terpéniques des pseudophylles du Pin maritime au moyen du réactif nadi. C. R. Acad. Sci. Paris, Ser D, v.258, p.1338-1340.
DIAS, C. N.; RODRIGUES, K. A. F.; RESPLANDES, S. M.; AGUIAR, L. R.; AMARAL, F. M. M.; MORAES, D. F. C. Caracterização farmacobotânica das folhas de
Eugenia uniflora L. (Myrtaceae) coletadas em São
Luís–MA, Brasil. Rev. Ciênc. Saúde, v.14 n.2, p. 95-102.
FEUCHT, W.; SCHMID, P. P. S. 1983. Selektiver histochemischer nachweis von flavanen (catechinen) mit p-dimethylaminozimtaldehyd in sprossen einiger obstgeholzi. Gartenbauwissenschaft, v.48, p.119-124.
FIUZA, T. S.; REZENDE, M. H.; SABÓIA-MORAIS, S. M. T.; BARA, M. T. F.; TRESVENZOL, L. M. F.; PAULA, J. R. 2008. Caracterização farmacognóstica das folhas de
Eugenia uniflora L. (Myrtaceae). Rev. Eletrônica
Farm., v.2, p.1-11.
FONTENELLE, G. B.; COSTA, C. G.; MACHADO, R. D. 1994. Foliar anatomy and micromorphology of eleven species of Eugenia L. (Myrtaceae). Bot. J. Linn. Soc., v.115, p.111-133. FRANCESCHI, V. R.; NAKATA, P. A. 2005. Calcium oxalate in plants: formation and function. Annu. Rev. Plant Biol., v.56, n.1, p.41-71.
HADDAD, A.; SESSO, A.; ATTIAS, M.; FARINA, M.; MEIRELLES, M. N.; SILVEIRA, M.; BENCHIMOL, M.; SOARES, M. J.; BARTH, O. M.; PADRÓN, T. S.; SOUZA, W. 1998. Técnicas básicas de microscopia eletrônica aplicadas às Ciências Biológicas. Sociedade Brasileira de Microscopia Eletrônica, Rio de Janeiro.
JENSEN, W. A. 1962. Botanical histochemistry, principles and practice. W. H. Freeman, San Francisco.
JOHANSEN, D. A. 1940. Plant Microtechnique. Mc Graw Hill, New York.
JORGE, L. I. F.; OLIVEIRA, F.; KATO, E. T. M.; OLIVEIRA, I. 1994. Caracterização farmacognóstica das folhas e dos frutos de Eugenia
uniflora L. Myrtaceae. Lecta, v.2, p.103-120.
KRAUS, J. E; ARDUIN, M. 1997. Manual básico de métodos em morfologia vegetal. EDUR, Rio de Janeiro.
KRAUTER, D. 1985. Erfahrungen mit Etzolds FSA-Färbung für pflanzenschnitte. Mikrokosmos, v.74, p.231-233.
LEE, M. L.; NISHIMOTO, S.; YANG, L. L.; YEN, K. Y.; HATANO,T.; YOSHIDA, T.; OKUDA, Y. 1997. Two macrocyclic hydrolysable tannin dimers from Eugenia uniflora. Phytochemistry, v.44, n.7, p.1343-1349.
LIMA, R. A.; MAGALHÃES, S. A.; SANTOS, M. R. A. 2011. Levantamento etnobotânico de plantas medicinais utilizadas na cidade de Vilhena, Rondônia. Rev. Pesquisa & Criação, v.10, n.2, p.165-179.
LORCA, G. G.; AMAT, A. G.; GONZÁLEZ, C. 1995. Análisis comparativo de caracteres diagnósticos para la identificación de tres especies Argentinas de Myrtaceae empleadas en la medicina popular. Acta Farm. Bonaerense, v.14, n.2, p.81-86.
LORENZI, H.; MATOS, F. J. A. 2002. Plantas medicinais no Brasil: nativas e exóticas cultivadas. Instituto Plantarum, Nova Odessa.
LORENZI, H.; LACERDA, M. T. C.; BACHER, L. B. 2015. Frutas no Brasil: nativas e exóticas (de consumo in natura). Instituto Plantarum de Estudos da Flora, São Paulo.
LOZANO, A.; ARAÚJO, E. L.; MEDEIROS, M. F. T.; ALBUQUERQUE, U. P. 2014. The apparency hypothesis applied to a local pharmacopoeia in the Brazilian northeast. J. Ethnobiol. Ethnomed., v.10, n.2, p.1-17.
MACE, M. E.; BELL, A. A.; STIPANOVIC, R. D. 1974. Histochemistry and isolation of gossypol and related terpenoids in root of cotton seedlings. Phytophatol., v.64, p.1297-1302.
MACE, M. Z.; HOWELL, C. R. 1974. Histochemistry and identification of condensed tanin precursors in roots of cotton seedlings. Can. J. Bot., v.52, p.2423-2426.
MESSIAS, M. C. T. B.; MENEGATTO, M. F.; PRADO, A. C. C.; SANTOS, B. R.; GUIMARÃES, M. F. M. 2015. Uso popular de plantas medicinais e perfil socioeconômico dos usuários: um estudo em área urbana em Ouro Preto, MG, Brasil. Rev. Bras. Pl. Med., v.17, n.1, p.76-104.
METCALFE, C. R.; CHALK, K. L. 1950. Anatomy of the dicotyledons: leaves, stem, and wood in relation to taxonomy with notes on economic uses. Clarendon, Oxford.
NETO, F. R. G.; ALMEIDA, G. S. S. A.; JESUS, N. G.; FONSECA, M. R. 2014. Estudo etnobotânico de plantas medicinais utilizadas pela Comunidade do Sisal no município de Catu, Bahia, Brasil. Rev. Bras. Pl. Med., v.16, n.4, p.856-865. RODRIGUES, K. A. F.; AMORIM, L. V.; OLIVEIRA, J. M. G.; DIAS, C. N.; MORAES, D. F. C.; ANDRADE, E. H. A.; MAIA, J. G. S.; CARNEIRO, S. M. P.; CARVALHO, F. A. A. 2013. Eugenia uniflora L. essential oil as a potential anti-Leishmania agent: effects on
Leishmania amazonensis and possible mechanisms
of action. Evid. Based. Complement. Alternat. Med., v.2013.
SANTOS, K. K. A.; MATIAS, E F. F.; TINTINO, S. R.; SOUZA, C. E. S.; BRAGA, M. F. B. M.; GUEDES, G. M. M.; ROLÓN, M.; VEJA, C.; ARIAS, A. R.; COSTA, J. G. M.; MENEZES, I. R. A.; COUTINHO, H. D. M. 2012.
Anti-Trypanosoma cruzi and cytotoxic activities of Eugenia uniflora L. Exp. Parasitol., v.131,
p.130-132.
SANTOS, M. R. A.; LIMA, M. R.; OLIVEIRA, C. L. L. G. 2014. Medicinal plants used in Rondônia,
Western Amazon, Brazil. Rev. Bras. Pl. Med., v.16, n.3, p.707-720.
SANTOS, F. R.; BRAZ-FILHO, R.; CASTRO, R. N. 2015. Influência da idade das folhas de Eugenia
uniflora L. na composição química do óleo
essencial. Quim. Nova, v.8, n.36, p.762-768. SASS, J. E. 1951. Botanical microtechnique. The Iowa State College Press, Ames, Second Edition. SCHMEDA-HIRSCHMANN, G.; THEODULOZ, C.; FRANCO, L.; FERRO, E. 1987. Preliminary pharmacological studies on Eugenia uniflora leaves: xanthine oxidase inhibitory activity. J. Ethnopharmacol., v.21, p.183-186.
SCHUMACHER, N. S. G.; COLOMEU, T. C.; FIGUEIREDO, D.; CARVALHO, V. C.; CAZARIN, C. B. B.; PRADO, M. A.; MELETTI, L. M. M.; ZOLLNER, R. L. 2015. Identification and antioxidant activity of the extracts of Eugenia
uniflora leaves. Characterization of the
anti-inflammatory properties of aqueous extract on diabetes expression in an experimental model of spontaneous type 1 diabetes (NOD Mice). Antioxidants, v.4, p.662-680.
SILVA, N. C. C.; BARBOSA, L.; SEITO, L. N.; FERNANDES JUNIOR, A. 2012. Antimicrobial activity and phytochemical analysis of crude extracts and essential oils from medicinal plants. Nat. Prod. Res., v.26, n.16, p.1510-1514.
SILVA, J. D. A.; NASCIMENTO, M. G. P.; GRAZINA, L. G.; CASTRO, K. N. C.; MAYO, S. J.; ANDRADE, I. M. 2015. Ethnobotanical survey of medicinal plants used by the community of Sobradinho, Luís Correia, Piauí, Brazil. J. Med. Plants Res., v.9, n.32, p.872-883.
SOBRAL-SOUZA, C. E.; LEITE, N. F.; CUNHA, F. A. B.; PINHO, A. I.; COSTA, J. G. M.; COUTINHO, H. D. M. 2014. Avaliação da atividade antioxidante e citoprotetora dos extratos de Eugenia uniflora Lineau e Psidium sobraleanum Proença & Landrum contra metais pesados. Rev. Cienc. Salud., v.12, n.3, p.401-409.
SOBRAL, M.; PROENÇA, C.; SOUZA, M.; MAZINE, F.; LUCAS, E. 2016. Myrtaceae in Lista de Espécies da Flora do Brasil. Jardim Botânico do Rio de Janeiro. Disponível em: http://floradobrasil.jbrj.gov.br/jabot/floradobrasil/ FB10560. Acesso em: 28 Setembro, 2016.
SOUZA, V. C.; LORENZI, H. 2005. Botânica sistemática: guia ilustrado para identificação de famílias de Angiospermas da flora Brasileira, baseado em APG II. Instituto Plantarum, Nova Odessa.
TEIXEIRA, M. P.; CRUZ, L.; FRANCO, J. L.; VIEIRA, R. B.; STEFENON, V. M. 2016. Ethnobotany and antioxidant evaluation of commercialized medicinal plants from the Brazilian Pampa. Acta Bot. Bras., v.30, n.1, p.47-59.
VÁSQUEZ, S. P. F.; MENDONÇA, M. S.; NODA, S. N. 2014. Etnobotânica de plantas medicinais em comunidades ribeirinhas do Município de Manacapuru, Amazonas, Brasil. Acta Amazonica, v.44, n.4, p.457-472.
VICTORIA, F. N.; ANVERSA, R. G.; SAVEGNAGO, L.; LENARDÃO, E. J. 2013. Essential oils of E. uniflora leaves protect liver injury induced by acetaminophen. Food Bioscience, v.4, p.50-57.