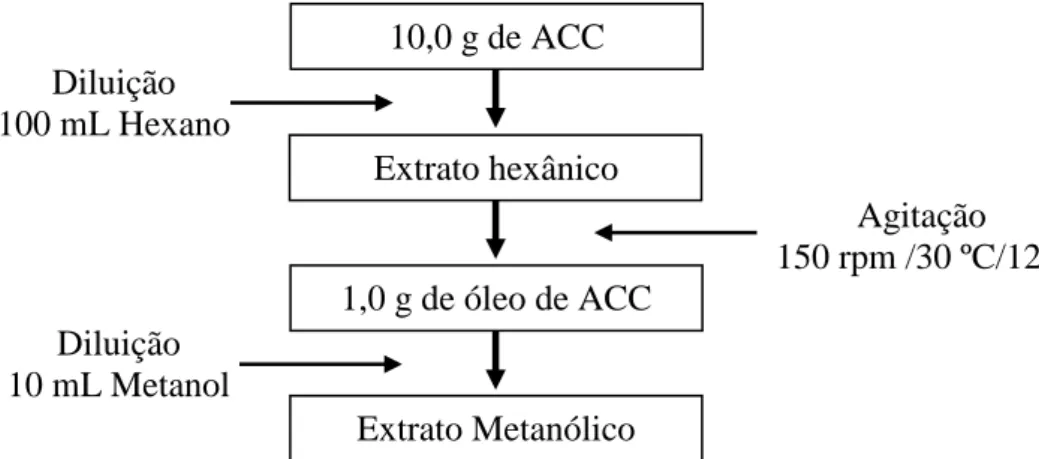
i
UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE TECNOLOGIA
DEPARTAMENTO DE ENGENHARIA QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
JÉFFERSON MALVEIRA CAVALCANTE
EXTRAÇÃO DE ALQUILFENÓIS DA CASCA, FENÓLICOS
DA PELÍCULA E EFEITO DO PROCESSAMENTO
INDUSTRIAL SOBRE CONSTITUINTES DA AMÊNDOA DE
CASTANHA DE
CAJU
ii
JÉFFERSON MALVEIRA CAVALCANTE
Extração de alquilfenóis da casca, fenólicos da película e efeito do processamento industrial sobre constituintes da amêndoa de castanha de caju
Tese submetida à Coordenação do Curso de Pós-Graduação em Engenharia Química, da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Doutor em Engenharia Química.
Área de concentração: Processos químicos e bioquímicos.
Orientador: Dr. Edy Sousa de Brito
iv
JÉFFERSON MALVEIRA CAVALCANTE
EXTRAÇÃO DE ALQUILFENÓIS DA CASCA, FENÓLICOS DA
PELÍCULA E EFEITO DO PROCESSAMENTO INDUSTRIAL SOBRE
CONSTITUINTES DA AMÊNDOA DE CASTANHA DE CAJU
v Aos meus pais, Jucival e Antonia, pelo exemplo de coragem, determinação, persistência e simplicidade em suas metas.
Aos meus irmãos, Jucianne e Tiago, que muito me ajudaram a chegar onde estou. Ao meu avô, vovô Deca (in memorian), pelo exemplo de vida.
vi
AGRADECIMENTOS
À Universidade Federal do Ceará e em especial ao Programa de Pós-Graduação em Engenharia Química pelo conhecimento e experiência adquirida.
À Embrapa Agroindústria Tropical pela utilização de seus laboratórios durante a realização deste trabalho. Em especial aos amigos Adriana Dutra, Marcelo Lima, Tigressa Rodrigues, Larissa Vieira, Mariana Victor, Isabel Maia, Rosa Soares e Paulo Ribeiro do Laboratório Multiusuário de Química de Produtos Naturais pelos debates e auxílio nos experimentos.
À Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico (FUNCAP) pelo apoio financeiro com a manutenção da bolsa de auxílio.
À Companhia Industrial de Óleos do Nordeste (CIONE), em especial ao Sr. Saulo Sales, pelo fornecimento da matéria-prima, líquido da casca e amêndoa de castanha de caju.
Ao Dr. Edy Sousa de Brito, pela valiosa orientação, ensino e incentivo no decorrer do curso de doutorado e na avaliação deste trabalho.
Ao Prof. Dr. Fabiano André Narciso Fernandes e Dr. Gustavo Adolfo Saavedra Pinto pela oportunidade de participarem do Exame de Qualificação.
Ao Dr. Kirley Marques Canuto, Drª. Morsyleide de Freitas Rosa, Drª. Nágila Maria Pontes Silva Ricardo e Dr. Gustavo Adolfo Saavedra Pinto pela oportunidade de participarem da Defesa de Doutorado.
Aos meus pais Antonia Malveira Cavalcante e Jucival Ferreira Cavalcante pelo encorajamento em todas as fases de minha vida, pelo seu amor e por suas orações.
Aos meus irmãos Tiago Malveira Cavalcante e Jucianne Maria Malveira Cavalcante que tanto me incentivaram, ajudaram e apoiaram durante toda a minha vida.
Aos meus avós, tios e tias, primos e primas, amigos e amigas pelo carinho, incentivo e apoio.
vii
"Abras suas asas e tome voo, pois a liberdade é uma benção."
viii
RESUMO
A castanha de caju é um dos principais insumos agroindustriais, destacando-se como um ícone na economia do Nordeste do Brasil. A castanha de caju é constituída de amêndoa (ACC), principal produto, casca e película, que apresentam características específicas devido à presença de compostos fenólicos. O presente estudo apresenta como objetivo, avaliar os efeitos do processamento industrial sobre constituintes da amêndoa, métodos de extração do líquido na casca (LCC) e compostos fenólicos na película de castanha de caju. A extração do LCC foi realizada seguindo um delineamento experimental fatorial 32 completo, variando pressão e temperatura. O LCC extraído por prensagem variou entre 26 a 34 g/100g de casca, com pressão e temperatura exercendo efeitos positivos estatisticamente significativos. Ocorreu uma predominância dos ácidos anacárdicos C15:3, C15:1 e C15:2 nas amostras obtidas por prensagem e com a utilização de solvente orgânico, apresentando uma concentração na faixa de 44 a 62% de ácidos anacárdicos totais. As extrações dos compostos fenólicos da película, com água, foram realizadas seguindo um delineamento composto central rotacional 32 para extração assistida por ultrassom (EAU), variando tempo, densidade de potência e razão líquido/sólido, e um 22 para extração acelerada com solvente (EAS), variando tempo e temperatura. O conteúdo fenólico extraído da película de castanha de caju utilizando EAU se apresentou na faixa de 40-44% com SST variando entre 0,6 e 3,8, e para EAS entre 33-46% e 1,5 a 4,3, respectivamente. Os compostos fenólicos majoritários foram catequina e epicatequina. As etapas do processamento industrial de ACC selecionadas foram
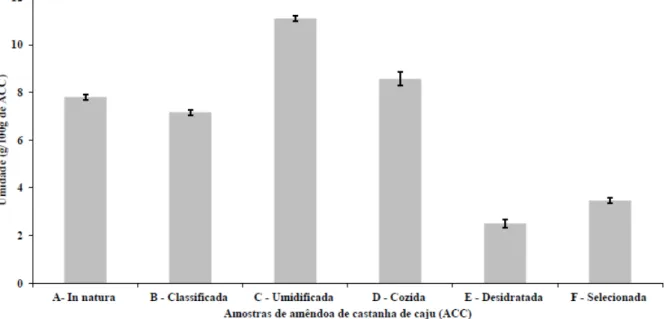
in natura, classificada, umidificada, cozida, desidratada e selecionada, submetidas à secagem,
moagem e extração lipídica. O teor de umidade variou entre 2,5 a 11,0% e o lipídico apresentou um valor médio de 42%, exceto para a ACC umidificada. Os ácidos anacárdicos totais, C15:3 e C15:1, apresentaram concentrações entre 32 e 182 mg/g de óleo de ACC, e seu conteúdo degradado e/ou transformado foi o proveniente da incorporação na amêndoa durante as etapas de armazenagem e umidificação. Os grânulos de amidos identificados pela presença da “cruz de Malta”, birrefringente, apresentavam formas arredondadas e a quantidade diminuiu com o avanço das etapas do processamento industrial. O aproveitamento integral da castanha de caju com a extração do líquido da casca da castanha de caju de mini-fábricas por apresentar elevado conteúdo alquifenol em ácidos anacárdicos, juntamente com as extrações assistida por ultrassom e acelerada com solvente de compostos fenólicos da película de castanha de caju se mostraram atrativos para o mercado de produtos naturais. O efeito do processamento industrial sobre constituintes da amêndoa de castanha de caju como os ácidos anacárdicos direciona para uma reavaliação de processo por parte da indústria devido a grande perda do conteúdo alquilfenol após a etapa de cozimento.
ix
ABSTRACT
The cashew nut is a major agro-industrial inputs, distinguishing as an icon in the economy northeast of Brazil. The cashew nut is made of almond (ACN), the main product, shell and testa, which have specific characteristics due to the presence of phenolic compounds. Of the present work the objective is to the evaluate the effects of industrial processing on constituents of almond, methods of extracting shell liquid (CNSL) and phenolic compounds in the testa. The extraction of CNSL was carried out following a full factorial design of experimental 32, varying pressure and temperature. The yield of pressing ranged from 26 to 34% in the extraction of CNSL with pressure and temperature exerting statistically significant positive effects. Occurred predominance the anacardic acids of C15:3, C15:2 and C15:1 in samples obtained by pressing and with the use of organic solvent, having a concentration in the range of 44-62% total anacardic acids. The extraction of phenolic compounds from the testa with water was performed following a rotational central composite design 32 by ultrasound-assisted extraction (UAE), varying the time, power density and liquid / solid ratio, and 22 for accelerated solvent extraction (ASE), varying time and temperature. The phenolic content extracted of the testa cashew nut using UAE ranged from 40-44% with SST ranging between 0.6 and 3.8, and between 33-46% for EAS and 1.5 to 4.3, respectively. The major phenolic compounds in the samples were catechin and epicatechin. The industrial processing steps of ACN were in nature, classified, humidified, cooked, dehydrated and selected, subjected to drying, grinding and lipid extraction. The humidity ranged between 2.5 and 11.0%, lipid had a mean value of 42%, except for the humidified ACN. The total anacardic acids, C15:3 and C15:1, had concentrations between 32 and 182 mg / g ACN oil and its degraded content and/or has been transformed from the incorporation of the seed during storage and humidification. The starch granules identified by the presence of the cross of Malta had rounded shapes and the amount decreased with the advance of industrial processing steps. The whole utilization the cashew with the extraction of the shell liquid cashew mini-factories because of its high content of alkylphenol in anacardic acids, together with the assistance of ultrasound and accelerated solvent extraction of phenolic compounds testa cashew nut proved attractive to the natural products market. The effect of industrial processing on constituents of almond cashew nut as anacardic acids directs to a reassessment process by the industry due to the large loss of alkylphenol content after the cooking step.
x
LISTA DE FIGURAS
Figura 1 Caju (A), casca (B), película (C) e amêndoa de castanha de caju (D) ... . 01
Figura 2 Produção nacional de castanha de caju no século 21 ... 01
Figura 3 Exportação de amêndoa de castanha de caju no século 21 ... 02
Figura 4 Peso líquido da amêndoa de castanha de caju exportada no século 21 ... 03
Figura 5 Caju (Anacardium occidentale L.) ... 04
Figura 6 Fluxograma – Beneficiamento da castanha de caju ... 05
Figura 7 Líquido da casca da castanha de caju (LCC técnico) ... 05
Figura 8 Representação da estrutura química dos principais componentes do líquido da casca de castanha de caju (LCC) ... 06
Figura 9 Compostos fenólicos presentes em alimentos ... 08
Figura 10 Representação estrutural da parede celular primária das células vegetais. (A) Celulose, (B) Hemicelulose, (C) Proteína, (D) Pectina, (E) Ácido fenólico, e (F) Lignina . ... 11
Figura 11 Sistema utilizado para a extração do líquido da casca de castanha de caju. (A) Êmbolo, (B) Cilindro, (C) Base, (D) Malha de aço, e (E) Sistema completo .... 27
Figura 12 Diagrama de Pareto na extração de LCC por prensagem: nível de 90% de confiança (p < 0,10) ... 31
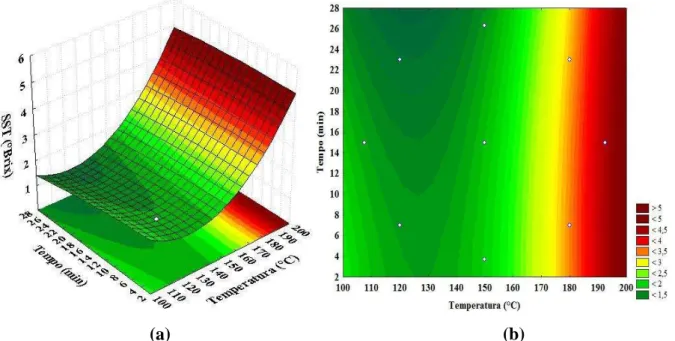
Figura 13 Superfície de resposta (a) e curvas de contorno (b) em função da pressão e temperatura para o LCC extraído por prensagem . ... 32
Figura 14 Curva ABC para extração de LCC com hexano ... 33
Figura 15 Perfil cromatográfico de compostos fenólicos da película de castanha de caju extraídos com acetona 70% (a), água (b), etanol 80% (c) e metanol (d) no modo negativo ... 45
xiv Figura 56 Espectro de massas na polaridade de ionização negativa (-),
afzelequina-galocatequina ... 92 Figura 57 Espectro de massas na polaridade de ionização negativa (-), catequina ... 93 Figura 58 Espectro de massas na polaridade de ionização negativa (-), dímero de propelargonidina ... 93 Figura 59 Espectro de massas na polaridade de ionização negativa (-), proantocianidina A
... 94 Figura 60 Espectro de massas na polaridade de ionização negativa (-), epicatequina ... 94 Figura 61 Espectro de massas na polaridade de ionização negativa (-), procianidina B1
3-O-galato ... 95 Figura 62 Espectro de massas na polaridade de ionização negativa (-), florentina ... 95 Figura 63 Espectro de massas na polaridade de ionização negativa (-), epicatequina galato
xvi
LISTA DE TABELAS
Tabela 1. Compostos fenólicos em plantas ... 09
Tabela 2. Composição média em compostos fenólicos totais de óleos extraídos de amêndoas, castanhas e nozes ... 10
Tabela 3. Utilização de ultrassom em análise química ... 12
Tabela 4. Extração de polifenóis em produtos agroindustriais utilizando ultrassom ... 13
Tabela 5. Condições de extração acelerada com solvente de fitoquímicos em diversos produtos agroindustriais ... 14
Tabela 6. Processos empregados para obtenção de LCC ... 27
Tabela 7. Matriz do delineamento fatorial completo 32 ... 28
Tabela 8. Conteúdo de líquido da casca de castanha de caju extraído ... 30
Tabela 9. Análise de variância para líquido da casca de castanha de caju obtido por prensagem ... 32
Tabela 10. Componentes fenólicos tentativamente identificados no LCC em diferentes processos ... 34
Tabela 11. Teor de ácidos anacárdicos no líquido da casca da castanha de caju ... 35
Tabela 12. Matriz do delineamento composto central rotacional 23 – extração assistida por ultrassom ... 42
Tabela 13. Matriz do delineamento composto central rotacional 22 – extração acelerada com solvente ... 43
Tabela 14. Compostos fenólicos tentativamente identificados na película de castanha de caju ... 46
Tabela 15. Sólidos solúveis totais e conteúdo fenólico em amostras de película de castanha de caju utilizando extração assistida por ultrassom ... 47
xvii Tabela 17. Análise de variância - fenólicos totais em extratos de película de castanha de caju ... 51 Tabela 18. Sólidos solúveis totais e conteúdo fenólico em amostras de película de castanha de caju utilizando extração acelerada com solvente ... 52 Tabela 19. Análise de variância para teor de sólidos solúveis totais em extratos de película de castanha de caju utilizando extração acelerada com solvente ... 53 Tabela 20. Análise de variância para fenólicos totais em extratos de película de castanha de caju utilizando extração acelerada com solvente ... 55 Tabela 21. Variação do conteúdo lipídico durante o processamento industrial de amêndoa de castanha de caju ... 68 Tabela 22. Ácidos anacárdicos da amêndoa de castanha de caju em diferentes etapas da indústria ... 69 Tabela 23. Médias das concentrações de ácidos anacárdicos em amêndoa de castanha de caju ... 69 Tabela 24. Estatística descritiva – Área do grânulo (µm2) de amido em amêndoa de
xviii
SUMÁRIO
1. INTRODUÇÃO ... 1
2. REVISÃO BIBLIOGRÁFICA ... 4
2.1. Caju (Anacardium occidentale L.) ... 4
2.2. Compostos fenólicos ... 7
2.3. Técnicas de extração de compostos fenólicos ... 10
3. REFERÊNCIAS BIBLIOGRÁFICAS ... 15
4. AVALIAÇÃO DO EFEITO DE PRESSÃO E TEMPERATURA NA EXTRAÇÃO DO LÍQUIDO DA CASCA DA CASTANHA DE CAJU ... 25
4.1 RESUMO ... 25
4.2 INTRODUÇÃO ... 25
4.3 MATERIAL & MÉTODOS ... 26
4.3.1 Matéria-prima ... 26
4.3.2 Obtenção do líquido da casca da castanha de caju (LCC) ... 27
4.3.3 Extração com solvente ... 28
4.3.4 Alquilfenóis ... 29
4.4 RESULTADOS & DISCUSSÃO ... 30
4.4.1 Conteúdo de LCC extraído ... 30
4.4.2 Alquilfenóis ... 34
4.5 CONCLUSÃO ... 35
4.6 AGRADECIMENTOS ... 36
4.7 REFERÊNCIAS ... 36
5. EXTRAÇÃO DE COMPOSTOS FENÓLICOS DA PELÍCULA DE CASTANHA DE CAJU ... 40
5.1 RESUMO ... 40
5.2 INTRODUÇÃO ... 40
5.3 MATERIAL & MÉTODOS ... 41
5.3.1 Material ... 41
5.3.2 Medotologia ... 42
5.3.3 Extração assistida por ultrassom (EAU) ... 42
5.3.6 Extração acelerada com solvente (EAS) ... 43
5.3.7 Sólidos solúveis totais - SST ... 43
5.3.3 Fenólicos totais ... 43
5.3.4 Identificação dos compostos fenólicos ... 44
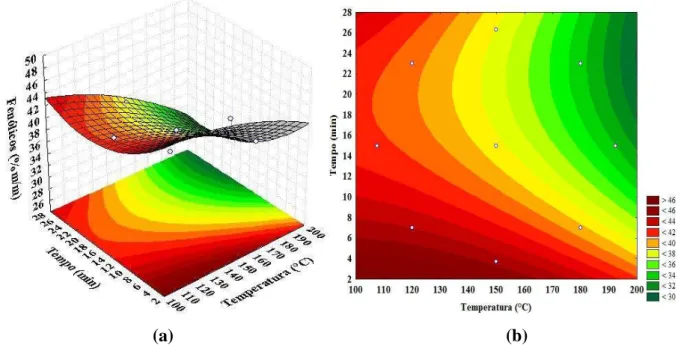
5.4 RESULTADOS & DISCUSSÃO ... 45
5.4.1 Seleção de solvente ... 45
5.4.2 Extração assistida por ultrassom (EAU) ... 47
5.4.3 Extração acelerada com solvente (EAS) ... 52
5.4 CONCLUSÃO ... 57
5.5 AGRADECIMENTOS ... 57
5.6 REFERÊNCIAS ... 58
6. EFEITO DO PROCESSAMENTO INDUSTRIAL SOBRE CONSTITUINTES DA AMÊNDOA DE CASTANHA DE CAJU ... 63
6.1 RESUMO ... 63
6.2 INTRODUÇÃO ... 63
6.3 MATERIAL & MÉTODOS ... 65
xix
6.3.2 Extração lipídica ... 65
6.3.3 Caracterização de ácidos anacárdicos... 65
6.3.4 Citoquímica - Amido ... 67
6.4 RESULTADOS & DISCUSSÃO ... 67
6.4.1 Umidade e conteúdo lipídico ... 67
6.4.3 Amido ... 70
6.5 CONCLUSÃO ... 72
6.6 AGRADECIMENTOS ... 72
6.7 REFERÊNCIAS ... 72
7. CONSIDERAÇÕES FINAIS ... 76
8. SUGESTÕES PARA TRABALHOS FUTUROS ... 77
1
1. INTRODUÇÃO
A agroindústria no Brasil vem ocupando um posto privilegiado na definição dos rumos da economia nacional e no fluxo internacional de comércio (BRASIL SUSTENTÁVEL, 2009). O agronegócio brasileiro responde por aproximadamente 30% do produto interno bruto nacional, 37% dos empregos existentes, 39% das exportações (ECOAGRO, 2014), ocupando a quarta posição em exportação mundial (ABRAPA, 2014).
No estado do Ceará, o caju (Figura 1) é um dos principais produtos agroindustriais, destacando-se como um ícone na economia do Nordeste, que é formado por um pedúnculo comestível que se forma junto à castanha, o verdadeiro fruto (FRUTICULTURA, 2010).
Figura 1. Caju (A), Casca (B), película (C) e amêndoa de castanha de caju (D).
Fonte: Foto A - http://acaiecompanhia.com.br/; B-C-D - Elaborada pelo autor.
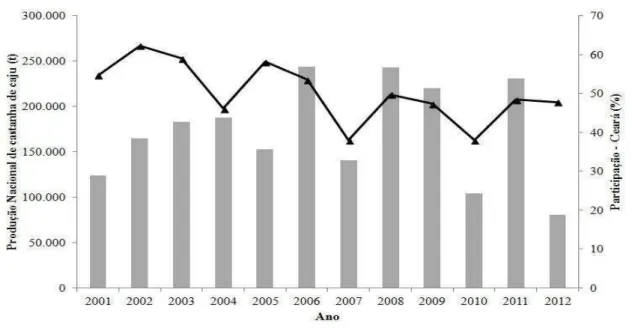
Em 2012, o Brasil produziu 80 mil toneladas de castanha de caju (FIGURA 2), ocupando a décima posição em produção mundial (FAOSTAT, 2014) com o estado do Ceará participando com 48% da produção nacional (CONAB, 2014).
Figura 2. Produção nacional de castanha de caju no século XXI.
2 A castanha de caju é constituída de três partes (Figura 1): a casca, que representa 65 a 70% do peso total da castanha; a película ou tegumento da amêndoa, cerca de 3% e; a amêndoa, parte comestível que equivale a aproximadamente 28 a 30% (PAIVA, 2000).
A casca da castanha de caju é repleta de um líquido escuro, conhecido por líquido da casca da castanha do caju (LCC), ou cashew nut shell liquid (CNSL) como é conhecido internacionalmente, que representa aproximadamente 25% do peso da castanha e é considerado um subproduto de agronegócio do caju (MAZZETO et al., 2009). O LCC é constituído de alquilfenóis que apresentam um interesse potencial na área de produção de materiais biologicamente ativos, surfactantes, polímeros e aditivos (AGOSTINI-COSTA et al., 2000; KUMAR et al., 2002; CORREIA et al., 2006).
O tegumento da castanha de caju in natura contém os esteroides: β-sitosterol e estigmasterol; triterpenoides pentacíclicos: lupeol e β-amirina; e os flavonóis: catequina e epicatequina (CHAVES et al., 2010), atrativos para o mercado de produtos naturais.
A amêndoa de castanha de caju possui em sua composição um perfil de aminoácidos biologicamente ativos, amido, ácidos graxos benéficos e outros compostos como alquilfenóis, fitoesteróis, selênio e tocoferóis que potencializam sua ação antioxidante (FREITAS & NAVES, 2010; MELO et al. 1998).
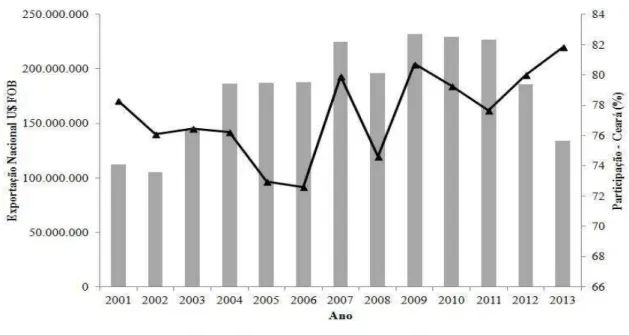
A amêndoa de castanha de caju brasileira vem mantendo uma movimentação anual no século XXI acima de 100 milhões de dólares em exportação e o estado do Ceará recebe destaque por ser responsável por no mínimo 70% do que foi exportado (FIGURA 3).
Figura 3. Exportação de amêndoa de castanha de caju no século XXI.
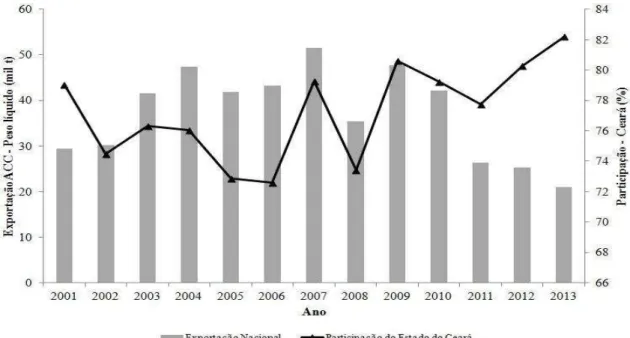
3 Em termos de peso líquido da amêndoa de castanha de caju exportada no século XXI (FIGURA 4), a quantidade mínima exportada foi de 21 mil toneladas por ano, podendo-se estimar 45 mil toneladas de casca e quatro mil toneladas de película, matérias-primas consideradas resíduo, mas que apresentam conteúdo fenólico elevado e de potencial interesse industrial.
Figura 4. Peso líquido da amêndoa de castanha de caju exportada no século XXI.
Fonte: MDIC (2014).
A incorporação de práticas de melhoria contínua com a utilização de tecnologias limpas, principalmente pelo uso sustentável e transformação eficiente de matérias-primas, fomentando o reaproveitamento e o mínimo desperdício de seus produtos finais (JABBOUR, 2010; SILVA JÚNIOR & ANDRADE, 2011) tem motivado a investigação de novas técnicas no controle de qualidade de processos e a consequente redução ou eliminação dos riscos à saúde do consumidor e ao meio ambiente.
Dentro deste contexto, o objetivo desta tese foi avaliar os efeitos do processamento industrial sobre constituintes da amêndoa, os métodos de extração de LCC na casca e compostos fenólicos na película de castanha de caju. A tese foi dividida em três etapas:
Avaliação do efeito de pressão e temperatura na extração do líquido da casca da castanha de caju;
Extração de compostos fenólicos da película de castanha de caju;
4
2. REVISÃO BIBLIOGRÁFICA
2.1. Caju (Anacardium occidentale L.)
O cajueiro, Anacardium occidentale (Anacardiaceae), é uma árvore de aparência exótica, troncos tortuosos, folhas glabras, flores masculina e hermafroditas, fruto reniforme e cresce nos trópicos das Américas, África e Ásia (CHITARRA & CHITARRA, 2006). A introdução de plantas no melhoramento genético do cajueiro (clones), tem sido a principal fonte de obtenção de materiais mais adequados à exploração comercial (PAIVA & BARROS, 2004).
O fruto do cajueiro, o caju (FIGURA 5), é formado por um pedúnculo comestível, ou pseudofruto, que se forma junto à castanha, o verdadeiro fruto (FRUTICULTURA, 2010) constituído de três partes: a casca, que representa 65 a 70% do peso total da castanha; a amêndoa, parte comestível que equivale a aproximadamente 28 a 30%; e a película ou tegumento da amêndoa, cerca de 3% (PAIVA et al., 2000).
Figura 5. Caju (Anacardium occidentale L.).
Fonte: http://www.sindfrutas.com.br
5 O processo de beneficiamento da castanha de caju (FIGURA 6) para a obtenção da amêndoa envolve operações complexas devido à resistência da casca ao corte e aderência da película à amêndoa (PAIVA et al., 2006; LEMOS, 2009).
Figura 6. Fluxograma – Beneficiamento da castanha de caju.
Fonte: Adaptado de Paiva et al. (2006), Silva Neto et al. (2010).
A castanha de caju é um aquênio que apresenta casca coriácea lisa, mesocarpo alveolado, repleto de um líquido escuro, conhecido por líquido da casca da castanha do caju, LCC (FIGURA 7) ou cashewnut shell liquid (CNSL) como é conhecido internacionalmente e que apresenta baixíssimo valor agregado (MAZZETO et al., 2009).
Figura 7. Líquido da casca da castanha de caju (LCC técnico).
Fonte: Elaborada pelo autor.
Seleção e limpeza
Armazenamento
Cozimento
Decorticação Recepção
Minifábrica – utiliza vapor úmido
Despeliculagem
Seleção e classificação
Embalagem
Fritura Secagem
6 O LCC apresenta como principal característica a ocorrência de compostos fenólicos (FIGURA 8) que apresentam um interesse potencial na área de produção de materiais biologicamente ativos, surfactantes, polímeros e aditivos, constituído pelos alquilfenois: ácidos anacárdicos, derivados do ácido salicílico; pelos cardóis, derivados do resorcinol; e por cardanóis (CORREIA et al., 2006; MAZZETO et al., 2009; AGOSTINI-COSTAet al., 2000; KUMAR et al., 2002).
Figura 8. Representação da estrutura química dos principais componentes do líquido da
casca de castanha de caju (LCC).
Fonte: Mazzeto et al. (2009).
O LCC pode ser classificado como LCC natural, por conter uma grande quantidade de ácido anacárdico e não apresentar material polimérico em sua composição e LCC técnico, que apresenta um elevado percentual de cardanol e presença de material polimérico (GEDAM & SAMPATHKUMARAN, 1986).
Na obtenção do LCC podem ser empregados diferentes processos como extração com solvente que apresente afinidade apolar ou utilização de fluido supercrítico, por prensagem e processo térmico-mecânico (PATEL et al., 2006; MAZZETO et al., 2009). A extração por prensagem é um processo muito utilizado atualmente para extração em pequena escala para atender demandas locais de cooperativas podendo ser utilizado para materiais que apresentem baixa umidade, menor que 10%, e presença de material fibroso (ANTONIASSI, 2014).
7 O tegumento da castanha de caju in natura apresenta os esteroides sitosterol e estigmasterol, os triterpenoides pentacíclicos lupeol e β-amirina e os flavonóis catequina e epicatequina (CHAVES et al., 2010; CHANDRASEKARA & SHAHIDI, 2011; TROX et al., 2011). Após o processamento industrial, este material geralmente é descartado ou utilizado na preparação de rações (FREITAS et al., 2006; HOLANDA et al., 2010; LEITE et al., 2013) e como complemento de fertilizantes agrícolas (ALMEIDA et al., 1988).
O Brasil é um dos países que mais produzem resíduos agroindustriais provocando graves problemas ambientais e a busca de alternativas para utilização de resíduos orgânicos gerados vem crescendo dentro de vários centros de pesquisa (CATANEO et al., 2008; SOUSA et al., 2011). Agregar valor a esses resíduos é de interesse econômico e ambiental, necessitando de investigação científica e tecnológica que favoreça uma produção sustentável de forma eficiente e segura (SCHIEBER et al., 2001). Nesse sentido, as indústrias estão desenvolvendo e buscando novas formas de lidar com os problemas ambientais, mediante mecanismos de auto-regulação ou gestão ambiental proativa (SANCHES, 2000).
2.2. Compostos fenólicos
Os vegetais, em geral, condimentos e produtos industrializados, podem apresentar numerosos fitoquímicos, compostos bioativos de vegetais, amplamente distribuídos na natureza dentre eles compostos fenólicos, compostos nitrogenados, carotenoides, ácido ascórbico e tocoferóis (DEGÁSPARI & WASZCZYNSKYJ, 2004; SILVA et al., 2010; OLIVEIRA & BASTOS, 2011). Os compostos ativos mais comumente encontrados em frutas e hortaliças são os fenólicos, que podem se apresentar na forma de pigmentos, que dão a aparência colorida (RHODES, 1996; SILVA et al., 2010; ARAUJO, 2011).
8
Figura 9. Compostos fenólicos presentes em alimentos.
9 Os polifenóis englobam uma gama enorme de substâncias, dentre elas fenóis simples, ácidos fenólicos (tanto o ácido benzoico e os derivados do ácido cinâmico), alquilfenóis (ácido anacárdico, cardanol e cardol) cumarinas, flavonoides (catequinas, antocianinas, e isoflavonas), estilbenos e os polímeros taninos e ligninas (KING & YOUNG, 1999; NIJVELDT et al., 2001; VOLP et al., 2008). Não existe nenhuma classificação universal de polifenóis (MOTILVA et al., 2013). Crozier et al. (2009), por exemplo, classificaram esses compostos fenólicos em flavonóides e não flavonóides.
Em termo químico estrutural (TABELA 1), os fenólicos são definidos como substâncias que possuem anel aromático com um ou mais substituintes hidroxílicos, incluindo seus grupos funcionais (D’ARCHIVIO, 2007; IGNAT et al., 2011; MOTILVA et al., 2013).
Tabela 1. Compostos fenólicos em plantas.
Classe Estrutura
Fenólicos simples, benzoquinonas C6
Ácidos hidroxibenzóicos C6-C1
Acetofenol, ácidos fenilacéticos C6-C2
Ácidos hidroxicinâmicos, fenilpropanóides C6-C3
Naftoquinonas C6-C4
Xantonas C6-C1-C6
Estilbenos, antroquinonas C6-C2-C6
Flavonóides, isoflavonóides C6-C3-C6
Lignanas, neolignanas (C6-C3)2
Biflavonóides (C6-C3-C6)2
Ligninas (C6-C3)n
Taninos condensados (C6-C3-C6)n
Fonte: Angelo & Jorge (2007).
Os ácidos fenólicos livres representam a menor parte dos compostos fenólicos e são solúveis em soluções de metanol, etanol ou acetona (TIAN et al., 2004). Os fenólicos conjugados geralmente estão sob a forma de ésteres e amidas, incluindo compostos de baixo peso molecular, solúveis em água, presentes no citosol, ou formas lipossolúveis, associadas às ceras da superfície da planta (KARAKAYA, 2004).
10 oxidativo nos alimentos, que estão presentes em diversos resíduos agroindustriais (SOUSA et al., 2011).
Em sementes oleaginosas, poucos compostos fenólicos ocorrem em concentrações relativamente altas e entre óleos extraídos de amêndoas, castanhas e nozes são destaque na família Juglandaceae (Noz Pecan e Noz comum), seguidos pelo pistache, macadâmia e castanha de caju conforme Tabela 2 (COSTA & JORGE, 2011).
Tabela 2. Composição média em compostos fenólicos totais de óleos extraídos de amêndoas,
castanhas e nozes.
Amostra Nome científico Fenólicos totais (mg/100g de óleo)
Castanha do Brasil Bertholletia excelsa 169,2
Amêndoa Prunus dulcis 212,9
Avelã Corylus Avellana 314,8
Castanha de Caju Anacardium occidentale 316,4 Macadâmia Macadamia integrifolia 497,8
Pistache Pistacia vera 571,8
Noz pecan Carya illinoensis 1463,9
Noz comum Juglans regia 1580,5
Fonte: Adaptado de Yang et al. (2009).
Os compostos fenólicos são conhecidos como potentes antioxidantes e antagonistas naturais de patógenos (CATANEO et al., 2008), com atividade biológica relacionada com a estrutura química, conjugação com outras substâncias, grau de polimerização e solubilidade (MIRA et al., 2008). Dentre as atividades biológicas, os ácidos anacárdicos (FIGURA 9) apresentam atividades antitumoral (CORREIA et al., 2006; WU et al., 2011), antioxidante (KUBO et al., 2006; TREVISAN et al., 2006; STASIUK & KOZUBEK, 2010) antiacne (KUBO et al., 1994), antibacteriana (PARASA et al., 2011), larvicida (GUISSONI et al., 2013) e inibição das enzimas CYP3A4 do citocromo P450 (SUO et al., 2012), tirosinase, urease (HEMSHEKHAR et al., 2012), prostaglandina sintase e lipoxigenase (PARAMASHIVAPPA et al., 2001).
2.3. Técnicas de extração de compostos fenólicos
11 micro-ondas, fluido pressurizado ou por ultrassom; e purificação do princípio ativo (BARRETO JÚNIOR et al., 2005; PETRUCCI et al., 2010; RAMALHO & SUAREZ, 2013). A parede celular vegetal (FIGURA 10) é formada por uma mistura complexa de polissacarídeos e outros compostos secretados pela célula e que são dispostos e conectados de uma forma muito bem organizada através de ligações covalentes e não covalentes (TAIZ & ZEIGER, 2002). O objetivo de extrair compostos fenólicos a partir de vegetais é a liberação destes compostos das estruturas celulares onde eles se encontram, ocorrendo a necessidade de uma operação unitária de ruptura do tecido da planta (ASPE & FERNANDEZ, 2011).
Figura 10. Representação estrutural da parede celular primária das células vegetais. (A)
Celulose, (B) Hemicelulose, (C) Proteína, (D) Pectina, (E) Ácido fenólico, e (F) Lignina.
Fonte: Acosta-Estrada et al. (2014).
O crescente aumento na demanda de moléculas-alvo, produtos intracelulares, pela indústria alimentícia e farmacêutica tem impulsionado o desenvolvimento de sistemas eficientes para recuperação destes materiais (PESSOA JUNIOR & KILIKIAN, 2005). A ruptura celular, também conhecido por rompimento celular, é a primeira etapa no processo de isolamento de materiais intracelulares (HARRISON et al., 2003; MEDEIROS et al., 2008).
Dentre as técnicas para a extração de nutracêuticos de plantas, as extrações assistida por ultrassom e acelerada com solvente apresentam como vantagens a diminuição do tempo de extração e do consumo de solvente, aumento do rendimento de extração e melhoria na qualidade dos extratos (WANG & WELLER, 2006). Estes métodos se apresentam ainda mais atrativos quando se faz uso de solventes considerados seguros GRAS, do inglês General
12 A extração assistida por ultrassom (EAU) é uma técnica que utiliza ondas mecânicas com frequência maior que 18 kHz que se propagam em ciclos sucessivos de compressão e rarefação, cavitação, através de qualquer meio material promovendo efeitos de ativação em reações químicas, melhoria na eficiência de processos extrativos, aumento da transferência de massas entre fases e não possui interação direta com espécies moleculares (MASON & LORIMER, 1988; SUSLICK, 1998; DELGADO-POVEDANO & CASTRO, 2013).
Existem dois tipos de equipamentos geradores de ondas ultrassônicas: o banho e a sonda (KORN et al., 2003). A influência do ultrassom na etapa de extração depende da frequência, potência do equipamento e do tempo (PICO, 2013; CASTRO & DELGADO-POVEDANO, 2014).
Para fins analíticos, os ultrassons têm sido utilizados em diferentes etapas de separação e extração, como apresentado na Tabela 3.
Tabela 3. Utilização de ultrassom em análise química.
Etapa Aplicação
Amostragem Não se aplica
Preparo de amostras
Extração sólido - líquido Extração líquido - líquido Separação granulométrica Desgaseificação
Degradação de matéria orgânica Separação por co-precipitação Geração de reagentes
Determinação Medida do tempo de voo da onda
Medida da atenuação da intensidade de onda
Tratamento de dados Não se aplica
Fonte: Korn et al. (2003).
13
Tabela 4. Extração de polifenóis em produtos agroindustriais utilizando ultrassom.
Amostra Solvente Potência %* Tempo** Referência
Ginkgo biloba Metanol 60-80 (300W) 45-75 Zhou et al. (2014)
Urucum Clorofórmio 36 (550W) 2-10 Yolmeh et al. (2014) Azeitona - 100 (150W) 0-10 Clodoveo et al. (2013)
Romã Hexano 10-100 (130W) 2-40 Goula (2013)
Amora Etanol 100 (150W) 5-20 Oancea et al. (2013) Mostarda Etanol 15 (400W) 10-60 Dubie et al. (2013) Casca de rambutã Água 50-100 (40W) 10-30 Maran et al. (2013)
Legumes Metanol 100 (135W) 120 Konar (2013)
Folhas de amora Metanol - 20-120 Aybastıer et al. (2013) Mel Metanol 56-100 (160 W) - Biesaga & Pyrzynska (2013) Amêndoa Hexano 100 (150 W) 40-60 Zhang et al. (2009)
Pistache Água - 45 Goli et al. (2005)
Cereja Metanol 100 (50 W) 15 Karabegovic et al. (2014)
* capacidade máxima entre parenteses ** tempo em minutos
As técnicas instrumentais que envolvem extração com fluido pressurizado são extração acelerada com solvente (EAS), extração com fluido supercrítico (EFS), microextração em fase sólida (MEFS) e extração com água no estado subcrítico (EAES) (LANÇAS, 2002; MEDIOLA et al., 2007).
14
Tabela 5. Condições de extração acelerada com solvente de fitoquímicos em diversos produtos agroindustriais.
Amostra Molécula alvo Solvente T (°C) t (min) Ciclos Referência
Sidra Fenólicos Metanol 40 5 2 Alonso-Salces et al. (2001)
Farelo de sorgo Fenólicos Etanol/água 50-70% v/v 60-120-150 - 1 Barros (2013)
Casca de Citrus unshiu Flavanonas Água 110-200 (160) 5-20 (10) 1 Cheigh et al. (2012) Microalga Spirulina platensis Antioxidantes Etanol-Água 60-115-170 3-9-15 - Herrero et al. (2005) Alecrim e orégano Fenólicos Metanol/Água 32-88% v/v (56,5%) 66-129 - - Hossain et al. (2011) Erva-mate Constiuintes Metanol (13,8%) 50-100 10-30 1-3 Jacques et al. (2008)
Casca de cebola Quercetina Água 100-190 (165) 5-30 (15) - Ko et al. (2011)
Mistura de cascas Flavonóides Água 110-200 (150-190) 5-15 - Ko et al. (2014)
Berberis cretica Fenólicos Etanol/água 50% v/v 75-100 - - Kukula-Koch et al. (2011) Fermentado de arroz Monacolina K Acetato de etila 80-100-120 5-7-9 1-2-3 Liu et al. (2010) Bagaço de uva vermelha Procianidinas Etanol/Água 0 - 90% v/v (50%) 80-140 - 1 Monrad et al. (2010a) Bagaço de uva vermelha Antocianinas Etanol/Água 10 - 70% v/v (50%) 40 -140 (70) - 1 Monrad et al. (2010b) Casca de Jabuticaba Fenólicos Etanol 40-120 (80) 3-15 (9) - Santos et al. (2012)
Erva-doce Estragol Metanol 75-100-125 3-5-7 1-2-3 Rodríguez-Solana et al. (2014)
Bagaço de maçã Antioxidantes Etanol/água 25-85% v/v (60%) 75-200 - - Wijngaard & Brunton (2009) Fructus Schisandrae Lignana Etanol/água 50-100% v/v (60%) 80-180 (160) 5-12 (10) - Zhao et al. (2012)
15
3. REFERÊNCIAS BIBLIOGRÁFICAS
ABRAPA. Exportação Mundial. Disponível em: <http://www.abrapa.com.br/>. Acesso em 17 abr. 2014.
ACOSTA-ESTRADA, B. A.; GUTIERREZ-URIBE, J. A.; SERNA-SALDIVAR, S. O. Bound phenolics in foods, a review. Food Chemistry, v. 152, p. 46–55, 2014.
AGOSTINI-COSTA, T. S.; SANTOS, J. R.; GARRUTI, D. S.; FEITOSA, T. Caracterização, por cromatografia em camada delgada, dos compostos fenólicos presentes em pedúnculos de caju (Anacardium occidentale L.). Boletim do CEPPA, v. 18, p. 129-137, 2000.
ALMEIDA, F. A. G.; FONTES, J. M.; ALMEIDA, F. C. G. Uso da cinza da casca da
castanha do caju, Anacardium occidentale L, como fonte de fósforo para a cultura do feijão de corda Vigna unguiculata (L.) Walp. Ciência Agronômica, v. 19, p. 31-35, 1988.
ALONSO-SALCES, R. M.; KORTA, E.; BARRANCO, A.; BERRUETA, L. A.; GALLO, B.; VICENTE, F. Determination of polyphenolic profiles of basque cider apple varieties using accelerated solvent extraction. Journal of Agricultural and Food Chemistry, v. 49, p. 3761-3767, 2001.
ANGELO, P. M.; JORGE, N. Compostos fenólicos em alimentos – Uma breve revisão.
Revista do Instituto Adolfo Lutz, v. 66, p. 1-9, 2007.
ANTONIASSI, R. Prensagem em pequena escala. Disponível em:
<http://www.agencia.cnptia.embrapa.br/gestor/tecnologia_de_alimentos/arvore/CONT000gc8 yujq302wx5ok01dx9lcudlguwx.html>. Acesso em: 31 mar. 2014.
ARAUJO, J. M. Química de Alimentos: Teoria e prática, 5 ed. Viçosa: UFV, 2011.
ASPE, E.; FERNANDEZ, K. The effect of different extraction techniques on extraction yield, total phenolic, and anti-radical capacity of extracts from Pinus radiata Bark. Industrial
Crops and Products, v. 34, p. 838– 844, 2011.
ASSIS, L. M.; PINTO, J. S. S.; LANÇAS, F. M. Comparasion among different extraction methods (PFE, SFE, Sonication, Soxhlet) for the isolation of organic compounds from coal.
The Journal of Microcolumn Separations, v. 12, p. 292-301, 2000.
AYBASTIER, O.; ISIK, E.; SAHIN, S.; DEMIR, C. Optimization of ultrasonic-assisted extraction of antioxidant compounds from blackberry leaves using response surface methodology. Industrial Crops and Products, v. 44, p. 558–565, 2013.
BARRETO JÚNIOR, A. G.; BISCAIA JUNIOR, E. C.; VEIGA JUNIOR, V. F.; PINTO, A. C.; CARVALHAES, S. F.; MACIEL, M. A. M. Cromatografia de troca-iônica aplicada ao isolamento da fração ácida do óleo de copaíba (Copaifera multijuga) e da sacaca (Croton
16 BARROS, F.; DYKES, L.; AWIKA, J. M.; ROONEY, L. W. Accelerated solvent extraction of phenolic compounds from sorghum brans. Journal of Cereal Science, v. 58, p. 305-312, 2013.
BECKMAN, C. H. Phenolic-storing cells: keys to programmed cell death and periderm formation in wilt disease resistance and in general defence responses in plants? Physiological
and Molecular Plant Pathology, v. 57, p. 101-110, 2000.
BIESAGA, M.; PYRZYNSKA, K. Stability of bioactive polyphenols from honey during different extraction methods. Food Chemistry, v. 136 p. 46–54, 2013.
BRASIL SUSTENTÁVEL - Perspectivas do Brasil na Agroindústria. Ernst & Young Terco, Série Brasil Sustentável, 2009.
CASTRO, M. D. L.; DELGADO-POVEDANO, M. M. Ultrasound: a subexploited tool for sample preparation in metabolomics. Analytica Chimica Acta, v. 806, p. 74– 84, 2014. CATANEO, C. B.; CALIARI, V.; GONZAGA, L. V.; KUSKOSKI, E. M.; FETT, R.. Atividade antioxidante e conteúdo fenólico do resíduo agroindustrial da produção de vinho
Semina, v. 29, p. 93-102, 2008.
CAVALCANTE, J. M.; MORAIS, A. C. S.; RODRIGUES, M. C. P. Efeito da adição de amêndoas da castanha de caju nas propriedades sensoriais do iogurte adoçado com mel.
Revista Brasileira de Tecnologia Agroindustrial, v. 3, p. 01-14, 2009.
CHANDRASEKARA, N.; SHAHIDI, F. Effect of roasting on phenolic content and
antioxidant activities of whole cashew nuts, kernels, and testa. Journal of Agricultural and
Food Chemistry, v. 59, p. 5006-5014, 2011.
CHAVES, M. H.; CITÓ, A. M. G. L., LOPES, J. A. D. COSTA, D. A.; OLIVEIRA, C. A. A.; COSTA, A. F.; BRITO JÚNIOR, F. E. M. Fenóis totais, atividade antioxidante e constituintes químicos de extratos de Anacardium occidentale L., Anacardiaceae. Revista Brasileira de
Farmacognosia, v. 20, p. 106-112, 2010.
CHEIGH. C. I.; CHUNG, E. Y.; CHUNG, M. S. Enhanced extraction of flavanones hesperidin and narirutin from Citrus unshiu peel using subcritical water. Journal of Food
Engineering, v. 110, p. 472–477, 2012.
CHITARRA, M. I. F.; CHITARRA, A. B. Pós-colheita de Frutas e Hortaliças: Glossário. Lavras: UFLA, 2006.
CLODOVEO, M. L.; DURANTE, V.; NOTTE, D.; PUNZI, R.; GAMBACORTA, G.
Ultrasound-assisted extraction of virgin olive oil to improve the process efficiency. European
Journal of Lipid Science and Technology, v. 115, p. 1062–1069, 2013. CONAB. Companhia Nacional de Abastecimento. Disponível em: <http://www.conab.gov.br/>. Acesso em: 17 abr. 2014.
17 COSTA, T.; JORGE, N. Compostos Bioativos Benéficos Presentes em Castanhas e Nozes.
Unopar Científica Ciências Biológicas e da Saúde, v. 13, p.195-203, 2011.
CROZIER, A.; JAGANATH, I. B.; CLIFFORD, M. N. Dietary phenolics: chemistry, bioavailability and effects on health. Natural Product Reports, v. 26, p. 1001-1043, 2009.
D’ARCHIVIO, M.; FILESI, C.; BENEDETTO, R.; GARGIULO, R.; GIOVANNINI, C.;
MASELLA, R. Polyphenols, dietary sources and bioavailability. Annali dell'Istituto
Superiore di Sanità, v. 43, p. 348-361, 2007.
DEGÁSPARI, C. H.; WASZCZYNSKYJ, N. Propriedades antioxidantes de compostos fenólicos. Visão Acadêmica, v. 5, p. 33-40, 2004.
DELGADO-POVEDANO, M. M.; CASTRO, M. D. L. Ultrasound-assisted analytical emulsification-extraction. Trends in Analytical Chemistry, v. 45, p. 1-13, 2013.
DUBIE, J.; STANCIK, A.; MORRA, M.; NINDO, C. Antioxidant extraction from mustard
(Brassica juncea) seed meal using high-intensity ultrasound. Journal of Food Science, v. 78,
p. 542-548, 2013.
ECOAGRO. O agronegócio no Brasil. Disponível em: <http://www.ecoagro.agr.br/>. Acesso: 17 abr. 2014.
FAOSTAT. Food and Agriculture Organization of the United Nations. Disponível em: <http://faostat.fao.org/>. Acesso em: 17 abr. 2014.
FAULDS, C. B.; WILLIAMSON, G. The role of hydroxycinnamates in the plant cell wall.
Journal of the Science of Food and Agriculture, v. 79, p. 393-395, 1999.
FDA – Food and Drug Administration. GRAS, General Recognize as Safe. Disponível em: < http://www.fda.gov/>. Acesso em: 31 mar. 2014.
FERNANDES, F. A. N.; RODRIGUES, S. Ultrasound applications in minimal processing.
Stewart Postharvest Review, v. 5, p. 1-7, 2009.
FREITAS, E. R.; FUENTES, M. F. F.; SANTOS JUNIOR, A.; GUERREIRO, M. E. F.; ESPINDOLA, G. B. Farelo de castanha de caju em rações para frangos de corte. Pesquisa
Agropecuária Brasileira, v. 41, p. 1001-1006, 2006.
FREITAS, J. B.; NAVES, M. M. V. Composição química de nozes e sementes comestíveis e sua relação com a nutrição e saúde. Revista de Nutrição, v. 23, p. 269-279, 2010.
FRUTICULTURA, Caju. Brasília: Fundação Banco do Brasil, Série cadernos de propostas para atuação em cadeias produtivas, v. 4, set. 2010.
18 GOLI, A. H.; BARZEGAR, M.; SAHARI, M. A. Antioxidant activity and total phenolic compounds of pistachio (Pistachia vera) hull extracts. Food Chemistry, v. 92, p. 521–525, 2005.
GOULA, A. M. Ultrasound-assisted extraction of pomegranate seed oil – Kinetic modeling.
Journal of Food Engineering, v. 117, p. 492–498, 2013.
GUÇLU-USTUNDAG, O.; BALSEVICH, J.; MAZZA, G. Pressurized low polarity water extraction of saponins from cow cockle seed. Journal of Food Engineering, v. 80, p. 619– 630, 2007.
GUISSONI, A. C. P.; SILVA, I. G.; GERIS, R.; CUNHA, L. C.; SILVA, H. H. G. Atividade larvicida de Anacardium occidentale como alternativa ao controle de Aedes aegypti e sua toxicidade em Rattus norvegicus. Revista Brasileira de Plantas Medicinais, v. 15, p. 363-367, 2013.
HARRISON, R. G.; TODD, P.; RUDGE, S. R.; PETRIDES, D. P. Bioseparations Science
and Engineering. New York: Oxford University Press, 2003.
HEMSHEKHAR, M.; SANTHOSH, M. S.; KEMPARAJU, K.; GIRISH, K. S. Emerging roles of anacardic acid and its derivatives: A pharmacological overview. Basic & Clinical
Pharmacology & Toxicology, v. 110, p. 122-132, 2012.
HERRERO, M.; MARTIIN-ALVAREZ, P. J.; SENORANS F. J.; CIFUENTES, A.; IBANEZ, E. Optimization of accelerated solvent extraction of antioxidants from Spirulina
platensis microalga. Food Chemistry, v. 93, p.417–423, 2005.
HOLANDA, J. S.; TORRES, J. F.; OLIVEIRA, M. T.; FERREIRA FILHO, L.; HOLANDA, A. C. Da carne de caju à carne de cordeiro. Natal: EMPARN, 2010. (Boletim de Pesquisa n° 35).
HOSSAIN, M. B.; BARRY-RYAN C.; MARTIN-DIANA, A. B.; BRUNTON, N. P. Optimisation of accelerated solvent extraction of antioxidant compounds from rosemary
(Rosmarinus officinalis L.), marjoram (Origanum majorana L.) and oregano (Origanum
vulgare L.) using response surface methodology. Food Chemistry, v. 126, p. 339–346, 2011.
IGNAT, I.; VOLF, I.; POPA, V. I. A critical review of methods for characterisation of polyphenolic compounds in fruits and vegetables. Food Chemistry, v. 126 p. 1821–1835, 2011.
JABBOUR, C. J. C. Tecnologias ambientais: em busca de um significado. Revista de
Administração Pública, v. 44, p. 591-611, 2010.
JACQUES, R. A.; DARIVA, C.; OLIVEIRA, J. V.; CARAMÃO, E. B. Pressurized liquid extraction of mate tea leaves. Analytica Chimica Acta, v. 625, p. 70–76, 2008.
KANMAZ, E. O. Subcritical water extraction of phenolic compounds from flaxseed meal sticks using accelerated solvent extractor (ASE). European Food Research and
19 KARABEGOVIC, I. T.; STOJICEVIC, S. S.; VELICKOVIC, D. T.; TODOROVIC, Z. B.; NIKOLIC, N. C.; LAZIC, M. L. The effect of different extraction techniques on the composition and antioxidant activity of cherry laurel (Prunus laurocerasus) leaf and fruit extracts. Industrial Crops and Products, v. 54, p. 142–148, 2014.
KARAKAYA, S. Bioavailability of phenolic compounds. Critical Reviews in Food Science
and Nutrition, v. 44, p. 453-464, 2004.
KING, A., YOUNG, G. Characteristics and occurrence of phenolic phytochemicals. Journal
of the American Dietetic Association, v. 99, p. 213-218, 1999.
KO, M. J.; CHEIGH, C. I.; CHO, S. W.; CHUNG, M. S. Subcritical water extraction of flavonol quercetin from onion skin. Journal of Food Engineering, v. 102, p. 327–333, 2011. KO, M. J.; CHEIGH, C. I.; CHUNG, M. S. Relationship analysis between flavonoids
structure and subcritical water extraction (SWE). Food Chemistry, v. 143, p. 147–155, 2014. KONAR, N. Non-isoflavone phytoestrogenic compound contents of various legumes.
European Food Research and Technology, v. 236, p. 523–530, 2013.
KORN, M.; ANDRADE, M. V. A. S.; BORGES, S. S. Procedimentos analíticos assistidos por ultrassom. Revista Analytica, n. 3, p. 34-39, 2003.
KUBO, I.; MASUOKA, N.; HA, T. J.; TSUJIMOTO, K. Antioxidant activity of anacardic acids. Food Chemistry, v. 99, p. 555-562, 2006.
KUBO, I.; MUROI, H.; KUBO, A. Naturally occurring antiacne agents. Journal of Natural
Products, v. 57, p. 9-17, 1994.
KUKULA-KOCH, W.; ALIGIANNIS, N.; HALABALAKI, M.; SKALTSOUNIS, A. L.; GLOWNIAK, K.; KALPOUTZAKIS, E. Influence of extraction procedures on phenolic content and antioxidant activity of Cretan barberry herb. Food Chemistry, v. 138, p. 406– 413, 2011.
KUMAR, P. P.; PARAMASHIVAPPA, R. VITHAYATHIL, P. J.; RAO, P. V. S.; RAO, S. Process for isolation of cardanol from technical cashew (Anacardium occidentale L.) nut shell liquid. Journal of Agricultural and Food Chemistry, v. 50, p. 4705-4708, 2002.
LANÇAS, F. M. Extração com fluido supercrítico: quo vadis? Revista Analytica, n. 2, p. 30-37, 2002.
LEITE, D. F. L.; AGUIAR, E. M.; HOLANDA, J. S.; RANGEL, H. N.; AURELIANO, I. P. L.; MEDEIROS, V. B.; LIMA JUNIOR, D. M. Valor nutritivo do resíduo de caju desidratado associado a diferentes concentrados. Acta Veterinaria Brasilica, v. 7, p. 66-72, 2013.
LEMES, A. C.; ÁLVARES, G. T.; KALIL, S. J. Extraction of β-galactosidase from
Kluyveromyces marxianus CCT 7082 by ultrasonic method. Biochemistry and
20 LEMOS, S. S. Implantação do sistema APPCC (análise de perigos e pontos críticos de
controle) em uma indústria de beneficiamento de castanha de caju: um estudo de caso.
2009. 104 f. Monografia (Especialização em Gestão da Qualidade e Segurança de Alimentos)
– Faculdade de Engenharia Química, Universidade Estadual de Campinas, Fortaleza, 2009. LEONEL, M.; CEREDA, M. P. Caracterização físico-química de algumas tuberosas amiláceas. Ciência e Tecnologia de Alimentos, v. 22, n. 1, p. 65-69, 2002.
LIMA, J. R.; BRUNO, L. M. Estabilidade de pasta de amêndoa de castanha de caju. Ciência e
Tecnologia de Alimentos, v. 27, p. 816-822, 2007.
LIMA, J. R.; SILVA, M. A. A. P.; GONÇALVES, L. A. G. Caracterização sensorial de amêndoas de castanha de caju fritas e salgadas. Ciência e Tecnologia de Alimentos, v. 19, p. 123-126, 1999.
LIMA, J. R.; SOUSA, M. M. M.; Influência do tipo de óleo utilizado para fritura na estabilidade de amêndoas de castanha de caju. Boletim do Centro de Pesquisa de
Processamento de Alimentos, v. 19, p. 43-52, 2001.
LIU, Y.; GUO, X.; DUAN, W.; WANG, X.; DU, J. Accelerated solvent extraction of monacolin K from red yeast rice and purification by high-speed counter-current chromatography. Journal of Chromatography B, v. 878, p. 2881–2885, 2010.
MARAN, J. P.; MANIKANDAN, S.; NIVETHA, C. V.; DINESH, R. Ultrasound assisted extraction of bioactive compounds from Nephelium lappaceum L. fruit peel using central composite face centered response surface design. Arabian Journal of Chemistry, p. 1-13, 2013.
MASON, T. J.; LORIMER, J. P. Sonochemistry: Theory, Applications and Uses of Ultrasound in Chemistry. Chichester: Ellis Horwood Limited, 1988.
MAZZETO, S. E.; LOMONACO, D.; MELE, G. Óleo da castanha de caju: oportunidades e desafios no contexto do desenvolvimento e sustentabilidade industrial. Química Nova, v. 32, p. 732-741, 2009.
MDIC. Ministério do Desenvolvimento, Indústria e Comércio Exterior. Disponível em: < http://aliceweb2.mdic.gov.br/>. Acesso em: 17 abr. 2014.
MEDEIROS, F. O.; ALVES, F. G.; LISBOA, C. R.; MARTINS, D. S.; BURKERT, C. A. V.;
KALIL, S. J. Ondas ultrassônicas e pérolas de vidro: um novo método de extração de β
-galactosidase para uso em laboratório. Química Nova, v. 31, p. 336-339, 2008.
MELO, E. A.; MACIEL, M. I. S.; LIMA, V. L. A. G.; NASCIMENTO, R. J. Capacidade antioxidante de frutas. Revista Brasileira de Ciências Farmacêuticas, v. 44, p. 193-201, 2008.
MELO, M. L. P.; MAIA, G. A.; SILVA, A. P. V.; OLIVEIRA, G. S. F.; FIGUEIREDO, R. W. Caracterização Físico-química da amêndoa de castanha de caju (Anacardium occidentale
21 MENDIOLA, J. A.; HERRERO, M.; CIFUENTES, A.; IBANEZ, E. Use of compressed fluids for sample preparation: Food applications. Journal of Chromatography A, v. 1152, p. 234-246, 2007.
MIRA, N. V. M.; BARROS, R. M. C.; SCHIOCCHET, M. A.; NOLDIN, J. A.; LANFER-MARQUEZ, U. M. Extração, análise e distribuição dos ácidos fenólicos em genótipos pigmentados e não pigmentados de arroz (Oryza sativa L.). Ciência e Tecnologia de
Alimentos, v. 28, p. 994-1002, 2008.
MONRAD, J. K.; HOWARD, L. R.; KING, J. W.; SRINIVAS, K.; MAUROMOUSTAKOS, A. Subcritical solvent extraction of procyanidins from dried red grape pomace. Journal of
Agricultural and Food Chemistry, v. 58, p. 4014–4021, 2010a.
MONRAD, J. K.; HOWARD, L. R.; KING, J. W.; SRINIVAS, K.; MAUROMOUSTAKOS, A. Subcritical solvent extraction of anthocyanins from dried red grape pomace. Journal of
Agricultural and Food Chemistry, v. 58, p. 2862-2868, 2010b.
MOTILVA, M. J.; SERRA, A.; MACIA, A. Analysis of food polyphenols by ultra high-performance liquid chromatography coupled to mass spectrometry: An overview. Journal of
Chromatography A, v. 1292, p. 66– 82, 2013.
NACZK, M.; SHAHIDI, F. Extraction and analysis of phenolics in food. Journal of
Chromatography A, v. 1054, p. 95-111, 2004.
NIJVELDT, R. J.; VAN NOOD E.; VAN HOORN, D. E. C; BOELENS P. G.; VAN NORREN, K.; VAN LEEUWEN, P. M. Flavonoids: a review of probable mechanisms of action and potential applications. American Journal of Clinical Nutrition, v. 74, p.418-25, 2001.
OANCEA, S.; GROSU, C.; KETNEY, O.; STOIA, M. Conventional and ultrasound-assisted extraction of anthocyanins from blackberry and sweet cherry cultivars. Acta Chimica
Slovenica, v. 60, p.383–389, 2013.
OLIVEIRA, D. M.; BASTOS, D. H. M. Biodisponibilidade de ácidos fenólicos. Química
Nova, v. 34, p.1051-1056, 2011.
OWIREDU, I.; LARYEA, D.; BARIMAH, J. Evaluation of cashew nut flour in the production of biscuit. Nutrition & Food Science, v. 44, p. 204-211, 2014.
PAIVA, F. F. A.; SILVA NETO, R. M.; PESSOA, P. F. A.; LEITE, L. A. S. Processamento
de castanha de caju. Brasília: Embrapa Informação Tecnológica, 2006.
PAIVA, F. GARRUTI, D. SILVA NETO, R. M. Aproveitamento Industrial do Caju. Fortaleza: Centro Nacional de Pesquisa de Agroindústria Tropical – EMBRAPA-CNPAT/ SEBRAE/CE, 2000 (Embrapa-CNPAT, Documento, 38).
PAIVA, J. R.; BARROS, L. M. Clones de cajueiro: Obtenção, características e
perspectivas. Fortaleza: Embrapa Agroindústria Tropical, 2004. (Embrapa Agroindústria
22 PALMA, M.; PINEIRO, Z. BARROSO, C. G. In-line pressurized-fluid extraction– solid-phase extraction for determining phenolic compounds in grapes. Jounal of Chromatography
A, v. 968, p. 1–6, 2002.
PARAMASHIVAPPA, R.; KUMAR, P. P.; VITHAYATHIL, P. J.; RAO, A. S. Novel
method for isolation of major phenolic constituents from cashew (Anacardium occidentale L.) nut shell liquid. Journal of Agricultural and Food Chemistry, v. 49, p. 2548-2551, 2001. PARASA, L. S.; TUMATI, S. R.; CYRIL ARUN KUMAR, L.; CHIGURUPATI, S. P.; RAO, G. S. In vitro antimicrobial activity of cashew (Anacardium occidentale L.) nuts shell liquid against methicillin resistant staphylococcus aureus (MRSA) clinical isolates. Internacional
Journal of Pharmacy and Pharmaceutical Sciences, v. 3, p. 436-440, 2011.
PATEL, R. N.; BANDYOPADHYAY, S.; GANESH, A. Economic appraisal of supercritical fuid extraction of refined cashew nut shell liquid. Journal of Chromatography A, v. 1124, p. 130-138, 2006.
PESSOA JUNIOR, A.; KILIKIAN, B. V. Purificação de Produtos Biotecnológicos. São Paulo: Manole, 2005.
PETRUCCI, R. H.; HERRING, F. G.; MADURA, J. D.;BISSONNETTE, C. General
Chemistry – Principles and Modern Applications, 5 ed. Toronto: Pearson Canada, 2010. PHENOL-EXPLORER. Database on polyphenol content in foods. Disponível em: < http://www.phenol-explorer.eu/>. Acesso em: 20 mar. 2014.
PICO, Y. Ultrasound-assisted extraction for food and environmental samples. Trends in
Analytical Chemistry, v. 43, p. 84-99, 2013.
RAMALHO, H. F.; SUAREZ, P. A. Z. A Química dos Óleos e Gorduras e seus Processos de Extração e Refino. Revista Virtual de Química, v. 5, p. 2-15, 2013.
RHODES, M. J. C. Physiologically-active compounds in plant food: an overview.
Proceedings of the Nutrition Society, v. 55, p. 371–384, 1996.
RODRIGUES, S.; FERNANDES, F. A. N. Ultrasound-assisted extraction. Stewart
Postharvest Review, v. 5, p. 1-11, 2009.
RODRIGUEZ-MEIZOSO, I.; MARIN, F.R.; HERRERO, M.; SENORANS, F. J.;
REGLERO, G.; CIFUENTES, A.; IBANEZ, E. Subcritical water extraction of nutraceuticals with antioxidant activity from oregano, chemical and functional characterization. Journal of
Pharmaceutical and Biomedical Analysis, v. 41, p. 1560–1565, 2006.
RODRÍGUEZ-SOLANA, R.; SALGADO, J. M.; DOMÍNGUEZ, J. M.; CORTÉS-DIÉGUEZ, S. Characterization of fennel extracts and quantification of estragole: Optimization and comparison of accelerated solvent extraction and soxhlet techniques.
Industrial Crops and Products, v. 52 p. 528– 536, 2014.
23 SANTOS, D. T.; VEGGI, P. C.; MEIRELES, M. A. A. Optimization and economic
evaluation of pressurized liquid extraction of phenolic compounds from jabuticaba skins.
Journal of Food Engineering, v. 108 p. 444–452, 2012.
SCHIEBER, A.; STINTZING, F. C.; CARLE, R. By-products of plant food processing as a source of functional compounds – recent developments. Trends in Food Science
&Technology, v. 12, p. 401-413, 2001.
SILVA JÚNIOR, A. C.; ANDRADE, J. C. S. Tecnologias mais limpas e desenvolvimento sustentável no Brasil: contribuição de projetos de MDL. Revista de Administração,
Contabilidade e Economia da FUNDACE, ed. 4, p. 1-16, 2011.
SILVA NETO, R. M.; LEITE, L. A. S.; PESSOA, P. F. A. P.; VERAS, L. G. C. Equipamento e processo para seleção da matéria-prima para as médias e pequenas fábricas de
processamento da castanha de caju. Acta Tecnológica, v. 5, p. 113-126, 2010.
SILVA, M. L. C; COSTA, R. S.; SANTANA, A. S.; KOBLITZ, M. G. B. Compostos fenólicos, carotenoides e atividade antioxidante em produtos vegetais. Semina, v. 31, p. 669-682, 2010.
SINGH, J.; DARTOIS, A.; KAUR, L. Starch digestibility in food matrix: a review. Trends in
Food Science & Technology, v.21, p.168-180, 2010.
SOUSA, M. S. B.; VIEIRA, L. M. SILVA, M. J. M. LIMA, A. Caracterização nutricional e compostos antioxidantes em resíduos de polpas de frutas tropicais. Ciência e
Agrotecnologia, v. 35, p. 554-559, 2011.
STASIUK, M.; KOZUBEK, A. Biological activity of phenolic lipids. Cellular and
Molecular Life Sciences, v. 67, p. 841-860, 2010.
SUO, M.; ISAO, H.; ISHIDA, Y.; SHIMANO, Y.; BI, C.; KATO, H.; TAKANO, F.; OHTA, T. Phenolic lipid ingredients from cashew nuts. Journal of Natural Medicines, v. 66, p. 133-139, 2012.
SUSLICK, K. S. Kirk-Othmer Encyclopedia of Chemical Technology. 4 ed. New York: J. Wiley & Sons:, 1998, v.. 26, p. 517-541. Disponível em:
<http://www.scs.illinois.edu/suslick/sonochemistry.html>. Acesso em: 1º abr. 2014. TAIZ, L.; ZEIGER, E. Plant physiology. 3 ed. Sunderland: Sinauer Associates, 2002.
TIAN, S.; NAKAMURA, K.; KAYAHARA, H. Analysis of phenolic compounds in white rice, brown rice and germinated brown rice. Journal of Agricultural and Food Chemistry, v. 52, p. 4808-4813, 2004.
TREVISAN, M. T. S.; PFUNDSTEIN, B.; HAUBNER, R.; WURTELE, G.;
SPIEGELHALDER, B.; BARTSCH; OWEN, R. W. Characterization of alkyl phenols in cashew (Anacardium occidentale) products and assay of their antioxidant capacity. Food and
24 TROX, J.; VADIVEL, V.; VETTER, W.; STUETZ, W.; KAMMERER, D. R.; CARLE, R.; SCHERBAUM, V.; GOLA, U.; NOHR, D.; BIELSALKI, H. K. Catechin and epicatechin in testa and their association with bioactive compounds in kernels of cashew nut (Anacardium
occidentale L.). Food Chemistry, v. 128, p. 1094-1099, 2011.
VOLP, A. C. P., RENHE, I. R. T., BARRA, K., STRINGUETA, P. C. Flavonoides antocianinas: características e propriedades na nutrição e saúde. Revista Brasileira de
Nutrição Clínica, v. 23, p. 141-149, 2008.
WALTER, M.; SILVA, L. P.; EMANUELLI, T. Amido resistente: características físico-químicas, propriedades fisiológicas e metodologias de quantificação. Ciência Rural, v. 35, p. 974-980, 2005.
WANG, L; WELLER, C. L. Recent advances in extraction of nutraceuticals from plants.
Trends in Food Science & Technology, v.17, p. 300–312, 2006.
WIJNGAARD, H.; BRUNTON, N. The optimization of extraction of antioxidants from apple pomace by pressurized liquids. Journal of Agricultural and Food Chemistry, v. 57, p. 10625–10631, 2009.
WU, Y.; HE, L.; ZHANG, L.; CHEN, J.; YI, Z.; ZHANG, J.; LIU, M.; PANG, X. Anacardic acid (6-Pentadecylsalicylic acid) inhibits tumor angiogenesis by targeting Scr/FAK/Rho GTPases signaling pathway. Journal of Pharmacology and Experimental Therapeutics, v. 339, p. 403-411, 2011.
YANG, J.; LIU, R.H.; HALIM L. Antioxidant and antiproliferative activities of common edible nut seeds. Food Science and Technology, v. 42, p.1-8. 2009.
YOLMEH, M.; NAJAFI, M. B. H.; FARHOOSH, R. Optimisation of ultrasound-assisted extraction of natural pigment from annatto seeds by response surface methodology (RSM).
Food Chemistry, v. 155, p. 319–324, 2014.
ZHANG, Q. A.; ZHANG, Z. Q.; YUE, X. F.; FAN, X. H.; LI, T.; CHEN, S. F. Response surface optimization of ultrasound-assisted oil extraction from autoclaved almond powder.
Food Chemistry, v. 116, p. 513–518, 2009.
ZHAO, L. C.; HE, Y.; DENG, X. YANG, G. L.; LI, W.; LIANG, J.; TANG, Q. L. Response surface modeling and optimization of accelerated solvent extraction of four lignans from
Fructus Schisandrae. Molecules, v. 17, p. 3618-3629, 2012.
ZHOU, G.; YAO, X.; TANG, Y. QIAN, D.; SU, S.; ZHANG, L.; JIN, C.; QIN, Y.; DUAN, J. A. An optimized ultrasound-assisted extraction and simultaneous quantification of 26
characteristic components with four structure types in functional foods from ginkgo seeds.
25
4. AVALIAÇÃO DO EFEITO DE PRESSÃO E TEMPERATURA NA EXTRAÇÃO DO LÍQUIDO DA CASCA DA CASTANHA DE CAJU
4.1 RESUMO
O líquido da casca da castanha de caju (LCC) é um subproduto agroindustrial que apresenta características específicas devido a sua rica composição em alquilfenóis. O presente estudo tem como objetivo avaliar o rendimento de extração e componentes fenólicos do líquido da casca da castanha de caju originário de mini-fábrica obtido por prensagem, em comparação com o LCC técnico e um controle obtido por extração com solvente. A prensagem foi realizada seguindo um delineamento experimental fatorial 32 completo, variando pressão e temperatura, com duas réplicas. O LCC foi analisado em cromatógrafo líquido acoplado a espectrômetro de massas. O LCC extraído por prensagem variou entre 26 a 34 g/100g de casca, com pressão e temperatura exercendo efeitos estatisticamente significativos positivos. Ocorreu uma predominância dos ácidos anacárdicos C15:3, C15:1 e C15:2 nas amostras obtidas por prensagem e com a utilização de solvente orgânico, apresentando uma concentração na faixa de 44 a 60% de ácidos anacárdicos totais (C15:3 + C15:1 + C15:2), valores compatíveis com o obtido por solvente. O LCC proveniente da casca de castanha de caju de mini-fábrica é uma importante fonte de compostos fenólicos, alquifenóis, que se mostra atrativo para o mercado de produtos naturais por preservar seu conteúdo em ácidos anacárdicos.
Palavras-chave: Ácido anacárdico, LCC, Prensagem, Rendimento.
4.2 INTRODUÇÃO
O caju é formado por um pedúnculo comestível, ou pseudofruto, que se forma junto à castanha, o verdadeiro fruto (FRUTICULTURA, 2010). A castanha de caju é um aquênio que apresenta casca coriácea lisa, mesocarpo alveolado, repleto de um líquido escuro, conhecido por líquido da casca da castanha do caju (LCC) ou cashew nut shell liquid (CNSL) como é conhecido internacionalmente (MAZZETO et al., 2009).
Em 2012, o Brasil produziu 80 mil toneladas de castanha de caju, ocupando a décima posição em produção mundial (FAOSTAT, 2014). O Ceará foi o Estado com a maior participação na produção nacional, 48% (CONAB, 2014). O LCC representa aproximadamente 25% do peso da castanha e é considerado um subproduto de agronegócio do caju (MAZZETO et al., 2009).
O LCC apresenta como principal característica a ocorrência de compostos fenólicos, constituídos pelos ácidos anacárdicos, derivados do ácido salicílico (SCHULTZ et al., 2006), pelos cardóis, derivados do resorcinol (AGOSTINI-COSTA, 2000), e por cardanóis (CESLA
26 materiais biologicamente ativos (CORREIA et al., 2006; ANDRADE et al., 2011; WU et al., 2011), surfactantes (YANG, et al., 2014), resinas (NARAYANAMURTI & GUPTA, 1963; KASEMSIRI et al., 2011; KANEHASHI et al., 2013; JAILLET et al., 2014), plastificante (ARAYAPRANEE & REMPEL, 2007; RODRIGUES, 2010; MENON et al., 2012), tintas e vernizes (KUMAR et al., 2002).
Na obtenção do LCC podem ser utilizados diferentes processos como extração com solvente ou fluido supercrítico, por prensagem e processo térmico-mecânico (PATEL et al., 2006; MAZZETO et al., 2009). Na produção de amêndoa de castanha de caju em larga escala industrial é empregado o processo térmico-mecânico, ou seja, o cozimento das castanhas in
natura é feito no próprio líquido da castanha de caju (LCC) aquecido à temperatura em torno
de 200 °C (PAIVA et al., 2006), tornando a casca mais frágil para favorecer o seu rompimento (ARAÚJO & FERRAZ, 2008), liberando os alquilfenóis presentes no mesocarpo dando origem ao LCC técnico que apresenta um elevado percentual de cardanol e presença de material polimérico (GEDAM & SAMPATHKUMARAN, 1986).
Já a pequena indústria (mini-fábrica) utiliza o vapor úmido de autoclave, ou de caldeira, na operação de cocção (PAIVA et al., 2006) que acarreta a necessidade de uma etapa para extração do LCC, este classificado como natural por conter uma grande quantidade de ácido anacárdico e não apresentar material polimérico em sua composição (GEDAM & SAMPATHKUMARAN, 1986).
Diante deste contexto, este trabalho teve como objetivo avaliar o rendimento de extração e componentes fenólicos do líquido da casca da castanha de caju originário de mini-fábrica obtido por prensagem, em comparação com o LCC técnico e um controle obtido por extração com solvente.
4.3MATERIAL & MÉTODOS
4.3.1 Matéria-prima
27
4.3.2 Obtenção do líquido da casca da castanha de caju (LCC)
A codificação das amostras e os processos empregados para obtenção do LCC estão dispostos da Tabela 6.
Tabela 6. Processos empregados para obtenção de LCC.
Amostra Especificação
P (1-9) LCC – obtido por prensagem
TEC LCC técnico
CTL LCC Controle - extraído com hexano
Os testes preliminares mostraram que a utilização de pressões superiores a 43 MPa e temperaturas acima de 100 ºC acarretavam entupimento do cilindro e dificuldade na remoção do êmbolo. Os limites máximos foram estabelecidos com os valores mencionados e os mínimos de acordo com a capacidade da prensa, necessidade de aquecer a amostra para facilitar a extração e aumento das faixas de pressão e temperatura.
A prensagem foi realizada em uma prensa hidráulica (Marconi MA/098/50A/l) com utilização de um cilindro oco de aço inox com base removível perfurada e com ranhuras onde se desloca um êmbolo que apresenta 18 cm2 de área no círculo da base (FIGURA 11).
Figura 11. Sistema utilizado para a extração do líquido da casca de castanha de caju. (A)
Êmbolo, (B) cilindro, (C) base, (D) malha de aço, e (E) sistema completo.
Fonte: Elaborada pelo autor.