CURSO DE PÓS-GRADUAÇÃO EM QUÍMICA
ESTUDO DA INIBIÇÃO DA CORROSÃO DO ZINCO POR ÍONS INORGÂNICOS ECOLOGICAMENTE AMIGÁVEIS: MOLIBDATO, TUNGSTATO, SILICATO E FOSFATO.
Regilany Paulo Colares
Orientador: Prof. Dr. Pedro de Lima Neto
ii
REGILANY PAULO COLARES
ESTUDO DA INIBIÇÃO DA CORROSÃO DO ZINCO POR ÍONS INORGÂNICOS ECOLOGICAMENTE AMIGÁVEIS: MOLIBDATO, TUNGSTATO, SILICATO E FOSFATO.
Tese apresentada à coordenação do Curso de Pós-Graduação em Química como requisito parcial para a obtenção do título de doutor, tendo como orientador o Prof. Dr. Pedro de Lima Neto.
FORTALEZA-CEARÁ
iii
CURSO DE PÓS-GRADUAÇÃO EM QUÍMICA
TESE DE DOUTORADO
ESTUDO DA INIBIÇÃO DA CORROSÃO DO ZINCO POR ÍONS INORGÂNICOS ECOLOGICAMENTE AMIGÁVEIS: MOLIBDATO, TUNGSTATO, SILICATO E FOSFATO.
Autora: Regilany Paulo Colares
Orientador: Prof. Dr. Pedro de Lima Neto
__________________________________ Prof. Dr. Pedro de Lima Neto
Universidade Federal do Ceará
__________________________________ Profa. Dra. Adriana Nunes Correia
Universidade Federal do Ceará
_______________________________ Prof. Dr. Walney Silva Araujo
Universidade Federal do Ceará
_______________________________ Profa. Dra. Eliane D’Elia
Universidade Federal do Rio de Janeiro
_______________________________ Prof. Dr. Auro Atsushi Tanaka
iv
Ao Pai Celestial.
À minha pequena Laís, aos meus pais Maria Nanci e Francisco Colares e ao meu amor Aluísio.
v Ao Pai Celestial, por tudo, tudo e tudo.
Aos meus pais, Francisco Lopes Colares e Maria Paulo Colares por todo amor e carinho incondicional.
Aos meus queridos irmãos: Regina, Maria, Francisco (nenê), e em especial a Ana por ter aceito a difícil e mais gostosa tarefa; cuidar da pequena Laís e por tantas noites ter abandonado o seu lar pra fazer-me companhia.
Às minhas tias Regina e Rita, minhas protetoras da infância.
A toda a minha família, por nunca terem deixado de acreditar em mim.
À minha mais nova amiga Rafaele, por ter enfrentado comigo tantos dias difíceis.
À minha amiga Ionete, pelas longas conversas ao telefone e por sempre dizer que ia dar certo, mesmo quando pensei em desistir.
Ao prof. Dr. Pedro de Lima Neto por ter me recebido em seu laboratório, pela amizade e contribuições durante todos estes anos de vida acadêmica, obrigada!
À professora Dra. Adriana Nunes Correia pelos exemplos de profissionalismo e competência; pela amizade e todo o apoio durante estes anos de trabalho.
Aos professores Rogério e Belmino pelaajuda e tempo gasto comigo durante o período de grande aprendizado em que lecionei na UFC.
Aos amigos do laboratório, Régis, Leandro “menino”, Nathalie, Sanderli, Célia, Wirley, Josenir, Gerson, Paulo e Cristiane que sempre estão prontos a auxiliar, conversar e tornar o dia mais feliz. Em especial ao Rafael, Gustavo e Roger por toda ajuda e atenção.
A todos os professores e funcionários do Departamento de Química que contribuíram para o meu crescimento acadêmico.
Ao programa de Pós Graduação em Química Inorgânica pela possibilidade de realizar este curso de doutorado.
Ao CNPq pela concessão da bolsa para desenvolvimento desta pesquisa.
vi
ESTUDO DA INIBIÇÃO DA CORROSÃO DO ZINCO POR ÍONS INORGÂNICOS ECOLOGICAMENTE AMIGÁVEIS: MOLIBDATO,
TUNGSTATO, SILICATO E FOSFATO.
Regilany Paulo Colares
Dezembro / 2009
Orientador: Prof. Dr. Pedro de Lima Neto
O cromato é amplamente utilizado como inibidor de corrosão. No entanto, é altamente tóxico e carcinogênico, o que tem levado pesquisadores a buscarem alternativas ecologicamente amigáveis a este inibidor. Dentre estes, molibdato, tungstato, silicato e fosfato surgem como potenciais candidatos por apresentarem propriedades inibidoras e serem atóxicos. Assim, este trabalho tem por objetivo desenvolver um estudo sistemático dos íonscomo inibidores da corrosão do Zn. Foram utilizadas soluções aquosas de NaCl 10-1 mol dm-3 com concentrações dos inibidores variando de 10-4 a 10-1 mol dm-3. A eficiência destes com relação à corrosão do Zn foi
vii
STUDY OF INHIBITION OF CORROSION ZINC BY INORGANIC IONS ENVIRONMENT-FRIENDLY: MOLYBDATE,
TUNGSTATE, SILICATE AND PHOSPHATE.
Regilany Paulo Colares
December / 2009
Advisor: Prof. Dr. Pedro de Lima Neto
viii
LISTA DE FIGURAS ... x
LISTA DE TABELAS ...xv
CAPÍTULO I ...01
1. INTRODUÇÃO ...01
I.1. REFERÊNCIAS BIBLIOGRÁFICAS ...06
CAPÍTULO II ...07
2. REVISÃO BIBLIOGRÁFICA ...07
2.1. CORROSÃO ...07
2.1.1. REAÇÕES NAS ÁREAS ANÓDICAS E CATÓDICAS ...09
2.1.2. DESCRIÇÃO DE UM PROCESSO DE CORROSÃO ...09
2.2. PROTEÇÃO CONTRA CORROSÃO ...11
2.3. INIBIDORES DE CORROSÃO ...12
2.3.1. AS PRINCIPAIS CLASSIFICAÇÕES DOS INIBIDORES DE CORROSÃO ...13
2.3.2. ALGUMAS CONSIDERAÇÕES SOBRE OS MECANISMOS DE INIBIÇÃO ...14
2.3.3. INIBIDORES DE CORROSÃO NA LINHA DO TEMPO ...16
2.3.4. INIBIDORES DE CORROSÃO E O MEIO AMBIENTE...17
2.4. MOLIBDATOS, TUNGSTATOS, SILICATOS E FOSFATOS COMO POTENCIAIS INIBIDORES DE CORROSÃO...19
2.5. REFERÊNCIAS BIBLIOGRÁFICAS ...32
CAPÍTULO III ...37
3. MATERIAIS E MÉTODOS...37
3.1. SOLUÇÕES ...37
3.2. ELETRODOS ...37
3.3. CÉLULA ELETROQUÍMICA ...38
3.4. MONITORAMENTO DO POTENCIAL A CIRCUITO ABERTO COM O TEMPO (ECA) ...38
3.5. POLARIZAÇÃO LINEAR POTENCIODINÂMICA (PLP) ...39
3.6. ESPECTROSCOPIA DE IMPEDÂNCIA ELETROQUÍMICA (EIE) ...39
3.7. MICROSCOPIA ELETRÔNICA DE VARREDURA (MEV)...39
ix
X (XPS) ...40
CAPÍTULO IV...41
4. RESULTADOS E DISCUSSÃO ...41
4.1. MONITORAMENTO DO POTENCIAL A CIRCUITO ABERTO COM O TEMPO (ECA) ...41
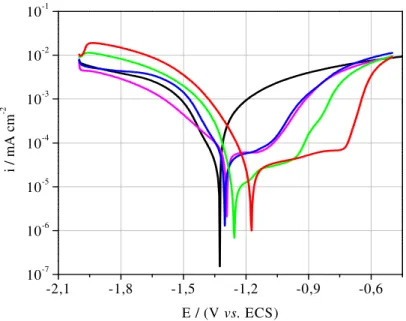
4.2. CURVAS DE POLARIZAÇÃO LINEAR POTENCIODINÂMICA (PLP) ...46
4.3. ESPECTROSCOPIA DE IMPEDÂNCIA ELETROQUÍMICA (EIS) ...51
4.4. MICROSCOPIA ELETRÔNICA DE VARREDURA (MEV) E ESPECTROSCOPIA DE ENERGIA DISPERSIVA DE RAIOS-X (EDX) ...73
4.5. DIFRAÇÃO DE RAIOS X (DRX) ...82
4.6. ESPECTROSCOPIA DE FOTOELÉTRONS EXCITADOS POR RAIOS-X (XPS) ...89
4.7. REFERENCIAS BIBLIOGRÁFICAS ...96
CAPÍTULO V ... 101
x
Figura I.1. Representação esquemática dos átomos metálicos individuais em um cristal metálico 4. ...02
Figura II.1. Corrosão de um metal divalente M em um eletrólito contendo oxigênio 7. ...10
Figura II.2. Esquema de curva voltamétrica do eletrodo de zinco em solução de molibdato de amônio em pH = 5,4 a 5 mV/s 51 ...25
Figura II.3. Modelos de solubilidade simplista para o cobre na presença de polifosfato e ortofosfato 60. ...30
Figura III.1.Célula Eletroquímica usada nos ensaios de corrosão...38
Figura IV.1. Variação do potencial com o tempo a circuito aberto do eletrodo de
zinco imerso nas respectivas soluções de Na2WO4, onde ( ) 10-4 mol·dm-3;
( ) 10-3 mol dm-3; ( ) 10-2 mol·dm-3 e ( ) 10-1 mol dm-3.... ...43
Figura IV.2. Variação do potencial com o tempo a circuito aberto do eletrodo de
zinco imerso nas respectivas soluções de Na2MoO4, onde ( ) 10-4 mol dm-3;
( ) 10-3 mol dm-3; ( ) 10-2 mol dm-3 e ( ) 10-1 mol dm-3... ...43
Figura IV.3. Variação do potencial com o tempo a circuito aberto do eletrodo de
zinco imerso nas respectivas soluções de Na2Si2O5, onde ( ) 10-4 mol dm-3;
( ) 10-3 mol dm-3; ( ) 10-2 mol dm-3 e ( ) 10-1 mol dm-3. ...44
Figura IV.4. Variação do potencial com o tempo a circuito aberto do eletrodo de
zinco imerso nas respectivas soluções de NaH2PO4, onde ( ) 10-4 mol dm-3;
xi
Na2WO4; ( )Na2Si2O5 e ( ) NaH2PO4, todos 10-1 mol dm-3. ...45
Figura IV.6. Curva de Polarização Potenciodinâmica do eletrodo de zinco imerso nas soluções de NaCl 10-1 mol dm-3, com diferentes concentrações de Na2WO4; onde ( ) 0; ( ) 10-4 mol dm-3; ( ) 10-3 mol dm-3; ( ) 10-2 mol dm-3 e
( ) 10-1 mol dm-3. ...48
Figura IV.7. Curva de Polarização Potenciodinâmica do eletrodo de zinco imerso nas soluções de NaCl 10-1 mol·dm-3, com diferentes concentrações de
Na2MoO4; onde ( ) 0; ( ) 10-4 mol dm-3; ( ) 10-3 mol dm-3; ( ) 10-2 mol dm-3 e
( ) 10-1 mol dm-3 ...49
Figura IV.8. Curva de Polarização Potenciodinâmica do eletrodo de zinco imerso nas soluções de NaCl 10-1 mol·dm-3, com diferentes concentrações de
Na2Si2O5; onde ( ) 0; ( ) 10-4 mol dm-3; ( ) 10-3 mol dm-3; ( ) 10-2 mol dm-3 e
( ) 10-1 mol dm-3. ...49
Figura IV.9. Curva de Polarização Potenciodinâmica do eletrodo de zinco imerso nas soluções de NaCl 10-1 mol·dm-3, contendo diferentes concentrações
de NaH2PO4, onde ( ) 0; ( ) 10-4 mol dm-3; ( ) 10-3 mol dm-3; ( )
10-2 mol dm-3 e ( ) 10-1 mol dm-3. ...50
Figura IV.10. Curva de Polarização Potenciodinâmica do eletrodo de zinco imerso nas soluções de NaCl 10-1 mol·dm-3 com diferentes inibidores, onde ( )
sem inibidor; ( )Na2WO4; ( ) Na2MoO4, ( )Na2Si2O5, ( ) NaH2PO4 todos 10-1
mol dm-3. ...59
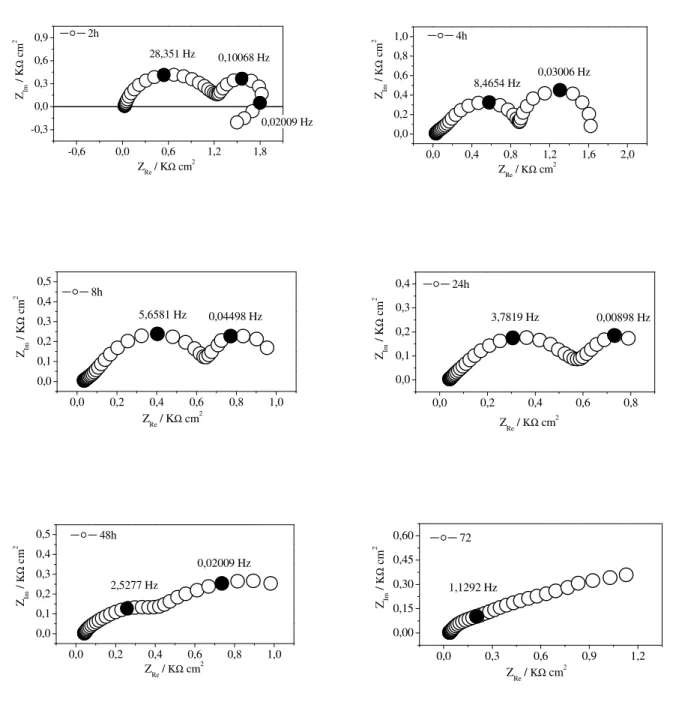
Figura IV.11. Diagramas de Nyquist para diferentes tempos de imersão do Zn em solução aquosa de NaCl 0,1 mol dm-3. ...54
xii
em solução de NaCl contendo Na2WO4 10 mol dm . ...56
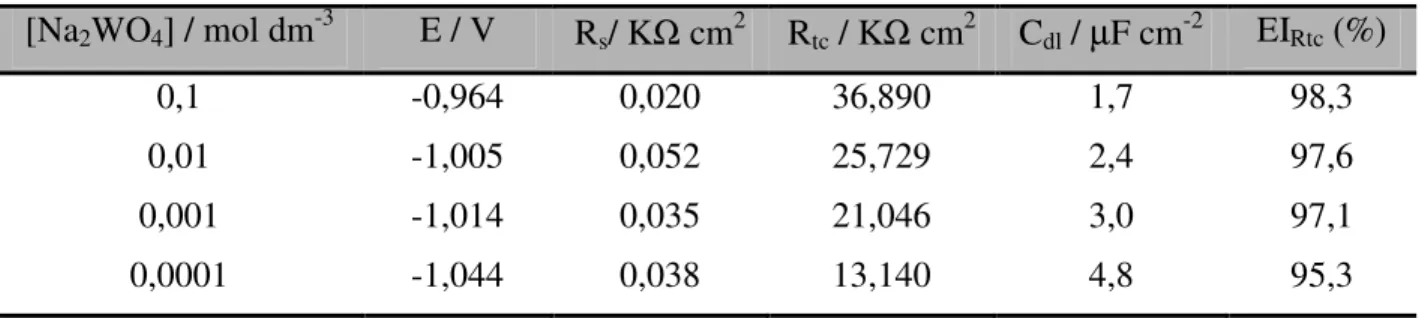
Figura IV.14. Diagramas de Nyquist para Zn imerso por 24 horas nas soluções de NaCl 0,1 mol·dm-3, com diferentes concentrações de WO42-; ( ) 10-4 mol dm -3; ( ) 10-3 mol dm-3; ( ) 10-2 mol dm-3 e ( ) 10-1 mol dm-3. ...57
Figura IV.15. Diagramas de Nyquist para diferentes tempos de imersão do Zn em solução de NaCl contendo Na2MoO4, ambos 10-1 mol dm-3...70
Figura IV.16. Diagramas de Nyquist para Zn imerso nas soluções de NaCl 0,1 mol·dm-3, com diferentes concentrações de Na2MoO4; ( ) 10-4 mol dm-3; ( )
10-3 mol dm-3; ( ) 10-2 mol dm-3 e ( ) 10-1 mol dm-3. ...62
Figura IV.17. Diagramas de Nyquist para diferentes tempos de imersão do Zn em solução de NaCl contendo Na2Si2O5 10-1 mol dm-3. ...65
Figura IV.18. Diagramas de Nyquist para Zn imerso nas soluções de NaCl 0,1 mol dm-3, com diferentes concentrações de Na2Si2O5; ( ) 10-4 mol dm-3; ( )
10-3 mol dm-3; ( ) 10-2 mol dm-3 e ( ) 10-1 mol dm-3. ...67
Figura IV.19. Diagrama esquemático da camada de silício adsorvida sobre a superfície dos produtos de corrosão 40. ...67
Figura IV.20. Diagramas de Nyquist para diferentes tempos de imersão do Zn em solução de NaCl contendo NaH2PO4 10-1 mol dm-3. ...70
Figura IV.21. Diagramas de Nyquist para Zn imerso nas soluções de NaCl 0,1 mol·dm-3, com diferentes concentrações de NaH2PO4; ( ) 10-4 mol dm-3; ( )
10-3 mol dm-3; ( ) 10-2 mol dm-3 e ( ) 10-1 mol dm-3. ...71
xiii
tempos de imersão ...75
Figura IV.24. Micrografias obtidas por MEV (a, b, c) e espectros de EDX (d, e, f) da superfície do Zn exposta em solução de NaCl e Na2WO4 0,1 mol dm-3
a diferentes tempos de imersão. ...78
Figura IV.25. Micrografias obtidas por MEV (a, b, c) e espectros de EDX (d, e, f) da superfície do Zn exposta em solução de NaCl e Na2MoO4, a
diferentes tempos de imersão. ...79
Figura IV.26. Micrografias obtidas por MEV (a, b, c) e espectros de EDX (e, f, g) da superfície do Zn exposta em solução de NaCl e Na2Si2O5
0,1 mol dm-3, a diferentes tempos de imersão. ...80
Figura IV.27. Micrografias obtidas por MEV (a, b, c) e espectros de EDX (d, e, f) da superfície do Zn exposta em solução de NaCl e NaH2PO4, a
diferentes tempos de imersão. ...81
Figura IV.28. Difratogramas do Zn imerso em solução de NaCl 0,1 mol dm-3..84
Figura IV.29. Difratogramas do Zn imerso em solução de NaCl contendo Na2WO4 10-1 mol dm-3. ...85
Figura IV.30. Difratogramas do Zn imerso em solução de NaCl contendo Na2MoO4 10-1 mol dm-3. ...86
Figura IV.31. Difratogramas do Zn imerso em solução de NaCl contendo Na2Si2O5 10-1 mol dm-3. ...87
Figura IV.32. Difratogramas do Zn imerso em solução de NaCl contendo NaH2PO4 10-1 mol dm-3. ...88
xiv
(b) Na2MoO4, ambos 0,1 mol dm-3. ...91
Figura IV.35. Espectros de XPS para ionizações (a) Si 2p e (b) P 2p. As amostras de Zn foram imersas em: (a) Na2Si2O5 e (b) NaH2PO4, ambos
xv
LISTA DE TABELAS
Tabela I.1. Custo da corrosão em alguns países. ... 1
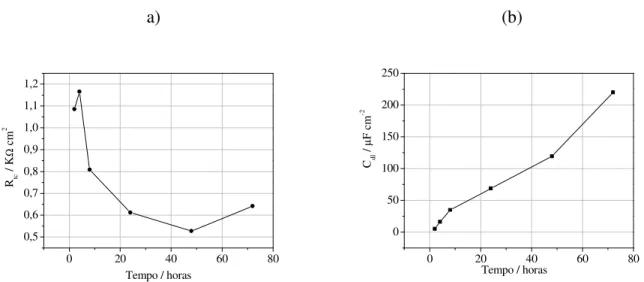
Tabela IV.1. Parâmetros eletroquímicos obtidos dos diagramas de Nyquist do Na2WO4.. ...58
Tabela IV.2. Parâmetros eletroquímicos obtidos dos diagramas de Nyquist do Na2MoO4.. ...64
Tabela IV.3. Parâmetros eletroquímicos obtidos dos diagramas de Nyquist do Na2Si2O5.. ...68
Tabela IV.4. Parâmetros eletroquímicos obtidos dos diagramas de Nyquist do NaH2PO4...71
Tabela IV.5. Energia de ligação (eV) dos elétrons 1s do oxigênio das amostras de Zn imersas nos diferentes meios estudados. ...93
Tabela IV.6. Energia de ligação (eV) dos elétrons 2p do Zn da amostra imersa em NaCl 0,1 mol dm-3.. ...93
Tabela IV.7. Energia de ligação (eV) dos elétrons 3d do molibdênio da amostra imersa em NaCl + Na2MoO4, ambos 0,1 mol dm-3.. ...94
Tabela IV.8. Energia de ligação (eV) dos elétrons 4f do tungstênio da amostra de Zn imersa em NaCl + Na2WO4, ambos 0,1 mol dm-3. ...94
xvi
CAPÍTULO I
1. INTRODUÇÃO
O avanço tecnológico ocorrido no último século veio acompanhado de uma maior utilização de peças e estruturas metálicas em todos os setores de nossa sociedade. Este fato torna o estudo da corrosão, particularmente no que diz respeito ao seu controle, fundamental para preservar a vida útil destes materiais, além de minimizar gastos oriundos dos processos corrosivos. Segundo estudo realizado nos Estados Unidos entre 1999 e 2001, estimou-se em US$ 276 bilhões (3,1% PIB americano) o custo total da corrosão por ano, sendo que deste valor, US$ 69 a 82 bilhões (1% PIB) poderiam ser economizados se todas as medidas viáveis de prevenção e controle de corrosão fossem postas em prática 1. No Brasil, a estimativa de gastos relativos a processos corrosivos situa-se na faixa de US$ 15 bilhões ao ano, podendo-se economizar cerca de US$ 5 bilhões mediante o uso de métodos de prevenção e controle 2.
Todo país tem um gasto muito elevado com os efeitos da corrosão; este custo é independente se o país é rico ou não, pois é proporcional ao seu produto nacional bruto, PNB. A Tabela I.1, apresenta o custo com a corrosão em alguns países em 1993, estimando-se 3,5 % do respectivo PNB 3.
Tabela I.1. Custo da corrosão em alguns países 3.
PAÍSES US$ BILHÕES EUA 220,50 Japão 147,00 Alemanha 61,25
Em um material metálico as imperfeições da superfície, ou as imperfeições resultantes da remoção de átomos da superfície metálica, ou ainda ligações dos átomos da superfície metálica com espécies presente no meio a que este material metálico está exposto, podem causar corrosão. Esta condição se deve à tendência dos átomos do material metálico ir para este meio, que se transmite de um átomo para o seu vizinho, ocasionando a corrosão do material metálico.
Os materiais reais diferem bastante dos metais ideais. A qualquer temperatura diferente do zero absoluto e a qualquer instante, os átomos que compõem os cristais metálicos apresentam estados de energia diferentes. O cristal metálico real apresenta várias imperfeições, como bordas (b) e cantos (c), que existem nos contornos dos planos dos retículos cristalinos incompletos. Os átomos destas regiões (bordas e/ou cantos) apresentam maior probabilidade de irem para a solução, proporcionando desta forma a corrosão do cristal metálico. Já os átomos do meio (m) do cristal metálico têm menor probabilidade de ir para a solução, assim, contribuem menos para a corrosão, do que os átomos das bordas e cantos, como mostra a Figura I.1 4.
A corrosão é um fenômeno que pode ser definido como a deterioração de materiais, pelas interações químicas e/ou eletroquímicas com o meio ambiente ou com o meio em que o material está em contato. Está presente no nosso dia-a-dia, é um fator muito preocupante e de grande importância do ponto de vista tecnológico, econômico e social 5.
A corrosão está presente na indústria de petróleo atacando a superfície metálica de tanques, tubulação, linhas de dutos e outros equipamentos. Problemas relacionados à corrosão surgem nessas linhas devido à agressão por parte dos líquidos que por eles passam. Estes líquidos, geralmente são: petróleo contendo água e gás sulfídrico, água de formação com alta salinidade ou água do mar 6. Além disso, o meio aquoso que passa nestas linhas de dutos contém alta concentração de cloreto e uma quantidade considerável de ânions sulfatados. A preocupação com este fenômeno e a importância de se conhecer mecanismos de minimizá-lo, aumenta muito quando se considera ambientes altamente corrosivos, como ambientes marítimo e industrial. Muitos esforços têm sido realizados para melhorar a resistência dos materiais frente à corrosão, e para determinar o tipo de material adequado para ser utilizado em um dado ambiente.
Dentre as várias técnicas de prevenção e controle da corrosão, destaca-se o emprego de inibidores de corrosão, utilizados em uma vasta gama de processos. Verifica-se o uso de inibidores na limpeza química de caldeiras, em vários setores da indústria petrolífera, sistemas de refrigeração, tubos de condensadores, salmoura de refrigeração , sistemas de geração de vapor, tubulações de água potável, tubulações de cobre para água quente, solventes clorados, polimento de metais, misturas anticongelantes, processos de decapagem ácida, minerodutos, proteção de cobre, proteção de alumínio e proteção temporária de peças ou equipamentos de aço carbono. Um setor que utiliza os inibidores de corrosão em grande escala é a indústria do petróleo, onde são fundamentais na preservação da integridade das peças metálicas envolvidas desde os processos de extração até os processos de refino 7.
aplicação. O principal e talvez único argumento apresentado para a substituição do cromato é seu caráter tóxico e poluente. Quando na forma hexavalente, o cromo agride a pele causando dermatites e se, manipulado em condições de higiene inadequadas pode atacar as vias respiratórias, podendo chegar inclusive à perfuração do septo nasal 3.
Muitos estudos no intuito de evitar o uso deste inibidor foram realizados. Nos primeiros estudos foram empregados oxiânios de metais com estruturas eletrônicas similares ao cromato como os molibdatos, permanganatos, vanadatos e tungstatos. Dentre estes compostos, o molibdato foi o mais investigado devido à sua natureza não tóxica e habilidade em reduzir a formação de pites em aços inoxidáveis 8. No entanto, a literatura mostra que até o momento nenhum processo de fácil execução encontra-se disponível de forma a substituir completamente o cromato no que diz respeito à resistência a corrosão e facilidade de aplicação.
compatíveis com o meio ambiente, evitando assim, os impactos e passivos ambientais. Daí a necessidade de criar tecnologias limpas direcionadas os inibidores de corrosão.
Neste contexto, o presente trabalho objetiva investigar de maneira sistemática as condições nas quais os íons MoO42-, WO42-, Si2O52-e H2PO4- poderão agir como inibidores
da corrosão do Zn e determinar a influência da concentração destes ânions na eficiência de inibição da corrosão, assim como caracterizar os possíveis filmes formados.
1.1. REFERÊNCIAS BIBLIOGRÁFICAS
[1] Corrosion costs and preventive strategies in the United States of America. In: http://www.NACE.org. Acessado em 05/07/2007 as 14:00 horas.
[2] COELHO, J. F. P. A nova ABRACO. In: http://www.abraco.org.br. Acessado em 05/07/2007 as 15:00 horas.
[3] GENTIL, V. Corrosão, 3ª edição, Livros Técnicos e Científicos, Rio de Janeiro. Editora S.A., 1996.
[4] GOMES, A.W.M. Tese (Doutorado em Ciências) – Departamento de Físico-Química, Universidade Estadual de Campinas, São Paulo, Brasil, 1999.
[5] MASTERTON, W. L.; SLOWINSKI, E. J. Princípios de Química, 6ª edição, Rio de Janeiro, Editora Guanabara, 1990.
[6] YANNICK, G., DEREK, P., BILL H. Journal of Eletroanalytical Chemistry, 000 (2002) 1.
[7] TELLES, P. C. S. Materiais para Equipamentos de Processos, 6a edição, Rio de Janeiro, Editora Interciência, 2003.
[8] MANSFELD, F.; WANG, Y. British Corrosion Journal,29 (1994) 194.
[9] KAUTEK, W.; SAHRE, M.; PAATSCH, W. Electrochimica Acta,39 (1994) 1151.
[10] GARRIGUES, L., PEBERE, N., DABOSI, F. Electrocimima acta,41 (1996) 1209.
[11] ARAMAKI, K. Corrosion Science,43 (2001) 591.
CAPÍTULO II
2. REVISÃO BIBLIOGRÁFICA
2.1. CORROSÃO
Todos os metais e ligas estão sujeitos à corrosão. Não há nenhum material que possa ser empregado em todas as aplicações. O ouro, por exemplo, conhecido por sua excelente resistência à ação da atmosfera, será corroído se exposto ao mercúrio, em temperatura ambiente. Por outro lado, o ferro não é corroído por mercúrio, mas enferruja rapidamente em presença do ar atmosférico. A maioria dos componentes metálicos deteriora-se com o uso, se em exposição a ambientes oxidantes ou corrosivos 1.
Segundo Mainier 2, sem que se perceba ao longo da formação, o processo corrosivo acaba fazendo parte direta ou indiretamente do cotidiano diversificado: seja dos profissionais de obras ou construções civis, públicas ou privadas, nos reparos de prédios, pontes e viadutos; seja dos empresários na incidência corrente de "ferrugem" em embalagens industriais; seja dos engenheiros ou cientistas químicos nos socorros técnicos de emergência aos riscos de contaminações de produtos alimentícios, explosões de caldeiras, rompimentos de adutora de água, derramamento de petróleo provocado por furos em oleodutos ou tanques de armazenamento, etc.; todos eles passíveis de conseqüências trágicas, senão fatais, à população; seja do homem comum, nos inusitados colapsos em eletrodomésticos de uso mais difundido, como geladeiras, fogões e máquinas em geral.
e perdas de vidas humanas, provocadas por contaminações, poluição e falta de segurança dos equipamentos.
Às vezes, o valor de um novo material, que substituirá o antigo, é vinte a cinqüenta vezes mais caro, fato que acaba determinando a opção pelo uso de aditivo químico no retardamento ou na inibição do processo corrosivo, na avaliação de custos. Tal saída resulta, muitas vezes, mais desastrosa, tendo em vista que estes produtos, pela toxidez, acabam acarretando, com seu despejo ou vazamento, uma agressão muito maior ao meio ambiente.
Sobre os vazamentos de tanques de armazenamento de combustíveis e de produtos químicos, a Environmental Protection Agency - EPA, um órgão de controle ambiental americano, estima que existem cerca de 3 a 5 milhões de tanques enterrados no mundo, armazenando derivados de petróleo, solventes e outros produtos perigosos, dos quais alguns milhares apresentam graves riscos, com desperdícios de custos incalculáveis, sem contar as contaminações do solo, do lençol freático e dos aqüíferos em grandes proporções 3.
2.1.1. REAÇÕES NAS ÁREAS ANÓDICAS E CATÓDICAS
As possíveis reações nas áreas anódicas e catódicas de um material metálico M, são:
Área anódica – onde ocorre a oxidação do material (corrosão).
M → Mn+ + ne- (II.1)
Área catódica – em meio não-aerado, ocorre à redução dos íons H+ em meio ácido e a produção
de H26, segundo a reação representada pela equação,
nH+ + ne- → n/2 H2 (II.2)
em meio ácido oxigenado, a equação que representa a reação é,
n/4 O2 + nH+ + ne- → n/2 H2O (II.3)
2.1.2. DESCRIÇÃO DE UM PROCESSO DE CORROSÃO
As principais características da corrosão de um metal divalente M em uma solução aquosa contendo oxigênio são apresentadas esquematicamente na Figura II.1.
catódica no exemplo é a redução do oxigênio. O processo forma um circuito elétrico sem qualquer acumulação de cargas. Os elétrons liberados pela reação anódica são conduzidos através do metal para a área catódica, onde são consumidos na reação catódica. Uma condição necessária para tal processo de corrosão é que o ambiente seja um líquido condutor (eletrólito), e que esteja em contato com o metal. O circuito elétrico é fechado por condução de íons através do eletrólito.
Figura II.1. Corrosão de um metal divalente M em um eletrólito contendo oxigênio 7.
De acordo com as condições deste processo de dissolução, ele é chamado corrosão aquosa, e o mecanismo é eletroquímico. No exemplo da Figura II.1 os íons metálicos M2+ são conduzidos no sentido de íons OH-, e juntos, formam hidróxido do metal que pode ser depositado na superfície do metal. Se por exemplo, o metal é o zinco e o líquido é água contendo O2
dissolvido, mas não o CO2, o padrão da Figura 2.1 é seguido: íons Zn2+ juntam-se com íons OH- e
formam Zn(OH)2. Quando o CO2 esta dissolvido no líquido o carbonato de zinco é depositado.
Corrosão de substâncias como ferro e cobre seguem padrões semelhantes, com modificações: óxido de ferro divalente, Fe(OH)2, que é instável, portanto, com acesso de água e oxigênio ele
passa a óxido trivalente de ferro hidratado, Fe2O3 . nH2O, ou a hidróxido de ferro, Fe(OH)3, que
também pode ser expressa como FeOOH + H2O. FeOOH, o qual é vermelho (ou marrom),
popularmente conhecido como ferrugem. Se o acesso de oxigênio é fortemente limitado, Fe3O4 é
formado em vez do produto de corrosão trivalente. Fe3O4 é preto (sem água) ou verde (com
água). Hidróxido divalente de cobre, Cu(OH)2, não é estável nem tende a ser desidratado para
A redução de oxigênio é a reação catódica dominante em ambientes naturais como água salgada, água doce, o solo e a atmosfera. No entanto, sob certas condições também existem outras importantes reações catódica: a reação do hidrogênio 2H+ + 2e- → H2, redução do ácido
carbônico, redução dos íons metálicos, entre outras.
2.2. PROTEÇÃO CONTRA CORROSÃO
A fim de reduzir seus efeitos e, principalmente, seus custos foram desenvolvidas, ao longo do tempo, diversas tecnologias de controle para o problema da corrosão, tais como: o uso de pinturas e revestimentos diversos (uma das primeiras técnicas empregadas, a qual permanece, até os dias de hoje, a mais utilizada), proteção eletrolítica, materiais não metálicos, proteção catódica, inibidores de corrosão, objeto desta pesquisa. Cada tipo de corrosão tem um método adequado para combatê-la 8, cujos principais são:
Revestimento metálico – este tipo de revestimento pode ser aplicado por imersão do material em metal fundido, eletrodeposição, metalização.
Revestimentos inorgânicos – alguns metais ao sofrerem corrosão têm em seu produto de corrosão uma forma de proteção. O produto inicial da corrosão corresponde a uma camada aderente, que pode ser porosa ou não. Os processos de anodização e fosfatização são exemplos de proteção com formação de produto de corrosão protetor.
Revestimentos não metálicos – este processo de combate à corrosão se baseia na aplicação de revestimentos maus condutores de corrente elétrica, em toda a superfície do material metálico a ser protegido 11. A qualidade desta proteção depende da natureza do revestimento, da aderência e da porosidade da camada protetora. Tintas e vernizes são exemplos deste tipo de proteção.
Inibidores de corrosão – são substâncias que adicionadas ao meio corrosivo objetivam evitar, prevenir ou impedir o desenvolvimento das reações de corrosão, sejam nas fases gasosas, aquosas ou oleosas. A eficiência de proteção oferecida pelos inibidores depende dos metais e ligas bem como da severidade do meio 2.
2.3. INIBIDORES DE CORROSÃO
Na extração do petróleo e em processos industriais, inibidores sempre foram considerados como sendo a primeira linha de defesa contra a corrosão. Um grande número de estudos tem se dedicado ao tema dos inibidores de corrosão 12, 13, 14.. No entanto, a maior parte do que é conhecido é devido a ensaios e erros experimentais, tanto no laboratório como no campo. Regras, equações e teorias para orientar o desenvolvimento e/ou utilização de inibidores são muito limitadas.
2.3.1. AS PRINCIPAIS CLASSIFICAÇÕES DOS INIBIDORES DE CORROSÃO
Não existe uma classificação que se possa considerar “universal” para os inibidores de corrosão, pois é difícil pela diversidade e amplitude do seu uso nos diferentes segmentos industriais. Alguns autores 1, 16 preferem classificar os inibidores em anódicos, catódicos, mistos
ou de adsorção.
Inibidores anódicos 1 - têm sua eficiência baseada na polarização das regiões anódicas do metal, devido à formação de um filme aderente, contínuo, insolúvel e de alta resistividade elétrica sobre a superfície metálica, que eleva o potencial do metal para valores mais nobres. São divididos em duas classes: os agentes oxidantes que promovem a passivação do metal, como, por exemplo, os cromatos, nitratos, molibdatos e sais férricos, e os formadores de camada, que precipitam uma camada insolúvel sobre a região anódica, como por exemplo, os hidróxidos, fosfatos, silicatos e benzoatos. A utilização dos inibidores anódicos deve ser feita com cautela, pois sua concentração na solução não pode ser inferior a concentração crítica (concentração mínima necessária para ocorrer inibição), o que levaria à formação de um filme não contínuo sobre o substrato metálico. A formação deste filme descontínuo acarretaria em uma elevada corrente nas regiões anódicas não protegidas, acelerando a corrosão nestes pontos.
Inibidores mistos 1- são formados por misturas de inibidores anódicos e catódicos, acarretando um efeito sinérgico com a formação de filme protetor tanto nas regiões catódicas quanto anódicas da superfície metálica.
Inibidores de adsorção 1 - ocorre a formação de um filme protetor sobre as regiões catódicas e anódicas da superfície metálica devido ao processo de adsorção entre o inibidor e o metal. Por tratar-se de um processo de adsorção, fatores como a concentração do inibidor, a temperatura, a velocidade e composição do fluido do sistema, a natureza da superfície metálica e o tempo de contato entre o inibidor e o metal, são fatores que determinam a eficiência do inibidor, que está diretamente ligada a sua capacidade de formar e manter um filme estável sobre a superfície metálica. Os inibidores de adsorção são compostos orgânicos possuidores de insaturações e/ou grupamentos fortemente polares contendo nitrogênio, oxigênio ou enxofre, cuja estrutura geralmente possui partes hidrofóbicas e hidrofílicas ionizáveis. Estes devem ser solúveis ou facilmente dispersáveis no meio que envolve o metal. Como exemplos tém-se as aminas, aldeídos, mercaptanas, compostos heterocíclicos nitrogenados, compostos contendo enxofre e compostos acetilênicos.
2.3.2. ALGUMAS CONSIDERAÇÕES SOBRE OS MECANISMOS DE INIBIÇÃO
Diversos autores propuseram-se a estudar os possíveis mecanismos de inibição responsáveis pela proteção dos metais expostos ao meio corrosivo.
Já LORENZ e MANSFELD 19 demonstraram uma perfeita diferença entre estes dois tipos de inibição: a de interfase e a de interface. Entende-se por inibição interfacial, quando ocorre a formação de uma camada bidimensional, como sendo uma forte interação entre o substrato metálico e o inibidor. Ela ocorre em sistemas onde um metal de superfície limpa é colocado em um meio agressivo, tal como uma solução ácida. Já a existência de uma camada tridimensional entre o substrato e o meio é representada por inibições de interfase. Os inibidores classificados nesta categoria “tridimensional” são identicamente divididos em “passivantes” e de “precipitação”. Os cromatos e nitritos podem ser tomados como exemplos de inibidores que promovem a formação de camada passivadora na superfície metálica. Compostos orgânicos e inorgânicos de fósforos são provavelmente os mais amplamente utilizados nesta categoria. A composição destas camadas tridimensionais deve ser constituída de compostos fracamente solúveis à base de produtos de corrosão, intermediários e inibidores. Independentemente do tipo de mecanismo, sabe-se que a eficiência dos inibidores de corrosão depende basicamente de aspectos mecânicos, estruturais e químicos das camadas que são formadas sobre a superfície dos metais.
Em soluções aquosas próximas da neutralidade, as superfícies metálicas são comumente cobertas por óxidos, hidróxidos e sais. O inibidor tende a estabilizar a situação, formando uma camada protetora. O efeito primário observado é a adsorção seguida de precipitação, fechando os poros e, por fim, o crescimento do filme.
Como já se tem conhecimento, em química, a maior parte das reações podem ser tratada como sendo interações ácido/base. Por sua vez, sendo o inibidor de corrosão uma substância química, esta abordagem é também válida. Assim, diversos autores estudaram e aplicaram o conceito chamado HSAB (Hard soft acids and basic). PEARSON 20 foi o primeiro autor a desenvolver este conceito, que afirma que ácidos fortes, ou seja, de alta polarizabilidade, reagem preferencialmente com bases fortes e por sua vez, ácidos fracos reagem com bases fracas.
2.3.3. INIBIDORES DE CORROSÃO NA LINHA DO TEMPO
Existem registros que documentam, no início do século XX, o uso de misturas de melaços, amidos e óleos vegetais na proteção de peças de aço carbono após a decapagem ácida 22.
Ainda, na década de 20, ocorreram acidificações em alguns poços de petróleo nos campos de Oklahoma (1928) e Kentucky (1929) visando aumentar sua produtividade devido às incrustações calcárias. Entretanto, só a partir de 1932 com a introdução de inibidores de corrosão mais eficientes é que se tornaram mais viáveis as acidificações com ácido clorídrico. Sucessos e insucessos marcaram esta nova prática de estimular a produção de petróleo, principalmente, em função dos vários tipos de rochas, das características físico-químicas dos inibidores de corrosão, dos diversos aditivos utilizados e da própria operação em si. Na década de 30, foram utilizadas na decapagem de aço-carbono várias substâncias orgânicas tais como: piridinas, toluidinas, fenil-hidrazina, dimetilamina, dibutilamina, quinoleinas, etc. Ainda nesta década foi recomendada pela American Society of Refrigeration of Engineers a utilização de cromato de sódio juntamente com hidróxido de sódio visando a proteção de aço-carbono imerso em salmouras de cloreto de sódio ou de cloreto de cálcio. Tanto os produtos orgânicos citados anteriormente, quanto o cromato de sódio são substâncias de alto poder tóxico 2.
Na década de 40, o cromato de sódio se destaca e se consagra na proteção anticorrosiva dos sistemas de água de refrigeração, principalmente, nas águas com alta salinidade 23. Também sais e óxido de arsênio foram usados com excelentes resultados na decapagem de aço-carbono. Entretanto, é sabido que desde o século XVIII o arsênio e seus compostos são considerados venenos fortíssimos.
O banimento de compostos de arsênio utilizados nos sistemas de acidificação, devido ao seu potencial tóxico, ocorreu a partir da década de 70. Quanto ao cromato, tem havido uma redução do uso devido ao seu alto potencial tóxico, conseqüentemente novas rotas já indicam o uso de molibdatos e outros produtos. As grandes empresas praticamente têm desativado o uso de cromato nos sistemas de refrigeração, entretanto o mesmo não tem acontecido nas pequenas e médias torres de refrigeração de supermercados, lojas de departamentos e hotéis. Estima-se que 90 % destas instalações, localizadas na região do Rio de Janeiro e de São Paulo, ainda utilizam cromato na ordem de 600 a 1000 ppm 3.
Percebe-se claramente nestas rotas tecnológicas apresentadas que os produtos utilizados no início do século como inibidores de corrosão eram inócuos. Entretanto, a necessidade de maior eficiência de proteção anticorrosiva levou à síntese de produtos mais complexos e conseqüentemente mais tóxicos.
2.3.4. INIBIDORES DE CORROSÃO E O MEIO AMBIENTE
Atualmente, a maioria dos programas de avaliação de impactos ambientisl está associada ou interligada aos vários programas de gestão e vigilância ambiental.
O Programa de Vigilância Ambiental Global do Programa das Nações Unidas para o Meio Ambiente - PNUMA procura romper um abismo existente de incertezas científicas que levam ao alarmismo inconsciente ou ao descrédito das informações relativas aos sistemas ambientais. Este programa, destituído de objetivos político-econômicos, objetiva apresentar as informações das mudanças ambientais a governos, cientistas, indústrias, enfim, a todos que necessitem informações sobre o tema. É monitorado pelo Sistema de Monitoramento Ambiental Global (GEMS) do qual participam 142 países; pelo Sistema Mundial de Informação Ambiental (INFOTERRA) e pelo Registro Internacional de Substâncias Potencialmente Químicas (IRPTC) 2.
entendimento das rotas industriais, as qualificações e a quantificações dos possíveis contaminantes e resíduos gerados durante o processo industrial. E, finalmente, como meta-objetivo, buscar sempre rotas industriais que possam prever o passivo ambiental e convergir para as tecnologias limpas.
Segundo Costa 24, o passivo ambiental, corresponde ao investimento que uma empresa deve fazer para corrigir os impactos ambientais gerados e não controlados ao longo dos anos de operação. Antigamente, era apenas um detalhe nas negociações de fusões ou de incorporações empresariais. Agora, dependendo do valor e do tipo de passivo ambiental a incorporação empresarial poderá não ocorrer. O valor de uma descontaminação ambiental poderá ser tão alto que inviabiliza o processo de incorporação empresarial.
A empresa Rhodia (São Paulo) é um dos exemplos desse problema, que até hoje paga pela herança ambiental adquirida na compra da Clorogil, empresa fabricante de produtos conservantes para madeiras. Em 1994, foi condenada pela Justiça a descontaminar quatro áreas em São Vicente (São Paulo), anteriormente contaminadas pelos resíduos gerados e dispostos pela Clorogil. Nestas áreas constatou-se o alto índice de produtos cancerígenos e capazes de gerar mutações genéticas 2.
Outro exemplo que merece reflexão, segundo a Gazeta Mercantil 25, é o caso da Indústria Matarazzo, em São Caetano do Sul (São Paulo), que produzia o agrotóxico BHC. Ao falir deixou um terreno com um passivo ambiental da ordem de 20 milhões de dólares. Vários grupos internacionais já se interessaram pelo terreno para construção de “shoppings”, entretanto desistiram ao saber do valor do passivo ambiental.
Convém lembrar que essas contaminações do solo aconteceram em décadas passadas, atualmente, esse passivo ambiental estaria enquadrado na Lei n° 9605/98 com infrações ambientais, podendo responsabilizar criminalmente a empresa e os seus executivos.
Atualmente, tem-se voltado para o estabelecimento de uma política que promova a desativação de formulações inibidoras tóxicas, principalmente, aquelas que afetem, pelo contato ou pela inalação, a saúde do trabalhador ou as que causem sérios danos ambientais.
No presente trabalho analisou-se a eficiência de molibdato, tungstato, silicato e fosfato, como potenciais inibidores da corrosão do zinco em presença de cloreto. Na próxima seção serão apresentados trabalhos encontrados na literatura sobre a utilização destes compostos como inibidores de corrosão.
2.4. MOLIBDATOS, TUNGSTATOS, SILICATOS E FOSFATOS COMO POTENCIAIS INIBIDORES DE CORROSÃO
A presença de sais e principalmente de cloretos nas águas naturais são responsáveis pela aceleração da corrosão dos aços galvanizados, isto é, aumentam a condutividade da água e influenciam nas características da camada de óxidos e/ou hidróxidos, tornando-a mais agressiva. Assim, o uso de aços galvanizados em meio aquoso deve estar atrelado a algum tipo de proteção contra corrosão. Como foi visto nas seções anteriores, dentre outras formas de proteção, o controle da corrosão pode ser feito com o uso de inibidores de corrosão, proteção catódica, revestimentos metálicos, etc., onde objetivam aumentar a vida útil dos equipamentos 26.
Nos primeiros estudos foram empregados oxiânios de metais com estruturas eletrônicas similares ao cromato como os molibdatos, permanganatos, vanadatos e tungstatos. Dentre estes, os molibdatos foram os compostos mais investigados devido à sua natureza não tóxica e sua habilidade em reduzir a corrosão por pites em aços inoxidáveis e também para alumínio e suas ligas 28, 29, 30, 31.
A literatura mostra que tanto Na2MoO4 como o Na2WO4 agem como inibidores anódicos
de corrosão para o aço carbono em meio neutro e que o mecanismo de inibição do Na2MoO4 e o
Na2WO4 é através da adsorção competitiva com íon Cl- 32, 33.
Em 1986, foi verificado que o MoO42- forma um filme protetor de ferro/molibdato nos
sítios anódicos, passivando o metal, e assim reduzindo a densidade de corrente de passivação e de transpassivação 34,35 .
De acordo com Gentil 1, os molibdatos produzem filmes protetores bastante semelhantes ao do cromato. Sua vantagem em relação ao cromato é por ser um produto não poluente e trabalhar melhor em meio fortemente aerado, mas apresenta como desvantagem o custo mais elevado. O cromato proporciona a formação de um filme passivo sobre a superfície metálica com alto poder de proteção. Já o molibdato tem um efeito muito importante na inibição dos processos de ataque e propagação de pites, pois migra para dentro dos mesmos e precipita. Esta capacidade de migrar para uma região anódica e lá se precipitar seletivamente, o torna um inibidor eficaz na corrosão por pite.
ALEXANDER E MOCCARI 37 usaram técnicas eletroquímicas para estudar o efeito do molibdato puro, molibdato com tolitriazol, molibdato com nitrito em aço carbono exposto à água estagnada deionizada, à temperatura ambiente. Em alguns testes foi acrescentado 1,5 ppm de cloreto e 1,5 ppm de sulfato. Todos os testes feitos foram comparados com o cromato a 200 ppm. As curvas de polarização mostraram que a 200 ppm o molibdato se mostrou tão eficiente quanto o cromato.
FERNANDES 38 comparou o efeito de proteção do molibdato (200 ppm) em relação ao cromato (200 ppm), em meio aerado contendo 30 ppm de cloreto. Foi verificado que, para as condições do meio estudado, o molibdato apresentou um desempenho semelhante ao cromato, tornando-o uma boa alternativa para a substituição do cromato em água de refrigeração. Observou-se ainda que o molibdato foi mais eficiente que o cromato a potenciais mais elevados, o que seria explicado pela formação de molibdato e óxidos de molibdênio, que inibem a propagação dos pites, resultando assim num crescimento mais lento da corrente de polarização.
Estudos sobre a utilização de molibdatos como inibidor para alumínio e suas ligas podem ser facilmente encontrados na literatura. Pode-se citar entre estes, os autores: MANSFELD 31, BRESLIN 39; BADAWY e AL KHARAFI 40, 41.
MANSFELD em seu trabalho estudou métodos de proteção contra a corrosão por pite em ligas de alumínio com alto teor de cobre, procurando alternativas ao cromato que é altamente tóxico. O processo estudado envolveu a imersão das ligas em solução fervente de Ce(NO3)3,
polarização anódica em solução Na2MoO4 e imersão em solução fervente de CeCl3. Para a liga
2024-T3 (Al-4,4Cu-0,6Mn-1,5Mg) foram observadas melhoras significativas na resistência à corrosão localizada.
à corrosão do alumínio e de muitas ligas de alumínio; entretanto, o mecanismo pelo qual se dá a passivação ainda é pouco conhecido.
BADAWY e AL KHARAFI estudaram o comportamento eletroquímico do Al, liga Al6061 e liga Al-Cu em soluções isentas de cloreto com diferentes pHs. Tanto o molibdato como o dicromato apresentou ação inibidora contra a corrosão. A exposição de diferentes eletrodos em soluções a pH 2 contendo MoO42-, Cr2O72- e SO42-, à mesma concentração, mostraram que o Cr e
o Mo são incorporados na matriz do filme passivo do alumínio e suas ligas, enquanto que o enxofre não é incorporado. O anion dicromato mostrou-se mais efetivo na inibição do processo corrosivo e de acordo com os autores, isso se deve ao seu menor tamanho comparativamente à espécie polimérica de molibdato (Mo6O216-), o que permite uma melhor acomodação nas regiões
falhas da camada passiva, além de ser um agente oxidante mais efetivo levando à formação de uma camada passiva estável.
BIJIMI et al. 42 realizaram estudos sobre o tratamento anódico do zinco em soluções contendo os íons Cr2O72-, MoO42- e WO42-. A influência das variáveis de pH, temperatura,
aeração e concentração dos ânions em solução foram analisadas, utilizando-se como ferramenta as curvas de polarização anódica do substrato na solução em estudo. As principais conclusões do estudo foram as seguintes: o tratamento de passivação é mais efetivo para a faixa de pH entre 9 e 10,5, concentração de solução entre 0,1 M e 1,0 M para soluções de cromato de sódio, molibdato, ou tungstato; a aeração ou deaeração da solução não tem efeito significativo sobre a formação do filme passivo.
SAREMI e et al.44, observaram o efeito da concentração e da hidrodinâmica na eficiência de inibição do molibdato, utilizando as técnicas de polarização potenciodinâmica e espectroscopia de impedância eletroquímica. Os resultados mostraram que o molibdato inibiu a corrosão do aço na água de refrigeração simulada. A eficiência da inibição do molibdato foi aumentada com aumento de sua concentração e da velocidade de circulação da água. Estes dois fatores parecem promover a adsorção de molibdato e íons oxigênio na superfície do metal, conduzindo à formação de uma camada protetora com uma maior resistência à transferência de carga e uma permeabilidade mais baixa.
WILCOX e GABE 45 avaliaram a passivação do zinco em soluções de cromato, molibdato e tungstato utilizando-se o tratamento catódico, mantendo-se o sistema aerado, a concentração da solução fixa em 0,1 e 1 mo dm-3 e pH 5, 7, 9, 11. As análises são baseadas na inflexão das curvas de polarização catódica e no resultado de ensaio de corrosão em câmara de névoa salina. Com relação ao ensaio de corrosão, os resultados obtidos indicam que as camadas de cromato apresentam as melhores propriedades de resistência à corrosão.
Os resultados encontrados por AZAMBUJA et al. 46 para aços inoxidáveis, em meio de cloreto e com a presença de Na2WO4 apresentaram altos valores de capacitância levando os
autores a concluir que, na presença de Cl-, o filme formado sobre o aço é defeituoso e poroso. Também foi concluído que a ação inibidora do tungstato está relacionada com a sua adsorção na superfície do metal e é dependente da presença de oxigênio no meio, embora o filme formado sobre a superfície metálica com o íon tungstato possa ser refeito e assim, aumentar a sua estabilidade.
BONORA et al. 47 realizaram estudo com a mistura de Na2MoO4, Na2WO4 e NaVO3
superfície do metal, formada por sais e complexos insolúveis. Segundo os autores, o melhor desempenho do MoO42- é devido à redução do Mo4+ a Mo2+.
BRESLIN estudou o comportamento eletroquímico do alumínio em soluções de cloreto contendo anions cromato e molibdato, objetivando um maior esclarecimento sobre o mecanismo de passivação exercido por estes anions. Estes elementos quando ligados ao alumínio ou presentes na forma de sais de cromato e sais de molibdato em soluções melhoram a resistência à corrosão do alumínio e de muitas ligas de alumínio; entretanto, o mecanismo pelo qual se dá a passivação ainda é pouco conhecido 48.
ALMEIDA 49, 50 avaliou o uso de molibdatos para passivação de aço galvanizado. O estudo envolveu a avaliação de morfologia e composição da camada, e também a resistência à corrosão por ensaios de névoa salina e impedância eletroquímica. Os resultados obtidos demonstram que para as melhores condições de passivação em solução de molibdato, a mesma apresenta desempenho bastante inferior comparativamente às camadas de cromato no que se refere à proteção do zinco contra a formação de produtos de corrosão branco e vermelho. Com relação à estrutura e composição química, a técnica utilizada; XPS, não permitiu obter informações completas, entretanto as análises indicam que a camada é composta por MoVI e MoIV.
KOROBOV et al. 51 estudaram o comportamento de camadas de zinco tratadas catodicamente em solução de molibdato [(NH4)6Mo7O24.4H2O] a diferentes pH, densidade de
aplicado e decorrente formação do filme passivo, os autores chegaram às seguintes informações sobre o mecanismo de formação do filme:
A redução dos íons Mo6+ inclui pelo menos dois estágios que envolvem transferência de elétrons . Isso pode ser indicado através da curva da amostra de aço zincado tratado em filme de molibdato, Figura II.2.
Figura II.2. Esquema de curva voltamétrica do eletrodo de zinco em solução de molibdato de amônio em pH = 5,4 a 5 mV/s 51.
Os dados de eletro-redução, utilizando-se eletrodo de mercúrio, sugerem que a primeira inflexão corresponde à transição do Mo4+ para Mo5+:
Mo4+→ Mo5+ (II.5)
ao cátodo. Essa transformação ocorre em pH 3,0, pois os compostos de molibdênio são mais estáveis em soluções ácidas.
A natureza do segundo pico demonstra uma diversidade de formas reduzidas de molibdênio e sua tendência à formação de compostos não estequiométricos de oxigênio. O seguinte processo é provável: Redução do Mo (VI) da solução para compostos de baixo grau de oxidação:
Mo6+ (solução) + ne- Mo4+, 3+ (II.6)
Em seguida, ocorre a redução do filme sólido já formado em estado de oxidação Mo5+ em outros estágios:
Mo5+ (filme) + ne- Mo4+, 3+ (II.7)
Redução química pela combinação dos hidrogênios.
Mo6+, 5+, 4+ + ne- Mo5+, 4+, 3+ (II.8)
polarização e a análise da composição do filme formado. Para zinco imerso em solução de cromato todas as curvas apresentam uma inflexão para baixos sobrepotenciais. Para imersão em solução de molibdato ocorre a formação de pelo menos uma inflexão em todas as curvas e duas inflexões em algumas condições quando a solução é neutra ou ligeiramente ácida. Alterações de coloração da solução também são observadas quando se altera o pH da mesma. Para o caso específico da solução de molibdato, os autores observaram que para imersão do zinco nesta solução com pH 5 a mesma se imediatamente azulada, e após a polarização a solução torna-se azul escura. Acrescentando-torna-se outros ciclos de polarização a solução torna-torna-se ligeiramente esverdeada. Para analisar a composição do filme os autores utilizaram a técnica de ESCA (Electron Spectroscopy for Chemical Analysis). Os resultados obtidos indicaram pouca ou nenhuma alteração na composição do filme antes e depois do ponto de inflexão, sugerindo que para soluções com pH 5, a redução pode ser um processo galvânico que se inicia assim que o zinco é imerso na solução. A primeira etapa poderia ser a dissolução do zinco seguida da redução do molibdênio conforme as reações descritas a seguir:
Zn → Zn2+ + 2e (II.9)
Mo6+ + 2e → Mo4+ (II.10)
Pôde-se verificar que o molibdênio encontra-se no estado reduzido nos filmes catódicos sobre o zinco na forma de Mo5+ e Mo4+.
Cr6+ → Cr3+ → Cr0 (II.11)
As soluções de molibdato e tungstato produzem inflexões bem mais suaves, provavelmente, devido ao menor poder oxidativo dessas soluções. Para as diferentes condições empregadas duas regiões de potencial se destacam pelo aparecimento dos pontos de inflexão: -0,800 a -1,000 mV (ECS) e -1,400 mV (ECS). A inflexão inicial ocorre a baixos sobrepotenciais e pode ser atribuída a reações de óxido-redução. Embora o substrato passe por um tratamento inicial de limpeza, não se pode desprezar a possibilidade de formação de filmes de óxido e hidróxido sobre a superfície do metal. Outra possibilidade é a de que a inflexão inicial seja um indicativo da redução do molibdênio. Os autores relataram a presença de um filme azul quando zinco é imerso em solução ácida de molibdato, sugerindo que a primeira inflexão estaria relacionada a um processo galvânico de redução do molibdênio. Entretanto, a inflexão inicial também aparece para zinco em soluções alcalinas de molibdato, situação esta em que não ocorre a formação do filme azul. A segunda inflexão poderia estar associada com um processo característico do filme ao invés de um processo de redução. A análise da composição do filme revela a presença de espécies reduzidas de molibdênio para filmes produzidos a partir de soluções ácidas, embora pareça não haver relação entre um processo de redução e o ponto de inflexão que aparece na curva de polarização.
ARAMAKI 54 analisou o efeito de vários cátions sobre a inibição da corrosão do zinco em solução de cloreto de sódio. Os cátions analisados foram: Al3+, La3+, Ce3+ e Ce4+. Dentre estes, o La3+ e o Ce3+ mostraram elevada eficiência na proteção contra a corrosão do zinco. A análise da superfície do zinco tratada com íons de cério mostrou a presença de uma espessa camada protetiva de Ce(OH)3, Ce2O3 e pequena quantidade de Zn(OH)2 e ZnO não havendo a presença
De acordo com SALASI et al. 55 fosfatos vêm sendo muito utilizados como inibidores de corrosão 56. Seu impacto ambiental nas concentrações usuais para inibição de corrosão é desprezível. Além disso, em contraste com compostos inorgânicos de fósforo, não causam eutrofização. Sua alta estabilidade à hidrólise e resistência à degradação são igualmente benéficos.
Segundo DANTAS 57, os ortofosfatos são muito empregados nos sistemas de água de recirculação. Dois tipos são preferencialmente utilizados: o fosfato dibásico (Na2HPO4) e o
fosfato básico (Na3PO4). As proteções dos metais feitas tanto com um tipo quanto com outro, são
muito efetivas, tendo além disso, custos baixos. Entretanto, na área catódica poderá haver uma precipitação de fosfatos de cálcio. Este problema pode ser evitado com a adição de copolímero ou terpolímero no meio em que funcionam com dispersantes do fosfato de cálcio.
TORRES 58 estudou o desempenho do molibdato como inibidor de corrosão do aço carbono em diferentes concentrações e combinado com outros inibidores, tais como o Na3PO4 e
HEDP, em meio aerado, contendo 30 ppm de Cl- à temperatura ambiente. Verificou-se que o molibdato mostrou ser altamente eficiente na proteção do aço atuando sozinho em concentrações de 200 ppm, fornecendo uma taxa de corrosão consideravelmente desprezível, em torno de 0,009 mm/ano. A concentração mínima de molibdato puro que ainda fornece uma boa inibição do aço carbono encontrada pelo autor foi de 100 ppm do respectivo inibidor, quando o meio contiver 30 ppm de Cl-, pH 7,5, concentração de oxigênio dissolvido próxima a 8,5 ppm e temperatura ambiente. A substituição do molibdato atuando sozinho a 200 ppm, por uma mistura de molibdato (200 ppm), fosfino, fosfato e fosfanato em uma razão MoO42-/AHFC/PO43-/HEDP de
4:1:1:2, mostrou ser uma ótima alternativa. Verificou-se que uma mistura de MoO42-/AHFC e PO43- na razão de 3:1:1 e concentração total de 50 ppm, pode perfeitamente
substituir o molibdato puro a 50 ppm.
Estudos realizados por BITENCOURT 59 mostram que os inibidores anódicos MoO42- e
PO43- elevam o potencial de corrosão, possibilitando a formação de filme protetor, que se degrada
EDWARDS et al.60 comparou a inibição da corrosão de tubulações de cobre para água potável por ortofosfato e polifosfato, em pH 7,2. Os autores observaram que a corrosão do cobre é uma função complexa da idade da tubulação,da qualidade da água e do tipo de inibidor. Concentrações moderadas de polifosfato e ortofosfato em geral, diminuem a dissolução de cobre. Dosagem de polifosfatos, que é sempre uma mistura de ortofosfato e polifosfato devido à reversão, não foi tão benéfica como ortofosfato. Estes efeitos relativos são consistentes com as expectativas baseadas em modelos de solubilidade simplista, em que a complexação de cobre por polifosfato tende a aumentar a liberação de cobre solúvel, enquanto que doses mais elevadas de ortofosfato tendem a diminuir a solubilidade de cobre (Figura II.3).
ARAMAKI 61 analisou o efeito de vários ânions como inibidores da corrosão do zinco em solução aerada de cloreto de sódio. Os ânions analisados, que foram efetivos na proteção do zinco contra a corrosão, foram o silicato de sódio (Na2Si2O5) e o fosfato de sódio (Na3PO4).
Apesar da longa história do uso de silicato de sódio como inibidor de corrosão 62, estudo sistemático deste composto barato e ecologicamente amigável raramente é observado 55. Além disso, discussões na literatura sobre este composto são, por vezes, contraditórias. Adicionalmente, silicato de sódio é muito atraente em termos de não-toxicidade, custo e disponibilidade 63.
Os silicatos são os únicos inibidores anódicos não-oxidantes, cujo mecanismo de proteção sobre as áreas anódicas é o de barreira. Formam, em solução aquosa, sistemas coloidais bastantes complexos. Em função desta complexidade, a proteção fornecida por este inibidor é função do pH da água, da temperatura da mesma e da salinidade do meio. A ação deste inibidor é maior em
águas brandas, por conta de sua precipitação caso haja a presença de cálcio e magnésio no meio. Segundo Dantas 36, a dosagem inicial para a proteção de tubulações de aço carbono
2.5. REFERÊNCIAS BIBLIOGRÁFICAS
[1] GENTIL, V. Corrosão, 3ª edição, Livros Técnicos e Científicos, Editora S.A., 1996.
[2] MAINIER, F.B., SILVA, R.R.C.M. Engevista,6 (2004) 106.
[3] MAINIER, F.B. Tese (Concurso Público para Professor Titular da Universidade Federal Fluminense) – Departamento de Engenharia, Universidade Federal Fluminense, 1993.
[4] MARTIN, R.L. Corrosion,4 (1993) 694.
[5] MARCUS, P.; OUDAR, J. Corrosion Mechanisms in Theory and Pratice, New York, Marcel Dekker, 1995.
[6] NOVOKSHCHENOV, V. Corrosion,6 (1994) 477.
[7] BARDAL, E. Corrosion and Protection, New York, Springer-Verlag London Limited, 2004.
[8].OHI, M.; NISHIHARA, H.; ARAMAKI, K. Corrosion Science,50 (1994) 223.
[9] HADZI-JORDANOV, S.; ANGERSTEIN-KOZOLOWSKA, H.; VUKOVIC, M.; CONWAY, B.E. Journal of Eletrochemica,60 (1975) 359.
[10] RICON, O.T.; CARRUYO, A.R.; ROMERO, D.; CUICA, E. Corrosion,48 (1992) 960.
[11] GRUNDMEIER, G. Electrochimica Acta, 51 (2006) 1847.
[12] SANTOS, J.R.; MATTOSO, L.H.C.; MOTHEO, A.J. Electrochimica Acta, 43 (1998) 309.
[14] JANG, J.; ISHIDA, H. Corrosion Science,33 (1992) 1053.
[15] SHREIR, L. L. Corrosion. Vol. 2, New York, John Wiley & Sons, 1963.
[16] SILVA, P.F. Introdução à Corrosão e Proteção das Superfícies Metálica. Imprensa Universitária da UFMG, Belo Horizonte, 1981.
[17] ROZENTAL, L.Y. Dissertação (Mestrado em Ciências) – Departamento de Engenharia Metalúrgica e de Materiais, Universidade Federal do Rio de Janeiro, COPPE, Rio de Janeiro, Brasil, 1999.
[18] FISCHER, H. Werkstoff und Korrosion, 23 (1972) 445. Citado em [17].
[19] LORENZ, W.J.; MANSFELD, F. Corrosion Inhibition, NACE, houston, TX (1983) 7. Citado em [17].
[20] PEARSON, R.G. Journal AmericaChemistry Society, 85 (1963) 3533. citado em [17].
[21] STRATMAN, M.; FURBETH, W. Corrosion Inhibition by Adsorbed Organic MonolayerIn: Corrosion Mechanisms in Theory and Practice. Marcel Dekker, 1995.
[22] NATHAN, C.C. Corrosion Inhibitors, Houston, Texas: National Association of Corrosion Engineers (NACE), 1973. Citado em [3]
[23] DARLING, D., RAKSHPAL, R. Materials Performance,37 (1998) 42.
[24] COSTA, A.B. Passivo Ambiental: Uma Preocupação Adicional, São Paulo, Gazeta Mercantil, 03/09/1998, C-1. Citado em [3]
[25] LIPPI, R. Passivo Ambiental Prejudica Fusões e Aquisições, São Paulo, Gazeta Mercantil,
[26] PATTON, C.C. Material Performance,32 (1993) 108.
[27] LUMPP, S.N. Tese (Doutorado em Engenharia Mecância) – Departamento de Engenharia de Materiais, Universidade Estadual de Campinas, São Paulo, Brasil, 2005.
[28] BRESLIN, C.B.; TREACY, G.; CARROLL, W.M. Corrosion Science, 36 (1994) 1143.
[29] BADAWY, W.A.; AL-KHARAFI, F.M. Corrosion Science, 39 (1997) 681.
[30] AL-KHARAFI, F.M., BADAWY, W.A. Corrosion Science, 54 (1998) 377.
[31] MANSFELD,F.; WANG, Y. Materials Science and Engineering,198 (1995) 51.
[32] VIRTANEN, S.; SURBER, P.; NYLUND, P. Corrosion Science, 43(1165) 2001.
[33] ABDALLAH, M.; EL-ETRE, A.Y.; SOLIMAN, M.G. Anti-Corrosion Methods and Matrials, 53 (2006) 118.
[34] VUKASOVICH, M.S.; FARR, J.P.G. Polyhedron,5 (1986) 551.
[35] BENTLEY, A.J.; EARWAKER, L.G.; SAREMI, M.; SEENEY, A.M. Polyhedron, 15 (1986) 547.
[36] DANTAS, E. Geração de Vapor e Água de Refrigeração, Rio de Janeiro, 2ª Ed., Ecolab Química LTDA, 1988.
[37] ALEXANDER, M.; MOCCARI, F. Corrosion, 16 (1993) 921.
[39] BRESLIN, C.B.; TREACY, G.; CARROLL, W.M. Corrosion Science, 36 (1994) 1143.
[40]. BADAWY, W.A.; AL-KHARAFI, F.M. Corrosion Science,39 (1997) 300.
[41] BADAWY, W.A.; AL-KHARAFI, F.M. Corrosion Science,39 (1996) 681.
[42] BIJIMI, D., GABE, D.R. British Corrosion Journal,18 (1983) 93.
[43] GUANNAN MU.; XIANGHONG LI.; QING QU, JUN ZHOU. Corrosion Science,
48 (2006) 445.
[44] SAREMI, M.; DEHGHANIAN, C.; MOHMMADI SABET, M. Corrosion Science,
22 (2005) 234.
[45] WILCOX, G.D.; GABE, D.R. British Corosion Journal,22 (1987) 254. Citado em [38].
[46] AZAMBUJA, D.S.; MARTINI, E.A.; MÜLLER, L. Journal Brazilian Chemistry Society, 14 (2003) 570.
[47] BONORA, P.L.; DEFLORIAN, F.; FREDRIZZI, L. Electrochimica Acta,41 (1996) 41.
[48]. BRESLIN, C.B.; TREACY, G.; CARROLL, W.M. Corrosion Science,36 (1994) 1143.
[49]. ALMEIDA, E. Surface and Coatings Technology, 106 (1998) 8.
[50]. ALMEIDA, E. Surface and Coatings Technology,105 (1998) 97.
[51]. KOROBOV, V.I.; LOSHKAREV, Yu.M.; KOZHURA, O.V. Russian Journal of Electrochemistry,34 (1998) 1154.
[53] WILCOX, G.D., GABE, D.R., WARWICK, M.E. Metal Finishing,86 (1988) 71.
[54] ARAMAKI, K. Corrosion Science,43 (2001) 591.
[55] SALASI, M.; SHAHRABI, T.; ROAYAEI, E.; ALIOFKHAZRAEI, M. Materials Chemistry and Physics, 104 (2007) 183.
[56] AWAD, H.S.; TURGOOSE, S. Corrosion, 49 (2004) 1168.
[57] DANTAS, E. Geração de Vapor e Água de Refrigeração, Rio de Janeiro, 2ª edição, Ecolab Química LTDA, 1988.
[58] TORRES, F. Dissertação (Mestrado em Ciências) – Departamento de Engenharia Metalúrgica e de Materiais, Universidade Federal do Rio de Janeiro, COPPE, Rio de Janeiro, Brasil, 1998.
[59] BITENCOURT, D.T. Dissertação (Mestrado em Ciências) – Departamento de Engenharia Metalúrgica e de Materiais, Universidade Federal do Rio de Janeiro, COPPE, Rio de Janeiro, Brasil, 2002.
[60] EDWARDS, M.; HIDMI, L.; GLADWELL, D. Corrosion Science, 44 (2002) 1057.
[61] ARAMAKI, K. Corrosion Science, 42 (2001) 591.
[62] KATSANIS, E.P.; ESMONDE, W.B.; SPENCER, R.W. Materials Performace, 25 (1986) 19. Citado em [55].
CAPÍTULO III
3. MATERIAIS E MÉTODOS
3.1. SOLUÇÕES
Foram utilizadas soluções aquosas de NaCl 10-1 mol dm-3 preparadas com
reagentes de pureza analítica com concentrações variando de 10-4 mol dm-3 a 10-1 mol dm-3 dos inibidores Na
2MoO4, Na2WO4, Na2Si2O5 e NaH2PO4. A água
utilizada no preparo das soluções foi previamente destilada e purificada por sistema de Milli-Q. O pH das soluções foi mantido em 7,0 ± 0,2.
3.2. ELETRODOS
3.3. CÉLULA ELETROQUÍMICA
A Figura III.1 mostra o desenho esquemático da célula eletroquímica utilizada nos ensaios de corrosão. A célula eletroquímica utilizada nos ensaios consistiu de um recipiente de vidro de capacidade de 140 mL com uma tampa de PVC (cloreto de polivinila) com furos onde foram fixados os eletrodos de trabalho, o contra eletrodo e o eletrodo de referência. Todos os ensaios foram realizados em condições de aeração natural e à temperatura ambiente.
Figura III.1. Célula eletroquímica usada nos ensaios de corrosão.
3.4. MONITORAMENTO DO POTENCIAL DE CIRCUITO ABERTO COM O TEMPO (ECA)
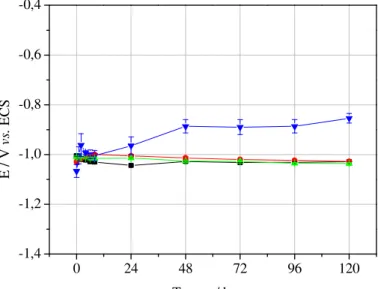
Os eletrodos embutidos foram imersos nas respectivas soluções de trabalho e foram realizadas medidas da variação do potencial de circuito aberto com o tempo em relação ao eletrodo de calomelano saturado, utilizando multímetro digital, por 120 horas.
ECS
Eletrodo de Trabalho (Zn)
Eletrodo Auxiliar (Pt)