UNIV CEN DEP PROGRAMA DE
VER
IVERSIDADE FEDERAL DO CEARÁ ENTRO DE CIÊNCIAS AGRÁRIAS
EPARTAMENTO DE ZOOTECNIA
E DOUTORADO INTEGRADO EM ZOOTECN PDIZ/ UFC/ UFPB/ UFRPE
RÓNICA GONZÁLEZ CADAVID
FORTALEZA
2014
VERÓNICA GONZALEZ CADAVID
PARÂMETROS ESPERMÁTICOS E PROTEÍNAS DO PLASMA
SEMINAL DE CACHAÇOS E PARÂMETROS REPRODUTIVOS DE
MARRÃS E PORCAS SUPLEMENTADOS COM MINERAIS E
VITAMINAS.
Tese apresentada ao programa de Doutorado Integrado em Zootecnia da Universidade Federal do Ceará,
Universidade Federal da Paraíba e Universidade Federal Rural de Pernambuco, como requisito parcial á
obtenção do título de Doutorado em Zootecnia. Área de concentração: Reprodução Animal.
Orientador: Prof. Dr. Arlindo A. A. Noronha Moura Co-orientador: Dr. Jorge Andre Matias Martins
FORTALEZA
AGRADECIMENTOS
A o Professor Dr. Arlindo A. A. Noronha Moura pela oportunidade de formar parte do seu grupo de pesquisa, além da orientação, confiança, estímulo, e pela dedicação na realização deste trabalho, também agradeço pela sua amizade.
A meu amigo Jorge Andre Matias Martins, quem alem de co-orientar este meu trabalho me brindou uma linda e sincera amizade.
A o veterinário da Granja Xerez Thiago Silvapor ter permitido a realização do trabalho, e aos funcionários Carlos, Marciano e Evanildo, pela ajuda na realização do trabalho, mas especialmente pelo bom recebimento a cada dia.
À empresa Formil Vet Ltda., pelo apoio que sempre me brindaram e alem dos recursos fornecidos fundamentais na realização deste trabalho.
Ao Dr. Carlos Eduardo Souza, que desde um inicio e com muita disposição me brindou muita ajuda, obrigada pela orientação e grandes contribuições.
Aos amigos, colegas, professores e funcionários do departamento de Zootecnia, pelo belo acolhimento, companheirismo e a sincera ajuda que sempre me brindaram. Em
especial um muito obrigado a Francisca Bezerra e Helena Oliveira pelo carinho que sempre me brindaram.
A meus amigos Brasileiros pelos momentos de grandes alegrias que juntos vivemos (João Paulo e toda a família Biai, Jorge Martins, Greicy, Rilvan, Poliana, Reijiane, Mariana Sizuki).
A meus amigos Colombianos, obrigada por facilitar minha vida longe de nossa linda Colômbia: Maria Eugenia, Verônica, Martha, Paula e Felipe, Deisy e Caca, Jorge Botero, Nadia, Javier Francisco e Aline, Jorge Luis Amaya, Juan Zulu e Andrés.
E a toda minha família González Cadavid quem proporcionaram dia a dia a energia para prosseguir nesta longa jornada, longe de vocês, mas sempre juntos. Obrigada por me ensinarem a lutar por um ideal e a acreditar na possibilidade de conquistá-lo, vocês são meu motor.
!....Não sei se estou perto ou longe demais, se peguei o rumo certo ou errado. Sei apenas que sigo em frente, vivendo dias iguais de forma diferente. Já não caminho mais sozinha, levo comigo cada recordação, cada vivência, cada lição. E mesmo que tudo não ande da forma que eu gostaria, saber que já não sou a mesma de ontem me
faz perceber que tudo valeu a pena....!
LISTA DE ILUSTRAÇÕES
Capítulo 2
Figura 1. Mapa bidimensional das proteínas do plasma seminal de suínos. (A) representa o gel sintético, (B) Corresponde ao conjunto de proteínas ácidas, de baixo peso molecular...53 Figura 2. Componente celular, função molecular e processos biológicos identificados nas proteínas do plasma seminal de suínos, analisados com o STRAP...67 Figura 3. Análise da interação das proteínas in silico. As interações das proteínas foram analisadas com o software STRING...69 Figura 5. Interactoma e redes de sinalizações associadas a proteínas do plasma seminal com relações empíricas com parâmetros espermáticos dos suínos. As analises foram realizadas através do software MetaCore, v. 6.8 (http://portal.genego.com; GeneGo, St. Joneph, MI, USA). Legendas e símbolos mostrados no presente diagrama são descritos na Figura Suplementar 1...74-76
Figura Suplementar 1. Legendas e símbolos do Interactoma e redes de sinalizações associadas a proteínas do plasma seminal dos suínos. As analises foram realizadas através do software MetaCore, v. 6.8 (http://portal.genego.com; GeneGo, St. Joneph, MI, USA)...145
Capítulo 3
Figura 1. Mapa bidimensional das proteínas do plasma seminal de suínos...122
LISTA DE GRÁFICOS
Capítulo 2
Figura 4. Modelos de regressão que mostram as variações dos parâmetros espermáticos dos suínos com relação às proteínas do plasma seminal...72
Capítulo 3
Figura 1. Parâmetros seminais (media ± erro padrão da media) de suínos adultos
suplementados com complexo vitamínico-mineral...113 Figura 2. Cromatograma de afinidade a heparina do plasma seminal Suíno...125 Figura 3. Cromatogramas de afinidade à heparina do plasma seminal suíno. A linha azul representa o período D0 e a linha ponteada vermelha representa o período
LISTA DE TABELAS
Capítulo 2
Tabela 1: Proteínas do plasma seminal de suínos (Sus scrofa) identificadas por eletroforeses bidimensional e espectrometria de massa em tandem . A tabela inclui os spots detectados em géis de 24 cm, dentro da faixa de pH 3-10. Os números e os nomes das proteínas referem-se aos apresentados na figura 1...55
Tabela Suplementar 2. Proteínas do plasma seminal de suínos (Sus scrofa) identificadas por eletroforese bidimensional e espectrometria de massa em tandem. A tabela inclui os spots detectados nos géis de 24 cm, dentro da faixa de pH 3-10. Os números e os nomes das proteínas referem-se aos apresentados na Tabela 1 e Figura 1...146
Capítulo 3
Tabela 1. Composição nutricional da ração dos machos reprodutores da granja...104
Tabela 2. Composição nutricional da ração das Fêmeas usada na granja Xerez...105
Tabela 3. Médias e desvios padrão das variáveis seminais (cinéticas) estudadas dos grupos (G1, G2, G3) em relação à suplementação...117
Tabela 5. Médias e desvios padrão das variáveis seminais (Teste de vitalidade e vitalidade) estudadas dos grupos (G1, G2, G3) em relação à suplementação...120
LISTA DE ABREVIATURAS
EUA: Estados Unidos de America Ltda: Limitada
ROS: Espécies Reativas de Oxigênio ATP: Adenosina Trifosfato
SOD: Superóxido Dismutase DNA: Ácido Desoxirribonucléico RNA: Ácido Ribonucléico
cAMP: Adenosina monofosfato cíclico LIA: Células vivas com acrossoma intacto LDA: Células vivas com dano no acrossoma DIA: Células mortas com acrossoma intacto DDA: Células mortas com dano no acrosoma D: Células mortas
BSA: Albumina sérica bovina VIG: Vigor espermática MOT: Motilidade espermática HOST: Teste Hiposmótico
Se: Selênio
Zn: Zinco
Mg: Magnésio
Cu: Cobre
min: Minutos
hr: Horas
V: Volts
Vh: Volt por hora
v/v: Medida de volumem por volumem Kg: Kilogramas
g: Gramas
m: Metros
µM: Microgramas
mM: Miligramas µL: Microlitros mL: Mililitros Kcal: Kilo-calorias
UI: Unidades Internacionais ppm: Partes por milhão nm: Nanometros
kDa: Kilodaltons (Unidade de massa atômica) N-3: Ácido docosaexaenóico
N-6: Ácido docosapentaenóico OH: Radicais Hidroxila Livres O2-: Ânion Superóxido
H2O2: Peróxidos
DTT: Dithiothreitol
SDS: Dodecilsulfato Sódico
TRIS: Tris(hidroximetil)aminometano
NCBI: National Center for Biotechnology Information PMSF: Fluoruro de fenilmetilsulfonilo
mAU: Miliequivalencias de absorbância IDC: Intervalo desmama cio
LISTA DE SIMBOLOS
® Marca registrada
α Alfa
ß Beta
± Mais ou menos
°C Graus Celsius
% Porcentagem
# Numeral
* Asterisco
< Menor que
SUMÁRIO
CAPÍTULO 1 ... 18
“Referencial teórico” ... 18
1-REVISÃO DE LITERATURA ... 19
1.1 Nutrição de cachaços ... 21
1.1.1 Selênio e vitamina E ... 22
1.1.2 Cálcio e fósforo ... 24
1.1.3 Zinco e magnésio ... 25
1.2.1 Danos Oxidativos sofridos pelos espermatozoides... 28
1.3 Análise convencional da qualidade dos ejaculados ... 30
1.4 Proteínas do plasma seminal suíno ... 31
1.5 Nutriçao das fêmeas ... 37
CAPÍTULO 2 ... 39
RESUMO ... 40
ABSTRACT ... 42
2. INTRODUÇÃO ... 43
3 MATERIAL E MÉTODOS ... 44
3.1 Animais ... 44
3.2 Avaliação seminal ... 44
3.3 Quantificação da concentração de proteína total no plasma seminal ... 45
3.4 Eletroforese bidimensional de proteínas do plasma seminal ... 45
3.5 Análises das imagens ... 47
3.6 Digestão dos spots protéicos dos géis 2-D ... 47
3.7 Identificação das proteínas por espectrometria de massa (Electrospray ionization quadropole-time-of-flight) ... 48
3.8 Análises de ontologia gênica ... 49
3.9 Análises das interações protéicas ... 50
3.10 Análise das interações proteína - proteína através da base de dados do Metacore... 50
3.11 Análise estatística ... 51
4 RESULTADOS ... 51
4.1 Parâmetros seminais ... 51
4.4 Análise das interações entre proteína ... 69
4.5 Associações entre as proteínas do plasma seminal e os parâmetros seminais ... 72
5 DISCUSSÃO ... 79
6 REFERÊNCIAS BIBLIOGRÁFICAS ... 86
CAPÍTULO 3 ... 98
RESUMO ... 99
7 INTRODUÇÃO ... 101
8 MATERIAL E MÉTODOS ... 103
8.1 Desenho experimental e tratamentos ... 103
8.2 Animais e tratamentos ... 103
8.3 Avaliação do sêmen ... 108
8.4 Quantificação da concentração de proteína total no plasma seminal ... 108
8.5 Eletroforese bidimensional de proteínas do plasma ... 109
8.5.1 Análise das imagens ... 110
8.6 Cromatografia de afinidade pela heparina do plasma seminal ... 111
8.6.1 Análise dos cromatogramas ... 112
8.7 Análise estatístico ... 112
9 RESULTADOS ... 113
9.1 Parâmetros seminais ... 113
9.2 Avaliação de grupos de animais conforme o nível de resposta ao tratamento ... 116
9.3 Proteínas do plasma seminal ... 122
10 DISCUSSÃO ... 129
11 Agradecimentos ... 133
18
CAPÍTULO
1
19
1-REVISÃODELITERATURA
Dentre as carnes de espécies exploradas comercialmente, a carne de suíno é a mais produzida no mundo e a China maoir país produtor, alcançou a comercialização de 49,5 milhões de toneladas em 2011, seguido da União Européia (22 milhões de toneladas/ano), EUA (10 milhões de toneladas/ano) e Brasil (3 milhões de toneladas/ano). A carne suína é também a mais consumida mundialmente, com um consumo per capita anualde 14,96 kg, seguida da carne de frango (11,5 kg), e a carne de bovinos (9,7 kg). Hong-Kong é o maior país consumidor, respondendo por 68,60 kg/habitante/ano. No Brasil, o consumo per capita de carne suína é de 14,7 kg/habitante, enquanto a carne bovina e de frango têm consumo per capita aproximado de 35 e 38 kg/habitante/ano, respectivamente (Abipecs, 2012).
O rebanho suíno brasileiro possui aproximadamente 38 milhões de animais e, no último ano, houve um aumento significativo do número de matrizes indústriais, chegando a 1.684.781 de cabeças no final de 2012. No que diz respeito à exportação, houve queda de 625 mil toneladas em 2010 para 535 mil toneladas de carne no final de 2012. Embora tenha havido uma reestruturação no mercado importador de carne suína brasileira, a Rússia continua sendo o maior mercado, responsável pela compra de 30,2 % do total exportado, seguida por Hong-Kong com 21,4 % e Ucrânia, com 15,2 %. Há perspectivas de aumento das exportações, principalmente para mercados como Japão, Coréia do Sul, México, EUA e União Européia (Abipecs, 2012). Nos últimos 50 anos, pesquisas em genética, biotecnologia e nutrição tiveram impacto no aumento de produtividade e, dentre estas, a inseminação artificial respondeu por progressos na suinocultura (Dyck et al, 2011; Gerrits et al, 2005; Eriksson et al, 2000) e importantes avanços nas áreas de genética, nutrição e controle de doenças e parasitas.
No Brasil, estima-se que perto de 15 % das matrizes suínas em idade de reprodução sejam inseminadas artificialmente, número, porém ainda 80 % menor do que os observados em países europeus (Nascimento, 2007). Um dos entraves ao aumento da utilização da
20 2000; Antunes 2007). Atualmente, a utilização do sêmen congelado no mundo está em menos de 1 % (Wagner e Thibier 2000; Antunes 2007; Corcini et al, 2010) devido a limitações como: baixa fertilidade, com taxa de partos 20 a 30 % menores que sêmen resfriado; diminuição de 2 a 3 leitões por leitegada; a dose inseminante da ordem de 6 bilhões de espermatozoides enquanto o sêmen resfriado requer de 3 a 4 bilhões de espermatozoides (Corcini et al, 2010; Erikson, 2000).
21
1.1NUTRIÇÃO DE CACHAÇOS
Devido aos machos, dentro de um rebanho comercial de suínos, representaram uma pequena proporção da população total de suínos, pesquisas sobre a nutrição de cachaços são escassas (Audet et al, 2004; Mullan et al, 2006), quando comparadas com as outras fases de produção. Outra razão para a escassez de pesquisas relacionadas à nutrição de machos é que o acasalamento por monta natural é predominante nos sistemas de criação, e um ejaculado suíno produz espermatozoides mais que suficientes para garantir a gestação de uma fêmea. Com a difusão da técnica de inseminação artificial, são necessárias estratégias de manejo e nutrição para aumentar a fertilidade dos machos e qualidade do sêmen (Estienne, 2005).
Deve-se considerar também que existem muitos fatores que podem interferir na biodisponibilidade de micro elementos fornecidos via dieta para suínos, entre eles: as micotoxinas; interação entre nutrientes; estresse térmico; armazenamento inadequado de ingredientes que compõem a dieta; doenças; entre outros (Close 2003). Devido a estes fatores, a suplementação extra de vitaminas e minerais pode apresentar resultados na qualidade e quantidade do sêmen, como demonstrado em muitas espécies animais (Marin-Guzman et al, 1997; Franchini et al, 2001; Yousef et al, 2003), seja pela inativação de danos oxidativos ou interação com processo biológicos e enzimáticos.
22 Os organismos desenvolvem diversos mecanismos para proteger-se dos danos causados pelas ROS. Pequenas moléculas como a vitamina E são capazes de reagir com estes radicais (Burton et al, 1986). Os mecanismos para neutralizar os efeitos da oxidação incluem a vitamina E e enzimas antioxidantes, dependentes de minerais (Funderburke e Shipp, 2007).
1.1.1SELÊNIO E VITAMINA E
O selênio (Se) é essencial para o desenvolvimento normal dos espermatozoides, já que é incorporada à membrana mitocondrial. Também é componente da enzima glutationa peroxidase, que atua como antioxidante celular (Kopinsk, 2005). Em geral, pesquisas têm demonstrado que a administração de suplementos de selênio em suínos aumenta os níveis da glutationa peroxidase e as concentrações de selênio nos espermatozoides e no plasma seminal (Segerson et al, 1981; Marin-Guzman et al, 1997). No entanto, (Kołodziej & Jacyno, 2005) observaram que a adição do selênio diminui a glutationa peroxidase no plasma seminal. Calvin (1979) notou que a maior parte do selênio injetado em ratos se localizava na peça intermediária do espermatozoide, sugerindo que o mineral deve estar envolvido na manutenção da integridade estrutural e função locomotora do gameta masculino.
23 et al, (2002), avaliando fontes orgânicas e inorgânicas de selênio aliadas a vitamina E em cachaços, não encontraram efeito dos tratamentos sobre a motilidade ou volume do ejaculado, porém, a concentração espermática e porcentagem de espermatozoides com acrossomos normais foi maior para a fonte orgânica, que também diminuiu a porcentagem de espermatozoides com anormalidades morfológicas. Na realidade, os minerais orgânicos, em geral, são menos reativos e apresentam maior biodisponibilidade (Mullan et al., 2006).
A associação de selênio e vitamina E é comum em muitos trabalhos. Brzezinska-Slebodzinska et al, (1995), sugeriram que a vitamina E pode atuar como um antioxidante no sêmen de suínos. Marin-Guzman et al, (1997) usaram dietas com concentrações de Se inorgânico de 0 a 0,5 ppm e vitamina E de 0 a 220 UI/kg na dieta em cachaços para avaliar, entre outros parâmetros, a qualidade do sêmen e a taxa de fertilização. Os autores concluíram que dietas com baixos níveis de Se e vitamina E provocaram a redução da motilidade espermática e a porcentagem de espermatozoides anormais aumentou. Não encontrando efeito da suplementação no volume ou concentração espermática. Para os machos suplementados com selênio, foi encontrado aumento da concentração de selênio no sêmen e da atividade da enzima glutationa peroxidase e a diminuição na incidência de gotas citoplasmáticas, bem como em espermatozoides sem cauda ou com anormalidades na cauda. Em relação à taxa de fertilização, o número de oócitos fertilizados pelo grupo de cachaços que receberam a dieta sem selênio foi menor.
24 A vitamina E tem papel fundamental no processo de espermatogênese (Mason, 1954; Marin-Guzman et al, 1997). Deficiência de vitamina E pode causar degeneração testicular em ratos, cachorros, gatos, suínos e macacos, e provocaram baixo número de células germinativas e consequente redução na produção espermática (Mason 1940; Mason e Maner 1957; Cooper et al, 1987). A vitamina E não teve efeito sobre as anomalias estruturais nos espermatozoides, mas provavelmente serve como antioxidante nas células espermáticas (Marín-Guzmán et al, 2000; Brzezinska-Stebodzinska et al, 1995). Cerolini et al. (2000) demonstraram que a vitamina E foi capaz de prevenir danos oxidativos nas membranas espermáticas do sêmen de suínos. Peña et al, (2004) usando vitamina E (100 µM e 200 µM – Trolox) no diluente de sêmen suíno, encontraram aumento da motilidade espermática após descongelação na maior concentração da vitamina.
1.1.2CÁLCIO E FÓSFORO
O fósforo e o cálcio desempenham um papel muito importante no desenvolvimento e manutenção do sistema esquelético, realizando também outras funções fisiológicas. Carter e Cromwell, (1998) indicaram que a nutrição adequada de cálcio e fósforo para todas as classes de suínos foi dependente da proporção destes minerais disponível na dieta e da presença de vitamina D, já que a absorção dos dois minerais foi dependente desta vitamina (Hancock e Benz 1986; Jongbloed, 1990). Na reprodução, quando administrados na fase de crescimento do animal, contribuiram para a vida útil reprodutiva (Kopinski, 2005; I Caballero et al, 2008).
25 fusão da vesícula acrossomal (Toniolli e Combarnous 1999; Suarez e Ho 2003). A membrana plasmática apresenta canais de cálcio voltagem-dependente que iniciam e mantém o aumento intracelular deste íon na hiperativação (Bootman et al, 2001). Lima et al, (2007), avaliando a adição de diferentes dosagens de cloreto cálcio no sêmen suíno concluíram que as amostras que receberam maiores níveis (5,0 e 7,0 mM) apresentaram motilidade espermática melhor e não encontraram diferenças quanto ao vigor espermático.
1.1.3ZINCO E MAGNÉSIO
O zinco (Zn) e o magnésio são minerais componentes das DNA e RNA sintetases e transferases, enzimas digestivas e insulina. Também têm função na produção espermática de cachaços (Kopinski, 2005). Liao et al, (1985), suplementando cachaços com diferentes níveis de zinco (32, 89, 146 e 197 ppm) encontraram maior produção de espermatozoides nos animais que receberam os níveis mais altos, porém não encontraram efeito do tratamento sobre o total de espermatozoides com anormalidades morfológicas. Liptrap et al, (1970) reportaram que cachaços têm maior exigência de Zn que fêmeas e machos jovens. No entanto, a quantificação do requerimento de Zn para machos não foi bem estabelecida, especialmente, durante épocas intensas de colheita de sêmen. Atrofia dos túbulos seminíferos e do epitélio germinal testicular acompanhada de retardo no desenvolvimento de testículos, epidídimo, próstata de glândula pituitária foram observadas em machos de diferentes espécies (Mason & Maner, 1957). Wegger e Palludan (1977) encontraram degeneração do testículo, aumento do tecido conectivo das células de Leydig em cachaços alimentados com uma dieta pobre em Zn por 10 semanas.
26
1.2 O espermatozoide
O espermatozoide é o produto final do processo de espermatogênese, em que ocorrem sucessivas mitoses, meioses e fases pós-meióticas nos túbulos seminíferos do testículo. Durante a fase mitótica, as células germinativas sofre uma série de divisões mitóticas para expandir a população de espermatogônias. A fase meiótica é dividida em duas ocorrendo sem duplicação de DNA com o objetivo de produzir células haplóides. Estas duas fases são essenciais para produzir os espermatozoides na fase pós-meiótica final. Esta fase final, também conhecida como espermiogênese, se caracteriza pela formação do acrossomo, condensação nuclear, perda da maior parte do citoplasma, desenvolvimento do flagelo e rearranjo das mitocôndrias. Como resultado tem-se uma célula altamente diferenciada e especializada em estrutura e função, capaz de se fundir ao o oócito para dar origem às próximas gerações (Senger 2002; Neill 2006; Boerke et al, 2007; Galeraud-Denis et al, 2007).
Os componentes principais do espermatozoide são a cabeça e a cauda. A cabeça contém o núcleo, a estrutura do citoesqueleto e uma pequena porção de citoplasma. Anteriormente à cabeça existe uma membrana com uma vesícula citoplasmática que contém enzimas hidrolíticas, denominada acrossomo (Neill, 2006). Na cauda, a peça intermediária contém as mitocôndrias responsáveis pela geração de energia para o movimento flagelar típico do espermatozoide.
27 (N-3) (Poulos et al, 1973). Esta composição confere à membrana uma maior fluidez devido à presença de muitas duplas ligações (Erikson, 1998) e pode ser essencial na prevenção de danos pela formação de cristais de gelo. A composição de ácidos graxos da membrana de espermatozoides suínos contém aproximadamente 25 % de ácido docosapentaenoico (N-6) e 30 % de ácido docosahexaenoico (N-3) (Penny et al, 2000; Rooke et al, 2001). Esta característica específica pode contribuir para a menor resistência destes espermatozoides ao processo de congelação.
Em relação à fertilidade dos espermatozoides, existem duas características principais que devem ser levadas em conta: primeiro, a sua competência em alcançar o local de fecundação do oócito e penetrar a zona pelúcida, uma vez que existem várias barreiras dentro do trato reprodutivo da fêmea para prevenir que espermatozoides com alguma anormalidade completem sua jornada até o oócito. Segundo, a habilidade do espermatozoide de iniciar e sustentar o desenvolvimento do zigoto, embrião ou feto. Uma vez que o espermatozoide penetra o oolema, ele deve emitir um sinal suficiente para ativar o oócito (Ostermeier et al. 2005).
Os espermatozoides recém-ejaculados não são capazes de fertilizar o oócito. Primeiramente, eles devem sofrer a capacitação e posteriormente a reação acrossomal. A capacitação espermática é um processo preparatório, em que ocorre a ativação do espermatozoide, normalmente dentro do oviduto. Durante a capacitação, o espermatozoide apresenta movimentação lateral da cabeça, aumento do movimento flagelar e tem uma trajetória não linear. As modificações funcionais devido à capacitação incluem a habilidade do espermatozoide de sofrer a reação acrossomal (Saling e Storey 1979; Florman et al. 1999). Durante a capacitação, ocorre reorganização da membrana plasmática que recobre a cabeça do espermatozoide devido à redistribuição dos fosfolipídios e remoção do colesterol (Langais e Roberts 1985; Lin e Kan 1996).
28 bruscas de pH podem gerar danos irreversíveis nas membranas plasmática e acossomal, causando perda prematura dos componentes do acrossomo fazendo com que este espermatozoide perca sua capacidade de fertilização (Senger, 2002).
A remoção do colesterol da membrana parece ser o primeiro sinal ativador do processo de capacitação e reação acrossomal (Shadan et al, 2004). A saída do colesterol aumenta a fluidez da membrana e favorece a entrada de íons de cálcio e bicarbonato (Travis e Kopf 2002). Estes íons ativam diretamente a adenil ciclase solúvel do espermatozoide a catalisar a formação de cAMP (Bailey et al, 2008). A concentração intracelular de cAMP está diretamente envolvida com a reação acrossomal devido à ação na inibição da adenosina (Miah et al, 2006). Desta forma, a elevação dos níveis intracelulares de Ca está entre os processos principais iniciadores da reação acrossomal (Florman et al, 1999). A regulação da reação acrossomal pode estar envolvida com a abertura dos canais de cálcio voltagem dependente, o influxo de cálcio e a manutenção de altos níveis de cálcio intracelulares (Evans e Florman 2002).
1.2.1DANOS OXIDATIVOS SOFRIDOS PELOS ESPERMATOZOIDES
Células vivas, estocadas em condições aeróbicas, requerem oxigênio para sustentar sua atividade metabólica. No entanto, o excesso de espécies reativas de oxigênio (ROS) pode causar danos oxidativos celulares (Thuwanut et al., 2008). As ROS são radicais com moléculas de oxigênios com um ou mais elétrons não pareados (Burton & Ingold, 1986), que tendem a se ligar a outras moléculas, alterando-as (Funderburke & Shipp, 2007). Os radicais danosos são: o ânion superóxido (O2-), peróxidos (H2O2) e os radicais hidroxila livres (OH). Os peróxidos são os que apresentam maior potencial de danos (Vishwanath e Shannon 1997; Bilodeau et al, 2002).
29 espermatozoide pelas mitocôndrias presentes. Elas são a principal fonte geradora de ROS (Funderburke & Shipp, 2007). Os danos de ROS na membrana espermática ou no DNA são causados por o acúmulo excessivo de peróxido (H2O2), o produto final do radical superóxido, em espermatozoides humanos (Lopez 1998; Aitken e Krausz 2001) e bovinos (Chatterjee e Gagnon 2001).
Os danos oxidadivos induzidos pelas espécies reativas de oxigênio, principalmente no DNA mitocondrial e arquitetura das membranas espermaticas podem ser os fatores de maior relevância na diminuição da motilidade e fertilidade dos espermatozoides, em especial no sêmen criopreservado (Cummins et al, 1994). Foi demonstrado que a perda de motilidade em amostras de sêmen e de espermatozoides nas mesmas amostras estava relacionada com o acúmulo de espécies reativas de oxigênio no espermatozoide (Erasmus et al, 1992). A presença de excesso de ROS no sêmen tem sido altamente associada com baixas concentrações e motilidade e a piora na morfologia (Agarwal et al, 1994).
O sêmen de suínos parece ser particularmente sensível aos danos produzidos pelas espécies reativas de oxigênio devido ao alto conteúdo de ácidos graxos insaturados e fosfolipídeos de membrana (Stubbs e Smith 1984). A peroxidação dos lipídeos dos ácidos graxos pode ser um dos mecanismos responsáveis para as mudanças bioquímicas e fisiológicas negativas durante a estocagem deste sêmen (Cerolini et al. 2001) associadas a baixa capacidade antioxidante do plasma seminal suíno (Brzezińska-Slebodzińska, Slebodziński, e Krysin 1995). O processo de criopreservação aumenta a peroxidação de lipídios em muitas espécies animais (Sławeta et al, 1988; Jeong et al. 2009).
Os organismos desenvolvem diversos mecanismos de defesa para proteger-se dos danos causados por estas espécies de oxigênio reativas. Pequenas moléculas como a vitamina E (a-tocoferol) são capazes de reagir com estes radicais diretamente (Burton et al. 1986). A vitamina E atua na reação de peroxidação lipídica de biomembranas e lipoproteínas (Dieber-Rotheneder et al, 1991). No plasma seminal, os mecanismos para neutralizar os efeitos da oxidação incluem a vitamina E e certas enzimas, dentre elas, a glutationa peroxidase, que é dependente de selênio e a peróxido dismutase, dependente de cobre e Zinco (Funderburke e Shipp 2007).
30 peroxidodismutase já foi observada em sêmen criopreservado de bovinos e humanos, quando comparado ao sêmen in natura (Lasso et al. 1994; Bilodeau et al. 2002). Além disso, a criopreservação reduziu os níveis da glutationa peroxidase em 78 % no sêmen de bovinos (Bilodeau et al, 2000).
A enzima glutationa peroxidase também é um importante antioxidante. Segundo Gadea et al, (2004), a glutationa é um tripeptídeo amplamente presente nas células vivas e que desempenha papel importante no mecanismo de defeça intracelular contra o estresse oxidativo (Irvine 1996). Gadea et al, (2004) determinaram o conteúdo de glutatina no espermatozoide suíno antes e depois da criopreservação, e os autores encontraram uma redução de 32 % no conteúdo de glutationa pos-criopreservação. No mesmo trabalho, eles concluíram que adição de glutationa no diluente da descongelação resultou em um aumento da tolerância da crioconservação do sêmen.
1.3ANÁLISE CONVENCIONAL DA QUALIDADE DOS EJACULADOS
Os métodos tradicionais de avaliação do sêmen geralmente incluem porcentagem de espermatozoides vivos, morfologia e principalmente motilidade e vigor, que são parâmetros subjetivos (Moldenhauer et al, 2003; Bissonnette et al, 2009; Novak et al, 2010). As alterações nas características seminais poderiam ser mais bem detectadas pela análise do perfil de proteínas do plasma seminal.
Análises bioquímicas, associadas aos critérios de avaliação espermática poderiam auxiliar na identificação de diferenças importantes na fertilidade potencial dos machos. Neste sentido, estudos desenvolvidos mostraram que há evidências de associações significativas entre a expressão de proteínas no plasma seminal e a fertilidade dos machos, avaliadas in vivo e in vitro. Tais proteínas assim poderiam ser consideradas como marcadores moleculares da fertilidade (Killian et al, 1993; Moura et al, 2006 a, 2006 b e 2207).
31 (1998) concluem que essas proteínas presentes no plasma seminal tem papel importante durante a capacitação espermática e fertilização.
Para melhorar a qualidade dos espermatozoides pode-se estudar os efeitos da suplementação vitamínico mineral de cachaços e analisar o efeito das mesmas nas proteínas do plasma seminal (Novak et al, 2010), já que a análise convencional do vigor e motilidade do sêmen é subjetiva e permite detectar apenas 50 % das alterações físicas e morfológicas dos espermatozoides (Moldenhauer et al, 2003).
A identificação de proteínas do plasma seminal pode ajudar a identificar marcadores da criotolerância ou de fertilidade potencial dos machos. Por exemplo, para bovinos, a criotolerância é favorecida na presença de duas proteínas de plasma seminal específicas, e desfavorecida por outras duas (Jobim et al, 2004). Em equinos, existem proteínas do plasma seminal negativamente correlacionada à fertilidade, enquanto uma determinada proteína de 72 kDa favorece a fertilidade (Brandon et al, 1999).
1.4PROTEÍNAS DO PLASMA SEMINAL SUÍNO
O plasma seminal de suínos é uma complexa mistura de secreções originárias dos testículos, epidídimo, e as glândulas acessórias do aparelho reprodutivo do macho, na qual os espermatozoides estão incluídos. Sabe-se que o plasma seminal contém fatores que influenciam, tanto os espermatozoides, quanto o trato reprodutivo feminino durante o processo de transporte espermático até o sítio de fecundação (Mann e Lutwak-Mann 1982; Johnson et al. 2000; Rozeboom et al. 2000; Strzezek 2002), além de prover suporte metabólico e fonte de energia para as células espermáticas (Maxwell e Johnson 1997; Centurion et al, 2003). A maioria destes fatores são proteínas do plasma seminal (Caballero et al, 2008).
32 espermática e fertilização (Rodriguez-Martinez et al, 1998) além de proteger os espermatozoides de danos e conservar sua longevidade (Novak et al, 2010).
Em cachaços, mais de 90 % destas proteínas do plasma seminal são representadas pela família das espermadesinas, um grupo de glicoproteína de 12-16 kDa, que se ligam à superfície espermática (Caballero et al, 2008). As espermadesinas são uma família de glicoproteínas de baixo peso molecular (12-16 kDa), que apresentam diferentes funções (Romero et al, 1997). Estas proteínas ligam-se à superfície do espermatozoide ejaculado (Sanz et al, 1992; Töpfer-Petersen et al, 1998). Até o momento, as espermadesinas foram identificadas no plasma seminal suíno (AWN, AQN-1, AQN-3, Calvete et al, 1996; PSPI/PSP-II, Varela et al, 1997), bovino (aSFP, Wempe et al, 1992; Z13, Tedeschi et al, 2000), equino (HSP-7, Reinert et al, 1996) e no ovino (Espermadesina de 15,5 kDa, Bergeron et al, 2005).
Em suínos, a PSP-I e PSP-II representam mais de 50 % do total de proteínas presente no plasma seminal. As AQN1, AQN3, AWN, PSPI, e PSPII, podem também influenciar a motilidade espermática (Centurion et al, 2003; Caballero et al, 2004) e a capacidade de penetração no óocito (Caballero et al, 2004), sugerindo a existência de um complexo mecanismo destas proteínas no macho.
Dependendo de sua capacidade de ligação, as espermadesinas podem ser classificadas em proteínas com afinidade à heparina (AQN-1; AQN-3 e AWN) e proteínas sem afinidade à heparina (heterodimeros PSP-I e PSP-II) (Calvete et al, 1995, 1996; Sanz et al, 1992; Jonakova et al, 2000).
A heparina é um glicosaminoglicano, isto é, um polissacarídeo de alto peso molecular, que é secretado, particularmente na fase folicular, pelo trato reprodutivo da fêmea, (Lenz et al, 1983) e que se liga ao espermatozoide bovino através de proteínas (HBPs), sendo capaz de induzir a capacitação (Lenz et al, 1983; Miller et al, 1990). As proteínas de ligação à heparina (HBPs) são produzidas pelas glândulas acessórias do macho (próstata, vesículas seminais e glândulas bulbouretrais) (Nass et al, 1990).
33 das proteínas AWN-1 e AQN-3 exibem uma ligação específica com os fosfolipídios, formando uma primeira camada de material por sua interação com a camada bilateral de fosfolipídios da membrana do espermatozoide (Dostalova et al, 1995). Dessa forma o espermatozoide está protegido por uma capa de espermadesinas agregadas que pode servir como um fator estabilizador da acrosina (Topfer-Petersen et al, 1998; Dostalova et al, 1995). Uma vez ejaculado, e depositado no trato genital feminino, ocorre uma massiva invasão de leucócitos no lumen uterino, que aparentemente pode ser modulada por heterodímeros de PSP-I e PSP-II (Assreuy et al, 2002; 2003; Rodriguez-Martinez et al, 2003). A população espermática que sobrevive a este ataque de leucócitos alcança o oviduto e forma o reservatório ístmico espermático, graças à interação de carboidratos entre as proteínas da superfície espermática e o epitélio do oviduto (Töpfer-Petersen 1999). Estudos têm demonstrado que populações espermáticas contendo maiores quantidades de espermatozoides com a capa de PSP-I/PSP-II sobre a região acrossomal também apresentam maior porcentagem de espermatozoides viáveis, móveis e com atividade mitocondrial (Ignacio Caballero et al. 2006). Os autores sugeram que a presença destas proteínas pode ser responsável pela estabilização da membrana espermática, atraso no processo de capacitação, fatores que são responsáveis pela deterioração da membrana, exocitose acrossomal e morte celular (Caballero et al, 2006; Kamaruddin et al, 2004; Barrios et al, 2005).
Recentemente, foi descoberto que as espermadesinas com afinidade à heparina, especialmente a AQN-1, estão envolvidas com esta interação espermatozoide-epitélio do oviduto, sugerindo que esta proteína pode estar envolvida com a formação do reservatório espermático no oviduto da fêmea (Ekhlasi-Hundrieser et al. 2005; Liberda et al. 2006).
Foi demonstrado também que as espermadesinas têm capacidade de se tornarem captadoras de moléculas de colesterol, sugerindo um papel na remoção dessas moléculas de colesterol durante o processo de capacitação espermática. Töpfer-Petersen et al, (1998) sugerem que a proteína PSP-I, primeiramente identificada por Rutherfurd et al, 1992, está envolvida com a prevenção da capacitação prematura do espermatozoide e reação acrossomal.
34 espermática e por isso podem estar envolvidas na interação entre os gametas. Sanz et al, (1992) sugere que a AWN afeta a atividade de ligação do espermatozoide com a zona pelúcida do oócito, além de possuir um papel importante no processo de capacitação (Calvete et al, 1997). A AWN é sintetizada pelos testículos, próstata e vesículas seminais (Sinowatz et al, 1995).
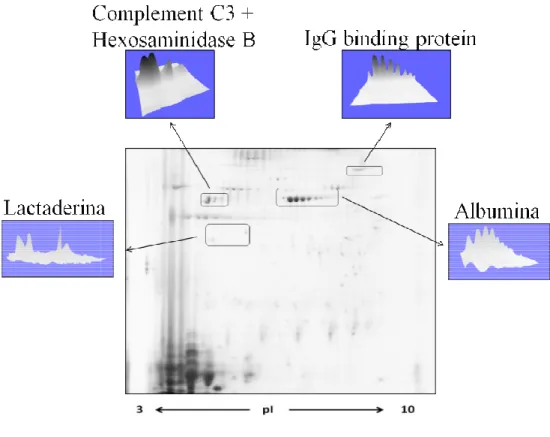
Dentre as proteínas identificadas no plasma seminal dos suínos se tem a albumina que é uma molécula de alto peso molecular (76,1 –78 kDa). Segundo Murase et al, (2007) pode ser um componente importante para a sobrervivência dos espermatozoides, porque junto a superóxido dismutase e a glutatione peroxidasa também conhecida como “Epididymal secretory glutathine peroxidade precursor”, protegem a membrana plasmática do espermatozoide da peroxidação. Como é bem sabido que a liberação das espécies reativas de oxigênio (ROS) forma parte do funcionamento normal das células, mas quando produzidas em excesso, estas moléculas são prejudiciais, é por isso que deve existir um mecanismo de defesa do organismo contra as ROS. Moura et al, (2012) identificaram no plasma seminal de carneiros, que a albumina, a peroxirredoxina e a superóxido desmutase junto com a transferrina e a lactotransferrina, protegem o espermatozoide contra o estresse oxidativo. Este mesmo sugere que a albumina no epidídimo, além de proteger a membrana plasmática contra a peroxidação lipídica, mantém alto os níveis de ATP do espermatozoide. A transferrina e a lactotransferrina são proteínas secretadas pelas células de Sertoli, o epitélio do epidídimo e as glândulas sexuais acessórias (Wakabayashi et al, 1999). Estas proteínas são aceptores de ferro quelatado que circula livremente. Esta captura do ferro impede a peroxidação lipídica dos espermatozoides. A captura do ferro por estas duas proteínas as classifica também como defensoras contra agentes patogênicos, já que este é um íon essencial para o crescimento de microorganismos patogênicos (Moura et al, 2012).
35 opsonização para a fagocitose (Boit et al, 2003). Boite et al, (2003) analisaram a relação da fração do complemento C3 com a qualidade do sêmen dos mesmos ejaculados e não observou nenhuma associação com o número de espermatozoides, motilidade espermática, nem com a morfologia dos espermatozoides. O Fator do complemento H é uma glicoproteína plasmática de cadeia única de peptídeos (155 kDa), que tem como função principal a homeostase do sistema do complemento no plasma e a proteção das células hospedeiras e dos tecidos contra os danos causados pela ativação do complemento. Rodriguez de cordoba et al, (2004) confirmaram a presença do Fator H nos condutos genitais masculino e feminino, no plasma seminal e no fluido do ovário, e detectaram que a atividade era de 6 a 10 vezes maior nos fluidos do trato reprodutor feminino do que no plasma seminal. Já (Sakaue et al, 2010), trabalhando com suínos, demonstraram que o Fator H do plasma seminal é secretado principalmente a partir das células epiteliais das vesículas seminais e também foi detectado na região exterior do acrossoma dos espermatozoides ejaculados; os mesmo autores encontraram que o fator H do plasma seminal e o do acrossoma espermático tem a mesma atividade reguladora contra o ataque dos complementos, protegendo assim os espermatozoides do ataque do complemento tanto no trato reprodutivo masculino, como no feminino. Já o fator do complemento D, é uma enzima (superfamília da serina protease) essencial para a ativação da via alternativa do sistema do complemento C3 (Narayanan e Pitzer 1994; Jing et al. 1998).
36 Os anticorpos anti-espermatozoides pertencem quase que exclusivamente às classes das imunoglobulinas IgA e IgG. Os anticorpos IgA encontrados no sêmen ou no muco cervical têm impacto clínico maior do que os anticorpos IgG, no processo de infertilidade humana (Jaiswal et al, 1994). O total de imunoglobulinas no plasma seminal dos suínos é bastante baixo em comparação com os encontrados no soro ou outras secreções, o que pode indicar que o plasma seminal é um ambiente ideal para a sobrevivência de agentes infecciosos, incluindo PRRSV (Kaiser et al, 2000).
A ß-Microseminoproteina é uma proteína não glicosilada relativamente pequena, com uma massa molecular de 10 kDa e é uma das principais proteínas secretadas pela próstata dos suínos (Manásková et al, 2002), e sua forma monomérica foi capaz de se ligar a imunoglobulina e de ser bloquear a produção de anticorpos contra o espermatozoide, tanto no trato reprodutivo masculino como no feminino (Kamada et al. 1998). Microseminoproteina foi localizado na região acrossomal dos espermatozoides do epidídimo e sobre o flagelo dos espermatozoides ejaculados (Maňásková-Postlerová et al. 2011).
A proteina secretória do epididimo E1 foi primeiramente detectada no plasma seminal humano (Xu et al. 2008; Araki et al, 2009) a mais abundante na cauda do epidídimo de touros (Moura et al, 2007), e ovinos (Muora et al, 2010), ela tem papel fundamental no efluxo de colesterol das membranas bilipídicas dos espermatozoides, remodelando a membrana durante a maturação do espermatozoide no epidídimo, evento chave durante a maturação (Muora et al, 2012).
37 A lactadherina (P47) foi identificada nos testículos e em todas as partes do epidídimo de porcos por Petrunkina et al, (2003) por métodos de imunológicos, confirmando que o espermatozoide que é liberado para o lúmen e transportado para o epidídimo já transporta na membrana acrossomal a molécula do P47. Os mesmos autores sugeriram que esta proteína poderia estar ativada ou desativada durante o processo da maturação pós-testicular e durante a capacitação, porém, a lactedherin está envolvida com a capacitação e a reação acrossômica.
Raymond et al, (2009) relataram que SED1 (também conhecida como lactadherin) é uma proteína de adesão, secretada no lúmen do epidídimo, onde ele cobre o espermatozoide o que depois vai facilitar o vínculo espermatozoide-oócito. No suíno conhecida como P47, foi isolada a partir de membranas plasmáticas de espermatozoides com base na sua afinidade por glicoproteínas da zona pelúcida (Ensslin et al, 1998). Raymond et al, (2009) sugeriram que a lactaderina em ratos é secretada no segmento inicial do epidídimo onde reveste o espermatozoide e, posteriormente, desempenha um papel crucial na adesão do espermatozoide na zona pelúcida.
1.5NUTRIÇAO DAS FÊMEAS
As fêmeas suínas, nos últimos 20 anos apresentaram avanços na seleção genética e na nutrição, melhorando significativamente o desempenho reprodutivo de matrizes, com uma média de 28 nascidos vivos por porca por ano nas 10 % das melhores granjas da América do Norte (Pigchamp, 2009). Entretanto, estes aumentos rápidos no tamanho da leitegada e produtividade anual de matrizes resultaram em aumento do número de leitões de baixo peso ao nascimento.
38 número de natimortos, dificuldades durante o parto e baixo peso ao nascer dos leitões. Deficiência de selênio resulta em infertilidade, aborto e retenção de placenta (Bedwal e Bahuguna 1994).
Os requerimentos nutricionais de micro minerais são estabelecidos em fases curtas (lactação, gestação) sem considerar a vida produtiva como um todo e o desgaste da matriz ao longo do tempo. Neste contexto, a reavaliação das exigências de micro minerais se torna mais indispensável visto o profundo impacto em cada fase produtiva da matriz suína e em sua progênie. Portanto, há uma grande oportunidade para melhorar a lucratividade de operações suinícolas pelo aprimoramento de sua estratégia de nutrição micro mineral para matrizes.
39
CAPÍTULO
2
Proteínas do plasma seminal de cachaços adultos e associações com os parâmetros seminais.
(Seminal plasma proteins of adult boars and correlations with sperm parameters)
Verónica G. Cadavid, Jorge A. M.Martins, Frederico B. Moreno, Tiago Silva Andrade, Antonio Carlos L. Santos, Ana Cristina O. Monteiro-Moreira, Renato A. Moreira, Arlindo
A. Moura*
40
RESUMO
41 parâmetros seminais. Tais relações servirão como base para a determinação de marcadores moleculares da função espermática na espécie suína.
42
ABSTRACT
The present study was conducted to identify the major seminal plasma protein profile of boars and its associations with semen criteria. Semen samples were collected from 12 adult boars and subjected to evaluation of sperm parameters (motility, morphology, vitality and percent of cells with intact acrosome). Seminal plasma was obtained by centrifugation, analyzed by 2-D SDS-PAGE and proteins identified by mass spectrometry (electrospray ionization quadrupole-time-of-flight). We tested regression models using spot intensities related to the same proteins as independent variables and semen parameters as dependent variables (p < 0,05). One hundred and twelve spots were indentified in the boar seminal plasma gels, equivalent to 39 different proteins. Spermadhesins PSP-I, PSP-II, AQN1, AQN3 and AWN1 represented 45,2 ± 8 % of the total intensity of all spots. Other proteins expressed in the boar seminal plasma include albumin, complement proteins (complement factor H precursor, complement C3 precursor and adipsin/complement factor D), immunoglobulins (IgG heavy chain precursor, immunoglobulin delta heavy chain membrane bound form, immunoglobulin gamma-chain, Ig lambda chain V-C region PLC3 and CH4 and secreted domain of swine IgM), IgG-binding proteins, epididymal specific lipocalin-5, epididymal secretory protein E1 precursor, epididymal secretory glutathione peroxidase precursor, transferrin, lactotransferrin and fibronectin type 1 (FN1). Based on regression analysis, the percentage of sperm with midpiece defects was related to the amount of CH4 and secreted domains of swine IgM and FN1 (R² = 0,58), IgG-binding protein (R² = 0,61), complement factor H precursor (R² = 0,61) and lactadherin (R² = 0.45). The percentage of sperm with tail defects was also related to CH4 and secreted domains of swine IgM and FN1 (R² = 0,40), IgG-binding protein (R² = 0,34) and lactadherin (R² = 0,74). Sperm motility, in turn, had association with the intensities of spots identified as lactadherin (R² = 0,48). In conclusion, we presently describe the major proteome of boar seminal plasma and significant associations between specific seminal plasma proteins and semen parameters. Such relationships will serve as the basis for determination of molecular markers of sperm function in the swine species.
43
2.INTRODUÇÃO
A inseminação artificial (IA) é a técnica mais importante para o melhoramento genético e alta produção de leitões na indústria de suínos (Erikson et al, 2000; Gerrits et al, 2005) mas, na atualidade, utiliza-se o sêmen resfriado, já que o espermatozoide dos suínos sofre danos tanto na membrana como nas organelas durante o processo de congelação, fato que ocasiona reduzida capacidade de fertilização e consequente diminuição da taxa de prenhez e tamanho da leitegada (Erikson et al, 2000). O conhecimento de fatores ou substâncias que estabilizem ou protejam os espermatozoides e o processo da fertilização é fundamental na produção animal. Portanto, inúmeras técnicas e trabalhos de pesquisa vêm sendo desenvolvidos com a expectativa de dispor de marcadores que auxiliem a indicação do potencial reprodutivo do animal além de obter produtos que possam ser usados para melhorar os métodos de avaliação dos reprodutores.
44
3MATERIALEMÉTODOS
3.1 Animais
O experimento foi conduzido em uma granja comercial de suínos ao Nordeste do Brasil (Xerez Avicola, Ltda; Maranguape – CE;03° 54' 46" S, 38° 39' 19,8" W). Empregou-se 12 cachaços Empregou-sexualmente maduros, usados na rotina de coleta de sêmen para IA, alojados em baias individuais (3.1 x 2.5 m) equipados com sistema de ventilação. Os animais foram alimentados com 2 kg/dia com uma dieta de acordo com as exigências nutricionais mínimas para suínos adultos e recebiam água ad libitum.
3.2 Avaliação seminal
O sêmen dos animais foi coletado pelo método da mão enluvada (Shipley, 1999). Uma alíquota de 20 µl foi colocada sobre uma lâmina e coberta com uma lamínula, ambas aquecidas a 37 °C, e utilizando microscópio de contraste de luz (200 x) para avaliar a motilidade total espermática (MOT) (Krause, 1996) e o vigor espermático (VIG; Scheid, 1993). A concentração espermática foi determinada usando a câmara de Neubauer e a porcentagem de espermatozoides vivos, mortos e o estado do acrossoma foram avaliados usando o método de tripan azul/giemsa (Kovács e Foote, 1992). Neste caso, as células espermáticas foram avaliadas por microscópio de luz (1000 x) e clasificadas da seguinte forma: células vivas com acrossoma intacto (LIA), células vivas com dano no acrossoma (LDA) e células mortas (D).
45 fixadas numa solução de formaldeído a 1 %. Uma alíquota (20 µL) desta mistura foi colocada sobre uma lâmina e coberta com uma lamínula e posteriormente avaliadas por microscópio optico (1000 x). Neste caso, avaliou-se a porcentagem de espermatozoides com cauda reta e cauda enrolada, contando-se 200 células por ejaculado (Lechniak et al, 2002).
3.3 Quantificação da concentração de proteína total no plasma seminal
Inicialmente, uma curva analítica de calibração foi obtida a partir de soluções padrões, com concentrações de proteína conhecidas, encerrando 0, 125, 250, 500, 750, 1000, 1500 e 2000 µg/mL de albumina sérica bovina (BSA) mL-1. A cada 20 µL padrão, 1,0 mL do reagente de Bradford (Bradford, 1976) foi adicionado, e as leituras de absorbância feitas a 280 nm (NanoDrop 2000c Spectrophotometer, Thermo Fisher Scientific, Wilmington, USA), após 10 minutos de incubação. A curva de calibração foi estabelecida pelas médias das triplicatas das absorbâncias obtidas, gerando uma equação linear de absorbância versus concentração (R² = 0,9761) pela qual foi possível a determinação do teor de proteínas totais em cada uma das amostras experimentais. A quantificação dos teores de proteína as amostras foram diluídas na proporção de 1:20 (v/v), em água milli-Q (Millipore, Billerica, MA, USA). Vinte µL da amostra diluída foi misturada com 1,0 mL do reagente de Bradford. Após 10 minutos, leituras em 280 nm foram feitas e a média das triplicatas usadas para o cálculo do teor de proteína de cada amostra.
3.4 Eletroforese bidimensional de proteínas do plasma seminal
(4-(2-46 aminoethyl) fluoreto de benzeno), pepstatina A, E-64, bestatina, leupeptina e aprotinina (Sigma-Aldrich, St. Louis, USA) (Martins et al, 2013). As amostras de sêmen foram centrifugadas a 800 g, 4 ºC, por 15 minutos, para separação do plasma e espermatozoides. O plasma seminal foi transferido para tubos novos e centrifugados a 5000 g, 4 °C, por 60 minutos, para a retirada de “debris” e possíveis espermatozoides ainda existentes. As amostras foram aliquotadas em volumes de 1 mL, acondicionadas em microtubos de 1,5 mL e mantidas a -20 ºC.
Um volume do plasma seminal contendo 750 µg de proteína total foi adicionado ao tampão de hidratação (8M uréia, 1M tiouréia, 2 % CHAPS, 10 % glicerol, 2 % anfólitos na faixa de pH 3 a 10 não linear, 25mM DTT e 0,002 % de azul de bromofenol) em uma quantidade suficiente para 450µl. Essa solução foi adicionada às canaletas da bandeja de hidratação e incubada com tiras de gradiente de pH imobilizado (GE Lifesciences, USA) de 24cm, com faixa de pH não linear de 3 a 10, por um período de aproximadamente 20 horas. A focalização isoelétrica foi conduzida em um equipamento IPGphor III (GE Lifesciences, USA) com a seguinte programação: 200V (60 min.), 1000V (60 min. gradiente), 7000V (30 min. gradiente), 7000V (60000 Vh) e 100V (12:30 hr.), totalizando 64.700 Vh. Após a focalização, as tiras foram equilibradas no tampão de equilíbrio I (6M uréia, 50mM Tris-HCl pH 8.8, 29, 3 % glicerol, 2 % SDS e 1 % DTT) por 15 minutos e em seguida incubadas por mais 15 minutos com a solução de equilíbrio II (mesma composição da solução I, substituindo-se o DTT por 2,5 % de iodoacetamida). Após a etapa de equilíbrio, as tiras foram posicionadas no topo de géis homogêneos de poliacrilamida (12,5 %) e fixadas em agarose (5 % em SDS-PAGE tampão de corrida). O conjunto foi submetido à corrida eletroforética a 500 V, com 40 mA por gel (EttanTMDaltSix (GE Lifesciences, USA).
47 solução final por 72 h. Os reagentes utilizados para as eletroforeses e coloração dos géis foram adquiridos da Bio-Rad Laboratories (USA), GE Lifesciences (USA) e/ou Sigma-Aldrich (USA).
3.5 Análises das imagens
Os géis bidimensionais foram digitalizados a 600 dpi (Image Scanner III; GE Life sciences, USA) em modo transparente e as imagens armazenadas em arquivo do tipo .tiff para posterior avaliação com o software PDQuest, version 7.3.0 (Bio-Rad, USA). Seguindo uma metodologia anteriormente descrita em detalhe (Moura et al, 2006a, 2006b, 2007, 2010; Souza et al, 2010, 2012; van Tilburg et al, 2013). Para esta análise, foi utilizado um grupo de 24 géis, doze géis antes da suplementação (D0) e doze géis 60 dias após a suplementação (D60). O master gel foi baseado num gel do período D60 e outras proteínas consistentemente presentes nos outros mapas foram adicionadas ao gel mestre. Além disso, as proteínas presentes nas principais regiões dos géis foram usadas como pontos de referência para que as proteínas fossem bem adaptadas em cada membro do match set. A quantificação dos spots das proteínas nos géis foram dadas em partes por milhão (ppm) de densidade óptica integrada do total de pontos, de acordo com PDQuest.
3.6 Digestão dos spots protéicos dos géis 2-D
48 ambiente e secados em “speed vacuum” (Eppendorf, Hauppauge, NY, USA). Os pedaços de gel foram incubados com tripsina (20 ng por spot, Promega, cat # V511; Madison, WI, EUA) durante 20 horas a 37 °C. Após a incubação final, os peptídeos foram extraídos por três lavagens com ácido trifluoroacético a 5 %, acetonitrila 50 %, em bicarbonato de amónio (50 mM). Os sobrenadantes foram concentrados em micro tubos usando um concentrador a vácuo “speed vacuum” (Eppendorf, Hauppauge, NY, USA). Um pedaço de gel em branco, sem spots, e um pedaço de albumina do marcador de peso molecular foram submetidos ao mesmo procedimento e utilizados como controle positivo e negativo, respectivamente.
3.7 Identificação das proteínas por espectrometria de massa (Electrospray ionization quadropole-time-of-flight)
Como anteriormente descrito (Souza et al, 2012; Martins et al, 2013; van Tilburg et al, 2013), as digestões proteolíticas (5 µL) foram injetados em solvente A (acetonitrila / água / ácido fórmico, 5/95/0.1) fornecido pela bomba auxiliar da unidade de HPLC capilar e preso em uma coluna Waters Symmetry 300 TM (C-18, 5 µm filme, 0.3 mm x 5 mm) para a dessalinização em linha e a pré-concentração. Após lavagem por 3 minutos com solvente A em 5 µL / min, os péptidos presos foram levados de volta através do fluxo de solvente com gradiente para a coluna analítica, HSS T3 (fused sílica capillary, C-18 5 µm, 0,075 mm x 150 mm ), usando uma válvula de comutação de 10 portas. A coluna analítica foi executada em gradiente (5 a 80 % de solvente B; acetonitrila/água/ácido fórmico; 95/5/0.2; por 40 min). O espectrômetro de massa foi calibrado usando fragmentos de ions do produto Glu-Fib conforme necessário para manter a precisão da massa dentro de 10 partes por milhão.
49 de dados de espectrometria de massa MS/MS (tandem), uma varredura (1,5 seg.) Sobre o m/z de 400-1500 foi realizada. A partir de cada levantamento de varredura, até três ions precursores mais intensos, com base nos critérios de seleção foram escolhidos para a espectrometria de massa em MS/MS (tandem) para obter os espectros de produção resultantes da dissociação induzida por colisão na presença de árgon. Os produtos do espectro de íons (6-8 segundos) coletados foram processados utilizando proteína Lynx global Server 2.1 e a lista de picos foi convertida para arquivos de texto para a busca de dados. A fim de identificar as proteínas, as pesquisas de ions de MS/MS foram realizadas sobre os espectros processados contra as bases de dados Swissprot e NCBInr utilizando MASCOT Daemon na plataforma de busca Matrix Science (Inc., Boston, MA, EUA). As pesquisas foram feitas usando o banco de dados NCBInr com o pressuposto de que havia um máximo de uma falta clivagem tripsina e peptídeos que foram mono-isotópico. As modificações pós-traducionais variáveis consideradas foram oxidação da metionina e carbamidometilação dos resíduos de cisteína como modificações fixa. A tolerância dos péptidos da massa e a tolerância dos fragmentos de massa foram inicialmente definidas para 0.1 e 0,1 Da, respectivamente, por MS/MS de íons da procura. No entanto, os IDs dos peptídios candidatos foram aceites apenas se os valores de m/z foram observados dentro de 0,1 Da da massa teórica da ID do candidato, como determinado e revisto manualmente os resultados da pesquisa MASCOT.
3.8 Análises de ontologia gênica
50
3.9 Análises das interações protéicas
As interações proteína-proteína (PPI) foram obtidas do banco de dados STRING (http://string-db.org) versão 9.1 (Snel et al., 2000; Santos et al., 2014). Esta base de dados é composta por interações protéicas coletadas, conhecidas e previstas, e de associações diretas (físicas) e indiretas (funcionais). A análise das interações foi feita para as espermadesinas (complexo PSP-I/PSP-II, AQN e AWN), fibronectina 1 (FN1), CH4 and secreted domain of swine IgM, IgG-binding proteine lactaderina. As análises foram realizadas com o máximo de 10 interações, utilizando a espécie Sus scrofa. Nenhuma anotação estava disponível na plataforma de STRING para CH4 and secreted domain of swine IgM e para a proteína IgG-binding, razao pela qual utilizou-se as respectivas sequências de aminoácidos obtidas no banco de dados “SwissProt”.
3.10 Análise das interações proteína - proteína através da base de dados do Metacore
51
3.11 Análise estatística
Foram testados os modelos de regressão linear e quadrática, usando a soma da intensidade dos spots pertencentes à mesma proteína como variável independente e parâmetros seminais como variáveis dependentes (Proc Reg; SAS, v 9.0, 2002). Todos os parâmetros dos modelos foram testados para a normalidade da distribuição dos resíduos pelo teste de Shapiro-Wilk, assimetria e curtose (Proc UNIVARIATE, com a opção NORMAL; SAS, v. 9.0, 2002). Apenas as variáveis independentes com p < 0,05 e resíduos com distribuição normal foram incluídas nos modelos de regressão.
4RESULTADOS
4.1 Parâmetros seminais
52
4.2 Proteínas do plasma seminal
Em média, foram detectados 245,8 ± 69,5 spots por gel do plasma seminal dos suínos (Figura 1), onde 36 destes spots estiveram presentes consistentemente em todos os géis 2-D corados com azul de coomassie. A intensidade destes spots representou 35,6 ± 7,9 % do total da intensidade de todos os spots detectados nos mapas. Cento e doze spots, o que equivale a 45,6 % da intensidade de todos os spots detectados no gel master, foram identificados por espectrometria de massa e corresponderam a 39 proteínas diferentes (Figura 1, Tabela 1, Tabela Supl. 1). Um grupo de spots de baixo peso molecular e de pI ácido (15,3 – 25,1 kDa; pI3 – 5,3, caixa em Figura 1A e Figura 1B) representaram 78 ± 13,1 % do total da intensidade dos spots detectados nos géis 2-D. Spots identificados como espermadesinas PSP-I, PSP-II (Chain B, the crystal structures of two members of the spermadhesin family reveal the folding of the CUB domain), AQN-1, AQN-3 e AWN-1 formaram, em conjunto, o grupo mais abundante de proteínas no plasma seminal dos suínos (45,2 ± 8 % do total da intensidade) e detectadas principalmente no agrupamento descrito acima.
54 (B)
55
56
Tabela 1: Proteínas do plasma seminal de suinos (Sus scrofa) identificadas por eletroforeses bidimensional e espectrometria de massa. A tabela inclui os spots detectados em géis de 24 cm, na faixa de pH 3-10. Os números e os nomes das proteínas referem-se aos apresentados na figura 1.
# Proteins NCBI accession
number
MS/MS protein score
Sequence covered (%) 01 Spermadhesin PSP-I
Spot 01 108346 362 65
Spot 02 108346 325 54
Spot 03 108346 189 36
Spot 04 108346 422 65
Spot 05 108346 374 65
Spot 06 108346 407 66
Spot 07 108346 381 66
Spot 08 108346 294 54
Spot 09 108346 402 65
Spot 100 47523176 243 37
Spot 101 47523176 116 21
Spot 104 108346 77 29
Spot 105 108346 294 54
Spot 106 108346 305 65
Spot 107 108346 251 55
Spot 108 108346 268 54
Spot 109 108346 260 45
Spot 111 47523176 69 18
02 Chain B, The Crystal Structures Of Two Members Of The Spermadhesin Family Reveal The Folding Of The Cub Domain
57
Spot 03 3318759 251 42
Spot 04 3318759 305 42
Spot 05 3318759 170 42
Spot 06 3318759 111 31
Spot 07 3318759 70 9
Spot 08 3318759 173 34
Spot 09 3318759 73 9
Spot 10 3318759 523 73
Spot 11 3318759 429 58
Spot 12 3318759 472 58
Spot 37 3318759 164 34
Spot 38 3318759 126 24
Spot 39 3318759 64 9
Spot 40 3318759 99 24
Spot 41 3318759 121 24
Spot 61 3318759 202 42
Spot 62 3318759 274 54
Spot 89 3318759 59 9
Spot 97 3318759 66 9
58
Spot 99 3318759 69 9
Spot 100 3318759 70 9
Spot 103 3318759 65 9
Spot 104 3318759 91 17
Spot 105 3318759 158 34
Spot 106 3318759 127 24
Spot 107 3318759 147 24
Spot 108 3318759 80 9
Spot 109 3318759 208 42
Spot 112 3318759 84 24
Spot 120 3318759 60 24
Spot 128 3318759 215 42
Spot 129 3318759 105 24
Spot 130 3318759 365 44
03 AQN-1
Spot 130 114082 45 7
04 AQN-3
Spot 10 72535165 147 36
Spot 11 72535165 138 48
59
Spot 128 72535165 216 64
05 AWN-1
Spot 10 248304 44 12
Spot 12 248304 80 19
Spot 128 248304 150 20
06 Complemet C3 precursor [Susscrofa]
Spot 32 47522844 692 13
Spot 33 47522844 71 2
Spot 34 47522844 319 5
Spot 35 47522844 342 6
Spot 54 47522844 101 2
Spot 69 47522844 504 7
Spot 80 47522844 167 2
07 Complementfactor H precursor [Susscrofa]
Spot 88 47523636 165 2
Spot 89 47523636 445 13
Spot 90 47523636 81 2
Spot 123 47523636 674 16
Spot 124 47523636 510 10
60
Spot 126 47523636 105 5
Spot 127 47523636 97 2
08 Adipsin/complement factor D [Susscrofa]
Spot 113 773265 152 30
09 Fc fragment of IgG binding protein
Spot 55 545830918 211 2
Spot 56 545830918 271 4
Spot 57 545830918 540 7
Spot 58 545830918 170 2
Spot 59 545830918 113 1
Spot 60 545830918 159 2
10 Predicted: IgGFc-binding protein-like
Spot 73 545830921 95 7
11 IgG heavy chain precursor [Susscrofa]
Spot 37 441477616 424 26
Spot 38 441477616 368 22
Spot 39 441477616 314 26
Spot 40 441477575 275 18
Spot 41 441477575 326 24
Spot 129 441477575 413 24
61
Spot 112 89216 54 19
Spot 116 89216 107 28
Spot 117 89216 96 24
13 Immunoglobulin gamma-chain [Susscrofa]
Spot 87 164503 75 3
14 Immunoglobulin delta heavy chain membrane bound form, partial [Susscrofa]
Spot 25 22774002 152 5
15 ch4 and secrete domains of swine IgM [Susscrofa]
Spot 22 1236646 184 10
Spot 25 1236646 175 13
Spot 87 1236646 277 21
16 Lactotransferrin [Susscrofa]
Spot 61 41688298 798 27
Spot 62 41688298 1094 35
17 Transferrin [Susscrofa]
Spot 26 833800 712 26
Spot 27 833800 1155 49
Spot 28 833800 1341 43
Spot 29 833800 1272 47
Spot 30 833800 48 4