P DEPA P RESPOST PEROXIDA UN ARTAMEN PROGRAM TA ANTIO ASES DE A
NIVERSID CEN NTO DE BI MA DE PÓ
JULIANA
OXIDANTE ASCORBAT
DADE FEDE NTRO DE C IOQUÍMIC ÓS-GRADU
A RIBEIR
E DE RAÍZ TO DO CI
OSMÓT
FORTAL 2014
ERAL DO CIÊNCIAS CA E BIOL UAÇÃO EM
RO DA CUN
JULIANA RIBEIRO DA CUNHA
RESPOSTA ANTIOXIDANTE DE RAÍZES DE ARROZ DEFICIENTES EM PEROXIDASES DE ASCORBATO DO CITOSOL AOS ESTRESSES SALINO E
OSMÓTICO
Dissertação apresentada ao Programa de Pós-Graduação em Bioquímica da Universidade Federal do Ceará, como requisito parcial à obtenção do título de mestre em Bioquímica. Área de concentração: Bioquímica vegetal.
Orientador: Prof. Dr. Joaquim Albenísio Gomes da Silveira.
FORTALEZA
AGRADECIMENTO
À CAPES, pelo apoio financeiro com a manutenção da bolsa de auxílio.
Ao Prof. Dr. Joaquim Albenísio Gomes da Silveira, pela excelente orientação,
confiança e por me proporcionar momentos de intensa aprendizagem científica e humana;
À Profa. Dra. Márcia Márgis-Pinheiro, chefe do Laboratório de Genética da
UFRGS, pela receptividade e auxílio ao desenvolvimento deste trabalho;
Aos professores: Dra. Cristiane Elizabeth C. de Macedo, Dr. Eduardo Luiz Voigt
e Dr. Josemir Moura Maia, que foram essenciais para o início da minha caminhada científica,
me proporcionando excelentes exemplos de profissionalismo e paixão pela ciência;
Aos professores participantes da banca examinadora: Dr. André Luis Coelho da
Silva e Dra. Cristina Silva de Lima pela disponibilidade e valiosas sugestões;
Ao programa de pós-graduação em Bioquímica da Universidade Federal do
Ceará, pela oportunidade de realização do Mestrado;
A todos que fizeram ou fazem parte do LABPLANT, que de alguma forma
contribuíram para a realização deste trabalho: Adilton, Ana Karla, Cris, Cynthia, Fabrício,
Girlaine, Glaydson, Jamyla, João Victor, Jones, Jordânia, Lara, Márcio, Milton, Petterson,
Rachel, Rafael, Tathiana e Yugo;
Ainda, aos amigos: Rachel, Jordânia, Girlaine, Cynthia, Cris, Tathiana, Ana
Karla, Lara, Cibelley, Ana Paula, Lisiane e Thiago pelo apoio, amizade e incentivo;
Aos eternos amigos de infância: Cássio, Clara, Débora, Ênia, Gille e Juan, que,
apesar da distância física, sempre estiveram comigo e torceram incondicionalmente por mim
em todos os momentos da minha vida pessoal e profissional;
Aos membros do Laboratório de Genética da UFRGS, em especial a Douglas
Jardim Messeder, pelo valioso auxílio, discussões científicas e carinho;
A Milton Costa Lima Neto, pela grande ajuda e colaboração tanto na bancada
quanto na parte escrita. Pela compreensão, paciência, amor e, principalmente,
companheirismo diário, que foi essencial para que eu conseguisse manter o foco e a
determinação nessa reta final. Muito obrigada por acreditar em mim;
À toda a minha família, em especial a minha mãe Ana Paula Melo Ribeiro, que
me apoiou incondicionalmente, mesmo que a distância, e não me deixou desistir diante as
dificuldades;
“A persistência é o menor caminho para o
êxito”.
RESUMO
Os estresses salino e osmótico são responsáveis por perdas significativas na produção
agrícola, particularmente nas regiões semiáridas. Nessas condições, a raiz é o órgão da planta
que sofre os primeiros efeitos e é responsável pela percepção e sinalização bioquímica dos
estresses. Em folhas, as peroxidases do ascorbato do citosol são as principais isoformas
envolvidas com a proteção antioxidativa contra o excesso de H2O2 e são também relacionadas
na sinalização em condições de estresses. Entretanto, esses mecanismos de ação em raízes são
pouco conhecidos. O objetivo deste estudo foi testar a hipótese de que as APXs citosólicas
são essenciais para a proteção antioxidativa de raízes de arroz expostas às condições de
estresse salino e osmótico. Para isso, plantas transgênicas silenciadas nas duas isoformas de
APXs citosólicas (APX1/2) e plantas não transformadas (45 dias de idade) foram expostas a
duas condições de estresse: (1) NaCl e manitol em concentrações iso-osmóticas (-0,62 MPa)
durante oito dias e (2) manitol 268 mM (-0,62 MPa) por dois dias. Em plantas silenciadas, a
quantidade de transcritos (RNAs) de OsAPX1 e OsAPX2 foi reduzida em 90% enquanto que a abundância das duas proteínas mensurada por western blotting não foi detectável. A atividade
total de APX foi diminuída em 66% em comparação com as NTs na condição controle,
evidenciando que o silenciamento foi efetivo nas raízes. Como consequência da deficiência
das APX1/2, o nível de H2O2 foi aumentado em 51% comparado com as NTs. Ambos os
estresses afetaram de modo similar o crescimento da raiz e parte aérea das APX1/2, em
comparação com as plantas não transformadas (NT). Os valores de danos de membrana nas
raízes foram aumentados na mesma intensidade nos dois genótipos e nos dois tipos de
estresses, indicando que as APX1/2 apresentaram mesma sensibilidade aos estresses
estudados. Nas plantas NT, as quantidades de transcritos de OsAPX1 e OsAPX2 foram aumentadas discretamente por NaCl e manitol enquanto que a atividade de APX foi
aumentada somente pelo NaCl. As plantas APX1/2 mostraram a mesma tendência das NTs
quanto a expressão e atividade de APX. O aumento na quantidade relativa dos transcritos das
outras isoformas de APX, principalmente de OsAPX3, OsAPX5 e OsAPX8, em ambos os
genótipos sob estresse salino, foi correlacionado com o aumento da atividade da APX. Além
disso, outras peroxidases (GPX e GPOD) apresentaram a mesma tendência de aumento de
atividade apenas sob estresse salino. Diferentemente, manitol induziu um aumento
proeminente na atividade de catalase nas plantas NT enquanto que nas APX1/2 essa enzima já
apresentava atividade aumentada antes do estresse e permaneceu no mesmo nível. As
de NaCl. O nível de TBARS (indicador de peroxidação lipídica) foi mantido inalterado na
presença dos dois estresses e nos dois tipos de plantas. Os resultados deste estudo, quando
analisados em conjunto, mostram que raízes de arroz expostas aos estresses salino e osmótico
exibiram respostas complexas em termos de metabolismo redox. Aparentemente, as duas
APXs citosólicas não são essenciais para a proteção antioxidativa, uma vez que as plantas
mutantes apresentaram uma performance fisiológica semelhante as plantas NT. As respostas
aos dois fatores de estresse, NaCl e manitol, foram contrastantes nos dois genótipos,
sugerindo que diferentes mecanismos de proteção antioxidante foram acionados para cada
tipo de estresse.
ABSTRACT
Salt and osmotic stresses are responsible for significant losses in agriculture, particularly in
semiarid regions. In such conditions, roots are the first plant organ in contact with the stress
and are responsible for perception and signaling. In leaves, cytosolic ascorbate peroxidases
(APX) are the main isoforms involved with antioxidative defence against H2O2 excess and
signaling under stressful conditions. Nevertheless, such metabolic mechanisms in roots are
still unknown. The aim of this study was to test the hypothesis that cytosolic APX isoforms
are essential to antioxidant protection in rice roots exposed to salt and osmotic stresses. To
test this hypothesis, rice mutants double silenced for cytosolic APXs (APX1/2) and
non-transformed plants, both with 45 day-old, were submitted to two stressful treatments: (1)
NaCl and mannitol in iso-osmotic concentrations (-0.62MPa) for eight days and (2) mannitol
268 mM (-0.62MPa) for two days. In mutant plants, OsAPX1 and OsAPX2 transcript amounts (RNAs) were reduced by 90% whereas both protein abundance measured by Western blotting
were not detectable. Under control conditions, total APX activity was reduced by 66% in
comparison with NT plants, showing that the silencing was effective in roots. In APX1/2
roots, H2O2 level was increased by 51% as a consequence of APX1/2 silencing. Both stresses
affected similarly root and shoot growing compared with NT. Membrane damage was
increased at the same level in both genotypes and in both stresses, showing that APX1/2 were
as sensible as NT plants. In NT roots, OsAPX1 and OsAPX2 transcript amounts was slightly
increased by NaCl and mannitol whereas only NaCl increased APX activity. Under salt stress,
both genotypes increased other APX isoforms, especially OsAPX3, OsAPX5 and OsAPX8. These increases were correlated with the increased APX activity. In addition, other
peroxidases (GPX and GPOD) displayed the same trend as APX, increasing their activity in
response to NaCl. On the other hand, mannitol induced a prominent increase in catalase
activity in NT plants, while in APX1/2 plants CAT activity did not changed. The H2O2
content was increased in both genotypes exposed to mannitol treatments, and was reduced for
NaCl. TBARS level was not altered in the presence of both stresses for both genotypes. This
study shows that rice plants exposed to salt or osmotic stresses display complex responses
regarding to redox metabolism. Apparently, both cytosolic APXs are not essential to
antioxidative protection, since mutant plants presented similar physiological performance to
NT plants. The responses to both stresses, NaCl and mannitol, were contrasting for both
genotypes, suggesting that different mechanisms of antioxidative protection were triggered for
LISTA DE ILUSTRAÇÕES
Figura 1 – Modelo atual de sinalização de S.O.S. em células de raízes para a manutenção da
homeostase iônica e desenvolvimento de raízes laterais 17
Figura 2 - Ciclo ascorbato-glutationa 21
LISTA DE TABELAS
Tabela 1- Espécies reativas de oxigênio (EROS) ... 18
SUMÁRIO
1 INTRODUÇÃO ... 13
CAPÍTULO I ... 14
2 REVISÃO DE LITERATURA ... 15
2.1 Efeitos do estresse salino e osmótico em raízes de plantas ... 15
2.1.1 Percepção e sinalização em resposta ao estresse iônico e osmótico ... 16
2.2 Espécies reativas de oxigênio e seus sítios de produção em raízes ... 18
2.3 Mecanismos de remoção de EROs ... 20
2.4 Peroxidases do ascorbato ... 22
2.4 H2O2 como molécula sinalizadora intracelular ... 23
2.5 O modelo vegetal (Oryza sativa L.) ... 24
2.1.1 Uso do mutante (APX1/2) ... 25
REFERÊNCIAS ... 27
CAPÍTULO II ... 35
Roots from rice plants silenced to cytosolic APX1/2 display compensatory mechanisms to cope with salt and osmotic stresses ... 35
Abstract ... 36
Introduction ... 37
Materials and methods ... 39
Construction of the plant vector and plant transformation ... 39
Plant growth and treatments ... 40
Statistical analyses and experimental design ... 40
Na+ and K+ content, H2O2 concentration, electrolyte leakage and TBARS (lipid peroxidation) determinations ... 41
Quantitative real‐time PCR (qRT‐PCR) ... 41
Protein extraction and enzyme activity assays ... 41
SDS page and Western blotting ... 43
Results ... 43
Comparative effects of iso‐osmotic solutions of NaCl and mannitol in roots of NT and cytosolic
APX 1/2 silenced rice roots ... 44
NaCl and mannitol triggered different effects on the expression of OsCATA, OsCATB and OsAPX ... 45
Activities of peroxidases were modulated differently in NT and APX1/2 plants under NaCl and mannitol stresses ... 46
Mannitol short‐term exposure induces membrane damage but did not cause oxidative stress and did not change activities of peroxidases in both genotypes ... 46
Discussion ... 47
Acknowledgments ... 50
References ... 51
Tables ... 57
Figures ... 62
Supplementary figures ... 69
1 INTRODUÇÃO
Plantas estão constantemente regulando suas respostas aclimatativas às mudanças
ambientais através de um complexo conjunto de reguladores bioquímicos, que participam de
maneira integrada em processos fisiológicos e de desenvolvimento (Choi et al., 2014). Por exemplo, a solução do solo é altamente heterogênea e as raízes reagem de maneira
generalizada a tais estímulos irregulares. Na superfície de contato das raízes com o solo, é
possível encontrar microrregiões apresentando condições estressantes, como variações
osmóticas ou elevados níveis de sais, que emitem estímulos individuais em cada raiz. Porém,
tais estímulos devem ser percebidos, sinalizados e respondidos pela planta como um todo, na
tentativa de modular suas respostas metabólicas às condições estressantes (Fujita et al., 2006). No sistema radicular, várias alterações metabólicas são observadas quando as plantas
são expostas a estresses abióticos (Maia et al., 2013). Frequentemente, observa-se o aumento da geração de espécies reativas de oxigênio (EROs), implicadas em diversos fenômenos de
sinalização, homeostase e morte celular (Møller et al., 2007). Esta acumulação altera as concentrações de antioxidantes enzimáticos e não-enzimáticos, que atuam juntos para
eliminar níveis elevados de EROs (Hernandez et al., 2010).
As peroxidases do ascorbato (APX) participam do processo de remoção de H2O2
através do ciclo ascorbato-glutationa (Mittler & Poulus, 2005). Diferentes isoformas desta
enzima podem ser encontradas no citosol, mitocôndria, peroxissomos e cloroplastos, sendo as
citosólicas as isoformas mais abundantes (Teixeira et al., 2006). Neste trabalho, plantas de arroz silenciadas para as isoformas citosólicas de APX através da técnica de RNAi foram
utilizadas com o objetivo de compreender melhor o papel das APX citosólicas (APX1/2) em
raízes expostas ao estresse salino e osmótico.
Atualmente, a maioria dos trabalhos devotados ao entendimento da resposta
antioxidativa da planta sob condições de estresse são realizados em folhas (Chawla, Jain &
Jain, 2013; Fan et al., 2014). Existe uma deficiência notável quanto ao número de trabalhos que avaliam processos como vias de sinalização e mecanismos de dano e reparo no sistema
radicular. Adicionalmente, devido ao metabolismo oxidativo ser similar na maioria das
plantas superiores, pouco se sabe a respeito da integração e funcionamento entre organelas e
citosol de raízes, especialmente sob condições de estresse oxidativo induzido por salinidade e
estresse osmótico (Mittler, 2002). Assim, esse estudo se propõe a contribuir na elucidação das
relações entre o metabolismo oxidativo de raízes de plantas duplamente silenciadas nas
CAPÍTULO I
2 REVISÃO DE LITERATURA
2.1 Efeitos do estresse salino e osmótico em raízes de plantas
A salinização do solo é um dos fatores ambientais que limitam a produtividade e a
qualidade de importantes culturas no mundo (Galvan-Ampudia & Testerink, 2011). Além
disso, as mudanças climáticas e ambientais, como alterações de temperatura e precipitações,
assim como práticas ambientais, causam rápidas modificações nos níveis de salinidade do
solo (Ji et al., 2013). Durante a evolução, várias espécies de plantas, conhecidas como halófitas, se readaptaram para a vida em ambientes altamente salinos, enquanto que a maioria
das espécies vegetais permaneceram sensíveis ao sal (glicófitas) (Flowers & Colmer, 2008).
Dentre os processos bioquímicos sensíveis ao sal, a redução da fotossíntese leva a diminuição
da fixação de carbono e, consequentemente, o crescimento e formação de biomassa na planta
(Munns & Tester, 2008).
O estresse iônico ocorre quando, na planta ou tecido, a concentração de íons Na+
alcança um patamar superior à concentração de íons K+ (Hasegawa, 2013). Este íon é
considerado o principal nutriente inorgânico catiônico em plantas e está associado ao
balanceamento de cargas no citoplasma, ativação de reações enzimáticas e regulação da
pressão de turgor. A troca do K+ pelo Na+ causa perturbações em todos os processos descritos
acima e é iniciada pela competição do Na+ pelos sítios de transporte de K+. A competição é
motivada pelas similaridades físico-químicas entre esses dois íons e culmina em uma
deficiência intracelular de K+. Neste compartimento, o Na+ compete por sítios de ligação com
o K+ e assim, inibe processos metabólicos cruciais dependentes desse íon (Hasegawa, 2013).
A salinidade afeta o crescimento das plantas, principalmente devido a presença de
um componente osmótico (Ji et al., 2013). Este componente caracteriza-se devido a presença de altas concentrações de sal que reduzem o potencial osmótico do solo, dificultando a
absorção de água pelas raízes, enquanto que o componente iônico está associado com a
acumulação gradual de sal nos tecidos, com o passar do tempo de exposição ao estresse
(Munns & Tester, 2008). Contudo, no estresse salino, não apenas o estresse osmótico está
relacionado com a redução de crescimento. Sümmer et al. (2004) encontraram evidências de que a toxicidade do Na+ (mas não o Cl-), durante as primeiras fases do estresse salino em
em níveis de íons e gerar respostas apropriadas é um requisito para a sobrevivência da planta
em ambientes salinos (Ji et al., 2013).
2.1.1 Percepção e sinalização em resposta ao estresse iônico e osmótico
Em situações de estresse salino e osmótico, as raízes constituem a primeira linha
de defesa, uma vez que representam o primeiro órgão em contato com o estresse. A via de
sinalização baseada nas proteínas SOS (“Salt Overly Sensitive”) é considerada um mecanismo central na manutenção dos níveis adequados de Na+ na célula e na homeostase iônica (Zhu,
2001). Nos anos 90, o isolamento e caracterização de vários mutantes hipersensíveis sob
condições salinas levaram a identificação das proteínas SOS3, SOS2 e SOS1, que atuam
devolvendo o Na+ para o meio extracelular e internalizando o H+ (atividade antiporte) (Zhu,
2002).
A SOS1 é a proteína central no controle do Na+ intracelular, sendo ativada e
ativando cascatas de sinalização específicas na resposta ao estresse iônico (Figura 1). Em altas
concentrações de Na+ extracelular, a atividade da SOS1 é aumentada, diminuindo o pH
apoplástico (Chung et al., 2008). Esta variação de acidez celular ativa um canal de Ca+2, aumentando o influxo deste íon (Hasegawa, 2013). Uma proteína denominada SOS3, descrita
como um sensor de Ca+2 citosólico, interage e ativa a SOS2, uma proteína quinase
serina/treonina (Maathuis, 2013). A proteína SOS2 controla o influxo de Na+ através da
inibição de canais HKT e canais não específicos de cátions (Ji et al., 2013). Os canais HKT
estão envolvidos com a absorção de Na+ nutricional principalmente em condições não-salinas.
Estudos filogenéticos demonstraram que tais transportadores podem ser classificados em dois
subgrupos dependendo da preferência pelo uniporte de Na+ (classe 1) ou pelo simporte de
Figur home direta
estim
al. C
Arab trans funci escla muito (Sree estre como respo de so abiót
ra 1 – Mod eostase iôn as enquanto
Para
mulam a acu
Carcaterizar
bidopsis tha
scritos acu
ionalidade d
arescida (H
os estudos s
enivasulu et
Um
esse osmótic
o um sinal
osta das pla
olutos comp
ticos e no c
delo atual d nica e desen
o linhas pon
a resistir a
umulação d
ram uma pr
aliana com mulados s
desta proteí
orie et al., são devotad
t al., 2007).
dos mais
co é o ácido
lizador intr
antas ao estr
patíveis (Zh controle do de sinalizaçã nvolvimento ntilhadas sug F ao estresse
de solutos c
roteína den
mo responsá
sobre cond
ína como se
2009). Em
dos a anális
conhecido
o abscísico (
racelular co
resse osmót
ao et al., 20 cresciment
ão de SOS o de raízes gerem links
Fonte: Ji et al
osmótico
ompatíveis
nominada H
ável pela pe
dições de
ensor de est
mbora o sis
e de sistem
os e melho
(ABA) (Hu
omo interce
tico. Além d
005), o ABA
to (Nambara
em células s laterais. L s entre os co
. (2013).
causado p
(Hasegawa
HK1 (histid
ercepção d
alta e ba
tresse osmó
stema senso
mas de sinais
ores sinaliza
et al., 2005 elular e as
de ser respo
A tem um p
a & Marion
s de raízes p Linha sólida
omponentes
pelo estress
a et al., 200 dina quinase
o estresse
aixa osmol
tico ainda n
or ainda se
s na respost
adores celu
5). Esta mol
sim, exerce
onsável pela
apel chave
n-Poll, 2005
para a man as indicam s representa
se salino,
00). Em 199
e) transmem
osmótico,
laridade. C
não foi com
eja alvo de
ta ao estress
ulares da r
lécula pode
er um pap
a sinalização
na resposta
5). Uma das
nutenção da regulações dos.
as plantas
99, Urao et
mbrana em
sendo seus
Contudo, a
mpletamente
pesquisas,
se osmótico
resposta ao
e atuar tanto
pel vital na
o da síntese
a a estresses
fontes de ABA são as raízes, atuando como reguladoras do crescimento, inclusive da parte
aérea (Sharp & LeNoble, 2002). A produção de ABA nas raízes pode ser causada por uma
indução do fechamento estomático em folhas e consequente redução do fluxo transpiratório,
reduzindo a acumulação de matéria seca devido limitação fotossintética (Seki et al., 2007).
Uma relação mais direta entre a redução do crescimento radicular, causada pelo
estresse salino, e o acúmulo de ABA, causado pelo estresse osmótico, envolve mecanismos
ainda não bem compreendidos. Sabe-se que o ABA pode estar relacionado com a regulação
do crescimento em raízes, através da ativação e/ou intermediação da ativação de cascatas
MAPKs juntamente com outros elementos como o Ca+2 e o H2O2 (Verslues & Zhu, 2007).
Além disso, a relação entre o Ca+2, H2O2 e ABA pode envolver quinases de proteínas
dependentes de Ca+2 (CPKs) (Sheen, 1996).
2.2 Espécies reativas de oxigênio e seus sítios de produção em raízes
As Espécies Reativas de Oxigênio (EROs) são encontradas em todos os sistemas
biológicos e são formadas a partir da redução univalente da molécula de oxigênio (O2). Essas
formas parcialmente reduzidas de O2 tais como o oxigênio singleto (1O2), o radical superóxido
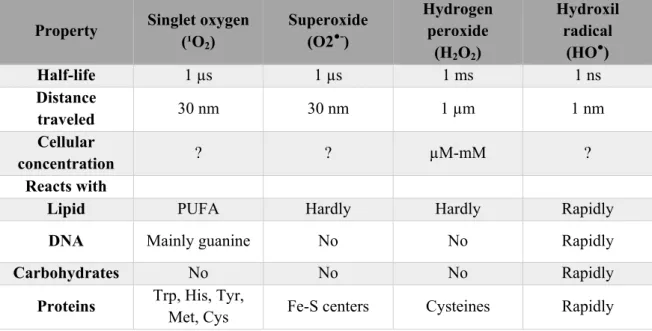
(O2-●), peróxido de hidrogênio (H2O2), o radical hidroxila (OH●) e outros citados na Tabela 1,
são EROs altamente reativas e tóxicas, podendo danificar proteínas, DNA e lipídios (Mittler
et al., 2004).
Tabela 1- Espécies reativas de oxigênio (EROs)
Property Singlet oxygen
(¹O2)
Superoxide
(O2●-)
Hydrogen peroxide
(H2O2)
Hydroxil radical
(HO●)
Half-life 1 µs 1 µs 1 ms 1 ns
Distance
traveled 30 nm 30 nm 1 µm 1 nm
Cellular
concentration ? ? µM-mM ?
Reacts with
Lipid PUFA Hardly Hardly Rapidly
DNA Mainly guanine No No Rapidly
Carbohydrates No No No Rapidly
Proteins Trp, His, Tyr,
Adaptado de Møller et al., (2007)
Em plantas, EROs são continuamente produzidas como bioprodutos de várias vias
metabólicas localizadas em diferentes compartimentos celulares, como por exemplo
cloroplastos, mitocôndrias e peroxissomos (Foyer & Noctor, 2013). Devido a alta atividade
metabólica destes compartimentos, sob condições fisiológicas equilibradas, EROs são
comumente eliminadas através de diferentes componentes antioxidativos presentes em tais
organelas (Møller et al., 2007). O equilíbrio entre a produção e a eliminação de EROs pode ser perturbado por diversos fatores ambientais que levam ao aumento intracelular dessas
moléculas (Apel & Hirt, 2004). Entretanto, devido ao seu rápido metabolismo, EROs
dificilmente são acumuladas a altos níveis, principalmente dentro da célula (Foyer & Noctor,
2013).
A principal rota de produção de EROs em vegetais é atribuída a cadeia
transportadora de elétrons (CTE) dos cloroplastos devido a ocorrência da “reação de Mehler”
(Slesak et al., 2007). Nesta reação, o O2-● é o produto primário da fotorredução do O2 em tilacóides e funciona como um dreno alternativo durante o excesso de elétrons (Karpinski et
al., 2003). Entretanto, em tecidos não fotossintetizantes como as raízes, os cloroplastos estão ausentes (ou pouco desenvolvidos), sendo a mitocôndria a mais poderosa fonte de EROs do
tecido (Maxwell et al., 1999).
A produção do O2-●nas mitocôndrias vegetais ocorre predominantemente na CTE
pelas NAD(P)H desidrogenases (complexo I) e no complexo citocromo bc1 (complexo III) (Møller, 2001). Esse processo resulta na formação de H2O2 principalmente através da
atividade da enzima Mn-SOD específica de mitocôndria (Rhoads et al., 2006). Entretanto, a presença da oxidase alternativa (AOX), complexo enzimático que catalisa a redução
tetravalente de O2 pela ubiquinona, pode limitar a geração de H2O2 uma vez que esta compete
com o complexo III por elétrons (Juszczuk & Rychter, 2003).
Outro importante sítio de geração de EROs são os peroxissomos. Embora sua
principal função seja a oxidação do glicolato, fonte natural de produção de EROs, H2O2
também pode ser gerado nesta organela através da β-oxidação dos ácidos graxos e de outros
substratos (Dat et al., 2000). Além disso, a geração de H2O2 também ocorre nas membranas de peroxissomos através de uma pequena cadeia de transporte de elétrons que regenera o
2002). Contudo, ainda não existem evidências de quais destas vias poderiam representar as
principais fontes de EROs em raízes (Mittova et al., 2004).
Outras fontes de produção de H2O2 intracelular são o citoplasma, a membrana
plasmática e a matriz extracelular. O citosol não pode ser considerado uma grande fonte de
EROs, porém atua como um depósito para estas moléculas derivadas de outros
compartimentos celulares (Slesak et al., 2007). Na membrana plasmática, as
NADPH-oxidases catalisam a produção de O2-● através da redução do oxigênio utilizando o NADPH
como doador de elétrons (Apel & Hirt, 2004). Após a liberação do radical para o apoplasto,
ocorre a ação da enzima SOD extracelular, catalisando sua conversão para H2O2 (Karpinska et
al., 2001). Adicionalmente as NADPH-oxidases, muitas enzimas da matriz celular são
apontadas como produtoras de H2O2, que está relacionado não apenas com respostas de
defesa, mas também na regulação da síntese de componentes da parede celular (Kacperska,
2004).
2.3 Mecanismos de remoção de EROs
Condições adversas, tais como estresse hídrico, salino e temperaturas elevadas,
podem desencadear um desbalanço entre a produção e a remoção de EROs, resultando no
aumento significativo em sua produção (Vaidyanathan et al., 2003; Guo et al., 2006). A proteção oxidativa na célula vegetal é realizada por um complexo sistema de defesa, o qual
envolve mecanismos não enzimáticos e enzimáticos (Foyer & Noctor, 2013). O sistema não
enzimático é constituído principalmente por componentes hidrofílicos, como o ácido
ascórbico (AsA), glutationa (GSH) e compostos fenólicos, enquanto que a proteção
enzimática é composta por um complexo sistema de enzimas, presentes em várias organelas.
Em raízes, as principais enzimas oxidativas são as dismutases de superóxido (SOD), catalases
(CAT), peroxidases de ascorbato (APX), peroxidases do guaiacol (GPOD), redutases da
glutationa (GR), redutases do monodehidroascorbato (MDHAR) e redutases do
dehidroascorbato (DHAR) (Foyer & Noctor, 2005).
AsA e GSH são os compostos antioxidativos não-enzimáticos mais importantes na
célula vegetal e atuam como doadores de elétrons para o sistema antioxidativo enzimático em
um ciclo denominado ascorbato-glutationa (Mittler & Poulos, 2005) (Figura 2). A GSH é
oxidada pelas EROs resultando em GSSG (glutationa oxidada), enquanto que o AsA é
nova dehid supo cofat distri (em f Figur impo (Dat apres enco grupa em H ascor quan ativid enzim amente atra droascorbat rtáveis pel tores enzim ibuídos no folhas) (Mit
ra 2 - Ciclo
A e
ortantes na r
et al., 200 senta menor
ntra-se em
amento hem
H2O e O2 (M
rbato) e a
ntidades de H
Nos
dades de CA
mas SOD c
avés da atu
to (DHAR)
a célula (M
máticos enc citosol, nas ttler, 2002) ascorbato-g Fonte: Mittle enzima cata remoção do
00). A catal
r afinidade
m alta conc
me-proteico
Møller et al.
apresenta a
H2O2 em lo
últimos an
AT, APX e
catalisam a
uação das
) de manei
Mittler &
contrando-se
s mitocôndr
.
glutationa
er & Poulus (2
alase e o
o H2O2, emb
lase não ne
por H2O2,
centração (W
em cada um
, 2007). Dif
alta afinida
cais específ
nos, uma gra
e SOD para
dismutação
enzimas re
ira a mant
Poulos, 20
e em alta
rias, nos pe
2005).
ciclo ascor
bora suas pr
ecessita de
sendo sua a
Willekens
ma de suas
ferente da c
ade por H2
ficos (Dat e
ande quanti
a a supressã
o do O2- em
edutase da
ter os níve
005). Tais concentraç eroxissomos rbato glutat ropriedades poder redu atividade au
et al., 199 quatro subu
catalase, a A
2O2, permi
et al., 2000).
dade de trab
ão dos nívei
m O2 e H2O
glutationa
eis de ERO
metabólitos
ão no inte
s, no apopa
tiona atuam
e requerim
utor e é alta
umentada q
97). Esta e
unidades e a
APX necess
itindo a re
.
balhos verif
is tóxicos d
e constitue
(GR) e r
Os sob con
s podem a
erior da cél
asto e nos c
m em para
mentos sejam
amente reat
quando este
enzima apr
atua conver
sita de pode
emoção de
fica o balan
de EROs na
em a primei
redutase do
ncentrações
atuar como
lula, sendo
cloroplastos
alelo e são
m diferentes
tiva, porém
metabólito
resenta um
tendo H2O2
r redutor (o
e pequenas
nço entre as
a célula. As
defesa contra EROs (Van Breusegen et al., 2001). Elas são classificadas de acordo com o seu metal co-fator: Fe-SOD, presente nos cloroplastos; Mn-SOD, presentes nas mitocôndrias e
peroxissomos; e as Cu-Zn-SOD, presentes nos cloroplastos, citosol e espaço extracelular
(Alscher et al., 2002).
Outras enzimas também estão envolvidas na defesa antioxidativa. As peroxidases
do guaiacol (GPOD), por exemplo, foram encontradas em diversos compartimentos celulares
como o citosol, vacúolo, apoplasto e parede celular (Mittler et al., 2004). No entanto, ainda não é completamente claro o seu envolvimento na remoção de EROS, já que esta enzima
também está envolvida no processo de lignificação e parada no crescimento em situações de
estresse (Cavalcanti et al., 2007). As peroxidases de glutationa (GPX) e as peroxidases de hidroperóxidos de lipídeos (PhGPX) são responsáveis pela proteção da membrana plasmática
contra EROS.
2.4 Peroxidases do ascorbato
Peroxidases do ascorbato (APX) (EC 1.11.1.11) são enzimas antioxidantes que
atuam convertendo H2O2 em H2O e O2 através da oxidação do ascorbato a
monodehidroascorbato (MDA) (Asada, 2006). Esta ação catalítica é importante no ciclo
ascorbato-glutationa, no qual essa enzima participa de reações removedoras de EROS dentro
das células (Shigeoka et al., 2002). A APX pertence a classe I de hemi-peroxidases
encontradas em plantas superiores, algas e membros do reino protista (Takeda et al., 1998).
Estas enzimas possuem um grupamento heme (protoporfirina IX) como grupo prostético e são
altamente instáveis na ausência de ascorbato (Shigeoka et al., 2002). Inibidores como azida, cianida, hidroxilamina, hidroxiureia e p-amino-fenol são utilizados em ensaios para distinguir a APX de outras peroxidases (Amako et al., 1994).
A enzima APX apresenta várias isoformas localizadas em diversos
compartimentos celulares, podendo ser encontradas no citosol (cAPX), cloroplastos
(chlAPX), peroxissomos (pAPX) e mitocôndrias (mitAPX) (Shigeoka et al., 2002). No
genoma de arroz foi identificado uma família multigênica de APX formada por oito genes:
APX1 e 2 são codificadoras das APXs citosólicas; APX3 e 4 das peroxissomais; APX5 e 6
apresentam diferentes propriedades bioquímicas, incluindo especificidade por substrato,
massa molecular e pH ótimo (Ishikawa et al., 1998).
Dentre as isoenzimas de APX, as citosólicas são as mais abundantes (Panchuk et
al., 2002). Estas isoformas são formadas por dímeros consistindo em duas subunidades
idênticas com a massa molecular de 28 kDa (Mittler & Zilinkas, 1991). As cAPX são
conhecidas por serem altamente responsivas a várias condições ambientais, resultando na
proteção de importantes compartimentos celulares e controlando o nível de sinalização
intracelular de H2O2 (Shigeoka et al., 2002). Nos últimos anos, importantes estudos associando a regulação gênica da cAPX causada pela sinalização do H2O2 estão sendo
realizados.
O tratamento de células de soja com H2O2 exógeno resultou no aumento dos
níveis de transcritos da cAPX (Lee et al., 1999). Em outro experimento, cultura de células de arroz tratadas com hidroxiureia, um inibidor de APX, ou aminotriazol, um inibidor da
catalase, apresentam um elevado conteúdo de H2O2 celular, além do aumento no nível de
transcritos de cAPX (Morita et al., 1999). Muitos estudos reportam o aumento da
concentração de H2O2 após a exposição ao estresse em diversas espécies, o que parece indicar
que esta molécula participa da resposta fisiológica das plantas em tais condições adversas
(Slesak et al., 2007). Sendo assim, esses resultados suportam a hipótese de que a expressão de genes da cAPX é super regulada em resposta ao aumento de H2O2 interno (Shigeoka et al.,
2002).
2.4 H2O2 como molécula sinalizadora intracelular
Estudos passados apontavam o H2O2 principalmente como um metabólito celular
tóxico (Neill et al., 2002). Atualmente, vários trabalhos sugerem que o H2O2 é uma molécula sinalizadora capaz de participar de respostas a estresses abióticos e bióticos (Karpinski et al., 2003; Zhang et al., 2001) (Figura 3). Altas concentrações de H2O2 podem levar a toxidez, enquanto que níveis relativamente baixos podem ser utilizados no processo aclimatatório da
planta (Dat et al., 2000). Isto foi verificado devido ao aumento da geração de H2O2 em resposta a vários estresses, implicando no aumento da tolerância da planta quando esta é
submetida a um estresse e posteriormente ao mesmo estresse ou outro diferente (Neill et al., 2002).
& Gu uma pode atrav conv tóxic estão 1986 Porém de de Boni uma estre que v 2.5 O O H utteridge, 1 sinalização
e ser facilita
vés das me
vertido para
cos em difer
o a peroxida
6).
(I)
O m
m, vários e
efesa, embo
ifacio et al., condição e
essante difer
vários estres
O modelo v
Fonte: (Slesla
H2O2, em co
985), suger
o intracelula
ada por cana
embranas (
radical hidr
rentes comp
ação lipídica
Fe + H2
modo de açã
studos indic
ora também
, 2011). Adi
estressante
rente (tolerâ
sses produz
vegetal (Ory
ak et al., 2007
omparação c
rindo que el
ar e sistêmic
ais de água
(Henzler &
roxila via re
partimentos
a, degradaçã
O2 Fe3+
ão do H2O2
cam que o H
m seja capaz
icionalment
pode levar
ância cruzad
zem um efei
yza sativa L 7).
com outras
le pode se d
ca (Mulline
(aquaporin
& Steudle,
eação de Fe
celulares (W
ão/modifica
+
+ OH- + O
como molé
H2O2 apres
z de causar
te, a concen
r a habilida
da) (Neill et
ito similar a
L.)
ROS, apres
difundir do
eaux & Kar
nas) que, pro
2000). Por
enton (I), qu
Wang et al.
ação de prot
OH●
écula sinali
senta efeitos
danos celul
ntração de H
ade da plan
t al., 2002). a nível celul
senta baixa
seu sítio de
rpinski, 200
ovavelment
rém, o H2O
ue induz um
. 2013). Den teínas e dan
zadora aind
s indutores
lares severo
H2O2 no teci
nta se mant
. Este efeito
lar, incluind
reatividade
e produção
02). Tal mov
te, transport
O2 pode ta
ma variedad
ntre os efei
no ao DNA
da permane
da expressã
os (Morita e
ido devido e
ter em outr
o é atribuído
do estresse o
e (Halliwell
para iniciar
vimentação
tam o H2O2
ambém ser
e de efeitos
tos tóxicos,
(Fridovich,
ce obscuro.
ão de genes
et al., 1999; exposição a
ra condição
o ao fato de
O arroz (Oryza sativa L.) é uma angiosperma monocotiledônea pertencente à família Poaceae. Esta espécie é conhecida pela sua importância na alimentação humana
devido seu alto valor nutricional, pois esta fornece cerca de 15% da proteína e 20% da energia
per capita necessárias ao homem (Filho & Einloft, 2008). Além disso, o arroz é utilizado com
principal fonte de alimento por cerca de 70% da população mundial e, para atender a esta
crescente demanda, estima-se que sua produção deve aumentar em 30% nos próximos 20 anos
(Peng et al., 1999).
Atualmente, a China e a Índia, juntas, são responsáveis por mais de 50% da
produção mundial de arroz. Porém, a China é considerada o país que mais consome arroz no
mundo (34% do consumo mundial), seguida pela Índia, Indonésia e Bangladesh (21, 9 e 6%,
respectivamente) (Fao, 2014). A América Latina ocupa o segundo lugar em produção mundial
de arroz e o terceiro em consumo, enquanto que o Brasil é o 9º maior produtor mundial, com
produção média nos últimos três anos de 12.250 mil toneladas (Filho & Einloft, 2008).
Devido sua grande importância econômica e suas características moleculares, o
arroz vem sido utilizado como planta modelo em pesquisas de genética e genômica funcional.
O arroz possui um genoma relativamente pequeno (390 Mb) quando comparado ao genoma
de outros cereais como o milho, cevada e trigo que têm seus genomas estimados em 3000,
5000 e 16000 Mb, respectivamente (Bennetzen, 2002). Atualmente, importantes ferramentas
para análises genéticas foram desenvolvidas, incluindo mapas genéticos (Harushima et al.,
1998) e técnicas eficientes de transformação gênica (Hiei et al., 1994).
No Brasil, a produtividade do arroz, assim como para outras culturas, depende da
capacidade destas de responder a diferentes tipos de adversidades ambientais, os quais
geralmente produzem um estresse oxidativo (Gomes & Magalhães Júnior, 2004). Devido a
atual conjuntura, é crescente a necessidade de realização de estudos, principalmente no campo
da biotecnologia, que promovam o aumento da produção desta cultura. A caracterização
funcional de genes que possam proteger as plantas contra esses danos oxidativos pode
contribuir para o desenvolvimento de plantas mais adaptadas ao meio ambiente.
2.1.1 Uso do mutante (APX1/2)
O uso de plantas transgênicas tem sido importante para ajudar a caracterizar o
papel de sinalização do H2O2 e sua influência no metabolismo redox da planta, principalmente
moduladas por diferentes estresses (Davletova et al., 2005; Teixeira et al., 2006). Para acessar o papel funcional de isoformas de genes OsAPX sob condições controle e adversas, plantas transgênicas de arroz silenciadas para as isoformas citosólicas através da estratégia de RNAi
foram geradas.
Nosso grupo demonstrou recentemente que plantas de arroz duplamente
silenciadas para as isoformas de APX citosólicas exibem crescimento normal e um aparente
mecanismo antioxidante compensatório sob condições controle e de estresse que envolve o
aumento da concentração de H2O2 (Rosa et al., 2010; Carvalho et al., 2013, Bonifácio et al., 2011). Porém, os mecanismos envolvidos com a compensação destas enzimas ainda não são
completamente compreendidos, principalmente sob condições estressantes. Além disso, pouco
REFERÊNCIAS
Ali, Z.; Park, H.C.; Ali, A.; Oh, D.H.; Aman, R.; Kropornicka, A.; Hong, H.; Choi, W.;
Chung, W.S.; Kim, W.Y. TsHKT1;2, a HKT1 homolog from the extremophile Arabidopsis
relative Thellungiella salsuginea, shows K(+) specificity in the presence of NaCl. Plant Physiology, n.158, p.1463–1474, 2012.
Alscher, R.G.; Erturk, N.; Heath, L.S. Role of superoxide dismutases (SODs) in controlling
oxidative stress in plants. Journal of Experimental Botany, n.372, p.1331-1341, 2002.
Amako K., Chen G.X. & Asada K. Separate assays specific for ascorbate peroxidase and
guaiacol peroxidase and for the chloroplastic and cytosolic isozymes of ascorbate peroxidase
in plants. Plant Cell Physiology, n.35, p.497–504, 1994.
Apel, K.; Hirt, H. Reactive oxygen species: metabolism, oxidative stress, and signal
transduction. Annual Review of Plant Biology, n.55, p.373-399, 2004.
Asada, K. Production and Scavenging of Reactive Oxygen Species in Chloroplasts and Their
Functions. Plant Physiology, n.141, p.391-396, 2006.
Bennetzen, J. Opening the Door to Comparative Plant Biology. Science, n. 296, p.60-63, 2002.
Bonifacio, A.; Martins, M.O.; Ribeiro, C.W.; Fontenele, A.V.; Carvalho, F.E.L.;
Margis-Pinheiro, M.; Silveira, J.A.G. Role of peroxidases in the compensation of cytosolic ascorbate
peroxidase knockdown in rice plants under abiotic stress. Plant, Cell and Environment,
n.34, p.1705–1722, 2011.
Carvalho, F.E.L.; Ribeiro, C.W.; Martins, M.O.; Bonifacio, A.; Staats, C.C.; Andrade,
C.M.B.; Cerqueira, J.V.; Margis-Pinheiro, M.; Silveira, J.A.G. Cytosolic APX knockdown
rice plants sustain photosynthesis by regulation of protein expression related to
photochemistry, Calvin cycle and photorespiration. Physiologia Plantarum, n.150,
p.632-645, 2013.
Cavalcanti, F.R.; Oliveira, J.T.A.; Martins-Miranda, A.S.; Viegas, R.A.; Silveira, J.A.G.
Superoxide dismutase, catalase and peroxidase activities do not confer protection against
Chawla, S.; Jain, S.; Jain, V. Salinity induced oxidative stress and antioxidant system in salt
tolerant and salt-sensitive cultivars of rice (Oryza sativa L.). Journal of Plant Biochemistry and Biotechnology. n.22, p.27–34, 2013.
Choi, W.; Toyota, M.; Kim, S.; Hilleary, R; Gilroy, S. Salt stress-induced Ca2+ waves are
associated with rapid, long-distance root-to-shoot signaling in plants. Proceedings of the
National Academy of Sciences, n. 17, p.6497-6502, 2014.
Chung, J.S.; Zhu, J.K.; Bressan, R.A.; Hasegawa, P.M.; Shi, H. Reactive oxygen species
mediate Na+-induced SOS1 mRNA stability in Arabidopsis. Plant Journal, n.53, p.554–565, 2008.
Dat, J.; Vandenabeele, S.; Vranová, E.; Van Montagu, M.; Inzé, D.; Van Breusegem, F. Dual
action of the active oxygen species during plant stress responses. Cellular and Molecular Life Science, n.57, p.779–795, 2000.
Davletova, S.; Rizhsky, L.; Liang, H.; Shengqiang, Z.; Oliver, D.J.; Coutu, J.; Shulaev, V.;
Schlauch, K.; Mittler, R. Cytosolic ascorbate peroxidase 1 is a central component of the
reactive oxygen gene network of Arabidopsis. Plant Cell, n.17, p.268-281, 2005.
Del Rio, L.A.; Sandalio, L.M.; Altomare, D.A.; Zilinskas, B.A. Mitochondrial and
peroxisomal manganese superoxide dismutase: differential expression during leaf senescence.
Journal of Experimental Botany, n.54, p.923-933, 2003.
FAO. Rice Market Monitor. vol. XVII, n. I, Abril 2014. Disponível em:
<http://www.fao.org/docrep/019/i3735e/i3735e.pdf>. Acesso em: 10 set. 2014.
Fan, Y.; Zhu, M.; Shabala, S.; Li, C.D.; Johnson, P.; Zhou, M.X. Antioxidant Activity in Salt
Stressed Barley Leaves: Evaluating Time- and Age-Dependence and Suitability for the Use as
a Biochemical Marker in Breeding Programs. Journal of Agronomy and Crop Science,
n.200, p.261-272, 2014.
Filho, P.M.F.; Einlof, N.E. A competitividade do arroz irrigado brasileiro no mercosul.
Organizações Rurais & Agroindustriais, n.10, p.11-22, 2008.
Flowers, T.J.; Colmer, T.D. Salinity tolerance in halophytes. New Phytology, n.179,
Foyer, C.H.; Noctor, G. Oxidant and antioxidant signalling in plants: a re-evaliation of the
concept of oxidative stress in a physiological context. Plant, Cell and Environmental, n. 28,
p.1056-1071, 2005.
Foyer, C.H.; Noctor, G. Redox Signaling in Plants. Antioxidants & Redox Signaling, n.16,
p.2087-2090, 2013.
Fridovich, I. Biological effects of the superoxide radical. Archives of Biochemistry and
Biophysics, n.247, p.1–11, 1986.
Fujita, M; Fujita, Y; Noutoshi, Y; Takahashi, F.; Narusaka, Y.; Yamaguchi-Shinozaki, K.;
Shinozaki, K. Crosstalk between abiotic and biotic stress responses: a current view from the
points of convergence in the stress signaling networks. Current Opinion in Plant Biology, n.
9, p. 436-442, 2006.
Galvan-Ampudia, G.C.; Testerink, C. Salt stress signals shape the plant root. Current
Opinion in Plant Biology, n. 14, p.296–302, 2011.
Gomes, A.S.; Magalhães Júnior, A.M. Arroz Irrigado no Sul do Brasil. Embrapa
Informação Tecnológica, 899p, 2004.
Guo, Y.P.; Zhou, H.F.; Zhang, L.C. Photosynthetic characteristics and protective mechanisms
against photooxidation during high temperature stress in two citrus species. Scientia
Horticulturae, n.108, p.260-267. 2006.
Halliwell, B.; Gutteridge, J.M.C. Free Radicals in Biology and Medicine, Ed 3. Oxford
University Press, Oxford, 1985.
Harushima, Y.; Yano, M.; Shomura, A.; Sato, M.; Shimano, T.; Kuboki, Y.; Yamamoto, T.;
Lin, S.Y.; Antonio, B.A.; Parco, A.; Kajiya, H.; Huang, N.; Yamamoto, K.; Nagamura, Y.;
Kurata, N.; Khush, G.S.; Sasaki, T. A high-density rice genetic linkage map with 2275
markers using a single F2 population. Genetics, n.148, p.479-494, 1998.
Hasegawa, P.M. Sodium (Na+) homeostasis and salt tolerance of plants. Environmental and
Experimental Botany, n.92, p.19– 31, 2013.
Hasegawa, P.M.; Bressan, R.A.; Zhu, J.K.; Bohnert, H.J. Plant cellular and molecular
responses to high salinity. Annual Review of Plant Physiology and Plant Molecular
Henzler, T.; Steudle, E. Transport and metabolic degradation of hydrogen peroxide in Chara corallina: model calculations and measurements with the pressure probe suggest transport of H2O2 across water channels. Journal of Experimental Botany, n.51, p.2053-2066, 2000.
Hernandez, M.; Fernandez-Garcia, N.; Diaz-Vivancos, P.; Olmos, E. A different role for
hydrogen peroxide and the antioxidative system under short and long salt stress in Brassica
oleracea roots. Journal of Experimental Botany, n.61, p.521-535, 2009.
Hiei, Y.; Ohta, S.; Komari, T.; Kumashiro, T. Efficient transformation of rice (Oryza sativa
L.) mediated by Agrobacterium and sequence analysis of the boundaries of the T-DNA. Plant
Journal, n.6, p.271-282, 1994.
Horie, T.; Hauser, F.; Schroeder; J.I. HKT transporter mediated salinity resistance
mechanisms in Arabidopsis and monocot crop plants. Trends in Plant Science. n.14, p.660– 668, 2009.
Hu, J.F.; Li, G.F.; Gao, Z.H.; Chen, L.; Ren, H.B.; Jia, W.S. Regulation of Water
Deficit-Induced Abscisic Acid Accumulation by Apoplastic Ascorbic Acid in Maize Seedlings. Acta
Botanica Sinica, n.47, p.1335-1344, 2005.
Ishikawa T, Yoshimura K, Sakai K, Tamoi M, Takeda T, Shigeoka S. Molecular
characterization and physiological role of a glyoxysome‐bound ascorbate peroxidase from
spinach. Plant and Cell Physiology, n.39, p.23–34, 1998.
Ji, H.; Pardob, J.M.; Batellic, G.; Van Oostend, M.J.; Bressane, R.A.; Li, X. The Salt Overly
Sensitive (SOS) Pathway: Established and Emerging Roles. Molecular Plant, n. 2, p.275–
286, 2013.
Juszczuk, I.M.; Rychter, A.M. Alternative oxidase in higher plants. Acta Biochimica
Polonica, v.50, p.1257-1271, 2003.
Kacperska, A. Sensor types in signal transduction pathways in plant cells responding to
abiotic stressors: do they depend on stress intensity? Physiologia Plantarum, n.122,
p.159-168, 2004.
Karpinska, B.; Karlsson, M.; Schinkel, H.; Streller, S.; Su, K.; Melzer, M.; Wingsle, G. A
novel superoxide dismutase with a high isoelectric point in higher plants. Expression,
Karpinski, S.; Gabrys, H.; Mateo, A.; Karpinska, B.; Mullineaux, P.M. Light perception in
plant disease defence signalling. Current Opinion in Plant Biology, n.4, p.390–396, 2003.
Lee, S.; Choi, H.; Suh, S.; Doo, I-S.; Oh, K-Y.; Choi, E.J.; Taylor, A.T.S.; Low, P.S.; Lee, Y.
Oligogalacturonic acid and chitosan reduce stomatal aperture by inducing the evolution of
reactive oxygen species from guard cells of tomato and Commelina communis. Plant
Physiology,n.121, p.147-152, 1999.
Maathuis, F.J. Sodium in plants: perception, signalling, and regulation of 1293 sodium fluxes.
Journal of Experimental Botany, n.65, p.849-858, 2014.
Maia, J.M.; Voigt, E.L.; Ferreira-Silva, S.L.; Fontenele, A.V.; Macêdo, C.E.C.; Silveira,
J.A.G. Differences in Cowpea Root Growth Triggered by Salinity and Dehydration are
Associated with Oxidative Modulation Involving Types I and III Peroxidases and Apoplastic
Ascorbate. Journal of Plant Growth Regulation, n.32, p.376–387, 2013.
Maxwell, D.P.; Wang, Y.; McIntosh, L. The alternative oxidase lowers mitochondrial reactive
oxygen production in plant cells. Proceedings of the National Academy of Sciences, n.14,
p.8271–8276, 1999.
Mittler R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, n. 7,
p.405–410, 2002.
Mittler R.; Poulos T.L. Ascorbate peroxidase. In Antioxidants and Reactive Oxygen
Species in Plants(ed. N. Smirnoff), Blackwell Publishing, Oxford, UK, pp. 87–100, 2005. Mittler, R.; Vanderauwera, S.; Gollery, M.; Van Breusegem, F. Reactive oxygen gene
network of plants. Trends in Plant Science, n.10, p.490-498, 2004.
Mittler, R.; Zilinskas, B.A. Regulation of pea cytosolic ascorbate peroxidase and other
antioxidant enzymes during the progression of drought stress and following recovery from
drought. Plant Journal, n.5, p.397-405, 1994.
Møller, I.M.; Jensen, P.E.; Hansson, A. Oxidative modifications to cellular components in
plants. Annual Review of Plant Biology, n.58, p.459–481, 2007.
Morita, S.; Kaminaka, H., Masumura, T.; Tanaka, K. Induction of rice cytosolic ascorbate
peroxidase mRNA by oxidative stress: the involvement of hydrogen peroxide in oxidative
Mullineaux, P.; Karpinski, S. Signal transduction in response to excess light: getting out of
the chloroplast. Current Opinion of Plant Biology, n.5, p.43–48, 2002.
Munns, R.; Tester, M. Mechanisms of salinity tolerance. Annual Review of Plant Biology,
n.59, p.651-681, 2008.
Nambara, E.; Marion-Poll, A. Abscisic acid biosynthesis and catabolism. Annual Review of
Plant Biology, n.56, p.165-185, 2005.
Panchuk, I.I.;, Volkov, R.A.; Schöffl, F. Heat stress- and heat shock transcription
factor-dependent expression and activity of ascorbate peroxidase in Arabidopsis. Plant Physiology, v.129, p.838–853, 2002.
Peng, S.; Cassman, K. G.; Virmani, S. S.; Sheehy, J.; Khush, G. S. Yield potential trends of
tropical rice since the release of IR8 and the challenge of increasing rice yield potential. Crop
Science, n.39, p.1552-1559, 1999.
Pierik, R.; Testerink, C. The art of being flexible: how to escape from shade, salt and drought.
Plant Physiology, n.27, 2014.
Rhoads, D.M.; Umbach, A.L.; Subbaiah, C.C.; Siedow, J.N. Mitochondrial Reactive Oxygen
Species. Contribution to Oxidative Stress and Interorganellar Signaling. Plant Physiology, n.
141, p.357-366, 2006.
Rosa, S.B.; Caverzan, A.; Teixeira, F.K.; Lazzarotto, F.; Silveira, J.A.; Ferreira-Silva, S.L.;
Abreu-Neto, J.; Margis, R.; Margis-Pinheiro, M. Cytosolic APx knockdown indicates an
ambiguous redox responses in rice. Phytochemistry, n.71, p.548-558, 2010.
Seki, M.; Umezawa, T.; Urano, K.; Shinozaki, K. Regulatory metabolic networks in drought
stress responses. Current Opinion in Plant Biology, n.10, p.296–302, 2007.
Sümer, A.; Zörb, C.; Feng, Y.; Schubert S. Evidence of sodium toxicity for the vegetative
growth of maize (Zea mays L.) during the first phase of salt stress. Journal of applied botany, n.78, p.135-139, 2004.
Sharp, R.E.; LeNoble, M.E. ABA, ethylene and the control of shoot and root growth under
Sheen, J. Ca2+-dependent protein kinases and stress signal transduction in plants. Science,
n.274, p.1900-1902, 1996.
Shigeoka, S.; Ishikawa, T.; Tamoi, M.; Miyagawa, Y.; Takeda, T., Yabuta Y.; Yoshimura, K.
Regulation and function of ascorbate peroxidase isoenzymes. Journal of Experimental
Botany,n.53, p.1305–1319, 2002.
Slesak, I.; Libik, M.; Karpinska, B.; Karpinski, S.; Miszalski, Z. The role of hydrogen
peroxide in regulation of plant metabolism and cellular signalling in response to
environmental stresses. Acta Biochimica Polonica, n.54, p.39-50, 2007.
Sreenivasulu, N.; Sopory, S.K.; Kavi Kishor, P.B., Deciphering the regulatory mechanisms of
abiotic stress tolerance in plants by genomic approaches, Gene, n.388, p.1-13, 2007.
Sumer, A.; Zorb, C.; Yan Feng; Schubert, S., Evidence of sodium toxicity for the vegetative
growth of maize Zea mays L. during the first phase of salt stress. Journal of Applied Botany
and Food Quality, n. 78, p.135-139, 2004.
Takeda, T.; Yoshimura, K.; Ishikawa, T.; Shigeoka, S. Purification and characterization of
ascorbate peroxidase in Chlorella vulgaris. Biochimie, n.80, p.295–301, 1998.
Teixeira, F.K.; Menezes-Benavente, L.; Galvão, V.C.; Margis R. & Margis-Pinheiro M. Rice
ascorbate peroxidase gene family encodes functionally diverse isoforms localized in diferente
subcellular compartments. Planta, n.224, p.300-314, 2006.
Teixeira, F.K.; Menezes-Benavente, L; Margis, R.; Margis-Pinheiro, M. Analysis of the
molecular evolutionary history of the ascorbate peroxidase gene family: inferences from the
rice genome. Journal of Molecular Evolutionn.59, p.761–770, 2004.
Urao, T.; Yakubov, B.; Satoh, R.; Yamaguchi-Shinozaki, K.; Seki, M.; Hirayama,
T.; Shinozaki, K. A transmembrane hybrid-type histidine kinase in Arabidopsis functions as
an osmosensor. Plant Cell, n.11, p.1743-1754, 1999.
Vaidyanathan, H.; Sivakumar, P.; Chakrabarty, R.; Thomas, G. Scavenging of reactive
oxygen species in NaCl-stressed rice (Oryza sativa L.) – differential response in salt-tolerant and sensitive varieties. Plant Science, v. 165, p. 1411-1418, 2003.
Van Breusegem, F.; Vranova, E.; Dat, J.F.; Inze, D. The role of active oxygen species in plant
Verslues, P.E.; Zhu, J.K. New developments in abscisic acid perception and metabolism.
Current Opinion in Plant Biology, n.10, p.447-52, 2007.
Wang, X.; Hou, C.; Liu, J.; He, W.; Nan, W.; Gong, H.; Bi, Y. Hydrogen peroxide is involved
in the regulation of rice (Oryza sativa L.) tolerance to salt stress. Acta Physiologia Plantarum, n.35, p.891–900, 2013.
Willekens, H.; Chamnongpol, S.; Davey, M.; Schraudner, M.; Langebartels, C.; Montagu,
V.M. Catalase is a sink for H2O2 and is indispensable for stress defence in C3 plants. EMBO
Journal, n.16, p.4806–4816, 1997.
Yao, X.; Horie, T.; Xue, S.; Leung, H.Y.; Katsuhara, M.; Brodsky, D.E.; Wu, Y.; Schroeder,
J.I. Differential sodium and potassium transport selectivities of the rice OsHKT;2 and
OsHKT2;2 transporters in plant cells. Plant Physiology, n.152, p.341–355, 2010.
Zhang, X.; Zhang, L.; Dong, F.; Gao, J.; Galbraith, D.W.; Song, C-P. Hydrogen peroxide is
involved in abscisic acid-induced stomatal closure in Vicia faba. Plant Physiology, n.126, p.1438-1448, 2001.
Zhao, J.; Davis, L.C.; Verpoorte, R. Elicitor signal transduction leading to production of plant
secondary metabolites. Biotechnology Advances, n.23, p.283-333, 2005.
Zhu, J.K. Salt and drought stress signal transduction in plants. Annual Review of Plant
Biology, n. 53, p.247–273, 2002.
CAPÍTULO II
Roots from rice plants silenced to cytosolic APX1/2 display compensatory mechanisms to cope with salt and osmotic stresses
Roots from rice plants silenced to cytosolic APX1/2 display compensatory mechanisms to cope with salt and osmotic stresses
Cunha, J.R.¹; Lima Neto, M.C.¹; Carvalho, F.E.L.¹; Martins, M.O.¹; Messeder, D.J.²; Márgis-Pinheiro, M.²; Silveira, J.A.G¹.
¹Departamento de Bioquímica e Biologia Molecular, Universidade Federal do Ceará, Brasil.
²Departamento de Genética, Universidade Federal do Rio Grande do Sul, Brasil.
Abstract
Roots provide support for plants and are responsible for absorbing water, nutrients and
maintaining the osmotic potential. In situations of salinity and osmotic stress, roots play a
fundamental role in perception and signaling processes as the first plant organ in contact with
stresses. Therefore, the main objective of the present study is to elucidate the modulation of
antioxidative metabolism, assessed by gene expression, enzymatic activities and physiological
approaches, in salt and osmotic tolerance in roots of NT rice plants and mutants double
silenced to cytosolic ascorbate peroxidase isoforms (APX1/2). NT and APX1/2 plants were
exposed to iso-osmotic concentrations (-0.62 MPa) of NaCl and mannitol for eight days. A
second experiment of short-term exposure of mannitol (two days at the same concentration)
was performed to evaluate plants early responses. In the first experiment, both genotypes
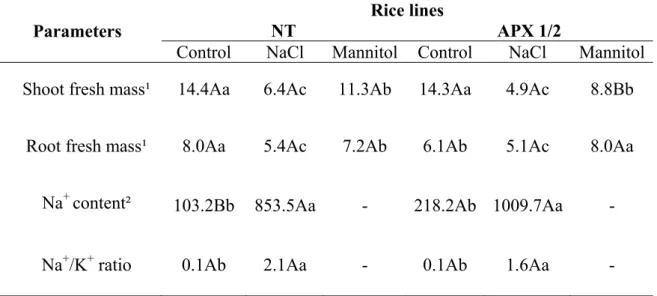
displayed similar decreases in fresh mass and root lengths. NT and APX 1/2 showed same
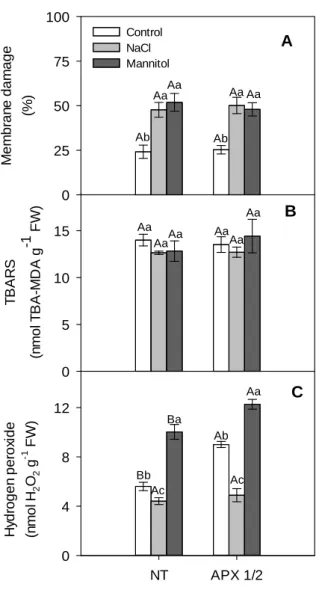
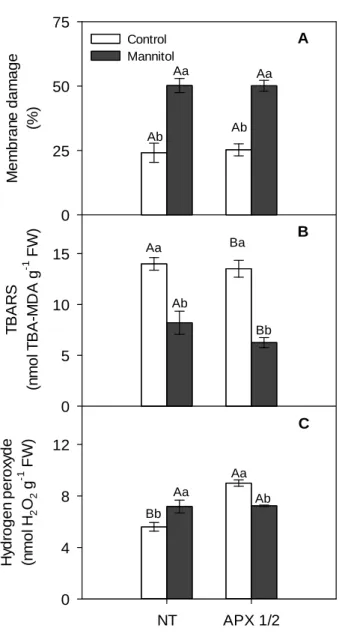
levels of electrolyte leakage and lipid peroxidation (TBARS). However, only plants exposed
to the osmotic treatment (mannitol) displayed higher H2O2 levels compared with their
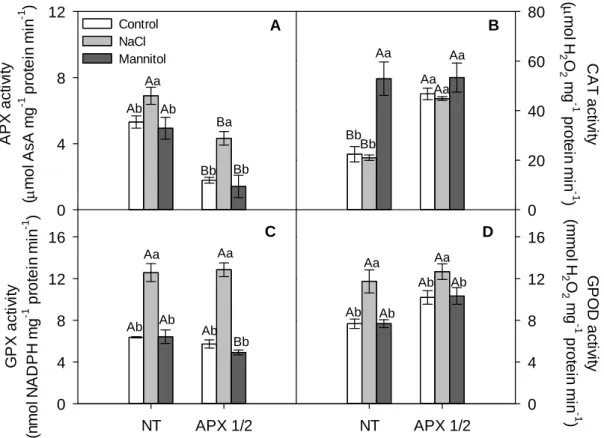
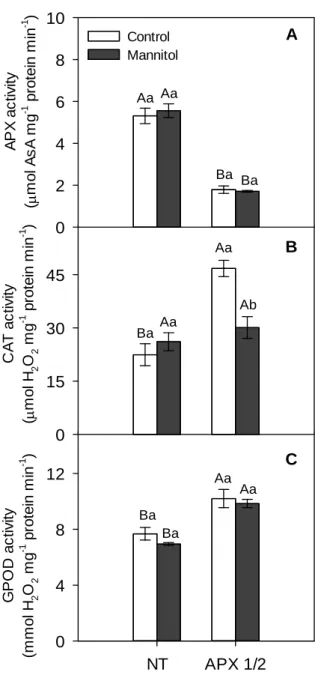
respective controls. Salt stress increased the activities of APX, GPX and GPOD in NT and
APX1/2. The increases of these enzymes activities were related with decreases in H2O2 levels
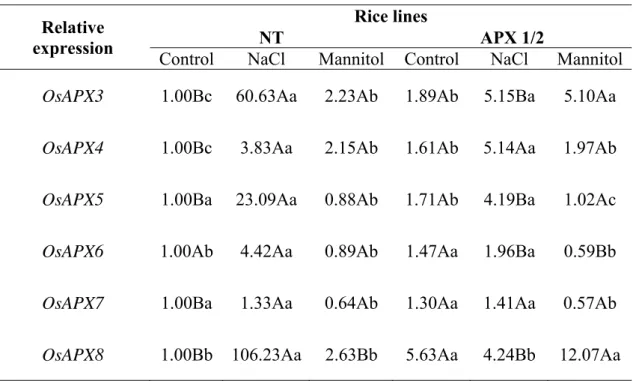
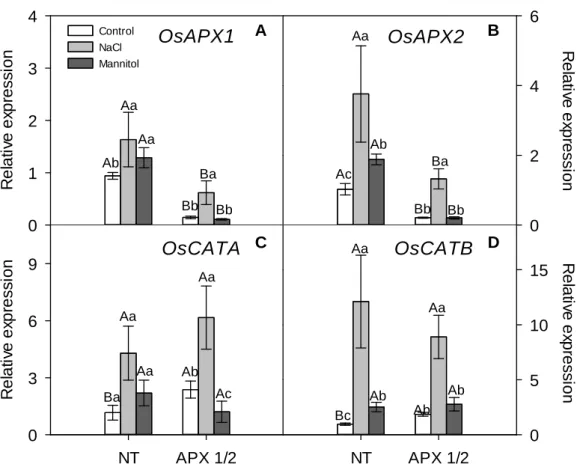
in both genotypes. In addition, the relative amount of the transcripts increased for OsAPX3,
OsAPX5 and OsAPX8 in both genotypes exposed to NaCl probably can justify the increase in the total APX activity. Short-term exposure to mannitol (2 d) induced an increase in the
electrolyte leakage in roots of NT and APX1/2 but the activities of other peroxidases and
H2O2 levels were not increased. Despite the discrete increase in the expression of OsAPX1
and OsAPX2 was related with the relative abundance of APX 1 and 2 isoforms in NT plants exposed to mannitol, these increases were not related with respective enzyme activities. Thus,
salt and osmotic stresses induce differentiated biochemical and molecular responses that
Keywords: Antioxidative metabolism. Ascobate peroxidase. Oryza sativa. Redox homeostasis.
Introduction
Roots provide support to anchor the plant in the soil and are critical for uptake of
water and nutrients and the maintenance of plant water balance (Pierik & Testerink, 2014).
Moreover, roots are intrinsically related to stress perception and these responses are
associated with signaling, synthesis and translocation of hormones, osmoregulation and ionic
balance (Siemens et al., 2003). Commonly, under stressful conditions, roots display increases in the production of reactive oxygen species (ROS). On the other hand, decreases in the
efficiency of ROS scavenging can lead to ROS accumulation in roots cells causing
ROS-associated injury under abiotic stress (Kim et al., 2005). The balance of ROS concentration is related to signaling responses, homeostasis and apoptosis (Neill et al., 2002). For this reason, the equilibrium between the production and scavenging of ROS should be maintained.
The earliest stress perception by roots induces signal transduction mechanisms
that lead to physiological and morphological responses in the whole plant (Pierik & Testerink,
2014). In general, severe osmotic stresses, including drought and salinity, decrease overall
root growth. These osmotic stresses restricts water uptake, as result, many of the same
signaling pathways are induced, and similar effects on root growth are generally observed
(Munns & Tester, 2008). Salt causes additional problems to the plant because of the toxicity
of Na+ ions. Therefore, besides regulation of osmotic balance, plants also mount other
responses to withstand NaCl, most notably the activation of ion channels to export and
compartmentalize salt in the vacuole (Hasegawa, 2013; Maathuis, 2014).
The exchange of K+ by Na+ is one of the major problems triggered by salinity,
causing inhibition of important metabolic processes such as regulation of turgor potential and
activation of enzymatic reactions (Zhu, 2002). Additionally, salinity causes osmotic stress,
which can reduce the water availability to the plant and interfere on plant growth (Munns &
Tester, 2008). Although the importance of salt and drought stress to crop production, and the
importance to know the different signalling pathways to these conditions, few molecular
components are known (Zhu, 2002). For the ionic component of salinity, the increase in Na+
concentration triggers the SOS pathway (Salt Overly Sensitive) that leads to a Ca+2 cytosolic
stress component, the change in cellular turgor leads to signalling pathway that activates gene
expression of osmolyte biosynthesis enzymes as well as water and osmolyte transport systems
and ABA synthesis (Zhu, 2002).
Roots are considered main targets for improvement in crop plants under drought
and salinity stress (Pierik & Testerink, 2014). However, despite the importance of the root
system to plant signaling and stress tolerance, how the root senses salinity and drought is
currently unknown and genetic screens have failed to determine the identity of molecular
receptors (Pierik and Testerink, 2014). On the other hand, significant progress has been made
in elucidating the early signaling responses to salt and drought. These include an increase in
cytosolic level of Ca2+and metabolic enzymatic remodeling (Ji et al., 2013; Maathuis, 2014).
Both ionic and osmotic stresses induce oxidative stress (Pierik & Testerink, 2014)
disrupting the balance between productions and scavenge of ROS. In roots, the mitochondrial
electron transport chain is the major source of ROS due to activity of NAD(P)H
dehydrogenase and cytochrome bc1 (Maxwell et al. , 1999). Peroxisomes are another important site of ROS generation. Although their main function is the oxidation of glycolate,
a natural source of ROS production, fatty acids β-oxidation also generates H2O2 (Dat et al., 2000). Moreover, cytoplasm, plasmatic membrane and extracellular matrix are other sources
of intracellular ROS in roots (Slesak et al., 2007). To achieve the balance between production and scavenge of ROS, the maintenance of the threshold concentration of ROS to promote
signalling and prevent cell damage, a complex system of redundant oxidative protection
mechanism is triggered (Foyer & Noctor, 2011).
Oxidative protection against ROS is performed by a complex redundant defence
system of enzymatic and non-enzymatic mechanisms (Foyer & Noctor, 2011). In roots,
superoxide dismutase (SOD), catalases (CAT), ascorbate peroxidase (APX), guaiacol
peroxidase (GPOD), gluthatione reductase (GR), monodehydroascorbate reductase (MDHAR)
ans dehydroascorbate reductase (DHAR) are some important enzymes related to ROS
scavenging (Foyer & Noctor, 2005). Non-enzymatic mechanisms, as ascorbate and
glutathione, are also employed to prevent ROS burst (Foyer & Noctor, 2011).
Current studies, particularly in Arabidopsis, have shown that mutants deficient in cytosolic ascobate peroxidases (APX) are susceptible to oxidative damage induced by abiotic