U IVERSIDADE FEDERAL DE OURO PRETO – ESCOLA DE MI AS DEPARTAME TO DE E GE HARIA DE MI AS
PROGRAMA DE PÓS GRADUAÇÃO EM E GE HARIA MI ERAL
Tratamento de Efluente de Percolação Pluvial em
Pilhas de Carvão Mineral
Dissertação de mestrado apresentada ao Programa de Pós Graduação em
Engenharia Mineral
Área de concentração: Tratamento de Minérios
Autora: Danielle Andrade Pimentel Orientador: Prof. José Aurélio Medeiros da Luz
U IVERSIDADE FEDERAL DE OURO PRETO ESCOLA DE MI AS DEPARTAME TO DE E GE HARIA DE MI AS
PROGRAMA DE PÓS GRADUAÇÃO EM E GE HARIA MI ERAL
Tratamento de Efluente de Percolação Pluvial em
Pilhas de Carvão Mineral
Autora: Danielle Andrade Pimentel Orientador: Prof. José Aurélio Medeiros da Luz
.
Ouro Preto – MG Outubro / 2007
Dissertação de mestrado apresentada ao
Programa de Pós Graduação em
P644t Pimentel, Danielle Andrade.
Tratamento de efluente de percolação pluvial em pilhas de carvão mineral [manuscrito] / Danielle Andrade Pimentel – 2007.
viii, 132f.: il.; grafs., tabs.
Orientador: Prof. Dr. José Aurélio Medeiros da Luz.
Dissertação (Mestrado) Universidade Federal de Ouro Preto. Escola de Minas. Departamento de Engenharia de Minas. Programa de Pós graduação em
Engenharia Mineral.
Área de concentração: Tratamento de minérios.
1. Efluente Qualidade Teses. 2. Sedimentação e depósitos Teses. 3. Floculação Teses. 4. Hulha Teses. I. Universidade Federal de Ouro Preto. II. Título.
CDU: 552.574
DEDICATÓRIA
Aos meus pais, Henrique e Elbanisa, pelo apoio e incentivo. Ao meu irmão amigo, Henrique ( enen),
AGRADECIME TOS
A Deus, razão da minha existência.
Aos meus pais, Elbanisa e Henrique, pelo exemplo de amor, respeito, dedicação e cumplicidade.
Ao meu irmão e grande amigo, Henrique (Nenen), pelo apoio, companheirismo e entusiasmo diante das minhas conquistas.
À Mariana, amiga irmã, pelo incentivo.
Ao mestre amigo José Aurélio Medeiros da Luz, pela orientação e compreensão.
Aos membros da banca, professor Antonio Clark Peres e Carlos Alberto Pereira, pelo incentivo.
Aos professores do Programa de Pós Graduação em Engenharia Mineral (PPGEM/UFOP) pelo apoio e ensinamentos.
Aos funcionários do Laboratório de Tratamento de Minérios (DEMIN/EM/UFOP) pela colaboração na parte experimental.
Ao Departamento de Engenharia de Minas e ao Programa de Pós Graduação em Engenharia Mineral (PPGEM/UFOP) e às suas secretárias, Denise Carvalho e Leila Souza.
Ao professor Hermínio Nalini (DEGEO/UFOP) pela disponibilidade na realização das análises químicas.
Aos funcionários do Laboratório de Geoquímica Ambiental (DEGEO/UFOP) Celso, Gilberto e Cristiano pela realização das análises químicas.
À CAPES, órgão financiador da bolsa de mestrado.
À COPELMI Mineração Ltda. pela viabilização das amostras de carvão mineral. À CYTEC pelo fornecimento dos reagentes.
Aos amigos conquistados durante o curso de mestrado, em especial, Gláucia, Mário, Júnia, Luciana, Érica, Germano e Lorena pela troca de conhecimentos.
Aos amigos André e Vânia pela ajuda e companheirismo durante a realização deste trabalho.
Às amigas Larice, Glaucy e Waléria (Palmito, Tico e “1 Litru”), pelas colocações sensatas e forte amizade.
RESUMO
SUMÁRIO
1. I TRODUÇÃO ... 1
2. OBJETIVOS E RELEVÂ CIA ... 4
3. REVISÃO BIBLIOGRÁFICA ... 5
3.1. Drenagem Ácida ... 5
3.2. Fenômenos de agregação entre partículas ... 7
5.4. Dupla Camada Elétrica ... 8
3.2.2. Coagulação e Floculação ... 13
3.3. Precipitação e/ou seqüestro de metais pesados ... 15
3.4. Processos de sedimentação ... 18
3.5. Sedimentação em proveta ... 24
3.6. Sedimentação em coluna ... 27
3.7. Fluxograma simplificado de tratamento de drenagem ácida ... 30
4. METODOLOGIA ... 32
4.1. Amostras, reagentes e equipamentos ... 32
4.1.1. Material sólido carvão mineral ... 32
4.1.2. Equipamentos e Reagentes ... 32
4.2. Roteiro metodológico ... 33
4.3. Ensaios de sedimentação ... 36
4.3.1. Sedimentação em proveta ... 36
4.3.2. Sedimentação em coluna ... 37
4.4. Ensaio de precipitação sobre o leito de carvão mineral ... 40
4.5. Caracterização do material sólido – Carvão Mineral ... 41
5. RESULTADOS E DISCUSSÃO ... 44
5.1. Caracterização do material sólido ... 44
5.2. Sedimentação em proveta ... 45
5.3. Sedimentação em proveta com alcalinização prévia do efluente ... 63
a. Sedimentação em coluna longa ... 78
b. Concentração de metais pesados no líquido clarificado ... 86
6. CO CLUSÃO ... 96
7. REFERE CIAS BIBLIOGRÁFICAS ... 98
LISTA DE FIGURAS
Figura 3. 1 Modelos propostos de dupla camada elétrica ... 9
Figura 3.2 Modelo atual de dupla camada elétrica ... 10
Figura 3.3 Dupla camada elétrica segundo Parks (1973), Monte e Peres (2004) ... 11
Figura 3.4 Teoria DLVO. Fonte: Pavanelli, 2001 ... 12
Figura 3.5 Processo de coagulação e floculação ... 14
Figura 3.6 Diagrama da concentração envolvendo a solubilidade e a precipitação de hidróxidos metálicos ... 17
Figura 3.7 Ensaio de sedimentação zonal em coluna (a) Instante inicial (b) Instante final ... 22
Figura 3.8 Evolução temporal da interface no regime de sedimentação ... 23
Figura 3.9 Ensaio de sedimentação ... 26
Figura 3.10 Representação das curvas de isoconcentração ... 29
Figura 3.11 Fluxograma com as etapas do processo de tratamento de efluentes ... 31
Figura 4.1 Homogeneização do carvão mineral ... 32
Figura 4.2 Fluxograma do roteiro metodológico dos ensaios ... 35
Figura 4.3 Ensaios de sedimentação em proveta ... 37
Figura 4.4 Colunas de sedimentação e a ordem de coleta dos pontos de amostragem ... 39
Figura 4.5 Ensaio de precipitação sobre o leito de carvão mineral ... 40
Figura 4.6 Digestão das cinzas do carvão ... 43
Figura 5.1 Gráfico de sedimentação das partículas utilizando o reagente Superfloc C 581 ... 46
Figura 5.2 Gráfico de Roberts para o ensaio em que se utilizou o reagente Superfloc C 581 ... 46
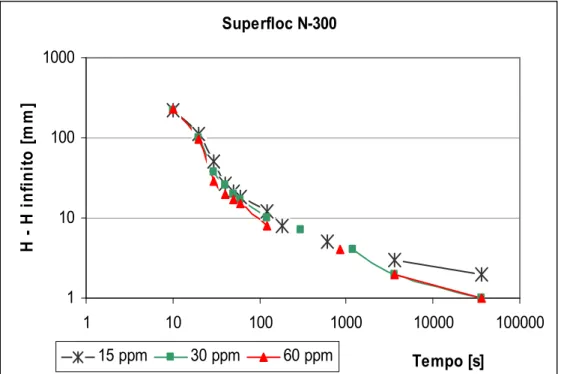
Figura 5.3 Gráfico de sedimentação das partículas utilizando o reagente Superfloc N 300 ... 47
Figura 5.4 Gráfico de Roberts para o ensaio em que se utilizou o reagente Superfloc N 300 ... 48
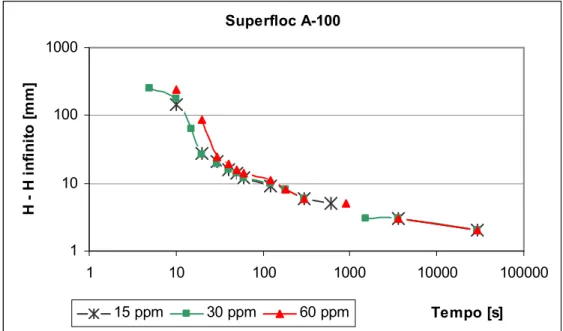
Figura 5.6 Gráfico de Roberts para o ensaio em que se utilizou o reagente
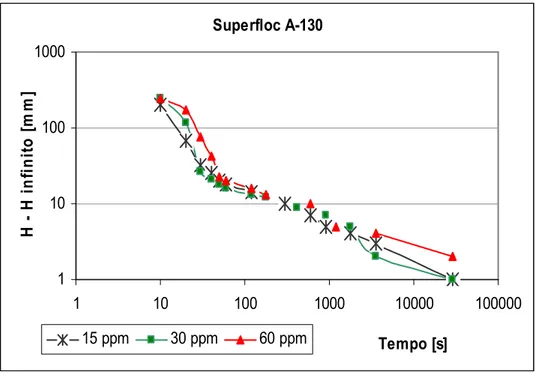
Superfloc A 100 ... 49 Figura 5.7 Gráfico de sedimentação das partículas utilizando o reagente
Superfloc A 130 ... 49 Figura 5.8 Gráfico de Roberts para o ensaio em que se utilizou o reagente
Superfloc A 130 ... 50 Figura 5.9 Gráfico da sedimentação com Superfloc A 130, A 100, C 581 e N 300, todos sob a dosagem de 5 ppm ... 51 Figura 5.10 Gráfico de sedimentação das partículas utilizando solução de amido de
milho a 0,1% de concentração ... 52 Figura 5.11 Gráfico de Roberts para o ensaio em que se utilizou solução de amido de
milho a 0,1% de concentração ... 53 Figura 5.12 Gráfico de sedimentação das partículas utilizando solução de Ca(OH)2 a
1% de concentração ... 54 Figura 5.13 Gráfico de Roberts para o ensaio em que se utilizou solução de Ca(OH)2
a 1% de concentração ... 55 Figura 5.14 Gráfico de sedimentação das partículas utilizando solução de NaOH a
1% de concentração ... 56 Figura 5.15 Gráfico de Roberts para o ensaio em que se utilizou solução de NaOH a
1% de concentração ... 57 Figura 5.16 Gráfico da sedimentação das partículas utilizando os reagentes
Superfloc C 581 N 300, A 100 e A 130 ... 59 Figura 5.17 Gráfico de Roberts para os ensaios os quais se utilizou os reagentes Superfloc C 581 N 300, A 100 e A 130 ... 60 Figura 5.18 Gráfico de sedimentação das partículas utilizando os reagentes Superfloc
A 130, A 100, N 300 e C 581 utilizando se água pluvial ... 61 Figura 5.19 Gráfico de sedimentação das partículas do efluente B alcalinizado com
Ca(OH)2 ... 64
Figura 5.20 Gráfico de Roberts para o ensaio do efluente B alcalinizado com Ca(OH)2 ... 64
Figura 5.21 Gráfico de sedimentação das partículas do efluente B alcalinizado com Ca(OH)2 e adição da solução de Superfloc A 100 ... 65
Figura 5.23 Gráfico de sedimentação das partículas do efluente B alcalinizado com Ca(OH)2 e adição da solução de Superfloc C 581 ... 66
Figura 5.24 Gráfico de Roberts para o ensaio do efluente B alcalinizado com Ca(OH)2 e adição da solução de Superfloc C 581 ... 67
Figura 5.25 Gráfico de sedimentação das partículas do efluente B alcalinizado com Ca(OH)2 e adição da solução de amido de milho gelatinizada ... 68
Figura 5.26 Gráfico de Roberts para o ensaio do efluente B alcalinizado com Ca(OH)2 e adição da solução de amido de milho gelatinizada ... 69
Figura 5.27 Gráfico de sedimentação das partículas do efluente B alcalinizado com Ca(OH)2 e adição da solução de NaOH ... 70
Figura 5.28 Gráfico de Roberts para o ensaio do efluente B alcalinizado com Ca(OH)2 e adição da solução de NaOH ... 70
Figura 5.29 Gráfico de sedimentação das partículas do efluente C alcalinizado com Ca(OH)2 ... 71
Figura 5.30 Gráfico de Roberts para o ensaio do efluente C alcalinizado com Ca(OH)2 ... 72
Figura 5.31 Gráfico de sedimentação das partículas do efluente C alcalinizado com Ca(OH)2 e adição da solução de Superfloc A 100 ...73
Figura 5.32 Gráfico de Roberts para o ensaio do efluente C alcalinizado com Ca(OH)2 e adição da solução de Superfloc A 100 ... 74
Figura 5.33 Gráfico de sedimentação das partículas do efluente C alcalinizado com Ca(OH)2 e adição da solução de Superfloc C 581 ... 74
Figura 5.34 Gráfico de Roberts para o ensaio do efluente C alcalinizado com Ca(OH)2 e adição da solução de Superfloc C 581 ... 75
Figura 5.35 Gráfico de sedimentação das partículas do efluente C alcalinizado com Ca(OH)2 e adição da solução de NaOH ... 76
Figura 5.36 Gráfico de Roberts para o ensaio do efluente C alcalinizado com Ca(OH)2 e adição da solução de NaOH ... 76
Figura 5.37 Gráfico de sedimentação das partículas do efluente C alcalinizado com Ca(OH)2 e adição da solução de amido de milho gelatinizada ... 77
Figura 5.38 Gráfico de Roberts para o ensaio do efluente C alcalinizado com Ca(OH)2 e adição da solução de amido de milho gelatinizada ... 77
Figura 5.40 Gráfico da velocidade de sedimentação versus a fração remanescente de sólidos do efluente A utilizando o reagente Superfloc A 130 ... 80 Figura 5.41 Gráfico da velocidade de sedimentação versus a fração remanescente de
sólidos do efluente primário do tipo A utilizando o reagente
Superfloc C 581... 81 Figura 5.42 Gráfico da velocidade de sedimentação versus a fração remanescente de
sólidos do efluente primário tipo A utilizando o reagente
Superfloc A 100 ... 82 Figura 5.43 Gráfico da velocidade de sedimentação versus a fração remanescente de
sólidos do efluente primário tipo A utilizando o reagente
Superfloc N 300 ... 82 Figura 5.44 Gráfico da velocidade de sedimentação versus a fração remanescente de
sólidos do efluente primário tipo A utilizando solução de
LISTA DE TABELAS
Tabela 3.1 Tabela com a disposição dos valores da concentração de sólidos em suspensão em função da profundidade e tempo de retenção ... 28 Tabela 3.2 Tabela com a disposição dos valores de concentração de sólidos em
suspensão, remoção e fração remanescentes de sólidos no efluente ... 38 Tabela 5.1 Concentração dos elementos solúveis resultante do processo de digestão
das cinzas ... 44 Tabela 5.2 Porosidade da polpa decantada após 24 horas de compressão ... 62 Tabela 5.3 Fração remanescente e removida da suspensão utilizando os reagentes do tipo Superfloc ... 83 Tabela 5.4 Valores de pH e turbidez da suspensão sintética em branco ... 86 Tabela 5.5 Concentração de metais pesados do efluente terciário clarificado ... 87 Tabela 5.6 Concentração de metais pesados do efluente clarificado do ensaio
utilizando reagente Superfloc C 581 ... 88 Tabela 5.7 Concentração de metais pesados do efluente clarificado do ensaio
utilizando reagente Superfloc A 100 ... 88 Tabela 5.8 Concentração de metais pesados do efluente clarificado do ensaio utilizando reagente Superfloc A 130 ... 89 Tabela 5.9 Concentração de metais pesados do efluente clarificado do ensaio utilizando reagente Superfloc N 300 ... 89 Tabela 5.10 Concentração de metais pesados do efluente clarificado do ensaio utilizando solução de amido gelatinizado ... 90 Tabela 5.11 Concentração de metais pesados do efluente primário e terciário resultante da sedimentação em proveta ... 91 Tabela 5.12 Valores de pH e turbidez do líquido clarificado do efluente terciário resultante da sedimentação em proveta ... 92 Tabela 5.13 Concentração de metais pesados do líquido clarificado do efluente terciário
resultante da sedimentação em proveta ... 93 Tabela 5.14 Concentração de metais pesados do efluente B clarificado do ensaio
utilizando Superfloc A 100 ... 93 Tabela 5.15 Concentração de metais pesados do efluente primário tipo B submetido a
alcalinização com Ca(OH)2 ... 95
1. I TRODUÇÃO
De acordo com a Organização dos Estados Americanos (OEA), as indústrias que mais contaminam o meio ambiente são as dos setores mineiro e metalúrgico que produzem diariamente grandes volumes de gases, resíduos líquidos e/ou sólidos, contendo elementos de toxicidade variada (Rubio e Tessele, 2004).
No caso dos efluentes líquidos, ou águas efluentes, estes são gerados a partir da contaminação por resíduos do processo industrial. Os efluentes líquidos ao serem despejados com os seus poluentes característicos podem causar a alteração de qualidade nos corpos receptores e, conseqüentemente, a sua poluição (degradação).
No caso das atividades de lavra e processamento mineral, estas podem contribuir para a poluição das águas superficiais e subterrâneas, caso não haja um controle rigoroso das operações envolvidas; levando se em consideração, principalmente, os processos erosivos e de assoreamento que ocorrem nas minas e pedreiras, os depósitos de material estéril permanente e de minério lixiviado, a área da usina de concentração e os locais de descarte de água, dentre outros (Virgili & Vianna, 2000, Custodio, 1992 apud Oliveira e Luz, 2001).
De acordo com Barbosa (2002), a extração de carvão e o seu processamento geram um passivo ambiental considerável, devido à exposição dos sulfetos contidos no carvão a agentes oxidantes, gerando uma drenagem ácida.
O carvão mineral é uma das principais reservas energéticas não renováveis do país, porém seu uso vem sendo questionado por gerar chuvas ácidas. Entre as várias tecnologias disponíveis para diminuir as emissões de óxidos poluentes no ar, as de menores custos efetivos são as que procuram diminuir os teores de enxofre do carvão antes da combustão (Sant'anna, 1999). O efluente líquido gerado é conhecido como água preta e também contém sólidos finos / ultrafinos, óleos e vários íons.
e oxigênio, na presença ou não de bactérias oxidantes. Este tipo de efluente é caracterizado por apresentar elevada acidez e altas concentrações de metais como Al, Cu, Fe, Mg, Mn e Zn, anions (sulfato) e compostos residuais orgânicos (no caso da drenagem ácida de minas de carvão).
Quando se fala em tratamento de efluentes líquidos, o objetivo principal é remover os contaminantes da água e deixar este efluente dentro dos padrões aceitáveis para serem despejados no corpo receptor. Os processos de tratamento de efluentes podem ser classificados em físico, químico e biológico, e consistem em uma série de operações unitárias que são aplicadas em diferentes combinações dependendo da situação em que se encontra o efluente. Os processos físicos de tratamento são considerados processos simples e se baseiam nas propriedades físicas dos contaminantes (Rao, 1991).
Estes processos compreendem basicamente os princípios de separação sólido líquido, como é o caso da etapa de peneiramento, sedimentação, flotação e filtração. Alguns processos químicos atuam em conjunto com estas etapas, seja através das propriedades químicas das impurezas ou pela adição de reagentes que possibilitem a precipitação, coagulação e desinfecção.
Os tratamentos dos efluentes ácidos característicos de uma drenagem ácida de mina envolvem a neutralização da acidez, para posterior precipitação e imobilização das espécies dissolvidas. Os agentes neutralizantes mais usados são calcário, cal virgem ou hidratada e soda cáustica. A desvantagem deste processo é que a precipitação resulta em lodo com alto teor de metais e, em caso de redissolução, os metais anteriormente imobilizados podem ser transportados podendo contaminar o meio ambiente (Dayube e Trindade, 2000).
Conforme Rytcey, 1989 (apud Oliveira, 2001) esforços na prevenção da drenagem ácida de minas podem incluir ações que envolvam:
− Restrição ou eliminação de oxigênio, dióxido de carbono, amônia, fósforo e vários nutrientes que promovam o crescimento das bactérias, por meio de revegetação imediata ou impermeabilização química;
− Restrição da ação da água da chuva pelos mesmos métodos adotados anteriormente;
− Redução do íon férrico responsável pela oxidação dos sulfetos;
− Controle de pH visando à redução da atividade bacteriana;
− Uso de bactericidas.
A caracterização do efluente permitirá a elucidação de quais mecanismos serão mais adequados para o tratamento do efluente oriundo das pilhas de carvão e calcário, de forma a deixar o efluente final nas devidas condições conforme estabelece a Resolução do CONAMA Nº. 357, de 17 de Março de 2005.
2. OBJETIVO E RELEVÂ CIA
O objetivo geral deste trabalho é simular e caracterizar o processo de percolação e lixiviação por águas pluviais em pilhas de carvão mineral, com subseqüente caracterização físico química dos efluentes gerados, em termos de potencial hidrogeno iônico (pH), concentração de partículas sólidas carreadas, comportamento dessas partículas frente às operações unitárias utilizadas em processos de separação sólido/líquido.
Os objetivos específicos são:
Caracterizar o efluente oriundo da percolação e lixiviação da pilha;
Detalhar e validar todo o processo de sedimentação das partículas finas de carvão mineral, a partir dos princípios de separação sólido/líquido;
3. REVISÃO BIBLIOGRÁFICA
3.1. Drenagem Ácida
Nos últimos anos, a indústria mineira tem movimentado maiores volumes de minerais em decorrência da automatização dos processos e do desenvolvimento de técnicas capazes de obter maior eficiência na lavra e processamento de minerais, incrementando também a geração de materiais não desejáveis (estéreis e rejeitos). Esses materiais não desejáveis, ricos em sulfetos, oxidam se gerando águas ácidas que, se não tratadas, provocariam sérios impactos ambientais. Este processo de oxidação é conhecido como drenagem ácida de mina DAM (Farfan et alii, 2004).
A drenagem ácida de minas ocorre quando resíduos de minas, estéreis ou rejeitos provenientes do beneficiamento, ricos em sulfetos metálicos, oxidam se ao ficarem expostos à água e ao oxigênio. A geração das drenagens ácidas pode resultar na contaminação das águas superficiais e subterrâneas, inviabilizando o uso destas para fins recreativos, agrícolas e de consumo. A drenagem ácida pode ocorrer nas minerações que envolvem a explotação comercial de minerais, como cobre, níquel, urânio, carvão e ouro (Ubaldo, 2005).
Este efluente é caracterizado usualmente por elevada acidez e altas concentrações de sulfato e de metais, tais como alumínio (Al), cobre (Cu), ferro (Fe), magnésio (Mg) e zinco (Zn), Esses efluentes podem atingir os mananciais de águas adjacentes, causando mudanças substanciais no ecossistema aquático, constituindo se em fonte difusa de poluição.
A drenagem ácida age como agente lixiviante dos minerais presentes produzindo um percolado rico em metais dissolvidos e ácido sulfúrico. Assim, os sulfetos, proveniente fundamentalmente da pirita e outros minerais sulfetados, são oxidados em um processo catalisado por bactérias, formando sulfatos e resultando em valores de pH extremamente baixos (pH = 2,0), mantendo elevadas concentrações de metais dissolvidos e elevados teores de sulfatos (>2.000 mg/L).
expressas pelas seguintes equações estequiométricas (MENDapud UBALDO, 2005): Oxidação da pirita:
2FeS2 + 7O2 + 2H2O → 2Fe+2 + 4SO2 + 4H+ ( 1 )
Oxidação da pirrotita:
Fe7S8 + 3/2 O2 + H2O → 7Fe2+ + + 8SO2 + 2H+ ( 2 )
Oxidação do ferro:
4 Fe+2 + O2 + 4 H+ → 4Fe+3 + 2H2 ( 3 )
Preciptação do ferro
Fe3+ + 3 H2O → Fe (OH)3 (sol) + 3 H+ ( 4 )
Oxidação da pirita pelo íon Fe+3
FeS2 + 14 Fe3+ + 8 H2O → 152 Fe+2 + 2SO24 + 16 H+ ( 5 )
Conforme descrito acima, as equações (1) e (2) de oxidação da pirita e pirrotita, respectivamente, podem ser catalisadas por bactérias, sendo a espécie Thiobacillus ferrooxidans a mais importante.
3.2. Fenômenos de agregação entre partículas
Em tratamento de efluentes, os processos de agregação de partículas finas, tais como a coagulação e a floculação, são principalmente utilizados na remoção de sólidos em suspensão que causam cor e turbidez no efluente (Amuda, 2006).
A presença de partículas coloidais é observada em diversos sistemas de origem natural ou individual, essas partículas podem apresentar se como dispersões estáveis ou formar agregados de tamanhos variados.
Os sistemas coloidais podem ser classificados em três grupos distintos, quais sejam: − As dispersões coloidais, que apresentam certa instabilidade termodinâmica
devido à elevada energia livre na superfície. São sistemas irreversíveis de difícil recomposição após a separação das fases;
− As soluções verdadeiras, neste caso trata se de suspensões de substâncias macromoleculares (naturais ou sintéticas) que estão termodinamicamente estáveis. São sistemas reversíveis que podem ser reconstituídos após a separação entre soluto e solvente;
− E os colóides de associação, geralmente chamados de eletrólitos coloidais e que apresentam estabilidade termodinâmica.
Uma partícula mineral, em suspensão aquosa, adquire uma carga elétrica superficial como resultado das interações entre as espécies iônicas presentes na superfície e as moléculas da água. A conseqüência natural do excesso de carga elétrica na superfície de um sólido é a aproximação de íons com carga elétrica contrária dando origem a uma dispersão estável.
Em uma suspensão, as energias de interação normalmente consideradas influentes na agregação e dispersão de partículas coloidais são originárias das forças de van der Waals e forças entre as duplas camadas elétricas das partículas. A estabilidade de uma suspensão coloidal, que se opõe à agregação das partículas dispersas, é uma conseqüência da interação repulsiva entre duas camadas de cargas elétricas iguais.
resultante de um ou mais mecanismos envolvendo ionização de moléculas da superfície, dissociação de grupos da superfície, adsorção iônica e defeitos da estrutura de superfície. Esta carga superficial influência a distribuição espacial dos íons próximos a esta região, atraindo íons de carga oposta e repelindo íons de mesma carga. Este efeito somado aos efeitos de movimento térmico, leva à formação da dupla camada elétrica.
3.2.1 Dupla Camada Elétrica
Quando é gerada uma camada de cargas elétricas na interface sólido – liquido, involuntariamente, uma camada de carga elétrica oposta surgirá na solução próximo à camada anterior com o objetivo de manter a eletroneutralidade do meio, constituindo se assim a dupla camada elétrica (DCE).
A dupla camada elétrica consiste de uma superfície carregada e um excesso de contra íons para neutralizar eletricamente e afastar da superfície co íons distribuídos de maneira difusa no meio polar. É constituída por duas regiões, uma região interna, que pode incluir íons adsorvidos, e uma região difusa na qual os íons se encontram distribuídos de acordo com a influência de forças elétricas e do movimento térmico.
São propostos vários modelos para melhor compreender a interação que ocorre na dupla camada elétrica, a exemplo têm se os seguintes modelos conforme proposto pro Silveira (2004):
−O Modelo de Helmholtz considera que a DCE se constitui de duas camadas compactas em um plano paralelo localizado entre a superfície ionizada do sólido e a cargas opostas do líquido. No entanto, este modelo não é válido, pois se fundamenta em que a DCE é uma constante e não depende do potencial eletrocinético, isto é, do potencial zeta onde os íons de carga oposta estariam fixos na interface sólido líquido.
carga oposta (contra íons) na interface sólido – líquido, e a agitação térmica procura dispersar os íons de carga oposta para a fase mais homogênea da solução.
−O Modelo de Stern considera que a dupla camada se divide em duas partes, separadas por um plano (Plano de Stern). Este plano está localizado a uma distância da superfície, idêntica ao raio hidratado, visto que o centro de um íon só pode se aproximar de uma superfície carregada, sem ser adsorvido especificamente, até uma distância correspondente a este raio hidratado. Este modelo propõe também a ocorrência de uma adsorção iônica específica em que os íons adsorvidos estão ligados a uma superfície através das forças eletrostáticas ou forças de van der Waals suficientemente fortes para se sobreporem à agitação térmica.
A Figura 3.1 apresenta de forma esquemática os modelos propostos da DCE.
Modelo de Helmhotz Modelo de Gouy – Chapman Modelo de Stern
Figura 3. 1: Modelos propostos de dupla camada elétrica. Fonte: Roman, 2004.
Segundo Silveira (2004), o modelo mais atual da dupla camada elétrica “surgiu pelo aprimoramento do modelo de Stern” em que na superfície das partículas sólidas ocorre a adsorção ou a dessorção de íons entre a partícula sólida e o meio polar (água).
térmica da suspensão, tem se a formação da camada difusa. O conjunto formado pela camada compacta e a camada difusa, resulta no modelo mais atual da denominada Dupla Camada Elétrica, conforme mostra a figura 3.2.
Figura 3.2: Modelo atual de dupla camada elétrica. Fonte: Pavanelli, 2001.
Monte e Peres (2004) acrescentam que, ao considerar os efeitos da adsorção específica, ou seja, quando os íons são adsorvidos na superfície por forças de caráter não eletrostático, a camada de Stern é subdividida em duas partes (dois planos), quais sejam: Plano Interno de Helmholtz (PIH) e Plano Externo de Helmholtz (PEH).
O PIH é aquele que passa pelo centro dos íons não solvatados (desidratados) e especificamente adsorvidos na superfície do sólido e o PEH é onde estariam adsorvidos os contra íons; é o plano que passa pelo centro dos íons solvatados (hidratados) e situados próximo a superfície do sólido (Figura 3.3).
A partir desta concepção de dupla camada elétrica, é fundamental citar a teoria DLVO, sigla que corresponde aos autores dessa teoria, os cientistas russos Derjaguin e Landau e os cientistas holandeses Verwey e Overbeek. Esta teoria descreve que, para se ter uma suspensão estável é necessário que as forças de interações repulsivas (forças da dupla camada elétrica) superem as forças de atração de van der Waals. Nesse sentido, independente da distância, as forças entre as partículas sempre serão de atração, no entanto, a partir de certa distância “d” da superfície da partícula, irão predominar as forças repulsivas. A figura 3.4 ilustra essa teoria.
3.2.2. Coagulação e Floculação
Na indústria mineral e nos processos de tratamento de efluentes industriais são utilizados dois mecanismos distintos no desempenho das atividades de separação sólido – líquido baseados em processo de agregação de partículas finas de diversas suspensões.
Os processos de agregação entre as partículas finas se dão devido aos fenômenos interfaciais entre as partículas coloidais estáveis e os íons da solução. Quando as partículas coloidais tendem a se agregar, a suspensão deixa de ser estável.
Para Lins (2000), as forças de van der Waals para duas partículas de mesma natureza, em água ou outro solvente, são atrativas. Neste caso, elas dependem da natureza da partícula e do solvente e da distância entre as partículas, no entanto, não dependem da carga das partículas, do valor do pH do meio nem da concentração de eletrólito da solução.
A repulsão ocorre devido à interação entre as duplas camadas elétricas de partículas com cargas superficiais idênticas, e este fenômeno depende da distância entre as partículas, da magnitude da carga ou potencial de superfície e, em muitos casos, do valor do pH do solvente.
O processo de coagulação consiste em aglomerar as partículas finas que se encontram em suspensões finais (ou em estado coloidal) e algumas que se encontram dissolvidas em partículas maiores que possam ser removidas por decantação ou filtração. A coagulação pode ser caracterizada por uma desestabilidade da suspensão devido à adição de produtos químicos que neutralizam as forcas elétricas superficiais e anulam as forças repulsivas. O fenômeno da coagulação resulta da agregação de partículas primárias na forma de um coágulo, mais denso e coeso que o floco, resultado da interação irreversível e mais forte entre as superfícies, movendo se como uma unidade cinética e hidrodinâmica.
Esta aglomeração é facilitada pela agitação suave, porém completa para facilitar o contato dos flocos uns com os outros sem, contudo, quebrá los. Não há redução de superfície, embora aqueles pontos da superfície que ficam em contato com a outra partícula fiquem bloqueados. As pequenas partículas mantêm sua identidade, apenas a independência cinética é perdida o floco se move como uma unidade hidrodinâmica.
Conforme Pearse (2000), o processo de coagulação envolve a neutralização da carga superficial da partícula sólida por ação da adsorção de contra íons inorgânicos ou seleção eletrostática; no caso da floculação, este processo envolve a formação de pontes entre as partículas sólidas através de cadeias longas de polímeros orgânicos (Figura 3.5).
Para La Mer apud Richard (1975), o termo “coagulação” pode ser utilizado para descrever a desestabilização de uma dispersão coloidal através da adição de íons que causam a redução das forças repulsivas da dupla camada elétrica presente na interface sólido líquido, ao passo que o termo “floculação” descreve a agregação de uma suspensão coloidal pela adição de polímeros solúveis de alto peso molecular na fase contínua à excepção da redução da carga.
3.3. Precipitação e/ou seqüestro de metais pesados
Os metais pesados ocorrem no ambiente aquático sob diversas formas: em solução na forma iônica ou na forma de complexos solúveis orgânicos ou inorgânicos; formando ou ficando retidos às partículas coloidais minerais ou orgânicas; ficando retidos no sedimento; ou incorporados à biota.
Alguns metais pesados são substâncias altamente tóxicas e não são compatíveis com a maioria dos tratamentos biológicos de efluentes existentes. Dessa forma, efluentes contendo esses metais não devem ser descartados na rede pública, para tratamento em conjunto com o esgoto doméstico (Aguiar, 2002).
Os metais pesados presentes nos efluentes industriais reduzem a capacidade autodepurativa das águas, devido à ação tóxica que eles exercem sobre os microorganismos. Esses microorganismos são os responsáveis pela recuperação das águas através da decomposição dos materiais orgânicos que nelas são lançados. Com isso, ocorre um aumento na demanda bioquímica de oxigênio (DBO), caracterizando um processo de eutrofização.
O que determina qual o mais apropriado método de tratamento para remoção de metais pesados do efluente é a forma com que estes metais se encontram na suspensão. A remoção dos metais pesados presentes em efluentes industriais pode ser feita por meio de diversos processos, tais como precipitação por via química, osmose reversa, resinas de troca iônica, eletro diálise e entre outros.
Várias pesquisas vêm sendo desenvolvidas com o objetivo de se empregar trocadores iônicos naturais como, por exemplo, os aluminossilicatos, os quais apresentam baixo custo e alta disponibilidade.
A aplicação de aluminossilicatos na remoção de metais pesados vem sendo muito estudada devido ao baixo custo, fácil obtenção e possibilidade de reutilização destes materiais.
Silveira (2004) submeteu os efluentes de drenagem ácida existentes no município de Santa Catarina a ensaios de precipitação e coagulação em colunas de sedimentação utilizando solução de hidróxido de sódio e hidróxido de cálcio, NaOH e Ca(OH)2
respectivamente, que apresentaram bom desempenho na remoção dos metais pesados
sob a forma de hidróxidos metálicos, numa faixa de pH = 9.
Silveira apud Merian (2004) explica que a reação de precipitação entre carga iônica e precipitado, chamada de regra de Shulze e Hardy, é realizada por um íon de um eletrólito adicionado em uma solução com carga elétrica oposta e o efeito do íon adicionado deve acrescentar o número de carga que o íon da solução possui, tendo como resultado um produto insolúvel em água.
Figura 3.6: Diagrama da concentração envolvendo a solubilidade e a precipitação de hidróxidos metálicos. Fonte: Silveira, 2004.
3.4. Processos de sedimentação
As operações de separação sólido líquido podem ser sub divididas em dois grupos, conforme a existência ou não de um obstáculo físico que impede a passagem das partículas, a saber:
− Processos sem barreira envolvem as operações de flotação, sedimentação por gravidade e sedimentação centrífuga.
− Processos com barreira envolvem as operações de filtração com formação de torta, filtração com leito profundo e separação de líquidos em peneiras.
Para Schawabe (1984), a sedimentação é uma operação física, sem barreira, de separação de partículas sólidas baseada na diferença de densidade gravitacional entre as fases líquida e sólida. Este processo baseia se em fenômenos de transporte, sendo que as partículas estão sujeitas à ação da gravidade, do empuxo e pelas forças de atrito que se desenvolvem entre o líquido e partícula.
Na sedimentação, o objetivo principal do processo é concentrar um sólido dentro de um líquido de forma a promover a separação total do líquido e obter uma polpa praticamente seca. Dependendo do produto final que se deseja obter, a sedimentação apresenta duas funções: espessamento, quando o que se deseja é uma polpa concentrada, e clarificação, quando o produto final é o líquido clarificado.
As características do regime de sedimentação das partículas em suspensão dependem da natureza das partículas, de sua concentração e das condições na unidade de sedimentação. Esta última característica pode ser classificada em três tipos de regimes, sendo que é possível que durante uma operação de sedimentação possa ocorrer mais de um tipo em um dado tempo, ou mesmo os três tipos ocorrerem simultaneamente.
O regime de clarificação é caracterizado pela individualidade de comportamento das partículas. Trata se da decantação de uma polpa qualquer totalmente diluída, para a qual podem ser aplicadas, de forma satisfatória, as formulações clássicas de velocidade de sedimentação de partículas, quais sejam, a Lei de Stokes e Lei de Newton. Para Roman (2004) isto ocorre quando o teor de sólidos é menor que 3%, e levando se em consideração que as partículas são esféricas.
Nesse sentido, Sperling (1996) julga que as partículas são ditas individuais, isto é, não floculam nem se aglomeram umas às outras, sendo assim, são conservadas as suas propriedades físicas, como forma, tamanho e densidade.
Uma partícula, ao se movimentar linearmente através de um fluido, sofre a ação de uma força externa, e essa força externa pode ser a força da gravidade ou a força de um campo de forças centrífuga. A teoria básica do movimento dos sólidos através dos fluidos está baseada no conceito do movimento dos corpos livres.
θ d dv m
F
gc= × (3.1)Onde F é a força resultante que atua sobre qualquer corpo, θ d
dv
é a aceleração do corpo, e m a massa do corpo.
As forças que atuam sob um corpo em queda são a forças externa (P), a força de empuxo (E) e a força de arraste (Rf).
Segundo Lima e Luz (2001), para uma partícula caindo no vácuo, sob um campo uniforme de forças (geralmente gravitacional), de modo que outras partículas que poderiam estar presentes não interfiram na sua queda, à medida que a partícula cai, a sua velocidade aumenta e continuará a crescer indefinidamente, independente do seu tamanho e densidade, até que as forças acelerativas e resistivas sejam iguais. Quando essa situação for atingida, ou seja, quando há o equilíbrio entre a força gravitacional e a força de resistência do fluido, a partícula alcança sua velocidade terminal de sedimentação e, portanto, cai a uma taxa constante.
A velocidade constante assumida pela partícula é chamada de velocidade terminal, princípio básico da Lei de Stokes. A velocidade da partícula permanece constante durante o resto da sua queda, a menos que o equilíbrio entre as forças seja alterado. (FOUST, 1960).
(
s l)
p
s d g
V ρ ρ
η× × × −
× = 2 18 1 (3.2) em que:
Vs: velocidade de sedimentação da partícula [m/s] g = aceleração da gravidade [m/s2]
η: viscosidade dinâmica do fluído [Pa.s] ρs: densidade da partícula [Kg/m3] ρl: densidade do líquido [Kg/m3]
dp: diâmetro da partícula [m]
A Lei de Stokes é aplicável para sedimentação de partículas movimentando se em regime laminar, onde o número de Reynolds (Re) é menor que 0,2. O número de Reynolds, considerando que as partículas são esféricas e estão se movendo em um meio fluido, é determinado através da seguinte equação:
η ρl p
s d
V × ×
=
Re (3.3)
onde:
Re: número de Reynolds
Vs: velocidade de sedimentação da partícula [m/s] dp: diâmetro da partícula [m]
ρl: densidade do líquido [Kg/m3]
Quando a sedimentação das partículas ocorre em um regime laminar em transição ou em regime turbulento, a velocidade da partícula isolada é expressa abaixo através da Lei de Newton. Neste sentido, Lima e Luz (2001) julgam que a resistência ao movimento no fluido é inteiramente devida aos microturbilhões.
)
(
arr l p l s s C d g V × × × − × × = ρ ρ ρ 3 4 (3.4) onde:Vs: velocidade de sedimentação da partícula [m/s] ρs: densidade da partícula [Kg/m3]
ρl: densidade do líquido [Kg/m3]
dp: diâmetro da partícula [m]
Carr: coeficiente de arraste da partícula
Há inúmeras formas de expressar o coeficiente de arraste da partícula, uma delas é a sugerida por Abraham em função do número de Reynolds, conforme demonstrada abaixo: 2 06 , 9 1 284 , 0 + × = e arr R
C (3.5)
Em uma suspensão, à medida que a concentração de sólidos aumenta, as partículas ou os agregados tendem a se aproximar uns dos outros até atingir um estado em que a livre movimentação da fase sólida é impedida.
Na sedimentação por zonas, conforme vão se reduzindo os espaços vazios entre as partículas sólidas da polpa decantada e com ascensão do líquido que é deslocado em função desta polpa em regime de decantação, os sólidos são induzidos a sedimentar juntos, possibilitando a formação de uma interface nítida entre a polpa decantada e o líquido sobrenadante (MASINI, 1994).
posições fixas entre si, como peças de uma estrutura. Isto faz com que as partículas se arranjem formando camadas que sedimentam de tal modo que cada camada se comporta como uma massa única sujeita a uma resistência do fluido ao seu movimento tanto maior quanto mais elevada for a sua concentração de sólidos.
Para Santos (et al 2005), este fenômeno característico da sedimentação zonal é semelhante à passagem de um fluido através de um leito filtrante granular, onde a resistência ao deslocamento do fluido é função da proximidade entre os grãos constituintes do leito. Tem se por resultado ser a velocidade de sedimentação da camada tanto menor quanto maior for sua concentração de sólidos.
Figura 3.7: Ensaio de sedimentação zonal em coluna (a) Instante inicial (b) Instante final. Fonte: Santos, 2005.
HT = altura total da coluna de suspensão no início do ensaio [cm];
HU = altura da camada de lodo (com concentração XU [mg/L]) ao final do ensaio [cm]; X = concentração de sólidos inicial [mg/L];
XU = concentração de sólidos final (máxima) [mg/L].
ao peso das partículas que são adicionadas como resultado da sedimentação das partículas situadas no líquido sobrenadante.
A Figura 3.8 ilustra, de forma genérica, os três tipos de regimes segundo os quais as partículas sólidas sedimentam. As provetas de número 0 e 1 representam o regime de sedimentação discreta caracterizado pela individualidade de comportamento das partículas. Na sedimentação por zonas (provetas 2 e 3), conforme a concentração de sólidos aumenta, as partículas ou os agregados tendem a se aproximar uns dos outros e são induzidos a sedimentar juntos, possibilitando a visualização da interface entre a polpa decantada e o líquido clarificado. Por fim, com o aumento da concentração de sólidos, a sedimentação ocorre por compressão da estrutura das partículas, originando uma resistência ao movimento de queda dos sólidos (provetas 4 e 5).
3.5. Sedimentação em proveta
A sedimentação em proveta é um método utilizado na determinação experimental da velocidade de sedimentação de uma polpa com determinada concentração de sólidos. A suspensão é previamente homogeneizada e colocada em uma proveta graduada de secção constante e deixada em repouso; decorrido certo período de tempo, verifica se que as partículas mais grossas sedimentam se no fundo da proveta, ao passo que as partículas finas permanecem em suspensão.
Este tipo de ensaio fornece dados necessários para traçar uma curva de sedimentação, base fundamental no dimensionamento de equipamentos de decantação (clarificador ou espessador). O projeto de dimensionamento consiste no cálculo da área de decantação Sobtida através da vazão volumétrica suspensão QA (alimentação do clarificador) e da velocidade de sedimentação da polpa v, conforme mostra a equação abaixo.
v Q
S = A (3.6)
em que:
S – Área do equipamento [m2]
QA – Vazão volumétrica da suspensão [m3/s]
ν – Velocidade de sedimentação [m/s]
De acordo com Gomide (1980) “a velocidade de decantação é obtida diretamente da curva de decantação”. Durante o processo de sedimentação das partículas no interior da proveta, mede se a altura H da polpa decantada ao longo de determinado período de tempo θ. Traça se a curva H versus θ , em que H corresponde à altura da interface da polpa em processo de sedimentação e a suspensão clarificada no instante θ. A altura inicial da suspensão é representada por H0. Nesse sentido, todas as partículas que
decantaram terão velocidade de decantação maior que
( )
θθ H H0−
. O tempo final de sedimentação da polpa, θf e Hf, corresponderá à altura final da polpa sedimentada, sendo assim, a velocidade de decantação pode ser obtida conforme a equação abaixo:
f f H H v θ − = 0 3.7 0
H e Hf em m2 ; θfem segundos (s)
A Figura 3.9 ilustra as fases do processo de sedimentação e a forma com que os resultados dos experimentos de sedimentação em proveta foram plotados.
Figura 3.9: Ensaio de sedimentação.
Gráfico 1: Esquema geral do gráfico de Roberts para um caso hipotético.
Os ensaios de sedimentação em proveta consistem em avaliar a capacidade dos reagentes utilizados para agregar as partículas finas, tais como, coagulantes e floculantes. E, por conseguinte, verificar se o processo de sedimentação é realmente viável como parte no processo de tratamento de efluentes.
3.6. Sedimentação em coluna
Os ensaios em coluna de sedimentação contendo a suspensão em estudo constituem o procedimento para calcular a taxa de overflow V0, tempo de retenção θr versus a taxa de remoção dos sólidos suspensos R %. Através deste tipo de ensaio e com os parâmetros mencionados é possível dimensionar uma operação de decantação que visa à clarificação do efluente, através da remoção dos sólidos contidos na suspensão.
De acordo com Metcalf & Eddy (1979), Vianna (2002) e Silveira (2004), a coluna de sedimentação deve apresentar as seguintes características operacionais:
b. Pontos de amostragem eqüidistantes entre si de 500 mm;
c. Coleta das amostras em tempo e volume pré determinados ao longo dos pontos de amostragem;
d. Valores de remoção dos sólidos suspensos [%] devem ser plotados como números relacionados as alturas correspondentes pela profundidade de coleta (eixo das ordenadas) e tempo (eixo das abscissas); o cálculo de remoção de sólidos em suspensão é feito através da seguinte equação:
100 × − = f f i C C C R 3.8 em que
R: remoção de sólidos em suspensão [%];
Ci: Concentração inicial de sólidos da polpa [kg/m3]; Cf: Concentração final de sólidos [kg/ m3];
e. Com os valores da concentração de sólidos suspensos em cada profundidade e em cada tempo, conforme descrito em (2º) e os dados do percentual de sólidos removidos, constrói se uma tabela com a seguinte disposição:
Tabela 3.1: Tabela com a disposição dos valores da concentração de sólidos em suspensão em função da profundidade e tempo de retenção
f. A partir dos valores da tabela, constrói se um gráfico da profundidade versus tempo;
Profundidade 1 = 0,50 2 = 1,00 3 = 1,50 = 2,00 = 2,50 = 3,00
SS Cf R Cf R Cf R Cf R Cf R Cf R
Tempo (min) mg/L % mg/L % mg/L % mg/L % mg/L % mg/L %
g. Entre os pontos mencionados na tabela, interpolam se curvas de percentagem de remoção constante, conhecidas como curvas de isoconcentração (ex: 25%, 35%, até 90%), sendo um exemplo representado na figura 3.10;
Figura 3.10: Representação das curvas de isoconcentração. Fonte: Roman, 2004
h. Uma série de tempos de retenção deve ser selecionada. A percentagem de remoção que corresponde a uma determinada altura h, em relação a cada tempo de retenção θ, é calculada uma vazão específica de overflow ν0, sendo que:
θ h
vo = 3.9
vo:Taxa de overflow [m3.s1.m2 = m/s];
h: altura da coluna de sedimentação [m]; θ: tempo de retenção selecionado [s]; RT: remoção total [%].
3.10
R1 a R7: curvas de isoconcentração [%];
Z1 a Z6: profundidade média entre as curvas no tempo selecionado [m];
θ1 a θ4 : tempo de sedimentação [s];
0
H a H6: alturas fixas dos pontos amostrais da coluna de sedimentação [m].
( ) ( ) ( ) ( ) ( ) ( 7 6)
0 6 5 6 0 5 4 5 0 4 3 4 0 3 2 3 0 2 1 2 0 1
1 R R
H Z R R H Z R R H Z R R H Z R R H Z R R H Z R
Todo o aparato utilizado para realizar os ensaios de sedimentação em coluna pode ser visualizado na figura 4.4. Cada coluna tem 3,0 m de altura e os pontos de amostragem distam entre si de 0,5 m.
3.7. Fluxograma simplificado de tratamento de drenagem ácida
Na ilustração a seguir é apresentado um esquema hipotético típico de usina de tratamento para geração de efluente pluvial de pilha de carvão mineral que possa ser destinado a corpo receptor da classe 3 da Resolução do CONAMA Nº. 357 de 17 de março de 2005, na seção I, artigo 4º, inciso IV, a saber:
"IV. Classe 3: águas que podem ser destinadas:
a) Ao abastecimento para consumo humano, após tratamento convencional ou avançado;
b) à irrigação de culturas arbóreas, cerealíferas e forrageiras; c) à pesca amadora;
d) à recreação de contato secundário; e e) à dessedentação de animais.”
Naturalmente, a rota apresentada, dentre as muitíssimas aplicáveis, é das mais simplificadas, baseada em clarificação seguida de filtragem e, por fim, adequação do pH. Pressupõe se que a remoção dos metais pesados dar se ia na etapa de clarificação, via ação seqüestrante dos floculantes.
Obviamente, se os floculantes não promoverem a remoção dos metais pesados, seria necessária a introdução de etapa de remoção de metais pesados, alternativamente obtida por: aumento de pH (formação de hidróxidos), sulfetização dos metais, oxi redução eletroquímica, adsorção, troca iônica, remoção por agentes oxidantes fortes (peróxido de hidrogênio, hipoclorito de sódio ou cálcio), entre outros.
Em vista de a clarificação usualmente não ser perfeita, mas com baixa concentração mássica de sólidos, no fluxograma mostrado adotou se remoção dos ultra finos remanescentes em suspensão por meio de filtro de cartucho, ou similar.
4. METODOLOGIA
Todos os ensaios e análises foram realizados nos laboratórios dos Departamentos de Engenharia de Minas e Geológica da Universidade Federal de Ouro Preto (DEMIN DEGEO/UFOP).
4.1. Amostras, reagentes e equipamento. 4.1.1. Material sólido carvão mineral
As amostras de carvão mineral foram procedentes da COPELMI Mineração Ltda. Todo este material foi homogeneizado, quarteado e separado em lotes de aproximadamente 15 kg (Figura 4.1).
Figura 4.1 – Homogeneização do carvão mineral.
4.1.2. Equipamentos e Reagentes −Equipamentos:
•Medidor de pH; •Turbidímetro;
•Pulverizador de moinho orbital de anéis de carbeto e tungstênio.
−Reagentes
Os reagentes utilizados para possibilitar o processo de agregação foram três tipos de poliacrilamida do tipo Superfloc e uma amina poliquaternária em água do mesmo fabricante da poliacrilamida, amido de milho da Cargill e soluções de hidróxido de cálcio Ca(OH)2 e hidróxido de sódio NaOH, conforme listados
abaixo:
•Superfloc A 100 (da Cytec); •Superfloc A 130 (da Cytec); •Superfloc N 300 (da Cytec); •Superfloc C 581 (da Cytec);
•Amido de milho da Cargill (solução gelatinizada com NaOH); •Hidróxido de cálcio
•Hidróxido de sódio
4.2. Roteiro metodológico
Os ensaios para avaliar a eficiência dos reagentes auxiliares no processo de agregação das partículas finas de carvão mineral e, por conseguinte, a execução dos ensaios de sedimentação foram realizados conforme demonstra o esquema a seguir.
Para efeito de padronização de nomenclatura, em especial para se evitar dubiedade de sentido da palavra efluente, neste trabalho foram considerados três tipos de efluentes, quais sejam:
Efluente Primário
Este efluente seria aquele oriundo diretamente do processo de percolação sobre uma pilha de carvão mineral em pátio industrial. O efluente primário seria a alimentação do clarificador, em circuito típico de tratamento de efluentes. Dada a inexistência de efluente industrial para o presente trabalho, o mesmo foi simulado em escala de bancada (rotulado como tipo A) e piloto (rotulado como tipo B).
carbeto de tungstênio. Este efluente foi utilizado com concentração mássica de sólidos na faixa entre 2 % e 5 %.
• Tipo B: resultante da simulação de precipitação pluvial sobre um leito de carvão mineral bitolado abaixo de 50 mm. É composto do material carreado resultante das cinco precipitações realizadas sobre o leito de carvão mineral.
• Tipo C: resultante da precipitação pluvial real sobre o mesmo leito de carvão mineral citado acima.
Os ensaios de clarificação do efluente primário tipo A foram realizados imediatamente após a formação da suspensão (tempo médio de maturação de aproximadamente 5 minutos). Por seu turno, os ensaios com o efluente primário tipo B foram executados após maturação de 7 dias. E para o efluente tipo C, os ensaios foram realizados após um período de maturação de apenas 12 horas.
Efluente Secundário: é o material resultante do processo de clarificação, isto é, o líquido clarificado. Este efluente alimentaria a próxima etapa de um sistema típico (hipotético) de tratamento de efluente, em geral filtragem em linha e/ou remoção de metais pesados residuais em leitos adsortivos (carvão ou resina). O tratamento físico químico deste tipo de efluente ficou fora de escopo do presente trabalho. Adotou se unicamente remoção de ultrafinos por filtro de Büchner, sob vácuo, simulando o tratamento via filtro de cartucho.
Figura 4.2: Fluxograma do roteiro metodológico dos ensaios Material Bruto
Homogeneizado
Separado em lotes de 15 kg aproximadamente
Efluente A Efluente B
Ensaio de Sedimentação em Proveta Ensaio de Sedimentação em Coluna Ensaio de Sedimentação em Coluna Ensaio de Sedimentação em Proveta Análise físico química e química
Amostra para ensaio de percolação pluvial
Determinação da Velocidade de Sedimentação
Ensaio de Percolação em leito Amostra para
cominuição
Preparação de suspensão sintética
R% de Sólidos em Suspensão e Concentração de Metais Pesados Determinação da Velocidade de Sedimentação R% de Sólidos em
Suspensão e Concentração de
4.3. Ensaios de sedimentação 4.3.1. Sedimentação em proveta
Os experimentos de sedimentação em proveta contendo finos de carvão visaram avaliar o comportamento do efluente frente à sua clarificação. Provetas de 1.000 ml contendo a suspensão do efluente primário foram utilizadas nos ensaios (Figura 3.4.1).
Inicialmente a suspensão foi homogeneizada e condicionada juntamente com o reagente, e posteriormente deixada em repouso onde as cotas da interface formada pela sedimentação foram registradas em função do tempo.
Os resultados dos experimentos de sedimentação em proveta foram plotados na forma de gráfico de sedimentação. O ponto de início de compressão da polpa foi determinado pelo gráfico de Roberts plotando se os valores de tempo em função da diferença entre cota da interface clarificada no tempo considerado, H (θ), e cota do sedimento final (“tempo infinito”), H∞, ambos em milímetros.
Nos ensaios de sedimentação em proveta utilizando o efluente primário do tipo B, após 5 horas de sedimentação da suspensão, utilizando se os mesmo reagentes supracitados, eram retiradas duas alíquotas de 100 ml cada da parte clarificada para verificar a porcentagem de remoção de sólidos em suspensão e a concentração de metais pesados.
Figura 4.3: Ensaios de sedimentação em proveta.
4.3.2. Sedimentação em coluna
Para Corbit (1990) apud Roman (2004) é convencional utilizar a técnica de ensaios em coluna de sedimentação no dimensionamento das operações de clarificação que ocorrem na presença de agregados de partículas coloidais, em suma, permite determinar parâmetros dimensionais de um decantador em escala industrial.
primário (Tipo A e B). Os resultados foram dispostos em forma de gráfico da fração remanescentes de sólidos no efluente (Fss) versus a velocidade espacial de
sedimentação da polpa conforme proposto por Sperling (1996).
A tabela 3.2 apresenta a forma com que os dados da sedimentação em coluna foram dispostos e os valores utilizados para a construção do gráfico supracitado.
Tabela 3.2: Tabela com a disposição dos valores de concentração de sólidos em suspensão, remoção e fração remanescentes de sólidos no efluente. Tempo de retenção
[minuto] Altura de coleta
Concentração de SS [g/L]
% de Remoção de SS Fss
H6 H5 H4 H3 H2 H1 vol m
Css = s × ×100
− = vol Ci C C
R i f
i f ss Css Css F =
Os valores da velocidade espacial de sedimentação foram obtidos através da razão entre a profundidade do ponto de amostragem e o tempo de retenção.
Por este gráfico é possível verificar em que ponto houve maior concentração de partículas ao longo do processo de decantação da suspensão e qual foi a velocidade média de sedimentação das partículas.
Nos ensaios de sedimentação em coluna, o efluente era preparado em um recipiente à parte e homogeneizado; antes de se adicionar o reagente era coletada uma alíquota da suspensão para análise de teor de metais pesados; após a adição do reagente, novamente era retirada uma alíquota a fim de verificar a concentração de sólidos em suspensão e o teor de metais pesados. Completava se a coluna com a devida suspensão até o volume total de 24 litros.
era determinada a concentração de sólidos em suspensão e, por conseguinte, a porcentagem de remoção. A Figura 4.4 mostra a ordem de coleta das alíquotas na coluna de sedimentação durante os ensaios.
Figura 4.4: Colunas de sedimentação e a ordem de coleta dos pontos de amostragem.
A cada 60 minutos de ensaio, era feita uma coleta separada de uma alíquota de 100 ml nos pontos 4, 5 e 6 a fim de determinar, a partir do teor de metais pesados por meio de acoplamento de plasma induzido ICP / OES, a eficiência do reagente em questão no seqüestro de metais pesados no efluente.
No entanto, para os ensaios de sedimentação em coluna longa, o critério de escolha dos reagentes que foram utilizados nestes ensaios foi baseado no desempenho dos reagentes usados nos ensaios de sedimentação em proveta em termos de velocidade de sedimentação. Neste caso foram utilizados todos os reagentes do tipo Superfloc e solução de amido de milho.
H
6Ponto 6
H
5Ponto 5
H
4Ponto 4
H
3Ponto 3
H
2Ponto 2
No caso do efluente primário do tipo B, oriundo do processo de lixiviação no leito de carvão, um único ensaio foi realizado com o reagente Superfloc A 100, que apresentou melhor desempenho nos ensaios de sedimentação em proveta em termos de velocidade de sedimentação.
4.4. Ensaio de precipitação sobre o leito de carvão mineral
Os ensaios de percolação e lixiviação do carvão mineral foram executado por meio de um leito de aproximadamente 20 cm de espessura do material, disposto sobre uma área de 2,28 m2. A precipitação pluvial ocorreu por meio de um duto com saída de água na extremidade, com vazão na cota de aspersão igual a 36 ml/s, e manipulado de forma manual sob o leito de carvão mineral. A Figura 4.5 mostra como foi realizado este ensaio.
Figura 4.5 – Ensaio de precipitação sobre o leito de carvão mineral
O efluente era coletado por meio das duas saídas paralelas na parte inferior do aparato no qual foi realizado o ensaio de precipitação sobre o leito de carvão mineral.
precipitação ao final de dez horas de encharcamento do leito, e por fim, com o objetivo de verificar se houve algum tipo de reação dos sulfetos presentes no material, foi realizada outra precipitação após 72 horas do início do primeiro ensaio.
Procurou se simular o tempo de retenção em canaletas e/ou bacias de retenção a jusante da pilha e a montante de um hipotético sistema de tratamento de efluentes baseado no processo de clarificação. Assim, o material resultante da precipitação sobre o leito de carvão mineral permaneceu em repouso (maturação) por 7 dias antes de se iniciar os ensaios de sedimentação, tanto em coluna, quanto em proveta.
Para permitir um cotejo dos resultados, os valores da concentração de metais pesados contidos no líquido clarificado, submetido ao processo de filtração (efluente terciário), no âmbito deste trabalho, foram comparados com os valores estabelecidos para a classe 3, dispostos na dita resolução, conforme se pode ver no adendo A.
4.5. Caracterização do material sólido – Carvão Mineral
A caracterização do carvão mineral foi baseada na análise das cinzas resultantes da queima de certa quantidade do material. A cinza do material foi submetida ao processo de digestão, o qual foi executado de três formas diferentes:
a) Método da digestão total via Savillex,
b) Digestão por adição de água régia, uma combinação de ácido clorídrico e ácido nítrico na proporção 3:1 e
c) Digestão por adição de ácido clorídrico apenas.
a) Método da digestão total via Savillex
Para a perda por calcinação, o material é submetido à “queima” em mufla em temperatura de aproximadamente 1.000º C. A cinza resultante dessa queima passa então por um processo de digestão por meio de adição de ácidos concentrados.
A seqüência de adição dos ácidos é descrita abaixo:
1º. Uma alíquota de aproximadamente 250 mg da cinza é colocada no interior de um frasco Savillex;
2º. Foram adicionados 2 ml de ácido clorídrico HCl na concentração 10 mol/L e colocado sobre placa secadora para secar à temperatura de aproximadamente 100º C;
3º. Com o material já seco, 3 ml de ácido clorídrico da mesma concentração e 1 ml de ácido nítrico HNO3 10 mol/l foram adicionados, e novamente
levado para secagem em placa secadora;
4º. Após secagem, foram adicionados 2 ml de ácido fluorídrico concentrado HF e o material foi levado para secar à uma temperatura de 140ºC, e depois de seco, adicionou se novamente 2 ml do mesmo ácido, e com o frasco fechado foi levado para a placa aquecedora por aproximadamente 30 horas.
5º. Após as 30 horas sobre a placa aquecedora, o frasco foi retirado desta,colocado para esfriar e depois novamente colocado, sem tampa, sobre a placa para secar à uma temperatura de 110ºC;
6º. Em seguida, foram adicionados 2 ml de ácido nítrico 10 mol/l em duas etapas, ou seja, 2 ml do ácido e depois da amostra já seca, foi adicionado mais 2 ml do mesmo ácido.
7º. Após a adição do ácido nítrico, foi adicionado novamente o ácido clorídrico 10 mol/l;
8º. Por fim, após a secagem foi adicionado 25 ml do ácido clorídrico e levado para a placa aquecedora durante 2 horas.
A figura 4.6 mostra algumas fases durante o processo de digestão do carvão.
Figura 4.6: Digestão das cinzas do carvão.
b) Digestão por adição de água régia
Uma alíquota de 1,0007 g do material sólido bruto foi submetido à “queima” em mufla a 1.000ºC 2 horas. As cinzas resultantes desta queima foram submetidas à digestão apenas pela adição de água régia, ou seja, as cinzas foram colocadas dentro de um Becker e foi adicionada uma combinação de ácido clorídrico e ácido nítrico na proporção 3:1 e colocadas sobre chapa aquecedora até dissolução total das cinzas.
Após dissolução das cinzas, o material do Becker era filtrado e transferido para um balão volumétrico para posterior leitura em espectrofotômetro de emissão atômica com fonte plasma.
c) Digestão por adição de ácido clorídrico