UNIVERSIDADEFEDERALDEOUROPRETO DEPARTAMENTO DE CIÊNCIAS BIOLÓGICAS LABORATÓRIO DE FISIOLOGIA CARDIOVASCULAR NÚCLEO DE PESQUISA EM CIÊNCIAS BIOLÓGICAS – NUPEB
O ÓXIDO NÍTRICO ATUA SOBRE RECEPTORES GLUTAMATÉRGICOS NMDA NA RVLM NA REGULAÇÃO DA PRESSÃO ARTERIAL
UNIVERSIDADEFEDERALDEOUROPRETO
DEPARTAMENTO DE CIÊNCIAS BIOLÓGICAS
LABORATÓRIO DE FISIOLOGIA CARDIOVASCULAR
NÚCLEO DE PESQUISA EM CIÊNCIAS BIOLÓGICAS – NUPEB
O ÓXIDO NÍTRICO ATUA SOBRE RECEPTORES GLUTAMATÉRGICOS NMDA NA RVLM NA REGULAÇÃO DA PRESSÃO ARTERIAL
AUTOR: Natália Lima Santos Machado
ORIENTADOR: Prof. Dr. Deoclécio Alves Chianca Júnior
CO-ORIENTADOR: Prof. Dr. Rodrigo Cunha Alvim de Menezes
v
vi
vii
a consciência de saber mais conduz-me à consciência de saber pouco,
aliás, apetece perguntar, que é saber...
(José Saramago, 1989)
viii
À minha família por ser meu alicerce de
equilíbrio para realização de todos os sonhos.
Ao Daniel por ser sempre meu incentivador orgulhoso.
Ao ensino público que proporcionou esta preciosa oportunidade.
Agradecimentos
À Deus por iluminar meu caminho.
Aos meus pais Grimaldo Machado e Glaúrea Lima, pelo suporte de
amor, equilíbrio e carinho.
Ao meu querido irmão Roberto Lima (Tuty) pelos conselhos, apoio e
incentivo constante.
Ao Daniel Pimentel, pelo amor, compreensão e pela sempre orgulhosa
motivação.
À República Patotinha, meu segundo lar, pelo acolhimento e por
dividirem comigo os momentos alegres e tristes.
Ao orientador Prof. Dr. Deoclécio Alves Chianca Júnior (Déo), pelo
apoio, incentivo e por acreditar na minha capacidade e potencial,
principalmente por me conceder esta valiosa oportunidade.
Ao Prof. Dr. Rodrigo Cunha Alvim de Menezes, pela constante orientação,
agradeço, especialmente, a generosidade de tornar o meu caminho
menos tortuoso.
ix
Ao Prof. Dr. Luciano Gonçalves Fernandes, pelo importante aprendizado durante
a iniciação científica.
Ao Prof. Dr. Carlos Xavier, pela sempre gentil colaboração e pela nobre influência
na minha formação profissional e acadêmica.
A Fabiana Aparecida Rodrigues, por me ensinar os primeiros passos no caminho
da ciência.
A Escola de Nutrição, pelo imprescindível apoio e contribuição nesta jornada,
especialmente aos Professores: Ana Lúcia dos Santos Regis, Ana Carolina Pinheiro
Volp, Camilo Dalton, Maria Cristina Passos, Marcelo Eustáquio Silva e Renata
Freitas.
À grande amiga Fernanda Silva, pelos ouvidos atenciosos, pelas aventuras e por ser
sempre tão solícita. Agradeço principalmente pelo companheirismo, incentivo e
amizade.
À Universidade Federal de Ouro Preto, pelo ensino público de qualidade e por
proporcionar esta preciosa oportunidade.
Às instituições de apoio a pesquisa, por viabilizarem a realização deste trabalho.
Aos atuais colegas do Laboratório de Fisiologia Cardiovascular da UFOP, Aline
Maria, Aline Rezende, Alessandra, Laura e Tayane pela colaboração e pelo
aprendizado, especialmente, ao Luiz Henrique Fortes pelas boas conversas e aos
“antigos” companheiros: Arlete Penitente, Míriam Rodrigues, Vanessa Bezerra,
Joelma Gomide, João Victor Albuquerque e Arthur Alves pelo aprendizado e
amizade.
Aos Técnicos, Milton Alexandre de Paula e Marli de Souza, pela dedicação,
cuidados e por serem sempre prestativos.
x
Aos demais colegas, professores e membros do NUPEB, pelo aprendizado e convívio,
especialmente as amigas: Ana Lia Mazzeti, Tassiane Assíria e Maíra Araújo por
terem tornado os dias mais suaves.
SUMÁRIO
1-
INTRODUÇÃO... ...1
1.1 - A Região Rostro Ventrolateral do Bulbo (RVLM) e a Regulação Cardiovascular ... 1
1.2 - Aminoácidos Excitatórios (AAE) e Receptores Ionotrópicos Glutamatérgicos ... 5
1.3 - O Óxido Nítrico e o Sistema Cardiovascular ... 7
2 – OBJETIVOS...10
2.1 - Objetivo Geral: ... 10
2.2 - Objetivos Específicos: ... 10
3 - MATERIAL E MÉTODOS...11
3.1 – O Modelo Animal ... 11
3.2 - Preparo de drogas/substâncias utilizadas ... 11
3.3 - Confecção de Cânulas-guia e agulha injetora ... 113
3.4 - Confecção de Cânulas arteriais ... 13
3.5 - Cirurgias ... 13
3.5.1 - Implante de cânulas-guia dirigida para o Bulbo rostroventro-lateral (RVLM) ... 13
3.5.2 - Implante da cânula femoral ... 14
3.6 - Registros de Pressão arterial e Frequência Cardíaca ... 15
3.7 - Microinjeções de L-Glutamato, NMDA, AMPA e L-NAME no RVLM ... 16
3.8 - Protocolos experimentais ... 16
3.9 - Histologia ... 18
xi
4 - RESULTADOS:...20
4.1 - Efeito do L-NAME sobre os parâmetros basais de Pressão Arterial Média (PAM) e Frequência Cardíaca (FC) ... 20
4.2 - Efeito da microinjeção de L-Glutamato na RVLM nos parâmetros cardiovasculares...20
4.3 - Efeito da microinjeção de L-NAME sobre a resposta pressora induzida pela microinjeção de L-glutamato na RVLM ... 23
4.4 - Efeito da microinjeção de L-NAME sobre as respostas cardiovasculares induzidas por agonista NMDA na RVLM ... 25
4.5 - Efeito da microinjeção de L-NAME sobre as respostas cardiovasculares induzidas por agonista AMPA na RVLM ... 28
4.6 - Análise comparativa do efeito do pré-tratamento com L-NAME sobre as respostas cardiovasculares induzidas por NMDA versos AMPA na RVLM... 30
4.7 - Sítios de microinjeções das drogas na RVLM... 31
5 – DISCUSSÃO... ...33
6 – CONCLUSÕES...40
7 – REFERÊNCIAS BIBLIOGRAFICAS ...41
8 -APÊNDICES...49
xii
LISTA DE FIGURAS
Figura 01. Nervos aferentes renais detectam informações em relação ao estado do rim, tais como hipertensão e a concentração de angiotensina II, este mecanismo é importante para regulação da atividade nervosa simpática eferente e controle da PA. A RVLM é importante região central com ação determinante na regulação das eferências simpáticas para o coração, vasos e rins...3
Figura 02. Regiões e vias bulbares que participam no reflexo baroreceptor, com os neurotransmissores relacionados...4
Figura 03. Glutamato e os agonistas dos receptores ionotrópicos glutamatérgicos (NMDA, AMPA e cainato) interagem com os subtipos de receptores glutamatérgicos NMDA e não NMDA (AMPA e cainato) no sistema nervoso central...5
Figura 04. Liberação do NO no SNC pela ativação do receptor NMDA, envolvimento do NO em modular a ativação do receptor NMDA e ação retrograda do NO no SNC...9
xiii Figura 06. Escala temporal do protocolo experimental para a avaliação das respostas cardiovasculares ao estímulo causado pelos AAEs (L-glutamato, NMDA e AMPA) após bloqueio da síntese de NO. O esquema temporal é demonstrado com início do registro à esquerda seguido da administração de substâncias para a direita...17
Figura 07. Escala temporal do protocolo experimental para a avaliação das respostas cardiovasculares ao estímulo causado pelo L-glutamato após ausência do bloqueio da síntese de NO. O esquema temporal é demonstrado com início do registro à esquerda seguido da administração de substâncias para a direita...18
Figura 08. Registro de Pressão Arterial Pulsátil em vermelho (PAP; mmHg), Pressão Arterial Média em azul (PAM; mmHg) e Frequência Cardíaca em rosa (HRF; bpm) (A) em resposta a microinjeção glutamato antes e (B) após microinjeção de L-NAME...21
Figura 09. (A) Níveis de Pressão Arterial Média (PAM; mmHg) e (B) Frequência Cardíaca ( FC; bpm) em resposta à microinjeção L-glutamato (GLUT) antes e após a microinjeção de PBS (GLUT PBS). Os símbolos representam média ± EPM (n=6). Não foram encontradas diferenças estatísticas entre os grupos......22
Figura 10. Registro de Pressão Arterial Pulsátil em vermelho (PAP; mmHg), Pressão Arterial Média em azul (PAM; mmHg) e Frequência Cardíaca em rosa (HRF; bpm) (A)
em resposta a microinjeção de L-glutamato antes e (B) após microinjeção de L-NAME...23
Figura 11. (A) Níveis de Pressão Arterial Média (PAM; mmHg) e (B) Frequência Cardíaca (FC; bpm) em resposta a microinjeção L-glutamato (GLUT) antes e após microinjeção de L-NAME (GLUT L-NAME). Os símbolos representam média ± EPM.; * Diferença estatística entre os grupos (p<0,001, Anova two-way, pós-teste de Bonferroni) (n=6)...24
Figura 12. Registro de Pressão Arterial Pulsátil em vermelho (PAP; mmHg), Pressão Arterial Média em azul (PAM; mmHg) e Frequência Cardíaca em rosa (HRF; bpm) (A)
xiv Figura 13. (A) Níveis de Pressão Arterial Média (PAM; mmHg) e (B) Frequência Cardíaca (FC; bpm) em resposta a microinjeção de NMDA após PBS (NMDA PBS) e após microinjeção de L-NAME (NMDA L-NAME). Os símbolos representam média ± EPM.; * Diferença estatística entre os grupos (p<0,05, Anova two-way, pós-teste de Bonferroni) (n=6)...27
Figura 14. Registro de Pressão Arterial Pulsátil em vermelho (PAP; mmHg), Pressão Arterial Média em azul (PAM; mmHg) e Frequência Cardíaca em rosa (HRF; bpm) (A)
em resposta a microinjeção de AMPA antes e (B) após microinjeção de L-NAME...28
Figura 15. (A) Níveis de Pressão Arterial Média (PAM; mmHg) e (B) Frequência Cardíaca ( FC; bpm) em resposta a microinjeção de AMPA após PBS (AMPA PBS) e após microinjeção de L-NAME (AMPA L-NAME). Os símbolos representam média ± EPM (n=6). Não foram encontradas diferenças estatísticas entre os grupos...29
Figura 16. Percentagem em barras da manutenção do aumento da PAM à microinjeção de AMPA após L-NAME em relação à resposta pressora ao AMPA após PBS (AMPA NAME/AMPA) comparado ao aumento da PAM à microinjeção de NMDA após NAME em relação à resposta pressora ao NMDA após PBS (NMDA L-NAME/NMDA). Os símbolos representam média ± EPM.; * Diferença estatística entre os grupos (p<0,05, Teste t, pós-teste de Mann Whitney) (n=12)...31
Figura 17.Fotomicrografias de secções do bulbo de ratos Fischer...32
xv
LISTA DE TABELAS
Tabela 1. Efeito do L-NAME sobre os parâmetros basais de Pressão Arterial Média (PAM) e Frequência Cardíaca (FC)...20
Tabela 2. Níveis de Pressão Arterial Média (PAM) e Frequência Cardíaca (FC) antes, após L-NAME e 10 minutos após L-NAME...45
Tabela 3. Níveis de Pressão Arterial Média (PAM; mmHg) em resposta temporal à microinjeção de GLU (Glutamato) antes e após microinjeção de L-NAME (Glutamato L-NAME)...46
Tabela 4. Níveis de FC (FC; bpm) em resposta temporal à microinjeção de GLU (Glutamato) antes e após microinjeção de L-NAME (Glutamato L-NAME)...46
Tabela 5. Níveis de Pressão Arterial Média (PAM; mmHg) em resposta temporal à microinjeção de GLU (Glutamato) antes e após microinjeção de PBS (Glutamato)...47
xvi Tabela 7. Níveis de Pressão Arterial Média (PAM; mmHg) em resposta temporal à microinjeção de NMDA (NMDA) antes e após microinjeção de NAME (NMDA L-NAME)...50
Tabela 8. Níveis de FC (FC; bpm) em resposta temporal à microinjeção de NMDA (NMDA) antes e após microinjeção de L-NAME (NMDA L-NAME)...50
Tabela 9. Níveis de Pressão Arterial Média (PAM; mmHg) em resposta temporal à microinjeção de AMPA (AMPA) antes e após microinjeção de NAME (AMPA L-NAME)...51
Tabela 10. Níveis de FC (FC; bpm) em resposta temporal à microinjeção de AMPA (AMPA) antes e após microinjeção de L-NAME (AMPA L-NAME)...51
Tabela 11. Delta da Pressão Arterial Média (PAM) máxima e Frequência Cardíaca (FC) mínima em resposta a microinjeção de PBS, NMDA antes (NMDA) e após microinjeção de L-NAME (NMDA L-NAME)...51
Tabela 12. Delta da Pressão Arterial Média (PAM) e Frequência Cardíaca (FC) em resposta a microinjeção de PBS, AMPA antes (AMPA) e após microinjeção de L-NAME (AMPA L-L-NAME)...52
xvii
LISTA DE ABREVIATURAS
AA Aminoácidos
AAE Aminoácidos Excitatórios
AMPA Ácido alfa-Amino-3-hidroxi-5-metil-4-isoxazol Propiônico
AMPARs Receptores ionotrópicos glutamatérgicos AMPA
AP Ântero-posterior
bpm Batimentos por minuto
CEUA Comissão de Ética de Uso Animal
CG Cânula-guia
CVLM Bulbo caudoventrolateral
cGMP Guanosina monofosfato ciclico
DV Dorso-ventral
FC Frequência Cardíaca
GABA Ácido gamma-aminobutírico GLU Glutamato
GTP Guanosina trifosfato
i.m. Intramuscular
IML Intermediolateral
xviii L-NAME Nω-Nitro-L-arginine methyl ester hydrochloride
mmHg Milímetros de mercúrio
NMDA N-metil D-Aspartato
NMDARs Receptores ionotrópicos glutamatérgicos NMDA
NO Óxido nítrico
NOS Óxido nítrico sintase
NTS Núcleo do Trato Solitário
ODQ 1H-[1,2,4]oxadiazolo [4,3-a]quinoxaline-1-one PA Pressão Arterial
PAP Pressão Arterial Pulsátil
PAM Pressão Arterial Média
PBS Salina tamponada com fosfato (pH: 7,2)
PE Tubo de polietileno
PVN Núcleo Paraventricular do Hipotálamo
RVLM Bulbo rostroventrolateral
s.c. Subcutâneo
SC Sistema Cardiovascular
sGC Guanilato ciclase solúvel
SNA Sistema Nervoso Autônomo
SNC Sistema Nervoso Central
SNS Sistema Nervoso Simpático
xix
RESUMO
xx
(15nmol/100nL) reduziu o aumento da pressão arterial média (PAM) induzido pelas microinjeções de aminoácidos excitatórios L-glutamato (1nmol/100nL) e NMDA (10pmol/100nL), porém não alterou a resposta produzida pela microinjeção de agonista AMPA (3pmol/100nL). Como resultado, observamos efeito modulatório do NO sobre a resposta pressora induzida por agonista GLU e NMDA, mas não para respostas induzidas por AMPA. Sugerimos que o NO possui ação simpatoexcitatória de modulação da PA pela via glutamatérgica e que o NO modula as respostas cardiovasculares por meio dos receptores glutamatérgicos NMDA presentes na RVLM.
ABSTRACT
xxi
1
1-
INTRODUÇÃO
1.1
- A Região Rostro Ventrolateral do Bulbo (RVLM) e a Regulação
Cardiovascular
O Sistema Nervoso Central (SNC), particularmente o bulbo, é de grande importância na regulação da função cardiovascular. Autores descreveram as diferentes áreas bulbares como regiões com atividade funcionais distintas, porém exercendo participação importante de manutenção e de controle reflexo da pressão arterial (PA) (Blessing et al., 1989; Ciriello et al., 1986; Dampney et al., 1982). Três regiões são
consideradas vitais para a manutenção do tônus simpático e regulação vasomotora: o Núcleo do Trato Solitário (NTS), Região Rostro Ventrolateral do Bulbo (RVLM) e Região Caudoventrolateral do Bulbo (CVLM) (Barraco, 1994). Estas regiões formam um circuito neural de regulação das respostas cardiovasculares, sendo o NTS o local integrador das primeiras aferências das sinapses cardiovasculares, o qual interage com as regiões ventrais do bulbo na modulação da atividade eferente para o sistema cardiovascular (Barraco, 1994; Dampney et al., 1982; Dias, 2003).
As diferentes informações vindas da periferia são processadas no Sistema Nervoso Central (SNC) com o objetivo de produzir respostas autonômicas apropriadas, de acordo com os ajustes necessários para o funcionamento do sistema circulatório. O barorreflexo, o quimiorreflexo e o reflexo Bezold-Jarish são os principais reflexos envolvidos na regulação da pressão arterial, via Sistema Nervoso Autônomo (SNA) (Machado et al., 1997). O SNA opera por meio de neurônios parassimpáticos que
inervam o coração e simpáticos que inervam os vasos sanguíneos, o coração, os rins e as glândulas adrenais (Guyenet, 2006).
2
A RVLM é conhecida como região de controle cardiovascular responsável pela manutenção da excitação tônica e controle da atividade vasomotora simpática (Dampney et al., 2003; Kishi et al., 2001; Menezes et al., 2007). Trabalhos nas últimas
quatro décadas demonstraram a importância dos neurônios pré-motores da RVLM como os principais reguladores do tônus vasomotor, sendo estes neurônios referidos como um centro nervoso simpático ou centro de controle cardiovascular devido à importante ação de regulação do tônus vasomotor simpático e controle da PA (Dampney, 1994; Dampney et al., 1980; Guyenet et al., 1990; Kumagai et al., 2012; McAllen, 1986). Os
neurônios retículo-espinhais da RVLM se projetam para região de neurônios pré-ganglionares na medula espinhal e geram atividade excitatória tônica para os neurônios vasomotores simpáticos pré-ganglionares da coluna intermédio-lateral (Dampney, 1994; Dampney et al., 2003; Rodrigues, 2008). Um aumento da atividade de neurônios da
RVLM é transmitida à coluna intermediolateral (IML) em cada nível da coluna vertebral, onde nervos periféricos simpáticos para o coração, arteríolas e rins são ativados aumentando a PA (Kumagai et al., 2012) . Ao contrário, a inibição local de
neurônios da RVLM diminui a pressão arterial, tanto em ratos anestesiados quanto em ratos acordados, da mesma maneira que ocorre quando é feita uma transecção na coluna vertebral (Dampney et al., 1982; Menezes et al., 2007).
A RVLM está envolvida na regulação da atividade simpática para o coração, vasos e rins. Núcleos centrais, como o núcleo paraventricular (PVN), são responsáveis por enviar projeções excitatórias para RVLM, que, por sua vez, possui neurônios pré-motores simpáticos que se projetam para IML e geram aumento da atividade simpática para neurônios vasomotores simpáticos, desta forma as eferências simpáticas promovem aumento da frequência cardíaca, vasoconstrição e aumento da atividade simpática renal
3
Adaptado de (Kumagai et al., 2012).
Figura 01. Nervos aferentes renais detectam informações em relação ao estado do rim, tais como hipertensão e a concentração de angiotensina II, este mecanismo é importante para regulação da atividade nervosa simpática eferente e controle da PA. A RVLM é importante região central com ação determinante na regulação das eferências simpáticas para o coração, vasos e rins.
A atividade de neurônios simpatoexcitatórios da RVLM é regulada por conexões do barorreflexo através do NTS e CVLM, o qual envia projeções inibitórias sobre neurônios da RVLM, ademais, outras áreas do sistema nervoso central (SNC) também podem participar da regulação da atividade dos neurônios da RVLM (Edwards
et al., 2004). A elevação súbita da PA gera um aumento na atividade dos
barorreceptores arteriais, bem como dos nervos aferentes vagais e aumento na atividade neuronal da região CVLM via projeções do NTS. Os neurônios da CVLM podem suprimir a atividade neuronal da RVLM através de projeções mediadas pelo aminoácido inibitório GABA. A supressão da RVLM reflete sobre a atividade dos neurônios da
4
coluna IML e nos nervos eferentes simpáticos na redução da atividade simpática para o coração e vasos sanguíneos, desta forma a pressão arterial pode retornar aos valores normais (Kumagai et al., 2012; Schreihofer et al., 2003) (Fig 02).
(Adaptado de Controle Central da Pressão Arterial. R.R. Campos Jr.; E. Colombari; O.
U. Lopes: Hiperativo, v. 2, p. 45-53, 1995).
Figura 02. Regiões e vias bulbares que participam no reflexo baroreceptor, com os neurotransmissores relacionados.
5
1.2 - Aminoácidos Excitatórios (AAE) e Receptores Ionotrópicos
Glutamatérgicos
O L-Glutamato (GLU) é o principal neurotransmissor excitatório do SNC e do barorreflexo (Talman et al., 1980). Este aminoácido excitatório atua sobre vários tipos
de receptores, em várias sinapses no SNC, incluindo receptores ionotrópicos α -amino-3-hydroxy-5-methyl-4-isoxazolepropionate (AMPA), cainato e N-methyl-D-aspartate (NMDA), divididos desta forma com base em suas espécies agonistas. No entanto, uma vez que nem o agonista, nem antagonista foram distinguidos claramente entre AMPA e cainato, estes receptores muitas vezes são referidos coletivamente como receptores não-NMDA. Estudos de clonagem demonstraram que eles são complexos de receptores distintos, embora possam ser ativados pelos mesmos agonistas (Ozawa et al., 1998).
(Adaptado de http://www.medscape.org acessado em 11/12/2012 13:38h)
6
Há também outra classe de receptores glutamatérgicos, receptores metabotrópicos, os quais são acoplados a proteínas GTP ligadas (proteínas G) e modulam a produção de mensageiros intracelulares.
Os receptores ionotrópicos NMDA (NMDARs) são ativados seletivamente por NMDA e possuem características únicas incluindo sua alta permeabilidade de íons de cálcio, lenta cinética de ativação e desativação, elevada afinidade para o glutamato, tensão de bloqueio produzida por Mg++ e grandes domínios citoplasmáticos que permitem que sejam parte de grandes complexos macromoleculares de sinalização sináptica. Dois eventos que ocorrem simultaneamente são necessários para a ativação dos receptores de NMDA: liberação pré-sináptica e ligação do glutamato aos receptores de NMDA e despolarização da membrana pós-sináptica suficientemente forte para a remoção do bloqueio produzido pelo Mg++ (Gonda, 2012; Laube et al., 1997).
Comparado com NMDARs, receptores ionotrópicos glutamatérgicos AMPA (AMPARs) abrem e fecham de forma mais rápida e, assim, mediam a maior parte da transmissão excitatória sináptica rápida no SNC. Canais dos receptores AMPA são considerados permeáveis somente a Na+ e K+ e quase impermeáveis ao Ca++ nos neurônios centrais (Wang et al., 2012).
Sabe-se que receptores ionotrópicos de glutamato, NMDA e AMPA/cainato, apresentam importante função na regulação da atividade cardiovascular (Dampney, 1994). (Zhou et al., 2006), mostraram que microinjeções de ácido kinurênico, um
antagonista inespecífico dos receptores ionotrópicos glutamatérgicos, diminui a atividade neuronal de neurônios cardiovasculares pré-motores simpáticos e do nervo esplênico em resposta ao glutamato na RVLM. Estudo anterior também mostrou a participação do receptor glutamatérgico NMDA no controle das respostas cardiovasculares. A injeção de AP-5 (phosphonovaleric acid), um bloqueador do receptor glutamatérgico NMDA, atenuou a bradicardia produzida pelo L-glutamato microinjectado no NTS de ratos não anestesiados de maneira dose-dependente (Colombari et al., 1997).
Os receptores glutamatérgicos participam da neurotransmissão excitatória no sistema nervoso central dos mamíferos (SNC) (Wang et al., 2012). Na RVLM
7
demonstraram a importância dos AAEs em regular as respostas cardiovasculares simpatoexcitatória (Mayorov et al., 2003).
1.3
- O Óxido Nítrico e o Sistema Cardiovascular
O óxido nítrico (NO) é sintetizado no endotélio vascular e também no sistema nervoso central e periférico (Morimoto et al., 2000). No sistema cardiovascular, o NO é
um fator de relaxamento derivado do endotélio que regula o fluxo nos vasos sanguíneos, enquanto no sistema nervoso central desempenha função de segundo mensageiro, alterando a longo e curto prazo a função sináptica (Garthwaite, 2010). Este mensageiro molecular é sintetizado a partir da L-arginina, por meio da atividade da óxido nítrico sintase (NOS) e possui importante ação central também na regulação da função cardiovascular (Chen et al., 2001).
Sabe-se que no NTS, local das primeiras aferencias do sistema cardiovascular no sistema nervoso central, os efeitos do glutamato dependem parcialmente da produção de NO. Estudos, nesta região, têm mostrado que os inibidores da síntese de NO reduzem as respostas cardiovasculares à microinjeção de agonistas de AAEs e diminuem os níveis de glutamato extracelular (da Silva et al., 2008; Dias et al., 2003; Dias et al., 2005).
Na RVLM, o NO influencia elementos neuronais que regulam a função cardiovascular (Patel et al., 2001). Os neurônios pré-simpáticos da RVLM são descritos
como um local importante de ação do NO (Martins-Pinge et al., 2007). A possível via
de modulação do NO na RVLM é pela neurotransmissão glutamatérgica (Ishide et al.,
2003; Kishi et al., 2012). Contudo, a função desta molécula é ainda controverso,
embora exista relato de efeito inibitório do NO na RVLM (Kishi et al., 2001),
pesquisadores mostraram também o seu efeito excitatório nesta região (Hirooka et al.,
1996; Martins-Pinge et al., 1999; Mayorov, 2005; Morimoto et al., 2000). O NO
endógeno pode participar da regulação das respostas simpatoexcitórias cardiovasculares, pois há tipos celulares formadores de NO na RVLM que são ativados durante reflexos cardiovasculares excitatórios (Guo et al., 2009).
8
Morimoto et al., 2000). Três isoformas de NOS foram identificados na RVLM: NOS
neuronal (nNOS), NOS induzível (iNOS) e NOS endotelial (eNOS), enquanto eNOS está localizado primariamente em vasos sanguíneos, nNOS e iNOS estão presentes nos neurônios e todas as três isoformas de NOS são sintetizadas na RVLM sob condições fisiológicas (Guo e cols., 2009).
Estudos sugerem que, na RVLM, o NO pode modular a neurotransmissão como um neurotransmissor, neuromodulador, ou um mensageiro retrógrado pelo sistema de retroalimentação positiva de liberação de glutamato (Ishide e cols., 2003). A liberação de AAEs e outros neurotransmissores pode ser modulada por meio de um mecanismo dependente da guanilato ciclase solúvel (sGC) (Mayorov, 2005).
Chianca et al., (2004) sugerem que a estimulação dos receptores de NMDA leva à
formação de NO ou que porções de NO possam
ativar GCs. A sGC ativada pelo NO resulta na acumulação de 3’,5’- guanosina monofosfato cíclica (cGMP) em células alvo, esta via NO/sGC/cGMP pode modular a estimulação de receptores de glutamato, e, portanto, aumentar a pressão arterial em ratos (Chan et al., 2003; Morimoto et al., 2000). Estudos descrevem a relação entre os
subtipos de receptores ionotrópicos glutamatérgicos na simpatoexcitação induzida pelo NO no NTS . No receptor, o NO modula diretamente os receptores do tipo NMDA e aumentam a afinidade de ligação de AMPA em subunidades de receptores não NMDA no encéfalo (Chan e cols, 2003).
9
(Flora Filho et al., 2000).
Figura 04. Liberação do NO no SNC pela ativação do receptor NMDA, envolvimento do NO em modular a ativação do receptor NMDA e ação retrograda do NO no SNC.
10
2 - OBJETIVOS
2.1 - Objetivo Geral:
Avaliar a participação do óxido nítrico na modulação das respostas cardiovasculares produzidas pelo glutamato na RVLM
2.2 - Objetivos Específicos:
Investigar a ação do óxido sobre a regulação das respostas cardiovasculares de PAM e FC induzidas pela estimulação glutamatérgica na RVLM.
11
3 - MATERIAL E MÉTODOS
3.1 – O Modelo Animal
Neste trabalho utilizamos 25 ratos Fischer, com peso de 300g ± 20g, fornecidos pelo Centro de Ciência Animal da Universidade Federal de Ouro Preto. Os animais foram mantidos em temperatura controlada (23 ± 1ºC), ciclo de 12 horas claro (a partir de 7hs da manhã) e 12 horas escuro e regime de livre acesso à água e à dieta.
Os procedimentos experimentais foram aprovados pela Comissão de Ética de Uso Animal da Universidade Federal de Ouro Preto (CEUA-UFOP), através do protocolo número 2011/19. Todas as normas estabelecidas por esta comissão foram respeitadas, de forma a minimizar o sofrimento dos animais durante os experimentos. Além disso, o número de animais em cada grupo foi reduzido ao máximo, sem comprometer a confiabilidade das análises estatísticas. Para tanto, sempre que possível, cada rato foi utilizado como controle dele mesmo.
3.2 - Preparo de drogas/substâncias utilizadas
AMPA: Solução de α-amino-3-hydroxy-5-methyl-4-isoxazolepropionate foi diluída em solução PBS para obtenção de uma solução com concentração de 3pmol/100 nL.
Anestésico (Solução de Ketamina + Xilazina): solução preparada pela adição de 2 mL de Xilazina 2% (p/v) a 10 mL de Ketamina 10% (p/v). Utilizada da seguinte forma: dose (ketamina: 80mg/kg ; Xilazina: 7mg/kg ) e volume (0,1mL/100g de animal; i.m.).
12 Antibiótico (Pentabiótico Veterinário): utilizado na prevenção de infecções, na seguinte dose: 48.000UI de penicilina, 20mg de estreptomicina e 20mg de diidroestreptomicina/kg. Volume injetado: 0,1 mL/100g de animal; i.m.
Antiinflamatório [Ketoflex 1% p/v (Cetoprofeno)]: empregado com o objetivo de reduzir inflamação e dor decorrente dos procedimentos cirúrgicos. Utilizado da seguinte forma: dose (4mg/Kg) e volume (0,1 mL/100g de animal; i.m.).
PBS (Salina tamponada com fosfato; pH 7,2): solução preparada pela diluição de 8,18g de NaCl P.A., 1,98 g de Na2HPO4.7H2O P.A. e 0,26 g de NaH2PO4.H2O P.A.
(Synth, LABSYNTH Produtos para Laboratórios Ltda, Diadema, SP) em água ultra-purificada (Milli – Q®) q.s.p. 1000,0 mL. Ajustou-se o pH da solução para 7,2 com soluções de HCl e NaOH, conforme necessidade. A solução foi esterilizada por autoclavação 120ºC e 1,0 Kg/cm2 durante 15 minutos, conforme protocolo em vigor no Laboratório de Fisiologia Cardiovascular.
Formalina: solução preparada com 11,36g de Na2HPO4 P.A. e 2,76 de NaH2PO4
P.A. em 1000 mL de água purificada destilada adicionado em 80g de paraformaldeído diluído em 900 mL de água destilada ajustado o pH entre 7,0 e 8,0 com 6 mL de hidróxido de sódio
Heparina: solução preparada com a diluição de heparina P.A. (5.000 UI/mL) utilizando 0,625 mL de heparina em água purificada destilada q.s.p. 25 mL.
L-Glutamato: Solução de L-Glutamato foi diluída em solução PBS para obtenção de uma solução com concentração de 1nmol/100 nL.
L-NAME: Solução de Nω-Nitro-L-arginine methyl ester hydrochloride foi diluída
em solução PBS para obtenção de uma solução com concentração de 15nmol/100 nL.
NMDA: Solução de N-methyl-D-aspartate foi diluída em solução PBS para obtenção de uma solução com concentração de 3pmol/100 nL.
13
3.3 - Confecção de Cânulas-guia e agulha injetora
A cânula-guia (CG) i.c.v. foi confeccionada utilizando-se agulha 25x6, ajustada até o comprimento de 15 mm, através de eletrocorrosão.
A agulha injetora foi confeccionada a partir da agulha G30 e ajustada a 19,1 mm através de eletrocorrosão. Assim, no momento da microinjeção, a extremidade da injetora permanecia 4.1mm abaixo da extremidade da CG, para se atingir região rostroventrolateral do bulbo (RVLM), de acordo com as coordenadas utilizadas.
3.4 - Confecção de Cânulas arteriais
Para a confecção das cânulas femorais, utilizamos tubo de polietileno PE-50 soldado ao tubo de polietileno PE-10 (Clai Adams, Parsipanny,NJ, EUA). As dimensões utilizadas foram: PE50 de 20 cm e PE10 de 3,8 cm.
3.5 - Cirurgias
3.5.1 -
Implante de cânulas-guia dirigida para o Bulbo
rostroventro-lateral (RVLM)
14
acomodado no aparelho estereotáxico e, por meio de duas barras auriculares, a cabeça do animal foi fixada. Em seguida, a região superior da cabeça foi anestesiada com lidocaína com vasoconstritor (Lidostesim 2%), afim de, minimizar o sangramento no local da incisão. A região superior do crânio foi exposta e lavada com PBS e a torre do estereotáxico foi posicionada em angulação zero. Em seguida, realizamos as leituras dos parâmetros ântero-posterior (AP), látero-lateral (LL) e dorso-ventral (DV), tomando-se como referência o Lâmbda. Com auxílio das informações de um atlas estereotáxico (Paxinos e Watson, 1998), determinamos os pontos de introdução de cânulas guia (AP=3.1; L=1.8; DV=6.8) e de acordo com estes parâmetros realizamos as trepanações na calota craniana utilizando-se de broca odontológica esférica acoplada a um motor de baixa rotação.
Através dos orifícios produzidos pelas trepanações, introduzimos as cânulas-guias. Posteriormente as cânulas foram fixadas utilizando-se de resina acrílica fixada no crânio por um pequeno parafuso de aço inoxidável. Em seguida à completa fixação das cânulas-guia, a torre do estereotáxico foi retirada. Para evitar a obstrução da cânula-guia, introduzimos um mandril de aço inoxidável de mesmo comprimento no interior de cada cânula, sendo então, o animal retirado do estereotáxico e acomodado novamente em caixas individuais. Como medida profilática, administramos após a cirurgia, 0,2 mL de Pentabiótico veterinário.
Feito isso, os animais passaram por um período de recuperação entre 6 e 8 dias.
3.5.2 - Implante da cânula femoral
Passado o período de recuperação, os animais foram novamente submetidos aos procedimentos pré-cirúrgicos com sedação induzida por inalação de isoflurano, e, em seguida, administramos cetoprofeno (i.m.) para a realização do implante da cânula femoral.
15
(trocáter) – essa disposição permitiu o registro dos parâmetros cardiovasculares do animal em livre movimentação. Terminado o procedimento, os locais de incisão foram suturados e os animais receberam o Pentabiótico Veterinário (Fort Dodge, São Paulo, Brasil - 0,2 mL/rato; i.m.) para cobertura antibiótica profilática.
Fig. 05: As letras A e B ilustram, de forma esquemática, respectivamente: (A) Local de dissecção do trígono femoral e (B) Isolamento da artéria femoral. Fonte: (Fortes, 2010).
3.6 - Registros de Pressão arterial e Frequência Cardíaca
Após 48h da realização da implantação da cânula na artéria femoral foram realizados os registros para aferição da pressão arterial e frequência cardíaca, sempre realizados na mesma faixa de horário, entre 8 e 18hs. Antes de iniciar o registro, foi administrada salina heparinizada (20:1), na cânula implantada na artéria femoral com o intuito de impedir a formação de coágulos durante o experimento. A cânula arterial foi, então, conectada a um transdutor de pressão MLT0699 (ADInstruments, Austrália) ligado a um amplificador ETH-400 (CB Sciences, Inc.). Este amplificador foi conectado a um conversor analógico digital PowerLab/400 (ADInstruments, Austrália). A
A
B
16
comunicação de dados entre o conversor e o computador foi feita por intermédio de uma placa SCISI onde o software Chart for Windows® gerava os registros de Pressão Arterial Pulsátil (PAP) a partir dos dados enviados pelo conversor analógico digital numa freqüência de amostragem de 200 Hz. Os registros de pressão arterial média (PAM) e de freqüência cardíaca (FC) foram derivados “on line” da PAP. Os animais foram conectados ao equipamento e passaram por um período de estabilização dos parâmetros cardiovasculares de aproximadamente 30 minutos antes do inicio dos experimentos.
3.7 - Microinjeções de L-Glutamato, NMDA, AMPA e L-NAME no
RVLM
Microinjeções de drogas na RVLM: O L-glutamato (1 nmol/100 nL), L-NAME (15 nmol/ 100nL), NMDA (10 pmol/100nL) e AMPA (3 pmol/100nL) foram microinjetados na RVLM, utilizando-se de uma microseringa Hamilton de 5µL conectada a uma cânula injetora (Agulha Gengival 30 G Curta) por meio de um tubo de polietileno.
3.8 - Protocolos experimentais
Após seis a oito dias do implante de cânulas dirigidas à RVLM foram realizados os protocolos experimentais, sendo que inicialmente os animais foram mantidos na sala de registro por aproximadamente 1 hora antes do experimento, possibilitando sua melhor adaptação ao ambiente.
17
Seguem de maneira esquemática a Fig. 06, em escala temporal, os protocolos experimentais utilizados neste trabalho:
Figura. 06. Escala temporal do protocolo experimental para a avaliação das respostas cardiovasculares ao estímulo causado pelos AAEs (L-glutamato, NMDA e AMPA) após bloqueio da síntese de NO. O esquema temporal é demonstrado com início do registro à esquerda seguido da administração de substâncias para a direita.
Realizamos também um protocolo controle para avaliarmos as respostas cardiovasculares às sucessivas microinjeções de AAE sem a presença do bloqueador da NOS, utilizamos neste protocolo experimental o L-glutamato como aminoácido excitatório. Durante os experimentos foram utilizados 06 animais submetidos à microinjeções de PBS na RVLM, seguida da microinjeção de L-glutamato. Após 15 minutos de nova microinjeção de PBS realizamos microinjeção de L-Glu novamente
10 minutos 30 minutos 15 minutos 10 minutos 15 minutos
PBS 100nL 1nmol/100nLL-Glu
L-Glu 1nmol/100nL L-NAME
15nmol/100nL
10 minutos 30 minutos 15 minutos 10 minutos 15 minutos
PBS 100nL 10pmol/100nLNMDA
NMDA 10pmol/100nL L-NAME
15nmol/100nL
10 minutos 30 minutos 15 minutos 10 minutos 15 minutos
PBS 100nL 3pmol/100nLAMPA
AMPA 3pmol/100nL L-NAME
15nmol/100nL
n=6
18
para avaliarmos a preservação da resposta excitatória causada pelo L-Glu na RVLM, conforme exemplificamos no esquema da Fig.07:
Figura 07. Escala temporal do protocolo experimental para a avaliação das respostas cardiovasculares ao estímulo causado pelo L-glutamato após ausência do bloqueio da síntese de NO. O esquema temporal é demonstrado com início do registro à esquerda seguido da administração de substâncias para a direita.
3.9 - Histologia
Ao término do protocolo experimental, injetamos o corante Azul de Evans na concentração de 2% (100nL no mesmo sitio de microinjeção do L-glutamato, NMDA, AMPA e L-NAME ) na RVLM, para confirmar a posição da agulha de injeção. Anestesiamos os animais com solução de Ketamina + Xilazina, submetendo-os a uma toracotomia para a exposição do coração. Através de punção cardíaca, realizamos a perfusão com solução salina (0,9%), seguida de solução de formalina (10%). Posteriormente, retiramos e fixamos o cérebro em solução de formalina por 7 dias, após este período os cérebros foram colocados em solução de sacarose (20%) seguido de congelamento para seccionamento. A seguir, a região foi colocada em um aparelho Criostato (Leica CM 1850, Alemanha).
O material foi seccionado transversalmente em fatias de 50µm de espessura. Os cortes histológicos receberam coloração de Vermelho Neutro com posterior visualização em microscópio óptico. Através da coloração histológica e da microscopia óptica verificou se o sítio de microinjeção pretendido foi realmente atingido. Apenas os animais que apresentaram cortes histológicos, onde a microscopia óptica assegurou que o núcleo pretendido foi atingido, foram considerados na análise de resultados.
10 minutos 30 minutos 15 minutos 10 minutos 15 minutos
PBS 100nL
L-Glu 1nmol/100nL
L-Glu 1nmol/100nL PBS 100nL
19
3.10 - Análise estatística
20
4 - RESULTADOS:
4.1 - Efeito do L-NAME sobre os parâmetros basais de Pressão Arterial
Média (PAM) e Frequência Cardíaca (FC)
A microinjeção unilateral de L-NAME (15nmol/100nL), inibidor não específico da NOS, na RVLM não alterou nem a FC nem a PA (tabela1).
Grupos n PAM , mmHg FC, bpm
Basal L-NAME L-NAME 10’
7 7 7
119,7 ± 3,47 119,1 ± 2,91 117,1 ± 3,086
348 ± 23,98 350,8 ± 19,59 362,8 ± 17,97
Tabela 01. Valores expressos em média ± EPM. Basal, parâmetros cardiovasculares anteriores às microinjeções de L-NAME; L-NAME, dados obtidos logo após microinjeções de L-NAME; L-NAME 10’, dados obtidos 10 minutos após microinjeções de L-NAME; PAM, pressão arterial média; FC, frequência cardíaca; bpm, batidas por minuto. Dados não apresentam diferença estatística, teste ANOVA One-way com pós-teste de Bonferroni).
4.2 - Efeito da microinjeção de L-NAME sobre a resposta pressora
induzida pela microinjeção de GLU na RVLM
21
5,35bpm PBS vs. -47,48 ± 18,4bpm vs. -17,22 ± 4,57bpm após L-NAME p<0,05). Valores expressos em média ± erro padrão da média. (Fig 08 e 09).
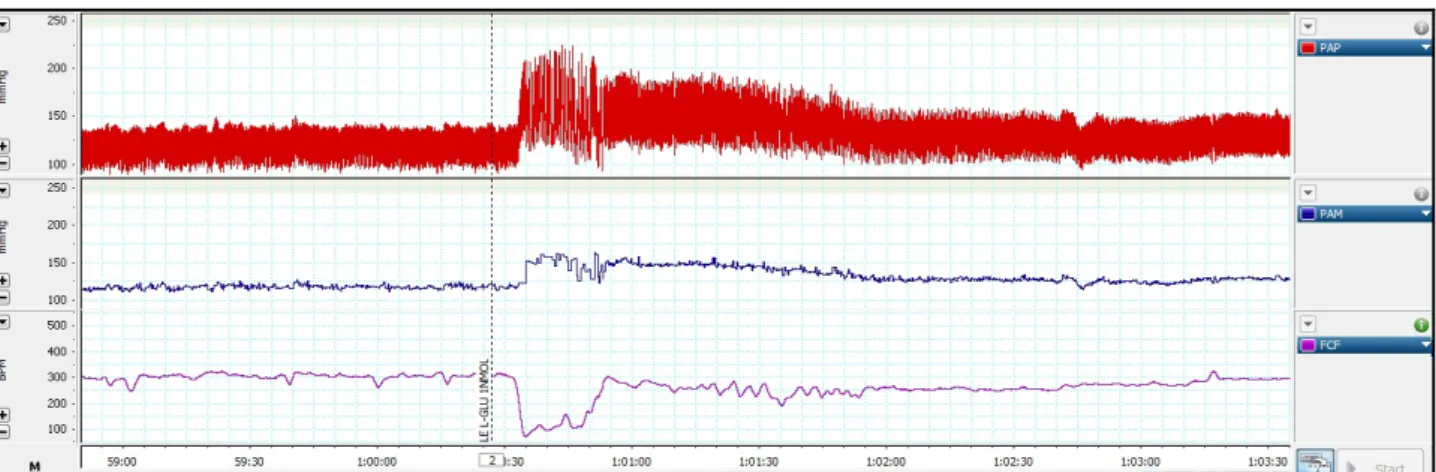
A Fig. 08 é a representação do registro dos parâmetros cardiovasculares em resposta a microinjeção de GLU antes e após a microinjeção de L-NAME, respectivamente:
A
B
Figura 08. Registro de Pressão Arterial Pulsátil em vermelho (PAP; mmHg), Pressão Arterial Média em azul (PAM; mmHg) e Frequência Cardíaca em rosa (HRF; bpm) (A)
22
A
-30 T0 30 60 90 120
-10 0 10 20 30
PBS
GLU
GLU L-NAME
TEMPO (seg)
∆
P
AM
(
m
m
Hg
)
B
-30 T0 30 60 90 120
-80 -60 -40 -20 0 20
PBS
GLU
GLU L-NAME
TEMPO (seg)
∆
FC
(
b
pm
)
Figura 09. (A) Níveis de Pressão Arterial Média (PAM; mmHg) e (B) Frequência
Cardíaca (FC; bpm) em resposta a microinjeção de PBS (PBS), L-glutamato (GLU) antes e após microinjeção de L-NAME (GLU L-NAME). Os símbolos representam
23
média ± EPM.; * Diferença estatística em relação ao grupo PBS (p<0,05, Anova two-way, pós-teste de Bonferroni). # Diferença estatística entre grupo GLU e GLU L-NAME (p<0,05, Anova two-way, pós-teste de Bonferroni) (n=6).
4.3 - Efeito da microinjeção de L-Glutamato na RVLM nos parâmetros
cardiovasculares
Analisamos as respostas cardiovasculares às microinjeções de PBS e ao GLU antes e após a microiejção veículo (PBS) na RVLM. Este protocolo permitiu observamos a manutenção das respostas cardiovasculares evocadas após sucessiva microinjeção deste AAE na RVLM. A microinjeção de PBS não alterou os parâmetros cardiovasculares de PAM e FC, enquanto a microinjeção de GLU nessa região produziu um aumento de PAM (0,11 ± 1,3mmHg PBS vs. 17,38 ± 3,18mmHg GLU vs. 12,93 ± 4,58mmHg GLU após PBS) acompanhado de bradicardia em relação ao grupo PBS (19,77 ± 9,52bpm PBS vs. -45,85 ± 25,27bpm GLU vs. 38,0 ± 17,95bpm GLU após PBS). Valores expressos em média ± erro padrão da média (Fig 10 e 11).
A Fig. 10 é a representação do registro dos parâmetros cardiovasculares em resposta a microinjeção de L-glutamato antes e após a microinjeção de PBS, respectivamente:
24 *
* *
*
B
Figura 10. Registro de Pressão Arterial Pulsátil em vermelho (PAP; mmHg), Pressão Arterial Média em azul (PAM; mmHg) e Frequência Cardíaca em rosa (HRF; bpm) (A)
em resposta a microinjeção L-glutamato antese (B) após microinjeção de PBS.
A
-30
T0
30
60
90
120
-10
0
10
20
30
PBS
GLU
GLU PBS
TEMPO (seg)
∆
P
AM
(
m
m
Hg
)
B
25 *
*
-30
T0
30
60
90
120
-80
-60
-40
-20
0
20
40
PBS
GLU
GLU PBS
TEMPO (seg)
∆
FC
(
b
pm
)
Figura 11. (A) Níveis de Pressão Arterial Média (PAM; mmHg) e (B) Frequência
Cardíaca ( FC; bpm) em resposta à microinjeção L-glutamato (GLU) antes e após a microinjeção de PBS (GLU PBS). * Diferença estatística em relação ao grupo PBS (p<0,05, Anova two-way, pós-teste de Bonferroni). # Diferença estatística entre grupo GLU e GLU PBS (p<0,05, Anova two-way, pós-teste de Bonferroni) (n=6).
4.4 - Efeito da microinjeção de L-NAME sobre as respostas
cardiovasculares induzidas por agonista NMDA na RVLM
26
A Fig. 12 é a representação do registro dos parâmetros cardiovasculares em resposta a microinjeção de NMDA antes e após a microinjeção de L-NAME, respectivamente:
A
B
Figura 12. Registro de Pressão Arterial Pulsátil em vermelho (PAP; mmHg), Pressão Arterial Média em azul (PAM; mmHg) e Frequência Cardíaca em rosa (HRF; bpm) (A)
27 #
#
#
A
-30 T0 30 60 90 120 -10 0 10 20 30
NMDA
NMDA L-NAME
PBS
TEMPO (seg)
∆
P
AM
(
m
m
Hg
)
B
-30 T0 30 60 90 120
-100 -50 0 50
NMDA
NMDA L-NAME
PBS
TEMPO (seg)
∆
FC
(
b
pm
)
Figura 13. (A) Níveis de Pressão Arterial Média (PAM; mmHg) e (B) Frequência Cardíaca (FC; bpm) em resposta a microinjeção de NMDA após PBS (NMDA PBS) e após microinjeção de L-NAME (NMDA L-NAME). Os símbolos representam média ± EPM.; * Diferença estatística em relação ao grupo PBS (p<0,05, Anova two-way, pós-teste de Bonferroni). # Diferença estatística entre grupo NMDA e NMDA L-NAME (p<0,05, Anova two-way, pós-teste de Bonferroni) (n=6).
* *
* *
28
4.5 - Efeito da microinjeção de L-NAME sobre as respostas
cardiovasculares induzidas por agonista AMPA na RVLM
Analisamos as respostas cardiovasculares às microinjeções de AMPA na RVLM antes e após a microiejção L-NAME na RVLM. A microinjeção de PBS não altereou os parâmetros cardiovasculares de PAM e FC, e, L-NAME não reduziu o aumento da PAM em reposta a microinjeção de AMPA (-0,2 ± 2,58mmHg PBS vs. 28,91 ± 5,77mmHg AMPA vs. 18,98 ± 3,49mmHg AMPA após L-NAME, p>0,05) e não alterou a FC (-17,86 ± 15,4bpm PBS vs. – 67,46 ± 20,74bpm AMPA vs. -47,35 ± 23,13bpm AMPA após L-NAME, p>0,05) (fig 14 e 15). Observamos que não há diferença nos parâmetros cardiovasculares em resposta a primeira microinjeção de AMPA comparada com a segunda microinjeção de AMPA na RVLM. Valores expressos em média ± erro padrão da média. (Fig 14 e 15).
A Fig. 14 é a representação do registro dos parâmetros cardiovasculares em resposta a microinjeção de AMPA antes e após a microinjeção de L-NAME, respectivamente:
29 *
* *
*
B
Figura 14. Registro de Pressão Arterial Pulsátil em vermelho (PAP; mmHg), Pressão Arterial Média em azul (PAM; mmHg) e Frequência Cardíaca em rosa (HRF; bpm) (A) em resposta a microinjeção de AMPA antes e (B) após microinjeção de L-NAME.
A
-30 T0 30 60 90 120 -10
0 10 20 30 40
AMPA
AMPA L-NAME
PBS
TEMPO (seg)
∆
P
AM
(
m
m
Hg
)
*
30
B
-30 T0 30 60 90 120
-100 -50 0 50
AMPA
AMPA L-NAME
TEMPO (seg)
PBS
∆
FC
(
b
pm
)
Figura 15. (A) Níveis de Pressão Arterial Média (PAM; mmHg) e (B) Frequência Cardíaca ( FC; bpm) em resposta a microinjeção de AMPA após PBS (AMPA PBS) e após microinjeção de L-NAME (AMPA L-NAME). Os símbolos representam média ± EPM (n=6). * Diferença estatística em relação ao grupo PBS (p<0,05, Anova two-way, pós-teste de Bonferroni). # Diferença estatística entre grupo AMPA e AMPA L-NAME (p<0,05, Anova two-way, pós-teste de Bonferroni) (n=6).
4.6 - Análise comparativa do efeito do pré-tratamento com L-NAME
sobre as respostas cardiovasculares induzidas por NMDA versos AMPA
na RVLM
31
de manutenção da resposta pressora às microinjeções dos EAA após L-NAME comparadas com as microinjeções de AMPA ou NMDA após PBS. Resultado desta análise em percentual: AMPA: 56,34 ± 7,73 vs. NMDA: 28,7 ± 5,8.
AMPA L-NAME/AMPA NMDA L-NAME/NMDA 0 20 40 60 80 AMPA L-NAME/AMPA NMDA L-NAME/NMDA % R esp o st a p resso ra a pós L-N A M E / a nt e s do L-N A M E
Fig 16.Percentagem em barras da manutenção do aumento da PAM à microinjeção de AMPA após NAME em relação à resposta pressora ao AMPA após PBS (AMPA NAME/AMPA) comparado ao aumento da PAM à microinjeção de NMDA após NAME em relação à resposta pressora ao NMDA após PBS (NMDA L-NAME/NMDA). As barras representam média ± EPM.; * Diferença estatística entre os grupos (p<0,05, Teste t, pós-teste de Mann Whitney) (n=6 para cada grupo).
4.7 - Sítios de microinjeções das drogas na RVLM
Os sítios de microinjeção de Glutamato, NMDA, AMPA e L-NAME na RVLM podem ser visualizados pelas fotomicrografias representativas de cada grupo: Glutamato, Controle, AMPA e NMDA, respectivamente, na Figura 17.
32 Figura 17. Fotomicrografias de secções do bulbo de ratos Fischer. Fotomicrografia representativa do grupo glutamato (A), grupo controle (B), grupo AMPA (C), grupo NMDA (D) com seus respectivos sítios de microinjeção na RVLM.
33
5 - DISCUSSÃO
A ação fisiológica do NO no SNC é amplamente investigada (Kagiyama et al.,
1997), especialmente a participação do NO na modulação das respostas cardiovasculares induzidas pelo glutamato (Chen et al., 2001; Martins-Pinge et al.,
2007). Neste trabalho demonstramos que o bloqueio da síntese de NO provocou atenuação da resposta pressora evocada pelo GLU. Diante deste resultado, concluímos que o NO possui efeito simpatoexcitatório sobre a via glutamatérgica na regulação das respostas cardiovasculares. Buscamos então investigar um possível mecanismo de modulação do NO sobre a função cardiovascular, para tal avaliamos o efeito do NO sobre os subtipos de receptores glutamatérgicos (NMDA e não-NMDA). Como resultado obtivemos a redução da resposta pressora ao NMDA após a microinjeção de L-NAME, enquanto a resposta pressora a estimulação causada pelo AMPA não foi atenuada pela pré-injeção de L-NAME. Estes resultados sugerem que o NO possui ação neuromodulatória prioritária sobre receptores NMDA. Desta forma, sugerimos que o NO possui ação simpatoexcitatória de modulação da função cardiovascular pela via glutamatérgica por meio dos receptores glutamatérgicos NMDA.
34
35
comparada a FC após GLU em relação à resposta ao PBS e a não alteração da FC no grupo GLU após pré-tratamento com L-NAME quando comparado ao PBS.
Pesquisadores mostraram que os efeitos do L-NAME na RVLM são similares aos do azul de metileno ou do ODQ (1H-[1,2,4]Oxadiazolo[4,3-a]quinoxalin-1-one, inibidor guanilato ciclase solúvel). Interessantemente a pré-injeção de L-NAME ou de azul de metileno reduziram a resposta pressora causada pela microinjeção de GLU na RVLM (Morimoto e cols., 2000). As respostas cardiovasculares causadas pela microinjeção de GLU na RVLM foram também fortemente atenuadas após microinjeção de ODQ na RVLM de ratos acordados, indicando que mecanismos ligados ao cGMP são importantes para a neurotransmissão glutamatérgica (Martins-pinge e cols., 1999). Estes dados sugerem que a via NO-cGMP pode mediar a excitação neuronal na RVLM (Morimoto e cols., 2000).
Embora diversos autores descrevam a participação do NO na RVLM como um modulador das respostas simpatoexcitatórias, as ações desta molécula no SNC são ainda bastante controversas, pois alguns trabalhos descrevem esta molécula como mediadora de respostas simpatoinibitórias sobre o sistema nervoso simpático (SNS), via liberação de GABA ou mesmo que por meio do NO há estabelecimento de modelos de hipertensão (Ishide et al., 2003; Kishi et al., 2002; Kishi et al., 2001; Patel et al., 2001).
Porém, nestes trabalhos foram utilizados animais anestesiados e/ou protocolos de indução de superexpressão da NOS, a interferência causada pelo anestésico, bem como a condição não fisiológica de indução da superexpressão da NOS, podem justificar as respostas simpatoinibitórias promovidas pelo NO nestes trabalhos.
Adicionalmente, o protocolo experimental com uso de animais acordados evita os efeitos da anestesia, bem como influências na neurotransmissão causadas pelo anestésico, efeitos que podem justificar algumas das divergências encontradas na literatura quanto à ação do NO na neuromodulação cardiovascular, uma vez que anestésicos podem influenciar as respostas tanto qualitativamente quanto quantitativamente (Martins-Pinge e cols., 2007).
36
ao colapso do sistema de controle da PA, bem como queda da PA, redução da atividade vasomotora simpática, abolição do componente vasomotor barorreceptor e do reflexo cardiopulmonar (Barraco, 1994). Para tal seguimos o protocolo de microinjeções de GLU na RVLM e encontramos respostas evocadas pelo GLU de mesma intensidade antes e após a microinjeção de PBS (Fig. 11). Estes achados reforçam que nos protocolos utilizados neste trabalho há integridade do sistema cardiovascular em regular as respostas cardiovasculares, especialmente, estes resultados salientam a evidência de que o pré-tratamento com L-NAME é capaz de atenuar a resposta pressora causada pela microinjeção de GLU (Fig. 09).
Visto que o L-NAME reduz a resposta pressora ao GLU, decidimos avaliar uma possível via de modulação do NO na RVLM, para isso investigamos a influência do NO sobre os subtipos de receptores ionotrópicos glutamatérgicos específicos: NMDA e AMPA. Nossos resultados mostraram o efeito atenuante do L-NAME sobre a resposta pressora evocada pelo agonista NMDA. Observamos que o NO participa da modulação das respostas cardiovasculares através de receptores NMDA na RVLM (Fig. 14). Um dos mecanismos possíveis de ação do NO sobre os receptores NMDA pode ocorrer pela estimulação da produção de NO pela nNOS em resposta ao um influxo de cálcio, desta forma o NO produzido pode exercer efeito sobre a S-nitrosilação de proteínas, incluindo os receptores NMDA, e sobre a ativação de guanilato ciclase/cGMP (Edwards e cols., 2004). O óxido nítrico ativaria sGC aumentando assim o nível de GMPc, no sistema nervoso o GMP pode atuar diretamente sobre os canais cálcio e sódio aumentando a taxa de disparo neuronal, ou atuar sobre proteínas quinases específicas (Wu e cols., 2001).
Pesquisadores mostraram ainda que o efeito evocado pelo NMDA de aumento da PA e produção de NO foram atenuados pelo tratamento com ODQ na RVLM de gatos anestesiados, o que demonstra a participação da via sGC/cGMP na modulação das respostas cardiovasculares (Wu e cols., 2001). Adicionalmente, achados sugerem que a ativação de receptores ionotrópicos NMDA, mas não receptores ionotrópicos AMPA ou receptores metabotrópicos, provocam a ativação de sGC e formação de cGMP para produzir respostas fisiológicas no NTS (Chianca et al., 2004).
37
inibidores da NOS (Wu e cols., 2001; Chen e cols., 1997; Chen e cols., 2001). Alguns destes autores descrevem o NO como uma molécula envolvida na ativação de receptores NMDA e AMPA, porém, a interação entre o NO e os receptores NMDA é comparativamente mais bem definida do que a interação do NO com receptores AMPA (Chen et al., 2001; Chen et al., 1997).
Em nosso estudo, quando analisamos o papel do NO sobre os receptores glutamatérgicos ionotrópicos encontramos redução da resposta pressora à estimulação por agonista NMDA e AMPA após o tratamento com L-NAME quando comparados os picos máximos de aumento da PAM antes e após o uso do bloqueador da NOS, contudo observamos maior eficácia na prevenção do aumento da PAM evocado pela microinjeção de NMDA quando comparada à resposta produzida pelo agonista AMPA (Fig. 17). Não obstante, a duração da resposta apresenta diferença estatística somente para o grupo NMDA (Fig. 14) e não encontramos alteração da resposta pressora na análise temporal à estimulação evocada pelo AMPA após tratamento com L-NAME comparada à microinjeção de AMPA antes do bloqueio da NOS (Fig. 16). Diante destes resultados acreditamos que há maior interação e ação modulatória do NO sobre os receptores NMDA na regulação da pressão arterial pela RVLM. Não foram encontradas alterações em relação à FC antes comparada à após a microinjeção de L-NAME, bem como nos encontramos nas respostas produzidos glutamato no pré-tratamento com L-NAME. Como discutido anteriormente, é possível que o controle das respostas ao NO sobre a FC não seja regulada pela RVLM, mas sim por outro/outros núcleos centrais de controle da função cardiovascular.
38
O presente estudo não abordou o mecanismo celular entre a ativação dos receptores de NMDA e o NO, mas uma possibilidade atraente é que NO pode ser gerado e atuar como um passo intermediário para ativação de sGC para formação de cGMP e que a formação de NO pode preceder a ativação de sGC e também à estimulação dos receptores NMDA.
A concepção de que NO tem ação durante a estimulação dos receptores NMDA, por meio da ativação da guanilato ciclase é atualmente estabelecida (Martins-Pinge e cols., 1999), Patel et al., (2001) propõem um mecanismo de ação pré-sináptica do NO no NTS, bem como a função direta da molécula de NO sobre os receptores NMDA. Com base na hipótese estabelecida por Patel, sugerimos uma via de modulação do NO por meio dos receptores NMDA em neurônios pós-sinápticos da RVLM (Fig. 18).
39
e difusão desta molécula, a qual pode ativar receptores NMDA ou sGC, promovendo síntese de cGMP. cGMP pode desencadear diversos eventos celulares, bem como ativar diretamente canais iônicos e proteínas quinases específicas.
40
6 - CONCLUSÕES
41
7 – REFERÊNCIAS BIBLIOGRAFICAS
Barraco IRA (1994). Nucleus of The Solitary Tract. edn.
Blessing WW, Li YW (1989). Inhibitory vasomotor neurons in the caudal ventrolateral region of the medulla oblongata. Progress in brain research81: 83-97.
Chan SH, Wang LL, Chan JY (2003). Differential engagements of glutamate and GABA receptors in cardiovascular actions of endogenous nNOS or iNOS at rostral ventrolateral medulla of rats. British journal of pharmacology138(4): 584-593.
Chen SY, Mao SP, Chai CY (2001). Role of nitric oxide on pressor mechanisms within the dorsomedial and rostral ventrolateral medulla in anaesthetized cats. Clinical and experimental pharmacology & physiology28(3): 155-163.
Chen SY, Wu WC, Tseng CJ, Kuo JS, Chai CY (1997). Involvement of non-NMDA and NMDA receptors in glutamate-induced pressor or depressor responses of the pons and medulla. Clinical and experimental pharmacology & physiology24(1): 46-56.
Chianca DA, Jr., Lin LH, Dragon DN, Talman WT (2004). NMDA receptors in nucleus tractus solitarii are linked to soluble guanylate cyclase. American journal of physiology. Heart and circulatory physiology286(4): H1521-1527.
42
Colombari E, Bonagamba LG, Machado BH (1997). NMDA receptor antagonist blocks the bradycardic but not the pressor response to L-glutamate microinjected into the nucleus tractus solitarius (NTS) of unanesthetized rats. Brain research749(2): 209-213.
da Silva LG, Dias AC, Furlan E, Colombari E (2008). Nitric oxide modulates the cardiovascular effects elicited by acetylcholine in the NTS of awake rats. American journal of physiology. Regulatory, integrative and comparative physiology 295(6):
R1774-1781.
Dampney RA (1994). Functional organization of central pathways regulating the cardiovascular system. Physiological reviews74(2): 323-364.
Dampney RA, Goodchild AK, Robertson LG, Montgomery W (1982). Role of ventrolateral medulla in vasomotor regulation: a correlative anatomical and physiological study. Brain research249(2): 223-235.
Dampney RA, Horiuchi J, Tagawa T, Fontes MA, Potts PD, Polson JW (2003). Medullary and supramedullary mechanisms regulating sympathetic vasomotor tone.
Acta physiologica Scandinavica177(3): 209-218.
43
Dias AC (2003). Interação entre o óxido nítrico e a ativação de neurônios glutamatérgicos nos Núcleos do Tracto Solitário sobre o controle cardiovascular: Universidade Federal de São Paulo.
Dias AC, Colombari E, Mifflin SW (2003). Effect of nitric oxide on excitatory amino acid-evoked discharge of neurons in NTS. American journal of physiology. Heart and circulatory physiology284(1): H234-240.
Dias AC, Vitela M, Colombari E, Mifflin SW (2005). Nitric oxide modulation of glutamatergic, baroreflex, and cardiopulmonary transmission in the nucleus of the solitary tract. American journal of physiology. Heart and circulatory physiology288(1):
H256-262.
Edwards MA, Loxley RA, Powers-Martin K, Lipski J, McKitrick DJ, Arnolda LF, et al.
(2004). Unique levels of expression of N-methyl-D-aspartate receptor subunits and neuronal nitric oxide synthase in the rostral ventrolateral medulla of the spontaneously hypertensive rat. Brain research. Molecular brain research129(1-2): 33-43.
Flora Filho R, Zilberstein B (2000). Óxido nítrico: o simples mensageiro percorrendo a complexidade. Metabolismo, síntese e funções. Revista da Associação Médica Brasileira46(3): 265-271.
44
Garthwaite J (2010). New insight into the functioning of nitric oxide-receptive guanylyl cyclase: physiological and pharmacological implications. Molecular and cellular biochemistry334(1-2): 221-232.
Gonda X (2012). Basic pharmacology of NMDA receptors. Current pharmaceutical design18(12): 1558-1567.
Guo ZL, Tjen ALSC, Fu LW, Longhurst JC (2009). Nitric oxide in rostral ventrolateral medulla regulates cardiac-sympathetic reflexes: role of synthase isoforms. American journal of physiology. Heart and circulatory physiology297(4): H1478-1486.
Guyenet PG (2006). The sympathetic control of blood pressure. Nature reviews. Neuroscience7(5): 335-346.
Guyenet PG, Darnall RA, Riley TA (1990). Rostral ventrolateral medulla and sympathorespiratory integration in rats. Am J Physiol259(5 Pt 2): R1063-1074.
Hirooka Y, Polson JW, Dampney RA (1996). Pressor and sympathoexcitatory effects of nitric oxide in the rostral ventrolateral medulla. Journal of hypertension14(11):
1317-1324.
45
Ishide T, Maher TJ, Ally A (2003). Role of nitric oxide in the ventrolateral medulla on cardiovascular responses and glutamate neurotransmission during mechanical and thermal stimuli. Pharmacological research : the official journal of the Italian Pharmacological Society47(1): 59-68.
Kagiyama S, Tsuchihashi T, Abe I, Fujishima M (1997). Cardiovascular effects of nitric oxide in the rostral ventrolateral medulla of rats. Brain research757(1): 155-158.
Kishi T, Hirooka Y (2012). Oxidative stress in the brain causes hypertension via sympathoexcitation. Frontiers in physiology3: 335.
Kishi T, Hirooka Y, Ito K, Sakai K, Shimokawa H, Takeshita A (2002). Cardiovascular effects of overexpression of endothelial nitric oxide synthase in the rostral ventrolateral medulla in stroke-prone spontaneously hypertensive rats. Hypertension39(2): 264-268.
Kishi T, Hirooka Y, Sakai K, Shigematsu H, Shimokawa H, Takeshita A (2001). Overexpression of eNOS in the RVLM causes hypotension and bradycardia via GABA release. Hypertension38(4): 896-901.
Kumagai H, Oshima N, Matsuura T, Iigaya K, Imai M, Onimaru H, et al. (2012).