UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
INFLUÊNCIA DA MENOPAUSA NOS DANOS POR
PEROXIDAÇÃO LIPÍDICA
Dissertação de mestrado em Gerontologia, Atividade Física e Saúde no Idoso
CLÁUDIA TÃO FERRAZ CARDOSO SOARES
Orientadora: Profª. Doutora Maria Paula Mota
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
INFLUÊNCIA DA MENOPAUSA NOS DANOS POR
PEROXIDAÇÃO LIPÍDICA
Dissertação de mestrado em Gerontologia, Atividade Física e Saúde no Idoso
CLÁUDIA TÃO FERRAZ CARDOSO SOARES
Orientadora: Profª. Doutora Maria Paula Mota
ii Dissertação elaborada com o objetivo da obtenção do grau de Mestre em Gerontologia, Atividade Física e Saúde no Idoso, pela Universidade de Trás-os-Montes e Alto Douro, de acordo com o Decreto-Lei 107/2008 de 25 de junho.
iii Soares, C. (2016). Influência da Menopausa nos Danos por Peroxidação Lipídica.
iv
Agradecimentos
No decorrer da realização deste trabalho contei com a colaboração e apoio de várias pessoas, cujos contributos se revelaram como cruciais para atingir o objetivo proposto. Desta forma, gostaria de manifestar o meu agradecimento:
À Professora Doutora Maria Paula Mota.
À minha família pelo apoio incondicional, em particular ao meu irmão. Ao Professor Doutor Eduardo Oliveira pelo incentivo.
Ao Miguel Santos pelo apoio e incentivo. À Vanessa Almeida.
v
Índice Geral
Agradecimentos……….iv Índice de Figuras……….……….vii Índice de Tabelas……….viii Índice de Quadros………...………..ix Índice de Gráficos………...x Lista de Abreviaturas………xi Resumo………,…xiii Abstract……….xiv 1. Introdução Geral………1 2. Revisão da Literatura………4 2.1. Processo de Envelhecimento………..5 2.2. Influência da Menopausa………..……...62.3. Radicais Livres e Espécies Reativas de Oxigénio………8
2.4. Sistema Antioxidante………..11
2.4.1. Antioxidantes Enzimáticos………..……..12
2.4.2. Antioxidantes não Enzimáticos………...…..12
2.5. Stress Oxidativo……….. 15
2.6. Stress Oxidativo e Processo de Envelhecimento ……….….15
2.7. Stress Oxidativo e Atividade Física Habitual ………..……16
3. Metodologia ………...…. 18
3.1. Amostra ……….………..19
vi 3.2.1. Parâmetros relacionados com o estilo de vida - Questionário de nível de
Atividade Física (IPAQ) ……….19
3.2.2. Parâmetros Bioquímicos ………...20 3.2.2.1. Colheita de Sangue ………20 3.2.2.2. TBARs ……….20 3.2.2.3. Proteína …..……….20 3.3. Tratamento Estatístico ………...21 4. Resultados ………...22
5. Discussão dos Resultados ………25
6. Conclusão ………28
vii
Índice de Figuras
Figura 1 – Interação das ERO com os componentes celulares……….10 Figura 2 – Relação entre oxidantes e antioxidantes no equilíbrio homeostático……….11
viii
Índice de Tabelas
Tabela 1 - Valores médios (± 𝐷𝑃) 𝑑a Idade (anos) e atividade física semanal (MET.min/sem) nos diferentes grupos da amostra (pré, peri e pós-menopausa ………23 Tabela 2 - Resultados teste de correlação de Spearman entre a idade (anos) e o ciclo reprodutivo e entre a idade e a atividade física semanal (MET.min/sem) ………...24
ix
Índice de Quadros
Quadro 1 - Principais características e sintomatologia nas diferentes fases do climatério (pré, peri e pós-menopausa) ……….8 Quadro 2 - Intervalo de idades e N da amostra nos diferentes grupos da amostra (pré, peri e pós-menopausa) ……….19
x
Índice de Gráficos
Gráfico 1 - Concentração de TBARs para os diferentes grupos da amostra (pré, peri e pós-menopausa) ……….23
xi
Lista de Abreviaturas
ADN – Ácido Desoxirribonucleico CAT – Catalase
ERO - Espécies Reativas de Oxigénio GPS – Glutationa
GPX – Glutationa Peroxidase GSSG – Glutationa oxidada HO• – Hidroxilo
H2O2 – Peróxido de Hidrogénio
IPAQ - Questionário de Nível de Atividade Física L• – Radical Lipídico
LOO• – Peroxilo
LOOH – Lípidos Hidroperóxidos MDA – Malondialdeído
NADPH - Nicotinamida Adenina Dinucleótido Fosfato NO – Óxido Nítrico
ONOO- - Peroxinitrilo
O2 – Oxigénio
O2•- - Radical Anião Superóxido
PL - Peroxidação Lipídica RL – Radicais Livres
R3C•. – Radicais Livres de Carbono
R3N• – Radicais Livres de Nitrogénio
xii R-O• – Radicais Livres de Oxigénio
SOD – Superóxido Dismutase
xiii
Resumo
O processo de envelhecimento é inevitável ao ser humano, implicando alterações fisiológicas nos organismos, entre as quais, uma tendência a uma menor tolerância ao stress oxidativo. Na vida das mulheres, o climatério é um período complexo que marca a passagem da fase reprodutiva para a não-reprodutiva, com mudanças significativas no organismo, sendo a menopausa, um fator que parece aumentar o risco de aumentar os níveis de stress oxidativo. Assim, o objetivo do presente estudo foi analisar a influência da menopausa nos danos por peroxidação lipídica (PL). Pretendeu-se também verificar qual a associação entre a atividade física, a idade e os danos por PL. Participaram neste estudo 39 indivíduos, do género feminino, com idade inferior a 60 anos, subdivididos em três grupos, de acordo com o ciclo reprodutivo: pré-menopausa (n=14), peri-menopausa (n=12) e pós-menopausa (n=13). Para determinar o nível de atividade física habitual da amostra foi utilizada a versão curta do questionário de nível de atividade física (IPAQ). Os danos de PL foram verificados no plasma, através da determinação da concentração dos produtos de reação ao ácido tiobarbitúrico (TBARs) (nmol/mg de proteína), para os três grupos da amostra. Como principais resultados verificamos que: i) existem diferenças estatisticamente significativas na variável TBARs, sendo o grupo das mulheres que se encontram na fase pós-menopausa aquele que revela maior concentração; ii) não se verificaram diferenças estatisticamente significativas entre grupos, na variável atividade física habitual; iii) o ciclo reprodutivo e a idade correlacionam-se positivamente. O presente estudo sugere que a menopausa influencia e potencia o stress oxidativo.
xiv
Abstract
The aging process is inevitable to the human being, implying physiological changes in the organisms, among which are a tendency towards a lower oxidative stress tolerance. In women’s lives, the climacteric is a complex period that marks the passage from the reproductive to the non-reproductive phase, with significant changes to the organism, menopause being a factor that seems to increase the risk of enhancing oxidative stress levels. Thus, the purpose of this study was to analyze the influence of menopause in lipid peroxidation (LP) damage. It was also intended to understand the association between physical activity, age and LP damage. 39 individuals of female gender and under 60 years of age participated in this study. They were divided into 3 groups, according to the reproductive cycle, specifically: pre-menopause (n=14), peri-menopause (n=12) and post-menopause (n=13). To determine the sample’s habitual physical activity level the short version of the physical activity questionnaire was used (IPAQ). The LP damage was verified through the determination of the concentration of reaction products to thiobarbituric acid (TBARs) (nmol/mg of protein). For the 3 sample groups this was conducted after the blood collection of 10 mL of blood plasma. As main results we found that: i) there are significant statistical differences in the TBARs variable, being that the group of women who are post-menopausal is the one with the highest concentration. Thus, menopause seems to influence and increase oxidative stress; ii) no statistical differences were found between groups regarding the habitual physical activity variable; iii) the reproductive cycle and age have a positive correlation.
1
Introdução Geral
2
1. Introdução Geral
A gerontologia tem como objetivo o estudo do processo de envelhecimento nas suas vertentes, biológica, psicológica e social, procurando aumentar a qualidade de vida dos indivíduos, prevenindo e promovendo a saúde (Achenbaum & Levin,1989). O conceito de envelhecimento é um processo endógeno, progressivo e universal, que afeta todos os indivíduos, sem exceção, sendo naturalmente irreversível, com danos acumulados com a idade, que se podem revelar como potencialmente prejudiciais. (Kirkland, 2002; Troen, 2003; Barja, 2013). Uma das repercussões deste processo relaciona-se com a atuação dos radicais livres (RL) e das espécies reativas de oxigénio (ERO) (Lipsky & King, 2015).
Hoje em dia é unanimemente aceite o facto dos danos oxidativos se encontrarem relacionados com numerosas patologias e doenças de caráter crónico e degenerativo, assim como com alterações degenerativas teciduais caracterizadoras do processo de envelhecimento (Ferreira, et al., 2007). Com a idade, a tolerância ao fenómeno de stress oxidativo é também menor, o que se reveste de cada vez mais importância, atendendo a que a esperança média de vida tem vindo a aumentar (Ikeyama et al., 2002; Droge, 2002; Li & Holbrook, 2003; Dato et al., 2013). Os RL e as ERO podem oxidar e provocar danos, ao nível dos principais componentes da membrana celular, nos ácidos nucleicos, nas proteínas e nos lípidos (Lawler & Powers, 1998; Irshad & Chaudhuri, 2002; Souza et al., 2005; Halliwell, 2012). Quando os radicais livres atuam sobre os lípidos presentes na membrana mitocondrial iniciam-se as reações de peroxidação lipídica (PL), acreditando-se que a acumulação dos produtos resultantes da PL sejam um dos mais potentes indutores do stress oxidativo (Anderson, Katunga, & Willis, 2012; Yoshida et al., 2013), ainda que os efeitos biológicos e fisiológicos da PL e seus produtos ainda se encontram pouco estudados. A primeira defesa do organismo para combater os RL e as ERO é realizada através de antioxidantes, enzimáticos e não enzimáticos, funcionando como agentes redutores, que existem no ambiente intra e extracelular, que ao reagir com as ERO minimizam as suas consequências, prevenindo, ou atrasando o stress oxidativo (Gomes et al., 2012).
Como já referimos, uma das características do envelhecimento relaciona-se com a universalidade, afetando, consequentemente, todos os indivíduos, independentemente do género. Nas mulheres, a menopausa é um acontecimento complexo, com alterações significativas no organismo. Assim, além das alterações fisiológicas decorrentes da idade importa destacar as modificações em função da menopausa, onde se verifica uma deficiência de estrogénio, um aumento da massa adiposa, juntamente com um metabolismo mais lento
Introdução Geral
3 (Florencio, 2011). Neste sentido, importa verificar se a ocorrência da menopausa e a variação real de estrogénios está associada a um aumento do stress oxidativo.
Assim desta forma o objetivo deste estudo é analisar a influência da menopausa nos danos por peroxidação lipídica. Pretende-se ainda verificar qual a associação entre a atividade física, a idade e os danos por peroxidação lipídica.
4
Revisão da Literatura
5
2. Revisão da Literatura
2.1. Processo de Envelhecimento
O processo de envelhecimento é inevitável ao ser humano, destacando-se pela sua irreversibilidade, universalidade e caráter temporal, iniciando-se no nascimento, continuando até à morte aumentando a fragilidade e vulnerabilidade dos indivíduos (Troen, 2003; Lipsky & King, 2015). Portanto, observa-se uma diminuição da habilidade para manter o equilíbrio homeostático (Hulbert et al., 2007). Por homeostasia entende-se a manutenção de um ambiente interno constante, ou inalterado, tendo este conceito sido utilizado inicialme nte por Walter Cannon, em 1932. Embora signifique que o ambiente interno não está alterado, não significa por isso que permaneça absolutamente constante, variando e representando mais uma consciência dinâmica (Powers & Howley, 2000). O processo de envelhecimento pode ser caracterizado pela perda progressiva das funções corporais, afetando células, tecidos e órgãos, resultando da interação dos fatores genéticos e ambientais, aumentando a suscetibilidade à doença e consequentemente elevando o risco de morte (Figueiredo et al., 2007; Hulbert et al., 2007). A manifestação deste fenómeno é variável de indivíduo para indivíduo, sendo que desta interação resulta a maior ou menor velocidade de envelhecimento do organismo, como Mota et al. (2004) refere. Nesta linha de pensamento, se a capacidade de adaptação do organismo for reduzida, ou se a ação do meio for exagerada verifica-se um desequilíbrio exagerado e consequentemente o organismo fica mais propenso a acumular lesões e défices celulares, refletindo-se no processo de envelhecimento. Através da diminuição da velocidade de envelhecimento, seria possível aproximarmo-nos de uma situação em que os indivíduos permanecessem fisiologicamente novos, no decorrer das suas vidas, independentemente da sua duração (Barja, 2013).
Diversas teorias têm sido propostas para explicar o processo de envelhecimento. Assim, historicamente as teorias do envelhecimento têm sido divididas em duas grandes categorias: genéticas, ou programadas e estocásticas (Troen, 2003; Sergiev et al., 2014; Lipky & King, 2015), sendo que estas não se excluem mutuamente. As primeiras defendem que o envelhecimento é determinado geneticamente, sendo que os organismos apresentam como que um relógio interno que programa a longevidade. As segundas propõem que este mesmo processo resulta da acumulação de danos com o tempo. Importa aprofundar a teoria dos radicais livres, que embora esteja catalogada como teoria estocástica, demonstra a interação entre fatores genéticos e ambientais. Desta forma, o processo de envelhecimento é explicado
Revisão da Literatura
6 como resultado da acumulação de danos oxidativos, nos constituintes celulares e/ou nos tecidos (Harman, 1956), mais concretamente, ao nível dos lípidos, ácido desoxirribonucleico (ADN), proteínas e tecidos. As espécies aeróbias apresentam a capacidade de utilizar oxigénio (O2) para produzir energia, no entanto, neste processo geram-se RL e as ERO, que
se revelam como agressores para o organismo. Convém salientar que existem mecanismos para prevenir estes danos, mais concretamente o sistema antioxidante (Monaghan et al., 2009). Deste equilíbrio entre RL, ERO e a capacidade antioxidante dos organismos surge o conceito de stress oxidativo, traduzindo-se pelo desequilíbrio entre oxidantes e a capacidade antioxidante do organismo, num determinado sistema biológico (Sies, 1986). Esta teoria assenta então em três aspetos base, tal como Hulbert et al. (2007) refere, mais concretamente o facto de nem todos as ERO produzidos pelo metabolismo serem radicais livres, a existência de defesas antioxidantes para minimizarem a ação dos ERO e mecanismos para reparar e remover as moléculas biológicas danificadas.
As ERO desempenham um papel na regulação na expressão genética diferencial, na replicação celular, na diferenciação e morte celular. Assim sendo, e de acordo com Troen (2003), esta teoria propõe que as espécies reativas de oxigénio contribuem de forma significativa para a acumulação de mutação somáticas no ADN mitocondrial, conduzido a uma perda gradual da capacidade bioenergética e consequentemente ao envelhecimento e à morte celular (Sen & Packer, 1996).
Apesar de toda a sua inevitabilidade, envelhecer com saúde, depende de indivíduo para indivíduo, sendo importante realçar que a adoção de estilos de vida sedentários acelera o mecanismo do processo de envelhecimento, aumentando o risco de doenças crónicas, além de numerosas disfunções e patologias, diminuindo a qualidade e esperança média de vida, como Troen (2003) refere.
2.2. Influência da Menopausa
A esperança média de vida tem vindo a aumentar, ao longo dos anos, sendo evidentes diferenças por género. Assim sendo, as mulheres apresentam uma esperança de vida à nascença superior (Fontes/Entidades: Eurostat a partir de dados de Institutos Nacionais de Estatística, PORDATA). De facto, o género é uma variável crítica, que requer uma análise complexa de vários aspetos individuais, entre os quais o envelhecimento (Campesi et al., 2016).
Revisão da Literatura
7 À medida que o processo de envelhecimento avança nas mulheres é natural o acontecimento da menopausa, traduzindo-se esta na cessação permanente da menstruação e ovulação, em função da idade, por falência ovárica (Laven et al., 2016; Campesi et al., 2016). Desde que é atingido o fim da fertilidade, natural, até à menopausa propriamente dita, tem sido repo rtado um intervalo de dez anos (Harlow et al., 2012; Daan & Fauser, 2015). Assim, o climatério identifica-se com o período de vida da mulher, no qual se verifica um declínio progressivo da função ovárica, acompanhado com um conjunto de sintomas, como irregularidades menstruais, calores, afrontamentos, alterações do humor e do sono (Sociedade Portuguesa de Ginecologia, 2004). Destacam-se três fases: pré, peri e pós-menopausa. A fase pré-menopausa engloba o tempo decorrido entre o início do declínio da função ovárica e a menopausa. A fase peri menopausa engloba a pré-menopausa até um ano após a menopausa, após o qual se inicia a pós-menopausa (Sociedade Portuguesa de Ginecologia, 2004). A sintomatologia mais característica do período climatérico é a vasomotora (afrontamentos e suores noturnos), constituindo a queixa mais frequente da mulher na peri e pós-menopausa. Estes sintomas podem iniciar-se na pré-menopausa, sendo que a manifestação mais intensa ocorre nas fases seguintes, até 6 meses a 5 anos após a menopausa, podendo persistir para além disso (Bruce & Rymer., 2009). As dificuldades no sono aumentam durante o climatério, com uma prevalência na peri menopausa entre os 33% a 51% (Gracia & Freeman, 2004). Aproximadamente 50% das mulheres na pós-menopausa apresentam atrofia génito-urinária resultante do hipoestrogenismo característico desta fase (Gracia & Freeman, 2004; Bruce & Rymer, 2009; Brown et al., 2009). Também a nível cutâneo, a pele apresenta uma série de modificações funcionais, estruturais e mecânicas próprias do normal envelhecimento que são exacerbadas pelo hipoestrogenismo da pós-menopausa, verificando-se uma maior secura e perda de elasticidade (Quatresooz, 2006). As principais características e sintomas que acompanham cada uma das fases descritas diferem, tal como se observa no quadro 1.
Revisão da Literatura
8
Quadro 1 – Principais características e sintomatologia nas diferentes fases do climatério (pré, peri e pós-menopausa)
Características
Fases Climatério
Pré-menopausa Peri menopausa Pós-menopausa
Duração Variável Variável Variável
Ciclo menstrual Regular Irregular Ausente
Hormona Folículo-estimulante (FSH)
Normal Normal/elevado Elevado
Sintomas Principais Ausentes Alterações menstruais/sintomatologia vasomotora Sintomatologia vasomotora/atrofia génito-urinária
(adaptado de Bernardini et al., 2013)
Decorrentes da menopausa verificam-se alterações a longo prazo, nos diferentes sistemas e processos metabólicos, incluindo o sistema imunitário, além de uma perda mineral óssea acentuada e uma diminuição nas concentrações de estrogénio (Schewenke, 1998; Faria et al., 2013; Daan & Fauser, 2015).
Existem evidências que a menopausa é um fator de risco para o stress oxidativo (Sanchez-Rodriguez et al., (2012); Kolisnikova et al., 2015), o que se encontra relacionado com a deficiência em estrogénios. Importa assim destacar a tendência que os estrogénios têm evidenciado a exercer um efeito antioxidante na membrana fosfolipídica (Ruiz-Larrea et al., 2000; Goy et al., 2015). Consequentemente os níveis de peroxidação lipídica tendem a ser superiores, comparativamente às mulheres nas fases anteriores (Bednarek-Tupikowska et al., (2004); Sanchez et al., 2012; Lizcano & Guzman, 2014; Kolisnikova et al., 2015). Ogunro et al. (2014) referem que quer nas fases peri e pós-menopausa estão associados a níveis mais elevados de stress oxidativo. Desta forma, os antioxidantes desempenham um papel fundamental, tendo, no entanto, sido relatadas alterações nos parâmetros do sistema oxidativo das mulheres, nas diferentes fases da menopausa (Vural et al., 2005; Arora et al., 2009; Kolisnikova et al., 2015).
A intensidade do stress oxidativo parece depender do tempo decorrido desde o início da menopausa (Signorelli et al., 2001).
2.3. Radicais Livres e Espécies Reativas de Oxigénio
Nos organismos a formação de radicais livres é constante, sendo estes definidos como um grupo de substâncias químicas, que se caracterizam por possuírem um, ou mais eletrões desemparelhados (Halliwell & Gutteridge, 1989; Halliwell, 1994). Este facto confere-lhes uma
Revisão da Literatura
9 elevada reatividade e instabilidade química, podendo interagir com outras moléculas e assim comportarem-se como oxidantes, conforme Ferreira et al. (2007) indicam. Por este mesmo motivo, quando presentes em elevadas concentrações, podem alterar a estrutura de moléculas fundamentais para a manutenção da homeostasia celular. Ainda de acordo com os mesmos autores, podemos encontrar radicais livres de carbono (R3C•), de nitrogénio (R3N•),
de enxofre (R-S•) e de oxigénio (R-0•), sendo os radicais livres de oxigénio os mais relevantes,
em termos biológicos, quer devido à sua toxicidade, quer por serem os mais dominantes nos organismos vivos. Destes, destacam-se o radical anião superóxido (O2•-) e o radical hidroxilo
(HO•).
Considerando a importância, assim como as repercussões, destes compostos nos organismos, importa salientar o facto de originarem outras moléculas, caracterizadas pela sua alta reatividade e toxicidade, identificando-se como as maiores responsáveis pela alteração de macromoléculas, que embora não sejam catalogadas como RL, por não apresentarem qualquer eletrão desemparelhado, sejam potenciais geradores do mesmo (Ferreira et al., 2007; Barrera, 2012). Desta forma, apesar do O2 ser essencial à vida aeróbia, em
determinadas condições pode ser tóxico, sendo esta dualidade conhecida como “o paradoxo do oxigénio”.
As ERO podem ser produzidas em vários locais da célula, nomeadamente, no retículo endoplasmático, nos lisossomas, nas membranas celulares, nos peroxissomas, no citosol e na mitocôndria (Ferreira et al., 2007; Lawler & Powers, 1998). Esta última parece constituir a maior fonte geradora de ERO, durante a fosforilação oxidativa. Por este facto, a mitocôndria é também o principal alvo dos ataques das ERO, através da oxidação dos seus componentes (Ferreira et al., 2007; Sanz, 2016). Aproximadamente 90% do oxigénio (O2) consumido é
utilizado pela mitocôndria, através da fosforilação oxidativa, desempenhando a cadeia transportadora de eletrões um papel muito importante na produção de energi a. Neste mecanismo, destaca-se uma parte de eletrões que reagindo diretamente com o O2, conduz à
formação de ERO (Ferreira et al., 2007). Através deste processo, e seguindo os mesmos autores, estima-se que uma percentagem compreendida entre dois a cinco por cento do O2
consumido, origina as ERO. Desta forma, os RL e as EROpodem oxidar e provocar danos, ao nível dos principais componentes da membrana celular, mais concretamente, os ácidos nucleicos, proteínas e lípidos, iniciando processos de degradação celular, conduzindo a alterações funcionais e estruturais, independentemente do local onde são geradas (Cadenas & Davies, 2000) referem (ver figura 1).
Revisão da Literatura
10
Figura 1 – Interação das ERO com os componentes celulares (adaptado de Ferreira et al., 2007).
Existem vários tipos de ERO, entre os quais: o radical anião superóxido, o peróxido de hidrogénio (H2O2) e o HO•, resultado da redução incompleta do O2. Em condições normais,
nem a produção de superóxido, nem de H2O2 são problemáticas para a célula, uma vez que
esta apresenta mecanismos de defesa, prontos a atuar. No entanto, os dois podem gerar ERO mais reativos, ao interagir com outras moléculas, como o radical HO•, que apesar de
apresentar um tempo de vida curto é bastante reativo podendo causar danos macromoleculares, incluindo mutações ao nível do ADN (Sanz, 2016; Ferreira et al., 2007). Convém salientar que o principal alvo do H2O2 são proteínas específicas, com grupos tióis de
resíduos de cisteína, envolvidas em processos de sinalização celular (Sohan & Forster, 2014). Quando os radicais livres atuam sobre os lípidos presentes na membrana mitocondrial inicia-se a peroxidação lipídica. Tal como em todas as reações radicalares, verificam-inicia-se três fainicia-ses neste processo, são elas: iniciação, propagação e terminação. Assim sendo, e de acordo com Catala (2009), a extração de um átomo de hidrogénio da cadeia polinsaturada de um lípido, pela ação do HO• ou do H
2O2, gera um radical lipídico (L•). Este, ao reagir com o O2, forma o
radical peroxilo (LOO•), que se não for neutralizado irá reagir com outros lípidos adjacentes,
formando lípidos hidroperóxidos (LOOH), num fenómeno de propagação da peroxidação lipídica, que podem ser novamente decompostos, para formar novamente radicais L•. Se estas
reações de propagação em cadeia não forem travadas, podem provocar danos muito superiores aos ERO que iniciaram a reação, como consequência da cascata oxidativa. A peroxidação lipídica altera a permeabilidade e fluidez da membrana, alterações no transporte de iões, inibindo o processo metabólico. Ainda na perspetiva de Catala (2009), as propriedades fisiológicas e químicas da membrana lipídica são alteradas, sendo produzidos compostos que podem ter efeitos prejudiciais, ou benéficos, quando é equacionado o efeito positivo que o processo de adaptação pode ter.
ERO
Lípidos Proteínas ADN Hidratos de
Carbno
Lesão Celular
Revisão da Literatura
11 Existem ainda as espécies reativas de nitrogénio, sendo a principal o óxido nítrico (NO•),
sendo produzido por sintases de óxido nítrico, metabolizando a arginina e a citrulina (Ghafourifar & Cadenas, 2005). Em células do sistema imunitário, durante processos inflamatórios, o NO• é produzido juntamente com o (O
2•-). Estes dois radicais reagem com
formação de peroxinitrilo (ONOO-), sendo este um potente oxidante, cujos danos podem
provocar a fragmentação do ADN e oxidação lipídica.
Importa ainda referir que a visão clássica, segundo a qual os oxidantes produzidos têm uma ação, invariavelmente, prejudicial para as moléculas e macromoléculas tem vindo a ser substituída pela noção que alguns deles, particularmente o H2O2, desempenha um papel
fisiológico fundamental. Desta forma, com baixas concentrações, verifica-se uma regulação de das funções redox ao nível das proteínas. Já altas concentrações destes compostos revelam-se como potencialmente prejudiciais (Sohal & Forster, 2014).
2.4. Sistema antioxidante
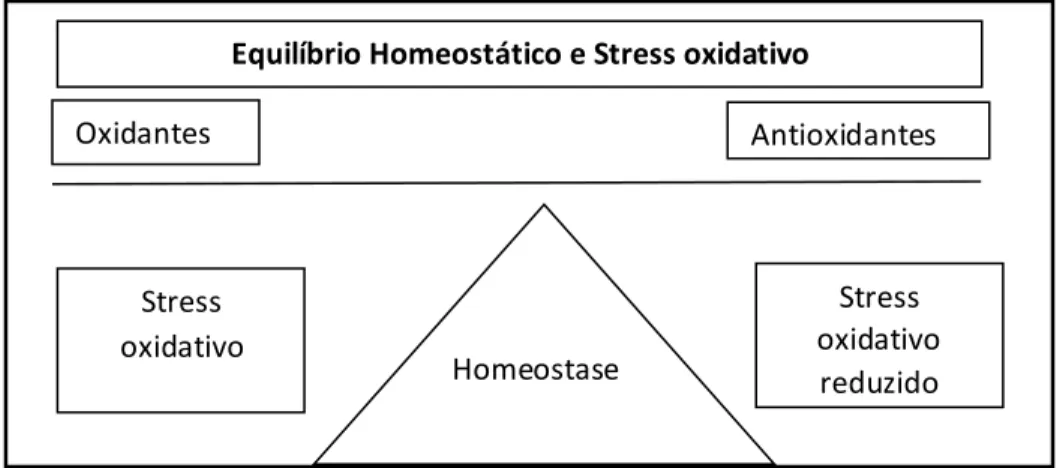
Atendendo às consequências do papel das ERO nos distintos componentes existem mecanismos de defesa antioxidante, que atuam no sentido de neutralizar as ERO, procurando manter o equilíbrio homeostático (Gomes et al., 2012). Assim, e de acordo com o mesmo autor, os antioxidantes são agentes redutores, que existem no ambiente intra e extracelular, que reagindo com as ERO minimizam as suas consequências, prevenindo, ou atrasando o stress oxidativo (ver figura 2). A proteção celular contra os danos oxidativos inclui quer a eliminação dos ERO, quer a reparação dos danos com antioxidantes a constituir a primeira linha de ação (Hulbert et al., 2007). Destacam-se diferentes estratégias na proteção às agressões originadas, quer através da transformação das ERO em moléculas menos ativas, quer pela prevenção da transformação das moléculas menos reativas em moléculas mais reativas, como é o caso da conversão do H2O2 no HO• (Powers et al., 2004).
Figura 2 – Relação entre oxidantes e antioxidantes no equilíbrio homeostático (Adaptado de Powers et al., 2004).
Equilíbrio Homeostático e Stress oxidativo
Oxidantes Antioxidantes Stress oxidativo Homeostase Stress oxidativo reduzido
Revisão da Literatura
12 Estes compostos podem ser divididos em dois grandes grupos, são eles: antioxidantes enzimáticos e não enzimáticos, trabalhando como um complexo, com o objetivo de remover as diferentes ERO geradas.
2.4.1. Antioxidantes Enzimáticos
Quando se considera os antioxidantes enzimáticos destacam-se o superóxido dismutase (SOD), que catalisa a dismutação do superóxido em O2 e H2O2, a glutationa peroxidase (GPX),
que transforma os hidroperóxidos lipídicos nos álcoois correspondentes, reduzindo o peróxido de hidrogénio a água, e a catalase (CAT), que decompõe o H2O2 (Finkel & Holbrook, 2000;
Hulbert et al., 2007).
Existem diferentes tipos de SOD, consoante o compartimento celular em que se encontram. Assim, na matriz mitocondrial existe a Mn-SOD, a Cu/Zn-SOD no citosol e espaço intermembranar, e uma Cu/Zn-SOD no espaço extracelular. A SOD elimina o superóxido, no entanto produz H2O2, sendo que quer a GPX, quer a CAT eliminam o H2O2. A CAT é uma
enzima muita ativa a remover o H2O2, mas necessita de grandes concentrações deste
composto para funcionar efetivamente. Contrariamente, a GPX é mais funcional na presença de concentrações mais baixas de H2O2, pela alta afinidade. Esta enzima tem as mesmas
localizações que a SOD, sugerindo que tem uma função fundamental agindo com o Cu/Zn-SOD no citosol e Mn-Cu/Zn-SOD na matriz mitocondrial (Hulbert et al., 2007).
2.4.2. Antioxidantes não enzimáticos
Existe uma diversidade de antioxidantes não enzimáticos nas células, de origem endógena ou dietética, onde se destacam as vitaminas, os minerais e os compostos fenólicos, entre os quais, a glutationa (GSH), a vitamina C, vitamina E, carotenóides, ácido úrico, a ubiquinona, bem como os minerais: selénio, magnésio, ferro e manganésio (Barbosa et al., 2010).
Relativamente à GSH, esta pode ser sintetizada de forma endógena, ou exógena, podendo reagir diretamente com as ERO, ou atuar como um co substrato das enzimas GPX (Ji & Leichtweis, 1997). A glutationa oxidada (GSSG) apresenta um papel importante na regulação da função proteica, sendo a glutationa redutase a enzima responsável pela conversão da GSSG a GSH, através do NADPH (Hulbert et al., 2007).
A vitamina C é um potente agente redutor, pela sua facilidade em ceder eletrões, necessitando a sua forma oxidada de ser reduzida pelo NADPH-, GSH-, ou NADH- para adquirir novamente
as suas propriedades antioxidantes (Gomes et al., 2012). É uma vitamina hidrossolúvel, que se encontra no fluido extracelular e no citosol, interagindo com os radicais livres, prevenindo assim os danos oxidativos (Ryan et al., 2010). A vitamina C pode atuar ainda como um
pro-Revisão da Literatura
13 oxidante, na medida em que reage com os metais de transição, gerando RL, entre os quais o HO• (Ji & Leichtweis, 1997).
A vitamina E atua nos grupos peroxil lipídicos reduzindo-os a hidroperóxidos, quebrando assim a cadeia da peroxidação lipídica, reduzindo ainda o alcóxido lipídico a álcoois lipídicos. Desempenha uma função protetora da membrana celular e das lipoproteínas do plasma, durante a peroxidação lipídica (Gomes et al., 2012). A forma oxidada da vitamina E pode ser reciclada à sua forma reduzida através do ácido ascórbico ou da ubiquinona (Ji & Leichtweis, 1997).
Ryan et al. (2010), destaca o facto da ação combinada das vitaminas C e E, resultar numa melhoria do seu efeito antioxidante, comparativamente ao seu efeito isolado, o que pode ser explicado pela distinta localização subcelular apresentada.
Os carotenoides são percursores da vitamina A, podendo esta desempenhar funções como antioxidante, ou como pró-oxidante. Desta forma, os carotenoides inibem a peroxidação lipídica, no entanto, sob elevadas concentrações de O2 tende a verificar-se uma diminuição
da capacidade antioxidante (Oliveira e Schoffen, 2010). A vitamina A é um fator importante no crescimento e na diferenciação celular, encontrando-se amplamente distribuída nos alimentos (Bianchi & Antunes, 1999).
O ácido úrico é um excelente eliminador do HO•, além de preservar ácido ascórbico no plasma
sob stress oxidativo. Durante o exercício físico agudo as concentrações de ácido úrico tendem a aumentar, pelo que pode atuar como um dos protetores contra as ERO (Ji & Leichtweis, 1997).
A atividade antioxidante do ubiquinol observa-se na eliminação dos radicais lipídicos.
Além destes, verificam-se substâncias de origem mineral, que participam do processo antioxidante em associação com enzimas, entre os quais, o zinco, o manganês, o selénio e ferro (Halliwell & Gutteridge, 1985). Neste sentido, o selénio ajuda a neutralizar a produção excessiva de ERO, assim como fenómenos de peroxidação lipídica (Volp, 2010). Níveis reduzidos deste mineral, traduzem-se em menores concentrações da enzima antioxidante GPX, resultando assim, numa maior suscetibilidade das células e do organismo, aos danos oxidativos (Scieszka et al., 1997). Além do selénio, o zinco é frequentemente mencionado na literatura como um elemento antioxidante envolvido nos mecanismos celulares de defesa contra os radicais livres (Alfieri et al.,1998; Yiin & Lin, 1998). A deficiência de magnésio aumenta a produção de radicais livres, levando a alterações nas membranas celulares, tendendo a aumentar o processo de peroxidação lipídica e diminui a atividade antioxidante
Revisão da Literatura
14 (Amorim & Tirapegui, 2008). Em relação ao manganês importa referir que este é um co-fator (SOD-Mn) da SOD na mitocôndria (Bianchi & Antunes, 1999). O ferro também apresenta um papel antioxidante, pois participa da composição da enzima catalase, que transforma o H2O2
em água (H2O) e O2. No entanto, também catalisa reações de radicais livres, como as reações
de Fenton e de Haber-Weiss (Haber & Weiss, 1932 & Ferreira et al., 2007), apresentadas em baixo:
Reação de Fenton Reação de Haber-Weiss Fe2+ +H
2O2 ———> Fe3+ +HO-+OH- (reação 1) H2O2 + O2 ———> O2 + OH- + OH- (reação 2) No entanto, apesar das defesas do organismo, os danos oxidativos ocorrem, pelo que importa salientar a defesa, a nível estrutural, ou seja, a remoção e/ou reparação dos danos moleculares que ocorreram, sendo a reparação do ADNN muito importante para a função celular (Collins, 2009; Monaghan et al., 2009). Desta forma, para evitar a acumulação gradual de ADN oxidado, lesões e simultaneamente manter a estabilidade do genoma, os danos no ADN têm de ser reparados. De facto, defeitos no processo de reparação permite esta mesma acumulação, contribuindo quer para processo de envelhecimento, quer para o desenvolvimento de doenças (Hulbert et al., 2007, Halliwell, 2012). Convém referir a possibilidade de um antioxidante atuar como protetor num determinado sistema, e simultaneamente aumente as lesões induzidas noutros sistemas, ou tecidos (Halliwell et al., 1995; Bianchi & Antunes et al., 1999).
O termo “paradoxo antioxidante” é referido várias vezes refletindo o facto dos radicais livres e das ERO estarem associadas a várias doenças, no entanto a administração de uma dieta antioxidante, não revela, ou revela poucos efeitos preventivos ou terapêuticos, exceto em situações de deficiência (Gutteridge & Halliwell, 2010; Halliwell, 2012). Na base deste paradoxo encontra-se a noção que os antioxidantes são benéficos, assim sendo, se as ERO causam danos oxidativos, que propiciam a ocorrência de doenças, a administração de antioxidantes deveria diminuir os danos e consequentemente as doenças associadas aos mesmos (Halliwell, 2012). Assim, Barja (2013) refere que os antioxidantes não se encontram relacionados com a longevidade, mas sim com a acumulação de ADN mitocondrial. No entanto, convém referir a complexidade do sistema antioxidante, do elevado número de antioxidantes, muitos deles que ainda não foram identificados, assim como dos seus variados campos de interação (Buffenstein, 2008).
Revisão da Literatura
15
2.5. Stress Oxidativo
Em concentrações baixas ou moderadas, os ERO podem ser benéficos para a célula, estando envolvidos em vários processos fisiológicos de sinalização e regulação, no entanto, quando se observa uma produção excessiva destes compostos, ou uma deficiência na capacidade antioxidante, este equilíbrio é destruído (Sohal & Forster, 2014). Importa referir que níveis elevados de ERO não resultam necessariamente em stress oxidativo, já que pode ser regulado pelas defesas do organismo. Seguindo a mesma linha de pensamento, indivíduos com níveis elevados de antioxidantes podem não apresentar um equilíbrio melhor, comparativamente com indivíduos com níveis mais baixos, já que depende dos valores de ERO com que têm de atuar. Desta forma, e atendendo ao facto das ERO apresentarem um tempo de vida muito curto, na prática, para se aferir o stress oxidativo, medem-se os danos, ou a presença de níveis elevados de ERO que aumenta consequentemente a sua produção, ou as reduzidas defesas (Monaghan et al., 2009). Assim, apesar de ser frequente a expressão de aferir a produção de ERO, aquilo que é estimado é o equilíbrio entre a produção e consequente eliminação de ERO (Barja, 2013).
Uma das formas utilizadas para aferir os danos decorrentes do stress oxidativo é através dos TBARS, que são formados como um subproduto da peroxidação lipídica ao utilizar o ácido
tiobarbitúrico como reagente (Pryor, 1991). Os danos oxidativos induzem uma cascata de reações, sendo que algumas das ERO aparecem mais tarde e acumulam-se, como o malondialdeído (MDA) (Miyata & Smith, 1996; Pedersen et al., 2000; Keller et al., 2000; Subramanian et al., 1998). A utilização do MDA a reagir com o ácido tiobarbitúrico tem vindo a revelar-se eficaz, quer para monitorizar o aumento das ERO, quer para tratamentos antioxidantes (Meagher & Fitzgerald, 2000; Dawn-Linsley et al., 2005).
2.6. Stress oxidativo e processo de envelhecimento
O papel do stress oxidativo, quer ao nível do envelhecimento saudável, quer ao nível da longevidade, tem sido alvo de estudo. Desta forma, as evidências parecem mostrar uma tendência para aumentar a produção de ERO, com a idade (Droge, 2002). Tem sido verificado que a produção de H2O2 mitocondrial aumenta progressivamente com a idade, iniciando assim
uma sequência de eventos, que resultam na disrupção dos mecanismos redox para a regulação da função proteica (Sohal & Forster, 2014). Ao nível da tolerância ao stress oxidativo, Dato et al., (2013) destacam o facto do envelhecimento ser associado a uma baixa tolerância ao stress oxidativo, tendo sugerido também modificações genéticas da resposta ao stress oxidativo, com a idade.
Revisão da Literatura
16 Um outro ponto fundamental que tem sido gradualmente aceite relaciona-se com a restrição calórica e como ela expande a longevidade. Mais concretamente, a restrição calórica, através da diminuição da temperatura corporal, da taxa de produção de ERO e do aumento da síntese de GSH contribui para o aumento da longevidade (Sohal & Forster, 2014).
Através de estudos realizados com espécies distintas e analisando aquelas que apresentam maior longevidade, tendem a evidenciar danos por stress oxidativo reduzidos, uma baixa produção de radicais livres, defesas antioxidantes elevadas, assim como uma resistência elevada ao stress oxidativo (Dato et al., 2013). Neste âmbito, espécies com maior longevidade tendem a apresentar menores taxas de ERO mitocondrial e menores danos oxidativos, ao nível do ADN mitocondrial. Quando é analisada a longevidade das espécies verifica-se um aspeto fundamental, mais concretamente uma menor taxa de ERO mitocondrial, sendo estes e não o nível de antioxidantes, que importa. Neste sentido, e equacionando ainda estudos entre espécies, observa-se em espécies com maior longevidade um menor número de ácidos gordos insaturados que diminuem a sensibilidade das membranas celulares e mitocondriais à peroxidação lipídica (Barja, 2013). Em muitas espécies, o processo de envelhecimento resulta numa reduzida capacidade antioxidante, conduzindo a um declínio progressivo nas defesas bioquímicas. Noutras, verifica-se que à medida que a idade avança, mais antioxidantes são produzidos, no sentido de neutralizar o aumento da taxa de produção de ERO (Buffenstein, 2008).
2.7. Stress oxidativo e Atividade Física Habitual
De acordo, com Dato et al. (2013) quer os fatores genéticos, quer o estilo de vida adotado pelos indivíduos influenciam os processos envolvidos na resposta ao stress oxidativo, assim como para atrasar os efeitos do envelhecimento. Desta forma, não esquecendo o importante papel desempenhado pelos fatores genéticos, muito pode ser feito no sentido de minimizar os efeitos do stress oxidativo, ao adotar um estilo de vida fisicamente ativo, juntamente com uma dieta rica em antioxidantes, com um baixo aporte calórico.
Relativamente aos efeitos do exercício físico na formação de ERO e na promoção de stress oxidativo, convém destacar que existem poucos estudos desenvolvidos com humanos. Esta situação pode ser explicada, quer pelo caráter invasivo dos procedimentos disponíveis para quantificar lesões oxidativas em biomoléculas, quer pela dificuldade da sua aplicação (Souza et al., 2005; Ferreira et al., 2007). Os efeitos do exercício são variáveis dependendo do tipo, intensidade, frequência e duração, assim como da idade, sexo, nível de treino, capacidade
Revisão da Literatura
17 física e estado de saúde dos indivíduos (Sallam & Laher, 2016). Ainda assim, tanto o exercício físico agudo, como aquele realizado de forma regular, podem influenciar o equilíbrio homeostático e a consequente adaptação, envolvendo os benefícios, riscos do aumento do consumo de oxigénio e consequente aumento da produção de ERO (Radak et al., 2013). No entanto, as evidências demonstram que o exercício físico praticado de forma regular potencia um aumento crónico da atividade das defesas antioxidantes, pelo que é provável que os níveis basais de stress oxidativo sejam inferiores aqueles que são evidenciados por indivíduos sedentários. (Ferreira et al., 2007). No que concerne ao exercício físico agudo, ou exaustivo, os danos oxidativos que ocorrem ao nível dos lípidos, proteínas e ADN aumentam, traduzindo-se num aumento dos níveis de stress oxidativo (Radak et al., 2013; Souza et al., 2005). O exercício físico realizado de forma regular pode minimizar os efeitos do envelhecimento, combatendo a disfunção mitocondrial, a perda de massa muscular e doenças como a obesidade, exercendo ainda uma ação antioxidante e anti-inflamatória (Sallam & Laher, 2016; Booth et al., 2011).
18
Metodologia
19
3. Metodologia
3.1. Amostra
A amostra foi constituída por 39 indivíduos, do género feminino, com idade inferior a 60 anos, subdivididos em três grupos de acordo com o ciclo reprodutivo, mais concretamente: pré-menopausa (14), peri-pré-menopausa (12) e pós-pré-menopausa (13), conforme é possível verificar no quadro 2.
Quadro 2 – Intervalo de idades e N da amostra nos diferentes grupos da amostra (pré, peri e pós-menopausa)
Fase N Intervalo de Idades Pré-menopausa 14 42,9 - 46,1
Peri-menopausa 12 45,3 - 49,8
Pós-menopausa 13 51,7 - 56,6
Os procedimentos experimentais encontram-se em concordância com os princípios éticos da Declaração de Helsínquia, tendo o protocolo do estudo sido aprovado pelo Comitê de Ética e Pesquisa da UTAD (Parecer 05-CIDESD-2012).
Incluir critérios classificação
3.2. Procedimentos
3.2.1. Parâmetros relacionados com o estilo de vida - Questionário de nível de Atividade Física (IPAQ)
A determinação do nível de atividade física habitual da amostra foi efetuada através da utilização da versão curta do IPAQ, descrito por Craig et al. (2003), traduzido e validado para a população portuguesa por Campaniço (2003) Este questionário consiste em nove itens, que abordam a tipologia das atividades específicas no âmbito do tempo da atividade física e lazer (exercício ou desporto), das atividades domésticas, atividades relacionadas com trabalho e atividades físicas relacionadas com transporte. As atividades específicas que são avaliadas são a marcha e atividades de intensidade moderada ou vigorosa. Os resultados foram expressos em MET.min/sem em função do peso de cada indivíduo.
Metodologia
20
3.2.2. Parâmetros bioquímicos 3.2.2.1. Colheita de sangue
A colheita de sangue foi realizada através de punção venosa, em tubos de vácuo com ácido etilenodiamino tetra-acético tripotássico (K3EDTA), tendo sido recolhidos 10mL de plasma
sanguíneo. As mulheres foram orientadas no sentido de não praticarem exercício físico no dia anterior à colheita e a chegarem durante a manhã, em jejum.
3.2.2.2. TBARS
A determinação dos TBARs foi efetuada de acordo Wills (1987), adaptado para Leitor de Microplacas. Foram utilizados 100 μL de plasma, posteriormente diluídos em 200 μL de ácido tricloroacético a 10% e agitados no vórtex. Após a centrifugação a 15000 rpm durante 20 segundos, a 1500 rpm, na centrífuga SIGMA 2 – 16K, foram retirados 200 μL de sobrenadante, diluídos em 200 μL de ácido tiobarbitúrico a 1% e incubados em banho fervente durante 10 minutos, numa placa de aquecimento SELECTA– AGIMATIC–E. Antes de ser colocado na microplaca, para análise no leitor de microplacas (THERMO ELETRON CORPORATION – MULTISKAN ASCENT) e lida a uma absorvância de 540 nm, verificou-se um período de arrefecimento. A quantidade TBARs formada, após terem sido subtraídos os valores do branco foi calculada, através da equação de beer-lambert A=εcl, com base no coeficiente de extinção molar (ɛ) de 1,55x105 M-1 cm-1 : C=(A)/(1,56x105) * d, na qual C = concentração, A =
absorvância; I=diâmetro do poço da placa utilizada no leitor de placas (d=0.8cm).
3.2.2.3. Proteína
Para determinar e quantificar a proteína utilizou-se o método colorimétrico do Biureto (Gornal, Bardawill & David, 1949). Este método incide na reação do sulfato de Cobre (CuSO4), em
solução alcalina, sendo este o reagente de Biureto, com as ligações amida das proteínas, dando origem a um complexo de cor violeta. A absorvância foi determinada para um comprimento de onda de 540 nm, tendo sido preparados uma série de padrões de BSA 0,4% (p/v), com as seguintes concentrações: 0, 0,4, 0,8, 1,6 e 2,4 mg de proteína, que correspondem respetivamente aos seguintes volumes: 0, 100, 200, 400 e 600 mL e adicionou-se 100 μL de dodecilsulfato de sódio (SDS) 10% (p/v) a cada tubo. O volume foi ajustado a 2000 μL com água desmineralizada e procedeu-se a adição de 2000 μL de reagente de biureto [(CuSO4.H2O) a 0,15% (p/v), tartarato de sódio e potássio (NaKC4H4O6.4H2O) a 0,6% (p/v),
hidróxido de sódio (NaOH) a 3% (p/v) e iodeto de potássio (KI) a 0,1% (p/v)] perfazendo um volume final de 4 mL. Para as amostras o procedimento foi semelhante, mas com a adição de 100 μL do homogeneizado a quantificar. As absorvâncias dos padrões e das amostras foram lidas após 15 minutos de reação à temperatura ambiente, a 540 nm, contra um branco que
Metodologia
21 continha todos os reagentes exceto a proteína. As leituras realizaram-se num espectrofotômetro UV-VIS Spectronic® GenesysTM 2PC.
3.3. Tratamento Estatístico (SPSS)
A análise exploratória dos dados obtidos foi realizada através da estatística descritiva, para calcular a média e respetivo desvio-padrão (DP) das diferentes variáveis (idade, TBARS e atividade física habitual). A normalidade das distribuições foi confirmada através do teste não paramétrico de Kolmogorov-Smirnov. De seguida, foi utilizado o programa Microsoft Excel, de modo a construir os gráficos para os TBARs.
No sentido de analisar as diferenças entre grupos (pré, peri e pós-menopausa) foi utilizada o teste One-Way ANOVA para a variável idade e o teste de Krukal-Wallis para as variáveis: TBARs e atividade física habitual.
Para medir a intensidade da relação entre as variáveis (ciclo reprodutivo, idade, atividade física habitual) recorreu-se ao coeficiente de correlação de Spearman.
As diferenças entre os valores foram consideradas significativas para um p ˂0,05. O tratamento estatístico foi realizada no programa SPSS, versão 20- , para Windows.
22
Resultados
23
4. Resultados
A média das idades e respetivos desvios-padrão de cada um dos grupos que constituem a amostra, bem como os parâmetros relativos aos hábitos de vida encontram-se na tabela 1.
Tabela 1 – Valores médios (± 𝐷𝑃) 𝑑a Idade (anos) e atividade física semanal (MET.min/sem) nos diferentes grupos da amostra (pré, peri e pós-menopausa).
Pré-menopausa N= 14 Peri-menopausa N= 12 Pós-menopausa N= 13 P Idade (anos) 44,5±2,8 47,6±3,6 54,2±4,1 0,000 IPAQ (MET.min/sem) 746,0±621,8 1747,4±289,3 925,6±577,6 0,561
Verificou-se que existem diferenças estatisticamente significativas entre grupos (p˂0,05), na idade. Na variável relativa à atividade física habitual não se observaram diferenças estatisticamente significativas entre os grupos.
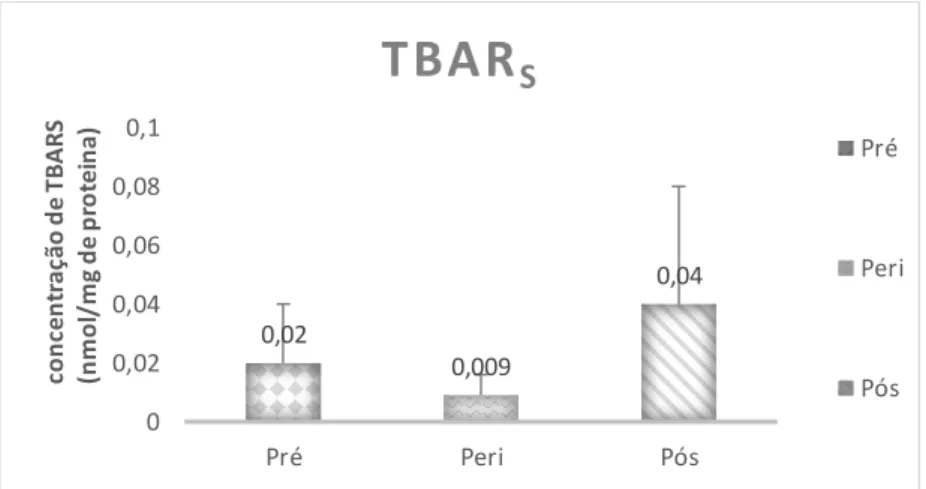
No gráfico 1 encontra-se representada a concentração de TBARs (nmol/mg de proteína), para os três grupos da amostra.
Gráfico 1 – Concentração de TBARs para os diferentes grupos da amostra (pré, peri e pós-menopausa).
De acordo com o gráfico 1, verificou-se que no grupo pré-menopausa o valor médio é de 0,022±0,02 nmol/mg de proteína, no grupo peri-menopausa é de 0,009±0,007 nmol/mg de proteína e no grupo pós-menopausa é de 0,044±0,04 nmol/mg de proteína. Considerando estes valores observaram-se diferenças estatisticamente significativas entre grupos na variável TBARs (H (2) = 7,496 p= 0,024).
Na tabela 2 é apresentada a correlação entre os diferentes parâmetros em estudo: ciclo reprodutivo, idade e IPAQ.
0,02 0,009 0,04 0 0,02 0,04 0,06 0,08 0,1 Pré Peri Pós co n ce n tr açã o d e T B A R S (n m o l/ m g d e p ro te in a)
TBAR
S
Pré Peri PósResultados
24
Tabela 2 – Resultados teste de correlação de Spearman entre a idade (anos) e o ciclo reprodutivo e entre a idade e a atividade física semanal (MET.min/sem).
Idade IPAQ
Ρ p ρ p
Ciclo Reprodutivo 0,762*** 0,000 0,079 0,619 IPAQ -0,034 0,818
***p<0,001
A análise da tabela 2 evidenciou que o ciclo reprodutivo e a idade se encontram correlacionados positivamente (ρ=0,762 p=0,000).
25
Discussão dos Resultados
26
5. Discussão dos Resultados
Vários estudos sugerem a menopausa como um fator de risco para o stress oxidativo, assim como para o aumento dos níveis de PL (Kolisnikova et al., 2015; sanchez et al., 2012). Neste sentido, o presente estudo teve como objetivo analisar a influência da menopausa nos danos por PL. O método TBARS tem sido utilizado como biomarcador de PL e consequentemente
do stress oxidativo (Haggag, Elsanhoty, & Ramadan, 2014; Honma et al., 2013). Assim, tendo sido os TBARS os indicadores de stress oxidativo neste estudo, verificaram-se diferenças
estatisticamente significativas entre os grupos considerados. Observou-se uma diminuição da concentração de TBARS do grupo pré-menopausa, para o peri-menopausa, tendo aumentado
quando se observa o grupo menopausa. O aumento da concentração nos grupos pós-menopausa sugere que após a pós-menopausa os danos por stress oxidativo aumentam, potenciando os efeitos do envelhecimento. Estes resultados foram corroborados por Bednarek-Tupikowska et al., (2004); Sanchez et al., (2012); Lizcano & Guzman, (2014) e Kolisnikova et al., (2015). O aumento da concentração de TBARS, quando comparados o
grupo peri e pós-menopausa vai de encontro aos resultados de Altindag et al., (2008), onde se verificaram níveis de stress oxidativo mais elevados no último grupo, possivelmente explicado pela deficiência de estrogénios. Ainda os mesmos autores reforçam a importância da adoção de uma dieta enriquecida em antioxidantes em mulheres deste grupo. No entanto, Ogunro et al. (2014) verificaram que a fase peri-menopausa evidencia níveis mais elevados de stress oxidativo, contrariamente ao que foi evidenciado neste estudo.
Um outro aspeto considerado, ao longo deste estudo foi a existência de alguma variação da atividade física com a idade. Importa reiterar, que o exercício físico realizado de forma regular desempenha um papel importante na redução do stress oxidativo, através de adaptações crónicas, como a elevação da atividade das enzimas e dos substratos responsáveis pela inativação dos compostos reativos em repouso (Duarte, 2006; Golbidi, Badran & Laher, 2012; Ma et al., 2013). Desta forma, e atendendo à independência crescente, nas atividades diárias dos adultos com idade mais avançada (Lacroix, et al., & Satterfield, 1993), seria de esperar que os níveis de atividade física aumentassem no grupo pós-menopausa. No entanto, tal não se verificou, quando comparados os níveis de atividade física habitual (determinada pelo IPAQ), não se tendo observado diferenças estatisticamente significativas, entre os grupos. Destaca-se ainda o facto de ser o grupo peri-menopausa a espelhar maiores resultados. Este facto pode encontrar-se relacionado com a representatividade da própria amostra. Estes resultados podem ter sido influenciados pela reduzida amostra utilizada, não sendo representativos das mulheres, em geral, nestas fases da vida. Assim, a utilização de uma amostra de maiores dimensões e a expansão do estudo a outras regiões, bem como a
Discussão dos Resultados
27 realização de um estudo longitudinal, em vez de transversal são fatores que poderiam ajudar a compreender melhor as alterações decorrentes da menopausa no stress oxidativo.
28
Conclusão
29
6. Conclusão
O objetivo do presente estudo foi analisar a influência da menopausa nos danos por PL, assim em função das análises efetuadas, os resultados permitem retirar as seguintes conclusões:
i. Existem diferenças estatisticamente significativas na variável TBARs, sendo o grupo das mulheres, que se encontram na fase pós-menopausa, aquele que revela maior concentração. Assim a menopausa parece influenciar e potenciar o stress oxidativo; ii. Não se verificaram diferenças estatisticamente significativas entre grupos, na variável
atividade física habitual;
iii. O ciclo reprodutivo e a idade correlacionam-se positivamente;
Importa ainda destacar a reduzida dimensão da amostra como uma limitação do estudo, não sendo esta representativa das mulheres, em geral, nestas fases da vida, facto que pode ter influenciado os resultados obtidos. Assim, para uma melhor compreensão das alterações decorrentes da menopausa no stress oxidativo, sugere-se a utilização de uma amostra de maiores dimensões e a expansão do estudo a outras regiões. Uma outra sugestão identifica-se com a realização de um estudo longitudinal, em vez de transversal.
30
Referências Bibliográficas
31
7. Referências Bibliográficas
Achenbaum, W. A., & Levin, J. S. (1989). What does gerontology mean? The Gerontologist, 29, 393–400.
Alfieri, M., Leung, F., Grace, D. (1998). Selenium and zinc levels in surgical patients receiving total parenteral nutrition. Biological Trace Element Research, 61 (1): 33-39.
Altindag, O., Erel, O., Soran, N., Celic, H.,Selec, S. (2008). Total oxidative/anti-oxidativestatus and relation to bone mineral density in osteoporosis. Rheumatol Int, 28:317–21.
Amorim, A. & Tirapegui, J. (2008). Aspetos atuais da relação entre exercício físico, estresse oxidativo e magnésio. Revista de Nutrição, 21 (5): 563-575.
Anderson, E. J., Katunga, L. A., & Willis, M. S. (2012). Mitochondria as a source and target of lipid peroxidation products in healthy and diseased heart. [Research Support, N.I.H., Extramural Review]. Clin Exp Pharmacol Physiol, 39 (2), 179-193.
Apostolova, N., Victor, V. (2015). Molecular Strategies for targeting antioxidants to mitochondria: therapeutic implications. Antioxidants & Redox Signaling, 12 (8).
Arora K.S., Gupta, N., Singh, R.A., Nagpal. S., Arora, D. (2009). Role of free radicals in menopausal distress. J Clin Diagn Res; 3: 1900–2.
Ascensão, A.,Magalhães, J., Soares, J., Ferreira, R., Neuparth, M., Apple, H., Duarte, J. A. (2005). Cardiac mitochondrial respiratory function and oxidative stress: the role of exercise. International Journal of Sports Medicine.
Barbosa, K., Costa, N., Alfenas, R., De Paula, S., Minim, V., Bressan, J. (2010). Oxidative stress: concept, implications and modulating factors. Journal of Nutritions, 23 (4): 629 – 543. Barja, G. (2013). Updating the Mitochondrial Free Radical Theory of aging: An Integrated View, Key Aspects, and Confounding Concepts. Antioxidants & Redox Signaling, 19 (12). Doi: 10.1089/ars.2012.5148.
Barrera, G. (2012). Oxidative stress and lipid peroxidation products in cancer progression and therapy. ISRN Oncol.
Base de dados Portugal Contemporâneo. Fontes/Entidades: Eurostat | NU | Institutos Nacionais de Estatística, PORDATA. Última atualização: 2016-09-07. Disponível através da
Referências Bibliográficas
32 hiperligação: http://www.pordata.pt/Europa/Popula%C3%A7%C3%A3o+residente-1951. Acedido em 2016/09/10.
Bernardini, M.A., Petti, M., Pistelli, L., Massaguer, A., Motta, E., Baracat, E. Introdução e definições – climatério, perimenopausa e menopausa. Disponível através da hiperligação:
http://www.medicinanet.com.br/conteudos/revisoes/1660/climaterio.htm. Acedido em 14/07/2016.
Bednarek-Tupikowska, G., Bohdanowicz-Pawlak, A., Bidzinska, B.,Milewicz, A., Antonowicz-Juchniewicz, J. & Andrzejak, R. (2004). Serum lipid peroxides and total antioxidant status in
postmenopausal women on hormone replacement therapy. Gynecological Endocrinology, 19,
57–63.
Bianchi, M. & Antunes, L. (1999). Radicais Livres e principais antioxidantes da dieta. Rev. Nutr., Campinas, 12 (2): 123-130.
Booth, F.,Laye, M., Roberts, M. (2011). Lifetime sedentary living accelerates some aspects of secondary aging. Journal Appl. Physio, 111: 1497-1504.
Brown J.P., Gallicchio L., Flaws, J.A., Tracy, J.K. (2009). Relations among menopausal symptoms, sleep disturbance and depressive symptoms in midlife. Maturitas, 62:184-9. Bruce D. & Rymer J. (2009). Symptoms of the menopause. Best Pract Res Clin Obstet Gynaecol; 23: 25-32.
Buffenstein, R., Edrey, Y., Yang, T., Mele, J. (2008). The oxidative stress theory of aging: embattled or invincible? Insights from non-traditional model organisms. AGE, 30:99–109. Cadenas, E., Davies, K. (2000). Mitochondrial free radical generation, oxidative stress, and aging. Free Radical Biology & Medicine, 29: 222-230.
Cakir,T., Goktas, B., Mutlu, M., Mutlu, I., Bilgihan, A., Erdem, M., Erdem, A. (2016). Advanced oxidation protein productsand malondialdehyde — the new biological markers of oxidative stress — are elevated in postmenopausal women. Ginekol Pol, 87(5):321-5.
Campaniço, H. (2003). Validation of actigraphy proportional IPAQ to assess habitual physical activity in adults. Ciências da Saúde.
Campesi, M., Occhioni, S., Tonolo,G., Cherchi, S., Basili, S., Carru, C., Zinellu, A., Franconi, F. (2016). Ageing/menopausal status in healthy women and ageing in healthy men differently affect cardiometabolic parameters. International Journal of Medical Sciences, 13(2): 124-132. Doi: 10.7150/ijms.14163.
Referências Bibliográficas
33 Catala, A. (2009). Lipid peroxidation of membrane phospholipids generates hydroxyl-alkenals and oxidezed phospholipids active in physiological and/or pathological conditions. Chemistry and Physics of Lipids.
Collins, A. (2009). Investigating oxidative DNA damage and its repair using the comet assay. Mutation Research, 681: 24-32.
Consenso e Estratégia para a saúde da mulher na pós menopausa. Sociedade Portuguesa de Ginecologia, 2004. Disponível através da hiperligação
http://www.spginecologia.pt/uploads/menopausa.pdf acedida em (17/07/2016). Craig, C. L., Marshall, A. L., Sjostrom, M., Bauman, A. E., Booth, M. L., Ainsworth, B. E., Pratt
M., Ekelund, U., Yngve, A., Sallis, J.F., Oja, P. (2003). International physical activity questionnaire: 12-country reliability and validity. Medicine and Science in Sports and Exercise, 35(8), 1381-1395.
Daan, N.M., Fauser, B.C. (2015). Menopause prediction and potential implications. Maturitas, 82(3): 257-65.
Dato, S., Crocco, P., D’aquila, P., Rango, F., Bellizi, R., Passarino, G. (2013). Exploring the role of genetic variability and lifestyle in oxidative stress response for healthy aging and longevity. International Journal of Molecular Sciences.
Dawn-Linsley M., Ekinci, F.J., Ortiz, D., Rogers, E., Shea, T.B. (2005). Monitoring thiobarbituric acid-reactive substances (TBARs) as an assay for oxidative damage in neuronal cultures and central nervous system. J Neurosci Methods, 141(2):219-22.
Dmitriev, L., Titov, V. (2009). Lipid peroxidation in relation to ageing and the role of endogenous aldehydes in diabetes and other age-related diseases. Ageing Research Reviews.
Droge, W. (2002). Free radicals in the physiological control of cell function. Phisiol rev,82. Duarte, J. A. (2006). O paradoxo do oxigénio, o exercício físico e a saúde de quem o pratica. Revista brasileira de Educação Física Esp. 20: 79-81.
Espinosa-Diez, C., Miguel, V., Mennerich, D., Kietzmann T. (2015). Antioxidant responses and cellular adjustments to oxidative stress. Redox Biology, 6: 183-197.
Faria, M., Simões, R., Santos, M. (2013). Pós-menopausa e sistema imune. Reprodução & Climatério, 2 8(1):30–35.
Referências Bibliográficas
34 Haber F., Weiss J. (1932). Über die Katalyse des Hydroperoxydes (On the catalysis of hydroperoxide). Naturwissenschaften. 20 (51): 948–950.
Ferreira, F., Ferreira, R., Duarte, J. A. (2007). Stress oxidativo e dano oxidativo muscular esquelético: influência do exercício agudo inabitual e do treino físico. Revista Portuguesa de Ciências do Desporto, 7: 257-275.
Figueiredo, P., Mota, M. P., Appell, H., Duarte, J. A. (2007). The role of mitochondria in aging of skeletal muscle. Biogerontology.
Finkel, T. & Holbrook N. (2000). Oxidants, oxidative stress and the biology of ageing. Nature, 408 (6809): 239-47.
Florencio, G., Gonçalves, A., Canário, A., Silva, M. (2011). Envelhecimento: uma reflexão sobre atividade física e estresse oxidativo em mulheres. Acta Med Port, 24: 983-988.
Ghafourifar, P. & Cadenas, E. (2005). Mitochondrial nitric oxide synthase. Trends Pharmacol Sci, 26(4):190-5.
Golbidi, S., Badran, M., Laher, I. (2012). Antioxidant and anti-inflammatory effects of exercise in diabetic patients. Exp Diabetes Res.
Gomes, E., Silva, A., Oliveira, M. (2012). Oxidants, antioxidants, and the beneficial roles of exercise-induced production of reactive species. Oxidative Medicine and Cellular Longevity Hindaei Publishing Corporation.
Gornal, A. G., Bardawill, C.J., & David, M.M. (1949). Determination of serum proteins by means of the biuret reaction. J. Biol Chem, 177 (2), 751-766.
Goy B., Atmaca, M., Aslan, M., Ucler, R., Alay, M., Seven, I., Demir, H., Ozturk, M. (2015). Relationship between serum DHEAS and oxidative stress levels of body mass index in healthy postmenopausal women. Redox Rep 21(2): 61-6.
Gracia C.R. & Freeman E.W. (2004). Acute consequences of the menopausal transition: the rise of common menopausal symptoms. Endocrinol Metab Clin North Am; 33:675-89.
Gutteridge, J. & Halliwell, B. (2010). Antioxidants: molecules, medicines and myths. Biochemical and Biophysical Research Communications. 393: 561–564.
Haggag, M., Elsanhoty, R. & Ramadan, M. (2014). Impact of dietary oils and fats on lipid peroxidation in liver and blood of albino rats. Asian Pac J Trop Biomed, 4(1): 52–58.
Halliwell B. & Gutteridge, J.M.C. (1985). Oxygen radicals and the nervous system. Trends Neurosci, 8:22– 6.