Universidade de Trás-os-Montes e Alto Douro
Otimização de técnicas de produção de
alimento vivo: rotíferos.
D
ISSERTAÇÃO DE MESTRADO EM
E
NGENHARIA
Z
OOTÉCNICA
Sofia Coelho Botelho
Orientador: Professor Doutor José Júlio Martins
III
Universidade de Trás-os-Montes e Alto Douro
Otimização de técnicas de produção de alimento vivo: rotíferos
.Dissertação de Mestrado em Engenharia Zootécnica
Sofia Coelho Botelho
Orientador: Professor Doutor José Júlio Martins
Composição do júri:
_____________________________________________ _____________________________________________ _____________________________________________
V
Dissertação submetida à Universidade de Trás-os-Montes e Alto Douro com vista à obtenção do grau de Mestre em Engenharia Zootécnica.
VII
Agradecimentos
É com muita alegria e satisfação que, neste pequeno espaço, tenho a possibilidade de expressar os meus profundos agradecimentos a quem, ao longo desta etapa da minha vida, tornou a sua presença uma mais-valia na minha formação como Engenheira Zootécnica e como pessoa.
Gostava de agradecer especialmente ao Professor José Júlio Martins, o meu orientador, por todo o apoio prestado, não só durante a formulação da minha dissertação, mas também durante estes 5 anos de curso. Muito obrigada não expressa corretamente as horas perdidas comigo, a paciência, a calma, a orientação e determinação para tornar este trabalho uma realidade.
Ao Oceanário de Lisboa, por esta oportunidade de trabalhar nas suas instalações, só posso esperar que o presente trabalho esteja ao nível de todos os ensinamentos de que me muniram para o realizar. À Doutora Núria Baylina, Hugo Batista e Margarida Ferreira, o meu profundo agradecimento pela oportunidade e apoio na realização do trabalho experimental. Ao Hugo, ainda, aproveito para afirmar que a ajuda em todos os passos desta minha etapa foi completamente fundamental, e sem dúvida valorizada e apreciada. Nada disto teria sido possível sem o suporte desta equipa.
Ao Luís Fontela, obrigada pela lembrança constante das minhas capacidades. Todos os momentos de angústia, tristeza e desespero que este projeto me trouxe foram ultrapassados e vencidos com esse apoio e companheirismo.
Às minhas queridas amigas, Diana Teixeira e Mariana Almeida, nem existem palavras para descrever o que foram estes meses enfiada num gabinete convosco a trabalhar. Foram a luz dos meus dias, especialmente quando havia dias negros. Garanto que vou ter muitas saudades destes tempos de escrita da tese, e nunca vou esquecer todos os conselhos, risadas e conversas que partilhamos. Muito obrigada!
Ao Professor Severiano Silva, aproveito para agradecer profundamente todo o auxílio que me prestou ao longo deste tempo todo. Foi dos primeiros professores que me conheceu na universidade, e certamente daqueles que mais me ajudou e me marcou. Só este parágrafo não demonstra a gratidão que sinto pelo seu auxílio.
VIII
À Professora Maria José Gomes e à Professora Ângela Martins quero expressar o meu agradecimento por todos os conselhos, tempo perdido a ajudar-me e palavras de apoio para que eu continuasse a trabalhar.
O meu grande agradecimento ao Engenheiro Paulo Fontes e Engenheira Elisabete Mena pela cedência do gabinete onde escrevi a presente dissertação. O apoio, amabilidade e boa disposição deste gabinete foram imprescindíveis para continuar motivada e focada na finalização deste trabalho.
Aos restantes professores do Departamento de Zootecnia da UTAD, o meu maior agradecimento, por todos estes anos de ensinamentos, apoio, incentivos e amizade que expressaram por mim. O encorajamento que senti por parte deste grupo de pessoas foi comovente, e muito valorizado!
Ao Doutor Carlos Ferreira, como não poderia faltar, é impossível expressar o apoio, acompanhamento e aconselhamento por meras palavras. Todas as conversas foram determinantes para a finalização deste trabalho, e o suporte ajudou-me a atingir todos os meus objetivos. Muito Obrigada.
A todos os meus amigos, que me perguntavam quase diariamente pela tese, obrigada pelo apoio e amizade que me providenciaram todos estes anos. Obrigada por todo o carinho.
E finalmente, à minha família, por me terem dado esta oportunidade de me formar num curso do ensino superior, e pela educação que me providenciaram. Forneceram-me todas as armas para poder vencer na vida, e tenciono usá-las no futuro.
IX
Abstract
Rotifers are widely used in aquaculture as the first feed for fish and crustacean larval stages, especially due to their small size (130-320 µm), low mobility, energetic value and the possibility of artificial manipulation of their dietary value. These invertebrates feed by filtration of several organisms and particles, such as microalgae, protozoa, bacteria, dead organic matter and artificial diets. For its use in aquaculture, their main food source is usually microalgae. These can be supplied fresh, concentrated, dried and dried-frozen. Another way of feeding rotifers consists on the supply of artificial diets, such as Easy DHA Selco®, which contains several essential nutrients for the right development of the marine fish larvae. Experiments were conducted in order to evaluate in which conditions of temperature (20 and 25ºC), salinity (16 and 32 ppm) and food (microalgae Nannochloropsis and Isochrysis, and artificial diet Easy DHA Selco®) the culture of rotifers (Brachionus plicatilis) would develop in the most favorable way. The best results were obtained with the microalgae
Nannochloropsis (P<0.0001), the temperature of 25ºC (P<0.0001) and with the salinity of 16
ppm (P<0.0001). Regarding the interactions, both microalgae present better growths at 25ºC, contrary to the artificial diet, which presented better results at 20ºC (P<0.0001). Concerning the effect of the salinity, the best results were obtained at 16 ppm for both microalgae, whereas the worst results were seen with the artificial feed, regardless of the salinity (P<0.0001). Between the temperature and the salinity was observed a highly significant interaction also, in which the population growth at 25 ºC was superior to the growth at 20ºC, regardless the salinity of the solution (P<0.01).
The results show that the best development of this culture was obtained with the supply of Nannochloropsis at the temperature of 25ºC and 16 ppm of salinity, being that the worst development of this culture was due to the use of Easy DHA Selco® at 25ºC and 16 ppm (P<0.0001).
XI
Resumo
Os rotíferos são largamente utilizados em aquacultura como o primeiro alimento para os estágios larvares de peixes e crustáceos, em especial devido ao seu tamanho reduzido (130-320 µm), à baixa mobilidade, ao valor energético e à possibilidade de manipular artificialmente o seu valor nutricional. Estes invertebrados alimentam-se por filtração de vários organismos e partículas, tais como microalgas, protozoários, bactérias, matéria orgânica morta e dietas comerciais. Para a sua utilização em aquacultura, a sua principal fonte de alimento são as microalgas. Estas podem ser fornecidas em fresco, concentradas, liofilizadas ou congeladas. Uma outra forma de os alimentar consiste no fornecimento de alimentos comerciais, tais como o Easy DHA Selco®, em cuja composição estão presentes nutrientes essenciais para o crescimento de larvas de peixe marinhos. Este ensaio teve como objetivo verificar em que condições de temperatura (20 e 25°C), salinidade (16 e 32 ppm) e alimento (microalgas Nannochloropsis e Isochrysis e o alimento comercial Easy DHA Selco®) a cultura de rotíferos (Brachionus plicatilis) se desenvolveria de forma mais favorável. Os melhores resultados foram obtidos com a microalga Nannochloropsis (P<0,0001), à temperatura de 25°C (P<0,0001) e com uma salinidade de 16 ppm (P<0,0001). Em termos de interações, ambas as microalgas apresentam melhores crescimentos a uma temperatura 25°C, ao contrário do alimento artificial, que apresentou os melhores resultados de desenvolvimento da cultura a 20°C (P<0,0001). Relativamente ao efeito da salinidade, os melhores resultados foram obtidos a 16 ppm, com ambas as microalgas, enquanto que os piores resultados foram obtidos com o alimento artificial, a qualquer uma das salinidades (P<0,0001). Entre os parâmetros temperatura e salinidade foi também verificada uma interação significativa, na qual o crescimento da população à temperatura de 25°C foi superior à temperatura de 20°C, independentemente da salinidade do meio (P<0,01).
Neste ensaio foi possível verificar que o melhor crescimento da cultura de rotíferos foi conseguido com o fornecimento de Nannochloropsis, a uma temperatura de 25°C e salinidade de 16 ppm, sendo que os piores resultados foram observados com a utilização de Easy DHA Selco®, a 25°C e salinidade 16 ppm (P<0,0001).
Palavras-chave: Brachionus plicatilis, rotífero, alimento, temperatura, salinidade,
XIII Índice Agradecimentos --- VII Abstract --- IX Resumo --- XI Índice --- XIII Índice de figuras --- XV Índice de tabelas --- XVII Lista de abreviaturas --- XIX
Introdução --- 1
PARTE I – REVISÃO BIBLIOGRÁFICA --- 5
1. Caracterização da espécie Brachionus plicatilis --- 5
1.1. Morfologia --- 5
1.2. Biologia e ciclo de vida --- 8
2. Recomendações nutricionais --- 11
2.1. Valor nutricional --- 16
2.2. Processos de enriquecimento --- 18
2.3. Alimentos fornecidos aos rotíferos --- 19
3. Cultivo de Rotíferos --- 23 3.1. Sistemas de Produção --- 24 3.1.1. Sistema batch --- 25 3.1.2. Sistema semi-contínuo --- 26 3.1.3. Contínuo --- 27 3.2. Qualidade da água --- 28 3.3. Temperatura--- 29 3.4. Salinidade --- 29 3.5. Oxigénio dissolvido--- 30
XIV
PARTE II – TRABALHO EXPERIMENTAL--- 31
1. Materiais e métodos --- 31
1.1. Contagem de rotíferos --- 33
1.2. Adição de alimento --- 35
1.3. Nannochloropsis sp concentrado vivo PhytoBloom green formula® --- 36
1.4. Isochrysis sp PhytoBloom prof® --- 37
1.5. Easy DHA Selco® --- 38
1.6. Análise estatística --- 38
2. Resultados e discussão--- 39
3. Considerações finais --- 48
Referências bibliográficas --- 49
XV
Índice de figuras
Figura 1: Representação esquemática da organização interna e morfológica de Brachionus
spp. fêmea (esquerda) e macho (direita). ... 6
Figura 2: Espécies de Brachionus spp. ... 7
Figura 3: Ciclo de vida partenogénico e sexual dos rotíferos. ... 9
Figura 4: Brachionus plicatilis após 24 horas de jejum (A), após 15 min de alimentação com microalga (B) e após 30 minutos de alimentação com microalga (C). ... 13
Figura 5: Representação esquemática de um sistema de cultura batch.. ... 25
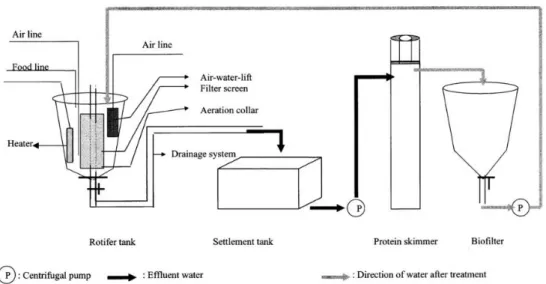
Figura 6: Representação esquemática de um sistema com recirculação de água. ... 28
Figura 7: Fotografia da instalação do sistema utilizado nos ensaios. ... 31
Figura 8: Vista lateral da instalação dos ensaios. ... 33
Figura 9: Esquematização dos diferentes locais de amostragem na coluna de água. ... 34
Figura 10: Exemplificação da pipetagem de gotas da solução e da malha de contagem. ... 35
Figura 11: Interação entre o alimento e a temperatura estudados em termos de número de rotíferos por ml.. ... 43
Figura 12: Interação entre o alimento e a salinidade estudados, expresso em número de rotíferos por ml.. ... 44
Figura 13: Interação entre a salinidade e a temperatura, expresso em número de rotíferos por ml.. ... 45
Figura 14: Interação entre o alimento*temperatura*salinidade, expressa por número de rotíferos por ml. ... 47
XVII
Índice de tabelas
Tabela 1: Estirpes aceites (negrito) e outros biótipos pertencentes ao complexo de espécies
Brachionus, agrupados de acordo com a sua classificação relativa ao tamanho corporal ... 7
Tabela 2: Parâmetros de cultura de Brachionus plicatilis e os intervalos toleráveis e preferenciais da espécie. ... 8 Tabela 3: Efeito da temperatura na atividade reprodutiva de Brachionus plicatilis. ... 8 Tabela 4: Peso seco e composição aproximada de rotíferos mantidos em jejumpor vários dias, a 22ºC, em µg por rotífero e em percentagem de matéria seca (entre parêntesis). ... 14 Tabela 5: Alguns ácidos gordos ômega 3 no total de lípidos de Brachionus plicatilis cultivados com fermento de padeiro (Saccharomyces cereviciae) e microalga marinha
Chlorella. ... 15
Tabela 6: Teor em ácidos gordos de microalgas utilizadas para a cultura de rotíferos. ... 20 Tabela 7: Parâmetros em estudo. ... 32 Tabela 8:Quantidade de alimento “Nannochloropsis sp. concentrado vivo PhytoBloom green formula®” a fornecer tendo em conta o número de rotíferos. ... 36 Tabela 9: Quantidade de alimento “Isochrysis sp. PhytoBloom prof®” a fornecer tendo em conta o número de rotíferos. ... 37 Tabela 10: Quantidades de DHA Protein Selco® a fornecer em função do número de rotíferos/ml da cultura. ... 38 Tabela 11: Média dos mínimos quadrados, desvio padrão, mínimo, máximo e coeficiente de variação para o número de rotíferos por alimento, temperatura e salinidade. ... 39 Tabela 12: Efeitos dos diferentes tratamentos na concentração de rotíferos por ml de solução. ... 40 Tabela 13: Interações entre alimento, temperatura e salinidade. ... 42 Tabela 14: Valores da interação entre alimento*temperatura*salinidade, expressos em número de rotíferos por ml. ... 46
XIX
Lista de abreviaturas
EPA – ácido eicosapentanóico ARA – ácido araquidónico DHA – ácido docosaexanóico
PUFA – ácidos gordos polinsaturados HUFA – ácidos gordos altamente insaturados EFA – ácidos gordos essenciais
Nanno – Nannochloropsis sp. Iso – Isochrysis sp.
1
Introdução
A nutrição larvar, mais precisamente a alimentação dos estágios larvares primários, é um dos maiores pontos de bloqueio para o desenvolvimento industrial das culturas de peixes marinhos, crustáceos e moluscos (Coutteau e Sorgeloos, 1997). O alimento vivo é considerado o componente principal na alimentação de larvas de peixes, tendo especial importância na criação de larvas de peixes marinhos do tipo altricial (larvas que mantêm um estado relativamente menos desenvolvido até o saco vitelino esgotar) (Conceição et al., 2010). No seu ambiente natural, as larvas têm acesso a uma grande variedade de organismos planctónicos, em contraste com as maternidades, onde a alimentação é baseada em apenas algumas espécies (Dhont et al., 2013), visto que coletar e fornecer plâncton natural não é prático a nível industrial, nem existe disponibilidade consistente para sustentar esta possibilidade (Coutteau e Sorgeloos, 1997). Tendo isto em conta, os alimentos vivos, consistentes em rotíferos, copépodes e artémia, são preferidos em detrimento do plâncton natural devido à sua disponibilidade, facilidade de cultura, relação custo-eficiência e aplicação versátil (Coutteau e Sorgeloos, 1997).
Os pioneiros na utilização do rotífero Brachionus plicatilis como alimento vivo foram aquacultores japoneses, em culturas de enguias (Ito, 1960, citado por Watanabe et al., 1983). Após esta descoberta, a aquacultura sofreu um grande desenvolvimento (Protella et al., 1997), sendo os rotíferos amplamente utilizados como primeiro alimento vivo para os estágios iniciais larvares de inúmeros peixes, crustáceos e moluscos (Watanabe, 1985; Hagiwara et al., 2001; Ando et al., 2004; Cheng et al., 2004; Kotani et al., 2009; Seychelles et al., 2009; Jeeja
et al., 2011) e, tornando possível, por sua vez, a produção em massa de larvas de peixe
(Watanabe, 1985).
Os rotíferos são considerados um alimento ideal devido ao seu tamanho (130-320 µm), natureza planctónica, intervalo entre gerações curto e taxas produtivas elevadas, sendo estas adequadas para a produção em massa (sob condições controladas), elevada capacidade de crescimento e de reprodução em culturas de elevada densidade, relativa baixa mobilidade, valor calórico adequado e a possibilidade de manipular artificialmente a sua qualidade nutricional (Watanabe et al., 1983; Lubzens, 1987; Fielder et al., 2000; Dhert et al., 2001; Seychelles et al., 2009; Jeeja et al., 2011; Yin et al., 2013). Desta forma, os rotíferos são considerados um primeiro alimento excecional para larvas de peixes (Howell, 1973; Lubzens, 1987; Dhont et al., 2013). Apesar dos rotíferos serem resistentes e a sua cultura em grande
2
escala ser fácil (Lucas e Southgate, 2012), também é laboriosa, intensiva e algo delicada, visto que podem ocorrer ocasionais contaminações de cultura, levando ao seu colapso (Dhont et al., 2013).
As presas vivas são preferidas ao alimento inerte devido à sua capacidade de se deslocarem na coluna de água, apelando ao instinto predatório das larvas e estando constantemente disponíveis para estas (Conceição et al., 2010). A adequação do tamanho da presa ao tamanho da boca do predador é de extrema importância, tornando a seleção da estirpe de organismo a utilizar um dos parâmetros mais importantes na cultura de rotíferos (Lubzens, 1987; Lucas e Southgate, 2012; Dhont et al., 2013). As estirpes de Brachionus
plicatilis tipicamente utilizadas são divididas de acordo com o tamanho, entre os tipos SS
(super small) e L (large) (Lucas e Southgate, 2012).
A iniciação de uma cultura em massa de rotíferos deve ser realizada tendo em conta vários aspetos:
Seleção da estirpe de rotíferos com tamanho adequado às larvas em questão e condições de cultura;
Manutenção da qualidade e quantidade de alimento fornecido;
Controlo dos parâmetros de qualidade da água nos tanques de cultivo (salinidade, temperatura, pH) e remoção dos produtos de excreção (Lubzens, 1987).
Entre os vários métodos de cultivo desta espécie temos o sistema batch e os métodos semi-contínuo e contínuo (Lucas e Southgate, 2012). Foram ainda desenvolvidos outros métodos de cultura de modo a possibilitar elevadas densidades populacionais em culturas contínuas, estando na sua base o uso de suspensões concentradas de microalgas (Abu-rezq et
al., 1997; Fu et al., 1997; Yoshimura et al., 1997a; Suantika et al., 2000).
Os rotíferos alimentam-se por filtração, e a sua dieta natural consiste numa variedade ampla de bactérias, protozoários, detritos, fitoplâncton (microalgas) e/ou zooplâncton de menor tamanho (Rezeq e James, 1987; Omori e Ikeda, 1994, citado por Coutteau e Sorgeloos, 1997; Øie e Olsen, 1997; Jeeja et al., 2011). A elevada densidade de partículas alimentares de diversos tamanhos e composição bioquímica possibilitam a satisfação de todas as necessidades nutricionais das larvas (Coutteau e Sorgeloos, 1997). A dieta surge assim como um fator de grande relevo, afetando o crescimento dos rotíferos e a sua qualidade nutricional, fator essencial para a sobrevivência e ótimo crescimento das larvas de peixes, crustáceos e moluscos (Lubzens, 1987; Szyper, 1989; Jeeja et al., 2011).
3
As microalgas desempenham um papel importante na aquacultura visto serem a base da cadeia alimentar, podendo fazer parte da dieta de moluscos e estágios iniciais larvares de crustáceos. São também essenciais para a produção de alimento vivo, como por exemplo os rotíferos, destinado a alimentar larvas de peixes e crustáceos (Ferreira et al., 2008). São várias as espécies de microalgas utilizadas na cultura de rotíferos, incluindo as Nannochloropsis,
Tetraselmis, Isochrysis e Pavlova (Lucas e Southgate, 2012). Estas têm também a função de
enriquecer os rotíferos por forma a melhorar o seu conteúdo nutricional antes de serem fornecidos às larvas de peixe (Ferreira et al., 2008).
O cultivo de rotíferos nas maternidades de peixes, moluscos e crustáceos continua a ser um processo dispendioso, em muitos casos ainda constituindo um dos fatores limitantes da industrialização do processo de larvicultura (Coutteau e Sorgeloos, 1997; Suantika et al., 2000). O fornecimento de rotíferos em quantidade adequada durante as épocas cruciais, aquelas em que existe uma grande quantidade de larvas, é um dos principais problemas em muitos tipos de produção em aquacultura (Lubzens, 1987), forçando as maternidades a manter várias culturas de rotíferos, para além de culturas de reserva (Candreva et al., 1996; Suantika
et al., 2000; Hagiwara et al., 2001).
Por tudo o que foi exposto, é de elevado interesse para a aquacultura a melhoria técnica e a eficiência da produção de alimento vivo (como por exemplo de rotíferos) pois tal terá um impacto positivo nos custos de produção das larvas de peixes e crustáceos.
Esta dissertação de mestrado teve dois objetivos: a exposição teórica da caracterização dos rotíferos como organismo biológico, os diversos métodos de cultivo e as recomendações nutricionais; e a elaboração de um trabalho prático levado a cabo pela autora bem como os resultados práticos obtidos. O trabalho prático teve como finalidade testar o efeito na densidade de cultivo de Brachionus plicatilis no tempo com a manipulação dos fatores: abióticos, temperatura (20ºC e 25ºC) e salinidade (16 ppm e 32 ppm); e bióticos, nomeadamente a fonte de nutrição, com microalgas (Nannochloropsis e Isochrysis) e a preparação comercial Easy DHA Selco®.
5
PARTE I–REVISÃO BIBLIOGRÁFICA
1. Caracterização da espécie Brachionus plicatilis 1.1.Morfologia
Rotifera, rotíferos – [do latim: rota, roda; fero, fera]. Seres pertencentes ao Reino Animalia e Filo Rotifera. São pseudocelomados aquáticos, muitos com uma corona anterior ciliada (Ann et al., 2005).
Posição sistemática segundo Barnes (1987) (citado por Ferreira, 2009): Filo – Rotifera
Classe – Monogononta Ordem – Ploima
Família – Brachionidae Género – Brachionus
Espécie – Brachionus plicatilis (O. F. Muller, 1786)
Do Filo Rotifera fazem parte alguns dos mais pequenos Metazoa, tendo sido descritas mais de 1.000 espécies, 90% das quais habitando a água doce. Os machos têm tamanhos corporais menores do que as fêmeas e são menos desenvolvidos do que estas (Lavens e Sorgeloos, 1996).O seu tamanho corporal varia entre 70 e 350 µm, dependendo da estirpe e da idade (Conceição et al., 2010).
O seu corpo é constituído por três partes distintas: a cabeça, o tronco e o pé. Encontra-se normalmente coberto por uma cutícula, camada densa de proteínas Encontra-semelhantes a queratina (Lavens e Sorgeloos, 1996; Moretti et al., 1999), denominada lórica (Moretti et al., 1999; Ferreira, 2009). Os rotíferos alimentam-se por filtração, filtrando pequenas partículas com o auxílio de um órgão anelar com cílios, a corona, localizada na parte anterior do seu corpo. A corona retráctil assegura também a locomoção, sendo que o movimento facilita a ingestão do alimento (detritos e microalgas). O tronco contém o sistema digestivo, que consiste no mastax, responsável pela moagem das partículas ingeridas, no esófago, no estômago, com glândulas gástricas, e no intestino. O sistema excretor consiste num par de protonefrídios com células terminais, o ducto e a bexiga. Os protonefrídios são responsáveis pela excreção de líquidos e pela regulação osmótica. O órgão genital não tem par (Monogononta) e a abertura externa conjunta da bexiga e do oviduto é denominada cloaca. O pé é uma estrutura retráctil
6
tipo anel, sem segmentação, terminando em um ou quatro dedos, com glândulas pedais (Lavens e Sorgeloos, 1996; Moretti et al., 1999). Na figura 1 é possível observar uma representação esquemática da organização interna e morfológica de Brachionus plicatilis.
Figura 1: Representação esquemática da organização interna e morfológica de Brachionus spp. fêmea (esquerda) e macho (direita). Modificado por Koste, 1980 (Lavens e Sorgeloos, 1996)
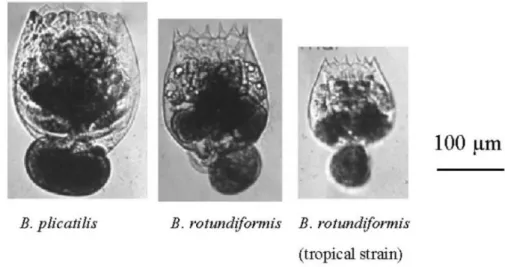
A dimensão da lórica, a sua forma e comprimento dos espinhos da sua parte final permitem a distinção entre as várias espécies (Yúfera, 2001). As estirpes de rotíferos foram inicialmente divididas em dois tipos, ‘S’ e ‘L’ (Fu et al., 1991), sendo esta divisão importante para a produção larvar, já que exibem características diferentes a nível morfológico (Ito et al., 1981, citado por Fu et al., 1991). Atualmente é possível observar uma classificação mais abrangente das estirpes de rotíferos, como é possível ver na tabela 1. Esta classificação é importante na medida em que facilita a escolha da estirpe a utilizar em função da espécie alvo do alimento. Na figura 2 podemos observar três das espécies de rotíferos mais utilizadas atualmente.
7
Tabela 1: Estirpes aceites (negrito) e outros biótipos pertencentes ao complexo de espécies Brachionus, agrupados de acordo com a sua classificação relativa ao tamanho corporal; (Gómez et al., 2002; Baer et al., 2008; Conceição et al. 2010).
L SM S e SS
220-340 µm 150-220 µm 100-150 µm
B. plicatilis B. ibericus B. rotundiformis B. manjavacas B. 'coyrecupiensis' B. 'lost'
B. 'nevada' B. 'almenara' B. 'austria' B. 'tiscar'
B. 'cayman'
B. 'towerinniensis'
L – grande; SM – médio; S e SS – pequeno e super pequeno. Os números indicam a variação aproximada do comprimento dos adultos de cada grupo
Figura 2: Espécies de Brachionus spp. (Hagiwara et al. 2001).
O crescimento do organismo é assegurado pelo aumento plasmático e não pela divisão celular (Lavens e Sorgeloos, 1996; Moretti et al., 1999). As taxas ótimas de reprodução são obtidas com salinidades abaixo de 36 partes por milhão (ppm) (Lubzens, 1987; Lowe et al., 2005).
Apesar de ser uma espécie que tolera grandes intervalos no que diz respeito a fatores abióticos, há intervalos mais curtos que possibilitam um melhor desenvolvimento das culturas, como se pode verificar na tabela 2.
8
Tabela 2: Parâmetros de cultura de Brachionus plicatilis e os intervalos toleráveis e preferenciais da espécie (Moretti et al., 1999).
Parâmetros Intervalo tolerável Intervalo preferível
Temperatura (ºC) 20-30 25-27 Salinidade (ppm) 01-60 18-25 Oxigénio dissolvido > 4 5-7 NH3/NH4+ (mg/l) 6-10 - NH3 (mg/l) - <1 pH 5-10 7,5-8,5 Luminosidade (lux) - 2000
1.2.Biologia e ciclo de vida
O ciclo de vida dos rotíferos está estimado entre 3,4 a 4,4 dias, a 25ºC (Lavens e Sorgeloos, 1996), mas há registos que indicam a duração até 10 dias, desde o ovo até adulto (Lucas e Southgate, 2012). Geralmente, as larvas passam à fase adulta após 0,5 a 1,5 dias e as fêmeas desovam aproximadamente a cada 4 horas (Lavens e Sorgeloos, 1996; Moretti et al., 1999). A atividade reprodutiva de Brachionus é condicionada pela temperatura de cultivo (tabela 3).
Tabela 3: Efeito da temperatura na atividade reprodutiva de Brachionus plicatilis, por Ruttner-Kolisko, 1972 (Lavens e Sorgeloos, 1996)
Temperatura °C 15 20 25
Tempo para o desenvolvimento embrionário (dias) 1,3 1 0,6 Tempo para as fêmeas novas desovarem pela 1ª
vez (dias) 3 1,9 1,3
Intervalo entre duas desovas (horas) 7 5,3 4
Duração da vida (dias) 15 10 7
Número de ovos desovados por fêmea durante a
vida 23 23 20
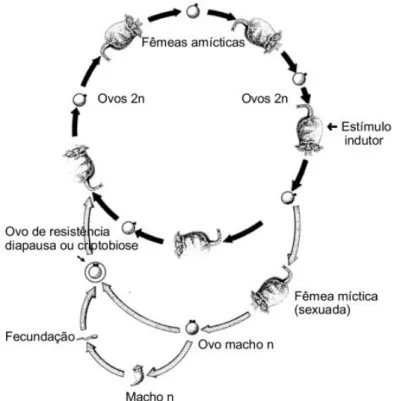
O ciclo de vida do B. plicatilis pode ser fechado de duas formas diferentes (figura 3), por via partenogénica/assexuada (amíctica) e sexuada (míctica) (Lavens e Sorgeloos, 1996; Moretti et al., 1999), sendo a primeira a mais frequente (Ferreira, 2009). As fêmeas partenogénicas (amícticas) produzem ovos diploídes (amícticos), não fecundados, que se
9
desenvolvem e dos quais eclodem fêmeas, também amícticas (Lavens e Sorgeloos, 1996; Lucas e Southgate, 2012).
Figura 3: Ciclo de vida partenogénico e sexual dos rotíferos; desenho de J. J. Sá e Silva (Ferreira, 2009).
Este ciclo ameiótico pode ser interrompido por fases de reprodução sexuada desencadeadas por fatores de origem exógena, tais como a temperatura, a alimentação e a densidade de população, ou endógena, como a idade (Støttrup e McEvoy, 2003; Ferreira, 2009). Em condições desfavoráveis, as fêmeas tornam-se mícticas, produzindo ovos mícticos que, na ausência de fecundação, dão origem a machos haplóides (Lavens e Sorgeloos, 1996; Ferreira, 2009; Lucas e Southgate, 2012). Assim, os machos só são produzidos na sequência de alterações importantes de parâmetros ambientais (Moretti et al., 1999). Estes não possuem trato digestivo nem bexiga, mas sim um testículo cheio de esperma (Lavens e Sorgeloos, 1996). Desta forma, os ovos mícticos que vão dar origem a um macho são mais raros e significativamente menores em tamanho (Lucas e Southgate, 2012).
Os ovos mícticos (de resistência), em diapausa, possuem um córion espesso, sendo semelhantes aos cistos de artémia (Moretti et al., 1999), e têm a possibilidade de permanecer dormentes durante vários anos, assegurando a sobrevivência da espécie em condições desfavoráveis, como por exemplo seca ou frio intenso (Ferreira, 2009; Lucas e Southgate, 2012). Assim sendo, é possível inferir que a presença de machos nas culturas de rotíferos é
10
um indicativo de alteração do meio de cultura por défice ou excesso, relativamente ao ideal para o crescimento da cultura (Lucas e Southgate, 2012), ou a mudança das dietas (Lavens e Sorgeloos, 1996). Quando um macho e fêmea acasalam produzem ovos mícticos fertilizados, de maior tamanho e com uma camada exterior grossa e ligeiramente granulosa (Lavens e Sorgeloos, 1996), de onde eclodem fêmeas amícticas (Moretti et al., 1999; Ferreira, 2009).
Na determinação do tipo de método reprodutivo (míctico ou amíctico), deve também ser enfatizada a densidade da população (Lavens e Sorgeloos, 1996). Apesar do mecanismo não ser completamente compreendido, é aceite que a produção de ovos em diapausa seja uma estratégia de sobrevivência da população em condições ambientais pouco favoráveis, como as secas ou temperaturas baixas (Lavens e Sorgeloos, 1996).
A dinâmica populacional em condições de produção em massa segue as seguintes fases:
Fase lag, quando, logo após o inóculo, os rotíferos iniciam o consumo de microalga do seu meio de cultura e os números de fêmeas com ovos e de ovos amícticos aumentam;
Fase log (exponencial), em que os rotíferos se reproduzem muito rapidamente e o crescimento populacional é exponencial;
Fase transitória (declínio de crescimento), na qual as taxas de crescimento abrandam e as fêmeas com ovos rareiam;
Fase de declínio, em que quase só se encontram rotíferos velhos sem ovos e o seu número diminui rapidamente, visto que a taxa de mortalidade excede a taxa de crescimento (Moretti et al., 1999; Conceição et al., 2010).
11
2. Recomendações nutricionais
Considerando-se as larvas de peixe como predadores visuais, é plausível que estas tenham preferência pela captura e ingestão de presas em movimento, ou que necessitem de um estímulo gustativo específico para ingerir as presas capturadas (Sargent et al., 2002; Conceição et al., 2010). Visto que a maior parte dos alimentos compostos comerciais tende a flutuar ou a afundar em pouco tempo, tornam-se menos disponíveis e apetecíveis para as larvas de peixe do que o alimento vivo (Conceição et al., 2010). Por outro lado, os rotíferos possuem um exosqueleto fino, teor de água elevado (> 80%), são provavelmente mais palatáveis do que os alimentos formulados, mais secos e duros, apesar de possuírem baixas concentrações de nutrientes (Conceição et al., 2010). Desta forma, o alimento vivo continua a ser a opção de eleição na maioria das situações, até as larvas serem grandes o suficiente para serem mantidas somente com alimentos compostos comerciais (Sargent et al., 2002).
O crescimento, a sobrevivência e o desenvolvimento normal das funções visuais das larvas requerem determinados ácidos gordos essenciais (essential fatty acids: EFA) na dieta, por forma a serem incorporados na membrana fosfolipídica (Seychelles et al., 2009). Vários estudos foram realizados por forma a determinar as necessidades em EFA das larvas e estágios juvenis de peixes marinhos. Atualmente, estas estimativas indicam que as necessidades em EFA n-3 só podem ser atingidas pela junção de ácido eicosapentanóico (EPA – 20:5n-3) com ácido docosaexanóico (DHA – 22:6n-3), muitas vezes denominados coletivamente por HUFA n-3 (highly unsaturated fatty acids n-3). A partir desses dados é ainda possível inferir que as necessidades em HUFA n-3 das larvas de peixes são geralmente maiores do que aquelas em peixes juvenis e pré-adultos (Sargent et al., 2002). Verifica-se ainda que as necessidades em DHA das larvas marinhas são normalmente mais elevadas do que em EPA, sendo as necessidades em EFA normalmente satisfeitas por níveis mais baixos de DHA, podendo ser atingidos somente com recurso a EPA (Watanabe, 1993, citado por Sargent et al., 2002).
As necessidades elevadas em DHA são explicadas pelo seu papel no desenvolvimento rápido dos tecidos neurais e visuais e manutenção da integridade funcional e estrutural das membranas biológicas, facilitando também rápidas mudanças configuracionais nas proteínas de membrana (particularmente importantes nos processos visuais e neuromusculares) (Sargent
et al., 2002; Seychelles et al., 2009). Nos estágios larvares, os tecidos visuais e neurais
12
deficiência de DHA na dieta resulta na debilitação da capacidade de captura de presas em intensidade de luz normal, presumidamente devido à enlanguescência dos fotorrecetores nos seus olhos (Bell et al., 1995; Halver e Hardy, 2002).
O crescimento larvar é caracterizado por uma rápida proliferação de membranas celulares, como foi referido anteriormente, sendo que os componentes estruturais primários são os ácidos gordos 16:0, 18:1n-9, EPA e DHA (Sargent et al., 2002). Nas larvas de peixes e em geral, o nível de DHA nos fosfolípidos é o dobro do nível de EPA (Seychelles et al., 2009). O ácido araquidónico (AA – 20:4n-6) e o EPA são, respetivamente, o precursor primário e competitivo da produção de eicosanóides (Seychelles et al., 2009).
As larvas possuem uma capacidade limitada de produzir fosfolípidos de novo (Sargent
et al., 2002; Seychelles et al., 2009). Esta limitação é o resultado de adaptações à
predominância de ácidos gordos polinsaturados (PUFA) na cadeia alimentar marinha e o tipo de dieta carnívora da maioria das espécies marinhas mais valorizadas em aquacultura e estudadas até ao momento. Desta forma, estes PUFA são dominados por HUFA n-3 originados a partir dos produtores primários, ou seja, microalgas marinhas que fazem parte do fitoplâncton e possuem EPA e DHA em abundância, com ácido alfalinolénico (ALA – 18:3n-3) e ácido linoleico (CLA – 18:2n-6) menos proeminentes (Sargent et al., 2002). Assim, como a maioria dos peixes marinhos, incluindo grande parte das espécies atualmente cultivadas e com perspetivas de cultivo, são carnívoros, consomem predominantemente uma dieta natural piscívora na maior parte do seu ciclo de vida. À partida, os peixes de que se alimentam ingerem, por sua vez, peixes mais pequenos que, a priori, são ricos em EPA e DHA derivados do fitoplâncton, via zooplâncton. Consequentemente, não têm de converter a ingestão limitada de ALA para EPA e DHA. Esta capacidade de conversão parece ter sido efetivamente perdida durante a evolução (Sargent et al., 2002). É possível que nenhuma espécie de peixe marinho tenha esta capacidade de conversão de quantidades significativas de ALA em EPA e DHA, tornando assim os EFA de espécies de peixes marinhos os HUFA: EPA, DHA e AA (Sargent
et al., 2002).
Nos primeiros estágios larvares dos peixes marinhos, são fornecidos rotíferos não enriquecidos com emulsões comerciais, cultivados com uma microalga de elevada qualidade, sendo o fornecimento de rotíferos enriquecidos adiado para quando as larvas conseguem tolerar o consequente decréscimo de qualidade da água em termos químicos (Lucas e Southgate, 2012).
13
A espécie Brachionus plicatilis alimenta-se por filtração, ingerindo células e partículas disponíveis na coluna de água (Lubzens, 1987; Conceição et al., 2010). A sua dieta compreende uma grande variedade de alimentos, incluindo microalgas, leveduras, bactérias e/ou alimento inerte/comercial (micropartículas) (Lubzens, 1987; Conceição et al., 2010) desde que o tamanho das partículas esteja entre 2 e 20 µm (Moretti et al., 1999). Visto que os rotíferos apresentam um comportamento pouco seletivo na sua alimentação, existe a possibilidade de incorporação de partículas destinadas às larvas de peixe nos seus tecidos e trato digestivo (Monroig et al., 2006; Giménez et al., 2007). O tamanho das partículas ingeridas está diretamente relacionado com o da abertura da boca, e existe uma correlação positiva entre o tamanho máximo das partículas ingeridas e o tamanho corporal (Hino e Hirano, 1980; Lubzens, 1987).
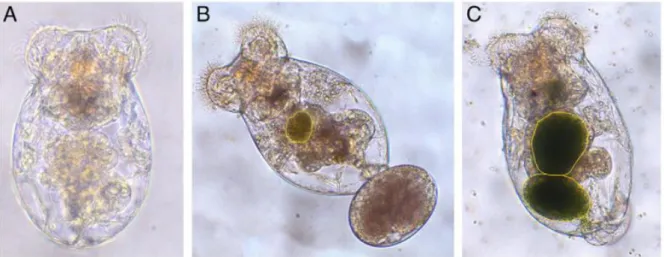
O processo de ingestão destes seres é relativamente rápido, como é possível verificar na figura 4. A 20ºC de temperatura, o estômago apresenta-se praticamente cheio ao fim de cerca de uma hora a partir do início do fornecimento de alimento (cerca de 80% do volume total do estômago). Após duas horas o estômago está completamente cheio (Romero-Romero e Yúfera, 2012).
Figura 4: Brachionus plicatilis após 24 horas de jejum (A), após 15 min de alimentação com microalga (B) e após 30 minutos de alimentação com microalga (C). Conteúdo do trato digestivo delineado a amarelo (Romero-Romero e Yúfera, 2012).
Isto pode levar a casos de exaustão do alimento, se este não for corretamente doseado. Quando não se encontra alimento quase nenhum na cultura os animais podem apresentar sinais de indícios de fome (pre-starvation), afetando o seu teor em matéria seca e a sua composição bioquímica e, consequentemente, originando uma colheita de baixa qualidade (Szyper, 1989; Makridis e Olsen, 1999; Kotani et al., 2009; Romero-Romero e Yúfera, 2012). Durante os primeiros dias sem alimento, observa-se a diminuição do peso seco do rotífero,
14
principalmente devido à perda de hidratos de carbono e proteína (tabela 4). Neste intervalo de tempo (primeiros 4 dias), os rotíferos utilizam 80% das suas reservas de hidratos de carbono, e até 50% das suas reservas de proteína e lípidos (Ortega et al., 1995).
Tabela 4: Peso seco e composição corporal centesimal de rotíferos mantidos em jejum por vários dias, a 22ºC, em µg por rotífero e em percentagem de matéria seca (entre parêntesis) (adaptado de Ortega et al., 1995). Dias Matéria seca Proteína Hidratos de Carbono Lípidos
0 371,5 152,43 (41,03) 96,11 (25,87) 44,51 (11,98)
4 154 75,46 (49,00) 16,73 (10,86) 19,93 (12,94)
7 n.d. n.d. (47,12) n.d. (19,48) n.d. (10,88)
n.d. – não determinado
Do dia 4 ao dia 7 observa-se um aumento na percentagem de hidratos de carbono, o que sugere um maior consumo de proteínas e lípidos, em detrimento dos hidratos de carbono (Ortega et al., 1995).
Relativamente à digestão, o trânsito digestivo nos rotíferos é relativamente rápido. Isto vai afetar o tempo que as presas vão ficar no tanque de maternidade até serem ingeridas pelas larvas de peixe, o que por sua vez afeta a qualidade final dos rotíferos como presa (Olsen et
al., 1989; Yamamoto et al., 2009; Romero-Romero e Yúfera, 2012). O fornecimento diário de
microalgas ao tanque de maternidade contribui para manter a qualidade nutricional dos rotíferos até estes serem ingeridos pelas larvas (Conceição et al., 2010). Este procedimento denomina-se de “água verde” e, como seria de esperar, tem uma correlação positiva com o crescimento e sobrevivência das larvas (Reitan et al., 1993; Romero-Romero e Yúfera, 2012). Contudo, é difícil e por vezes indesejável, manter estas suspensões de fitoplâncton densas, daí ser importante determinar estimativas quantitativas dos efeitos do jejum na qualidade dos rotíferos (Szyper, 1989).
A colheita dos rotíferos para fornecimento às larvas também é um fator a ter em atenção. A aglomeração e colheita deve ser realizada debaixo de água, para evitar lesões nos rotíferos (Lavens e Sorgeloos, 1996; Romero-Romero e Yúfera, 2012). A utilização de outros filtros, que não submergidos, provoca uma diminuição repentina de 60% do volume do estômago nos primeiros cinco minutos; já com a utilização de filtros submersos a diminuição do volume estomacal ocorre progressivamente, necessitando de cerca de uma hora para perder 60% do seu conteúdo (Romero-Romero e Yúfera, 2012).
Os ácidos gordos devem ser fornecidos aos rotíferos através do seu alimento, na maior parte dos casos baseado em microalgas unicelulares (Ben-Amotz et al., 1987). Em particular
15
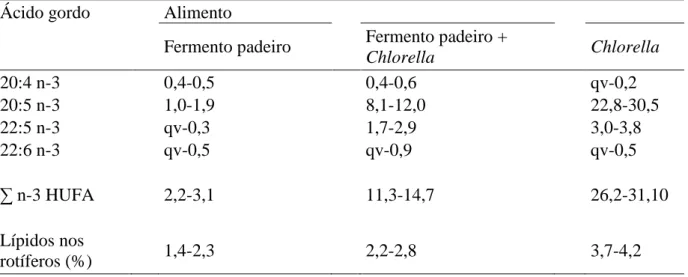
os HUFA devem estar presentes na dieta larvar (Watanabe et al., 1983). Apesar dos rotíferos serem capazes de sintetizar alguns HUFA n-3 (Lubzens et al., 1985), a quantidade acumulada no seu organismo é baixa e insuficiente para satisfazer as necessidades das larvas de peixe (Ben-Amotz et al., 1987). Também o nível de EFA é muito baixo nos rotíferos, sendo contudo essencial para o crescimento e desenvolvimento normal das larvas de animais marinhos (Lucas e Southgate, 2012). Os rotíferos alimentados com Saccharomyces cerevisiae (fermento de padeiro) têm níveis baixos de EFA (Lucas e Southgate, 2012) e de HUFA n-3, tais como EPA (20:5n-3), mas possuem níveis elevados de ácidos gordos monoinsaturados, tais como 16:1 e 18:1 (Watanabe, 1985). De acordo com Watanabe (1985), rotíferos alimentados com a microalga marinha Chlorella possuem níveis mais elevados de EPA, enquanto aqueles alimentados com microalga e fermento apresentam valores intermédios, como é possível verificar na tabela 5.
Tabela 5: Alguns ácidos gordos ômega 3 no total de lípidos de Brachionus plicatilis cultivados com fermento de padeiro (Saccharomyces cereviciae) e microalga marinha Chlorella (adaptado de Watanabe, 1985).
Ácido gordo Alimento
Fermento padeiro Fermento padeiro +
Chlorella Chlorella 20:4 n-3 0,4-0,5 0,4-0,6 qv-0,2 20:5 n-3 1,0-1,9 8,1-12,0 22,8-30,5 22:5 n-3 qv-0,3 1,7-2,9 3,0-3,8 22:6 n-3 qv-0,5 qv-0,9 qv-0,5 ∑ n-3 HUFA 2,2-3,1 11,3-14,7 26,2-31,10 Lípidos nos rotíferos (%) 1,4-2,3 2,2-2,8 3,7-4,2 qv – quantidades vestigiais
O fermento de padeiro utilizado em culturas em massa de rotíferos possui, geralmente, uma boa quantidade (52-82%) de ácidos gordos insaturados 16:1 e 18:1, e essencialmente nenhum HUFA n-3 (Watanabe, 1985), o que tem sérias implicações na qualidade nutricional dos rotíferos enquanto alimento vivo para larvas de peixe, baixando-a.
16
2.1.Valor nutricional
Nas maternidades de pisciculturas, os rotíferos são inicialmente cultivados com microalgas como alimento e, aquando do final de produção em massa, passam a ser alimentados com alimentos compostos comerciais que promovem o crescimento rápido da sua população e a melhoria do seu valor nutritivo (Moretti et al., 1999).
O valor nutricional dos rotíferos pode ser manipulado por alterações da dieta (Moretti
et al., 1999; Giménez et al., 2007; Jeeja et al., 2011) e depende de vários fatores,
principalmente da sua composição bioquímica, conteúdo em massa seca e valor calórico (Lubzens et al., 1989; Gómez et al., 2002; Støttrup e McEvoy, 2003; Baer et al., 2008; Conceição et al., 2010; Romero-Romero e Yúfera, 2012).
De acordo com alguns autores (Lubzens et al., 1989; Rainuzzo et al., 1994; Işik et al., 1999), a dieta determina maioritariamente o perfil em aminoácidos dos rotíferos, existindo muitos estudos que mostram que a qualidade nutricional de B. plicatilis depende da transferência de componentes nutritivos da sua dieta (Gatesoupe e Luquet, 1981; Ben-Amotz
et al., 1987; Frolov et al., 1991; Lubzens et al., 1995; Lie et al., 1997; Jeeja et al., 2011). Já
outros autores (Szyper, 1989; Yúfera e Pascual, 1989; Yúfera et al., 1997; Makridis e Olsen, 1999) afirmam que o perfil em aminoácidos, tal como o conteúdo proteico, só podem ser manipulados ligeiramente, dependendo das condições nutricionais e estado reprodutivo dos organismos (Conceição et al., 2010).
O perfil em lípidos e ácidos gordos tem uma elevada importância na nutrição larvar, como já foi referido (Conceição et al., 2010) visto serem os principais determinantes da qualidade nutricional dos rotíferos (Watanabe, 1985), e estarem fortemente dependentes da composição da dieta (Watanabe, 1985; Ben-Amotz et al., 1987; Lubzens et al., 1989; Rainuzzo et al., 1997; Conceição et al., 2010). O conteúdo em DHA, EPA e ARA, tal como os outros componentes nutritivos, pode ser manipulado pela alimentação, seja de curta ou longa duração, com espécies de microalgas selecionadas, emulsões de lípidos, microcápsulas ricas em lípidos, e outros tipos de alimentos (Lubzens et al., 1989; Rainuzzo et al., 1997; Støttrup e McEvoy, 2003; Conceição et al., 2010). Isto é possível porque a composição em ácidos gordos dos rotíferos depende dos lípidos disponíveis no cultivo ou no processo de enriquecimento (Watanabe et al., 1983; Lubzens et al., 1985; Ben-Amotz et al., 1987; Rainuzzo et al., 1989; Olsen et al., 1993; Rainuzzo et al., 1994).
17
Apesar dos rotíferos terem alguma capacidade para sintetizar de novo alguns PUFA n-3, tal como o DHA, a sua taxa de síntese não é suficientemente elevada para garantir o fornecimento de quantidades adequadas para as larvas de peixes marinhos, decorrendo daqui a necessidade do enriquecimento por fonte alimentar (Seychelles et al., 2009).
A composição bioquímica dos rotíferos pode ser afetada pelo sistema de cultura (Watanabe et al., 1983; Romero-Romero e Yúfera, 2012) e foi encontrada uma correlação positiva entre o conteúdo proteico do alimento e dos rotíferos (Millamena et al., 1990; Frolov
et al., 1991; Lie et al., 1997; Srivastava et al., 2006; Jeeja et al., 2011). Vários estudos
mostram também que os rotíferos apresentam um teor em proteína na sua composição bastante variável. Segundo Jeeja et al. (2011), estas variações podem estar relacionadas com a composição do alimento, com a fase de crescimento dos rotíferos ou com diferentes taxas de alimentação.
No que diz respeito ao teor de gordura dos rotíferos, este parece ser influenciado pela idade, verificando-se uma tendência decrescente dos níveis de gordura com o aumento da idade (Jeeja et al., 2011).
Quanto às vitaminas, a vitamina B12 é essencial para os rotíferos (Lucas e Southgate, 2012), sendo os rotíferos ricos nas vitaminas C, E, B1 e B2 (van der Meeren et al., 2008; Conceição et al., 2010).
Aparentemente, os rotíferos são deficientes em vários minerais, incluindo cobre, iodo, zinco e, em particular, manganês e selénio (Hamre et al., 2008; Conceição et al., 2010), não tendo sido possível encontrar idêntica correlação entre a sua composição mineral e o alimento ingerido (Watanabe et al., 1983).
Também o uso de fontes alimentares mais baratas, como fermento de padeiro, algumas espécies de microalgas ou alguns produtos comerciais, não permitem corrigir, em geral, as deficiências em ácidos gordos essenciais (Watanabe et al., 1983; Ben-Amotz et al., 1987; Rainuzzo et al., 1989; Rainuzzo et al., 1994), vitaminas e minerais (Giménez et al., 2007; Hamre et al., 2008; Romero-Romero e Yúfera, 2012).
Em relação à temperatura, esta aparenta ter pequeno efeito na determinação das características nutricionais de Brachionus (Yúfera et al., 1997). Estes possuem uma grande estabilidade na composição corporal quando sujeitos a diferentes temperaturas, apesar de apresentarem alguma variação no conteúdo de cinzas, e consequentemente, na matéria seca, em percentagem, de carbono, azoto e hidrogénio (Yúfera et al., 1997).
18
2.2.Processos de enriquecimento
Os rotíferos, por si só, não possuem os nutrientes necessários para suprir as necessidades de larvas de peixe em crescimento, uma vez que estas no seu habitat natural têm uma maior variedade de alimentos pelos quais optar e, consequentemente, têm uma dieta mais completa. Este problema foi resolvido com o enriquecimento, ou seja, com a distribuição de alimento extra, como algumas espécies de microalgas, emulsões de óleos, produtos comerciais com micropartículas ou boosters, antes de serem fornecidos às larvas (Olsen et al., 1989; Fernández-Reiriz et al., 1993; Rodríguez et al., 1996; Palmtag et al., 2006; Demir e Diken, 2011; Romero-Romero e Yúfera, 2012).
O enriquecimento é uma prática importante no cultivo de rotíferos. Este é efetuado antes destes serem fornecidos às larvas e o tipo de protocolo utilizado para tal, influencia em muito a sua qualidade como alimento vivo (Romero-Romero e Yúfera, 2012). Existem vários fatores que influenciam a eficácia do enriquecimento, tais como a qualidade e propriedades da emulsão e as condições de enriquecimento, que englobam a densidade de alimento vivo, oxigénio dissolvido e turbulência (Giménez et al., 2007).
A melhoria do perfil em ácidos gordos do rotífero B. plicatilis foi atingida por técnicas de enriquecimento de longa duração ou de curta duração, dependendo da exposição dos rotíferos às dietas de enriquecimento durante ou após o seu cultivo (Olsen et al., 1993). Para o enriquecimento a curto prazo, o tempo ideal varia entre duas e três horas (Romero-Romero e Yúfera, 2012).
A prática de enriquecimento da colheita tem dois objetivos:
Incorporação de nutrientes específicos e desejados nos tecidos corporais dos rotíferos, ou seja, pretende-se que os rotíferos processam o alimento ingerido e incorporem os seus produtos nos seus tecidos; e que tem a duração de 12 a 14 horas (Rainuzzo et al., 1994; Kotani et al., 2010);
Bioencapsulação, ou seja, o uso do corpo do rotífero, mais especificamente, as vísceras, como cápsula viva para a transferência de um dado componente para a larva de peixe (Romero-Romero e Yúfera, 2012).
19
2.3. Alimentos fornecidos aos rotíferos
As microalgas constituem o primeiro elo na cadeia alimentar do oceano, ou seja, são produtores primários, devido à sua capacidade de sintetizar moléculas orgânicas usando a energia solar (Conceição et al., 2010). Em aquacultura, estes organismos são produzidos como fonte de alimento direto para larvas que se alimentam por filtração, tais como moluscos bivalves, gastrópodes marinhos e crustáceos. Para além disso também são produzidos como fonte de alimento indireto, para o cultivo de zooplâncton, utilizado na alimentação de larvas marinhas carnívoras (Seychelles et al., 2009; Conceição et al., 2010).
Muitos centros de aquacultura possuem as suas próprias instalações de produção de microalgas para alimento direto ou indireto das larvas de organismos marinhos (Conceição et
al., 2010).
À semelhança do que ocorre com o cultivo de rotíferos, também existem vários sistemas de cultura de microalgas. As culturas contínuas e semi-contínuas são propostas como métodos alternativos para as culturas batch (unidose) (Borowitzka, 1997; Ferreira et al., 2008). Este tipo de culturas não só garante um maior abastecimento de biomassa de microalgas, como também assegura que seja mais constante, sendo as suas condições controladas uma mais-valia para a manipulação da composição bioquímica das células de microalga (Sukenik e Wahnon, 1991; Otero e Fábregas, 1997; Ferreira et al., 2008). Assim, apesar de microalgas de alta qualidade terem a possibilidade de fornecer EFA aos rotíferos (Dhert et al., 2001; Lucas e Southgate, 2012), é possível melhorar o valor nutritivo das microalgas através da seleção das condições de cultura corretas (Ferreira et al., 2008).
Esta seleção centra-se em vários critérios:
Tamanho da célula apropriado para as exigências do organismo consumidor;
Valor nutricional adequado;
Elevada digestibilidade;
Facilidade de cultura com elevadas densidades;
Ciclo de vida curto, com reprodução fácil em cativeiro;
Tolerância a variações ambientais (Conceição et al., 2010).
Em relação ao valor nutricional, as microalgas devem ser ricas em ácidos gordos (Lucas e Southgate, 2012) devido à importância destes componentes na dieta das larvas. Na
20
tabela 6 podemos observar a composição em ácidos gordos de diferentes alimentos fornecidos aos rotíferos. Também nas tabelas 15 e 16, em anexo, podem ser comparados os teores em ácidos gordos das microalgas Nannochloropsis sp. e Isochrysis sp.
Tabela 6: Teor em ácidos gordos (em percentagem de lípidos total) de microalgas utilizadas para a cultura de rotíferos (adaptado de Watanabe, 1985; Ben-Amotz et al., 1987).
Ácido gordo Isochrysis
galbana Nannochloropsis salina Saccharomices cereviciae Chlorella minutissima 14:0 22 4,3 3,1 4,3 16:0 9,4 25,2 20 22,5 16:1 n-7 4,9 32,8 27,2 22,3 16:2 + 3 - 0,3 - - 17:0 - - - - 18:0 10,7 13,5 4,7 1 18:1 n-9 20,2 4,8 26,1 3,1 18:2 n-6 19,8 - 10,9 3,4 18:3 n-3 4,6 1,2 3,2 0,1 18:4 3,1 0,5 - - 20:1 - - 0,8 0,1 20:2 n-6 - - - - 20:4 n-3 - 0,8 - 0,1 20:5 n-3 - 14,8 - 31,8 22:6 n-3 3,4 - - - Saturados 42,1 43 27,8 27,8 Monoinsaturados 25,1 37,6 54,1 25,5 Polinsaturados 30,9 17,6 14,1 6,6 Não identificados 1,9 1,8 4 40,1 Poli/(Sat + Mono) 0,46 0,21 0,41 0,12 Sat/Mono + Poli 0,75 0,77 0,06 1,25 ∑ω3 HUFA 3,4 15,6 0 31,9
Fonte: Ben-Amotz 1987 Ben-Amotz 1987 Watanabe 1985 Watanabe 1985 As microalgas mais utilizadas na atualidade são Nannochloris spp., Nannochloropsis spp., Tetraselmis spp., Pavlova lutheri e Isochrysis galbana (Conceição et al., 2010). Estas espécies foram investigadas com base nas suas caraterísticas biológicas e de performance em condições de laboratório, bem como as suas necessidades energéticas e nutricionais (Conceição et al., 2010).
Os elevados custos de produção, em junção com o valor nutricional do alimento vivo e variações temporais na sua disponibilidade, colocam problemas em qualquer empreendimento
21
de aquacultura que dependa da cultura em massa de microalgas e alimento vivo (Coutteau e Sorgeloos, 1997). Tendo isto em conta foram desenvolvidos novos produtos e tecnologias de forma a melhorar o custo-eficiência, quer seja para tentar substituir o alimento vivo por alimento inerte completo, quer seja para utilizar como suplemento/fonte de alimento para os organismos constituintes do alimento vivo. Isto inclui microcápsulas, microalgas secas e pastas de microalgas (Coutteau e Sorgeloos, 1997; Heasman et al., 2000; Conceição et al., 2010). Também existem produtos comerciais, tais como concentrados vivos de microalga e de microalga congelada e liofilizada, com bons resultados no geral para a produção de rotíferos (Conceição et al., 2010).
Estas dietas têm de cumprir determinados critérios, tais como uma disponibilidade máxima na coluna de água, uma lixiviação de nutrientes mínima, serem palatáveis, com digestibilidade aceitável e composição nutricional equilibrada (Coutteau e Sorgeloos, 1997).
23
3. Cultivo de Rotíferos
O alimento vivo é essencial na alimentação de larvas de peixes marinhos, especialmente nas do tipo altricial, que mantêm um estado relativamente menos desenvolvido até o saco vitelino ter sido esgotado (Conceição et al., 2010). Tal como referido anteriormente, as larvas de peixes são consideradas predadores visuais, ou seja, reagem ao estímulo do movimento das presas. Tendo estas últimas, capacidade para deslocar na coluna de água, estão constantemente disponíveis para as larvas (Conceição et al., 2010), daí a sua importância nas maternidades de peixes marinhos.
Como já foi mencionado, são as características próprias do rotífero, como a sua pequena dimensão corporal adequada às larvas, facilidade de cultivo a grande escala, com taxas reprodutivas elevadas, que o tornam um alimento vivo ideal (Lopes, 2010).
O cultivo de rotíferos pode ser realizado em vários tipos de recipientes, tanto no interior de edifícios como no exterior (Lucas e Southgate, 2012). Para se retirar o maior proveito nesta cultura é necessário ter em conta a qualidades sanitária e nutricional da mesma, as quais dependem de vários fatores. Os mais relevantes são o tipo de cultura, idade da mesma, a qualidade da água, temperatura, alimento e densidade de rotíferos (Lucas e Southgate, 2012). Bons resultados no cultivo de rotíferos são obtidos com níveis elevados de oxigénio dissolvido, temperatura a 25ºC, pH entre 7,5 e 8,5, salinidade no intervalo de 20-30 ppm, menos de 1 mg/l de amónia livre (NH3) e turbulência moderada; a luminosidade só é necessária quando os rotíferos são alimentados com microalgas (Moretti et al., 1999).
Existem alguns problemas associados ao cultivo de rotíferos, sendo os mais comuns a imprevisibilidade da produção em massa, a dificuldade em gerir e colher as produções de rotíferos, e a dificuldade em produzir rotíferos limpos, livres de flóculos e seguros do ponto de vista sanitário (Dhert et al., 2001).
Para ultrapassar estes problemas foram desenvolvidas várias técnicas de cultivo que permitem manter o crescimento exponencial dos rotíferos através do fornecimento de elevadas quantidades de alimento e a prevenção da acumulação de excessivas quantidades de excreção azotada (Conceição et al., 2010).
O sistema básico de cultura é determinado pelo padrão de renovação do meio de cultura (sendo o meio considerado a água juntamente com os inóculos de microalgas em suspensão). Os sistemas de cultura são divididos em culturas batch, sem renovações de água,
24
culturas semi-contínuas, com renovações parciais de água, e as culturas contínuas, com renovação de água constante (Conceição et al., 2010).
Para além disto, e independentemente do sistema de cultura, são utilizadas três escalas básicas de cultura com o intuito de estabelecer uma cadeia de produção completa. A primeira é a cultura stock, ou inóculo (50-500 ml), cujo objetivo é manter a pureza genética da estirpe; a segunda é a cultura starter (5-50 litros), com origem na cultura anterior, e objetivo de inocular culturas de maior volume; e por último, a cultura em massa − de 50 litros até vários metros cúbicos (Conceição et al., 2010).
A produção de rotíferos em culturas com densidades elevadas revela-se vantajosa na medida em que o espaço do recipiente e o custo de operação diminui mas, em contrapartida, é necessário adquirir equipamentos específicos e ter cuidados redobrados para prevenir declínios populacionais (Lucas e Southgate, 2012). Nestes sistemas superintensivos é possível atingir concentrações até 10.000 rotíferos/ml, enquanto nos sistemas batch este parâmetro varia entre 50 a 100 indivíduos por ml (Conceição et al., 2010).
Os métodos e cadeia de cultivo são muito flexíveis e podem variar de acordo com as condições de operação de cada maternidade (Conceição et al., 2010).
3.1. Sistemas de Produção
A cultura de rotíferos é iniciada a partir de um inóculo de uma estirpe purificada, ou
stock, geralmente mantida em condições específicas e axénicas em laboratório por forma a
manter a sua pureza genética (Ferreira, 2009; Lopes, 2010). Estas culturas são mantidas em tubos de ensaio de 40 ml, numa micromicroalga no estado de crescimento exponencial e sem arejamento. São mantidos em condições subótimas, a 15-18ºC de temperatura e aproximadamente 20 ppm de salinidade, por forma a garantir o mínimo de atividade reprodutiva (Ferreira, 2009). No espaço de uma semana, a densidade pode aumentar de 2 para 200 rotíferos por ml de solução (Lavens e Sorgeloos, 1996). Quando o tubo se encontra sem alimento é realizada uma repicagem parcial, na qual se retira uma parte dos rotíferos, para criar uma nova cultura stock (Ferreira, 2009), sendo o restante transferido para outro recipiente, de onde é iniciada uma nova cultura de rotíferos (Lavens e Sorgeloos, 1996; Ferreira, 2009).
25
3.1.1. Sistema batch
O sistema batch, ou descontínuo (Ferreira, 2009), é o mais utilizado nas maternidades de peixes marinhos visto ser o mais simples (Dhert et al., 2001). Utilizando um inóculo, com uma densidade relativamente baixa de rotíferos, é iniciada a cultura num meio denso com microalga. Esta cultura é levada a cabo até à exaustão do alimento (Conceição et al., 2010), durando na prática de 2 a 4 dias (Dhont et al., 2013). Este período de cultura é limitado devido à acumulação de amoníaco no meio (De Araújo et al., 2000; De Araújo et al., 2001). O tamanho dos tanques de cultura é muito variável, podendo ir desde tanques de plástico com 500 litros até tanques de cimento com 10 m3 (Dhert et al., 2001). Na figura 5 pode observar-se um deobservar-senho esquemático de um exemplo de cultura batch.
Figura 5: Representação esquemática de um sistema de cultura batch (Suantika et al. 2000).
No final da fase de crescimento exponencial da cultura toda a produção é colhida e, normalmente, uma parte é utilizada para a realização de um starter para iniciar as próximas duas ou três culturas e outra é utilizada para alimentar as larvas de peixe (Lubzens, 1987; Dhert et al., 2001; Conceição et al., 2010; Dhont et al., 2013). A qualidade deste inóculo, se realizado periodicamente, é decisiva para o sucesso da cultura na maternidade, garantindo a saúde e estabilidade da produção (Conceição et al., 2010).
26
Assim sendo, a estratégia desta cultura consiste numa de duas opções:
Manutenção de um volume de cultura constante, com um aumento na densidade populacional de rotíferos, até atingir a densidade de rotíferos desejada ou até ao esgotamento do alimento (Dhont et al., 2013);
Manutenção de uma densidade de rotíferos constante através do aumento de volume da cultura, ou seja, é iniciada uma cultura com pequeno volume, ao qual é acrescentada uma solução de microalgas, de 2 em 2 dias ou diariamente, até se atingir o volume final (Dhert et al., 2001; Ferreira, 2009; Dhont et al., 2013). Esta adição de volume promove uma qualidade de água mais constante, visto que os metabolitos, nitritos e amónia são diluídos diariamente (Dhont et al., 2013).
Neste sistema, os rotíferos estão sujeitos a várias diluições do meio, de forma a manter a qualidade da mesma aceitável, visto que à medida que o período de cultura decorre, a qualidade diminui (Suantika et al., 2000; Dhont et al., 2013). Assim, não é surpreendente que, sujeitos a estas condições, a densidade de rotíferos não seja muito elevada (Suantika et al., 2000).
A esta cultura também estão associadas desvantagens, tais como as condições altamente variáveis tanto na performance de crescimento como em termos de composição bioquímica dos rotíferos, a instabilidade dos parâmetros da água, baixa eficiência em termos laborais e de utilização de infraestruturas (Dhert et al., 2001). Estes fatores contribuem para condições de cultura instáveis/imprevisíveis e um rendimento de produção relativamente baixo (Walz et al., 1997) mas com elevado custo (Dhert et al., 2001).
3.1.2. Sistema semi-contínuo
O sistema semi-contínuo é similar ao sistema anterior batch, diferindo na colheita e renovação do meio (Conceição et al., 2010), ou seja, quando é atingida a concentração de rotíferos desejada, ou quando o alimento destes se esgota, é retirado parte do volume. Após retirar esse volume, a mesma quantidade é acrescentada à cultura em alimento (Ferreira, 2009). Deste modo, a densidade de rotíferos é mantida constante, graças a colheitas periódicas (Devauchelle e Girin, 1972; Dhert et al., 2001). Este sistema prova-se eficiente para a produção diária em quantidade de organismos visto que, apesar de colheitas sucessivas de rotíferos, a população consegue recuperar e manter níveis constantes e razoáveis de indivíduos por longos períodos de tempo, até mais de 50 dias (Protella et al., 1997).