UNIYERSIDADE
*
.i
EVÜRÀ
Contribuição
para
o
estudo da
Caracterização
Molecular
de
isolados
de
Erysiphe necator
nas
Vinhas
do
Alenteio
VERA
MARIA
GARCEZ
MOREIRA
Dissertação apresentada à Universidade de Évora para obtenção do Grau de Mestre em
Viticultura
e Enologia-!x6
Orientadora:
Professora Doutora Maria do Rosário Fernandes'FélixCo-orientadores:
Professor Doutor Yvon Bugaret e Engenheiro JorgeSilva
n
t
3g
UNHET§IüADE
ffi;,j
ffiH#ffi_e
Contribuição para
o estudo
da
Caracterização
Molecular
de
isolados
de
Erysiphe necator
nas
Vinhas
do
Alenteio
VERA
MARIA
GARCEZ
MOREIRA
Dissertação apresentada à Universidade de Évora para obtenção do Grau de Mestre em
Viticultura
e EnologiaOrientadora:
Professora Doutora Maria do Rosiário FernandesFélix
Co-orientadores:
Professor DoutorYvon
Bugaret e Engenheiro Jorge SilvaÍndice Geral
ÍNnrcn
GERAL
ÍN»rcB
DE
FrcuRAs
..._Íxorcr
DE
euADRos...
ABREVIATURAS
GERAIS
UTILIZADAS
AGRADECIMENTOS
RESUMO
vlll
lx
xlu
ABSTRACT
xlv
r.
rNrRoDUçÃO
rr. RnvrsÃo
grnr,tocnÁrrcn
1.
Oídio
..__...32.
O Organismo
Causal_-__-3.
Ciclo Biológico.
4.
Sintomas e Desenvolvimento dooídio
naVideira
115.
Factores Ambientais
queafectam o
desenvolvimento ea
Propagaçãodo fungo
E. necator.
5.1
Temperatura
5.2 18
5.3
Vento
195.4Lttz
t9
6.
Estratégias deControlo
e meios de protecçãocontra
ooídio
da Videira...-..---..---20 6.1 Técnicas deCultivo.
6.2Plantacão de Novas de
Vitis
6.3 Meios deBiolósica
6.4 Meios de
Luta
Ouímica
-
Funeicidas
6.4.1 Fenómenos de a Funeicidas
6.4.2 Mecanismos Moleculares de Resistência a Fungicidas
ARçsiçtê"nçia"aCI"8""ç"n"zim"id"azp.I ....28
B
Res"isÍên.çia..as*D*M-Is,=lnih.ido,rçgde"Dçm.çÍilagão-
...29B.1) Mutacões no eene
co
---..---29 6.5 Métodos Previsionais deAparecimento
doOídio..
.314 9 ..23 .26 27
lv
6.6 Tomadas de Decisão na Gestão dos
Tratamentos Fitossanitários Anti-Oídio
...33Y1
1
3
Índice Geral
7.
Influência
doOídio
naQualidade
Final
dos Vinhos...---. 7.1Vinhos
Brancos e Rosés7.2
Vinhos
8.
Métodos de DetecçãoMolecular
emE
necator---8.1 PCR-
Reaceão de Polimerase em Cadeia8.2
Deteccão
por
CAPS
-
'Cleaved
Amplified
Polvmorphic
Sequence'
dediferentes
grupos
genéticos de isolados deE
necaÍor8.3 Deteccão
por NAS-PCR
-'Nested
Allele-Specific
PCR'de
mutacões noseneCYPSI de necator
8.4
Deteccãopor
RAPD ('Random Amplification Polvmorphic' de
DNA)
degruDos de
E.
necatorIII. MATERIAIS
E
I\,M,TODOS.39 .4r
4l
42 43 45 47 1.Material
Vegetal1.1 Preparação do
Material
Vegetal-.... 2.Extracção
doDNA..._..-....-3.
Identificação
de isolados doGrupo
A
e doGrupo
B.-...3.1
Amplificação
por
Reacção de Polimerase em Cadeia(PCR)
deum fragmento
..._.__.._47
...___...49
..._.._..____49
do gene
da
p-tubulina..-.-3.2
Polimorfismo
da
sequência
amplificada
e
coúada
('Cleaved Amplified
Polymorphism
Sequence'-
CAPS)4.
IdentiÍicação
de isolados resistentes aosDMIs.
4.1
Amplificação por
Reacção de Polimeraseem
Cadeia(PCR) do
geneda
144-demetilase (CYP51) de E. necator4.
2'Nested Allele-Specific PCR'
-
NAS-PCR.---....IV. RESULTADOS
EDISCUSÃO
1.
Observaçõesrealizadas
à lupa
binocular durante
a
preparação
do
Material
50 ...-...._-.50 _..___.._.52 ...53 __..._...54 55
Vegetal-2.
Quantificação
doDNA
Total.
3.
Identificação
de isolados doGrupo
A
e doGrupo
8..-..-.--.-...--3.1 Amplificação
de um
fragmento
do
gene
da
p-tubulina
por
Reacção
de57
..----...--..-.-...57
ll
Índice Ceral
3.2 Análise
do
Polimorfismo
da
sequência
ampliÍicada
e
cortada
('Cleaved
Amplified
Polymorphism
Sequence'-
CAPS)....--
...-..--..--..14.
Identificação
de isolados resistentes aosDMIs-4.1
Amplificação por
Reacção de Polimeraseem
Cadeia(PCR) do
geneda
14u'
demetilase (CYPS1) de
E.
necator ...-.--4.2 'NestedAllele-Specific
PCR'-
NAS'PCR
65 68
_...68
7t
V.
CONCLUSÕES
VI.
REFERÊNCIAS BIBLIOGRAFICAS
__._.76
78
Índice de Figuras
ÍNnrcp
DE
FIGURAS
Figura
II.1:
-
Fotos de cleistotecas de E. necator - observação ao microscópio óptico (Foros:a partir do site:
http://www.muller-koeberle.frlodium-2.htm,2010)...---.-Figura
ll.2:
-
Fotos de cleistotecas deE.
necaror-
observação ao microscópio electrónico(Foros: a partir do site:
http://www.muller-koeberle.frlodium-2.htm,2010)..--...
-..---...---5Figura
II.3:
-
Ciclo Biológico do Oídio (adaptado de AGRIos, 2005; GormEN etal.,200l;
5
SILVA, 2008 e s.e., 1998);. 10
Figura
ll,4:
-Foto de um 'drapeau' com sintomatologia de Oídio (FoTo: YvoN BUGARET)...----.-..----11Figura
II.5:
-Foto de uma inflorescência com sintomatologia de Oídio(Foro:
a partir do sitehttp://www.muller-koeberle.frlodium-2.htm, 20 I 0)..
t2
Figura
II.6:
-
Foto de página superior de folha de videira deformada pelo ataque de Oídio(Foro: YvoN BUGARET).. .----13
Figura
ll.7:
-
Foto de página superior de folha de videira com formação de cleistotecas nofinal do Verão
(Foro:
YvoN BUGARET) 13Figura
II.8:
-
Foto de bagos de uvas com sintomatologia de Oídio ao estado fenológico debago de ervilha;
(Foro:
YvoN BUGARET)..--.- T4Figura II.9:
-
Foto de bagos de uvas com sintomatologia de Oídio - ruptura dos bagos; (Foro:YvoN BUGARET)..---__
t4
Figura II.10:
-
Fotos de bagos de uvas com sintomatologia de Oídio ao estado fenológicode fecho dos cachos
(Foro: YvoN
BUGARET). ..._t4Figura II.11:
-
Foto de um ramo com sintomatologia de Oídio na Primavera (Foro: a partir dosite: http://www.muller-koeberle.frlodium-2.htm, 20 10)..---..- 15
Figura
ll,l2:
-
Foto de
ramode
videiracom
sintomatologiade
Oídio
(Foro:
YVONBUGARET)..-._...-
l5
Figura II.13:
-
Foto de um ramo com sintomatologia de Oídio no Outono(Foro:
a partir dosite: http://www.muller-koeberle.frlodium-2.htm, 20 l0). ..----
t6
Índice de Figuras
Figura II.14:
-
Esquema de5
videiras seleccionadas no meio de uma parcela susceptível aooídio. A cepa do meio tem uma vara que foi conduzida até ao chão onde se deixaram 3 gomos.
(A)
rede para manter as folhas caídas;A
seta a rosa indica a queda das folhas sobre o ramodeixado no chão 32
Figura II.15:
-
Tomada de decisão parao
tratamento do oídio (Sn-ve, 2008-
Fonte YvoNBUGARET).. __._34
Figura II.16:
-
Cacho de uva tinta atacado pelo oídio (sva, 2008 36Figura ll.Í.7:
-
Sequência de aminoácidos do gene P-450r+oru deE.
necator.A
sequêncianucleótida está numerada relativamente
à
primeira basedo
codão de iniciaçãoATG, e
onúmero
á
direita de cadaliúa
representaa
posiçãodo
último nucleótidoou
resíduo deaminoácido nessa
linha.
O
truncamentoda
sequênciaé
indicadapor
asterisco.A
parteconservada do gene CR2, está sublinhada, e as posições dos 'primers' de PCR C14, C14R,
U14DM e MUT1 estão indicados acima da sequência do nucleótido. O codão modificado e a
respectiva sequência de aminoácidos encontrada nos genes P-4501apy flutântes de isolados resistentes é dada acima da sequência. O nucleótido substituído está indicado a negrito
([l]
43
Figura
II.18:-
Produtos de amplificação NAS-PCR do gene P-450r+o1,,r de DNAs extraídos apartir
de isolados sensíveise
resistentes ao triadimenol deE.
necator, usandoos
'primers' U14DM e MUT1. Amostras: 1-
marcador (1-kb DNA ladder; Gibco-BRL); 2-
(HzO) controlo negativo semDNA;
3-
vários fungos, de folhas de videira colhidas no campo, que cresceram em placas de agar com dextrose da batata; 4 a 8-
isolados sensíveis ao triadimenol; 9a
12-isolados resistentes com nível de resistência inferior a
5;
13a
19-
isolados resistentes comnível de resistência superior a 5..--- ..44
Figura
IV.l-
Foto de micélio de E. necator numa folha de videiraFigura lY.2z
-
Foto em que se observam hifas do fungo E. necator numa folha de videira..-.-.---...-55Figura IV.3
-
Foto de uma folha de videira com sintomatologia de oídio. Podem observar-se conidióforos (A) e conídios em cadeia(B);-Figura IV.4:
-
Análise dos produtos amplificadospor
PCR, para identificaçãode
um fragmento de 450 pb do gene da p+ubulina. M-
'DNA ladder 1 Kb pIus'(NVITROGEN);1,2,3,
4,
5, 6,'7, 8,9,55
e 56-
amostras em que se utilizou DNA total; CN-
controlo negativo dePCR; CPI
-
controlo positivo gentilmente cedido pelo Dr. Delmotte do INRA.A
seta indica asbandas correspondentes aos produtos de amplificação esperados (450
pb)..--...---.
---57Figura IV.S:
-
Análisedos
produtos amplificadospor
PCR, para identificaçãode
um fragmento de 450 pb do gene da p-tubulina.M
-
'DNA
ladder 1 Kb plus'(NvITRocEN); 15-amostra em que se utilizou DNA total; CN
-
controlo negativo de PCR; CPz e CPI-
controlospositivos
gentilmente cedidospelo
Dr.
Delmottedo
INRA.
A
seta indica
as
bandascorrespondentes aos produtos de amplificação esperados (450 pb)...---..-- 58
Figura IV.6:
-
Análise dos produtos amplificados por PCR, para identificação gene p+ubulina cujo fragmento tem aproximadamente 450 pb.M
-
'DNA
ladderI
Kb plus'(NvITROGEN); 5 e16
-
amostras em que se utilizouDNA
total; CN-
controlo negativo de PCR; CP2 e CPr-controlos positivos gentilmente cedidos pelo Dr. Delmotte do INRA.
A
seta indica as bandas55
59 correspondentes aos produtos de amplificação esperados (450 pb)
Índice de Figuras
Figura lY.7:
-
Análise dos produtos amplificados por PCR, para identificação gene p-tubulina cujo fragmento tem aproximadamente 450 pb. M-
'DNA
ladderI
Kb plus' (INVITROGEN); 17,19,27,41,42,43,49,52,58
e 59-
amostras em que se utilizouDNA
total; CN-
controlo negativo de PCR.A
seta indica as bandas correspondentes aos produtos de amplificaçãoesperados (a50 pb). 60
Figura
IV.8:
-
Análise dos produtos amplificados por PCR, para identificação gene p-tubulina cujo fragmento tem aproximadamente 450 pb. M-
'DNA
ladderI
Kb plus' (INVITROCEN); 31, 57,g,
ll,
14, 53, 35,4,
18, 55 e4l
- amostras em que se utilizou DNA total; CN-
controlo negativo de PCR.A
seta indica as bandas correspondentes aos produtos de amplificaçãoesperados (a50 pb) 61
Figura IV.9:
-
Análise dos produtos amplificados por PCR, para identificação gene p-tubulina cujo fragmento tem aproximadamente 450 pb. M-
'DNA ladderI
Kb plus' (NVITROGEN);22, 48,I7
e
4l
-
amostras em que se utilizouDNA
total nãodiluído;22n,48p,
l7p e
413 -amostras em que se utilizou DNA total em soluçãodiluída
1:3(v/v);
221rc, 481rc, 17 ns e4lils
-
amostras em que se utilizouDNA
totalem
soluçãodiluída
1:10(v/v);
CN-
controlonegativo de PCR. 62
Figura IV.10:
-
Análise dos produtos amplificadospor
PCR, para identificação genep-tubulina
cujo
fragmentotem
aproximadamente450
pb.
M
-
'DNA
ladder
I
Kb
plus' (NvITRoGEN); 14, 16, l'7, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27,I,
2, 3, 4 e 5-
amostras em que se utilizou DNA total em solução diluída 1:3(v/v);
CN-
controlo negativo dePCR..---.-.-Figura IV.11:
-
Análise dos produtos amplificadospor
PCR, para identificação geneB-tubulina
cujo
fragmentotem
aproximadamente450
pb.
M
-
'DNA
ladder
I
Kb
plus' (NvITRocEN); 1, 2,3,
12,13,27,35,36,39,41,52,55
e 58-
amostras em que se utilizouDNA total em solução
diluída
1:3(v/v);
CN-
controlo negativo de PCR.A
seta indica asbandas correspondentes aos produtos de amplificação esperados (450 pb)
Figura
lY.l2:
-
Análise dos produtos amplificadospor
PCR, para identificação geneB-tubulina
cujo
fragmentotem
aproximadamente450
pb.
M
-
'DNA
ladder1
Kb
plus' (NvITRoGErq);17,
18,43 e
52
-
amostras.A
seta indica as bandas correspondentes aosprodutos de amplificação esperados (450 pb).. 66
Figura
IY.13:
-
Análise dos produtos amplificadospor
PCR, para identificação genep-tubulina
cujo
fragmentotem
aproximadamente450 pb.
M
-
'DNA
ladderI
Kb
plus' (INVITRoGEN);41
-
amostra.As
setas indicam as bandas correspondentes aos produtos deamplificação esperados (281 pb e 168
pb)...-Figura
IV.14:
-
Análise dos produtos amplificadospor
PCR, para identificação genep-tubulina
cujo
fragmentotem
aproximadamente450 pb.
M
-
'DNA
ladder
I
Kb
plus' (NvITRoGEN); 17, 18, 43 e 52-
amostras. As setas indicam as bandas correspondentes aosprodutos de amplificação esperados (168 pb, 281 e 449
pb'l,.---
---67Figura IV.15:
-
Análise dos produtos amplificados por PCR, para identificação gene CYP1Icujo
fragmentoapós
amplificação
é
de
1756
pb.
M
-
'DNA
ladder
I
Kb
plus' (NvrrRoGEN); CPA e CPB-
controlos positivos gentilmente cedidos pelaDf.
Marie-France Corio-Costet doINRA;
5,6,7,17,
18,35,37,
41, 43, 52 e 53-
amostras; CN-
controlo negativo de PCR.A
seta indica as bandas correspondentes aos produtosde
amplificação69 63
67
esperados (1756 pb)
índice de Fisuras
Figura
IV.16:-
Análise dos produtos amplificados por PCR, para identificação gene CYPSLcujo
fragmentoapós
amplificação
é
de
1756
pb.
M
-
'DNA
ladder
I
Kb
plus' (INV1TRoGEN); CPB-
controlo positivo gentilmente cedido pela Dr.u Marie-France Corio-Costet doINRA; 49,50,51,54,55,
56, 57, 58, 59 e 60 - amostras; CN-
controlo negativo dePCR.
A
seta indica as bandas correspondentes aos produtos de amplificação esperados (1756pb). 69
Figura
IV.17:-
Análise dos produtos amptificados por PCR, para identificação gene CYPSLcujo
fragmentoapós
amplificação
é
de
1756
pb.
M
-
'DNA
ladder
1
Kb
plus' (INy1TRoGEN); CPB-
controlo positivo gentilmente cedido pela Dr.u Marie-France Corio-Costet do INRA; 25, 26, 27, 28, 29, e 3O - amostras; CN-
controlo negativo de PCR.A
setaindica as bandas conespondentes aos produtos de amplificação esperados (1756 pb).---...- ---70
Figura
IV.18:-
Análise dos produtos amplificados por PCR, para identificação gene CYPSLcujo
fragmentoapós
amplificação
é
de
1756
pb.
M
-
'DNA
ladder
I
Kb
plus' (INyTTROGEN); CPB-
controlo positivo gentilmente cedido pela Dr." Marie-France Corio-Costet do INRA;37,38,39,40,42,44,45,46
e 47 - amostras; CN-
controlo negativo de PCR.A
seta indica as bandas correspondentes aos produtos de amplificação esperados (1756 pb).--.-.-. _..70Figura
IV.19:-
Análise dos produtos amptificados por PCR, para identificação gene CYP5Lcujo
fragmentoapós
amplificação
é
de
1756
pb.
M
-
'DNA
ladder
I
Kb
plus' (INvtTRoGEr.r); CPB--
controlo positivo gentilmente cedido pela Dr." Marie-France Corio-Costet do INRA;20,21,22,23,24,31,32,34
e 36 - amostras; CN-
controlo negativo de PCR'A
seta indica as bandas correspondentes aos produtos de amplificação esperados (1756 pb)..-....---.----.71Figura
IV.20:-
Análise dos produtos amplificados por NAS-PCR, para amplificação de um fragmento com476pb.M
-
'DNA
ladder 1 Kb plus' (INvITROGEN); CPA e CPB-
controlospositivos gentilmente cedidos pela
Dr.'
Marie-France Corio-Costet do INRA;5,6,'7,
17, 18,4I,
43,52 e 53
-
amostras;CN
-
controlo negativo de PCR.A
seta indica as bandascorrespondentes aos produtos de amplificação esperados (476 pb)... 72
Figura
lY.2l:
-
Análise dos produtos amplificadospor
PCR, para amplificaçãode
um fragmentocom476 pb.M
-
'DNA ladderI
Kb plus' (INVITROGEN); CPB-
controlo positivo gentilmente cedido pela Prof. Marie-France Corio-Costet do INRA; 49, 50, 51, 54, 55, 56, 57,58, 59
e
60
-
amostras;CN
-
controlo negativode
PCR.A
seta indicaas
bandascorrespondentes aos produtos de amplificação esperados (476 pb).. 73
Figura
1Y.22
-
Análise dos produtos amplificadospor
PCR, para amplificaçãode
um fragmento com476pb.M
-
'DNA
ladderI
Kb plus' (INVITROGEN); CPB-
controlo positivo gentilmente cedido pela Prof. Marie-France Corio-Costet do INRA;37,38,39,
40, 42,4,
45, 46 e 47 - amostras; CN-
controlo negativo de PCR.A
seta indica as bandas correspondentesaos produtos de amplificação esperados (476 pb)...-.---.---.. 73
Índice de Ouadros
ÍNorcn
DE
euADRos
Qul»no II.1:
Resumodas
substânciasactivas
de
fungicidasanti-oídio
permitidoscomercializar actualmente em Portugal (s.4.,
2010);..---.----.-..----
.---..-.---24Qulono
II.2:
Modos de acção das substâncias activas de fungicida anti-oídio (S.e. a partir daInternet: http://membres.multimania.frlipmvigne/IVtaladies/oidium.htm, 2010);---...-... ---24
Quaono
III.I
: Identificação de Amostras; ---. - - - - - 47QU,l»nO
IV.l:
Quantificaçãode
DNA
das
Amostras
por
Qubitru
Fluorometer56
Qulono
IV.2: Amostras em que se obteve amplificação do fragmento de 450pb do gene da B-tubulina.QUAOnO IV.3: Amostras analisadas quanto ao grupo genético a que pertencem..---...----...-...-.-.--68
Qulono
IV.4: Amostras em que se obteve amplificação do geneCYP5l
de E. necator.---.----.---71Quaono
IV.S: Resultados obtidos na análise dos isolados sensíveis e resistentes aos DMI's.,-.-.---74Qunono
IV.6: Resumo dos resultados das amplificações realizadas ao gene da B-tubulina, e doCYPS1. _._...75
65
Abreviaturas Gerais Utilizadas
ABREVIATT]RAS GERAIS
UTILIZ
ADAS
CAPS
-'Cleaved Amplified
Polymorphic Sequence'CYPSI
- genecodificado
l4o-demetilaseD.M.I.
- inibição de demetilaçãoDNA
-
ácido desoxiribonucleico dNTPs-
deoxinucleótidos trifosfatosEDTA
-
ácido etilenodiamino tetra-acéticoEntub
- gene B- tubulina de E. necatorEPA
-
'Environmental Protection Agency'E.U.A.
-
Estados Unidos da AméricaHR
-
humidade relativaI.B.E.
- inibição de biossíntese de esteróisINRA
-
'Institute Scientifique de Recherche Agronomique'NAS-PCR
-
'Nested Allele-Specific PCR'RAPD
- ('RandomlyAmplified
PolymorphicDNA')
pb
-
pares de basesPCR -Reacção da Polimerase em Cadeia ('Polymerase Chain Reaction')
PCR-RFLP
-
PCR 'Fragment Lenght Polymorphism'PVP
-
polivinil
pirrolidone PVPP-
polivinilpolipinolidona
P-450uorvr - citocromo P-450 esterol l4o-demetilase
SI{P
-
'single nucleotide polimorphism'Taq
-
Thermus aquaticusTris
-
Tris (hidroximetil)
aminometanoE.
necator - Erysiphe necatorB.
cinerea - Botrytis cinerea E.graminis
- Erysiphe graminisMuscadinia rotundifulia.
-.M.
rotunddolia Kishrnish vatkana -K.
vatknnaV. vinífera
-
Vitis ViníferaAbreviaturas t Itilizadas g
-
grama "C-
grau centígrado h-
horasL
-
litro
> - maior quet
- mais ou menosÍ
- menor ou igual quepm
-
micrómetrospl
-
microlitro
mL
-
mililitro
mm
-
milímetro
mm2-
milímetro
quadradomM
-
milimolar
min.
-
minuto Vo-por
centorpm
-
rotações Por minutoseg.
-
segundov/v
-
volume/volume Basesnucleotidicas:
A
-
Adenina C-
Citosina G-
GuaninaT
-
Timina
U
-Uracilo
xAsradecimentos
AGRADECIMENTOS
Este trabalho
foi
realizado no laboratório deVirologia
do Instituto de Ciências AgráriasMeditenânicas
(ICAM)
e do
Departamento de Fitotecnia da Universidade de Évora,o
qual me proporcionou todas as condições de trabalho experimental..
Paru a realizaçáo deste trabalhofoi
importante todo o apoio e boa vontade que me foramdirigidos.
Todosos
que de algumaforma
contribuíram paraa
realizaçáo deste trabalho um reconhecido, OBRIGAoR! Assim, gostaria de agradecer:À
minha
Orientadora, ProfessoraDoutora
Maria do
Rosário
FernandesFélix,
que sempre me apoio e incentivou neste projecto, sempre acreditando emmim,
e sobretudo pela sua disponibilidade e amizade.A
sua constante boa disposição e alegriano
trabalho, fez-mesuperar diversos desafios e adversidades.
Foi
com enorrne pÍazeÍ que trabalhei consigo, e que recebi todos os ensinamentos que me transmitiu, bem como pela forma como me mostrou um mundo novo paramim,
sobre aBiologia
Molecular.Ao
meu
Co-Orientador, ProfessorYvon
Bugaret,com
quem aprenditudo
o
que
sei sobreviticultura
e fitossanidade da vinha. Agradeço todaa
amizade e disponibilidade amim
dirigidas
ao longo
destes anos quenos
conhecemos,e
nestemeu projecto,
o
meu
muitoobrigada pelo forte apoio e incentivo.
Ao
meu
Co-Orientador,Eng."
JorgeSilva
(BIvERCRoPScIENCE), responsável pelodelinear
inicial
desteprojecto. Faço votos
de
que
no futuro
tenhamos oportunidades detrabalhar mais em conjunto, quer consigo, quer com a empresa que representa.
Ao
Eng."
JoãoTones, pela
suaenoÍme disponibilidade
na
recolha
de
amostras de campo. Sem a sua ajuda este projecto nãoteria
sido possível.Um
carinhoso e sentido muitoobrigada.
Ao
Eng."
Nuno
Chegadinhoda
ATEVA
e
ao
amigo
Rui
Flores,
a
quem
agradeçotambém a disponibilidade pela recolha de algumas das amostras de campo.
Asradecimentos
À
equipa
do
Laboratório
de
Virologia
e
do
Laboratório
de
Microbiologia
daUniversidade de Éuora, Professora
Maria
Ivone Clara, Eng." Carla Varanda,D. Maria Mário
Azedo, Dr." Ana Alexandre, Professora Solange
Oliveira
e Dr." Marta Laranjo, que em muitome
ajudaram nas inúmeras tarefas de laboratório, bem como pela amizade, alegria e simpatia de todos os dias.Ao
Professor Femando Rei, o meumuito
obrigada pela sua disponibilidade no trabalhofotográfico
desenvolvido sobre
as
amostrasrecolhidas
no
campo,
em que se
conseguiurecolher imagens lindíssimas do fungo.
Ao
Eng."Luís
Antunes (BevnnCnopScmNCE), sempre disponívele pronto a
ajudar nas minhas inúmeras solicitações e sobretudo pela simpatia e amizade demonstradas.E
por
fim,
um
obrigadamuito
especialao meu marido
e
aos meus paispelo
apoioincondicional
em
todas as horas,
e
ao
meu
pequeninofilho,
que
acompanhoutodo
esteprocesso desde
o início
da suavida, e
que teveo
carinho enorÍne de me conceder algumas horas das suas brincadeiras, para que eu concluísse este meu projecto.Resumo
RESI]MO
Contribuição para
o estudo da CaracterizaçãoMolecular
de isolados de Erysiphe necator nas
Vinhas
doAlentejo
Este trabalho é o
primeiro
a ser realizado em Portugal, no sentido de optimizar técnicasde
caracterizaçáo molecular de isoladosdo fungo
Erysiphe necatore
no
sentido abordar aevolução
destefungo
numa das
mais
importantes regiõesvitivinícolas do
nossoPaís,
o Alentejo.Utilizaram-se
60
amostrasde videiras
infectadascom
E.
necator,
provenientes devideiras de diferentes castas representativas do Alentejo.
A
amplificação por PCR do fragmento de 450 pb do gene da B-tubulinafoi
conseguidoem
11 amostras, tendo estas sido posteriormente sujeitas a análise CAPS para identificaçãodos grupos genéticos
A
e B. Destas 11 amostras, obtiveram-se 5 do grupo genéticoB,
sendo 2 delas obtidas de 'drapeaux', e em4
dessas amostras aparentam coexistir também isolados do grupo genéticoA.
Na
análisepor
NAS-PCR,
obteve-seum
fragmentode
1756pb
que contémo
gene CYPS1em
9
amostras, mostrando1
isolado sensívele
8
resistentes aos fungicidasDMI's.
Apesar do baixo número de resultados obtidos,o
facto da maioria dos isolados ser resistente aosDMI's
pode ser um dado indicativo para a gestão dos tratamentos contra o oídio.Palavras-chave: Erysiphe necatori Oídio; Vinha; Resistência aos
DM['s;
Grupo genéticoA
eB.
Abstract
ABSTRACT
Contribution for
thestudy of
Molecular
Characterization
of
Erysiphe necator isolates
in
Alentejo vineyards
This
work
is the
first
one reportedin
Portugal,in
the matterof
optimization
of
molecular characterization techniques
of
Erysiphe necator isolates and in the approachingthe evolution
of
this
fungusin
oneof
the most
importantwine
region
of
our
country, Alentejo.We analyzed 60 E. necator infected samples collected
from
different grapevinesin
the
Alentejo
region.The
PCRamplification
of a
45O bp fragmentfrom
B-tubuline genewas obtained
only
in
11of
these samples, that were then subjectedto
CAPS analysisfor
identification
of
the different genetic groups,A
and B. From those 11 samples, 5 belongedto
B
group,
and2 of
those sampleswere
obtainedfrom
'flag
shots'.
Four
of
these 5samples seem to have simultaneously isolates from the two genetic groups.
The amplification
of
the
1756
bp
fragment that contain
the
CYPSL gene was obtainedonly
in
9 samples, but the NAS-PCR analysis was applied toall
60 samples. The obtainedresults show
I
sensitiveisolate and
8
resistant isolatesto DMI's
fungicides.Although the
low
amountof
results obtained,the
majority
areDMI's
resistant, whichindicate that attention is required in powdery mildew management.
Key
wordsz Erysiphe necatori Powdery
mildew;
vineyards;DMI's
resistance; geneticgroup
A
and BIntroducão
I.
INTRODUÇÃO
Nos últimos
anos as paisagensdo Alentejo
mudaram radicalmentede
longas eextensas planícies cobertas pela plantação de cereais, passando a praticar-se a cultura da
vinha. Para além da paisagem, as mudanças soci-económicas também decorreram a vários
níveis. Neste sentido, e porque
o
investimentoinicial
por parte doviticultor
é elevado, eeste espera
tirar
partido
desses custosde
implantação durante,pelo
menos, cerca de 25 anos davida
útil
de umaviú4
é
importante que as videiras sejam plantas saudáveis ecapazes de
frutificar
para originar vinhos de qualidade. Todos os anos,o viticultor
tenta assegurara
sanidadeda vinha
e
das suasuvas,
gerindo práticasculturais
e
aplicandoprodutos agro-químicos. Destes últimos, os produtos fitossanitários representam
o
maiorcusto
por
parte
do viticultor,
quenão quer
descuraro
bom
estadosanitário
das suasvinhas, pois sabe que se as suas videiras não
forem
saudáveis, não poderá produzir boas uvas para consumo em fresco ou produzir um bomviúo.
De entre as diversas doenças da
vinha
queo viticultor
tem de gerir, encontra-se ooídio.
O
oídio da vinha
tornou-se,a nível
mundial, a principal
doençada viticultura
(Conro-CoSTET, 2007). O seu organismo causal Erysiphe necator(sin.
Uncinula necator)foi
introduzido na Europa durante o séculoXIX,
provindo da América do Norte em 1840,e
rapidamente ocupou novas áreas geológicas propagando-sepor toda a
Europa (KISS,s.d.). Os
profissionais
da viticultura
encontraram-sena
obrigaçãode
tratar
e
tentarcontrolar
este
fungo
patogénico dependendodas
variáveis
condições meteorológicasfavoráveis. Actualmente devido
às
alterações
climáticas
e
ao
mais que
provado aquecimento do planeta, as zonas vitícolas temperadas arriscam-se a pressões parasitárias cadavez
mais fortespor
parte dos microorganismos, em especialdo fungo
E.
necator,sendo
que, as
condiçõesde
tempo
quentee
seco
favorecemo
seu
desenvolvimento(Conto-CosTET,
2007).
Coúecer
melhor
este patogénee
sabercomo
o
controlar,
são necessidades que se impõe para bem do futuro da viticultura.Em Portugal ainda não existem estudos aprofundados acerca dos grupos genéticos de E. necaÍor existentes nas nossas
viúas.
Se por um lado, pelos artigos estudados, e atélntrodução
similaridade dos grupos genéticos
A
e
B
sejaigual em
toda a Europa, como estarão asnossas
viúas
quantoà
resistência aos I.B.E.s.? TeremosE.
necator
maioritariamentesensíveis ou resistentes? Obviamente os resultados terão repercussão quanto à gestão dos tratamentos ao longo da campanha vitícola, e sobretudo, na escolha dos fungicidas a usar.
Com
este trabalho
pretende-sedar um
contributo
inicial
para
o
melhorconhecimento molecular de isolados do fungo
E.
necator. obtidos de videiras na Regiãodo Alentejo, nomeadamente identificar os grupos genéticos,
A
ouB,
presentes nas vinhasdesta região
e verificar a
altura
do
anoem
que predominam. Paralelamente,com
este trabalho, também nos propomos a identificar isolados com sensibilidade ou resistência aosfungicidas que contenham substâncias inibidoras da demetilação
(DMI's),
verificar
quais as castas mais sensíveis e época do ano em que ocoÍTe o aparecimento desses isolados.evisão Bihliosráfica
2.
O
Organismo
Causal
Os oídios de várias culturas são causados por muitas espécies de fungos diferentes pertencentes
ao
grupo
dos Ascomycetes filarrrentosose a
diferentes génerosda
ordem Erysiphates. Estes géneros são distinguíveis uns dos outros pelo número(l
versus vrários) de ascos por cleistoteca e pela morfologia do crescimento das hifas dos apêndices, fora da parede da cleistoteca (Acnlos,2005
e HomraeN et aI.,2007).O fungo causador do oídio na videira
foi
descoberto por Schweinitz na América doNorte no ano de 1834 ao qual dado o nome de Erysiphe necator, (sins. Urzcinula necator
Schw., E. tuckeri
Berk.,
IJ.americanaHowe,
tJ. spiralis Berk.&
Curt.,
U. subfuscaBetk.&
Curt.;
anamorfo Oidium tuckeriBerk.)
(GoHepN et aL.,2001).A
doença causava danos sem importância nas videiras nativas americanas e não adquiriu notoriedade até 1845, anoem
que
foi
observadapela primeira
vez
ia
Inglaterra.É
um
parasitaobrigatório
nos géneros dafamília
Vitaceae Ampelopsis, Clsszs, Porthenocissuse
Vfuis (GoHrEN et al.,2001).
Hoje em dia
podemos encontraresta
doençana
maioria
de
todas as
regiõesvitícolas
do
mundo. Quando nãoé
controlado,o
oídio
reduza colheita
e
afectaa
sua qualidade, para além de reduzir a capacidade de crescimento vegetativo da planta e a sua resistência aofrio
de lnverno(GonrsN
etaI.,2001).
O micélio do
fungo
E.
necatoré
constituídopor hifas
hialinasde
4
a
5
prm dediâmetro, superficiais mas semipersistentes e septadas (GougpN et a1.,2001).
A
infecção comegacom a
germinação dos conídeos na epiderme, formando-se emprimeiro
lugar o apressóriomultilobulado.
O fungo rompe a parede celular das células epidérmicas com apenetração
de
um
órgão,
que emergea partir do
apressório.(HorruteN
et
a1.,2007).Depois
da
penetraçãona
cutícula
e
na
membranacelular,
forma-sedentro
da
célulaepidérmica um órgão de alimentação
-
haustório globuloso(GoserN
et a1.,2001), que setorna
intimamente associadocom a
membrana plasmática do hospedeiro.Os
nutrientessão absorvidos
pelo
haustório que osutiliza
para se desenvolvere formar hifas.
A
hifa
alonga-se e desenvolve outros apressórios e outros haustórios, dando lugar á formação deconifióforos
e posteriorÍnente conídios. Estes esporos são os responsáveis pela repetição da doença porvia
assexuada, e subsequente aparecimento de contaminações secundárias.A
formação de um primeiro haustório funcional bem sucedida é oprincipal
requisito parao fungo se instale e possa entrar nas subsequentes fases de desenvolvimento
(HormlaN
efaI.,2007).
Revisão Bihliosráfica
Na
hifa
prostrada forma-seconidióforos
multiseptados,com
l0
a 400
pm
decomprimento,
em
intervalos frequentes
e
perpendiculares.Os
esporos
são
conídioshialinos
e
cilindro-ovoides,
que medem27-47
x
14-21FIr,
e
que se
agrupam-se emcadeias.
O
conídio mais antigo encontra-se no extremo distal da cadeia. Em condições de campo, as cadeias são muito curtas, com 3 a 5 conídios (GorneN et aL.,2001).As
cleistotecas(Ftc(s).
II.1
elI.2)
são formadaspor
fusãode hifas de
diferente sexo (reprodução sexuada), apresentam um corpo esférico globuloso com 70 a 130 prm dediâmetro quando totalmente desenvolvido e podem encontrar-se na superfície de todas as
partes
infectadas
do
hospedeiro
(s.4.,
a
partir
da
intemet:
http://www.muller-koeberle.frlodium_2.htm,
2010).
As
cleistotecas
têm
apêndices
largos, flexíveis
emultiseptados que têm uma curvatura característica no ápice quando maturam (GormeN er
a1.,2001).
As
cleistotecas mudam decor hialina
para amarelo,e
depois para castaúo-escuro a preto à medida que amadurecem.A
parede extema da cleistoteca é constituídapor
3
a4
camadas de células.No
caso deE.
necator,
contêm4
a
6
ascos (raras vezes mais) que têm forma de ovada a subglobosa e medem 50-60x25-40
trrm. Os ascos contêmde
4
a
7
ascósporoshialinos
(sendoo
mais
frequente4
na
maturação), ovados ouelipsóides e medem 15-25
x
10-14 trrm.De forma
parecida aos conídios, germinam comum ou
mais curtos tubos germinativos, rapidamente formando, cadaum,
um
apressóriomultilobulado
(GoueeN et al., 2001).FIc(s).II.1e
2-
Fotos de cleistotecas deE
necator. (1) observação aomicroscópio óptico; (2) observação ao microscópio electrónico (Foros: a
partir do site: http://www.muller-koeberle.frlodium_2.htm, 20 10);
Os isolados deste ascomiceta causador do
oídio
naviúa,
E.
necator, dividem-seem
dois
grupos genéticos diferenciados(A
e
B)
que coexistemno
mesmo hospedeiro(MoNrannY
etal.,
2008).5
Revisão Bibliosráfica
Existem vários
exemplosbem
documentadosde
populaçõesde
patogénes dasplantas que podem ser diferenciados geneticamente em completa
ou parcial
reprodução isolada,incluindo
Leptosphaeria macularcs(Wtllmus
e FITT, 1999), Gaeumannomycesgraminis var.
tritici (LnnnrroN
et a1.,2004),Botrytis
cinerea (FouRNrER etal.
2005), e E.syringae
(Snro
etal.
2008).A
descoberta de existência de diferenciação genética, masmorfologicamente
indistinguíveis, levanta
questões importantes acercada
coexistência destas espécies. De acordo com a teoria da competição, duas espécies ocupando o mesmonicho
ecológico não podemcoexistir
indefinidamente. Esta teoria,levou à
sugestão, de que algumas espécies podem coexistir numnicho
de modo fraccionado, apesar dos seuselevados graus de afinidade fenotípica. Para subgrupos do patogéne da planta, coexistir no mesmo hospedeiro
(isto
é, na mesma fonte), as diferenças ecológicas que conduzem a umnicho
fraccionado,
podem resultar numa
separaçãoespacial
e/ou
temporal
destes subgrupos (MoNTARRY et a1.,2008).E.
necator providenciaum bom
modelo para investigar os efeitos das estruturas genéticas dos patogénes das plantas. Durantea
epidemia, populações destefungo
estão estruturadasem dois
grupos
genéticos diferenciados(A
e
B)
que
foram
previamenteidentificados
num
número considerável de paísesvitícolas, incluindo
França, Austrália,Itáiia,
e
Espanha(MoNrARRy et a1.,2008).
DÉr-ypet
al.
(Úl
-
1997) sugerem que osisolados do grupo
A,
sobrevivem ao lnverno na forma de micélio nos gomos dormentes, eque
o
seu desenvolvimentoé
reactivado apósa
rebentação, levandoà
colonização dosjovens
rebentos-
'drapeaux';
em contraste,os
isoladosdo
grupoB,
sãooriginários
de ascósporos libertados pelas cleistotecas apóso
fim
do
lnverno.Foi
também encontrada uma associação entre os sintomas em 'drapeaux' e uma infecção com isolados do grupoA
(Auneu
e
CoRto-CosrET, 2006). Contudo,
a
associação entreo
grupo
genéticoe
aestratégia
pós Invernal indica
queos
sintomasem
'drapeaux' podem ser causados porambos
os
grupos
genéticos(ConrEsI
et
al.,
2005).
Comparaçõesentre
os
graus
de agressividadedos
diferentes grupos genéticosde E.
necator, conduzirama
resultadosparcialmente
conflituosos. Assim:
PÉRoset
al.
em
2006, reportaramque
o
índice
de infecção, isto é, a proporção de lesões por esporulação geradas por inoculação local, eram mais baixas, e queo
diâmetro da lesão erainferior
para isolados do$upo
genéticoA,
do que pÍua isolados do grupoB.
Contudo,WnLocquw
etal.
em2007, descobriram que osisolados
do
grupo
B
eram mais
agressivosque
os
isoladosdo grupo
A
para
certas característicastais como,
o
rácio
da germinaçãoe
eficiênciada
infecção.O
oposto eraverificado para outras características tais como, o período de latência, o diâmetro da lesão e a intensidade da esporulação.
são Rihliosráfica
As
frequênciasdos
grupos genéticosde E.
necator varia
consideravelmente aolongo das vinhas, e os dois grupos podem coexistir na mesma vinha. Os isolados do grupo
A,
encontram-se presentesno início do
crescimento vegetativo da planta, desaparecendoao
longo
do
percurso
do
ciclo
epidémico.
Por outro lado, os
isolados
do
grupo
Bencontram-se presentes
ao
longo
de
todo
o
ciclo
epidémico.
Desta forma,
estasobservações sugerem que a reprodução sexuada de
E.
necator (formação de cleistotecas)envolve
apenas isoladosdo
grupoB.
Esta descoberta sugere quea
manutenção de uma elevada diferenciação da estrutura genética em populações de E. necator, pode resultar apartir
deum
isolamento temporal de grupo genéticos.O
isolamento temporal dos grupos genéticos mostrou que desta forma se previne a recombinação entre os isolados do grupoA
eB,
importante para a manutenção das estruturas genéticas altamente diferenciadas empopulações
de
E.
necator (MoNrennY
et
al.,
2008). SruuueR
e
SCOTT,em
2003,realizaram estudos
que
demonstraramexistir
infertilidade entre estes grupos
em experiências controladas de cruzamento.De um
ponto devista evolutivo,
esta diferença numa estratégia de sobrevivênciaentre os
dois
grupos genéticos deveriaconferir
uma vantagem aos isoladosdo
grupo B,uma vez que estes isolados beneficiam de ambos os tipos de reprodução clonal e sexuada.
A
presença a longo termo dos isolados do grupoA
levanta questões acerca da competição entre os grupos genéticos de E. necator paÍa infecção dos rebentos noinício
da estação da rebentação(MoNrnnnY
et al., 2008).O
padrãotemporal
existente, podepor
suavez
resultara partir
de
diferenças anível
de agressividade entre isolados dos diferentes grupos genéticos.A
comparação das características dahistória
devida
que determinama
agressividade entre osdois
grupos genéticos, mostrou que o grupoA
era menos agressivo que o grupoB
em termos de ráciode germinação e eficiência de infecção.
O
grupoA
demonstrou ser mais agressivo que ogrupo
B
em termos de período de latência, diâmetro da lesão, e número de esporos porlesão. Desta forma,
as
característicasde
agressividadede
E
necator podem
serclassificadas
em dois
grupos
independentes:um
primeiro grupo incluindo
variáveismonocíclicas associadas com a infecção (o rácio da germinação e a eficiência da infecção)
e
um
segundogrupo incluindo
variáveis
associadascom
processos epidemiológicos seguindoa
infecção (período de latência, produção de esporose
tamaúo
da lesão). Naepidemia
do
oídio, os dois
grupos genéticos
podem
adoptar diferentes
estratégiasecológicas para colonizar e usar a mesma fonte. Isolados do grupo genético
A
produzemum
grande númerode
conídioscom baixa eficiência de
infecção,contudo
isolados dogrupo
genéticoB
produzemum
reduzido númerode
conídioscom
uma eficiência
deisão Biblioeráfica
infecção elevada.
De um
ponto
devista
ecológico,os
isoladosdo
grupo
A
podem serconsiderados
como tendo uma
estratégiade vida
como
sendo invasores
do
nicho ecológico, enquanto isolados do grupoB
têm uma estratégia de vida como competidores, ocupando nichos. Este padrão é consistente com as observações em isolados do grupoA
em
que se
encontravam
mais activos
no
início
do
período
vegetativo
da
planta, desaparecendo subsequentemente, e neste aspecto, a frequência dos isolados do grupo B aumentava ao longo do tempo(MoNrannY
et a1.,2008).A
agressividade entre os dois grupos genéticos não aumenta ao longo do decurso da epidemia. Este resultado contrasta com aqueles obtidos previamente para outros fungospatogénicos
das
plantas.
Vu-langru-
e
LaNNou
demonstraram,em 2000, que
uma selecção direccionadapaÍaum
aumento de agressividade tomou lugar em populações deE.
graminis
e
de
Phytophthora
infestans, duranteo
ciclo
epidémico.Alguns
fungospatogénicos das plantas alternam
a
sua agressividade, nas suas diferentes fases de vida.Outros fungos, como
a
Mycosphaerellagraminicola
(Cowcen e
MUNDT,2002)
e
E.necator,peÍmanecem estáveis quanto á sua agressividade.
O
isolamentotemporal
dos grupos genéticosde
populaçõesde
E.
necator
náoexplica contudo a predominância do grupo
A
noinício
do período vegetativo. Contudo, os resultados apresentadospor
MoNrenny
et a1.,2008,
mostraram queo
desaparecimento dos isolados do grupoA
durante a epidemia não estava associada a um efeito de aplicaçãode
fungicida, conforme se
observounas
amostrasque
foram
colhidas
de locais
nãotratados.
A
data dos componentes de agressividade mostrou que as diferenças numéricas entre os grupos genéticos eram pequenas e potencialmente insuficientes para serem tidasem
conta,no
que respeita ao desaparecimento dos isoladosdo
grupoA
duranteo
ciclo
epidémico. Segundo
Ftcxs
et al.,2OO2, este mecanismo de aparente desaparecimento dos isolados do grupoA
pode envolver os efeitos de temperatura e/ou a resistência ontogénica das folhas.As estratégias de sobrevivência dos isolados do grupo
A
eB
parecem ter maiores consequências para o subsequente desenvolvimento da doença e sua severidade. O grau de severidade da doença é mais elevada, em folhas ou bagos, nas vinhas em que a frequênciados isolados
do grupo
B
aumenta mais rapidamente, sugerindo uma associação entre onível
doençae a
frequência dos grupos genéticos,no início do
período vegetativo daplanta.
Os
danos encontrados são maiores naquelesem
quea
epidemia começou comisolados do grupo B
(MoNrennY
et a1.,2008).Revisão
3.
Ciclo Biológico
E.
necator pode hibernar comohifas
no
interior
dos gomos dormentesou
como cleistotecas na superfície dos sarmentos da cepa e nos restos de material vegetal caídos nosolo, folhas
e
restosde
podas.No
Inverno
ou em
climas tropicais,
os
micélios
e
osconídios
podem
sobreviver
a
uma
ou
outra
estaçãonos
tecidos
dos
órgãos
verdespresentes na planta
(GormN
et a1.,2001).O
fungo E. necator pode reproduzir-se de duas maneiras diferentes:via
sexuada evia assexuada.
por via
sexuada:Nas regiões vitícolas
em
que
as
cleistotecas
(forma
deconservação
Invemal)
são uma fonte importante de inoculoprimário,
podem-se observaras
primeiras
infecções como colóniasindividuais na
superfície dasfolhas
que crescem envoltosno
ritidoma.
Os rebentos que se desenvolvem envoltosno
ritidoma, isto
é, os rebentosdo
pé da videira
vulgarmente chamadosde
ladrões,são
frequentemente os primeiros a infectar-se, presumivelmente porque estão perto das cleistotecas que ficaramagarradas
às
fendas
do
ritidoma, depois de terem sido
arrastadasdesde
as
folhas, sannentos e pedicéolos dos cachos das uvas, por chuvas outonais (GOnfEN etal',2001)'
Na
Primavera,
com
temperaturas
superiores
a
1l"C
http : //membres. multimania. frlipmvigne/IVlal adies/oidium.htm,(s.e.,
a
partir
do
site:2010),
as
cleistotecas rasgam-seao
serem humedecidaspela
chuvae
libertam os
ascósporos (GOneENet
al',
2001)
responsáveis
pelas
infecções
primárias
(s.e.,
a
partir
do
site:http://membres.multimania.frlipmvigne/lvlaladies/oidium.htm,
2010).
Estesgerminam
e infectam os tecidos verdes, formando colónias que produzem conídios como disseminação secundária(GoureN
et al-,2001).por via
assexuada:No
abrolhamento, os gomos são infectados duranteo início
doperíodo
de
crescimento.O
fungo
desenvolve-se dentrodo
gomo, onde
permanece emestado latente
no interior
das escamasdo
gomo até
à
estação seguinte. Pouco tempodepois do abrolhamento, o fungo é reactivado e cobre o rebento
com micélio
branco. Osconídios produzem-se abundantemente nestes
jovens
rebentos infectados, chamados de rebentos indicadores ('drapeaux') e são rapidamente disseminados pelo vento e pela água para os órgãos vizinhos (GorGEN etal-,2001).
A
figura
seguinte(Frc.
II.3)
esquematizaa
interacçãodo
desenvolvimento dofungo E. necator ao longo da sua epidemia, com a planta
-
videira.Revisão Bihlioprátlca
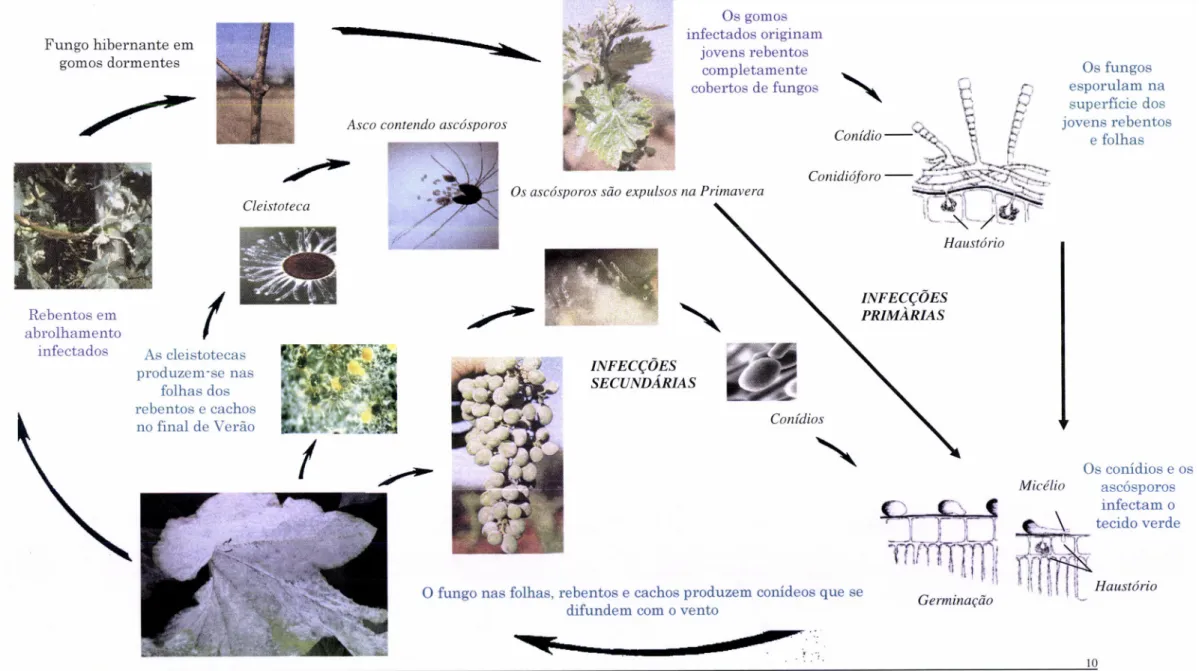
Fig. II.3: Ciclo Biológico do Oídio (adaptado de AGRIos, 2005; GounEN et aI.,2001;
Sllve,
2008 e s.A., 1998);Fungo hibernante em gomos dormentes Os gomos infectados originam jovens rebentos completamente cobertos de fungos Os fungos esporulam na superfície dos jovens rebentos e folhas
/r->
Asc o contendo asc ó s poro s
-?
/-Conídio
Conidióforo
-Os ascósporos são expulsos na Primavera
CLeistoteca It l1 Rebentos em abrolhamento infectados As cleistotecas
/
produzem-se nas folhas dos rebentos e cachos no final de Verão fi'tFECÇÕES PRIMARIAS Haustório INFECÇÕES SECUNDARIASffi
Conídios/
\
Micélio Os conídios e os ascósporos infectam o tecido verde Haustório O fungo nas folhas, rebentos e cachos produzem conídeos que sedifundem com o vento
§-)-rffi'\
Germinação o ):h&;";i
I
\
E
t ^Iir.
Revisão iosráÍica
Na
maioria das regiões vitícolas,
o
fungo produz
nas suas estruturas sexuals,cleistotecas
na
superfície
dos
órgãos vegetais infectados,folhas,
pâmpanose
ramos,durante a
última
parte do período de crescimento vegetativo (GounEN et a1.,2001 e s.e., 1998). Nos trópicos, onde a vegetação é contínua, o micélio permanece activo ao longo doano
e
é
produzido sem
interrupção
(s.4.
a
partir
da
lnternet:
http://www.muller-koeberle.frlodium-2.htm, 20 I 0).
4.
Sintomas
eDesenvolvimento
do
Oídio
na
Videira
Os sintomas sobre os diversos órgão da planta varia em função do período
do
anoe portanto da fase do estado vegetativo da videira.
l)
Jovens rebentos de gomos infectados no ano anterior ('drapeaux');Todas as superfícies das pequenas
folhas
são sensíveis à infecção.O jovem
rebento apresenta
um
aspecto
branco
acinzentado
pulverulento
quecorresponde
à
presença
do
micélio.
As
folhas
jovens,
ainda
emdesenvolvimento, quando infectadas
ficam
em tensão, atrofiam, deformam-se,e o
crescimentodos
ramosé
retardado(Frc.
II.4)
(S.a. apartir
da
Internet: http:lI
membres.multimania.frl, 20 1 0).FIG.II.4
-
Foto de um 'draPeau' comsintomatologia de Oídio (Foro: YvoN BUcARET);
2)
Inflorescências;ll
t
"x
r--Revisão hlioqráfica
Apresentam um aspecto seco e pulverulento com um pó branco
fino
(FIC.II.5),
oleoso
ao toque,
transformando-Se rapidamenteem
acinzentado,com
umgranulado.
Ao
microscópio,
destacam-sefacilmente
os
conidióforos
e
sãovisíveis
inúmeros
conídios
(s.e.
a
partir
da
[nternet:
http://www.muller-koeberle.frlodium-2.htm, 20 1 0).
FIc.II.5
-
Foto de uma inflorescência com sintomatologia de Oídio (FoTo: a paftir do site: http://www.muller-koeberle'fr/odium-2.htm, 2010);3)
Nas Folhas;A
presença demicélio
com as estruturas reprodutivas assexuadas conidióforose
conídios
na
superfície
do
tecido
hospedeiro, confere
um
aspecto
branco acinzentado pulverulento (Frc.II.6). Ambas as superfícies das folhas são sensíveis à infecção. Por vezes na página superior das folhas infectadas aparecem manchascloróticas brilhantes parecidas às vulgarmente chamadas "manchas
de
óleo"
domíldio
(GoHrENet
al.,
2001).No final do
Verão
as estruturasde
resistência, cleistotecas, começam a colonizar as folhas infectadas (FIc.II.7).l2
L
Bihlioç,ráÍir:a
Frc. II.6 e 7
-
Fotos de páginas superiores de folhas de videira. (6) deformada pelo ataque deOídio; (7) com formação de cleistotecas no final do Verão (FOTOS: YVON BuCAnpr);
4)
Nos Bagos;Os
bagos são sensíveisà
infecção
(Frc. II.10)
atéque
o
seu conteúdo emaçúcares
seja
aproximadamentede
\qo,
podendo
no
caso
de
infecções
já
estabelecidas, continuar a produzir-se esporos até atingiros
l5%o (GouneNl)
tal.,2001).
No
estadofenológico bago de
ervilha (Frc. II.8),
quando contaminados, os pequenos bagos apresentam rugas, murcham e geralmente caem perdendo-se todaa
colheita
(s.a.
a
partir
da Internet:
http://www.muller-koeberle.frlodium-2.htm,2010).
Se os
bagos são infectados antesde
alcançaro
seu tamanhodefinitivo,
ascélulas epidérmicas moÍrem, impedindo o crescimento da epiderme. Por seu lado,
como
a
polpa
contínuaa
desenvolver-se,a
película
rasga-sedevido
à
pressãointerna (Frc.
II.9).
Os bagoscom
películas quebradas desidratamou
apodrecem sendo frequentemente infectados pelo fungo B. cinerea (GOuurN et aL.,2001). Umataque provocado pelo fungo B. cinerea pode também ocasionar uma grande perda
na colheita. Para além disso, quando aparece
por
alturado pintor,
provoca umadiminuição
na
qualidadeos futuros
vinhos devido
à
degradaçãodas
matériascorantes, destruição
da
película
que
contém
os
precursores responsáveis pelaqualidade aromática, aumenta
a fixação do
SOznos vinhos
e
aumenta actdezvolátil
(s.e.,
1998).Na
fasedo pintor,
quandoos
bagos das castastintas
são infectadospor
E.necator, não
adquirirem
a
cor
que lhes
é
própria.
Na
superfície
dos
bagosinfectados, podem observar-se cicatrizes que adquirem
um
aspecto emforma
del3
r
t {6)L
F,,rl
'tà
Lt
L l -,Revisão Bibliosráfica
malha.
No
casode uva
de mesa, esta torna-se incomerçialtzâvel,e
na uva
paravinho vai originar características gustativas desagradáveis (GouenN et
aI.,2001).
Frc(s). II.8,9 e l0
-
Fotos de bagos de uvas com sintomatologia de Oídio.; (8) ao estado fenológico de bago de ervilha; (9) ruptura dos bagos; (10) ao estado fenológico de fecho dos cachos (Foros: YvoNBucanrr);
5)
Nos Ramos;Os pecíolos e os pedicéolos do ramo são sensíveis à infecção durante o período
de crescimento vegetativo (GouerN et
a|.,2001).
Durante
a
Primavera,os
ramos são parasitados principalmentepor
pequenasmanchas
brancas
que
vão
crescer
com
a
extensãodo
micélio,
tornando-se confluentese
formando grandes manchas que cobrem toda a superfíciedo
ramo, tendo um aspecto cinzento azulado ou cinza (FIG.II.11)
(s.4. apartir
da lnternet:http://www.muller-koeberle.frlodium_2.htm, 2010). Uma vez infectados tornam-se
quebradiços
e
podem
facilmente
partir-se
à
medida
que
decorre
o
períodovegetativo (GoHenN et a1.,2001).
A
infecção dos ramos antesou
imediatamente após a floração pode originar uma perda considerável na colheita.A
parte superior dos ramos pode ser totalmente contaminada e as folhas jovens tornam-se atrofiadas (s.e. a partir da Internet: http://www.muller-koeberle.frlodium-2.htm, 2010).t4
L
I
(e)
Revisão Bibliosráfica
Ftc.II.11-
Foto de um ramo com sintomatologia de Oídio naPrimavera (FoTo: a partir do site:
http ://www. muller-koeberle. frlodium_2. htm, 20 I 0) ;
Antes
do
atempamento,
nos
pâmpanos
infectados, aprecem
manchaspulverulentas
de
cor
castanhaescuro
a
negras(Ftc. II.12), que, mais
tarde, aparecem castanho arroxeadasna
superfície
dos
sarmentosdurante
a
fase
derepouso vegetativo
(Frc.II.13).
Neste período apenas se podem encontrar resíduosde fragmentos de hifas colapsadas (GouEEN e/
al.,2O0l).
Os
ataquesfortes originam
um
mau
atempamentodos
sarmentos,com
aconsequente
diminuição da
acumulaçãode
reservas nos gomos (GoHnnNet
al.,2O0l e
s.4.,
1998). Os gomos dormentes destes ramos contôm em sio micélio
emestado latente,
que se
irá
desenvolverna
Primavera seguinte (s..A.a partir
da Internet : http ://www. muller-koeberle. frlodium-2. htm, 20 1 0).Frc.II.12