ORALOMA DA PERI-IMPLANTITE
Dissertação apresentada à Universidade Católica Portuguesa
para obtenção do grau de mestre em Medicina Dentária
Por:
Rafaela Carina de Sousa Albino
ORALOMA DA PERI-IMPLANTITE
Dissertação apresentada à Universidade Católica Portuguesa
para obtenção do grau de mestre em Medicina Dentária
Por:
Rafaela Carina de Sousa Albino
Orientador: Prof. Doutor Nuno Rosa
Co-Orientadores: Prof. Doutora Marlene Barros
Prof. Doutor André Correia
”The best thing in life is to go ahead with all your plans and your dreams, to embrace life and to live everyday with passion, to lose and still keep the faith and to win while being grateful. All of this because the world belongs to those who dare to go after what they want. And because life is really too short to be insignificant.”
Agradecimentos
Ao Professor Doutor Nuno Rosa,
Orientador e pec¸a fundamental para a viabilidade deste projeto, cujo exemplo de dedicac¸ ˜ao suscitou em mim o gosto pela investigac¸ ˜ao. Obrigada por todo o apoio, motivac¸ ˜ao, disponibilidade e conhecimentos transmitidos ao longo deste processo.
`
A Professora Doutora Marlene Barros,
Pelos valiosos conhecimentos transmitidos ao longo da realizac¸ ˜ao deste trabalho.
Ao Professor Doutor Andr ´e Correia,
Pelo exemplo de profissionalismo, compet ˆencia e trabalho ´arduo, que me incita a querer fazer mais e melhor.
`
A minha m ˜ae,
Pelo amor incondicional, compreens ˜ao inesgot ´avel e por ser o meu grande pilar, principalmente nos dias mais dif´ıceis. A tua forc¸a e determinac¸ ˜ao s ˜ao uma inspirac¸ ˜ao para mim.
Ao meu pai,
Pela determinac¸ ˜ao, perseveranc¸a e coragem que sempre incutiu em mim, e pelo amor incondicional que perpetua. Sei que estar ´as orgulhoso, onde quer que estejas.
Ao Jorge,
Por todo o amor, carinho e compreens ˜ao, e por estares sempre l ´a, mesmo quando tudo falha. N ˜ao h ´a palavras para descrever o quanto o teu apoio e ajuda foram inestim ´aveis ao longo deste processo. Obrigada por colorires a minha vida de todas as cores.
`
A Sofia,
Companheira desde o primeiro dia at ´e ao ´ultimo e agora, bin ´omia para a vida. Obrigada por todas as aventuras vividas e momentos partilhados. Se estes 5 anos
foram t ˜ao especiais, em grande parte a ti o devo.
Ao Andr ´e,
Pela amizade, apoio e por todas as gargalhadas. Porque h ´a amigos que se tornam fam´ılia.
` A Rita,
Pelo companheirismo e amizade, e por tornar os dias de trabalho muito mais leves e divertidos.
Ao Lu´ıs e ao Andr ´e,
Pela amizade e momentos partilhados.
A todos os colegas, professores e funcion ´arios,
Resumo
A reabilitac¸ ˜ao de zonas ed ˆentulas pode ser efetuada com recurso a pr ´oteses dent ´arias implanto-suportadas. Estas proporcionam ao paciente uma situac¸ ˜ao cl´ınica mais se-melhante `a dentic¸ ˜ao natural, traduzindo-se numa melhor qualidade de vida.
A evoluc¸ ˜ao da implantologia, associada a motivos socioecon ´omicos, tem propici-ado um aumento do n ´umero de implantes colocpropici-ados nas ´ultimas tr ˆes d ´ecadas. Este facto, associado ao maior tempo de perman ˆencia in vivo, tem favorecido um aumento de casos reportados de peri-implantite. Esta ´e definida como uma inflamac¸ ˜ao dos te-cidos peri-implantares com perda de osso de suporte, resultando em ´ultima an ´alise na falha da soluc¸ ˜ao prot ´etica.
Deste modo, a presente dissertac¸ ˜ao prop ˆos-se a atualizar a informac¸ ˜ao molecular em peri-implantite, atrav ´es da identificac¸ ˜ao e esclarecimento dos mecanismos mole-culares com import ˆancia no estabelecimento e progress ˜ao da doenc¸a.
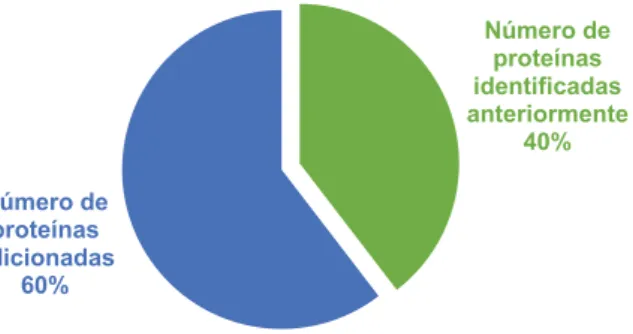
Esta investigac¸ ˜ao permitiu acrescentar 58 novas prote´ınas ao OralOma da peri-implantite, juntando-se `as 38 previamente catalogadas. A an ´alise funcional permitiu depreender um aumento da interfer ˆencia de determinadas prote´ınas. Em particu-lar, a sobre-regulac¸ ˜ao da IL1β e MPO e a sub-regulac¸ ˜ao da IL-10 foram apontados como marcadores inflamat ´orios; um aumento de MMP8 parece sugerir o processo de destruic¸ ˜ao do tecido conjuntivo e a sobre-regulac¸ ˜ao do RANK, RANKL e TNF-α, bem como a sub-regulac¸ ˜ao da OPG, s ˜ao promissores biomarcadores de remodelac¸ ˜ao ´ossea. Contudo, para que seja poss´ıvel a utilizac¸ ˜ao destes no futuro, ´e necess ´ario o estabelecimento de um protocolo estandardizado de recolha e an ´alise de PICF e saliva, visando a caracterizac¸ ˜ao dos valores padr ˜ao para cada subst ˆancia, tal como existe atualmente para o sangue.
Espera-se que os dados gerados neste trabalho possam contribuir para a identificac¸ ˜ao de prote´ınas e mecanismos moleculares que possibilitem o diagn ´ostico precoce, a determinac¸ ˜ao da suscetibilidade do doente e a determinac¸ ˜ao do progn ´ostico dos im-plantes afetados. Este conhecimento poder ´a ajudar a orientar abordagens de trata-mento personalizadas e avaliar o sucesso da terap ˆeutica.
Palavras-chave: ”Peri-implantitis”, ”biomarkers”, ”proteome”, ”bone disease”, ”den-tal implants”
Abstract
Rehabilitation of edentulous areas can be performed using implants-supported den-ture prostheses. These provide the patient with a clinical situation more similar to the natural dentition, improving their quality of life.
The evolution of implantology, associated with socioeconomic reasons, has led to an increase in the number of implants placed in the last three decades. This fact, asso-ciated to the longer in vivo maintenance, has favoured the incidence of peri-implantitis. This is defined as an inflammation of the peri-implant tissues with loss of supporting bone, ultimately resulting in failure of the prosthetic solution.
Accordingly, the present dissertation proposed to update the molecular information in peri-implantitis, through the identification and clarification of the molecular mecha-nisms with impact in the establishment and progression of the disease.
This investigation allowed to add 58 new proteins to the OralOma of peri-implantitis, joining the 38 previously catalogued. Functional analysis showed an increase in the interference of certain proteins. In particular, over-regulation of IL1β and MPO and down-regulation of IL10 were indicated as inflammatory markers; an increase in MMP8 seems to suggest the process of connective tissue destruction; and over-regulation of RANK, RANKL and TNF-α, as well as the down-regulation of OPG, are promising biomarkers of bone remodelling. However, for the possible application of these in the future, it is necessary to establish a standard protocol for the collection and analysis of PICF and saliva, in order to characterize the pattern values for each substance, as it currently exists for blood.
It is hoped that the data generated in this work may contribute to the identification of proteins and molecular mechanisms that allow the early diagnosis, determination of the patient’s susceptibility and determination of the prognosis of the affected implants. This knowledge can help guide personalized treatment approaches and evaluate the success of therapy.
Keywords: ”Peri-implantitis”, ”biomarkers”, ”proteome”, ”bone disease”, ”dental implants”
NOTA PR ´
EVIA
Nesta dissertac¸ ˜ao aparecem, por vezes, express ˜oes em l´ıngua Inglesa, escritas em it ´alico, de modo a manter a uniformizac¸ ˜ao universal dos termos usados para descre-ver conceitos biol ´ogicos, entre culturas e l´ınguas diferentes. A traduc¸ ˜ao destas ex-press ˜oes poderia distorcer o seu significado original e alterar o conceito biol ´ogico que se pretende identificar.
´Indice
Agradecimentos . . . vii
Resumo . . . ix
Abstract . . . xi
Lista de Figuras . . . xix
Lista de Tabelas . . . xxi
Lista de Abreviaturas . . . xxv
1 Introduc¸ ˜ao 1 1.1 Implantologia . . . 1
1.1.1 Contextualizac¸ ˜ao hist ´orica . . . 1
1.1.2 Implantologia contempor ˆanea . . . 2
1.1.3 Implante versus dente natural . . . 3
1.2 Introduc¸ ˜ao `as doenc¸as peri-implantares . . . 6
1.3 Peri-implantite . . . 7
1.3.1 Definic¸ ˜ao/Diagn ´ostico . . . 7
1.3.2 Epidemiologia . . . 8
1.3.3 Fisiopatologia . . . 9
1.3.4 Fatores de risco . . . 11
1.3.5 Tratamento . . . 14
1.4 Flu´ıdos orais enquanto ferramentas de diagn ´osico . . . 15
1.4.1 Flu´ıdo crevivular . . . 15
1.4.2 Saliva . . . 16
1.5 Biomarcadores em doenc¸a peri-implantar . . . 17
1.5.1 Mol ´eculas envolvidas na resposta inflamat ´oria . . . 18
1.5.2 Mol ´eculas envolvidas na remodelac¸ ˜ao dos tecidos de suporte . 21 1.6 Objetivos . . . 25
2 Materiais e M ´etodos 27
2.1 Estrat ´egias de Pesquisa . . . 27
2.2 Anotac¸ ˜ao manual dos dados relativos `as prote´ınas presentes e altera-das em Peri-implantite . . . 28
2.2.1 Identificac¸ ˜ao da prote´ına . . . 29
2.2.2 Proveni ˆencia da amostra . . . 30
2.2.3 Relac¸ ˜ao com os estados de sa ´ude e doenc¸a . . . 30
2.2.4 Caracterizac¸ ˜ao dos indiv´ıduos da amostra . . . 32
2.2.5 M ´etodos de recolha e an ´alise da amostra . . . 32
2.2.6 Caracterizac¸ ˜ao do estudo . . . 33
2.2.7 Outras informac¸ ˜oes . . . 33
2.3 An ´alise da proveni ˆencia das amostras . . . 33
2.4 Caracterizac¸ ˜ao funcional . . . 34
2.4.1 PANTHER (Protein ANalysis THrough Evolutionary Relationships) 34 2.5 Comparac¸ ˜ao com o OralOma normal – Diferenc¸a fracional . . . 35
3 Resultados e Discuss ˜ao 37 3.1 Catalogac¸ ˜ao das prote´ınas . . . 37
3.1.1 Atualizac¸ ˜ao do OralOma . . . 37
3.1.2 Origem das prote´ınas identificadas . . . 43
3.1.3 Relac¸ ˜ao com os estados de sa ´ude e doenc¸a . . . 44
3.1.4 Caracterizac¸ ˜ao dos indiv´ıduos da amostra . . . 48
3.1.5 M ´etodos de recolha e an ´alise da amostra . . . 49
3.2 Caracterizac¸ ˜ao funcional . . . 50
3.2.1 Caracterizac¸ ˜ao funcional das prote´ınas humanas envolvidas em peri-implantite . . . 50
3.3 Comparac¸ ˜ao com o OralOma normal . . . 55
3.3.1 Func¸ ˜oes moleculares das prote´ınas envolvidas em peri-implantite 55 3.3.2 Procesos biol ´ogicos das prote´ınas envolvidas em peri-implantite 56 3.3.3 Vias de sinalizac¸ ˜ao das prote´ınas envolvidas em peri-implantite, com origem no flu´ıdo crevicular . . . 60
Lista de Figuras
1.1 Comparac¸ ˜ao entre as estruturas de suporte dos implantes e dentes na-turais. Adaptado de Carl E. Misch. Dental Implants Prosthetics (2015)1
. . . 5 2.1 Cabec¸alhos que permitem a organizac¸ ˜ao da informac¸ ˜ao recolhida atrav ´es
de estudos de prote ´omica da cavidade oral (prote´ınas identificadas na PI anotadas manualmente) numa tabela Microsoft Excel 2013. . . 29 2.2 Cabec¸alhos da tabela Microsoft Excel 2013 relativos `a identificac¸ ˜ao das
prote´ınas da PI anotadas manualmente . . . 29 2.3 Cabec¸alhos da tabela Microsoft Excel 2013 relativos `a proveni ˆencia das
prote´ınas da PI anotadas manualmente. . . 30 2.4 Cabec¸alhos da tabela Microsoft Excel 2013 relativos `a relac¸ ˜ao das prote´ınas
da PI anotadas com os estados de sa ´ude e doenc¸a. . . 31 2.5 Cabec¸alhos da tabela Microsoft Excel 2013 relativos `a caracterizac¸ ˜ao
dos indiv´ıduos dadores da amostra. . . 32 2.6 Cabec¸alhos da tabela Microsoft Excel 2013 referentes aos m ´etodos de
recolha e an ´alise das amostras. . . 32 2.7 Cabec¸alhos da tabela Microsoft Excel 2013 relativos `a caracterizac¸ ˜ao
dos estudos analisados. . . 33 2.8 Cabec¸alhos da tabela Microsoft Excel 2013 relativos `as caracter´ısticas
especiais das prote´ınas da PI. . . 33 3.1 Total de prote´ınas identificadas na base de dados SalivaTecDB para a
PI, at ´e `a data da presente dissertac¸ ˜ao. . . 38 3.2 Total de prote´ınas identificadas na base de dados SalivaTecDB para a
PI, at ´e `a data da presente dissertac¸ ˜ao (continuac¸ ˜ao). . . 39 3.3 Total de prote´ınas identificadas na base de dados SalivaTecDB para a
3.4 Total de prote´ınas identificadas na base de dados SalivaTecDB para a PI, at ´e `a data da presente dissertac¸ ˜ao (continuac¸ ˜ao). . . 41 3.5 Total de prote´ınas identificadas na base de dados SalivaTecDB para a
PI, at ´e `a data da presente dissertac¸ ˜ao (continuac¸ ˜ao). . . 42 3.6 Total de prote´ınas identificadas na base de dados SalivaTecDB para a
Lista de Tabelas
1.1 Datada de 600 DC, esta mand´ıbula foi encontrada na Am ´erica Central. Os Incas implantaram nesta tr ˆes incisivos esculpidos a partir de con-chas do mar. A formac¸ ˜ao de c ´alculos sobre estes tr ˆes implantes indica que esta pr ´atica n ˜ao se tratou de uma cerim ´onia f ´unebre, mas sim uma substituic¸ ˜ao dent ´aria fixa, funcional e est ´etica. (Cortesia do Peabody Museum of Archaeology and Ethnology, Harvard University). Imagem adaptada de Carl E. Mish (2015)1. . . . 2
1.2 Mecanismos inflamat ´orios que conduzem `a perda ´ossea na peri-implantite. Imagem adaptada de Hajishengallis G. (2014)27 . . . . . 10
1.3 OPG/RANK/RANKL como efetores comuns dos sistemas ´osseo, imu-nol ´ogico e vascular. Estes s ˜ao produzidos seletivamente por numerosos tipos de c ´elulas e uma variedade de tecidos tais como linf ´ocitos, oste-oblastos e c ´elulas endoteliais. O RANKL induz fortemente osteoclas-tog ´enese e, em seguida, reabsorc¸ ˜ao ´ossea atrav ´es de sua ligac¸ ˜ao ao RANK. A OPG inibe a oste ´olise e bloqueia a interac¸ ˜ao RANKL/RANK. Embora a tr´ıade OPG/RANK/RANKL seja o principal regulador do ciclo aposic¸ ˜ao/reabsorc¸ ˜ao ´ossea, existem outros controlos de diferenciac¸ ˜ao osteocl ´astica, como TNF-α e IL-1, capazes de modular as atividades biol ´ogicas desta tr´ıade. Imagem adaptada de Theoleyre S. et al (2004)69
. . . 23 2.1 Esquematizac¸ ˜ao dos objetivos trac¸ados e da metodologia seguida para
os alcanc¸ar. . . 27 2.2 Exemplo ilustrativo da visualizac¸ ˜ao do site da Uniprot durante a atribuic¸ ˜ao
do c ´odigo UniProtKB AC, nome, nome do gene e organismo a uma de-terminada prote´ına. . . 30
2.3 Exemplo ilustrativo da visualizac¸ ˜ao do site da Uniprot durante a atribuic¸ ˜ao do c ´odigo UniProtKB AC, nome, nome do gene e organismo a uma de-terminada prote´ına. . . 35 3.1 N ´umero de prote´ınas introduzidas neste trabalho comparativamente com
o n ´umero de prote´ınas previamente inseridas. . . 37 3.2 Diagrama de Venn obtido pelo programa Venny, representando a
pro-veni ˆencia das prote´ınas catalogadas. . . 44 3.3 Gr ´afico representativo da distribuic¸ ˜ao de prote´ınas com origem no flu´ıdo
crevicular, obtido pelo PANTHER, para a ontologia ’Molecular Function’. 50 3.4 Gr ´afico representativo da distribuic¸ ˜ao de prote´ınas com origem no flu´ıdo
crevicular, obtido pelo PANTHER, para a ontologia ’Biological Process’. 51 3.5 Gr ´afico representativo da distribuic¸ ˜ao de prote´ınas com origem no flu´ıdo
crevicular, obtido pelo PANTHER, anotadas no n´ıvel 1 da ontologia ’Bi-ological Process’ na func¸ ˜ao Immune System Process. . . 52 3.6 Gr ´afico representativo da distribuic¸ ˜ao de prote´ınas com origem no flu´ıdo
crevicular, obtido pelo PANTHER, anotadas no n´ıvel 2 da ontologia ’Bi-ological Process’ na func¸ ˜ao Immune Response. . . 52 3.7 Gr ´afico representativo da distribuic¸ ˜ao de prote´ınas com origem no flu´ıdo
crevicular, obtido pelo PANTHER, anotadas no n´ıvel 1 da ontologia ’Bi-ological Process’ na func¸ ˜ao Response to stimulus. . . 53 3.8 Gr ´afico representativo da distribuic¸ ˜ao de prote´ınas com origem no flu´ıdo
crevicular, obtido pelo PANTHER, para a ontologia ’Pathways’. . . 54 3.9 Distribuic¸ ˜ao das prote´ınas com origem em flu´ıdo crevicular e saliva
to-tal de pacientes com PI, segundo as func¸ ˜oes moleculares em que in-terv ´em, atrav ´es da ferramenta PANTHER. A func¸ ˜ao molecular que apre-senta alterac¸ ˜ao estatisticamente significativa em relac¸ ˜ao ao OralOma normal encontram-se assinaladas com asterisco. . . 56 3.10 Distribuic¸ ˜ao das prote´ınas com origem em flu´ıdo crevicular e saliva
to-tal de pacientes com PI, segundo os processos biol ´ogicos em que in-terv ´em, atrav ´es da ferramenta PANTHER. Os processos biol ´ogicos que apresentam alterac¸ ˜oes estatisticamente significativas em relac¸ ˜ao ao Ora-lOma normal est ˜ao assinaladas com asterisco. . . 57
3.11 Distribuic¸ ˜ao das prote´ınas com origem em flu´ıdo crevicular e saliva to-tal de pacientes com PI, segundo as vias de sinalizac¸ ˜ao em que in-terv ´em, atrav ´es da ferramenta PANTHER. As vias de sinalizac¸ ˜ao que apresentam alterac¸ ˜oes estatisticamente significativas est ˜ao assinaladas com asterisco. . . 61
Lista de Abreviaturas
A2M – Alpha 2-Macroglobulin (Macroglobulina Alfa-2).
BOP – Bleeding on Probing (Sangramento `a Sondagem Suave).
CSF2 – Granulocyte-Macrophage Colony-Stimulating Factor (Fator Estimulador de
Col ´onias de Granul ´ocitos e Macr ´ofagos).
EBI – European Bioinformatics Institute.
ELANE – Neutrophil Elastase (Elastase Neutrof´ılica).
GCF – Gingival Crevicular Fluid (Fluido Crevicular Gengival).
ICT – Inflammatory Cell Infiltrate (Infiltrado Celular Inflamat ´orio).
IL – Interleukin (Interleucina).
IL1RN – Interleukin-1 Receptor Antagonist Protein (Prote´ına Antagonista do Receptor
de Interleucina-1).
LPS – Lipopolysaccharide (Lipopolissacar´ıdeo).
MeSH – Medical Subject Headings.
MMP – Matrix Metalloproteinase (Metaloproteinase de Matriz).
MPO – Myeloperoxidase (Mieloperoxidase).
OPG – Osteoprotegerin (Osteoprotegerina).
PANTHER – Protein Analysis Through Evolutionary Relationships.
PI – Peri-Implantite.
PICF – Peri-Implant Crevicular Fluid (Flu´ıdo Crevicular Peri-Implantar).
PIR – Protein Information Resource.
PMN – Polymorphonucleases (Polimorfonucleases).
PPD – Probing Pocket Depth (Aumento da Profundidade de Sondagem).
RANK – Receptor Activator of Nuclear Factor kappa-B (Fator Nuclear de Ativac¸ ˜ao do
Receptor kappa-B).
RANKL – Receptor Activator of Nuclear Factor kappa-B Ligand (Ligando do Fator
Nuclear de Ativac¸ ˜ao do Receptor kappa-B).
rCAL – Relative Clinical Attachment Level (N´ıvel Relativo de Inserc¸ ˜ao Cl´ınica).
SIB – Swiss Institute of Bioinformatics.
TGFb1 – Transforming Growth Factor beta-1 (Fator de Transformac¸ ˜ao de Crescimento
beta-1).
Th – T-helper .
TIMP – Tissue Inhibitor of Metalloproteinases (Inibidor Tecidual das Metaloproteinases de Matriz).
TNF – Tumor Necrosis Factor .
UniProt – Universal Protein Resource.
VEGF – Vascular Endothelial Growth Factor (Fator de Crescimento Endotelial
Cap´ıtulo 1
Introduc¸ ˜ao
1.1
Implantologia
1.1.1
Contextualizac¸ ˜ao hist ´orica
A implantologia ´e a segunda mais antiga disciplina da odontologia, sendo a primeira a cirurgia oral. As primeiras refer ˆencias remontam a milhares de anos e abrangem v ´arias das grandes civilizac¸ ˜oes ancestrais. Como exemplo pioneiro, h ´a cerca de 4000 anos, os Chineses esculpiram varas de bambu em forma de cavilhas e introduziram-nas no osso para substituic¸ ˜ao fixa dos dentes em falta. Mais tarde e de forma seme-lhante, os Eg´ıpcios reinventaram o design do mesmo encavilhamento usando metais preciosos. Seguindo pela linha temporal, foram encontradas evid ˆencias datadas de 600 D.C, que relatam a substituic¸ ˜ao de dentes perdidos por conchas de mar incrusta-das contra o osso por parte dos Incas na Am ´erica Central (ver Figura 1.1). Por outras palavras, a hist ´oria demonstra claramente que o Homem desde sempre procurou re-estabelecer as zonas ed ˆentulas com soluc¸ ˜oes fixas, mantendo a forma aproximada de um dente natural1.
Maggiolo introduziu a hist ´oria mais recente da implantologia em 1809 com o uso do ouro na forma da raiz de um dente. Por sua vez, em 1887, Harris relatou o uso de dentes feitos de porcelana, cujo interior teria um revestimento de platina. Muitos materiais foram testados e, no in´ıcio de 1900, Lambotte fabricou implantes de alum´ınio, prata, lat ˜ao, cobre vermelho, magn ´esio, ouro, ac¸o banhado a ouro e n´ıquel, tendo identificado a corros ˜ao de v ´arios destes metais nos tecidos orais, relacionada com a ac¸ ˜ao eletrol´ıtica1.
Figura 1.1: Datada de 600 DC, esta mand´ıbula foi encontrada na Am ´erica Central. Os Incas implantaram nesta tr ˆes incisivos esculpidos a partir de conchas do mar. A formac¸ ˜ao de c ´alculos sobre estes tr ˆes implantes indica que esta pr ´atica n ˜ao se tratou de uma cerim ´onia f ´unebre, mas sim uma substituic¸ ˜ao dent ´aria fixa, funcional e est ´etica. (Cortesia do Peabody Museum of Archaeology and Ethnology, Harvard University). Imagem adaptada de Carl E. Mish (2015)1.
Mais recentemente, em 1965, iniciaram-se os estudos cl´ınicos de implantes em seres humanos com a filosofia Br ˚anemark, tendo sido seguidos durante 10 anos. O termo osteointegrac¸ ˜ao foi introduzido por Br ˚anemark, tendo sido definido por este como o contato direto entre o osso e a superf´ıcie de um implante ao n´ıvel de microsco-pia ´optica de ampliac¸ ˜ao. A sua documentac¸ ˜ao de casos cl´ınicos anteriores, pesquisa de cirurgia e fisiologia ´ossea, cicatrizac¸ ˜ao de tecidos moles e duros e aplicac¸ ˜oes res-tauradoras constitu´ıram um trabalho sem precedentes1 .
1.1.2
Implantologia contempor ˆanea
A reabilitac¸ ˜ao de zonas desdentadas nos maxilares, sejam parciais ou totais, pode ser efetuada com recurso a pr ´oteses dent ´arias implanto-suportadas. Este tipo de pr ´oteses proporciona ao paciente uma situac¸ ˜ao cl´ınica mais semelhante `a presenc¸a de dentes naturais, o que naturalmente se traduz numa melhor qualidade de vida para o paciente. Paralelamente, os m ´edicos dentistas devem dispor de todas as suas habilidades cl´ınicas para ajudar os pacientes a combater o edentulismo pelo que, a utilizac¸ ˜ao de implantes dent ´arios tem vindo, gradualmente, a impor-se no mundo da Medicina Dent ´aria. Desta forma, problemas dent ´arios que historicamente se verifica-vam mais complexos podem hoje em dia ser solucionados de forma eficaz com este
tipo de tratamento2, 3 .
Seja atrav ´es da substituic¸ ˜ao de um ´unico dente ou da reabilitac¸ ˜ao completa das arcadas dent ´arias, os objetivos da implantologia contempor ˆanea passam por restituir ao paciente o contorno normal, func¸ ˜ao, conforto, est ´etica, fon ´etica e sa ´ude oral. O que torna a implantologia ´unica ´e a capacidade de atingir esse objetivo, independen-temente da atrofia, doenc¸a ou les ˜ao do sistema estomatogn ´atico. Como resultado de pesquisas cont´ınuas, ferramentas de diagn ´ostico, planeamento de tratamento, design de implantes, materiais e t ´ecnicas, a previsibilidade de sucesso ´e agora uma realidade para a reabilitac¸ ˜ao de muitas situac¸ ˜oes cl´ınicas desafiadoras1 .
Estima-se que o n ´umero de implantes colocados por ano por cada 10.000 pessoas seja de 230 para Israel (o maior n ´umero), 180 para a Coreia do Sul e It ´alia, 140 para Espanha e Su´ıc¸a, 60 para o Brasil, Holanda e Estados Unidos e de 20 para Taiwan e Reino Unido (o menor n ´umero1) , sendo que mais de 2 milh ˜oes de implantes dent ´arios
s ˜ao instalados em todo o mundo a cada ano4. A longo prazo, ´e esperado um aumento
de 12% a 15% na maioria dos pa´ıses que utilizam implantes dent ´arios no presente mo-mento. Este aumento adv ´em da crescente necessidade de tratamentos relacionados com a colocac¸ ˜ao de implantes e que resultam do efeito combinado de v ´arios fatores, incluindo: a esperanc¸a m ´edia de vida, a perda dent ´aria relacionada com a idade, as limitac¸ ˜oes e falhas da pr ´otese fixa, as consequ ˆencias anat ´omicas do edentulismo, o limitado desempenho de pr ´oteses remov´ıveis, aspetos psicol ´ogicos relacionados com a perda de dentes, vantagens das restaurac¸ ˜oes implanto-suportadas e com o aumento da consci ˆencia p ´ublica1 .
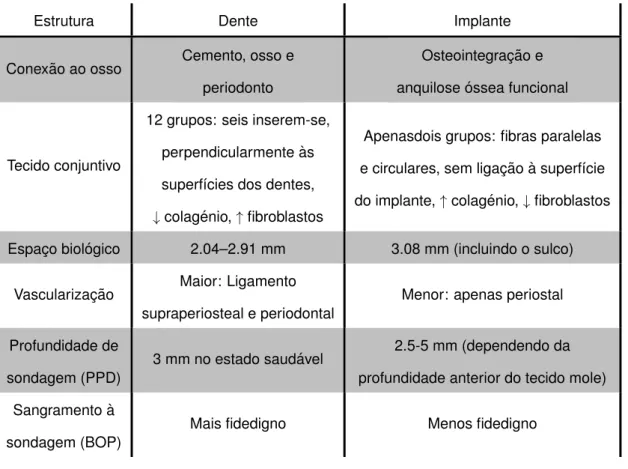
1.1.3
Implante versus dente natural
Nos dentes naturais, os tecidos moles circundantes t ˆem um espac¸o biol ´ogico m ´edio de 2.04 mm entre a profundidade do sulco e a crista do osso alveolar – 1.07 mm de tecido conjuntivo acima do osso e sobre este, 0.97 mm de epit ´elio juncional. Quer em torno de um implante como de um dente, as regi ˜oes sulculares s ˜ao semelhantes em muitos aspetos - uma margem gengival livre com epit ´elio sulcular n ˜ao queratinizado, com c ´elulas epiteliais na sua base e c ´elulas epiteliais juncionais. No entanto, visto que o dente natural tem duas regi ˜oes prim ´arias que comp ˜oem o espac¸o biol ´ogico – ao contr ´ario de um implante que apenas apresenta uma –, existe uma diferenc¸a
fun-damental. A ader ˆencia do tecido conjuntivo em torno de um dente atua como uma barreira f´ısica, impedindo a progress ˜ao bacteriana e evitando que a sonda penetre mais profundamente no sulco. O tecido em si ´e constitu´ıdo por onze grupos de fibras gengivais diferentes (dentogengivais, alveologengivais, intracapilares, transgengivais, circulares, semi-circulares, dentoperiostais,trans-septais, periosteogengivais, intercir-culares e intergengivais) e pelas fibras de Sharpey, distribu´ıdos de forma perpendicular em relac¸ ˜ao `a raiz do dente.
No que concerne aos implantes dent ´arios, temos que o seu espac¸o biol ´ogico est ´a estimado para cerca de 3.3 mm, valor que inclui a profundidade do sulco. Nestes casos, o selamento biol ´ogico ´e fornecido pelos hemidesmossomas que integram o epit ´elio juncional, sendo que a ader ˆencia da camada de mucopolissacar´ıdeos `a su-perf´ıcie do implante ´e inferior quando comparada com a de um dente natural. Para al ´em disso, as fibras encontradas no tecido conjuntivo s ˜ao periosteogengivais e apre-sentam apenas orientac¸ ˜ao paralela e circular em relac¸ ˜ao ao corpo do implante. Dito isto, uma infec¸ ˜ao peri-implantar progredir ´a com maior facilidade, comparativamente com uma infec¸ ˜ao periodontal. Adicionalmente, a interface implante-osso d ´a-se por anquilose funcional, n ˜ao existindo ligamento periodontal. Por sua vez, o ligamento pe-riodontal presente nos dentes naturais – que atua como um amortecedor viscoel ´astico –, ´e respons ´avel pela dissipac¸ ˜ao da energia proveniente das cargas oclusais e pela diminuic¸ ˜ao da transmiss ˜ao de stress ao osso subjacente. Desta forma, as forc¸as oclusais s ˜ao transmitidas muito mais rapidamente ao osso alveolar nos implantes dent ´arios, aumentando assim modo o risco de reabsorc¸ ˜ao ´ossea1 . O resumo
des-tas caracter´ısticas encontra-se na Tabela 1.1.
Contrariamente `a dentic¸ ˜ao natural, a aus ˆencia do ligamento periodontal coloca os tecidos peri-implantares em maior risco de infec¸ ˜ao e trauma, pois estes mostraram-se menos resistentes ao aumento dos n´ıveis de acumulac¸ ˜ao de placa bacteriana. Em resposta ao desafio bacteriano, esta progress ˜ao mais r ´apida e intensa da inflamac¸ ˜ao cr ´onica acaba por afetar diretamente o tecido ´osseo e, portanto, levar `a destruic¸ ˜ao da interface osso-implante. Adicionalmente, a escassez de recetores de dor nesta interface faz com que a sintomatologia da PI (PI) seja geralmente menor e dispersa5 ,
o que destaca a import ˆancia de um diagn ´ostico oportuno para prevenir essas doenc¸as ou, pelo menos, de um tratamento precoce6.
Tabela 1.1: Comparac¸ ˜ao entre as estruturas de suporte dos implantes e dentes naturais. Adap-tado de Carl E. Misch. Dental Implants Prosthetics (2015)1.
Estrutura Dente Implante
Conex ˜ao ao osso Cemento, osso e
periodonto
Osteointegrac¸ ˜ao e anquilose ´ossea funcional
Tecido conjuntivo
12 grupos: seis inserem-se, perpendicularmente `as superf´ıcies dos dentes, ↓colag ´enio, ↑ fibroblastos
Apenasdois grupos: fibras paralelas e circulares, sem ligac¸ ˜ao `a superf´ıcie do implante, ↑ colag ´enio, ↓ fibroblastos
Espac¸o biol ´ogico 2.04–2.91 mm 3.08 mm (incluindo o sulco)
Vascularizac¸ ˜ao Maior: Ligamento
supraperiosteal e periodontal
Menor: apenas periostal
Profundidade de sondagem (PPD)
3 mm no estado saud ´avel 2.5-5 mm (dependendo da
profundidade anterior do tecido mole) Sangramento `a
sondagem (BOP)
Mais fidedigno Menos fidedigno
Apesar das semelhanc¸as entre as caracter´ısticas cl´ınicas e etiologia da PI e peri-odontite, existem diferenc¸as histopatol ´ogicas cr´ıticas entre as duas les ˜oes. No estudo realizado por Berglundh T. et al7 , os autores utilizaram uma t ´ecnica de colocac¸ ˜ao de
ligadura para promover a les ˜ao tecidular, tendo verificado que nos tecidos em torno dos dentes ocorreu um processo ”auto-limitante”, com formac¸ ˜ao de uma c ´apsula pro-tetora do tecido conjuntivo, que separou o infiltrado celular inflamat ´orio (ICT) do osso alveolar. O mesmo n ˜ao se verificou nos tecidos peri-implantares, pelo que o ICT se estendeu at ´e `a crista ´ossea. Embora a presenc¸a de c ´elulas plasm ´aticas e linf ´ocitos tenha ocorrido de igual forma nas duas patologias, por ´em os neutr ´ofilos e macr ´ofagos encontraram-se em maiores proporc¸ ˜oes na PI7 . De forma semelhante, tamb ´em
Car-cuac O. et al8estudaram as diferenc¸as entre estas duas patologias, atrav ´es da
realiza-c¸ ˜ao de bi ´opsias aos tecidos periodontais e peri-implantares. Estes autores verificaram um n ´umero superior de c ´elulas inflamat ´orias nas secc¸ ˜oes de PI, bem como uma maior densidade de vascularizac¸ ˜ao8. Previamente, o mesmo autor havia conduzido um
es-tudo experimental em c ˜aes, no qual relatou que as les ˜oes verificadas na PI eram consideravelmente mais extensas e pr ´oximas do osso de suporte, para al ´em de que apresentavam um maior n ´umero de osteoclastos quando comparadas com as les ˜oes de periodontite9 .
1.2
Introduc¸ ˜ao `as doenc¸as peri-implantares
O aumento exponencial do n ´umero de implantes colocados nas ´ultimas d ´ecadas conduziu a um incremento da ocorr ˆencia de complicac¸ ˜oes relacionadas com este pro-cedimento10 . Do conjunto de poss´ıveis complicac¸ ˜oes inerentes `a colocac¸ ˜ao de
im-plantes iremos dar particular ˆenfase `as doenc¸as peri-implantares, as quais compre-endem a mucosite peri-implantar e a PI. Estas patologias s ˜ao de natureza infeciosa e ocorrem quando se rompe o equil´ıbrio entre o hospedeiro e o agente patog ´enico11
. Assim sendo, da mesma forma que o tecido periodontal ´e vital para a estabilidade da dentic¸ ˜ao natural, tecidos peri-implantares saud ´aveis s ˜ao essenciais para a longe-vidade dos implantes dent ´arios12 . Contudo, as les ˜oes encontradas nas doenc¸as
peri-implantares s ˜ao consideravelmente mais significativas e apresentam caracter´ısticas mais agressivas, quando comparadas com as doenc¸as periodontais, n ˜ao respondendo positivamente a terapias usadas tradicionalmente na periodontite13 . Adicionalmente,
o tratamento desta condic¸ ˜ao pode ser inconveniente e desconfort ´avel para o paciente, e requer um esforc¸o elevado em termos de recursos econ ´omicos. Assim, `a medida que aumenta o n ´umero de pessoas que recorre a reabilitac¸ ˜ao oral com recurso a im-plantes, a PI surge como um problema major crescente na medicina dent ´aria14, 15 .
Embora o principal foco desta dissertac¸ ˜ao seja a PI, ´e importante dedicarmos al-guma atenc¸ ˜ao `a mucosite peri-implantar. Esta apresenta-se como uma les ˜ao
infla-mat ´oria revers´ıvel, correspondendo `a gengivite na dentic¸ ˜ao natural12 . Clinicamente,
pode ser identificada pelo aparecimento de vermelhid ˜ao e edema dos tecidos moles peri-implantares, sendo o par ˆametro chave para o seu diagn ´ostico o sangramento `a sondagem suave (0.25 N)11, 16, 17.
A mucosite precoce e tardia caracteriza-se pela alterac¸ ˜ao da composic¸ ˜ao da placa bacteriana, com aumento dos microrganismos Gram-negativos, sendo que estes, por sua vez, ativam uma resposta localizada do hospedeiro. Os produtos da resposta
inflamat ´oria que ocorrem dentro do periodonto tamb ´em est ˜ao presentes no flu´ıdo cre-vicular peri-implantar (PICF) no caso da mucosite, tendo estes de igual forma, vindo a ser utilizados para comparar os estados de sa ´ude e doenc¸a18 . Como ´ultimo ponto, a
prevenc¸ ˜ao apresenta particular destaque, devido ao potencial risco de evoluc¸ ˜ao para PI se a mucosite permanecer sem tratamento19 , especialmente tendo em conta que
esta ´e revers´ıvel quando tratada adequadamente, ao contr ´ario da PI cujos resulta-dos s ˜ao ainda imprevis´ıveis20 . Ao contr ´ario da primeira cujos resultados s ˜ao ainda
imprevis´ıveis, a segunda ´e revers´ıvel quando tratada adequadamente20 . Como
tra-tamento eficaz para a mucosite, destaca-se a terapia mec ˆanica n ˜ao-cir ´urgica quando associada `a utilizac¸ ˜ao de colut ´orios antiss ´eticos16 .
De seguida, ir ´a ser aprofundado em maior detalhe o tema da PI enquanto objeto de estudo dentro do campo da implantologia.
1.3
Peri-implantite
1.3.1
Definic¸ ˜ao/Diagn ´ostico
A PI ´e definida como uma reac¸ ˜ao inflamat ´oria induzida por bact ´erias, que afeta os tecidos circundantes dos implantes dent ´arios osteointegrados, em func¸ ˜ao oclusal, resultando em ´ultima an ´alise na perda de osso de suporte4, 21 . Esta patologia
cons-titui a complicac¸ ˜ao biol ´ogica major associada `a terapia com implantes dent ´arios22 ,
podendo em ´ultima an ´alise conduzir `a falha do implante e da soluc¸ ˜ao prot ´etica. ´E caracterizada pela diminuic¸ ˜ao do n´ıvel do osso alveolar de suporte (avaliada radiogra-ficamente) em associac¸ ˜ao com sangramento `a sondagem suave (BOP), aumento da profundidade de sondagem (PPD), diminuic¸ ˜ao dos n´ıveis relativos de inserc¸ ˜ao cl´ınica (rCAL), supurac¸ ˜ao, edema da mucosa e vermelhid ˜ao, sendo que normalmente a sin-tomatologia est ´a ausente11, 16, 17. Numerosos estudos t ˆem sido conduzidos para
ava-liar a precis ˜ao dos procedimentos de diagn ´ostico cl´ınico e radiogr ´afico de rotina para doenc¸as peri-implantares23, sendo que estes foram considerados n ˜ao suficientemente
sens´ıveis para fornecer informac¸ ˜oes diagn ´osticas precisas acerca da taxa de risco, in´ıcio e atividade da doenc¸a, progn ´ostico e resultados do tratamento5 . As medic¸ ˜oes
cl´ınicas em torno dos implantes podem estar dependentes da forc¸a e direc¸ ˜ao da son-dagem, geometria do implante, desenho da pr ´otese e bi ´otipo de tecido mole
peri-implantar24 .
O colapso inicial da interface implante-tecido inicia-se na crista ´ossea, indepen-dentemente da abordagem cir ´urgica (submerso ou n ˜ao-submerso). Esta perda ´ossea inicial ´e observada ap ´os um ano em func¸ ˜ao, seguido por uma perda m´ınima - at ´e 0.2 mm anualmente11 .
´
E assumido que o aparecimento, gravidade e extens ˜ao da doenc¸a depende de uma variedade de caracter´ısticas individuais. Al ´em de higiene oral, o tabagismo e condic¸ ˜oes sist ´emicas, tais como doenc¸as decorrentes de imunodefici ˆencia, diabe-tes e obesidade, s ˜ao considerados fatores-chave para a rutura progressiva do tecido peri-implantar25 . A reabsorc¸ ˜ao ´ossea pode ser desencadeada por stress oclusal,
bact ´erias ou uma combinac¸ ˜ao de ambos. A primeira ocorre sem intervenc¸ ˜ao bacte-riana enquanto agente causador prim ´ario, contudo, ap ´os a perda ´ossea inicial d ´a-se um aumento da profundidade do sulco, diminuindo no seu interior a concentrac¸ ˜ao de oxig ´enio, e promovendo assim a proliferac¸ ˜ao de bact ´erias anaer ´obias. Posto isto, es-tas podem tornar-se ent ˜ao os principais promotores da perda ´ossea cont´ınua1.
Com vista ao estabelecimento do diagn ´ostico de PI e `a avaliac¸ ˜ao da sua pro-gress ˜ao, ´e fundamental determinar a baseline, ou seja, deve proceder-se `a realizac¸ ˜ao de uma radiografia periapical ap ´os remodelac¸ ˜ao fisiol ´ogica, bem como `a medic¸ ˜ao dos valores de sondagem. Esta monitorizac¸ ˜ao ser efetuada pelo menos uma vez por ano de modo a permitir um diagn ´ostico precoce16, 17 .
1.3.2
Epidemiologia
Com o intuito de comprovar a elevada frequ ˆencia destas complicac¸ ˜oes, dois es-tudos transversais s ˜ao descritos na literatura dispon´ıvel, com amostras de 662 (3413 implantes) e 216 indiv´ıduos (987 implantes), respetivamente16, 17 . No primeiro grupo
verificou-se a ocorr ˆencia de mucosite peri-implantar em 80% dos indiv´ıduos e em 50% dos locais do implante, enquanto a PI foi identificada em 28% e 56% de indiv´ıduos e em 12% e 43% dos locais do implante, como mencionado no segundo estudo16, 17, 26.
Na revis ˜ao sistem ´atica realizada por Derks e Tomasi (2015), os estudos identifi-cados demonstram um intervalo de preval ˆencias para a mucosite peri-implantar de 19% a 65% e para a PI de 1% a 47%. Esta variabilidade nos resultados obtidos ´e explicada em parte por quest ˜oes metodol ´ogicas, nomeadamente a heterogeneidade
nas definic¸ ˜oes utilizadas. Assim sendo, os autores que obtiveram 47% de preval ˆencia, consideraram implantes com perda ´ossea a partir de 0.4 mm e os que obtiveram 1%, inclu´ıram apenas implantes com perda ´ossea superior a 5 mm20. Posto isto, urge que
se estabelec¸a um m ´etodo padronizado para o diagn ´ostico e classificac¸ ˜ao das doenc¸as peri-implantares.
1.3.3
Fisiopatologia
A sa ´ude peri-implantar requer um estado inflamat ´orio controlado que possa manter a homeostasia entre o hospedeiro e o seu microbiota. No entanto, defeitos no estado imuno-inflamat ´orio do hospedeiro, condic¸ ˜oes predisponentes ou fatores ambientais, podem alterar este equil´ıbrio, propiciando que o biofilme venha a incluir microrganis-mos patobiontes. Face a esta microbiota disbi ´otica, os neutr ´ofilos s ˜ao recrutados para a bolsa peri-implantar interagindo com tipos de c ´elulas imunes adicionais, como ´e o caso dos macr ´ofagos, c ´elulas dendr´ıticas e c ´elulas T. Neste processo s ˜ao produ-zidos mediadores pr ´o-inflamat ´orios -– como o TNF-α, IL-1β e IL-17 –, e promovem a diferenciac¸ ˜ao de c ´elulas Th-17, que contribuem para a exacerbac¸ ˜ao da resposta inflamat ´oria. A IL-17 produzida pelos Th17, atua sobre tipos de c ´elulas inatas do te-cido imune e conjuntivo, como neutr ´ofilos, fibroblastos e osteoblastos. Atrav ´es dessas interac¸ ˜oes, a IL-17 induz a produc¸ ˜ao de quimiocinas CXC, metaloproteinases de ma-triz (MMPs) e outras mol ´eculas destruidoras de tecidos (esp ´ecies reativas de oxig ´enio - ROS). Induz igualmente a express ˜ao do receptor activator of nuclear factor kB li-gand (RANKL), que impulsiona a maturac¸ ˜ao dos precursores dos osteoclastos. Os linf ´ocitos ativados (c ´elulas B e T, especificamente Th-1 e Th-17) desempenham um papel importante na reabsorc¸ ˜ao ´ossea patol ´ogica atrav ´es do mesmo mecanismo de-pendente de RANKL, enquanto a osteoprotegerin (OPG) inibe a interac¸ ˜ao de RANKL com seu recetor funcional (RANK) nos osteoclastos. A raz ˜ao RANKL/OPG aumenta com o aumento da atividade inflamat ´oria. Os neutr ´ofilos ativados expressam RANKL ligado `a membrana e podem estimular diretamente a osteoclastog ´enese se estiverem suficientemente pr ´oximos do osso27 .
De forma inversa, a citocina anti-inflamat ´oria IL-10 - produzida por c ´elulas regu-ladoras T (Tregs), bem como o interferon-γ (produzido por c ´elulas Th-1) e IL-4 mais IL-13 (produzido por c ´elulas Th-2) podem suprimir a osteoclastog ´enese. A interac¸ ˜ao
celular adaptativa inata ´e consideravelmente mais complexa do que aqui descrita, mas serve para ilustrar os principais mecanismos destrutivos que operam no contexto da infec¸ ˜ao e inflamac¸ ˜ao periodontal n ˜ao resolvidas27 . Estes encontram-se representados
na Figura 1.2.
Figura 1.2: Mecanismos inflamat ´orios que conduzem `a perda ´ossea na peri-implantite. Ima-gem adaptada de Hajishengallis G. (2014)27.
Esta patologia foi descrita como uma infec¸ ˜ao site-specific, apresentando muitas ca-racter´ısticas em comum com a periodontite cr ´onica sendo, por ´em, a les ˜ao inflamat ´oria dos tecidos moles e a perda ´ossea mais exuberantes em torno dos implantes18 .
1.3.4
Fatores de risco
A PI apresenta origem multifatorial, onde uma resposta aberrante do hospedeiro combinada com a agress ˜ao bacteriana, pode contribuir para o desenvolvimento da destruic¸ ˜ao do tecido em torno dos implantes phantoma18 . Posto isto, apesar da sua
natureza infeciosa, esta patologia pode ser desencadeada e/ou perpetuada por fa-tores iatrog ´enicos, tais como excessos de res´ıduos de cimento, inadequado assen-tamento do abutment, sobrecontorno da pr ´otese, mau posicionamento do implante ou complicac¸ ˜oes t ´ecnicas. Para al ´em disso, a perda ´ossea induzida pelo trauma de colocac¸ ˜ao do implante no osso primitivo pode persistir quando este ultrapassa a sua capacidade de adaptac¸ ˜ao17 . Da mesma forma, existem in ´umeros fatores de
risco fortemente associados a esta patologia, nomeadamente, pacientes com higi-ene oral deficit ´aria, hist ´oria de periodontite e indiv´ıduos fumadores15 ; e ainda fatores
cuja evid ˆencia de associac¸ ˜ao ´e limitada, tais como, pacientes com diabetes mellitus descontrolada, consumo de ´alcool, fatores gen ´eticos e acabamento da superf´ıcie do implante16 .
No estudo conduzido por Derks e Schaller (2016), verificaram que pacientes com periodontite e com ≥ 4 implantes, implantes de determinadas marcas, reabilitac¸ ˜ao prot ´etica realizada por m ´edicos dentistas generalistas, bem como implantes instalados na mand´ıbula e com uma dist ˆancia inferior a ≤ 1.5 mm da margem da pr ´otese `a crista alveolar, exibiram um risco mais elevado de desenvolver PI moderada/severa.14
O estabelecimento de perfis de risco para a doenc¸a peri-implantar pode tornar mais f ´acil prever que implantes estar ˜ao em risco de desenvolver esta complicac¸ ˜ao, auxiliar na tomada de decis ˜ao cl´ınica, atrav ´es da selec¸ ˜ao do tratamento individual mais efetivo e estimar as possibilidades de sucesso18 . Assim sendo, ir ˜ao ser abordados
em particular os fatores de risco mais relevantes na literatura.
Invas ˜ao do espac¸o biol ´ogico
A manutenc¸ ˜ao de uma dist ˆancia inferior a ≤ 1.5 mm da margem da pr ´otese `a crista alveolar sugere invas ˜ao do espac¸o biol ´ogico, ou seja, indica que a coroa interferiu numa fase inicial com o selamento mucoso ao redor do implante, promovendo desta forma o aparecimento da doenc¸a.14 A espessura e qualidade dos tecidos moles no
dos tecidos18 .
Hist ´oria pr ´evia de periodontite
In ´umeros artigos t ˆem abordado esta quest ˜ao, tendo muitos deles verificado uma incid ˆencia aumentada de PI em pacientes com perda dent ´aria associada a periodon-tite22, 28–31 .
No estudo realizado por Cho-Yan Lee,32 verificou-se que implantes colocados em
pacientes periodontalmente comprometidos (PPC) que apresentavam bolsas residu-ais no follow-up, exibiram valores mresidu-ais elevados de PPD e perda ´ossea, quando com-parados com implantes colocados em pacientes periodontalmente saud ´aveis (PPS) ou PPC sem evid ˆencia de bolsas residuais. Posto isto, conclu´ıram que mais do que a hist ´oria pr ´evia de periodontite, o fator determinante seria o controlo periodontal, realc¸ando a import ˆancia de uma efetiva terapia periodontal.
Placa bacteriana
Um grande n ´umero de esp ´ecies bacterianas formam massas de pel´ıcula viscosa (placa), constituindo o fator etiol ´ogico predominante para a progress ˜ao da doenc¸a peri-implantar18 . Esta representa um importante fator de risco para o desenvolvimento de
PI, tendo sido encontrada uma correlac¸ ˜ao positiva entre a acumulac¸ ˜ao de placa e a perda ´ossea marginal em torno dos implantes dent ´arios. Esta evid ˆencia explica a observac¸ ˜ao de que a participac¸ ˜ao num programa de manutenc¸ ˜ao de suporte resulta numa menor preval ˆencia desta patologia33 .
Diabetes
A diabetes ´e uma doenc¸a sist ´emica que resulta numa ampla gama de mecanismos que podem protelar a cicatrizac¸ ˜ao de feridas e aumentar a suscetibilidade de um pa-ciente `a infec¸ ˜ao ou perda de implante34 . Isto ocorre porque a hiperglicemia cr ´onica
prejudica o reparo tecidual e os mecanismos de defesa do hospedeiro. Al ´em disso, uma maior formac¸ ˜ao e acumulac¸ ˜ao de produtos finais de glicosilac¸ ˜ao avanc¸ada nos tecidos peri-implantares aumenta a produc¸ ˜ao de citocinas pr ´o-inflamat ´orias (6, IL-1β, IL-18) e metaloproteinases de matriz (MMP8 e MMP9) na saliva e flu´ıdo crevicular, podendo comprometer a osteointegrac¸ ˜ao e sobreviv ˆencia a longo prazo de pacientes com hiperglicemia cr ´onica35 .
Embora a associac¸ ˜ao entre diabetes e perda de implantes tenha sido abordada em an ´alises sistem ´aticas por Kotsovilis et al36 e Mombelli e Cionca,37 existe apenas um
estudo que descreve a associac¸ ˜ao entre diabetes e PI. Ferreira S.D. et al31 relataram
que pacientes com diabetes descontrolada apresentavam um maior risco de desenvol-ver PI. No entanto, ´e pertinente mencionar que um adequado controlo glic ´emico - em pacientes previamente diagnosticados com diabetes – desempenha um papel impor-tante para uma osteointegrac¸ ˜ao bem-sucedida e uma manutenc¸ ˜ao da sobreviv ˆencia dos implantes a longo prazo.35
Tabagismo
A preval ˆencia e a gravidade das doenc¸as periodontais nas suas diversas formas s ˜ao elevadas entre os fumadores, comparativamente com os n ˜ao fumadores. O trata-mento com recurso a implantes dent ´arios ´e significativamente influenciado pelo v´ıcio do tabagismo: o tabaco age ao n´ıvel das defesas do hospedeiro, da destruic¸ ˜ao da ma-triz extra-celular, do aumento da perda ´ossea e do comprometimento da capacidade de regenerac¸ ˜ao. Desta forma, surge associado a um aumento na taxa de insucesso na osteointegrac¸ ˜ao, a uma maior dificuldade na manutenc¸ ˜ao da higiene oral e a uma maior preval ˆencia de ocorr ˆencia de PI38 .
Contudo, a evid ˆencia dispon´ıvel para o h ´abito de fumar enquanto indicador de progn ´ostico para o sucesso do tratamento da PI ´e limitado e conflituante. Um ex-tenso estudo retrospetivo39 sugere que esta pr ´atica, bem como a sua dose podem
estar associados `a falha no tratamento da PI por ´em, o mesmo n ˜ao foi fundamentado nos estudos prospetivos de Serino e Turri40 e Heitz-Mayfield et al34 .
Res´ıduos de cimento
Uma abordagem convencional para a restaurac¸ ˜ao com implantes dent ´arios ´e a utilizac¸ ˜ao de pr ´oteses fixas cimentadas. No entanto, a inadequada remoc¸ ˜ao do ci-mento residual pode conduzir a PI, sendo que a sua manutenc¸ ˜ao no sulco peri-implantar tem sido associado `a inflamac¸ ˜ao dos tecidos, BOP, supurac¸ ˜ao, aumento da PPD, evid ˆencia radiogr ´afica de perda ´ossea e desconforto do paciente35 .
1.3.5
Tratamento
Embora algumas les ˜oes iniciais de PI possam ser tratadas de forma eficaz apenas com recurso a tratamento mec ˆanico, as les ˜oes mais avanc¸adas requerem intervenc¸ ˜ao cir ´urgica adicional para alcanc¸ar a resoluc¸ ˜ao da doenc¸a16 . Nestas, a terapia cir ´urgica
tem-se revelado imprescind´ıvel, pois nenhum outro m ´etodo permite o acesso direto `as superf´ıcies contaminadas dos implantes, visando o seu desbridamento. Tem-se verifi-cado a utilizac¸ ˜ao de diversos procedimentos de descontaminac¸ ˜ao, que inclui t ´ecnicas mec ˆanicas e qu´ımicas, contudo, nenhum m ´etodo ou combinac¸ ˜ao de m ´etodos demons-trou ser mais eficiente16 . Regimes de terapia adjuvante com antibi ´oticos sist ´emicos
s ˜ao frequentemente aplicados por rotina em casos de tratamento cir ´urgico da PI, sem se avaliar de facto o seu benef´ıcio. A discrep ˆancia no in´ıcio e progress ˜ao da doenc¸a entre os pacientes e a grande variac¸ ˜ao nos m ´etodos de tratamento cir ´urgico dificul-tam contudo as an ´alises e conclus ˜oes41 . Um relat ´orio de consenso do 8o Workshop
Europeu sobre Periodontologia enfatizou a necessidade de estabelecer uma terapia padronizada para o tratamento da PI42 .
Com o intuito de clarificar esta quest ˜ao, Carcuac et al41 realizaram um estudo que
procurou verificar a efic ´acia da terapia adjuvante de antibi ´oticos sist ´emicos e o uso local de clorhexidina para a descontaminac¸ ˜ao da superf´ıcie do implante no tratamento cir ´urgico da PI. Estes autores obtiveram sucesso em 45% de todos os implantes, mas foi maior em implantes com uma superf´ıcie n ˜ao modificada (79%) do que aqueles com superf´ıcie modificada (34%), tendo conclu´ıdo que a aplicac¸ ˜ao local de clorohexidina n ˜ao teve efeito geral sobre os resultados do tratamento. Por outro lado, apuraram ainda que a terapia adjuvante com antibi ´oticos sist ´emicos n ˜ao teve impacto no sucesso do tratamento nos implantes com superf´ıcie n ˜ao modificada, ao contr ´ario dos implantes com superf´ıcie modificada, em que esta revelou um efeito positivo41 .
Alguns estudos43–46 t ˆem vindo a recomendar o uso de lasers como um
comple-mento ao tratacomple-mento n ˜ao cir ´urgico convencional da PI. Romanos e Nentwig43
investi-garam a efic ´acia de um laser de CO2 na descontaminac¸ ˜ao de implantes acometidos por PI. Os par ˆametros cl´ınicos e radiogr ´aficos foram avaliados na baseline e 2 anos ap ´os tratamento. Os resultados evidenciaram um preenchimento ´osseo quase com-pleto dos defeitos peri-implantares, tendo conclu´ıdo portanto que a utilizac¸ ˜ao de lasers de CO2 constitui uma opc¸ ˜ao eficaz para o tratamento da PI.
At ´e o momento, n ˜ao existem evid ˆencias claras acerca de qual ´e a intervenc¸ ˜ao mais eficaz para o tratamento da PI. A terapia com lasers e a cirurgia ressetiva com implantoplastia (modificac¸ ˜ao da topografia da superf´ıcie do implante) t ˆem apresen-tado resulapresen-tados promissores. Todavia, ´e necess ´aria a realizac¸ ˜ao de mais estudos que corroborem estes dados, com vista `a implementac¸ ˜ao de protocolos de tratamento pa-dronizados para a PI16, 35, 47.
1.4
Flu´ıdos orais enquanto ferramentas de diagn ´osico
1.4.1
Flu´ıdo crevivular
O fluido crevicular peri-implantar (PICF) ´e semelhante em composic¸ ˜ao ao fluido crevicular gengival (GCF) que se encontra em torno dos dentes naturais, sendo que os pacientes que apresentam PI geralmente evidenciam um aumento no volume de PICF48 . Devido `a especificidade do processo de peri-implante, esta rede deve ser
controlada por processos locais, pelo que o fluido crevicular fornece um meio n ˜ao-invasivo para estudar a resposta do hospedeiro, sob a forma de alterac¸ ˜oes metab ´olicas e bioqu´ımicas precoces18 .
Considera-se que o conte ´udo bioqu´ımico da PICF reflete precisamente os proces-sos decorrentes nos tecidos peri-implantares. Atrav ´es da avaliac¸ ˜ao de um grande n ´umero de citocinas no PICF, em diferentes est ´agios da doenc¸a, dados importantes sobre o estado dos tecidos peri-implantares podem ser obtidos18 . Contudo, existe
al-guma falta de consist ˆencia na literatura que se deve provavelmente ao facto de o fluxo de PICF ser relativamente escasso, quando comparado com outros meios. A este junta-se a falta de uniformidade de estrat ´egias entre estudos, o que acrescenta mais dificuldade em padronizar os n´ıveis de detec¸ ˜ao. Alguns estudos descrevem dados sob a forma de percentagens de detec¸ ˜ao, outros em n´ıveis de biomarcadores e outros em concentrac¸ ˜oes. Esta falta de consist ˆencia nos resultados relatados na literatura complica a interpretac¸ ˜ao do valor em diagn ´ostico destes biomarcadores6 .
1.4.2
Saliva
A saliva foi identificada h ´a muito como um promissor flu´ıdo de diagn ´ostico para uma vasta gama de patologias, quer orais quer sist ´emicas. A sua composic¸ ˜ao proteica ´e fornecida essencialmente pelas secrec¸ ˜oes das gl ˆandulas salivares major (par ´otida, submandibular, sublingual), mas tamb ´em pelas gl ˆandulas salivares minor, GCF, l´ıngua, mucosa oral, mol ´eculas de origem microbiana e plasma49 .
Este flu´ıdo apresenta claras vantagens em relac¸ ˜ao ao sangue, nomeadamente o facto de possibilitar a sua recolha atrav ´es de m ´etodos simples e n ˜ao-invasivos, possui menor risco de disseminar infec¸ ˜oes, menor necessidade de pr ´e-processamento das amostras e acarreta menos custos50 . A saliva possui tamb ´em vantagens em relac¸ ˜ao
ao PICF, pois permite a colheita de volumes de amostra substancialmente superiores, a principal limitac¸ ˜ao deste. O facto de possuir uma concentrac¸ ˜ao de algumas prote´ınas inferior ao PICF, frequentemente dificultava a detec¸ ˜ao de biomarcadores. Contudo, t ´ecnicas modernas como o Multiplex e os mais recentes avanc¸os em espectrometria de massa t ˆem vindo a colmatar esta falha, permitindo a utilizac¸ ˜ao da saliva como uma potencial fonte de biomarcadores, com vista ao desenvolvimento de novas t ´ecnicas de diagn ´ostico e tratamento51 .
In ´umeros avanc¸os t ˆem sido feitos na investigac¸ ˜ao em saliva, sendo que dispositivos de diagn ´ostico miniaturizados j ´a est ˜ao a ser desenvolvidos e prometem alcanc¸ar o di-agn ´ostico de doenc¸as infeciosas, cancro, doenc¸as card´ıacas e muitas outras doenc¸as sist ´emicas com apenas uma gota de saliva52 . Apesar destes progressos, este flu´ıdo
apresenta algumas limitac¸ ˜oes: at ´e agora a generalidade dos biomarcadores identi-ficados n ˜ao pertencem aos componentes intr´ınsecos da saliva, sendo derivados do soro que se deslocam para a saliva por meio da difus ˜ao dos tecidos circundantes da cavidade oral, maioritariamente do fluido crevicular gengival. Assim, no que diz res-peito a estes biomarcadores, a saliva s ´o pode ser considerada como fonte secund ´aria de informac¸ ˜ao52 . Adicionalmente, a saliva apresenta diferenc¸as entre indiv´ıduos ao
n´ıvel do fluxo salivar, composic¸ ˜ao e concentrac¸ ˜ao proteica53 . Estas disparidades
exis-tem igualmente no sangue, contudo, a padronizac¸ ˜ao das metodologias de recolha e an ´alise h ´a muito implementadas, permitiram a identificac¸ ˜ao de valores padr ˜ao para cada subst ˆancia.52 Em suma, s ˜ao importantes estudos como o de Rosa et al que
a caracterizac¸ ˜ao dos valores padr ˜ao para cada subst ˆancia, de modo a que a saliva se possa tornar um meio de diagn ´ostico alternativo e/ou suplementar aos tradicional-mente utilizados53 .
1.5
Biomarcadores em doenc¸a peri-implantar
A PI ´e uma condic¸ ˜ao progressiva que, se n ˜ao tratada, envolve 3 fases biol ´ogicas: inflamac¸ ˜ao, destruic¸ ˜ao do tecido conjuntivo e reabsorc¸ ˜ao ´ossea. Como tal, os inves-tigadores t ˆem procurado concentrac¸ ˜oes de mol ´eculas associadas a estas 3 fases em fluidos orais, com o objetivo de encontrar preditores precoces de suscetibilidade, e detetar as mol ´eculas associadas com os pontos iniciais, intermedi ´arios e tardios desta doenc¸a54 .
At ´e agora, a determinac¸ ˜ao da atividade da doenc¸a peri-implantar foi baseada em observac¸ ˜oes cl´ınicas e radiogr ´aficas. Usando esta abordagem, est ´agios muito iniciais de um processo patol ´ogico n ˜ao s ˜ao pass´ıveis de detec¸ ˜ao. Numa tentativa de com-plementar estes m ´etodos, foram propostos procedimentos diagn ´osticos alternativos, especialmente aqueles com caracter´ısticas n ˜ao-invasivas24 .
Um biomarcador ´e definido como uma caracter´ıstica que ´e objetivamente medida e avaliada como um indicador de processos biol ´ogicos normais, processos patog ´enicos ou respostas farmacol ´ogicas a uma intervenc¸ ˜ao terap ˆeutica. Portanto, os biomarca-dores podem ser considerados uma potencial soluc¸ ˜ao diagn ´ostica com a capacidade de compensar algumas das limitac¸ ˜oes referidas das ferramentas cl´ınicas de rotina quando aplicadas ao diagn ´ostico de PI6 .
Uma vez que a PI pode estar latente nos seus est ´adios iniciais, a an ´alise de bio-marcadores no PICF e saliva pode servir como uma ferramenta para:
• O diagn ´ostico precoce;
• Determinac¸ ˜ao da suscetibilidade do doente;
• Determinac¸ ˜ao do progn ´ostico dos implantes afetados, atrav ´es da identificac¸ ˜ao de biomarcadores espec´ıficos envolvidos no in´ıcio e na progress ˜ao da doenc¸a; • Ajudar a orientar abordagens de tratamento distintas para cada indiv´ıduo; • Avaliar sucesso da terap ˆeutica4, 24, 28, 54 .
Marcadores bioqu´ımicos presentes em PICF e saliva podem indicar a instalac¸ ˜ao de PI mais precocemente, permitindo a intervenc¸ ˜ao antes que quantidades substanciais de osso de suporte se percam55 . Os biomarcadores representam, portanto, uma
ferramenta de diagn ´ostico atraente e promissora na implantologia oral, uma vez que t ˆem a capacidade de fornecer informac¸ ˜ao em tempo real dos processos em curso que afetam o metabolismo ´osseo e, como tal, s ˜ao capazes de compensar algumas das limitac¸ ˜oes das atuais ferramentas de diagn ´ostico.
1.5.1
Mol ´eculas envolvidas na resposta inflamat ´oria
Entre os muitos mediadores inflamat ´orios e imunol ´ogicos identificados no PICF, as
citocinas t ˆem atra´ıdo especial atenc¸ ˜ao. Estas s ˜ao prote´ınas segregadas pelas c ´elulas
da imunidade inata e adaptativa que medeiam muitas das func¸ ˜oes dessas c ´elulas, constituindo mensageiros intercelulares que s ˜ao essenciais para a patog ´enese de muitas doenc¸as, incluindo a PI. Estes mediadores sol ´uveis de reac¸ ˜oes imunes presen-tes em PICF s ˜ao produzidos como resultado da interac¸ ˜ao fisiol ´ogica entre o epit ´elio gengival e leuc ´ocitos locais com a placa bacteriana e microorganismos orais, desem-penhando tamb ´em pap ´eis importantes na homeostase dos tecidos18 .
Concomitante-mente, os desequil´ıbrios entre as citocinas pr ´o-inflamat ´orias e anti-inflamat ´orias geral-mente impedem a resoluc¸ ˜ao da inflamac¸ ˜ao e, em vez disso, conduzem `a perpetuac¸ ˜ao da doenc¸a e `a destruic¸ ˜ao dos tecidos24 .
Na periodontologia e implantologia, est ˜ao envolvidos na alterac¸ ˜ao e reparac¸ ˜ao de tecidos periodontais ou peri-implantares relacionados com a inflamac¸ ˜ao. Determi-nadas citocinas t ˆem sido propostas como marcadores de destruic¸ ˜ao de tecido pe-riodontal ou peri-implantar, potencialmente v ´alidos para determinar o diagn ´ostico ou progn ´ostico destas patologias18. De seguida apresentam-se algumas dessas mol ´eculas
e as suas potencialidades no contexto das doenc¸as peri-implantares.
AsInterleukin-1 Beta (IL-1β) s ˜ao citocinas que se relacionam com a destruic¸ ˜ao
te-cidual e envolvem a estimulac¸ ˜ao da reabsorc¸ ˜ao ´ossea e a induc¸ ˜ao de proteinases que degradam os tecidos, estando estes efeitos dependentes da sua concentrac¸ ˜ao nos te-cidos18 . Sabe-se que a IL-1β regula a degradac¸ ˜ao dos componentes da matriz
extra-celular do sistema de plasminog ´enio e a atividade da colagenase na inflamac¸ ˜ao e na cicatrizac¸ ˜ao de feridas. Foi demonstrado que a inibic¸ ˜ao da IL-1β reduziu a destruic¸ ˜ao
dos tecidos e a progress ˜ao da inflamac¸ ˜ao tecidual25 .
O Tumor necrosis factor (TNF-α) ´e uma citocina pr ´o-inflamat ´oria com
proprie-dades semelhantes `a IL-1β. ´E o principal mediador em resposta a bact ´erias Gram-negativas e a concentrac¸ ˜ao de TNF-α reflete a quantidade de bact ´erias e o est ´adio da inflamac¸ ˜ao18 . Um aumento local ou sist ´emico na concentrac¸ ˜ao de TNF-α conduz
`a desregulac¸ ˜ao do metabolismo ´osseo, favorecendo a destruic¸ ˜ao deste ao aumentar a diferenciac¸ ˜ao e ativac¸ ˜ao dos osteoclastos, mas tamb ´em inibindo a formac¸ ˜ao ´ossea, bloqueando a diferenciac¸ ˜ao e atividade dos osteoblastos, bem como induzindo a sua apoptose56 . Desta forma, reduz a capacidade de reparac¸ ˜ao do tecido peri-implantar
e potencia a progress ˜ao da doenc¸a25 .
O ligando da mol ´ecula CD40 humana sol ´uvel (CD40L) ´e um membro da
super-fam´ılia TNF e liga-se a esta na superf´ıcie das c ´elulas apresentadoras de antig ´enio. Esta pode ativar a maturac¸ ˜ao de c ´elulas B, ´e essencial para a ativac¸ ˜ao de c ´elulas Th e constitui um conhecido indicador de risco de doenc¸as cardiovasculares4. Chaturvedi
R. et al57 relataram que os n´ıveis de CD40L no GCF se mostraram significativamente
aumentados no grupo com periodontite (p ≤ 0,001) e relacionados com o aumento da gravidade da doenc¸a. No p ´os-tratamento, os n´ıveis diminu´ıram significativamente57 .
A Interleukin-15 (IL-15) ´e essencial para a homeostase de c ´elulas T, sendo que
n´ıveis aumentados desta prote´ına na circulac¸ ˜ao e tecidos inflamados t ˆem sido rela-tados em v ´arias doenc¸as auto-imunes, incluindo a artrite reumatoide58 . Tymkiw K.D. et al59 relataram n´ıveis elevados de IL-15 no GCF de indiv´ıduos com periodontite em
comparac¸ ˜ao com indiv´ıduos periodontalmente saud ´aveis.
AInterleukin-10 (IL-10) ´e uma citocina anti-inflamat ´oria, produzida por c ´elulas
Th-2 (THTh-2), macr ´ofagos e c ´elulas B, que inibe a s´ıntese de citocinas pr ´o-inflamat ´orias, tais como IL-1, IL-2, IL-6, IL-8, TNF-α e IFN-γ. No entanto, IL-10 ´e um estimulador das c ´elulas B, aumentando a proliferac¸ ˜ao e diferenciac¸ ˜ao destas60 .
Os neutr ´ofilos polimorfonucleares s ˜ao a primeira linha de defesa n ˜ao espec´ıfica. A Myeloperoxidase (MPO) ´e a prote´ına mais abundante nos neutr ´ofilos e ´e a ´unica
peroxidase que catalisa a convers ˜ao de per ´oxido de hidrog ´enio e cloreto em ´acido hipocloroso, sendo este ´e um poderoso agente oxidante envolvido no mecanismo de defesa contra agentes infeciosos. Contudo, sob condic¸ ˜oes de ativac¸ ˜ao incontrol ´avel ou excessiva, pode atuar sobre as c ´elulas do hospedeiro e inativar fatores humorais.
Para al ´em disso, devido ao seu amplo espectro de reatividade, o ´acido hipocloroso atua como mediador de muitos processos inflamat ´orios. Portanto, a MPO est ´a envol-vida na homeostase celular e desempenha um papel importante na iniciac¸ ˜ao e agra-vamento dos processos inflamat ´orios agudos e cr ´onicos. Assim sendo, um aumento da atividade de MPO em diferentes processos patol ´ogicos est ´a associado a um risco aumentado de stress oxidativo, como ´e o caso de doenc¸as infeciosas locais ou gerais e doenc¸as inflamat ´orias61, 62 .
ANeutrophil Elastase (ELANE) ´e uma das principais enzimas dos gr ˆanulos azur
´o-filos de leuc ´ocitos humanos e, durante a inflamac¸ ˜ao, sabe-se que a sua libertac¸ ˜ao contribui para o dano tecidual. No entanto, a atividade desta protease ´e modulada pela presenc¸a de inibidores produzidos localmente ou circulantes no plasma.55 Como
tal, ´e importante esclarecer o equil´ıbrio entre a ELANE e os seus inibidores.
Durante a ´ultima d ´ecada, foi identificada uma superfam´ılia de prote´ınas quimiot ´aticas para leuc ´ocitos, designada por quimiocinas. As quimiocinas atraem seletivamente e ativam diferentes sub-populac¸ ˜oes de leuc ´ocitos e s ˜ao mediadores-chave de uma vari-edade de condic¸ ˜oes fisiopatol ´ogicas, incluindo a inflamac¸ ˜ao18, 24 . Deste grupo ir ´a ser
dado particular destaque `a IL-8 e ao MIP-1α. A Interleukin-8 (IL-8), um dos membros da sub-fam´ılia CXC de quimiocinas espec´ıfica de neutr ´ofilos, ´e um potente fator qui-miot ´atico e ativador de neutr ´ofilos que desempenha um papel crucial no recrutamento seletivo e ativac¸ ˜ao de neutr ´ofilos e no seu encaminhamento para o sulco gengival18 .
O aumento local da IL-8 ativa os PMN presentes (que est ˜ao em contato com a placa bacteriana) e influencia a migrac¸ ˜ao seletiva de mais PMN dos vasos sangu´ıneos gen-givais. Isso resulta num aumento do n ´umero de c ´elulas num curto espac¸o de tempo e cria condic¸ ˜oes para a inflamac¸ ˜ao. Assim, se um aumento na IL-8 for detetado, pode indicar o est ´agio inicial da PI18, 63 . De forma semelhante, a prote´ına Macrophage
inflammatory protein 1-alpha (MIP-1α) ´e um membro da subfam´ılia β ou CC de
qui-miocinas que atuam como potentes c ´elulas progenitoras. Estas quiqui-miocinas causam a migrac¸ ˜ao seletiva de mon ´ocitos e linf ´ocitos para locais de inflamac¸ ˜ao e s ˜ao os me-diadores de v ´arias condic¸ ˜oes fisiopatol ´ogicas18 .
1.5.2
Mol ´eculas envolvidas na remodelac¸ ˜ao dos tecidos de
su-porte
Um outro grupo de prote´ınas relevantes neste estudo, as metaloproteinases de
matriz (MMP) representam uma superfam´ılia estruturalmente relacionada, mas
ge-neticamente distinta, de proteases que atuam n ˜ao apenas no desenvolvimento fi-siol ´ogico e remodelac¸ ˜ao de tecidos, mas tamb ´em na destruic¸ ˜ao patol ´ogica de tecido inflamat ´orio e maligno. As metaloproteinases de matriz podem ser divididas em cinco grupos principais: colagenases (MMP 1, 8 e 13); gelatinases (MMP 2 e 9); estromeli-sinas (MMP 3, 10 e 11); metaloproteinases de matriz tipo membrana (MMP 14, 15, 16 e 17); e outras. As metaloproteinases de matriz podem degradar coletivamente quase todos os componentes da matriz extracelular e da membrana basal, e a sua atividade patol ´ogica excessiva leva `a destruic¸ ˜ao dos tecidos periodontais e peri-implantares. As interac¸ ˜oes c ´elula-c ´elula e c ´elula-matriz, tais como a produc¸ ˜ao de enzimas, ativado-res, inibidoativado-res, citocinas e fatores de crescimento, regulam a remodelac¸ ˜ao do tecido conjuntivo e a destruic¸ ˜ao da matriz do tecido. As MMP s ˜ao controladas e inibidas por inibidores teciduais de metaloproteinases de matriz (TIMP), sendo que tamb ´em podem processar v ´arios substratos bioativos n ˜ao matriciais, tais como citoquinas, qui-miocinas, fatores de crescimento e mediadores imunit ´arios, mediando assim proces-sos anti-inflamat ´orios e pr ´o-inflamat ´orios64 . Em particular a MMP-8, surge na
lite-ratura como um importante mediador de destruic¸ ˜ao irrevers´ıvel de tecido periodontal e peri-implantar, tendo-se verificado que a sua quantificac¸ ˜ao se apresentou substan-cialmente elevada65, 66 , e inclusivamente que esta decresce ap ´os implementac¸ ˜ao do
tratamento67 .
Contudo, os n´ıveis de metaloproteinases da matriz n ˜ao devem ser interpretados unicamente como marcadores de destruic¸ ˜ao de tecidos, mas tamb ´em como parte da defesa fisiol ´ogica ou anti-inflamat ´oria. Em resposta ao desafio bacteriano, os leuc ´ocitos polimorfonucleares e os mon ´ocitos/macr ´ofagos migram para os locais de inflamac¸ ˜ao e desgranulam a MMP-8 e a MMP-9. Acredita-se que um desequil´ıbrio en-tre as metaloproteinases da matriz e os inibidores teciduais destas resulte na destruic¸ ˜ao tecidual patol ´ogica observada na periodontite e PI64 .