Universidade Trás-os-Montes e Alto Douro
Avaliação do dispositivo Uranotest reader para análise
semiquantitativa de urina do cão e do gato
Dissertação de Mestrado em Biologia Clínica Laboratorial
Ana Catarina Campos Martins
Orientadora: Professora Doutora Ana Cristina Silvestre Ferreira
Universidade Trás-os-Montes e Alto Douro
Avaliação do dispositivo Uranotest reader para análise
semiquantitativa de urina do cão e do gato
Dissertação de Mestrado em Biologia Clínica Laboratorial
Ana Catarina Campos Martins
Orientadora: Professora Doutora Ana Cristina Silvestre Ferreira
Composição do Júri:
Presidente: Prof. Doutora Maria Cristina Guiomar Antunes
Primeiro Vogal (Arguente): Prof. Doutora Maria João Miranda Pires
Segundo Vogal (Arguente): Prof. Doutor Dario Joaquim Simões Loureiro dos Santos Terceiro Vogal (Orientadora): Prof. Doutora Ana Cristina Silvestre Ferreira
III Declaração de Responsabilidade Pessoal
Eu, Ana Catarina Campos Martins, declaro que esta dissertação de mestrado intitulada de “Avaliação do dispositivo Uranotest reader para análise semiquantitativa de urina de cão e de gato.” é da minha autoria. As fontes consultadas estão devidamente referenciadas ao longo de todo o trabalho, respeitando as normas de referenciação bibliográfica APA da 6ª edição, utilizando o programa de gestão de referências bibliográficas Endnote® versão X7 da Thomson Reuters.
V Agradecimentos
À Universidade Trás-os-Montes e Alto Douro, representada pelo Reitor Professor Doutor António Augusto Fontaínhas Fernandes, pela formação que me foi possibilitada durante a minha licenciatura e mestrado.
À Professora Doutora Ana Cristina Ferreira pela orientação, acompanhamento e paciência ao longo de todo este trabalho. Pela disponibilidade, preocupação e por acreditar em mim e no meu futuro. Obrigada por todos os conhecimentos e pelo seu bom profissionalismo. Obrigada por tudo!
Às Professoras Doutoras Maria João Pires e Felisbina Queiroga por todo o acompanhamento e toda a ajuda ao longo deste trabalho. Foram fundamentais para a concretização deste trabalho, obrigada!
Ao Doutor Carlos Pires por toda a ajuda na análise estatística deste estudo, obrigada!
Ao Doutor André Pinto por me ter acompanhado em todo o trabalho prático e me ter transmitido todos os seus conhecimentos, obrigada!
À minha querida Susana Morais, que para além de me ter ajudado e acompanhado no laboratório, transmitiu-me muita amizade e confiança. Foi a minha grande parceira e o motivo de muitos sorrisos. Obrigada por tudo!
A toda a restante equipa do Hospital Veterinário da UTAD. Obrigada por todo o apoio e por todos os momentos partilhados!
A todos os meus colegas de mestrado pelos momentos fantásticos que partilhamos. Em especial aos meus amigos Marta, Luís e Rui, obrigada por toda a força e amizade que me deram. Obrigada por estarem ao meu lado nas alturas em que mais precisei de vocês. Assim como, os bons momentos, que foram tantos e tão bons. Levo-vos comigo para o resto da vida, obrigada!
Aos meus colegas de casa, Zélia, Liliana e Filipe, pelo apoio que sempre me deram e por toda a amizade. Obrigada!
VI
Aos restantes amigos, os “amigos de Macieira”, os de sempre, os que são para a vida toda, obrigada!
A toda a minha família, em especial aos meus pais, por me ajudarem a alcançar todos os meus objetivos, pois sem vocês nada seria possível, obrigada!
VII Resumo
A análise de urina apresenta um papel fundamental na Medicina Veterinária, pois permite obter informações sobre o estado clínico do doente. Esta análise baseia-se em três componentes: a análise física, análise bioquímica e análise microscópica. Na análise física é avaliada a cor da amostra, o grau de turbidez e a medição da densidade urinária. Na análise bioquímica são avaliados diferentes parâmetros bioquímicos através do uso de tiras reativas de urina. Na avaliação microscópica é observado o sedimento urinário para determinação de vários elementos. O aparecimento da tecnologia na análise de urina permitiu a criação de leitores automatizados de tiras reativas de urina, possibilitando uma melhoria da técnica, facilitando o trabalho do técnico.
O principal objetivo deste estudo é a avaliação da facilidade de utilização do equipamento Uranotest reader, um leitor automatizado de tiras reativas de urina, em urina de cão e de gato na rotina laboratorial, bem como a sua reprodutibilidade aquando do uso das as tiras Uranotest 11C. Como objetivo secundário temos a identificação das principais alterações encontradas na análise de urina na rotina laboratorial do Laboratório de Patologia Clínica do HVUTAD, entre janeiro e julho de 2017.
Deste estudo fizeram parte 159 amostras de urina, das quais 107 de cão e 52 de gato. Numa análise física avaliamos a cor e a turbidez da amostra. Relativamente à análise bioquímica foram avaliados os parâmetros de densidade urinária, pH, leucócitos, glicose, corpos cetónicos, bilirrubina, sangue, urobilinogénio, nitritos, proteínas, creatinina e rácio UPC. Posteriormente, para uma análise microscópica foi observado o sedimento urinário.
Da análise dos resultados, foi possível concluir que o dispositivo Uranotest reader é um método prático de utilização na rotina laboratorial para a análise de urina no cão e no gato. Mais especificamente, é um método de execução rápida, com registo de resultados em suporte de papel e cuja utilização diminui a subjetividade inter-observador, mostrando uma boa reprodutibilidade. Quanto às alterações encontradas na análise de urina, verificamos que há uma maior incidência de proteinúria, piúria e hematúria, na leitura das tiras reativas de urina. Na observação do sedimento urinário, verificamos com maior frequência a presença de células epiteliais de descamação, eritrócitos e cilindros granulares.
Palavras chave: análise de urina, leitores semiautomáticos, Uranotest reader, Uranotest
VIII Abstract
Urinalysis plays a key role in Veterinary Medicine, as it provides information on the clinical status of the patient. This analysis is based on three components: physical analysis, biochemical analysis and microscopic analysis. In the physical analysis the color of the sample, the degree of turbidity and the measurement of the urinary density are evaluated. In the biochemical analysis different biochemical parameters are evaluated using reactive strips of urine. In the microscopic evaluation the urinary sediment is observed to determine several elements. The appearance of the technology in the analysis of urine allowed the creation of automated readers of reactive strips of urine, allowing an improvement of the technique, facilitating the work of the technician.
The main objective of this study is to evaluate the ease of use of the Uranotest reader, an automated reader of reactive strips of urine, in cat and dog urine in the laboratory routine, as well as its reproducibility when using the Uranotest 11C strips. As secondary objective we have the identification of the main alterations found in the urine analysis in the laboratory routine of the Clinical Pathology Laboratory of HVUTAD between January and July 2017.
From this study 159 urine samples were included, 107 of which were dog and 52 of cat. In a physical analysis we evaluated the color and turbidity of the sample. Regarding the biochemical analysis, the parameters of urinary density, pH, leukocytes, glucose, ketone bodies, bilirubin, blood, urobilinogen, nitrites, proteins, creatinine and UPC ratio were evaluated. Subsequently, the urinary sediment was observed for microscopic analysis.
From the analysis of the results, it was possible to conclude that the Uranotest reader device is a practical method of use in the laboratory routine for urine analysis in dogs and cats. More specifically, it is a fast execution method, with record of results in paper format and whose use diminishes the interobserver subjectivity, showing a good reproducibility. Regarding the alterations found in the urine analysis, we found a higher incidence of proteinuria, pyuria and hematuria in the reading of urine reactive strips. In the observation of urinary sediment, the presence of scaling epithelial cells, erythrocytes and granular cylinders was more frequently observed.
Keywords: urine analysis, semiautomatic readers, Uranotest reader, Uranotest 11C, dog, cat
IX Índice
Declaração de Responsabilidade Pessoal ... III Agradecimentos ... V Resumo ... VII Abstract ... VIII Índice ... IX Índice de Figuras ... XIII Índice de tabelas ... XV Índice de gráficos ... XV Lista de Siglas e Abreviaturas ... XVII
Capítulo I - Introdução ... 1
1.1. Análise de urina ... 1
1.1.1. Importância da análise de urina na Medicina Veterinária ... 1
1.1.2. Métodos de colheita de urina ... 2
1.1.2.1. Micção espontânea ... 2 1.1.2.2. Algaliação ... 3 1.1.2.3. Cistocentese ... 3 1.1.3. Manuseamento da amostra ... 4 1.1.3.1. Recipiente de recolha ... 4 1.1.3.2. Transporte ... 4 1.1.3.3. Tempo e refrigeração ... 5 1.1.3.4. Uso de conservantes ... 6
1.1.4. Propriedades físicas da urina ... 7
1.1.4.1. Cor ... 7
1.1.4.2. Turbidez ... 7
1.1.4.3. Odor ... 8
1.1.4.4. Densidade urinária ... 8
1.1.4.4.1. Refratometria ... 9
1.1.5. Propriedades bioquímicas da urina ... 10
1.1.5.1. pH ... 11
1.1.5.2. Glicose ... 12
1.1.5.3. Corpos cetónicos ... 13
X 1.1.5.5. Sangue ... 14 1.1.5.6. Leucócitos ... 14 1.1.5.7. Urobilinogénio ... 15 1.1.5.8. Nitritos ... 16 1.1.5.9. Densidade urinária ... 16 1.1.5.10. Proteínas ... 17 1.1.5.11. Creatinina ... 18 1.1.5.12. Rácio Proteína/Creatinina ... 18 1.1.5.13. Fontes de erro ... 19
1.1.6. Análise do sedimento urinário ... 20
1.1.6.1. Elementos ... 20 1.1.6.1.1. Células ... 21 1.1.6.1.1.1. Leucócitos ... 21 1.1.6.1.1.2. Eritrócitos ... 21 1.1.6.1.1.3. Células epiteliais ... 22 1.1.6.1.2. Cilindros ... 23 1.1.6.1.3. Cristais ... 23 1.1.6.1.4. Organismos ... 24 1.1.6.1.5. Outros ... 25
1.2. Leitores automatizados de tiras reativas de urina ... 25
1.2.1. Uranotest reader ... 26
1.2.1.1. Tiras 11C ... 27
1.2.1.2. Tiras 2AC ... 28
1.2.1.3. Tiras BHB ... 28
Capítulo II - Objetivos ... 29
Capítulo III - Material e Métodos ... 31
3.1. Animais ... 31 3.2. Protocolo do estudo ... 31 3.3. Análise de urina ... 31 3.3.1. Análise física ... 31 3.3.1.1. Características macroscópicas ... 32 3.3.2. Análise bioquímica ... 32 3.3.2.1. Uranotest reader ... 32
XI 3.4. Análise estatística ... 35 Capítulo IV – Resultados ... 37 4.1. Estatística descritiva ... 37 4.1.1. Métodos de colheita ... 37 4.1.2. Características macroscópicas ... 38 4.1.3. Alterações bioquímicas ... 41
4.1.4. Concordância entre as duas leituras Uranotest 11C ... 43
4.1.5. Sedimento urinário ... 45
Capítulo V – Discussão dos Resultados ... 51
5.1. Métodos de colheita ... 51
5.2. Características macroscópicas ... 52
5.3. Alterações bioquímicas nas tiras Uranotest 11C ... 52
5.4. Sedimento urinário ... 58
5.5. Reprodutibilidade do equipamento ... 62
5.6. Uranotest reader ... 62
5.7. Uranotest 11C ... 63
Capítulo VI – Conclusão ... 65
Capítulo VIII – Anexos ... 73
8.1. Anexo A – Ficha de resultados ... 73
XIII Índice de Figuras
Figura 1 – Refratómetro (FG-302, Rojo Sampaic, França). Fotografia do LPC-HVUTAD. ... 10 Figura 2 - Equipamento Uranotest reader, à esquerda, e a impressora, à direita. Fotografia do LPC-HVUTAD 27 Figura 3 - (A) Menu para selecionar o tipo de tira a analisar; (B) Identificação da amostra: número referente à
amostra e nome do animal; (C) Seleção da cor da amostra; (D) Seleção da turbidez para o grau de turbação da amostra. Fotografia do LPC-HVUTAD. ... 32
Figura 4 - Tira reativa de urina Uranotest 11C. Fotografia do LPC-HVUTAD. ... 34 Figura 5 - Final da análise, a bandeja retira a tira do equipamento e mostra os resultados no monitor e a
impressora dá os resultados em papel. Fotografia do LPC-HVUTAD. ... 34
Figura 6 - (A) Amostra de urina canina com coloração amarela; (B) Amostra de urina felina com coloração
amarelo âmbar; (C) Amostra de urina canina com coloração laranja. (D) Amostra de urina felina com coloração vermelha. Fotografias do LPC-HVUTAD. ... 39
Figura 7 - (A) amostra de urina canina normal de cor amarelo palha e límpida; (B) amostra de urina felina de cor
amarelo palha e muito turva. Fotografias do LPC-HVUTAD. ... 40
Figura 8 - Sedimento urinário com aglomerado de leucócitos, 40x. Fotografia do LPC-HVUTAD. ... 45
Figura 9 - Sedimento urinário com piúria, 40x. Fotografia do LPC-HVUTAD. ... 45
Figura 10 - Sedimento urinário com piúria (cabeça de seta), hematúria com eritrócitos crenados (seta a
tracejado) e uma célula epitelial de transição (seta), 40x; A – ampliação de um leucócito. Fotografia do LPC-HVUTAD ... 46
Figura 11 - Sedimento urinário com hematúria, 40x. Fotografia do LPC-HVUTAD. ... 46 Figura 12 - Sedimento urinário com hematúria, com eritrócitos crenados, 40x. Fotografia do LPC-HVUTAD: 46 Figura 13 - Sedimento urinário com hematúria, cristalúria com estruvite (seta) e espermatozoides (seta a
tracejado), 40x. A: ampliação de um eritrócito crenado. B: ampliação de um eritrócito. Fotografia do LPC-HVUTAD. ... 46
Figura 14 - Sedimento urinário com células epiteliais de descamação, 40x. Fotografia do LPC-HVUTAD. ... 47 Figura 15 - Sedimento urinário com uma célula epitelial de descamação e leucócitos (seta) 40x. Fotografia do
LPC-HVUTAD. ... 47
Figura 16 - Sedimento urinário com uma célula epitelial de transição (seta) e hematúria 40x. Fotografia do
LPC-HVUTAD. ... 47
Figura 17 - Sedimento urinário com uma célula epitelial de transição caudada (seta) e várias gotas lipídicas 40x.
Fotografia do LPC-HVUTAD... 47
Figura 18 - Sedimento urinário com espermatozoides e um cilindro granular (seta), 40x. Fotografia do
LPC-HVUTAD. ... 48
Figura 19 - Sedimento urinário com espermatozoides e cilindros granulares (seta), 40x. Fotografia do
LPC-HVUTAD. ... 48
Figura 20 - Sedimento urinário com cristais de bilirrubina (seta), 40x. Fotografia do LPC-HVUTAD. ... 49 Figura 21 - Sedimento urinário com cristais amorfos, 40x. Fotografia do LPC-HVUTAD. ... 49
XIV
Figura 22 - Sedimento urinário com cristais de oxalato de cálcio monohidrato (seta), 40x. Fotografia do
LPC-HVUTAD. ... 49
Figura 23 - Sedimento urinário com cristais de estruvite, 40x. Fotografia do LPC-HVUTAD. ... 49
Figura 24 - Sedimento urinário com bacteriúria e leucócitos, 40x. Fotografia do LPC-HVUTAD. ... 50
Figura 25 - Sedimento urinário com bacteriúria, 40x. Fotografia do LPC-HVUTAD. ... 50
Figura 26 - Sedimento urinário com espermatozoides, 40x. Fotografia do LPC-HVUTAD. ... 50
Figura 27 - Sedimento urinário com gotas lipídicas, 40x. Fotografia do LPC-HVUTAD. ... 50
Figura 28 – Esquema representativo da relação da hematúria com a cistocentese ... 52
XV Índice de tabelas
Tabela 1 – Tipos de cilindros urinários (Baños-Laredo et al., 2010; Sink & Weinstein, 2012). ... 23
Tabela 2 – Tipos de cristais urinários (Sink & Weinstein, 2012). ... 24
Tabela 3 - Escala de leitura do Uranotest 11C ... 33
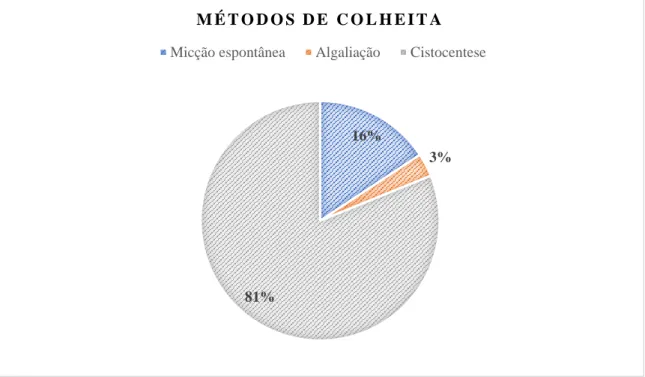
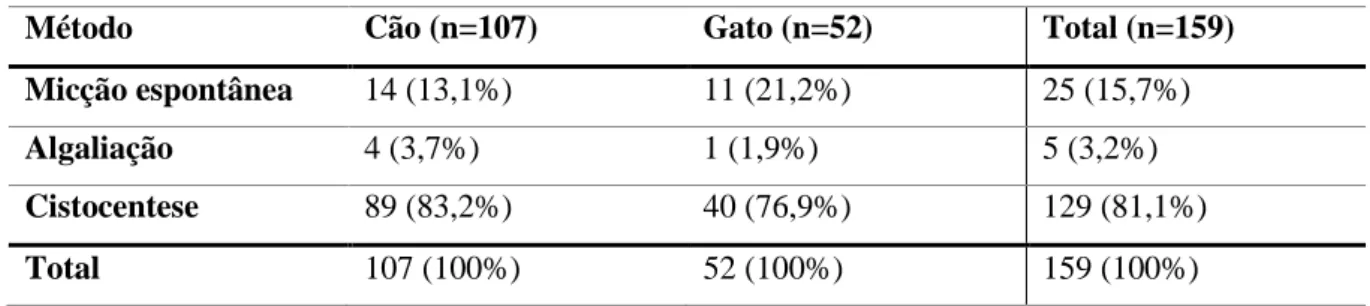
Tabela 4 – Métodos de colheita de urina por espécie em 159 amostras de urina ... 38
Tabela 5 – Cor das amostras de urina em 159 amostras de cão e gato ... 39
Tabela 6 – Turbidez das amostras em 159 amostras de cão e gato ... 40
Tabela 7 – Patologias encontradas em amostras de urina de cão e gato turvas ou muito turvas [33% (n=68)] ... 41
Tabela 8 - Alterações encontradas nos parâmetros bioquímicos da urina com o uso das tiras Uranotest 11C em 159 amostras de cão e gato... 41
Tabela 9 – Resultados da densidade urinária, pH, creatinina e rácio UPC nas tiras Uranotest 11C em 159 amostras de cão e gato ... 42
Tabela 10 – Relação das alterações bioquímicas observadas nas tiras Uranotest 11C em 29 amostras pigmentadas em cães e gatos... 42
Tabela 11 - Concordância entre a 1ª e a 2ª medições do Uranotest 11C em todos os parâmetros... 43
Tabela 12 - Número de casos com células epiteliais no sedimento urinário em 159 amostras de cão e gato ... 47
Tabela 13 – Número de casos de cristalúria em 159 amostras de cão e gato ... 49
Tabela 14 – Outros elementos encontrados no sedimento urinário em 159 amostras de cão e gato ... 50
Índice de gráficos Gráfico 1 – Métodos de colheita de urina por espécie em 159 amostras de urina ... 37
Gráfico 2 – Cor das amostras de urina em 159 amostras de cão e gato ... 38
Gráfico 3 – Turbidez das amostras ... 40
Gráfico 4 - Número de casos com hematúria e piúria no sedimento urinário ... 45
XVII Lista de Siglas e Abreviaturas
CLSI – Clinical and Laboratory Standards Institute CGA – Campo de grande ampliação
κ – Coeficiente Kappa de Cohen ponderado
LPC – HVUTAD – Laboratório de Patologia Clínica do Hospital Veterinário da Universidade de Trás-os-Montes e Alto Douro
r.p.m. – Rotações por minuto
SPSS – Software Package for the Social Sciences THP – Proteína Tamm-Horsfall
1 Capítulo I - Introdução
1.1. Análise de urina
1.1.1. Importância da análise de urina na Medicina Veterinária
A análise de urina, em Medicina Veterinária, apresenta um papel fundamental no diagnóstico de muitas doenças, muitas vezes em casos com sede fora do sistema urinário. Em conjunto com a história clínica do doente, o seu exame físico e a bioquímica clínica, muitas doenças podem estar incluídas ou excluídas da lista de diagnósticos diferenciais.
A urina apresenta-se como um indicador crítico para infeções do trato urinário, doenças renais e doenças não renais (Thrall et al., 2012). Muitas destas doenças não exibem sinais nos estádios iniciais, nos doentes, levando a danos graves quando não diagnosticadas precocemente (Bakan et al., 2016). Muitas vezes, os testes laboratoriais podem não detetar de forma fiável pequenas alterações na função renal, ou seja, os doentes não são diagnosticados até que estejam clinicamente doentes, podendo encontrar-se já em estádios avançados da doença. Uma deteção precoce da doença seria muito importante para que o médico veterinário possa implementar medidas terapêuticas de modo a poder aumentar a qualidade de vida do doente (Garner & Wiedmeyer, 2007). Assim, a nível laboratorial, a análise de urina apresenta uma elevada importância, pois permite obter, aos doentes, um tratamento precoce, aumentando as suas possibilidades de recuperação (Parrah et al., 2013). O exame da urina deve ser considerado como uma ferramenta de triagem e não deve ser realizado isoladamente, pois ocorrem muitos falsos-positivos. Assim, depois de realizada, a análise, pode ser necessário um exame adicional à urina e/ou sangue (Steggall, 2007).
Desta análise, faz parte um conjunto de procedimentos, onde se inclui a avaliação de características físicas da urina (cor, turbidez, densidade, odor), a avaliação de parâmetros bioquímicos (pH, eritrócitos/hemoglobina, leucócitos, bilirrubina, urobilinogénio, nitritos, glicose, corpos cetónicos, proteína) e a avaliação microscópica do sedimento urinário, onde podemos observar eritrócitos, leucócitos, cilindros, cristais, células epiteliais, entre outros. Muitos destes parâmetros são influenciados por toda a fase pré-analítica, desde os métodos de colheita de urina, passando pela manipulação da amostra até ao seu armazenamento e conservação. Deste modo, conjunta de todos estes aumenta em muito a probabilidade de obtenção de um correto diagnóstico (Reine & Langston, 2005).
2
Para a realização das provas da urina de avaliação bioquímica são usadas tiras reativas de urina. São tiras que possuem almofadas com reagentes que nos permitem identificar, semiquantitativamente, os parâmetros pretendidos. É uma prova de fácil utilização e de custo reduzido para o doente/proprietário. Contudo, a precisão dos resultados depende de uma correta colheita da amostra, do respeito pelas normas pré-analíticas (tempo, transporte, armazenamento, refrigeração da amostra), de uma correta interpretação da escala de cores e do tempo preciso de leitura da tira (Smith et al., 2016). Hoje em dia, a ciência concentra-se na automatização de todos os procedimentos referentes à análise de urina para, deste modo, reduzir o trabalho manual e subjetivo por parte do técnico (Dumonceaux & Gamez, 2016).
1.1.2. Métodos de colheita de urina
Os métodos de colheita de urina apresentam alguma importância na prática veterinária. pois podem condicionar a análise dos resultados (Parrah et al., 2013). As técnicas mais utilizadas para obtenção de urina são a micção espontânea com ou sem compressão manual da bexiga, a algaliação e a cistocentese, sendo que o último é o mais seguro e eficaz contra a contaminação do trato urogenital (Radin & Meyer, 2010).
1.1.2.1. Micção espontânea
Este é o método menos invasivo, não apresentando nenhum risco para o doente. Além disso, é uma técnica fácil de executar (Sink & Weinstein, 2012). A colheita por este método é realizada, de preferência, pela manhã, pois é quando a urina se encontra, normalmente, na concentração máxima (Thrall et al., 2012). O primeiro jato deve ser rejeitado, pois contém células, bactérias e detritos da zona urogenital, resultando numa amostra não representativa (Reine & Langston, 2005). As amostras resultantes deste método apresentam um maior risco de contaminação por microrganismos provenientes do trato genital, pele ou pelos, podendo resultar em falso-positivos nos testes microbiológicos. Para diminuir o grau de contaminação, a zona urogenital deve ser limpa antes da colheita da amostra (Sink & Weinstein, 2012). O recipiente de colheita de urina deve estar limpo e sem detergentes para evitar interferências nos testes bioquímicos. Apesar da amostra não ser indicada para cultura microbiológica, podem ser realizados os restantes parâmetros (Reine & Langston, 2005). Além da cultura bacteriana, este tipo de colheita também interfere na avaliação microscópica do sedimento e na avaliação das
3
proteínas, pois as amostras de urina colhidas por micção espontânea podem conter uma maior quantidade de células epiteliais (Caney, 2010). A compressão manual da bexiga melhora a obtenção da amostra (Reine & Langston, 2005).
1.1.2.2. Algaliação
A algaliação é um método que requer um grau de treino do operador mais elevado do que o método anteriormente descrito (Sink & Weinstein, 2012). A algaliação pode dar origem a pequenas hemorragias e, também, pode introduzir células epiteliais da uretra na urina (Thrall et al., 2012). Antes da algaliação, os órgãos genitais externos devem ser limpos, assim como todo o material utilizado deve ser esterilizado. Depois da introdução do cateter urinário na bexiga, deve desprezar-se ou eliminar os primeiros mililitros de urina, pois é a porção que contém mais detritos provenientes da uretra, podendo influenciar os resultados. O risco de haver uma infeção urinária através do cateterismo é maior em animais do sexo feminino, comparativamente aos do sexo masculino (Reine & Langston, 2005).
1.1.2.3. Cistocentese
Este método é rápido e seguro e consiste na colheita de urina com agulha e seringa diretamente na bexiga, através da parede abdominal. É um método muito comum para a obtenção de urina de cães e gatos. A cistocentese simplifica a interpretação dos resultados, pois é eliminada a contaminação do trato urogenital (Parrah et al., 2013). Apesar de ser considerada uma técnica segura, apresenta alguns efeitos colaterais como presença de hematúria devido ao contacto entre a agulha e a parede oposta da bexiga. Pode também ocorrer rutura da bexiga e vazamento de urina e, deste modo, a cistocentese deve ser eco-guiada para diminuir o risco de lesão dos órgãos adjacentes (Sink & Weinstein, 2012). Se a análise pretendida for para monitorizar a hematúria, a colheita por micção espontânea é o método mais indicado (Reine & Langston, 2005). A cistocentese é o método de colheita ideal para a realização de cultura bacteriana e geralmente pode ser efetuada com o doente acordado (Sink & Weinstein, 2012).
4 1.1.3. Manuseamento da amostra
As variáveis pré-analíticas têm uma grande importância em todo o processo analítico porque um pequeno erro pode condicionar um conjunto de resultados, sendo que, de uma forma geral, cerca de 50% de todos os resultados incorretos devem-se a erros pré-analíticos (Carraro & Plebani, 2007). Deste modo, é necessário um manuseamento e armazenamento de amostras corretos para obter resultados mais precisos (Veljkovic et al., 2012). Assim, as diretrizes europeias de análise de urina foram publicadas pela primeira vez em 2000, para garantir uma correta análise, fornecendo instruções claras, como o tempo, padronização de procedimentos, armazenamento, informações sobre diferentes amostras de urina, entre muitos outros conceitos de grande importância para a realização dos vários procedimentos (Kouri, 2000).
1.1.3.1. Recipiente de recolha
As amostras de urina são, normalmente, transferidas do recipiente de recolha para um recipiente secundário, dependo do tipo de teste a realizar. O recipiente secundário deve ser selecionado de acordo com o tipo de teste, como, por exemplo, se for necessário a realização do exame microscópico do sedimento urinário, o tubo deve encaixar na centrífuga. Além disso, todos os recipientes devem ser estéreis. Os recipientes não devem ser lavados e reutilizados, pois os detergentes interferem com a análise química e análise do sedimento urinário. É, também, obrigatório o uso de recipientes transparentes para se poder avaliar as características físicas da urina como a cor e a turbidez (Sink & Weinstein, 2012). A identificação de todas as amostras, é um aspeto a salientar pois podem ocorrer erros de identificação (Veljkovic et al., 2012).
1.1.3.2. Transporte
A colheita e transporte do analito para o laboratório, a receção pelo laboratório e a preparação e transporte para a zona específica do laboratório, podem induzir potenciais fontes de erro (Delanghe & Speeckaert, 2016). As amostras devem ser entregues o mais rapidamente possível ao laboratório de modo a serem analisadas (Sink & Weinstein, 2012). O transporte é, muitas vezes, uma questão externa ao laboratório tornando-se um pouco difícil de controlar. O atraso do transporte, a distância do posto de recolha ao laboratório, a temperatura e o modo de
5
transporte, tudo pode prejudicar a análise e ser realizada fora do intervalo de tempo correto (Veljkovic et al., 2012).
1.1.3.3. Tempo e refrigeração
A urina deve ser analisada, idealmente, até 30 minutos após a colheita (Parrah et al., 2013). Contudo, as diretrizes do CLSI recomendam uma análise dentro de 2 horas após a colheita (Kouri, 2000). Se não for possível é aconselhada a refrigeração num recipiente hermético para não ocorrer a deterioração dos componentes celulares ou perda da amostra. As células e os cilindros urinários acabam por se alterar se estiverem à temperatura ambiente e a glicose é metabolizada, aquando à presença de células. Há uma diminuição de corpos cetónicos, assim como bilirrubina e CO2. O pH aumenta de acordo com a libertação de CO2 e a conversão
de ureia em amoníaco, havendo proliferação de bactérias (Thrall et al., 2012). Muitos dos parâmetros dependem do intervalo de tempo entre a recolha e a análise laboratorial (Delanghe & Speeckaert, 2016). Contudo, há estudos que mostram que num intervalo de tempo de 120 minutos, já ocorrem alterações dos constituintes da urina e, deste modo, recomendam um intervalo de tempo até 90 minutos após colheita (Dolscheid-Pommerich et al., 2016).
O intervalo de tempo vai depender do tipo de teste a realizar (Delanghe & Speeckaert, 2016). O foco pré-analítico não deve estar apenas no armazenamento, mas também na estabilidade do analito. Para a preservação da amostra até 2 horas da colheita, para efeitos de análise bioquímica e observação do sedimento, a urina deve ser armazenada a 4ºC, contudo, outras análises podem ser realizadas após 4 horas da colheita (Kouri, 2000). As culturas bacterianas podem ser executadas em amostras conservadas a 4ºC por um intervalo de 24 horas (Koivula et al., 1990).
A refrigeração é o método mais usado para preservação da amostra de urina e é preferido à utilização de conservantes, pois há uma menor probabilidade de afetar os resultados bioquímicos das tiras reativas de urina (Albasan et al., 2003). Este método é capaz de conservar melhor os componentes celulares e diminuir a velocidade da proliferação bacteriana. Contudo, também apresenta algumas desvantagens como um aumento da densidade urinária porque a urina a temperaturas mais inferiores torna-se mais densa que à temperatura ambiente. A refrigeração pode inibir reações enzimáticas nas tiras reativas de urina. Além disso, leva à formação de novos cristais urinários. Recomenda-se, então, que antes de realizar a análise se
6
agite levemente a amostra e que se permita que volte à temperatura ambiente e, deste modo, melhore as reações enzimáticas e dissolva os cristais formados (Sink & Weinstein, 2012). Não há um tempo definido para a refrigeração da urina e manter a sua preservação, pois depende da presença de diferentes elementos em cada amostra (Ekşioglu et al., 2016). Relativamente à formação de cristais, com a refrigeração há a formação dos mesmos tipos de cristais que se formam in vivo. Deste modo, pode prejudicar a interpretação clínica do sedimento, pois os cristais podem não estar presentes quando realizada a colheita (Albasan et al., 2003).
O congelamento da amostra deve ser evitado pois proporciona uma destruição dos cilindros urinários e de outros componentes celulares, como eritrócitos ou leucócitos. Além disso, provoca alterações no pH urinário (Parrah et al., 2013).
1.1.3.4. Uso de conservantes
Com o aumento da distância entre o doente e o laboratório, há, também, um aumento no desafio pré-analítico. Como foi referido, a análise deve ser realizada duas horas após a colheita, caso contrário, deve ser refrigerada ou devem ser utilizados conservantes, dependendo da análise pretendida (Ekşioglu et al., 2016).
A adição de conservantes não é recomendada na análise de urina de rotina, contudo a integridade da amostra pode ser mantida através de métodos de preservação. O uso destes métodos pode ser necessário em amostras que tenham um transporte com uma maior duração e não possam ser refrigerados. A escolha do conservante é importante pois não deve alterar a composição da urina nem interferir nos testes laboratoriais (Sink & Weinstein, 2012). Tradicionalmente, foram usados conservantes em amostras para análise microbiológica (Ekşioglu et al., 2016). O uso destes compostos geralmente previne alterações metabólicas da amostra, assim como o crescimento bacteriano (Delanghe & Speeckaert, 2016).
A formalina tem a vantagem de preservar o sedimento e o fluoreto de sódio inibe a glicólise, porém, ambos os conservantes interferem nas tiras reativas de urina (Sink & Weinstein, 2012). O etanol é usado para preservar os constituintes celulares (Ekşioglu et al., 2016). O CLSI aconselha a que, se forem tomadas medidas de conservação, devem primeiro ser avaliadas no laboratório, pois podem ter algumas limitações para testes específicos (Kouri, 2000).
7 1.1.4. Propriedades físicas da urina
As propriedades físicas da urina a avaliar numa análise macroscópica da urina são a cor e a turbidez da urina, a avaliação do odor e ainda a avaliação da densidade urinária.
1.1.4.1. Cor
A cor e transparência são avaliadas através da observação do recipiente que contem a amostra de urina. A cor normalmente é avaliada em função da densidade urinária e do volume da amostra (Parrah et al., 2013). A coloração pode variar de incolor a preto, sendo que estas variações são causadas pelo normal funcionamento do metabolismo, esforço físico, administração de fármacos ou condições patológicas. Esta propriedade da urina é, muitas vezes, usada de forma estimativa como um indicador do estado de hidratação do doente (Sink & Weinstein, 2012). As causas da variação de cor levam à existência de muitos pigmentos exógenos e endógenos que proporcionam estas alterações na cor da urina. As cores anormais observadas com maior frequência são vermelho, castanho e preto em que a hematúria, mioglobinúria, hemoglobinúria e bilirrubinúria são as causas mais comuns. Para distinguir a hematúria da mioglobinúria ou hemoglobinúria, é necessário centrifugar a urina e observar a cor do sobrenadante. Se o sobrenadante ficar translúcido, estamos perante uma hematúria, pois os eritrócitos intactos sedimentam, em caso de hemoglobinúria o sobrenadante permanecerá avermelhado (Reine & Langston, 2005). Mas também podemos encontrar outras cores nas amostras como laranja (desidratação, medicamentos, problemas hepáticos), azul/verde (dieta, medicação, infeções), castanho (distúrbios hepáticos, dieta, exercício, medicação) e vermelho (infeções, tumores, cálculos, medicação, dieta, todos estes são causas de hematúria) (Dumonceaux & Gamez, 2016).
1.1.4.2. Turbidez
A turbidez da urina pode ser provocada por elementos suspensos presentes na amostra, como cristais, muco, células, entre outros, que não alteram a densidade urinária, podendo não indicar uma patologia (Thrall et al., 2012). Uma urina concentrada é mais suscetível a ser turva que uma urina diluída (Reine & Langston, 2005). Posteriormente ao armazenamento, a amostra pode apresentar-se turva pois pode ocorrer, tal como já descrito, precipitação de sais, fosfatos amorfos, carbonatos, entre outros. Com o aumento da temperatura, estes acabam por se
8
dissolver (Sink & Weinstein, 2012). A avaliação do sedimento urinário ajuda a verificar a causa da turbidez presente na amostra. Contudo, deve-se analisar a turvação após a colheita, pois como foi referido, durante o armazenamento há precipitação de cristais (Reine & Langston, 2005).
1.1.4.3. Odor
O odor é uma propriedade que não é usualmente avaliada nas análises de urina de rotina, contudo, há diversos elementos que vão alterar o odor da urina e que, muitas vezes, podem facilitar a interpretação dos resultados. O cheiro a amónia indica que estamos perante uma urina envelhecida ou perante a presença da ação da urease bacteriana. Um odor a acetona mostra cetonemia. O uso de diferentes fármacos também se vai pronunciar no cheiro da urina. Cheiros a químicos distintos podem sugerir contaminação através de conservantes presentes na amostra, desinfetantes ou produtos de limpeza da pele (Sink & Weinstein, 2012).
1.1.4.4. Densidade urinária
A densidade urinária consiste na razão entre o peso de um volume de urina e o peso do mesmo volume de água pura, à mesma temperatura, e aumenta proporcionalmente com a concentração de soluto, variando com o tipo de soluto. A osmolalidade na urina, também é considerado um índice de concentração de urina. A osmolalidade consiste na concentração total do soluto por unidade de peso do solvente. A osmolaridade expressa o número de partículas por unidade de volume de solução (Watson, 1998). Assim, a densidade e a osmolalidade são diretamente proporcionais (Parrah et al., 2013). Contrariamente à densidade urinária, a osmolalidade e a osmolaridade não são afetadas por outras características da solução, como o peso molecular e a composição química (Watson, 1998). O padrão clínico mais preciso para a medição da concentração da urina é a osmolalidade, através do osmómetro, contudo, são equipamentos dispendiosos e não estão integrados na rotina laboratorial (Wyness et al., 2016). Deste modo, a avaliação da densidade urinária pelo método de refratometria tem demonstrado consistência e uma elevada correlação com a osmolalidade da urina (Minton et al., 2015). Os solutos presentes na urina são compostos por numerosos eletrólitos e por produtos que são resultado do metabolismo interno (ureia e creatinina). A urina apresenta uma composição de aproximadamente 5% de solutos e 95% de água sendo que a concentração de solutos acaba por
9
ser afetada pelo estado de hidratação do doente. Elementos com maior dimensão como a ureia, glicose ou proteínas causam uma maior densidade do que o sódio ou o cloreto (Sink & Weinstein, 2012). A densidade urinária permite avaliar a função renal, a capacidade que os túbulos têm para concentrar e diluir a urina, mantendo a homeostase, assim como, manter ou excretar água adequadamente, avaliando o estado de hidratação. Permite, também, avaliar a perda de elementos na urina (Rishniw & Bicalho, 2015; Watson, 1998). Através da urina também nos é possível avaliar o estado de hidratação do doente, pois a urina é, normalmente, composta por 95% de água, contudo, não conseguimos realizar essa avaliação através das tiras reativas de urina. Quando temos uma amostra com densidade urinária <1,008 (hipostenúria), é nos indicado que a urina é mais diluída que o ultrafiltrado glomerular, apresentando uma osmolalidade menor que a do plasma, os rins podem não apresentam capacidade de concentrar urina e o doente pode possuir uma insuficiência renal. Quando temos uma densidade urinária entre 1,008 e 1,012 (isostenúria), indica-nos que a osmolalidade da urina, do plasma e do ultrafiltrado glomerular é semelhante, podendo sugerir uma insuficiência renal primária. As amostras com densidade urinária >1,012 (hiperestenúria) apresentam uma urina moderadamente concentrada a concentrada, indicando uma função renal adequada, contudo, se o doente apresentar desidratação pode ter uma insuficiência renal ou extra-renal. A densidade urinária em cães saudáveis varia entre 1,015 e 1,040 e em gatos saudáveis varia entre 1,036 e 1,060 (Parrah et al., 2013; Reine & Langston, 2005; Sink & Weinstein, 2012).
1.1.4.4.1. Refratometria
A refratometria é um método de medição da densidade urinária através do uso do refratómetro. Este instrumento mede o grau em que a luz é refratada quando atravessa a urina, e o índice de refração depende da concentração de solutos (Parrah et al., 2013). É um método indireto que substitui os métodos diretos, pois a refratometria é um processo simples de realizar e de baixo custo (Sink & Weinstein, 2012). Este método de rápida execução e de leitura imediata de resultados necessita de apenas uma gota de urina para a sua realização (Thrall et al., 2012). Além da concentração e da composição do soluto, a temperatura também é um fator que influencia o índice de refração e, como tal, a densidade (Sink & Weinstein, 2012). O refratómetro (Figura 1) permite fazer uma leitura rápida (<1 minuto) e precisa da densidade. Contudo, há possíveis erros como uma má calibração, má interpretação da escala, contaminação da amostra, falta de limpeza na placa de luz natural, ou a superfície do prisma, que podem afetar
10
a leitura da densidade urinária. Com a finalidade de diminuir o tempo de leitura foram introduzidos refratómetros digitais na rotina, o seu uso também leva a uma diminuição de alguns potenciais erros de determinação (Minton et al., 2015).
Embora a densidade urinária seja a unidade mais frequente para relatar a concentração de solutos na urina, pode nem sempre ser a mais indicada. A escala da densidade presente nos refratómetros é baseada em dados experimentais de urina normal. Certos solutos alteram a relação entre a refração e a densidade urinária, como, por exemplo, a acetona que tem uma densidade menor que a água, reduzindo a densidade da urina, mas no entanto aumenta a refração (Ayoub et al., 2013). Para a urina humana, a medição da densidade por refratometria apresenta uma correlação linear próxima à osmolalidade, e se as amostras conterem proteínas e glicose devem ser excluídas (George, 2001). Nestes casos, Osborne 1995 recomenda fazer correções da leitura da densidade (Osborne et al., 1995).
1.1.5. Propriedades bioquímicas da urina
Em Medicina Veterinária, as características bioquímicas da urina são, por norma, avaliadas através do uso de tiras reativas de urina que consiste num método de bioquímica seca semi-quantitativa. As tiras reativas de urina são usadas na rotina laboratorial da Medicina Veterinária pois apresentam uma grande facilidade de execução para o técnico, fornecem várias informações sobre o estado clínico do doente e permitem rapidez na obtenção de resultados (Defontis et al., 2013). As tiras reativas de urina são compostas por um conjunto de almofadas
Figura 1 – Refratómetro (FG-302, Rojo Sampaic, França). Fotografia do
11
constituídas por reagentes na forma sólida e, quando estas, são expostas a determinadas substâncias químicas, sofrem uma alteração de cor, pois ocorreu uma reação química. Os resultados são obtidos por comparação da cor obtida com uma escala de cores fornecida pelo fabricante. Para cada parâmetro, cada cor corresponde a um intervalo de concentração (Caple & Pravikoff, 2016).
As tiras reativas de urina têm como objetivo a análise química da urina incluindo vários parâmetros como bilirrubina, urobilinogénio, glicose, corpos cetónicos, proteínas, eritrócitos/ hemoglobina, leucócitos, densidade urinária e pH (Dumonceaux & Gamez, 2016). Esta técnica apresenta uma elevada importância pelo facto de detetar as anormalidades na bioquímica da urina, referentes a distúrbios renais, metabólicos e hepáticos, entre outros, alertando o clínico da necessidade de testes adicionais de diagnóstico e fornece informações relativas à avaliação e monitorização de terapias (Caple & Pravikoff, 2016). Podemos encontrar também tiras que nos dão uma avaliação dos parâmetros creatinina e microalbumina, assim como, o rácio proteína/creatinina (UPC) (Dumonceaux & Gamez, 2016).
Contudo, a imprecisão e a instabilidade dos elementos presentes na urina são, muitas vezes, ignoradas pelos clínicos. Se a análise bioquímica, através das tiras reativas, não for realizada dentro do tempo recomendado e de acordo com as recomendações de manuseamento, ocorrem alterações da urina e não obtemos o resultado pretendido (Caple & Pravikoff, 2016; Skitek, 2004).
Sendo um método muito utilizado, a ciência tende sempre a melhorá-lo. Deste modo, há estudos em Medicina Humana que pretendem integrar biomarcadores urinários para proteínas específicas com a finalidade de diagnosticar e monitorizar diversas doenças (Boyd & Barratt, 2011).
1.1.5.1. pH
O pH urinário mede a capacidade renal de regular a concentração de iões de hidrogénio, fornecendo uma estimativa do equilíbrio ácido-base do organismo. Contudo, o pH urinário não reflete o pH corporal, porque depende da alimentação, da presença de infeções bacterianas, variação diurna e estado da doença, entre outros (Sink & Weinstein, 2012). Uma alimentação rica em proteína, como no caso dos carnívoros, produz uma urina ácida a neutra e os herbívoros apresentam um pH urinário neutro a alcalino. Apesar disso, qualquer animal pode apresentar
12
uma urina alcalina, pois as bactérias são responsáveis pela metabolização da ureia, convertendo-a em convertendo-amóniconvertendo-a, levconvertendo-ando à convertendo-alcconvertendo-alinizconvertendo-ação dconvertendo-a urinconvertendo-a. Nconvertendo-a rotinconvertendo-a lconvertendo-aborconvertendo-atoriconvertendo-al, pconvertendo-arconvertendo-a medir o pH urinário pode ser usado um potenciómetro, ou mais facilmente, as tiras reativas de urina (Parrah et al., 2013). O pH urinário dos cães e dos gatos encontra-se normalmente entre 5 e 7 (Thrall et al., 2012).
O medidor de pH, ou potenciómetro, fornece-nos uma medição mais precisa, contudo torna-se um método mais complicado de realizar na prática clínica devido à necessidade de frequentes manutenções e calibrações do aparelho e, também, necessita de uma maior quantidade de amostra. Assim, na rotina laboratorial são usadas as tiras reativas de urina. A metodologia das tiras reativas baseia-se na presença de dois indicadores, vermelho de metilo e azul de bromotimol, que vão reagir com os iões de hidrogénio presentes na amostra resultando uma cor visível na almofada da tira urinária (Sink & Weinstein, 2012).
1.1.5.2. Glicose
A presença de glicose na urina denomina-se glicosúria. Um animal saudável excreta pouca ou nenhuma glicose através da urina (Parrah et al., 2013). Se a concentração de glicose no sangue for elevada, os túbulos renais excedem a sua capacidade de reabsorção de glicose e esta passará para a urina (Dumonceaux & Gamez, 2016). O limiar de excreção renal dos gatos (14-17 mmol/L) é superior ao dos cães (10 mmol/L) (Parrah et al., 2013). A glicosúria é detetada pela reação enzimática da glicose oxidase e peroxidase, que apresenta especificidade para a glicose (Reine & Langston, 2005; Sink & Weinstein, 2012).
As amostras de urina refrigerada devem ser levadas à temperatura ambiente para que a leitura da concentração de glicose na urina não se traduza em resultados falsos negativos (Reine & Langston, 2005). O ácido ascórbico, também, é reconhecido como interferente porque pode inibir a oxidação do cromogéneo, presente na almofada das tiras reativas, obtendo-se um resultado falso-negativo (Costa et al., 2012). Além da temperatura e do ácido ascórbico, uma grande concentração de corpos cetónicos e um aumento da densidade urinária também afetam a sensibilidade da almofada da tira reativa para a glicose (Dumonceaux & Gamez, 2016).
13 1.1.5.3. Corpos cetónicos
A presença de corpos cetónicos na urina tem por nome cetonúria. Um animal saudável não deve conter corpos cetónicos na urina, contudo podemos estar perante uma amostra com cetonúria se o animal se encontrar em jejum (Parrah et al., 2013; Thrall et al., 2012). Na urina podem ser encontrados três tipos de corpos cetónicos, sendo excretados nas seguintes proporções: 78% de beta-hidroxiburato, 20% de acetoacetato e 2% de acetona. A almofada das tiras contém nitroprussiato de sódio que reage, principalmente, com o ácido aceto-acético, podendo reagir com menor eficiência com a acetona (volátil) presente na amostra. As tiras reativas de urina não detetam o corpo cetónico mais abundante, o beta-hidroxiburato, porque este não possui o grupo cetona na sua estrutura química, portanto, não é detetado (Reine & Langston, 2005; Thrall et al., 2012).
Como interferentes para a deteção dos corpos cetónicos na tira reativa de urina temos uma urina bastante pigmentada, resultando em falsos-positivos, ou amostras mal armazenadas, resultando falsos-negativos (Dumonceaux & Gamez, 2016).
1.1.5.4. Bilirrubina
A bilirrubina forma-se a partir da degradação da hemoglobina, convertendo o grupo heme em bilirrubina, que é conjugada no fígado e excretada na bílis. Assim, alguma da bilirrubina conjugada liberta-se pela circulação sanguínea e é filtrada pelo glomérulo, levando ao seu aparecimento na urina. A almofada correspondente à bilirrubina nas tiras reativas de urina utiliza o diazónio para mudança de cor, pois este composto é mais sensível à bilirrubina conjugada e liga-se a esta produzindo uma mudança de cor (Reine & Langston, 2005).
Em cães com uma densidade urinária normal, o aparecimento de pequenas quantidades de bilirrubina na urina (equivalentes a 1+) é fisiológico, contrariamente aos gatos, pois o cão tem capacidade de conjugar a bilirrubina a nível renal e, também, porque os cães apresentam um limiar de excreção renal da bilirrubina menor do que os gatos. Nos gatos, mesmo que a bilirrubina apareça em pequenas quantidades em urina concentrada, é sempre um indicador de doença (Parrah et al., 2013; Reine & Langston, 2005).
14 1.1.5.5. Sangue
A presença de sangue na tira reativa de urina indica a ocorrência de hematúria, hemoglobinúria ou mioglobinúria. A hematúria define-se como a presença de eritrócitos na urina e pode ser o resultado de hemorragia em qualquer parte do trato urinário (Boyd & Barratt, 2011; Sink & Weinstein, 2012). O ferro, que se encontra na constituição dos glóbulos vermelhos, é o componente que causa a reação de oxidação na almofada da tira reativa de urina, que resulta na mudança de cor. Esta cor varia consoante a quantidade de “heme” detetada (Thrall et al., 2012). Podem ocorrer falsos-positivos em amostras contaminadas com agentes oxidantes em desinfetantes, assim como, falsos-negativos se os eritrócitos estiverem depositados no fundo do recipiente, fazendo com que haja uma disparidade entre a leitura da tira e a análise do sedimento urinário. Os eritrócitos, em urinas diluídas ou alcalinas, acabam por lisar (Reine & Langston, 2005). Contudo, existem mais casos onde ocorrem resultados falsos-positivos como a presença de espermatozoides, hipoclorito de sódio ou peroxidases bacterianas ou vegetais (Pirkle et al., 2013). A presença de ácido ascórbico pode degradar o peróxido de hidrogénio presente na almofada da tira, fazendo com que ocorra uma reação falsa-negativa (Sink & Weinstein, 2012).
O grupo heme da hemoglobina e mioglobina comportam-se como uma peroxidase, levando à alteração da almofada da tira urinária. A hemoglobinúria, presença de hemoglobina na urina, pode ocorrer se os eritrócitos intactos hemolisarem na urina, ou se os níveis de hemoglobina no sangue são elevados. A mioglobinúria, presença de mioglobina na urina, pode ocorrer devido a uma lesão muscular. Para uma distinção entre hematúria e hemoglobinúria ou mioglobinúria, como já explicado, é necessária uma visualização do sobrenadante da amostra, após centrifugação. Para a distinção de hemoglobinúria e mioglobinúria, teremos de verificar outros parâmetros indicadores de lesão muscular (Reine & Langston, 2005).
1.1.5.6. Leucócitos
Este é um parâmetro que, normalmente, não é considerado para análises de urina em Medicina Veterinária, quando usadas as tiras reativas de urina (Sink & Weinstein, 2012). Através da observação do sedimento urinário ao microscópio é possível determinar a existência de leucócitos na urina. No entanto esta é uma metodologia demorada e em alternativa são usadas as tiras reativas de urina, que é considerada uma técnica simples, rápida e barata (Holan et al.,
15
1997). As tiras reativas de urina detetam esterase leucocitária humana, uma enzima presente nos leucócitos, e quando ocorre um aumento desta enzima indica-nos inflamação no trato urinário. Estas células sanguíneas podem estar presentes na urina com ou sem a presença de bactérias (Dumonceaux & Gamez, 2016).
Contudo, a determinação de leucócitos em animais deve ser realizada através da análise microscópica do sedimento urinário (Thrall et al., 2012). Em cães, as tiras reativas de urina apresentam especificidade, mas não sensibilidade pois não detetam muitos casos de piúria, porém um teste positivo é indicador de piúria. No caso dos gatos, este teste apresenta uma elevada inespecificidade para a deteção de piúria, sendo que há uma elevada taxa de falsos positivos, tornando este teste com pouca utilidade nesta espécie (Holan et al., 1997; Reine & Langston, 2005). Um aumento de glicose, proteína e densidade urinária pode traduzir-se em interferentes na reação da almofada da tira reativa, assim como, antibióticos, fármacos ou alimentação (Dumonceaux & Gamez, 2016).
1.1.5.7. Urobilinogénio
A bílis excreta bilirrubina conjugada que posteriormente é degradada pelas bactérias existentes no intestino em urobilinogénio. O urobilinogénio é convertido, por oxidação, em urobilina e uma pequena quantidade é reabsorvida e excretada através da urina. Como o urobilinogénio é instável, as amostras armazenadas de urina fornecem resultados imprecisos, assim, a concentração de urobilinogénio apresenta uma utilização clínica questionável, para além de que este elemento é, geralmente, encontrado na urina em pequenas quantidades (Reine & Langston, 2005; Steggall, 2007). Contudo, como o parâmetro urobilinogénio faz parte das tiras reativas de urina utilizadas na Medicina Humana, este foi incorporado nas tiras usadas em Medicina Veterinária (Sink & Weinstein, 2012).
Os principais interferentes desta substância são a formalina, elevadas concentrações de nitritos e fármacos. As amostras devem ser levadas à temperatura ambiente para não nos fornecer um resultado incorreto (Dumonceaux & Gamez, 2016).
16 1.1.5.8. Nitritos
A presença de nitritos nas amostras de urina, nitritúria, dá-nos uma evidência indireta de infeção bacteriana, pois as bactérias, tipicamente gram-negativas, são responsáveis pela produção de nitritos (Sink & Weinstein, 2012; Thrall et al., 2012). Isto deve-se ao facto de as bactérias conterem nitrito redutase e, consequentemente, o nitrato urinário ser convertido em nitrito (Sink & Weinstein, 2012). Contudo, a presença de nitrito não é um marcador de confiança da bacteriúria, ou seja, presença de bactérias na urina, em pequenos animais com a presença de muitos falsos-positivos e falsos-negativos (Reine & Langston, 2005). Pelo que, um resultado negativo não significa que a infeção urinária não esteja presente, pois, alguns microrganismos não têm a capacidade de converter nitrato em nitrito (Steggall, 2007). Também podem ocorrer resultados falsos-negativos em amostras que não tenham ficado retidas na bexiga o tempo suficiente para uma conversão em nitrito. Como nos animais, o tempo de retenção torna-se mais complicado de controlar, este teste torna-se numa ferramenta pouco valiosa; além disso, podem ocorrer falsos-positivos em amostras de urina com uma coloração muito acentuada e densidades urinárias elevadas (Sink & Weinstein, 2012).
Como interferentes na determinação de nitritos, temos uma elevada concentração de ácido ascórbico e um armazenamento inadequado (Dumonceaux & Gamez, 2016).
1.1.5.9. Densidade urinária
A medição da densidade urinária através das tiras reativas de urina tem por base a mudança de cor do azul bromometimol, um indicador de pH (Dossin et al., 2003). Através desta reação, obtém-se uma estimativa indireta com base no pKa que utiliza a mudança de pH para ocorrer uma mudança de cor. Como as tiras reativas de urina foram desenvolvidas para Medicina Humana, os resultados da tira não se correlacionam muito bem com os resultados pelo método de refratometria, pois a urina de cão é mais concentrada, variando entre 1,015 e 1,040, assim como a urina de gato, que varia entre 1,036 e 1,060, do que em humanos, que varia entre 1,003 e 1,030 (Dossin et al., 2003; Parrah et al., 2013; Thrall et al., 2012).
Deste modo, o parâmetro da densidade das tiras reativas de urina apresenta uma elevada imprecisão em toda a gama de valores, sendo recomendado, em Medicina Veterinária, o uso do refratómetro para medição da densidade urinária (Dossin et al., 2003; Van Vonderen et al., 1995).
17 1.1.5.10. Proteínas
A presença de proteína na urina designa-se por proteinúria (Dumonceaux & Gamez, 2016). Uma lesão no glomérulo renal permite a que as proteínas de maior dimensão e com carga negativa atravessem a barreira de filtração glomerular, ocorrendo proteinúria (Garner & Wiedmeyer, 2007). A proteinúria persistente numa urina com um sedimento inativo é um marcador patológico com uma elevada importância, em cães e gatos (Vilhena et al., 2015). A proteinúria pode ter origem pré-glomerular, glomerular ou pós-glomerular (Reine & Langston, 2005).
Numa tira reativa de urina, a almofada correspondente às proteínas é mais sensível à albumina do que às outras proteínas (Dumonceaux & Gamez, 2016). A albumina é a principal proteína presente na urina na maior parte dos cães e gatos, saudáveis ou doentes. No entanto, a proteinúria indica a presença de qualquer proteína na urina (albumina, globulinas, proteínas Bence-Jones, entre outras) (Vilhena et al., 2015). O filtrado glomerular, normalmente, contém uma reduzida quantidade de albumina, pois é uma proteína com uma estrutura grande para atravessar a barreira de filtração. A albuminúria indica disfunção renal, por lesão renal. A deteção de albuminúria dá-nos um diagnóstico precoce de doença renal, permitindo uma melhor monitorização da doença, prevenindo ou retardando a progressão da mesma (Murgier et al., 2009).
A microalbuminúria é definida como a quantidade de albumina que não é detetada através das tiras convencionais apresentando-se abaixo do limiar de deteção, ou seja, são pequenas quantidades de proteína que são perdidas na urina. A microalbuminúria é a albumina urinária que se encontra abaixo de 30 mg/dL enquanto que a albuminúria se apresenta acima de 30 mg/dL, numa amostra de urina com densidade urinária normal (Thrall et al., 2012). A presença de microalbumina pode indicar o início de uma doença renal, não apresenta sintomas clínicos (Garner & Wiedmeyer, 2007). A microalbuminúria geralmente antecede uma proteinúria, tornando-se um excelente marcador de doença renal, doença sistémica e doença subclínica (Murgier et al., 2009).
Uma urina muito alcalina, urina muito pigmentada, ou presença de desinfetantes pode traduzir-se em leituras da tira urinária falsas-positivas (Sink & Weinstein, 2012).
18 1.1.5.11. Creatinina
A creatinina é um produto de degradação da creatina muscular e creatina fosfato que é excretado através da filtração glomerular nos rins. A depuração desta substância corresponde ao volume de plasma que é depurado de creatinina por unidade de tempo. Nos cães, a maioria da creatinina que entra no filtrado é excretada (Thrall et al., 2012). A depuração de creatinina é relativamente constante nos animais saudáveis, pois a creatinina atravessa facilmente o filtro glomerular comparativamente com a proteína (Welles et al., 2006).
A determinação da concentração de creatinina, através do uso de tiras reativas de urina, consiste na atividade semelhante à peroxidase de um complexo de creatinina e cobre, ocorrendo alteração colorimétrica da área de teste (Welles et al., 2006; Wilde et al., 2008).
1.1.5.12. Rácio Proteína/Creatinina
A quantificação da proteína é um procedimento importante que nos pode levar ao diagnóstico de várias doenças renais. Deste modo, é feita uma quantificação da perda da proteína ao longo de um período de 24 horas, sendo considerado o método mais preciso para a avaliação da proteinúria. Contudo, em Medicina Veterinária, é um processo complicado e de difícil realização (Welles et al., 2006). Para corrigir esse problema, foi desenvolvida a técnica da medição do rácio UPC.
O rácio UPC é um método alternativo para uma avaliação quantitativa de proteinúria e designa-se como uma medição da relação proteína-creatinina numa amostra de urina (Xin et al., 2004). Esta relação correlaciona-se com a excreção de proteína diária e é um método prático, pois pode ser avaliado apenas numa amostra de urina. O rácio UPC apresenta uma grande importância para quantificar com precisão a proteinúria e para uma monitorização de diversos tratamentos e elevada importância diagnóstica e prognóstica (Beatrice et al., 2010). O melhor método para obter o rácio UPC consiste na determinação bioquímica quantitativa das concentrações de proteína urinária e creatinina urinária (Welles et al., 2006). Animais que apresentem uma razão UPC<0,2 não possuem proteinúria, uma razão UPC >0,4 (em gatos) e uma razão UPC >0,5 (em cães) é classificada como proteinúria (Vilhena et al., 2015).
Apesar disto, a determinação do rácio UPC apresenta uma limitação na recolha de amostra. O método de colheita ideal para este teste urinário é a cistocentese e muitas vezes,
19
com as desvantagens que a cistocentese apresenta, torna-se difícil obter amostra por este método. No entanto, estudos prévios concluíram que a determinação do rácio UPC em amostras colhidas por micção espontânea forneciam resultados semelhantes, comparativamente com amostras colhidas por cistocentese, quer no cão quer no gato (Beatrice et al., 2010; Vilhena et al., 2015).
O rácio UPC não é um parâmetro comum nas tiras reativas de urina. Contudo, a ciência tem evoluído com o objetivo de integrar o rácio UPC nas tiras reativas de urina, devido às suas vantagens na rotina clínica, como a sua facilidade de utilização, rapidez e baixo custo. No entanto, ainda são necessários diversos estudos, devido a este parâmetro possuir vários falsos-negativos na deteção da proteína e creatinina, levando a erros de diagnóstico fazendo com que os veterinários optem por outros métodos analíticos de bioquímica (Zatelli et al., 2010). Estudos recentes, continuam a verificar que este é um método com pouca sensibilidade (Park et al., 2017).
1.1.5.13. Fontes de erro
Para além dos erros anteriormente descritos, como todos os interferentes relativos a cada parâmetro, existem muitos outros que são comuns a todos os parâmetros e que se relacionam com a execução da técnica.
Assim, na sua maioria, na análise de urina por meio da tira reativa de urina existem muitas fontes de erro que podem condicionar todo o procedimento laboratorial, tais como: a subjetividade do técnico relativamente à cor que se encontra na almofada do reagente (Garner & Wiedmeyer, 2007); a qualidade da amostra; urina pigmentada ou turva; a validade das tiras reativas de urina; o facto de a embalagem das tiras estar aberta faz com que as tiras fiquem expostas ao ar e à luz; exceder o tempo de leitura da tira; leitura da tira na posição vertical; contaminação da amostra com desinfetantes; não remover o excesso de urina na tira com papel absorvente; colocar o dedo nas zonas reativas da tira (Uranovet, 2015a).
20 1.1.6. Análise do sedimento urinário
O exame microscópico é considerado um elemento indispensável à análise de urina, pois, a análise bioquímica não nos consegue transmitir toda a informação necessária como a deteção de cilindros, de cristais, de células e bactérias, assim como outros organismos. Todos estes elementos apresentam uma grande importância para um diagnóstico precoce de vários estádios patológicos (Williams, 2013). O sedimento urinário apresenta-se, então, como um bom indicador do estado do sistema urogenital (İnce et al., 2016).
Este teste é considerado como teste padrão na análise de urina para a deteção de células, cristais, cilindros, entre outros (Delanghe & Speeckaert, 2016). É uma técnica que requer um trabalho mais intensivo, requer mais tempo, é imprecisa e tem grande variabilidade, estando associada a diversos erros de determinação (Chien, Kao, et al., 2007). É, contudo, uma técnica fácil de executar, económica e possível de realizar na maioria dos laboratórios (Baños-Laredo et al., 2010). As fontes de erro associadas são a falta de experiência do técnico em identificar os diferentes elementos, objetivas sujas, contaminação, diafragma do microscópio aberto, urina mal homogeneizada, urina analisada num tempo superior ao recomendado, entre outros (Thrall et al., 2012).
Atualmente, já existem procedimentos automatizados de análise do sedimento que pretendem economizar no tempo, trabalho, tornando-se mais viável para um laboratório com grande volume de trabalho. Os equipamentos de análise de sedimento baseiam-se num sistema de captura de imagens através de uma câmara de vídeo, ou pelo princípio de citometria de fluxo que classifica as partículas com base no seu tamanho e complexidade (Chien, Kao, et al., 2007). Apesar das vantagens, é um equipamento com um elevado custo, comparativamente aos métodos tradicionais e apresenta um baixo poder discriminativo referente a alguns elementos presentes no sedimento urinário (cilindros, leveduras, parasitas, entre outras), sendo aconselhada uma análise microscópica tradicional (Baños-Laredo et al., 2010).
1.1.6.1. Elementos
A observação microscópica do sedimento urinário permite uma identificação de diversos elementos como vários tipos de células, cilindros urinários, cristais urinários, microrganismos, entre outros, que nos levam a uma análise de urina mais completa.
21 1.1.6.1.1. Células
No sedimento urinário é possível detetar células sanguíneas (leucócitos e eritrócitos) e células epiteliais (descamação, transição e renais).
1.1.6.1.1.1. Leucócitos
A presença, na urina, de mais de 5 leucócitos por campo de alta ampliação (x40) denomina-se de piúria (Reine & Langston, 2005). Para a sua identificação, os leucócitos apresentam-se como células esféricas, granulares, com estruturas internas, contém núcleos redondos ou lobados e são 1,5 vezes maiores que os eritrócitos (Sink & Weinstein, 2012; Thrall et al., 2012). A importância da presença destas células está na quantidade e pode dar-nos um bom indicador de infeção ou inflamação (Baños-Laredo et al., 2010).
O tipo de leucócito mais comum que se encontra no sedimento urinário é o neutrófilo (Radin & Meyer, 2010). Contudo, pode-se encontrar outros tipos de leucócitos, e muitas vezes é importante conhecer a sua morfologia para nos levar a um correto diagnóstico. Os neutrófilos possuem grânulos citoplasmáticos e núcleos lobados e os eosinófilos apresentam semelhança com os neutrófilos, sendo distinguíveis através da coloração do sedimento. Os linfócitos têm núcleos redondos e podem ser confundidos com eritrócitos, mas a adição de ácido acético, faz com que ocorra a lise dos eritrócitos, facilitando a sua distinção. Os monócitos podem estar presentes em amostras que contenham sangue periférico (Sink & Weinstein, 2012).
1.1.6.1.1.2. Eritrócitos
Na observação do sedimento urinário a hematúria define-se como a presença de 5 ou mais glóbulos vermelhos por campo de grande ampliação (40x). Pode resultar de hemorragia no trato urinário, mas também podemos verificar hematúria iatrogénica que resulta da técnica de cistocentese. Se existir dúvida na origem da hematúria, deve-se pedir nova colheita por micção espontânea (Reine & Langston, 2005). A morfologia dos eritrócitos fornece dados importantes para a conclusão do diagnóstico, eritrócitos isomórficos são provenientes de zonas pós-glomerulares e eritrócitos dimórficos tem origem nos glomérulos (Baños-Laredo et al., 2010). Em amostras com uma densidade urinária <1.008, assim como, em urina alcalina os eritrócitos tendem a lisar. Com uma densidade >1.025, os eritrócitos tornam-se crenados, diminuem o tamanho e apresentam o contorno irregular. Uma urina com um intervalo de 1.008