Estudo de métodos de modificação de propriedades dos glóbulos ver- melhos para mimetizar efeitos da malária
Texto
Imagem
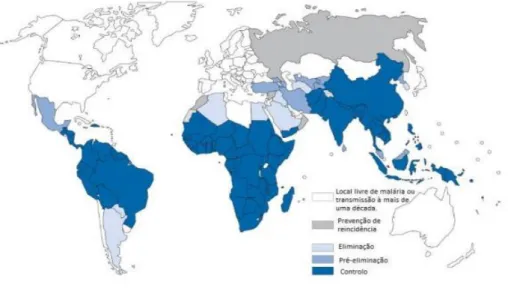
![Figura 2 - Alterações das taxas de incidência entre o ano de 2000 e 2015 [7].](https://thumb-eu.123doks.com/thumbv2/123dok_br/16815280.751115/21.892.166.725.126.403/figura-alterações-das-taxas-de-incidência-entre-ano.webp)
![Figura 4 - Ciclo de infeção da malária [20].](https://thumb-eu.123doks.com/thumbv2/123dok_br/16815280.751115/29.892.226.660.161.493/figura-ciclo-de-infeção-da-malária.webp)
![Figura 7 - Visualização de leucócitos no microscópio de varrimento [40].](https://thumb-eu.123doks.com/thumbv2/123dok_br/16815280.751115/33.892.306.588.124.354/figura-visualização-de-leucócitos-no-microscópio-de-varrimento.webp)
Documentos relacionados
Em 1979, o Centro Nacional de Referências Culturais, sob a denominação de Fundação Pró-Memória, se fundiu com o Instituto do Patrimônio Histórico e Artístico Nacional,
Assim, o método dialético visa a apreensão da totalidade social que é, em si e para si, uma totalidade concreta, modo de ser das múltiplas determinações que imbricam o
The Anti-de Sitter/Conformal field theory (AdS/CFT) correspondence is a relation between a conformal field theory (CFT) in a d dimensional flat spacetime and a gravity theory in d +
It can be concluded from the results obtained for the indoor air temperature and velocity distribution that the heat pump technology is a good option to promote thermal comfort
Ribas (2013) propôs um método para avaliação do desempenho térmico e acústico de edificações, aplicado a sistemas de fechamentos industrializados em painéis de placa
Para avaliar a toxicidade dos compostos in vitro utilizou-se testes colorimétricos (MTT) em formas tripomastigotas (cepa Y) e em macrófagos J774A.1, além de ensaios
Nesse contexto, quando o indivíduo age de acordo com o princípio da utilidade, ele cuida de si mesmo através do cultivo da sua natureza humana esse cultivo é a expressão do amor
Pretendo, a partir de agora, me focar detalhadamente nas Investigações Filosóficas e realizar uma leitura pormenorizada das §§65-88, com o fim de apresentar e
![Figura 9 - Classificação de fluidos de acordo com a dependência tensão de corte vs. taxa de deformação de corte [42].](https://thumb-eu.123doks.com/thumbv2/123dok_br/16815280.751115/36.892.204.690.127.334/figura-classificação-fluidos-acordo-dependência-tensão-corte-deformação.webp)
![Figura 11 - a) Efeito de Fahraeus em capilares de vidro. b) Distribuição do Hct [37].](https://thumb-eu.123doks.com/thumbv2/123dok_br/16815280.751115/37.892.225.657.726.994/figura-efeito-de-fahraeus-capilares-vidro-distribuição-hct.webp)
![Figura 12 - Efeito de Fahraeus-Lindqvist. Variação da viscosidade em função do diâmetro do microcanal [37].](https://thumb-eu.123doks.com/thumbv2/123dok_br/16815280.751115/38.892.261.626.331.650/figura-fahraeus-lindqvist-variação-viscosidade-função-diâmetro-microcanal.webp)


