ANÁLISE E RELEVÂNCIA DOS DADOS
DE ESTABILIDADE ADICIONAIS DO NIVESTIM™
(FILGRASTIM SOLUÇÃO INJETÁVEL)
António de Melo Gouveia
Diretor do Serviço Farmacêutico do Instituto Português de Oncologia de Lisboa, Francisco Gentil. Membro da Comissão de Avaliação de Medicamentos do INFARMED
Resumo
Pretende-se com este artigo analisar os dados mais recentes, disponibilizados pelo titular da autorização de introdução no mercado (AIM), sobre a estabilidade do medicamento nas diversas condições recomendadas para o seu armazenamento (particularmente sem refrigeração) e comentar a sua relevância para os doentes e os profissionais de saúde.
Os dados analisados referem-se a três lotes de duas apresentações do medicamento Nivestim™ que foram estudados oito meses após a conclusão do prazo de validade. Os estudos incidiram sobre o produto mantido em condições normais ICH para estudos em tempo real (25°C + -2°C durante sete dias), com alternância de exposi-ção à luz. Foram igualmente estudados em condições congelamento. Para controlo utilizaram-se amostras man-tidas nas condições expressas no resumo das características do medicamento (RCM), ou seja, entre 2 e 8°C. Os parâmetros estudados em todas as condições mantiveram-se estáveis e dentro das especificações definidas. Os dados apresentados, que sustentam o ponto 6.4 do RCM, apontam para uma adaptação do medicamento às condições reais de utilização, o que é vantajoso para doentes e profissionais de saúde.
Palavras-chave: Biossimilar, estabilidade, Nivestim.
Introdução
Os doentes em terapêutica com medicamentos antine-oplásicos sofrem frequentemente de neutropenia. Esta reação adversa a alguns medicamentos (por exemplo, o docetaxel, de utilização frequente em cancro da mama e cancro do pulmão) aumenta a suscetibilidade a infeções, que em situações extremas podem ser fatais. Por este motivo, também pode ser forçado o adiamento dos trata-mentos, com eventual perda de eficácia. É fundamental
Abstract
The most recent data about stability of fligrastim biossimilar (“Nivestim™), as made available by the mar-keting authorization holder, is analyzed with a focus on different storage conditions and impact on real life use, both for patients and healthcare professionals. Data assessed is about 3 batches and 2 strengths of the Nivestim ™, which were studied 8 months after end of approved shelf-life. The drug product was stored at 25ºC+-2ºC for 7 days, with and without light exposure. Freeze – thaw studies were also performed. As a con-trol, samples were kept in storage conditions as stated on the approved summary of product characteristics. The parameters analyzed were stable with no appreciable trends during the time and in the conditions of this study. This data allows a drug product more adapted to real life use, with advantages for both patients and healthcare professionals.
Keywords: Biossimilar, stability, Nivestim.
corrigir a neutropenia precocemente, sendo esta a indi-cação terapêutica fundamental dos fatores estimulantes de crescimento de granulócitos (G-CSF – granulocyte colony stimulating factor), como o filgrastim, que são hoje
parte integrante e fundamental da terapêutica de mui-tas doenças oncológicas. Desde 1991 que está autorizado em Portugal o medicamento Neupogen® (Amgen), cuja substância ativa é o filgrastim. O Nivestim™ (Hospira), aprovado em 2010, é um biossimilar do Neupogen®.
Tabela 1 - Condições de conservação aplicadas nos estudos de estabilidade
Estudo cíclico 2 dias a 25°C, seguidos de 2 dias a 5°C, repetido 3
vezes para cada amostra Estudo temperatura
ambiente
7 dias a 25°C, dois grupos, um com exposição à luz e outro embrulhado em folha de alumínio Estudo cíclico
e temperatura ambiente
2 dias a 25°C, seguidos de 2 dias a 5°C, repetido 3 vezes para cada amostra, seguido de 7 dias a 25°C, dois grupos, um com exposição à luz e outro embrulhado em folha de alumínio Estudo
de congelamento
3 dias a -20°C (+/-5°C)
Os parâmetros estudados são os adequados para este tipo de produto e correspondem aos utilizados no es-tudo de estabilidade original, conforme a Tabela 2.
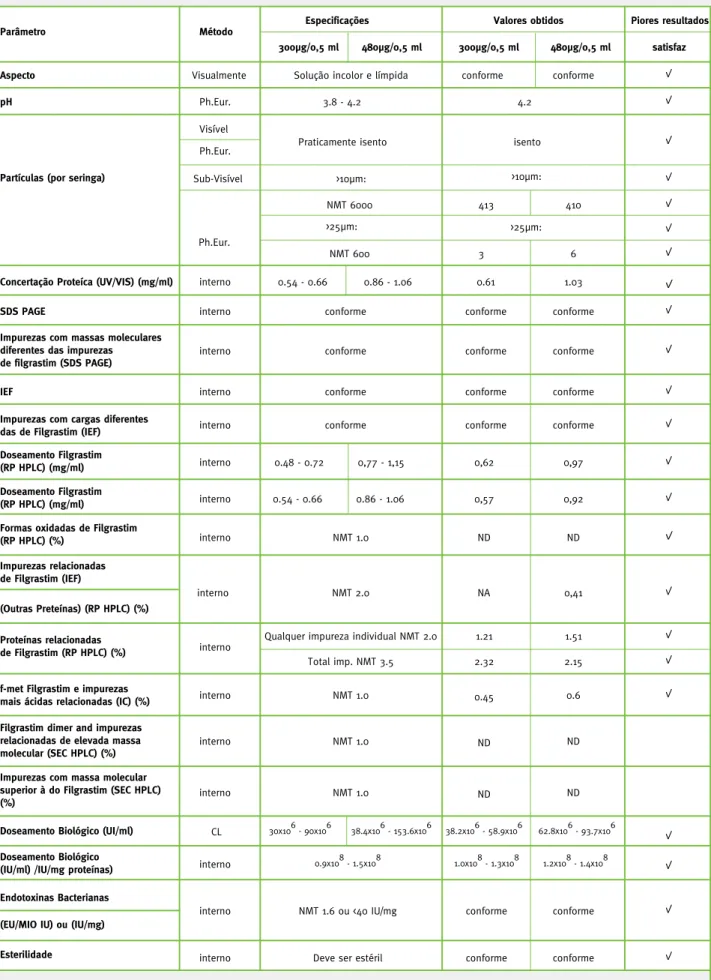
Analisando os parâmetros estudados, verifica-se que em nenhuma das condições e períodos estudados ocorreram alterações relevantes, conforme a Tabela 3. Na maior parte dos parâmetros não se verificou qual-quer tendência de degradação dos resultados, com exceção das impurezas ácidas e f-met filgrastim. Para estas impurezas, os resultados na maioria das condi-ções foram próximos dos 0,30 por cento, mas no «es-tudo cíclico e temperatura ambiente» evoluíram para um máximo de 0,72 por cento, mantendo-se no en-tanto abaixo das especificações (1,0 por cento).
Discussão e Conclusão
A eficácia e segurança de um medicamento protei-co protei-como o filgrastim não dependem apenas dos pa-râmetros de qualidade habituais nos medicamentos constituídos por pequenas moléculas químicas (do-seamento, impurezas de degradação, contaminantes, etc.). A estrutura conformacional da proteína e a sua variabilidade face às condições ambientes são funda-mentais para assegurar a qualidade do medicamen-to. A degradação dos medicamentos proteicos pode resultar nomeadamente de reações como a hidrólise, a oxidação, a agregação, etc. A agregação pode ser muito influenciada pelas condições térmicas, pelo que é de notar que o estudo efetuado não demons-trou qualquer tendência de aumento de agregados (SEC-HPLC).
Um biossimilar cai no âmbito do artigo 19.º do De-creto-Lei 176/2006, de 30 de agosto, no que se refere à dispensa de alguns ensaios. É, no entanto, engloba-do no ponto 6 engloba-do mesmo artigo, que refere que «caso um medicamento biológico similar a um medicamento biológico de referência não satisfaça as condições da definição de medicamento genérico, devido, em espe-cial, às diferenças relacionadas com as matérias-primas ou relativas aos processos de fabrico, são apresentados os resultados dos ensaios pré-clínicos ou clínicos ade-quados e relacionados com essas condições (…)». «A aprovação de biossimilares pela EMA (European Medicines Agency), que decorre da aplicação de cri-térios e orientações estritas que garantem a sua qua-lidade, segurança e eficácia, vem corrigir uma aparen-te anomalia do mercado do medicamento. De facto, para medicamentos biológicos, até recentemente não se aplicavam as regras que permitem a aprovação de medicamentos genéricos, o que permitia aos medica-mentos inovadores longos períodos de exclusividade de mercado, veja-se a título de exemplo os 19 anos que de-correram entre a aprovação do Neupogen® e a dos sues biossimilares, por comparação com os 10 anos de exclu-sividade exigidos aos medicamentos genéricos.» Como em qualquer medicamento essencialmente si-milar, a demonstração da qualidade é exigida integral-mente, acrescida da sua comparação com a qualidade do medicamento de referência, pelo que é pertinente a existência de aspetos adicionais, como os dados de estabilidade que são o objeto deste artigo.
Estudos Adicionais de Estabilidade
do Nivestim™
No estudo em apreciação foram testadas duas dosa-gens de Nivestim™ (filgrastim biossimilar da Hospira): 300 microgramas/0,5ml e 480 microgramas/0,5ml. De cada dosagem foram testados três lotes, de dimen-são industrial, e todos após o fim do prazo de vali-dade, ou seja, os medicamentos foram conservados entre 2 e 8°C durante 31 a 38 meses, para um prazo de validade aprovado de 30 meses. Releva-se este últi-mo aspeto, uma vez que constitui o pior cenário, isto é, os lotes estudados já estariam perto do limite das especificações assumidas para o prazo de validade, situação que na prática não é frequente.
As condições dos estudos estão resumidas na Tabela 1 (as temperaturas referidas devem ser consideradas como um intervalo de mais ou menos 2°C, exceto se indicado diferentemente).
Um dos aspetos específicos dos medicamentos bio-lógicos que é adequadamente abordado neste estudo é a ocorrência de impurezas proteicas, resultantes de uma possível degradação do filgrastim, nomeada-mente devido a alterações de conformação, oxidação e ocorrência de dímeros e formação de f-met filgrastim.
24
Tabela 2 - Parâmetros de qualidade analisados nos estudos de estabilidade
Parâmetro Método
Deteção de impurezas com carga elétrica diferente da do filgrastim (IEF)
Farmacopeia Europeia Aparência Visual
pH Farmacopeia Europeia Partículas em suspensão (visível e
subvisível)
Focalização isoelétrica, Farmacopeia Europeia
Deteção de impurezas com massas moleculares diferentes da do filgrastim (SDS-PAGE)
Eletroforese em gel de poliacrila-mida com dodecil sulfato de sódio, Farmacopeia Europeia
Doseamento de impurezas com massas moleculares superiores à do filgrastim (SEC-HPLC)
Cromatografia por exclusão, Farmacopeia Europeia
Pureza por RP-HPLC (proteínas relacionadas com o filgrastim)
HPLC de fase reversa
Pureza por IC (impurezas ácidas e formilmetionina-filgrastim (f-met filgrastim))
Cromatografia iónica
Potência por atividade biológica Farmacopeia Europeia – com células mieloblásticas murinas M-NFS-60
Concentração de proteínas Espectrometria ultravioleta/visível Doseamento por RP-HPLC HPLC de fase reversa
Endotoxinas bacterianas Farmacopeia Europeia Esterilidade Farmacopeia Europeia Os RCM aprovados pelo INFARMED/EMA para o
medicamento alvo deste estudo (Nivestim™) e para o inovador (Neupogen®) referem o seguinte, no que diz respeito às condições de conservação:
Nivestim™ Neupogen®
6.4. Precauções especiais de conservação
Conservar e transportar em condições refrigeradas (2°C-8°C).
Não congelar. Conservar as seringas pré-cheias nas embalagens para proteger da luz.
Exposição acidental, até 24 horas, a temperaturas de congelação não afetam negativamente a estabilidade do Nivestim. As seringas pré-cheias congeladas podem ser descongeladas e refrigeradas para uso futuro. Se a congelação foi superior a 24 horas, ou congeladas mais do que uma vez, então o Nivestim NÃO deve ser utilizado. Dentro do seu prazo de validade, e para a utilização em ambulatório, o doente pode remover o produto do frigorífico e conservá-lo à temperatura ambiente (não acima de 25°C) por um único período até sete dias. No fim deste período, o produto não deve ser refrigerado novamente e deve ser eliminado. (…) 6.4. Precauções especiais de conservação Conservar a 2°C-8°C. (…) A exposição acidental a temperaturas de congelação não afeta adversamente a estabilidade do Neupogen.
Os dados adicionais que resultaram do estudo em aná-lise permitiram uma informação mais detalhada sobre a estabilidade do medicamento Nivestim™.
O filgrastim é utilizado na profilaxia da neutropenia subsequente a tratamentos antineoplásicos onde esta reação adversa é frequente e grave. Estes tratamentos são frequentemente prolongados por vários meses (ha-bitualmente quatro a seis) e os doentes encontram-se em regime ambulatório, recebendo os tratamentos em hospital de dia ou através de formas sólidas orais (com-primidos ou cápsulas). As deslocações ao hospital po-dem envolver distâncias consideráveis, devido à espe-cialização inerente ao tratamento da doença oncológica, que obriga à referenciação dos doentes para hospitais distantes da sua área de residência. Os doentes sofrem habitualmente de um conjunto extenso de reações ad-versas agressivas e que diminuem as suas capacidades físicas e intelectuais – náuseas e vómitos, astenia, mu-cosite, diarreia, alopecia, etc.
Trata-se de um processo complexo e traumatizante, e a necessidade de garantir um circuito de frio rigoroso e ininterrupto para um medicamento que terá de ser ad-ministrado vários dias após o tratamento constitui um ónus adicional para o doente. Neste contexto, a garantia dada pela informação adicional obtida no estudo
anali-sado e inserida no RCM é uma vantagem nas condições reais de utilização do medicamento Nivestim™, para doentes e profissionais de saúde.
De facto, as variações entre as condições de frio e a tem-peratura ambiente (estudo cíclico) reproduzem cir-cunstâncias decorrentes de períodos de transporte e os sete dias de estudo fora do frigorífico (abaixo de 25°C) representam a duração mais frequente de tratamento com G-CSF para prevenção da neutropenia, ou seja, mesmo que o doente não coloque o medicamento no frigorífico, aquele mantém-se com qualidade adequada durante o período de tratamento previsível.
Como conclusão, deixa-se a nota de que este tipo de es-tudos, de extensão da estabilidade em condições reais de utilização, é da máxima importância para os doentes e profissionais de saúde. Devem, por isso, ser encora-jados pelas autoridades competentes e pelos próprios profissionais de saúde.
Tabela 3 - Piores resultados de qualidade obtidos nos estudos de estabilidade
Parâmetro Método Especificações Valores obtidos Piores resultados
Aspecto
300µg/0,5 ml 480µg/0,5 ml 300µg/0,5 ml 480µg/0,5 ml satisfaz
Visualmente Solução incolor e límpida conforme conforme
pH Ph.Eur. 3.8 - 4.2 4.2
Partículas (por seringa)
Visível Ph.Eur. Sub-Visível
Ph.Eur.
Praticamente isento isento
NMT 6000 413 410
NMT 600 3 6
Concertação Proteíca (UV/VIS) (mg/ml) interno 0.54 - 0.66 0.86 - 1.06 0.61 1.03
SDS PAGE interno conforme conforme conforme
Impurezas com massas moleculares diferentes das impurezas
de filgrastim (SDS PAGE) interno conforme conforme conforme
IEF interno conforme conforme conforme
Impurezas com cargas diferentes
das de Filgrastim (IEF) interno conforme conforme conforme Doseamento Filgrastim
(RP HPLC) (mg/ml) interno 0.48 - 0.72 0,77 - 1,15 0,62 0,97 Doseamento Filgrastim
(RP HPLC) (mg/ml) interno 0.54 - 0.66 0.86 - 1.06 0,57 0,92 Formas oxidadas de Filgrastim
(RP HPLC) (%) interno NMT 1.0 ND ND Impurezas relacionadas de Filgrastim (IEF) interno NMT 2.0 NA 0,41 (Outras Preteínas) (RP HPLC) (%) Proteínas relacionadas de Filgrastim (RP HPLC) (%) interno
Qualquer impureza individual NMT 2.0 1.21 1.51 Total imp. NMT 3.5 2.32 2.15
f-met Filgrastim e impurezas
mais ácidas relacionadas (IC) (%) interno NMT 1.0 0.45 0.6 Filgrastim dimer and impurezas
relacionadas de elevada massa
molecular (SEC HPLC) (%) interno NMT 1.0 ND ND Impurezas com massa molecular
superior à do Filgrastim (SEC HPLC)
(%) interno NMT 1.0 ND ND
Doseamento Biológico (UI/ml) CL 30x106 - 90x106 38.4x106 - 153.6x106 38.2x106 - 58.9x106 62.8x106 - 93.7x106
Doseamento Biológico
(IU/ml) /IU/mg proteínas) interno 0.9x10
8
- 1.5x108 1.0x108 - 1.3x108 1.2x108 - 1.4x108
interno NMT 1.6 ou <40 IU/mg conforme conforme
Endotoxinas Bacterianas (EU/MIO IU) ou (IU/mg)
Esterilidade interno Deve ser estéril conforme conforme
Nota: NMT - não mais do que / ND - Não detetado / NA - não analisado
>10µm: >10µm:
>25µm: >25µm:
26
Bibliografia
- Os dados do estudo foram gentilmente cedidos por Hospira Portugal, Lda.
Outra bibliografia relevante:
- Base de dados INFOMED, disponível em www.infarmed.pt. - EPAR na EMA, disponível em http://www.ema.europa.eu/ema/ index.jsp?curl=pages/medicines/human/medicines/001142/hu-man_med_001344.jsp&mid=WC0b01ac058001d124.
- Decreto-Lei 176/2006, de 30 de agosto.
- Farmacopeia Portuguesa 9.8, ed. 2010, INFARMED.
- European Medicines Agency Committee for Medicinal Products for Human Use, EMEA/CHMP/BWP/49348/2005 «Guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: quality issues». Disponível em www.ema.europa.eu/docs/en_GB/document_library/Scienti-fic_guideline/2009/09/WC500003953.pdf.
Ficha de Assinatura
Nome Morada Código Postal Telefone Fax Actividade profissional Empresa 1 ano - € 50 (4 números) 2 anos - € 100 (8 números)Pretendo assinar a Revista Portuguesa de Farmacoterapia durante:
Junto envio:
cheque n.º do banco
comprovativo de TB para o NIB BPI 0010 0000 3687107 0001 90 ou IBAN PT50 0010 0000 3687 1070 0019 0 Dados para envio:
Formifarma, Consultoria na área da Saúde e do Medicamento, Lda Morada: Rua Luiz Marques, Lote 8 Alto dos Gaios 2765-448 Estoril, Portugal Fax: 21 465 90 90
NIF E-mail Telemóvel
- European Medicines Agency Committee for Medicinal Products for Human Use, EMEA/CHMP/BMWP/31329/2005 «Annex to guideline on similar biological medicinal products containing biotechnology-derived proteins as active substance: non-clinical and clinical issues guidance on similar medicinal products con-taining recombinant granulocyte-colony stimulating factor». Disponível em www.ema.europa.eu/docs/en_GB/document_li-brary/Scientific_guideline/2009/09/WC500003955.pdf.
Declaração
O autor não tem qualquer conflito de interesses a declarar e não foi remunerado direta ou indiretamente pela elaboração do pre-sente artigo.