UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA
PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA INORGÂNICA
Desenvolvimento de Novos Materiais à base de Goma do
Cajueiro (
): Derivados e Microesferas
com Gelatina
Érico de Moura Neto
Orientadora: Dra Jeanny da Silva Maciel
Co Orientadora: Dra Regina Célia Monteiro de Paula
UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA ORGÂNICA E INORGÂNICA
PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA INORGÂNICA
Desenvolvimento de Novos Materiais à base de Goma do
Cajueiro (
): Derivados e Microesferas
com Gelatina
Érico de Moura Neto
Dissertação submetida à coordenação
do programa de Pós graduação em
Química Inorgânica, como requisito
parcial para obtenção do grau de
Mestre.
! "
# $ % & '
( ) $ * (+ $
, -. / 0 1 2
-. 3 4 ) 5 6 ( 7 ( ( 8 9 / 0 # 2 1 2 6 :
; $ 0 ' -. < #= -. >+ 1 % & ' 3 4 11 $ * (+ 3 ) 4 111 5 6 ( 7 ? $ $@ )> -. / 0 # 2 1 2 1A B0
Os filósofos limitaram se a
interpretar o mundo de diversas
maneiras; o que importa é
modificá lo.
AGRADECIMENTOS
Aos meus queridos pais, Érico e Maria Rosália e minhas queridas irmãs, Rubiane,
Rejaine, Izabella e Izadora, por todo esforço, carinho, dedicação amor, incentivo,
que mesmo à distância sempre estiveram tão presentes.
A toda a minha família, avós, tias, tios, primos e primas que mesmo distante sempre
demonstraram seu carinho e confiança na minha escolha.
As minhas amigas Dalgiza e Tia Terezinha por nunca deixarem de incentivar o
sonho da pós graduação.
Ao Campos por me trazer a Fortaleza e propiciar momentos eternos.
A minha orientadora Jeanny da Silva Maciel por todos os momentos de orientação e
dedicação que proporcionaram a realização deste trabalho.
A professora Regina de Paula pelo empurrão e discussões responsáveis pelo
término do trabalho.
A professora Judith Feitosa por todas as contribuições tão fundamentais para a
construção deste trabalho.
Aos colegas do Laboratório de Polímeros, em especial à diretoria (Ana Paula,
Guilherme, Janaina e Paulo), por todas as ocasiões inesquecíveis e principalmente
pelos momentos de distração.
A Alexsandra e ao Frank pela ajuda na oxidação da goma do cajueiro e a Marília
pelos MEV’s tão cuidadosamente obtidos.
Ao professor Luiz Gonzaga de França Lopes, coordenador do programa de pós
graduação em Química Inorgânica da UFC pela competência e prestatividade com a
A funcionária Tereza pelas análises termogravimétricas e ao secretário da
coordenação da pós graduação em Química Inorgânica, Orlando, por ambos sempre
estarem disposto a ajudar.
Ao CENAURENM pelos espectros de ressonância magnética nuclear.
À CAPES pela bolsa concedida, à FUNCAP e ao CNPQ pelo auxílio financeiro ao
projeto “Desenvolvimento de microesferas de géis tipo semi IPN e HPN de
RESUMO
Gelatina é uma proteína obtida por desnaturação do colágeno que tem gerado grande interesse na preparação de materiais para uso biomédico devido às propriedades como, biocompatibilidade e bioadesividade. No entanto, devido a solubilidade de microesferas de gelatina em meio aquoso, a interação com outros polímeros e reticulação tem sido proposta para melhorar suas propriedades físico químicas. A goma do cajueiro foi modificada por reação de sulfatação (GCS) e oxidação (GCX), e os derivados foram utilizados no desenvolvimento de microesferas por interação com gelatina. Os derivados da goma foram caracterizados por espectroscopia na região do infravermelho, ressonância magnética nuclear, análise elementar, cromatografia de permeação em gel, viscosidade intrínseca e análise termogravimétrica. As reações foram eficientes na modificação, resultando grau de substituição de 0,02 a 0,88 para a goma sulfatada, e relação de 10:3 e 10:4 de unidades glicosídicas/unidades oxidadas. Análises de
RMN 13C DEPT indicam sulfatação em C 6 da galactose. Os espectros de RMN 1H
das GCX´s mostraram sinal de aldeído em 8,3 ppm. As microesferas foram
preparadas pelo método de emulsão óleo/água e caracterizadas por MEV, RMN 1H e
ABSTRACT
LISTA DE TABELAS
Tabela 1. Dados experimentais da reação de oxidação da goma do cajueiro. ... 25
Tabela 2. Dados experimentais da reação de sulfatação da goma do cajueiro. ... 27
Tabela 3. Dados experimentais da preparação das esferas de GE e GEGC ... 28
Tabela 4. Dados experimentais da preparação das esferas de GEGCX. ... 29
Tabela 5. Dados experimentais da preparação das esferas de GEGCS. ... 29
Tabela 6. Atribuições das absorções no espectro na região do infravermelho. ... 33
Tabela 7. Efeito da quantidade de matéria de periodato na porcentagem de oxidação da goma do cajueiro. ... 34
Tabela 8. Parâmetros obtidos do TGA para a GC e derivados oxidados em atmosfera de ar sintético. ... 38
Tabela 9. Comparação entre as condições da sulfatação e as características dos derivados de polissacarídeos obtidos...40
Tabela 10. Efeito da concentração do ácido monoclorosulfônico na reação de sulfatação da goma do cajueiro. ... 41
Tabela 11. Parâmetros obtidos do TGA para a GC e derivados sulfatados em atmosfera de ar sintético. ... 49
Tabela 12. Parâmetros obtidos do TGA em atmosfera de ar sintético para as esferas. ... 52
Tabela 13. Dados experimentais da reticulação para as esferas de GE e GEGC em 24 horas. ... 54
Tabela 14. Dados experimentais da reticulação para as esferas de GE e GEGC em 72 horas. ... 54
Tabela 15. Parâmetros obtidos do TGA em atmosfera de ar sintético para as esferas reticuladas por 24 e 72 horas. ... 56
Tabela 16. Dados experimentais da cinética de intumescimento das esferas reticuladas. ... 58
Tabela 17. Parâmetros obtidos do TGA em atmosfera de ar sintético para as esferas GEGCX's. ... 61
Tabela 19. Parâmetros obtidos do TGA em atmosfera de ar sintético para as esferas. ... 64 Tabela 20. Dados experimentais da cinética de intumescimento em água para as
LISTA DE FIGURAS
Figura 1. Estrutura dos principais aminoácidos da gelatina e típica estrutura da gelatina Ala Gly Pro Arg Gly Glu Hyp Gly Pro . ... 5
Figura 2. Estrutura do colágeno: a) Estrutura secundária do colágeno orientada à esquerda. b) modelo espaço cheio da hélice mostrada em (a). c) Estrutura terciária do colágeno formada pelo enrolamento de três hélices em uma torção orientada à direita. d) A super hélice (estrutura quaternária) de três elementos do colágeno mostrada a partir de uma de suas extremidades, em uma representação bola bastão Os resíduos de Gly estão mostrados em vermelho. A Gly, devido ao seu pequeno tamanho, é necessária nas junções apertadas onde as três cadeias estão em contato [Lehninger, Nelson, Cox (2000)].. ... 6
Figura 3. Estrutura de uma torção β ou curvatura β. a) Note a ligação de hidrogênio entre os grupos peptídicos do primeiro e do quarto resíduos envolvidos na volta. b) Os isômeros cis e trans de uma ligação peptídica envolvendo o nitrogênio imino da prolina [Lehninger, Nelson, Cox (2000)]. ... 7
Figura 4. (A) Unidades monossacarídicas da composição da goma do cajueiro do nordeste. (B) Representação da estrutura do polissacarídeo extraído do exudato do cajueiro. (R = ramnose, arabinose ou ácido glucurônico) [Cunha e col. (2007)]. ... 10
Figura 5. Sulfatação de polissacarídeo com ácido metaclorosulfônico em piridina [Mahner, Lechmer, e Nordmeier (2001)] ... 12
Figura 6. Seletividade da reação de periodato de sódio com unidades de açúcar substituídos em diferentes posições [Aspinall (1982)] ... 14
Figura 7. Esquema da reação seletiva de oxidação de uma unidade de glucose da
cadeia lateral de um polissacarídeo [Maeda e col. (2001)] ... 15
Figura 8. Estrutura química: A do geniposídeo, onde Glu é glucose e B da genipina [Butler, Ng e Pudney (2003)] ... 17
Figura 9. Mecanismo da reação de reticulação entre grupo amina e genipina: a) esquema reacional 1 e b) esquema reacional 2 [Butler, Ng e Pudney (2003)]. .... 18
Figura 10. Formação da rede tridimensional do hidrogel com o processo de
intumescimento [Rudzinski e col. (2002)]. ... 19
Figura 11. Esquema ilustrativo de estruturas de géis reticulados tipo (A) Polímero reticulado com um agente reticulante de baixa massa molar; (B) Hidrogel do tipo HPN; (C) Hidrogel do tipo IPN e (D) Hidrogel do tipo PEC [Bae e Kim (1993)]. ... 20
Figura 12. Esquema ilustrativo da reação de um polissacarídeo aldeído
Figura 13. Eletroforese em gel de poliacrilamaida. Linha 1 padrões e linha 2
amostra. ... 32
Figura 14. Espectro na região do infravermelho da gelatina. ... 33
Figura 15. Espectro de RMN 1H a 70°C em D2O. ... 35
Figura 16. Espectro de RMN 13C a 70°C em D2O. ... 36
Figura 17. Formação de um hemiacetal intra residual [Bruneel e Schacht (1993)]. 36 Figura 18. Cromatograma de GPC para soluções aquosas 0,1% m/v da Goma do Cajueiro (GC) e dos derivados oxidados (GCX). ... 37
Figura 19. Curva de TGA e DTG para a GC e derivados oxidados em atmosfera de ar sintético ... 38
Figura 20. Espectro na região do infravermelho para GC e derivados sulfatados. .. 43
Figura 21. Espectro de RMN 13C a 70°C em D2O. ... 44
Figura 22. Espectro de RMN 13C DEPT 135 a 70 °C em D2O. ... 45
Figura 23. Cromatograma de GPC para soluções aquosas 0,1% m/v da Goma do Cajueiro (GC) e dos derivados sulfatados (GCS). ... 46
Figura 24. Gráfico de viscosidade em função da taxa de cisalhamento para soluções aquosas 2,0% m/v de GC e derivados sulfatados. ... 47
Figura 25. Curvas de TGA e DTG para a GC e derivados sulfatados em atmosfera de ar sintético. ... 48
Figura 26. Espectro na região do infravermelho para esferas de GEGC's. ... 50
Figura 27. Espectro de RMN 1H a 70°C em D2O. ... 51
Figura 28. Curva de TGA e DTG para as esferas GEGC's em atmosfera de ar sintético... 52
Figura 29. Microscopia eletrônica de varredura das microesferas: a, b GE; c, d GEGC1:1. ... 53
Figura 30. Espectro na região do infravermelho para as esferas GEGC10:1 antes e após a reticulação de 24 e 72 horas com genipina. ... 55
Figura 32. Cinética de intumescimento em água para as esferas GEGC's reticuladas com genipina: a) por 24 horas e b) por 72 horas. ... 57
Figura 33. Espectro na região do infravermelho para as amostra de gelatina, goma
do cajueiro oxidada (GCX) e da esfera gelatina/goma do cajueiro oxidada. ... 59
Figura 34. Espectro de RMN 1H a 70°C em D2O. ... 60
Figura 35. Curva de TGA e DTG para as esferas GEGCX's em atmosfera de ar sintético... 60
Figura 36. Microscopia eletrônica de varredura das microesferas GEGCX1: a,b; GE:
c; GEGC1:1: d. ... 61
Figura 37. Curvas da cinética de intumescimento em água para as esferas
GEGCX’s. ... 62
Figura 38. Espectro na região do infravermelho para a esfera GEGCS. ... 63
Figura 39. Curva de TGA e DTG para as esferas GEGCS em atmosfera de ar
sintético... 64
Figura 40. Curvas da cinética de intumescimento em água para as esferas GEGCS.
LISTA DE ABREVIATURAS E SIGLAS
ABS: absorbância
AE: análise elementar
Ala: alanina
Arg: arginina
BSA: albumina do soro bovino
CPE: complexo polieletrolítico
Da: Dalton
DEPT:
DMF: dimetilformamida
DTG: 1ª derivada da curva de termogravimetria
EMBRAPA: Empresa Brasileira de Pesquisa Agropecuária
gal: galactose
GC: goma do cajueiro
GCS: goma do cajueiro sulfatada
GCX: goma do cajueiro oxidada
GE: esferas de gelatina
GEGC: esferas de gelatina e goma do cajueiro
GEGCS: esfera de gelatina e goma do cajueiro sulfatada
GEGCX: esfera de gelatina e goma do cajueiro oxidada
glu: ácido glucurônico
Glu: glutamato
GLU: glucose
Gly: glicina
GPC: cromatografia de permeação em gel ( )
GS: grau de sulfatação
ha: hectare
HPN: redes poliméricas híbridas ( )
Hyp: hidroxiprolina
IPN: redes poliméricas interpenetradas ( )
IV: infravermelho
;D
MEV: microscopia eletrônica de varredura
mu: massa da esfera intumescida
Mw; massa molar ponderal média
ppm: partes por milhão
Pro: prolina
R’GE: esfera de gelatina reticulada com genipina por 72 horas
R’GEGC: esfera de gelatina e goma do cajueiro reticulada com genipina por
72 horas
RGE: esfera de gelatina reticulada com genipina por 24 horas
RGEGC: esfera de gelatina e goma do cajueiro reticulada com genipina por 24
horas
RMN: ressonância magnética nuclear
SDS: dodecilsulfato de sódio
TEMPO: N oxil 2,2,6,6 tetrametilpipiridina
TG: termogravimetria
UFC: Universidade Federal do Ceará
UV0VIS: ultravioleta visível
Ve: volume de eluição
;E
SUMÁRIO
10 INTRODUÇÃO ... 3
... 4
... 8
... 11
1.3.1 Reação de Sulfatação ... 11
1.3.2 Reação de Oxidação ... 12
1.3.3 Reação de Reticulação ... 16
! ... 19
20 OBJETIVOS ... 23
"# $ % ... 23
3. METODOLOGIA ... 24
... 24
& ... 24
... 24
... 25
! " ! ... 25
! # ! ... 26
' % ( %) * ( % ) ... 27
$ ! % ... 28
+ ' % * ... 29
, ! - . ... 30
& ' ... 30
& ! ( ) ... 30
& * + , - ... 30
& $ . / ! % ... 30
& 0 ... 31
& & ' 1 ) , ... 31
& 2 + 3 4 5+ 46 ... 31
& 7 ( ... 31
4. RESULTADOS E DISCUSSÃO ... 32
;
$ ... 32
$ ! ( ) ... 32
& / $ "0 ... 34
$ 8 ! / " ! ... 34
$ * + , - ... 34
$ . / ! % ... 37
$ $ ' 1 ) , ... 37
& / $ 1 ... 38
$ . ! 9 + 3 % # ! ...38
$ ! ( ) ... 42
$ * + , - ... 44
$ $ . / ! % ... 45
$ 0 ... 47
$ & ' 1 ) , ... 48
& % ... 49
$ $ ! ( ) ... 49
$ $ * + , - ... 50
$ $ ' 1, ... 51
$ $ $ + 3 4 ... 52
+ & % 2 ... 53
$ 0 8 ! % ! ! ... 53
$ 0 ! ( ) ... 54
$ 0 ' 1 ) , ... 55
$ 0 $ . , ( ... 57
, & % "0 58 $ & ! ( ) ... 58
$ & * + , - ... 59
$ & ' 1 ) , ... 60
$ & $ + 3 4 ... 61
$ & 0 . , ( ... 62
3 & % 1 62 $ 2 ! ( ) 63 $ 2 ' 1 ) , ... 63
$ 2 : . , ( ... 64
4 ! 5 ... 65
50 CONSIDERAÇÕES FINAIS ... 66
;!
10 INTRODUÇÃO
A Ciência de Polímeros tem dado grande importância na preparação e
aplicação de novos materiais. Sistemas poliméricos obtidos pela mistura e/ou
associação de polímeros distintos na forma de redes interpenetradas, blendas
poliméricas ou copolímeros em bloco ou grafitados recebem atenção dos
pesquisadores nos últimos anos, sobretudo devido à vasta possibilidade de
aplicação que inclui os setores farmacêutico, médico, tecnológico e agrocopecuário
[Bucholz e Peppas (1994), Bae e Kim (1993), Xia e col. (2005), Toti e col. (2004),
Rokhade, Patil e Aminabhavi (2006) e El Rehim, Hegazy e El Mohdy (2004)].
A associação de polissacarídeos com polímeros sintéticos é investigada
na busca por materiais que apresentem suas propriedades originais reforçadas ou
mesmo fornecer novas funcionalidades, que influenciem suas características físicas,
químicas, mecânicas e reológicas. Propriedades de alguns polissacarídeos como
abundância, biodegrabilidade, biocompatibilidade e não toxicidade têm favorecido a
escolhas desses polímeros na preparação de biomateriais [Berger e col. (2004a)].
A microencapsulação de fármacos a partir da preparação de microesferas
de géis (com polímeros sintéticos e/ou naturais) tem sido foco de inúmeras
pesquisas na área farmacêutica nas últimas décadas, envolvendo diferentes
objetivos, entre eles a obtenção de produtos de liberação modificada de fármacos,
diminuição da toxicidade gastrointestinal de antiinflamatórios não esteróides,
melhoria na estabilidade ou aumento na biodisponibilidade de fármacos, liberação
em regiões específicas e o tratamento das doenças inflamatórias do intestino [Beck
(2005), Freiberg e Zhu (2004), Gavini e col. (2004), Giunchedi e col. (1995), Gohel e
Amin (1998), Espósito e col. (2002), Lamprecht, Schafer e Lehr (2000), Sajeev e col.
(2002), Saravanan e col. (2004)]. Microesferas podem ser preparadas através de
inúmeros métodos descritos na literatura, entre os quais se encontra a coacervação
[Madan, Luzzi e Price (1974)], emulsificação [Tanaka, Takino e Utsumi, (1963),
Raymond, Degennaro e Mikeal, (1990)] e secagem por aspersão ( : )
[Bassani e col. (2001)].
As características físicas como, por exemplo, tamanho das microesferas,
determinam seu desempenho para o uso em diferentes objetivos terapêuticos. Por
exemplo, microesferas com diâmetros na faixa de 20 100 em podem ser utilizadas
intersticial, micropartículas menores têm sido propostas para o tratamento de
infecções, alergias e artrites, devido à capacidade de permanecer em sítios
específicos [Esposito, Cortesi e Nastruzzi (1996)].
Considerando a busca por novas formulações farmacêuticas e também o
potencial que o Estado do Ceará tem como fonte da goma do cajueiro, essa
proposta de trabalho visa a síntese de derivados da goma do cajueiro e o
desenvolvimento de novos materiais (na forma de microesferas), preparados a partir
da goma do cajueiro e gelatina, com intuito de aplicá los posteriormente em
sistemas de liberação de fármacos.
A gelatina é um biopolímero, biocompatível, biodegradável, e solúvel em
pH fisiológico à temperatura ambiente, o que a torna ideal para aplicações
farmacêuticas. É um produto heterogêneo que tem uma mistura de espécies, α , β ,
e γ peptídeos derivada do colágeno, uma proteína natural a qual é um material
fibroso que ocorre na pele, ossos e tecidos de animais [Ferdinando (2000)]. A
gelatina é amplamente utilizada em indústrias de alimentos, cosméticas e
farmacêuticas, ganhou popularidade devido as suas propriedades multifuncionais;
dentre as quais a capacidade de formar géis termoreversíveis é a mais importante.
As gelatinas são comercializadas de acordo com suas propriedades físico químicas,
como o valor do ; (um parâmetro que representa a rigidez do gel) e
viscosidade [Segtnan e Isaksson (2004)].
Ambos, a gelatina e o colágeno, consistem de uma variação de 18
aminoácidos, dentre os quais, glicina (Gly), prolina (Pro) e hidroxiprolina (Hyp) são
os mais abundantes. Estruturalmente, as moléculas de gelatina contêm seqüências
de (Gly X Y)n, onde X e Y, aproximadamente 30%, são ocupadas pela Pro e Hyp, o
restante por resíduos de outros aminoácidos como alanina (Ala), arginina (Arg) e
glutamato (Glu) entre outros, o n é aproximadamente 330 (Figura 1) [Rose e col.
(1989) e Prystupa e Donald (1996)].
;
Figura 1. Estrutura dos principais aminoácidos da gelatina e típica estrutura da
gelatina Ala Gly Pro Arg Gly Glu Hyp Gly Pro .
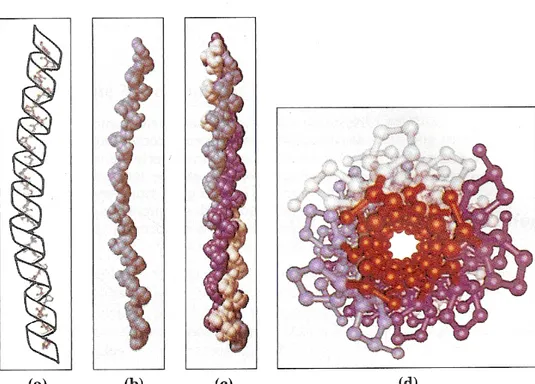
A unidade fundamental do colágeno é chamada de tropocolágeno,
formada de três moléculas polipeptídicas, arranjadas em forma de hélice [Segtnan e
Isaksson (2004)]. O colágeno apresenta propriedades que dão resistência e/ou
elasticidade às estruturas em que ocorre, tem composição molecular relativamente
simples e é insolúvel em água devido à alta quantidade de aminoácidos hidrofóbicos
presentes tanto no interior como na superfície de sua estrutura. A hélice do colágeno
é uma estrutura secundária única e característica desta proteína, ela é orientada à
esquerda e formada pela repetição da seqüência tripeptídica, contendo três resíduos
por volta, que interagem por ligações de hidrogênio. A sua resistência mecânica é
aumentada pelo enrolamento helicoidal de múltiplos segmentos em uma tripla hélice
(estrutura terciária) (Figura 2), similar a cordões enrolados entre si para formar uma
corda mais resistente [Lehninger, Nelson, Cox (2000) e Guo e col. (2003)].
N H O
H
O
N H O
H
O
OH NH2
OH O
Figura 2. Estrutura do colágeno: a) Estrutura secundária do colágeno orientada à
esquerda. b) modelo espaço cheio da hélice mostrada em (a). c) Estrutura terciária
do colágeno formada pelo enrolamento de três hélices em uma torção orientada à
direita. d) A super hélice (estrutura quaternária) de três elementos do colágeno
mostrada a partir de uma de suas extremidades, em uma representação bola
bastão. Os resíduos de Gly estão mostrados em vermelho. A Gly, devido ao seu
pequeno tamanho, é necessária nas junções apertadas onde as três cadeias estão
em contato [Lehninger, Nelson, Cox (2000)].
A desnaturação (perda total da sua estrutura tridimensional) do colágeno
para obtenção da gelatina normalmente é feita a partir do colágeno de pele ou osso
de boi e porco [Rokhade e col. 2006]. A reação pode ser realizada em meio ácido,
originando gelatina do tipo A, e em meio básico, originando gelatina do tipo B. As
proporções de peptídios e a massa molar da gelatina dependem da natureza do
processo químico de desnaturação [Rokhade e col. 2006].
Após desnaturação, pode ocorrer renaturações de pequenos segmentos
recuperando parcialmente a estrutura original do colágeno. Ross Murphy (1992)
relata que a cinética do processo de renaturação tem sido estudada extensivamente
e recentes teorias sugerem que a estrutura secundária é mais importante que a
terciária para a nucleação da hélice. As estruturas secundárias predominantes na
gelatina são do tipo torção β ou curvatura β, que consiste numa curva fechada
<
Figura 3. Estrutura de uma torção β ou curvatura β. a) Representação da ligação de
hidrogênio entre os grupos peptídicos do primeiro e do quarto resíduos envolvidos
na volta. b) Os isômeros cis e trans de uma ligação peptídica envolvendo o
nitrogênio imino da prolina [Lehninger, Nelson, Cox (2000)].
As extensas possibilidades de conformação da gelatina estão
relacionadas à sua estrutura, os resíduos de Gly e Pro são geralmente encontrados
na conformação de torção β (Figura 3), o primeiro porque é pequeno e flexível e o
segundo porque as ligações peptídicas envolvendo o nitrogênio do grupo imino são
facilmente encontradas na forma cis, que se fecha em curva [Lehninger, Nelson, Cox
(2000)]. Acredita se que a expansão da hélice é governada pela diferença no raio da
conversão dos resíduos da prolina da forma cis em trans. Essa estrutura é crucial
para o entendimento da habilidade da gelatina em formar géis [Prystupa e Donald
(1996) e Choi e col. (1999)].
As micropartículas de gelatina para encapsulação de fármacos têm sido
preparadas por métodos de coacervação [Madan, Luzzi e Price (1974)],
emulsificação [Tanaka, Takino e Utsumi, (1963), Raymond, Degennaro e Mikeal,
(1990)] e métodos de adsorção [Ugwoke e Kinget, (1998)]. Apesar de o método de
coacervação ser mais antigo, o método de emulsificação é o mais simples. O
método de emulsão explora a termoreversibilidade da gelatina, no qual a dispersão
de gelatina forma gel quando a temperatura é diminuída para valores menores que a
temperatura de geleificação [Ugwoke e Kinget, (1998)]. Primeiramente a gelatina é
dissolvida em temperaturas acima de 40°C e após a preparação da emulsão é
grande potencial para aplicações farmacêuticas, pois pode ser usada para o
encapsulamento de fármacos hidrofílicos e hidrofóbicos.
Segundo Ugwoke e Kinget (1998), microesferas de gelatina podem ser
usadas para liberação de fármacos via nasal, bucal, vaginal e oftalmológicas devido
a propriedade de mucoadesividade da gelatina.
Para a maior parte das aplicações em sistemas de liberação controlada,
devido às propriedades hidrofílicas da gelatina, a reticulação se torna uma estratégia
para controlar propriedades desses sistemas, como capacidade de absorção de
água, dentre outras que afetam diretamente a sua cinética de liberação. A
reticulação da gelatina pode ser de natureza química, formada por ligações
covalentes irreversíveis, e reticulação física, formada por várias ligações reversíveis
(complexos de polieletrólitos) [Berger e col. (2004a)].
O termo goma na indústria está associado a polissacarídeos e seus
derivados. Mas a sua definição está relacionada a um polissacarídeo solúvel em
água e que forma soluções viscosas a baixas concentrações, sendo substâncias
incolores, inodoras, insípidas e não tóxicas [BeMiller (1987)]. As gomas industriais
podem ser classificadas em naturais e modificadas. As naturais podem ser obtidas
de exudatos de árvores, de sementes, de algas ou por fermentação microbiológica
[Rodrigues, de Paula e Costa (1993)]. As gomas extraídas de exudatos foram as
primeiras gomas conhecidas [Whistler (1973)].
A goma do cajueiro (GC) é um polissacarídeo exudato da árvore cajueiro
( ), que é considerada um planta de porte alto (6 a 12
metros) Foi utilizada para florestamento e há registro de uso como árvore
ornamental e para sombreamento. É originária da América Tropical e suas
explorações comerciais restringiram se à Índia, Brasil, Moçambique, Quênia e
Tanzânia. O cultivo de caju ocupa uma área de 551842 ha e aproximadamente 98%
desta área encontra se no nordeste, abrangendo os estados do Ceará, Piauí e Rio
Grande do Norte [Pessoa, Leite e Pimentel (2006)].
O principal produto do cajueiro é a sua castanha, mas existe potencial
C
A média de produção de goma/árvore/ano é 700 g [Bandeira (1991)], com um
potencial de produção anual da goma de até 38 mil toneladas.
A goma do cajueiro tem aplicações como espessantes para sucos e
refrescos, emulsificante para molhos e saladas, suporte para microcápsulas e ainda
como agente depressor de minério [Mothé (2000)]. Por possuir características
semelhantes a goma arábica, pode substituí la como cola líquida para papel, na
indústria farmacêutica em cosméticos e como aglutinante de cápsulas e
comprimidos e na indústria de alimentos como estabilizante de sucos, cervejas e
sorvetes e como clarificante de sucos [Silva (2006)].
O Grupo de Polímeros – UFC tem estudado essa goma desde 1993
[Rodrigues, de Paula e Costa (1993)]. A goma extraída de árvores do nordeste
brasileiro foi caracterizada como um heteropolissacarídeo contendo βD galactose
(72 73%), αD glucose (11 14%), arabinose (4,6 5%), ramnose (3,2 4%) e ácido
glucurônico (4,7 6,3%) em porcentagem de massa [de Paula, Heatley e Budd
(1998), de Paula e Rodrigues (1995)]. A goma é composta sobretudo de uma cadeia
principal de galactose ligada por C 1 e C 3, com ramificações de galactose ligada
por C 1 e C 6. A glucose pode formar cadeias laterais e a arabinose, ramnose e
ácido glucurônico apresentam como grupos terminais (Figura 4) [de Paula, Heatley,
e Budd (1998)].
A pesquisa dentro do grupo de polímeros – UFC e colaborações com
outros grupos de pesquisa no Brasil permitiram outras propostas de trabalho com a
goma do cajueiro: modificação por carboximetilação com ácido monocloroacético
como agente esterificante [Silva e col. (2004)] e oxidação utilizando TEMPO (N oxil
2,2,6,6 tetrametilpipiridina) como agente oxidante [Cunha e col. (2007)];
copolimerização via enxertia com acrilamida [Silva, de Paula e Feitosa (2007)];
interações com quitosana em estudos de cinética de intumescimento [Paula, Gomes
e de Paula (2002)], na liberação de fármacos [Maciel e col. (2006); Magalhães Jr e
col. (2008)] e de larvicidas [Paula, de Paula e Bezerra (2006)], estudo da
degradação térmica de complexos polieletrolíticos [Maciel e col. (2005)], estudo da
formação de filmes finos [Maciel e col. (2007)] e preparação de hidrogéis
superabsorventes para o condicionamento do solo [Guilherme e col. (2005) e Silva
D
Figura 4. (A) Unidades monossacarídicas da composição da goma do cajueiro do
nordeste. (B) Representação da estrutura do polissacarídeo extraído do exudato do
cajueiro. (R = ramnose, arabinose ou ácido glucurônico) [Cunha e col. (2007)].
O H H H O H H OH H OH OH OH O H H H H O H OH H OH OH OH O OH H H H O H OH H OH H CH3 O OH H H H O H OH H OH H O O H F G O H OH O H H H OH H O H 1 3
gal gal 1 3 1 3 gal1 3 gal 1 3 gal 1 3 gal 1 3 gal
1 6 glu 1 3 gal 1 3 gal 1 6 1 6 1 3 gal 1 3 gal 1 6 6 R glu a 1 3 gal 1 6 gal 1 6 1 3 gal 1 6 gal 1
3 gal 6 1
3
6
1 1 6
gal 3 1
glu a 1 6 1 6 gal 1 6
gal 3 R
1 6
1 6
1 glu a 6
1
6
R 3 1 3
E
Diversos tipos de modificações de polissacarídeos com distintos
interesses têm sido propostas, desde aumentar a hidrofilicidade à adição de caráter
hidrofóbico. Na busca de aumentar o caráter hidrofílico e aumentar os sítios de
interação com outros polímeros (polímeros sintéticos, polissacarídeos e proteínas)
ou com metais, modificações tais como: carboximetilação, carboxilação, oxidação e
sulfatação vêm sendo propostas.
1.3.1 Reação de Sulfatação
Os açúcares sulfatados têm geralmente fórmula ROSO3H onde ROH é o
açúcar. O interesse corrente nesses açúcares é devido principalmente ao fato
destes ésteres ácidos ocorrerem extensivamente na natureza. No reino vegetal,
açúcares sulfatados são encontrados combinados com muitos polissacarídeos de
algas [Mori (1953); Percival (1964)], no entanto dificilmente são encontrados em
plantas terrestres. No reino animal, estes ésteres são polissacarídeos como a
heparina, sulfatos de condroitina e de mucoitina, e são encontrados no cérebro
[Thannhauser, Felling e Schmidt (1955)].
Muita atenção tem sido focalizada no papel fisiológico de polissacarídeos
sulfatados e, associado a isto, muitos métodos de sulfatação de polissacarídeos têm
sido propostos com intenção de aplicações terapêuticas comerciais. Um exame
detalhado da estrutura de polissacarídeos sulfatados requer o conhecimento da
posição da ligação do grupamento sulfato, e que a reatividade química desses
grupamentos seja entendida. Isto é importante, visto que os grupos sulfatos exercem
papel importante nas propriedades biológicas desses polissacarídeos [Shanmugam
e Mody (2000)].
Sulfatação de polissacarídeos tem sido reportada para uma variedade de
carboidratos, entre esses quitosana [Baumann e Faust (2001)], dextrana, pululana
[Mahner, Lechmer e Nordmeier (2001)] e laminarina, polissacarídeo extraído da alga
< [O’Neill (1955)]. Os reagentes utilizados são principalmente o
ácido metaclorosulfônico (CℓSO3H) em piridina (Figura 5) [Geresh, Mamontov e
Weinstein (2002)] ou complexo de trióxido sulfúrico com piridina [Wu e col. (1998)],
solventes utilizados são geralmente formamida, dimetilformamida, dimetilsulfóxido e
piridina.
No entanto, devido à complexidade estrutural dos polissacarídeos, um
mesmo método de sulfatação pode resultar em produtos previsíveis para um
determinado polissacarídeo, mas imprevisíveis para outros polímeros [Yang e col.
(2003)]. Assim, é importante estabelecer um método apropriado de sulfatação. O
solvente deve ser escolhido adequadamente para cada polissacarídeo, já que estes
podem ter solubilidade e conformação diferente em diferentes solventes, o que pode
afetar a sulfatação devido às distintas forças intermoleculares.
Figura 5. Sulfatação de polissacarídeo com ácido metaclorosulfônico em piridina
[Mahner, Lechmer, e Nordmeier (2001)].
As propriedades de polissacarídeos sulfatados, tais como atividade
anticoagulante [Alban e Franz (2001), Huynh, Chaubet e Jozefonvicz (2001)],
antiviral [Amornrut e col. (1999)], antiinflamatória [Winkelhake (1991)] entre outras,
pode depender fortemente de sua estrutura, como por exemplo, do grau de
sulfatação (GS) [Alban, Schauerte e Franz (2002)], da massa molar [Barbucci e col.
(1998)] e da ramificação da cadeia [Mulloy, Mourão e Gray (2000)].
1.3.2 Reação de Oxidação
A oxidação com periodato de sódio é uma reação simples e bastante
usada como ferramenta na elucidação estrutural de carboidratos complexos [Perlin e
Casu (1982)]. A oxidação de amido com periodato, até pouco tempo era um dos
poucos exemplos no qual esta era empregada para obter novas propriedades com
aplicações industriais [Veelaert e col. (1997)]. No entanto, a modificação por
oxidação com periodato tem sido proposta para outros polissacarídeos como
pullulana [Brunneel e Schacht (1993)], escleroglucana [Crescenzi e col. (1983);
!
Stokke (2001)], goma guar [Varma e col. (1997)], dextrana [Sokolsky Papkov, Domb
e Golenser (2006) e Schacht e col. (1997)], goma arábica [Nishi e Jayakrishnan
(2007) e Nishi e Jayakrishnan (2004)] e goma Konjac [Yu e Xiao (2008)].
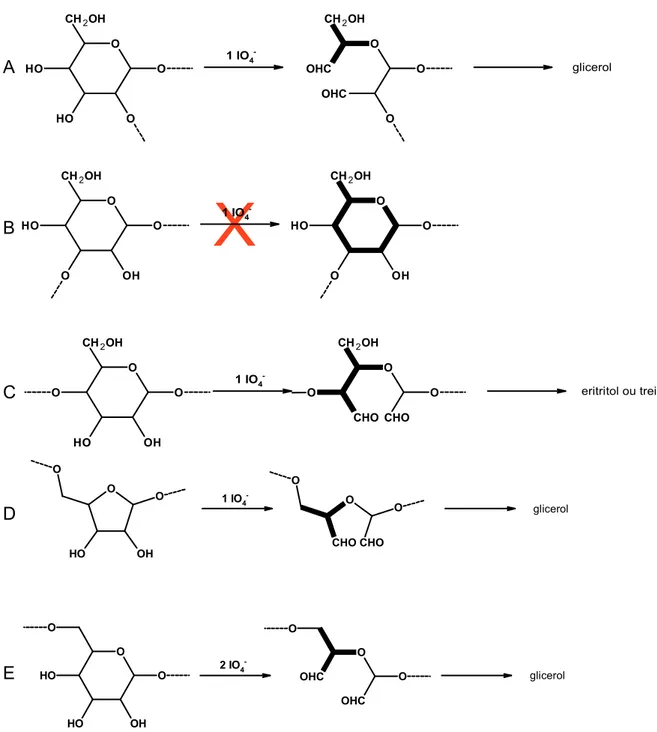
Periodato oxida seletivamente as cadeias laterais do polissacarídeo, se a
cadeia principal não possuir nenhuma hidroxila vicinal. Assim, quando na cadeia
principal as unidades dos monossacarídeos são ligadas (1→3) a oxidação com
periodato leva a introdução de grupamentos aldeídos nas cadeias laterais, sem
degradação da cadeia principal. A Figura 6 mostra diferentes unidades de açúcares
reagindo com periodato de sódio. Observa se que a única unidade não oxidada é a
B devido às ligações glicosídicas na posição 1 e 3 que não apresenta duas
hidroxilas vicinais.
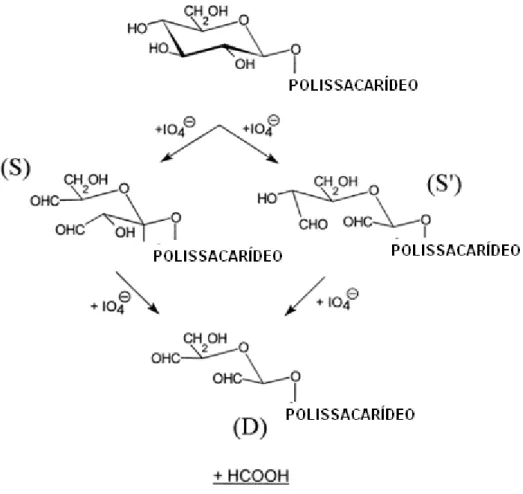
Polissacarídeos como a goma do cajueiro [de Paula, Heatley e Budd
(1998)] e escleroglucana [Christensen, Aasprong e Stokke (2001)] apresentam esse
tipo de ligação em suas estruturas. A Figura 7 mostra o mecanismo básico da
reação de oxidação de uma D glucose de cadeia lateral [Jackson e Hudson (1938)].
O mecanismo descrito assume que a ligação dos carbonos C(2) – C(3) e C(3) – C(4)
do anel de glucose pode ser acessada por oxidação com periodato [Aalmo e Painter
(1981)]. A reação ocorre quando a ligação C(3) – C(4) ou C(2) – C(3) é quebrada na
primeira oxidação, originando grupamentos aldeídos nos respectivos carbonos
(unidades S e S’). Esses intermediários podem existir em solução nas formas
cíclicas e de hemiacetal [Aalmo e Painter, 1981]. Uma segunda oxidação
complementar origina novos grupamentos aldeído, formando a unidade D
(duplamente oxidada) com conseqüente liberação de ácido fórmico de C(3).
A análise do consumo de periodato possibilita a determinação da
proporção de unidades oxidadas. O controle da estequiometria
periodato/polissacarídeo pode produzir materiais com diferentes graus de oxidação.
Os grupos aldeídos das unidades oxidadas podem reagir com NaBH4
para formar o correspondente poliálcool [Schulz e Rapp (1991)] ou com NaCℓO2 para
formar correspondentes policarboxilatos [Crescenzi e col (1983)]. O estudo de
derivados aldeídos funcionalizados é interessante devido a sua reatividade com
grupamentos amina de quitosana e proteínas, como por exemplo, a gelatina para a
formação da imina ( C=N ).
<
Figura 6. Seletividade da reação de periodato de sódio com unidades de açúcar
substituídos em diferentes posições. [Aspinall (1982)].
X
O CH2OH
O H
O
H O
O
1 IO4
0 O
OHC OHC
CH2OH
O
O glicerol
O CH2OH
O H
O OH
O
O CH2OH
OH O O
H
O 1 IO4
0
O CH2OH
O
O
H OH
O
1 IO4 0
CHO O
CHO CH2OH
O
O eritritol ou treitol
O O OH O H O
1 IO40
glicerol O CHO CHO O O O O H O H OH O O
2 IO40
<;
Figura 7. Esquema da reação seletiva de oxidação de uma unidade de glucose da
cadeia lateral de um polissacarídeo [Maeda e col. (2001)].
A oxidação com periodato de sódio da goma arábica foi proposta
recentemente na preparação de um carreador de fármaco, o qual interage
diretamente com este através da formação da base de Schiff, reação entre os
grupamentos amina do fármaco e os grupos aldeído da goma. Diferentes perfis de
liberação do fármaco são obtidos e podem ser controlados pelo grau de oxidação da
<
1.3.3 Reação de Reticulação
Os géis físicos são formados por ligações reversíveis, que no caso da
quitosana, por exemplo, ocorrem por interação com cátions, tais como íons cálcio e
alumínio ou pela formação de complexos polieletrolíticos (CPE’s) [Berger e col.
(2004a)]. A reticulação física da gelatina pode ser realizada por aquecimento térmico
e irradiação ultravioleta [Weadock, Olson e Silver (1983)].
A estabilidade mecânica, ou resistência, em uma larga faixa de pH nem
sempre é conseguida para géis físicos. Por isso, algumas vezes é necessário a
introdução de ligações covalentes para fortalecer o gel formado, mantido apenas por
interações eletrostáticas.
A reticulação química consiste na introdução de moléculas de baixa
massa molar, chamadas de agentes reticulantes. A presença de grupos funcionais –
OH, –COOH e –NH2 na estrutura do polissacarídeo pode ser utilizada para a
formação de ligações cruzadas através de reações com aldeídos ou com moléculas
bifuncionais que permitem a formação de pontes entre as duas cadeias do
polissacarídeo [Hennink e van Nostrum (2002)].
Para a gelatina, vários agentes reticulantes têm sido propostos, tais como
formaldeído [Hazel e col. (1980)], glutaraldeído [Damink e col. (1995)], carboimida
[Sheehan e Hlavka (1957)], compostos diepóxidos [Sung e col. (1996)], gliceraldeído
[Kosmala, Henthorn e Brannon Peppas (2000)] e genipina [Lien, Li e Huang (2008),
Wei e col. (2007), Nickerson e col. (2006) Yao e col. (2004), Liang e col. (2003)].
Entretanto, o uso de agentes reticulantes como formaldeído e
glutaraldeído podem levar a efeitos tóxicos laterais devido a resíduos dos
reticulantes. Portanto, há a necessidade de uma excessiva purificação durante a
preparação dos hidrogéis para eliminar excesso do agente reticulante que não
formou ligações cruzadas. Eles podem ser retirados por sucessivas lavagens ou
neutralizados por uso de reagentes específicos [Berger e col. (2004b)]. Esses
métodos para remoção do reticulante podem, também, extrair qualquer fármaco que
tenha sido incorporado na rede polimérica ou gerar reações adicionais devido a
aplicações de reagentes para neutralização do reticulante.
Uma alternativa a estes reticulantes tóxicos é a utilização da genipina. A
reticulação de quitosana e gelatina com genipina tem sido proposta como uma
<<
toxicidade é mais baixa do que a do glutaraldeído, em torno de 5.000 a 10.000 vezes
[Sung e col. (1999)].
A genipina é um iridóide derivado do geniposídeo (Figura 8), extraída do
fruto de jenipapo (% 6, tem sido utilizada na medicina chinesa para
tratamento de doenças hepáticas e como agente antiinflamatório, sendo produzida e
vendida somente em Taiwan. Na presença de oxigênio, forma um pigmento azul
quando reage com grupos amina livres de aminoácidos como a glicina e lisina em
pH 7 [Paik e col. (2001)].
Figura 8. Estrutura química: A do geniposídeo, onde GLU é glucose e B da
genipina [Butler, Ng e Pudney (2003)].
A genipina participa de ligações covalentes com grupos amina livres
contidos em polímeros, essa reação se processa por dois mecanismos distintos. O
primeiro é o ataque nucleofílico ao carbono 3 da genipina por aminas primárias
formando uma amina cíclica ligada à cadeia do polímero (Figura 9a). A segunda
reação é a substituição nucleofílica (SN2) do grupo éster da genipina formando uma
amida secundária ligada à cadeia polimérica com a liberação de metanol (Figura 9b)
[Butler, Ng e Pudney (2003)].
Segundo Liang e col. (2003) a aplicação dessa substância como agente
reticulante pode minimizar a redução da biodegradabilidade e biocompatibilidade de
polissacarídeos modificados por reticulação. Microesferas de gelatina reticuladas
com genipina mostraram em estudo ) ) menor grau de inflamação em tecidos
implantados que aquelas microesferas de gelatina reticuladas com glutaraldeído.
O O O
HO GLU
O O O
HO OH
F H
; < C
D
E
<
Figura 9. Mecanismo da reação de reticulação entre grupo amina e genipina: a)
esquema reacional 1 e b) esquema reacional 2 [Butler, Ng e Pudney (2003)].
NH2 R
O
HO
O OCH3
OH
NH2 R
O
HO
O OCH3
OH
NH2 R
O
HO
O OCH3
OH HN R O HO O OH
I (J<#J b)
O
O H
OH O OCH3
N
H2 R CH
O O H O OCH 3 NH R N O H OH R O OCH3
N
O H
R O OCH3
<C
!
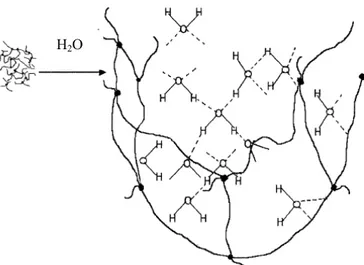
Hidrogéis foram definidos por Peppas (1986) como sistemas
macromoleculares que intumescem em água ou fluidos biológicos, devido a sua
capacidade de absorver e reter grandes volumes de água em sua estrutura sem se
dissolver em função de reticulações físicas ou químicas entre as cadeias individuais
do polímero (Figura 10). Este tipo de sistema polimérico tem sido amplamente
investigado e explorado nos campos biomédicos e industriais [Mitsumata e col.
(2003)]. Os polissacarídeos em geral são soluvéis em água ou formam géis fisicos
que na presença de excesso de água formam soluções viscosas.
Figura 10. Formação da rede tridimensional do hidrogel com o processo de
intumescimento [Rudzinski e col. (2002)].
O processo de intumescimento de um gel é governado por fatores físicos
e externos. Entre os físicos, são favoráveis a presença de forças de coesão, grupos
hidrofílicos, baixa densidade de reticulação e a flexibilidade do polímero [Rudzinski e
col. (2002)]. A presença de grupos hidrofóbicos, alta densidade de reticulação e a
presença de íons desfavorecem a absorção de água. Os fatores externos que
interferem no intumescimento são mudanças de pH, força iônica, temperatura,
composição do solvente e aplicação de voltagem, entre outros.
Géis com redes interpenetradas e semi interpenetradas têm sido
estudados como matrizes em sistemas de liberação utilizando diferentes
combinações de polímeros para se obter materiais com propriedades físico químicas
específicas. Géis do tipo redes poliméricas interpenetradas (IPN’s –
) são formados por redes tridimensionais de polímeros
<D
homogêneos ou heterogêneos, onde pelo menos um deve ser polimerizado na
presença do outro. As redes individuais podem ou não ser quimicamente
interconectadas. Géis do tipo semi IPNs são obtidos quando apenas um dos
polímeros é reticulado.
Géis do tipo semi IPN têm sido desenvolvidos e avaliados para liberação
de vários tipos de drogas [Kulkarni, Soppimath e Aminabhavi (2000); Agnihotri e
Aminabhavi (2005)]. Hidrogéis do tipo IPN e semi IPN de gelatina com
polissacarídeos têm sido preparados para obtenção de esferas [Isiklan (2006);
Rokhade e col. (2006)], membranas [Liu e Zhao (2006)] e esponjas [Choi e col.
(1999)]. Em geral, o agente reticulante aplicado para preparação desses hidrogéis é
o glutaraldeído. No entanto, géis do tipo semi IPN têm sido preparados utilizando
como reticulante o gliceraldeído [Kosmala, Henthorn e Brannon Peppas (2000)] ou
genipina [Lien, Li e Huang (2008), Liang e col. (2003)] para minimizar os efeitos
tóxicos desses materiais.
Hidrogéis do tipo HPN (HPN – 6 são obtidos
quando grupos funcionais presentes nos dois polímeros reagem formando pontos de
reticulação sem a necessidade da adição de um agente reticulante. A Figura 11
mostra quatro diferentes tipos de estruturas de géis.
Figura 11. Esquema ilustrativo de estruturas de géis reticulados tipo (A) Polímero
reticulado com um agente reticulante de baixa massa molar; (B) Hidrogel do tipo
HPN; (C) Hidrogel do tipo IPN e (D) Hidrogel do tipo PEC [Bae e Kim (1993)].
A B
Cadeia I Cadeia II
<E
Quando quitosana reage com polímeros aldeído funcionalizados forma
géis com pontos de reticulação via reação base de Schiff, os quais são géis do tipo
HPN [Berger e col. (2004b)]. A Figura 12 representa um esquema da interação dos
grupos amina com o aldeído de outro polímero funcionalizado com grupos aldeídos.
Figura 12. Esquema ilustrativo da reação de um polissacarídeo aldeído
funcionalizado com gelatina. [Fang, Takahashi e Nishinari (2005)]. A linha em zig
zag representa a cadeia principal do polissacarídeo oxidado ou da gelatina.
A geleificação da gelatina com polialdeídos (ex. poliacroleína)
[Himmelmann, Ulrich e Meckl (1963)] e com amido oxidado com periodato (amido
aldeído funcionalizado) [Jeffreys e Tabor (1962)] é bem documentada na literatura.
Schacht e col. (1997) observaram que a velocidade de geleificação,
durante a reação de dextrana dialdeídica (oxidada com periodato de sódio) com
gelatina, depende da massa molar e do grau de oxidação da dextrana, da natureza
da gelatina e das condições reacionais. A reticulação ocorre devido à formação da
base de Schiff na reação entre o ε amino da lisina ou grupos lateriais da hidroxilisina
e os aldeídos disponíveis [Schacht e col. (1997)]. O pH do meio reacional é um dos
fatores determinantes, isso pode ser explicado em função do aumento de
grupamentos amina não protonados na gelatina com o aumento do pH, o que
favorece a formação da base de Schiff.
Recentemente hidrogéis preparados pela interação da gelatina com a
goma oxidada Konjac foram testadas quanto à capacidade de liberação de
ketoprofeno ) , e mostrou que a taxa de liberação pode ser controlada por
variação da razão goma oxidada/gelatina, o que segundo os autores [Yu e Xiao
(2008)] oferece uma nova janela para preparação de matrizes à base de gelatina,
quando comparadas à preparação tradicional com aplicação de reticulantes de baixa
massa molar. Os hidrogéis de dextrana oxidada com gelatina têm sido investigados
Polissacarídeo
oxidado
CHO
CHO
NH2
NH2
+
CHO NH2
+
CH=N
Gelatina
<
como um curativo para liberação de fatores de regeneração de tecidos [Schacht e
col. (1997); Fang, Takahashi e Nishinari (2005)].
Outros trabalhos recentes têm investigado a preparação, propriedades
físico químicas e perfil de liberação de microesferas ou géis de gelatina com
polissacarídeo aldeído funcionalizados. Microesferas de gelatina com a goma
dextrana oxidada foram preparadas e estudadas quanto às características de
liberação de cloridrato de Pingyangmycin (Bleomicina A5), antibiótico utilizado em
tratamento de tumores [Wu e col. (2006)] e mostraram ser uma excelente alternativa
para o tratamento de tumores na cabeça ou no pescoço.
Hidrogel de sulfato de condroitina oxidada com periodato de sódio e
gelatina foi proposto como curativo ( ). Géis de gelatina e do
polissacarídeo oxidado extraído da # foram estudados quanto às
propriedades viscoelásticas, parâmetros cinéticos de geleificação e analisados em
função da concentração de gelatina e do grau de oxidação do polissacarídeo [Fang,
Takahashi, Nishinari (2005)]. Hidrogéis de alginato oxidado e gelatina também têm
sido avaliados como biomateriais, mostrando se não tóxicos e biodegradáveis
[Balakrishnan e col. (2005)].
Microencapsulação de drogas, tais como cloridrato de doxorubicina,
mitomicina C, e 5 fluorouacil dentro de microesferas de gelatina reticulada com
aldeídos têm sido investigadas [Leo e col. (1997), Yan e col. (1991)]. Estudos
mostram que microesferas de gelatina reticuladas com aldeído tem um longo
período de biodegradação, propriedade importante para liberação controlada de
<!
20 OBJETIVOS
Preparação e caracterização de derivados de goma do cajueiro e
utilização destes no desenvolvimento de microesferas com gelatina.
"# $ %
Para atingir este objetivo o trabalho foi dividido nas seguintes etapas:
Modificar a goma do cajueiro por reação de sulfatação para obtenção de
um polieletrólito aniônico e caracterizá la.
Modificar a goma do cajueiro por reação com periodato de sódio para
obtenção de derivados polialdeídicos e caracterizá la.
Preparar e caracterizar microesferas de géis de gelatina e goma do
cajueiro não modificada reticuladas com genipina. Desenvolver microesferas de
goma do cajueiro oxidada e sulfatada com gelatina.
Estudar as propriedades físico químicas de géis de gelatina e goma do
cajueiro não modificada, sulfatada e oxidada, visando sua futura utilização como
3. METODOLOGIA
A goma do cajueiro ( ) foi fornecida pela
EMBRAPA (Empresa Brasileira de Pesquisa Agropecuária), Ceará, em 2004. A
goma foi purificada pelo método descrito por Rodrigues, de Paula e Costa (1993).
Os espectros de infravermelho e ressonância magnética nuclear de 13C para a GC apresentaram valores similares aos obtidos por de Paula e Rodrigues (1995) e
massa molar foi estimada em 2,32x104 g/mol.
O fruto do jenipapo (% <) foi coletado em julho de 2007,
no município de Pacatuba, Ceará. A genipina foi extraída do fruto verde seguindo a
metodologia descrita por Djerassi, Gray e Kincl (1960), com algumas modificações
desenvolvidas dentro do Laboratório de Polímeros – UFC [Magalhães Jr. (2007)].
A gelatina (Vetec) utilizada é de origem da pele bovina com ; 170 a
190 g.
&
A massa molar da gelatina foi determinada por eletroforese em gel de
poliacrilamida em presença de dodecilsulfato de sódio (SDS) e β:mercaptoetanol
realizada segundo a técnica de Laemmli (1970), usando se um gel de aplicação de
3,5% de acrilamida em tampão tris HCℓ 0,5 mol/L, pH 6,8 e um gel de separação a
12,5% em tampão tris HCℓ 3,0 mol/L, pH 8,8 e SDS 1%, adaptada para o uso em
placas medindo 10x8 cm2 (Sistema Hoefer SE250 Pharmacia Biotech). O tampão
de corrida foi preparado com tris 0,025 mol/L, glicina 0,2 mol/L e SDS 0,1% a pH
8,3. Os seguintes padrões de proteína da Dalton Mark VII L Protein foram utilizados:
albumina bovina (66000 Da), ovoalbumina (45000 Da), desidrogenase
gluceraldeído 3 fosfato (36000 Da) e anidrase carbônica (29000 Da).
As amostras foram dissolvidas em tampão tris HCℓ 0,0625 mol/L, pH 8,3,
contendo SDS 10, azul de bromofenol 0,02% e em seguida incubadas a 110°Cpor
;
ainda cristais de sacarose. Alíquotas de 12 L das amostras tratadas foram
aplicadas no gel, e então submetidas a uma corrente de 40 mA durante
aproximadamente uma hora.
As bandas foram visualizadas usando revelação das bandas protéicas
com prata seguindo a metodologia descrita por Blum, Beier e Gross (1987).
A gelatina foi caracterizada por espectroscopia na região do infravermelho
(IV), como descrito no tópico métodos de análise, item 3.6.
! " !
A reação de oxidação parcial da goma do cajueiro foi realizada por
modificação do método descrito por Christensen, Aasprong e Stokke (2001) e
Dawlee e col. (2005). A goma do cajueiro (1,0 g, 6x103 mol de unidades glicosídicas) foi dissolvida em água destilada por 2 horas e duas quantidades
distintas de NaIO4 foram adicionados de modo a obter razões molares de unidades
glicosídicas/periodato de 10:3 e 10:4 (Tabela 1).
A mistura reacional foi deixada por 6 horas à temperatura ambiente e
após este período etilenoglicol foi adicionado para parar a reação. A goma do
cajueiro oxidada (GCX) obtida foi dialisada contra água destilada (4 – 5 vezes) para
eliminação de excesso de reagente e então, liofilizada.
Tabela 1. Dados experimentais da reação de oxidação da goma do cajueiro.
Produto* Mol de NaIO4 Razão Molar
GCX10:3 1,9x103 10:3
GCX10:4 2,5x103 10:4
*A numeração refere se à relação GC/NaIO4.
grau de oxidação da goma do cajueiro foi determinado por
espectroscopia de absorção na região do UV VIS, como descrito por Gomez,
Rinaudo e Villar (2007). Neste método, utiliza se um indicador preparado com
tampão fosfato pH 7,4. Para determinação do teor de periodato foi retirado 2,5 mL
da solução reacional (antes da introdução de etilenoglicol) e misturado com 1,5 mL
do indicador, em seguida, o volume foi completado para 5,0 mL com água destilada.
O complexo formado é diluído adequadamente para análise num
espectrofotômetro Hitachi U 2000 em 486 nm. A diferença entre a quantidade inicial
e final de periodato corresponde à quantidade de unidades glicosídicas oxidadas.
A curva padrão do íon periodato foi utilizada para calcular a concentração
de NaIO4 não consumido durante a oxidação. A curva foi preparada com soluções
de concentração de 1,57x105, 1,96x105, 2,35x105, 2,75x105 e 3,14x105 mol/L, obtendo uma relação linear, r = 0,990 e a equação (1)
ABS = 0,02 + 0,26.[IO4]x10+5 Equação (1)
onde ABS é a absorbância medida e [IO4]é a concentração do íon periodato em
mol/L.
! # !
Os derivados sulfatados da goma do cajueiro foram preparados segundo
método descrito por O’Neill (1955) e Ono e col. (2003), no qual o ácido
monoclorosulfônico (densidade 1,75 g/mL) é utilizado como reagente para sulfatação
em meio básico. Goma do cajueiro (1,0 g, 6x103 mol de unidades glicosídicas) foi suspendida em 75,0 mL de dimetilformamida (DMF), durante 24 horas sob agitação.
A esta solução adicionou se 60 mL de piridina e manteve o sistema sob agitação por
3 horas. Após esse período o sistema foi colocado num banho de gelo, em frasco
fechado, onde adicionou se o ácido monoclorosulfônico vagarosamente, 1 mL a
cada 5 min.
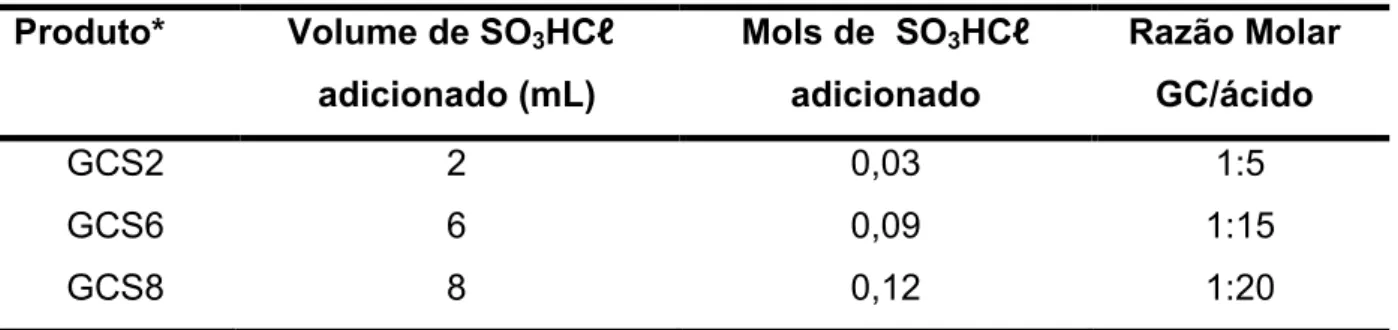
O procedimento foi realizado com volume variado de ácido: 2, 6 e 8 mL,
para obtenção de diferentes razões molares GC/ácido (Tabela 2). Após a adição
total do ácido, manteve se o sistema reacional em agitação por 12 horas sob
refrigeração. A goma do cajueiro sulfatada (GCS) foi então neutralizada com
bicarbonato de sódio, dialisada contra água destilada (acompanhado por
<
liofilizada. O material obtido foi solubilizado em água, ajustado o pH para 7,0 e
precipitado em etanol PA.
Tabela 2. Dados experimentais da reação de sulfatação da goma do cajueiro.
Produto* Volume de SO3HCℓ
adicionado (mL)
Mols de SO3HCℓ
adicionado
Razão Molar
GC/ácido
GCS2 2 0,03 1:5
GCS6 6 0,09 1:15
GCS8 8 0,12 1:20
* A numeração corresponde ao volume de ácido adicionado.
Os derivados oxidados e sulfatados da GC foram caracterizados por
espectroscopia na região do infravermelho (IV), por espectroscopia de ressonância
magnética nuclear (RMN), por cromatografia de permeação em gel (GPC), reometria
e análise termogravimétrica (TGA), como descrito do tópico métodos de análise, item
3.6.
' % ( %) *
( % )
As esferas de GE e GEGC foram preparadas como descrito por Liang e
col. (2003) com algumas modificações, utilizando o método de emulsão óleo/água.
No caso das esferas de gelatina, a proteína foi dissolvida em tampão fosfato
(pH=7,4) a 50°C, concentração de 12,5% m/v. A solução foi gotejada em 40 mL de
óleo de milho comercial (gorduras totais de 0,92 g/mL) pré aquecido a 50°C. O
sistema foi mantido em agitação por 10 minutos. Subsequentemente, o sistema foi
resfriado a 4°C em banho de gelo e as esferas de gelatina foram formadas na fase
aquosa. As esferas foram separadas por filtração em funil de placa porosa e lavadas
com acetona várias vezes para remover o óleo remanescente. Por fim, foram secas
a vácuo durante a noite.
As emulsões de gelatina e goma do cajueiro foram preparadas
dissolvendo gelatina em tampão fosfato (pH=7,4) a 50°C, concentração de 12,5%
goma (Tabela 3). Após a completa solubilização, as soluções foram misturadas e
deixadas em agitação por 10 min a 50°C. As esferas GEGC foram preparadas
seguindo a mesma metodologia usada para as esferas de gelatina.
Tabela 3. Dados experimentais da preparação das esferas de GE e GEGC.
Produto* Massa de GE (g) Massa de GC (g) Relação GE/GC
(massa/massa)
GE 6,26 1:0
GEGC10:1 1,25 0,13 10:1
GEGC1:1 5,02 5,01 1:1
*A numeração corresponde à relação GE/GC
$ ! %
As esferas dos géis semi IPN (GE e GEGC’s) foram reticuladas com
genipina conforme metodologia descrita por Wei e col. (2007) com algumas
modificações. As esferas foram dispersas em uma solução de genipina 0,067 mol/L
em solução de etanol 90% e deixadas por 24 horas (RGE e RGEGC’s) e 72 horas
(R’GE e R’GEGC’s), em seguida foram filtradas em funil de placa porosa, lavadas
com etanol e secas a vácuo.
A quantidade de genipina (gen) consumida na reticulação das esferas do
tipo semi IPN foi determinada utilizando a espectroscopia de absorção na região do
UV VIS acompanhando se a variação na absorção em 240 nm, correspondente à
genipina, conforme descrito por Paik e col. (2001).
O equipamento utilizado foi um espectrofotômetro Hewlett Packard,
modelo 8453 diode array, acoplado a um programa de coleta de dados. A curva de
calibração foi obtida medindo se a absorbância de soluções de genipina de
concentrações conhecidas, obtendo uma relação linear, r = 0,999, e a equação (2)
permite o cálculo da concentração da genipina (gen) que não reagiu durante a
reticulação.
C
As esferas antes e após a reticulação foram caracterizadas por
espectroscopia na região do infravermelho (IV), análise termogravimétrica (TGA),
microscopia eletrônica de varredura (MEV) e cinética de intumescimento, como
descrito do tópico métodos de ánalise, item 3.6.
+ ' % *
A produção de esferas da goma do cajueiro oxidada com gelatina foi feita
como descrito para gelatina e dextrana oxidada, por Wu e col. (2006) com
modificações. Dissolveu se 0,125 g da goma do cajueiro oxidada em água,
concentração de 1,25% m/v e em outro frasco dissolveu se 1,25 g de gelatina em
água a 50°C, concentração de 12,5% m/v. Após a completa solubilização, volumes
iguais das soluções foram misturadas e deixadas sob agitação por 10 min a 50°C.
A solução resultante foi então gotejada em óleo de milho comercial com
gorduras totais de 0,92 g/mL, previamente aquecido a 50°C. Depois de 10 min a
emulsão obtida foi resfriada a 4°C em banho de gelo. Para desidratar e flocular as
esferas, adicionou se acetona pré resfriada a 4°C. As esferas foram recuperadas
pela filtração da suspensão em funil de placa porosa, lavadas em acetona
previamente resfriadas a 4°C e depois secas a vácuo.
Com a finalidade de avaliar o comportamento físico químico dos géis com
a adição de goma do cajueiro oxidado (GCX), esferas de gelatina com goma oxidada
com diferentes graus de oxidação foram preparadas (Tabela 4).
Tabela 4. Dados experimentais da preparação das esferas de GEGCX.
Produto* Massa de
gelatina (g)
Massa de
GCX (g)
Relação GE/GCX
(m/m)
Amostra de
GCX
GEGCX1 1,26 0,13 10:1 GCX10:3
GEGCX2 1,26 0,13 10:1 GCX10:4
*A numeração corresponde à ordem de preparação das esferas.
As esferas de gelatina e goma do cajueiro sulfatada (GCS6) foram
preparadas seguindo a mesma metodologia descrita para as esferas GEGCX. Os
![Figura 8. Estrutura química: A do geniposídeo, onde GLU é glucose e B da genipina [Butler, Ng e Pudney (2003)]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15336994.558130/33.892.220.670.387.639/figura-estrutura-química-geniposídeo-glucose-genipina-butler-pudney.webp)
![Figura 9. Mecanismo da reação de reticulação entre grupo amina e genipina: a) esquema reacional 1 e b) esquema reacional 2 [Butler, Ng e Pudney (2003)]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15336994.558130/34.892.121.757.119.1124/figura-mecanismo-reação-reticulação-genipina-esquema-reacional-reacional.webp)