Prevalência do Vírus da Imunodeficiência Felina (FIV) e do Vírus da
Leucemia Felina (FeLV) e Fatores de Risco associados à
seropositividade em gatos domésticos do Distrito de Lisboa
- Versão Definitiva –
Dissertação de Mestrado em Medicina Veterinária
Ana Patrícia Rocha Pimenta Fernandes
Orientadora: Ana Cláudia Coelho
Co-Orientadora: Maria João Dinis da Fonseca
3
Agradecimentos
Deixo aqui a primeira palavra de agradecimento e de carinho às minhas orientadoras, a Professora Ana Cláudia Coelho e a Dra. Maria João Fonseca, por terem aceitado integrar este projeto, pelo cuidado, apoio, paciência e pela pronta disponibilidade.
Um obrigada a toda a equipa do Hospital do Gato por me acolherem, pelos ensinamentos, profissionalismo e pelas palavras de incentivo. Agradeço também ao Dr. Luís Almeida e à Dra. Manuela Machado, do Hospital Veterinário de Braga, por me deixarem sempre a porta aberta e pela partilha de conhecimentos, mesmo quando tornar-me médica veterinária parecia ainda uma realidade distante.
À minha mãe, um exemplo de coragem, amor e entrega, aos meus avós, irmão e tia Rita, os meus grandes pilares, a quem devo tudo o que sou hoje, e por terem sempre apoiado a minha dedicação aos animais, deixo um obrigada maior do que o mundo.
Agradeço ainda aos meus amigos de sempre, em particular à Teresinha e ao Manuel João, e aos que se foram juntando ao longo dos últimos seis anos, por me terem estampado um sorriso no rosto, mesmo quando as circunstâncias poderiam ditar outro estado de
espírito, e por olharem para a minha paixão por gatos com carinho.
Aos sempre meus, Matilde e Lucas, pelo companheirismo permanente e por todos os dias fazerem com que a minha admiração por felinos cresça.
Em memória à minha gata Kika, que fez com que me debruçasse sobre o FIV e o FeLV ainda antes de saber que o que queria mesmo era ser médica veterinária.
5
Resumo
O impacto de infeções por retrovírus em medicina felina é bem conhecido. No entanto, não existe informação acerca da sua atual dimensão em Portugal. Pela primeira vez, um grande estudo foi realizado em Lisboa.
O objetivo do presente estudo foi determinar a seroprevalência de infeção pelo Vírus da Imunodeficiência Felina (FIV) e pelo Vírus da Leucemia Felina (FeLV) em gatos domésticos com assistência médica veterinária no distrito de Lisboa, e identificar possíveis fatores de risco associados à seropositividade. A idade, o género, o estado fértil, o estilo de vida, e os resultados dos testes para anticorpos FIV e antigénio FeLV foram analisados em 1157 gatos registados no Hospital do Gato, desde a sua abertura em Julho de 2012 até Março de 2015.
A prevalência total para anticorpos FIV foi de 2,7% (IC 95%: 1,91-3,8%) e a de antigénio FeLV de 5,7% (IC 95%: 4,5-7,2%). Três gatos testaram positivo para ambos os retrovírus (0,3%), enquanto 0,5% obtiveram um resultado duvidoso para anticorpos FIV e 1,0% para antigénio FeLV, respetivamente. A idade foi o único fator intimamente relacionado com o risco de positividade para FIV e para FeLV. Adicionalmente, gatos com menos de três anos de idade exibiram uma probabilidade 22,9 vezes superior de se tornarem infetados por FeLV, enquanto gatos machos apresentaram um risco de 2,8 vezes superior de se tornarem infetados por FIV.
6
Abstract
The impact of retrovirus infection in feline medicine is well known. Nevertheless, there is no information available on their current status in Portugal. For the first time, a large study was conducted in Lisbon.
The aim of this study was to determine the prevalence of feline immunodeficiency virus (FIV) and feline leukemia virus (FeLV) infection among owned cats in the metropolitan area of Lisbon and to identify possible risk factors for seropositivity. Age, gender, breeding status, lifestyle factors, and test results for FIV antibody and FeLV antigen were analyzed for 1157 cats presented to the Veterinary Cat Hospital since its first opening in July, 2012, until March, 2015. Seroprevalence for FIV antibody was 2.7% (IC 95%: 1,91-3,8%) and seroprevalence for FeLV antigen was 5.7% (IC 95%: 4,5-7,2%).. Three cats were seropositive for both retroviruses (0.3%), while 0.5% obtained a dubious result for FIV antibody and 1.0% for FeLV antigen, respectively. Age was the only factor significantly associated with risk of FIV and FeLV seropositivity. Additionally, cats less than three years old had 22.9 greater odds of being seropositive for FeLV while male cats had a 2.8 times higher risk of becoming infected with FIV.
7
Índice Geral
Índice de Tabelas ... 9
Lista de Abreviaturas, Siglas e Acrónimos...10
I – Revisão Bibliográfica ...11
Família Retroviridae ...11
Vírus da Imunodeficiência Felina (FIV) ...12
1. Propriedades ...12
2. Epidemiologia...13
3. Patogénese ...16
4. Sinais Clínicos ...18
5. Diagnóstico ...21
6. Prevenção e Maneio Geral ...23
Vírus da Leucemia Felina (FeLV) ...25
1. Propriedades ...25
2. Epidemiologia...27
3. Patogénese ...29
4. Sinais Clínicos ...32
5. Diagnóstico ...36
6. Prevenção e Maneio Geral ...38
II – Objetivos ...43
III – Material e Métodos ...45
1. População e Amostra...45 2. Material e Métodos ...47 IV – Resultados ...51 1. Caracterização da Amostra ...51 2. Análise Estatística ...53 V – Discussão ...59 VI – Conclusão ...63
8
9
Índice de Figuras
Figura 1: Anatomia molecular do Vírus da Imunodeficiência Felina (FIV) ...13
Figura 2: Distribuição mundial do FIV de acordo com a localização geográfica preferencial dos seus subtipos. ...14
Figura 3: Patogénese da infeção por FIV. SNC: Sistema Nervoso Central; FIV: Vírus da Imunodeficiência Felina. ...18
Figura 4: Teste Rápido utilizado no estudo...47
Figura 5: Placa de Teste Rápido para anticorpos FIV e antigénio FeLV ...48
Figura 6: Solução Tampão de Teste ...48
Figura 7: Linha de resultado positivo para FeLV ...49
Figura 8: Distribuição da amostra quanto ao género ...51
Figura 9: Distribuição da amostra quanto à faixa etária ...52
Figura 10: Distribuição da amostra quanto ao estado de fertilidade ...52
Figura 11: Distribuição da amostra quanto ao estilo de vida ...53
Figura 12: Gatos com resultado FeLV positivo identificados como integrantes de uma casa com vários gatos, sugerindo o risco acrescido de infeção por contacto com um indivívuo infetado ...61
Índice
de
Tabelas
Tabela 1: Classificação dos subtipos de FeLV. ...26Tabela 2: Tipos de infeção por Vírus da Leucemia Felina (FeLV) ...32
Tabela 3: Resultados absolutos ao teste rápido serológico para anticorpos FIV e antigénios FeLV ...54
Tabela 4: Distribuição dos resultados dos testes rápidos de acordo com o género ...55
Tabela 5: Distribuição dos resultados dos testes rápidos segundo a faixa etária...56
Tabela 6: Distribuição dos resultados dos testes rápidos quanto ao estado de fertilidade ....57
10
Lista de Abreviaturas, Siglas e Acrónimos
ADN: Ácido Desoxirribonucleico ARN: Ácido Ribonucleico AZT: Zidovudina
CCE: Carcinoma das Células Escamosas CID: Coagulação Intravascular Disseminada ELISA: Enzyme-linked Imunosorbent Assay enFeLV: Vírus da Leucemia Felina Endógeno FeLV: Vírus da Leucemia Felina
FeSV: Vírus do Sarcoma Felina FIV: Vírus da Imunodeficiência Felina mARN: Ácido Ribonucleico Mensageiro PCR: Polymerase Chain Reaction
SIDA: Síndrome da Imunodeficiência Adquirida Th: células T-helper
11
I – Revisão Bibliográfica
As infeções provocadas por vírus são comuns em gatos, sobretudo entre jovens. Muitos dos agentes virais podem levar a uma condição muito grave ou até mesmo à morte. Alguns destes causam infeções permanentes, o que adquire ainda importância acrescida pela sua maioria ser contagiosa. A rápida identificação destes agentes é fundamental como medida de prevenção e controlo, sobretudo no caso de gatos que contactam com outros. Têm sido desenvolvidas vacinas, muitas das quais integram o protocolo vacinal básico. À semelhança do que se verifica nas outras espécies, o tratamento antiviral é ainda escasso, no entanto, tem vindo a aumentar à medida que a pesquisa se intensifica (Kennedy & Little, 2012; Taffin et al., 2014).
No âmbito desta dissertação, a autora destaca a família Retroviridae, nomeadamente os géneros Gammaretrovirus, onde se inclui o Vírus da Leucemia Felina (FeLV), e Lentivirus, onde se enquadra o Vírus da Imunodeficiência Felina (FIV). Clinicamente, uma das principais consequências de ambos os vírus é a depressão do sistema imunitário, que, por conseguinte, promove a infeção por agentes bacterianos secundários e oportunistas. O FeLV assume relevância superior por ser também considerado um oncovírus, ou seja, um vírus promotor de vários tipos de neoplasias. Motivos que justificam a sua importância em Medicina Veterinária (Dunham & Graham, 2008 Lairmore, 2011).
Família Retroviridae
A família Retroviridae subdivide-se em sete géneros: Alpharetrovirus, Betaretrovirus,
Gammaretrovirus, Deltaretrovius, Epsilonretrovirus, Lentivirus e Spumavirus. A sua
designação provém da sua capacidade de realizar um processo denominado transcriptase reversa, por possuir uma enzima homónima, responsável por sintetizar uma cópia de ácido desoxirribonucleico (ADN) a partir do seu genoma diplóide (contrariamente às outras famílias), ou seja, constituído por duas cópias de uma cadeia simples de ARN, outra característica desta família (Pereira & Tavares, 2002; Wise & Carter, 2005; Dunham & Graham, 2008; Lairmore, 2011).
Durante a transcrição reversa, o ARN é convertido em dsADN, sendo o segundo integrado no genoma da célula hospedeira por uma integrase, originando o provírus, essencial à replicação viral. Este provírus possui ainda outra característica adaptativa, a de poder permanecer latente (através da ativação e inativação de genes específicos) ou produzir ARN
12
mensageiro (mARN), que por conseguinte, dá origem a novos componentes virião. Este processo é, no entanto, suscetível a erros (mutações), responsável pela enorme variabilidade genética e pela capacidade de se evadir da ação do sistema imunitário do hospedeiro, permitindo perpetuar a infeção. Os testes de diagnóstico de retroviroses permitem apenas a deteção de infeção e não de doença clínica, dificultando por vezes o diagnóstico (Harbour et al., 2004; Wise & Carter, 2005; Dunham & Graham, 2008; Lairmore, 2011; Hartmann, 2012a).
Vírus da Imunodeficiência Felina (FIV)
1. Propriedades
O Vírus da Imunodeficiência Felina (FIV), descoberto em 1987, pertence ao género
Lentivirus, assim denominado por ser responsável por patologias de evolução crónica, com
períodos longos de incubação e viremia persistente. A sua estrutura, ciclo de vida e patogénese são em tudo semelhantes ao Vírus da Imunodeficiência Humana (VIH), pelo que se torna importante referir, tanto quanto necessário, que este vírus não é transmissível aos humanos, sendo exclusivo de felinos. (Pereira & Tavares, 2000; Hosie et al., 2009, O’Brien et al., 2012).
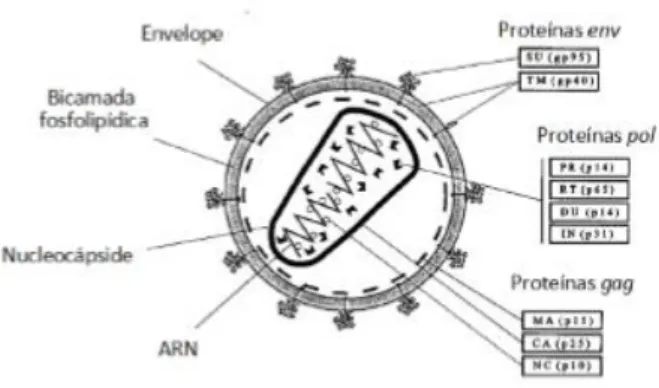
Os lentivirus são retrovírus complexos, que contêm genes adicionais acessórios, responsáveis por manter o estado de latência, para além dos habituais gag, pol e env, presentes em todos os retrovírus. O gene gag codifica as proteínas da cápside, da nucleocápside e da matriz; e, devido à primeira (a designada p24), é extremamente importante no diagnóstico. Por sua vez, o gene pol codifica a protease, a integrase e a transcriptase reversa, bem como enzimas adicionais que assumem relevância na virulência do FIV. Tanto o gag como o pol se mantêm relativamente constantes entre estirpes. Por fim, o gene env codifica a glicoproteína viral (gp120) e a proteína transmembranar (gp41), as principais determinantes da diversidade antigénica dos subtipos de FIV e, intervenientes na sua interação com os recetores das células do hospedeiro, determinando o seu tropismo, pelo que apresentam relevância notável (Bendinelli et al., 1995; Dunham & Graham, 2008; Hosie et al., 2009; Lairmore, 2011).
13
Figura 1: Anatomia molecular do Vírus da Imunodeficiência Felina (FIV), adaptado de Lairmore (2011)
2. Epidemiologia
2.1 Prevalência
O FIV apresenta uma distribuição mundial, altamente variável tendo sido já isolado em 27 espécies de felinos para além do gato doméstico, como o leão, puma, leopardo ou manul (Olmsted et al., 1992; Harbour et al., 2004; Hosie et al., 2009). Para já, estão descritos sete estirpes diferentes (A-F e U), que apresentam graus de virulência e distribuição inconstantes. Tal como mencionado anteriormente, o gene env é responsável por esta variabilidade genética, que pode atingir cerca de 26%. Os subtipos mais frequentes são o A e o B, sendo o segundo o mais comum na Península Ibérica, embora o subtipo A possa também ser encontrado. Os subtipos F e U foram os mais recentemente descobertos, nomeadamente nos Estados Unidos e Nova Zelândia. A figura 2 apresenta a atual variabilidade de subtipos de acordo com a localização geográfica (Sodora et al., 1994; Kakinuma et al., 1995; Grace, 2011).
14
Figura 2: Distribuição mundial do FIV de acordo com a localização geográfica preferencial dos seus subtipos. Adaptado de Hosie et al., 2009
Apesar dos estudos recorrentes, a prevalência de FIV em gatos domésticos permanece dúbia, por vários motivos facilmente compreendidos, como o regime voluntário de testagem de animais, a inexistência de uma base de dados centralizada que permita o registo e partilha de resultados, e a variedade de métodos de diagnóstico utilizados, que por vezes se limita ao uso de testes rápidos sem recorrer a métodos mais sensíveis. É pouco usual, em estudos, os resultados positivos de testes ELISA (Enzyme-Linked Imunosorbent Assay) serem confirmados por outros métodos, pelo que pode ocorrer uma sobrestimação da prevalência de infeção real, sobretudo em gatos saudáveis. Segundo a informação publicada, a prevalência de FIV é altamente variável e dependente do estilo de vida do gato. Os fatores de risco para a infeção incluem género masculino, idade adulta, e acesso ao exterior, enquanto que gatos confinados ao interior do lar e esterilizados apresentem taxas de infeção reduzidas, o que reflete o comportamento agressivo (sobretudo, mordeduras) como uma das principais vias de transmissão (Hoover & Mullins, 1991; O’Connor et al., 1991; Levy, 2000; Levy et al., 2006).
Nos Estados Unidos da América e Canadá, a seroprevalência de anticorpos FIV varia aproximadamente entre 4% e 24% (Luria et al., 2004; Little, 2005; Levy et al., 2008b; Little et al., 2009; Ravi et al., 2010). Um estudo efetuado em larga escala na América do Norte incluiu 18000 gatos, tendo identificado uma prevalência média de anticorpos de 2,5% e, uma prevalência de anticorpos em gatos doentes de 18,2% (Levy et al., 2006). Na realidade europeia, a prevalência é altamente variável. Alguns países (sobretudo os nórdicos) (Gleich et al., 2009) apresentam taxas baixas de infeção. Por outro lado, países como a Itália, que possuem grandes populações de gatos errantes, apresentam taxas que podem atingir os 30%
15
(Bandechii et al., 1992; Peri et al., 1994). Pelo mesmo motivo, o Japão apresenta uma taxa igualmente elevada (Nakamura et al., 2010), situação semelhante à de Istambul, que apresenta uma prevalência média de 23% (Yilmaz et al., 2000).
No panorama ibérico, está descrita uma prevalência de FIV nos gatos errantes de Madrid de 8,3% (Arjona et al., 2000). Na capital portuguesa, estudos semelhantes em gatos errantes têm apontado taxas de prevalência díspares: em 2000, esta era de 18% (Rosado, 2009); e em 2010, mostrou-se bastante inferior, 10% (Duarte, 2010). Ainda em 2012, na zona da Moita, um estudo concluiu que a taxa de prevalência de FIV em gatos errantes seria de 22% (Rodrigues, 2012). Mais recentemente, um estudo que abrangeu 88 gatos errantes na zona metropolitana de Lisboa apontou uma prevalência de 8%, enquanto outro efetuado em S. Miguel (Açores) apontou uma prevalência de 14,2% em gatos errantes e assilvestrados e em alto risco de infeção (Turras, 2014; Botelho, 2014).
2.2 Transmissão
O FIV transmite-se maioritariamente de forma horizontal por inoculação parenteral do vírus que se encontra na saliva ou sangue, presumivelmente através de mordeduras ou feridas de lutas, o que justifica que haja uma maior prevalência entre os machos (Hosie et al., 2009; Grace, 2011). O FIV pode ser encontrado no epitélio das glândulas salivares, durante a infeção aguda, bem como na saliva, linfócitos sanguíneos, e no plasma ou soro, o que evidencia a importância desta via de transmissão (Matteucci et al., 1993; Nakamura et al., 2010).
O aparelho reprodutor feminino contém linfócitos T e B, macrófagos e células dendríticas, reconhecidas células-alvo do FIV (Sellon & Hartmann, 2012), pelo que a transmissão in utero é admitida, sendo, no entanto, considerada rara em circunstâncias naturais. Contudo, estudos de anticorpos não excluem a possibilidade de ocorrência de transmissão ocasional por estas vias. A elevada mortalidade em neonatos FIV-positivos ou as infeções rapidamente progressivas podem provocar uma subestimação da transmissão in utero e neonatal na natureza (O’Neil et al., 1995; O’Neil et al., 1996; Obert & Hoover , 2000a; Obert & Hoover, 2000b; Allison & Hoover, 2003a; Allison & Hoover, 2003b; Coats, 2005). Adicionalmente, a observação de gatinhos filhos de uma mãe infetada por FIV poderem conter provírus nos seus tecidos, mas não necessariamente no seu sangue, na ausência de anticorpos detetáveis, complica a compreensão da transmissão congénita (Allison & Hoover, 2003a).
A presença de cargas virais superiores no leite materno comparativamente às presentes nas células secretoras de leite ou plasma sugere que o vírus esteja concentrado no primeiro, podendo constituir uma fonte de infeção para os neonatos. Contudo, a maioria das
16
progenitoras infetadas transmite apenas anticorpos no colostro/leite, o que leva à obtenção de resultados falsos positivos quando as crias são testadas recorrendo a ELISA ou Western
Blot, antes dos seis meses de idade (O’Neil et al., 1995; O’Neil et al., 1996; Allison & Hoover,
2003a; Kennedy & Little, 2012; Litster, 2014). Por outro lado, a transmissão pela saliva aquando do “grooming” materno parece ser pouco relevante (Lairmore, 2011).
Apesar das transmissões venérea ou oronasal não estarem descritas em natureza, os gatos podem ser infetados experimentalmente por inoculação do vírus no nariz, boca, vagina e reto, e o vírus pode ser isolado a partir de sémen quer em infeção natural, quer experimental (Yamamoto, 1988; Moench et al., 1993; Jordan et al., 1998; Sellon & Hartmann, 2012).
A transmissão indireta é tida como extremamente improvável, já que o vírus é bastante frágil no meio ambiente, sensível a desinfetantes comuns e não resiste muito tempo no exterior do hospedeiro. Assim, é possível que gatos infetados coabitem com gatos não infetados sem que os últimos se tornem seropositivos, ainda que teoricamente a transmissão seja possível através do contacto de saliva entre si no comedouro ou durante o “grooming”, sobretudo se o gato não infetado lamber feridas do gato infetado (Harbour et al., 2004; Lairmore, 2011).
2.3 Fatores de Risco
Dos fatores de risco, destacam-se a condição de macho adulto inteiro (quatro vezes mais suscetíveis do que gatos jovens e três a quatro vezes mais infetados do que as fêmeas), pelo seu comportamento naturalmente mais agressivo e territorial, e a densidade populacional, que promove a competição por recursos, aumentando confrontos e a ocorrência de mordeduras (Hosie et al., 1989; Levy et al., 2006; Levy et al., 2008a; Bande et al., 2012).
3. Patogénese
A patogénese da infeção por FIV está condicionada por uma larga variedade de fatores, como a idade do animal aquando da infeção (animais mais novos manifestam sinais clínicos mais cedo), propriedades do isolado FIV (alguns são mais patogénicos do que outros), a carga viral a que o animal é exposto e a via de infeção (parenteral versus mucosa). Todas estas variáveis interferem com a cinética viral, as respostas imunitárias do hospedeiro, os sinais clínicos e a progressão da infeção (Hokanson et al., 2000; Obert & Hoover, 2000a; Obert & Hoover, 2000b; Burkhard et al., 2001; Burkhard et al., 2002).
17
Os principais alvos da infeção por FIV são os linfócitos T CD4+ ativados (ocorrendo infeção também das células dendríticas e macrófagos), que tipicamente funcionam como células T-helper (Th), ocupando um lugar de destaque na função imunitária, por facilitarem o desenvolvimento da imunidade humoral e mediada por células. A glicoproteína do seu envelope, a gp120, liga-se ao recetor primário da superfície celular do hospedeiro, a molécula CD134, desencadeando o processo de transcrição reversa, ou seja, a transcrição do ARN (ácido ribonucleico) viral para uma cópia de ADN (ácido desoxirribonucleico) (ou provírus) (Shimojima et al., 2004; Willet et al., 2006). Esta replicação viral coincide com a fase de viremia (fase aguda de infeção), afetando primordialmente o Sistema Nervoso Central, pulmões, timo, linfonodos mesentéricos e glândulas salivares. O vírus é passível de ser detetado através da análise por Polymerase Chain Reaction (PCR) ou segundo o seu isolamento em cultura celular em leucócitos cinco dias após a infeção e dez dias após a infeção noutros órgãos, sendo, no entanto, o pico de viremia e de ADN proviral nas células nucleadas atingido apenas oito a dez semanas após o início da infeção. Nesta fase, podem ser observados sinais clínicos ligeiros a moderados, como anorexia, depressão e febre, que geralmente desaparecem rapidamente. Por outro lado, sinais como a linfadenopatia generalizada, devido ao número aumentado de centros germinativos e do seu tamanho, pode persistir por semanas a meses. A diminuição da carga viral no plasma marca o início da fase assintomática, que pode prolongar-se por anos (ou até durante toda a vida). O resultado de uma infeção por FIV é variável. Durante a fase assintomática, a carga viral plasmática mantém-se estável, mas vai ocorrendo um declínio progressivo dos linfócitos T CD4+ e um aumento progressivo de linfócitos citotóxicos (CD8+), resultando num rácio de linfócitos CD4+:CD8+ invertido, o que leva a uma imunodeficiência funcional, aos sinais clínicos da síndrome de imunodeficiência adquirida (SIDA) e morte (Harbour et al., 2004; Dunham & Graham, 2008; Hosie et al., 2009; Lairmore, 2011).
Os anticorpos produzidos pelo sistema imunitário em resposta às proteínas estruturais do invólucro, cápside e membrana, podem ser detetados no sangue entre cerca de duas a seis semanas após a infeção, estando este intervalo de tempo condicionado pelos fatores já mencionados, como a carga viral aquando da exposição, a título de exemplo (Hosie & Jarrett, 1990; Fevereiro et al., 1991; Bendinelli et al., 1995; Hosie et al., 2009; Sellon & Hartmann, 2012). Os anticorpos persistem ao longo de toda a infeção, à exceção da fase terminal, onde ocorre exaustão do sistema imunitário (Fevereiro, et al., 1991; Noronha, 1991; Lairmore, 2011; Sellon & Hartmann, 2012). Uma infeção torna-se latente quando a célula do hospedeiro integra a cópia do provírus, mas não produz partículas virais – a menos que a célula seja ativada. Estas células infetadas de forma latente representam um reservatório de infeção que não é atingido pelos anticorpos neutralizantes, tornando-se um obstáculo à eficácia da
18
vacinação, motivo pelo qual um gato pode conter o provírus e não apresentar anticorpos (Hosie et al., 2009).
Figura 3: Patogénese da infeção por FIV. SNC: Sistema Nervoso Central; FIV: Vírus da Imunodeficiência Felina. Adaptado de Hartmann, 2012.
4. Sinais Clínicos
Experimentalmente, a infeção por FIV evolui ao longo de vários estádios, de forma semelhante ao vírus da imunodeficiência humana (VIH), incluindo-se uma fase aguda, uma fase clinicamente assintomática de duração variável, e uma fase terminal por vezes referida como “síndrome da imunodeficiência felina adquirida” (equivalente à SIDA em humanos) (English, 1995; Goto et al., 2000). No entanto, não existe uma distinção clara entre estas etapas em gatos infetados por FIV de forma natural, e nem todas elas são aparentes. Por conseguinte, a utilidade da classificação em estádios na infeção natural por FIV tem sido questionada (Wise et al., 2005; Sellon & Hartmann, 2012). Além disso, gatos em condição moribunda com imunodepressão grave e infeções secundárias podem recuperar totalmente, com os cuidados médicos adequados, e retornar à fase assintomática. Ou seja, contrariamente ao que acontece em humanos infetados pelo VIH, gatos classificados na fase de SIDA (elevada carga viral e sinais clínicos graves devido a infeção secundária) podem
19
recuperar e tornar-se novamente assintomáticos, com um decréscimo dramático da sua carga viral (Hartmann, 2012a). Na realidade, é frequente o gato exibir manifestações de doença crónica, com episódios esporádicos e recorrentes. Alguns gatos sofrem uma progressão muito célere do quadro clínico, enquanto outros não demonstram qualquer sinal clínico durante anos. Contudo, o mais comum é que a diminuição progressiva de linfócitos T CD4+ se faça acompanhar de episódios cada vez mais frequentes e de gravidade superior até que os gatos entrem na fase terminal (Richards, 2005; Belak et al., 2009).
Os sinais clínicos da infeção por FIV refletem geralmente doenças secundárias, tais como infeções ou neoplasias, para as quais os gatos afetados pelo vírus são considerados suscetíveis, devido à síndrome de imunodepressão associada ao vírus. O FIV em si provoca alguns sinais clínicos, resultantes de uma função anormal ou inflamação de órgãos afetados. Em infeção experimental, a primeira fase (cerca de quatro a seis semanas após a inoculação) é por vezes denotada frequentemente através de sinais clínicos ligeiros a moderados, como febre transiente, letargia, leucopenia, sinais de enterite, estomatite, dermatite, conjuntivite, doença do trato respiratório, e aumento generalizados dos linfonodos (Obert & Hoover, 2000a; Hartmann, 2012a; Liem et al., 2013). A fase aguda pode perdurar entre vários dias a poucas semanas, ao final da qual os gatos iniciam um período em que se apresentam clinicamente saudáveis, o que torna a fase inicial impercetível à maioria dos proprietários. Alguns gatos podem, no entanto, exibir sinais clínicos mais graves, ainda que esta situação seja pouco frequente, tais como septicémia, dermatite pustular facial, anemia, diarreia e estomatite (Hartmann, 2012a; Liem et al., 2013). A duração da fase assintomática é variável, mas geralmente mantém-se por bastantes anos (Hartmann, 2012). A duração desta fase está condicionada por vários fatores, como a virulência da estirpe (também dependente do subtipo de FIV), exposição a agentes patogénicos secundários, e a idade do gato, sendo a gravidade inversamente proporcional à idade do animal aquando da infeção (George et al., 1993; Podell et al., 1997; Pedersen et al., 2001; Sellon & Hartmann, 2012). Na última fase (a fase “SIDA”), os sinais clínicos são um reflexo de infeções oportunistas, neoplasia, mielossupressão, e doença neurológica (Hartmann, 2012a). É de ressalvar que a fase assintomática não se trata de uma fase de latência característica dos lentivírus. Numa fase de latência, não ocorre replicação viral, enquanto que na fase assintomática, apesar de silenciosa, o vírus se mantém ativo, podendo ser detetado no plasma e na saliva, em quantidade semelhante à do encontrado em gatos que manifestam sintomatologia (Ishida et al., 1992; Wise & Carter, 2005; Liem et al., 2013).
Gatos infetados por FIV apresentam um risco cinco vezes superior de desenvolver linfoma ou leucemia. Têm sido associados ao FIV linfomas (sobretudo das células B), leucemias,
20
carcinomas das células escamosas (CCE), fibrossarcomas, meningiomas, adenocarcinomas e mastocitomas. Como o FIV não é um vírus oncogénico, presume-se que a sua ação no desenvolvimento destas neoplasias seja indireta e consequente à imunodepressão e não à ação do vírus em si (Fleming et al., 1991; Terry et al,. 1995; Poli et al., 1996; Callanan et al., 1996; Barr et al., 2001; Gabor et al., 2001; 2006; Magden et al., 2011; Lairmore, 2011; Sellon & Hartmann, 2012).
A diminuição progressiva de linfócitos T CD4+, a imunoestimulação excessiva e a adulteração da resposta dos mecanismos imunes aos antigénios promovem inflamações crónicas, bem como doenças imunomediadas, estando descritas estomatite/gengivite crónicas (em mais de 50% dos casos), por vezes com ulceração ou necrose, doença respiratória crónica (provocada por infeções bacterianas, fúngicas, protozoárias ou parasitárias), linfadenopatia, diarreia crónica, perda de peso e infeções por agentes patogénicos secundários oportunistas, como o vírus da leucemia felina (FeLV), calicivírus, herpesvírus, Staphylococcus spp., Pseudomonas spp., ou Demodex. É frequente que estas infeções se instalem simultaneamente, sendo resistentes ao tratamento e exigindo, por isso, que este seja prolongado. Uma perda de peso acentuada (mais de 20% dos gatos), leucopenia e anemia persistentes são comuns (Linenberger & Abkowitz, 1995; Wise et al., 2005; Hosie et al., 2009; Barraza et al., 2009; Ettinger & Feldman, 2010; Liem et al., 2013).
O FIV é ainda tido como responsável de alterações renais, por causar amiloidose intersticial e glomerular e glomerulonefrite intersticial, o que predispõe a insuficiência renal crónica (Baxter et al., 2012; Poli et al., 2012; Asproni et al., 2013). Subjacente à estirpe de FIV, gatos em fase terminal ou muito jovens podem exibir alterações neurológicas: anisocoria, reflexo pupilar diminuído, convulsões, ataxia, tremores de intensão, parésia, paralisia (ainda que rara), anomalias motoras multifocais, capacidade de aprendizagem diminuta, e alterações do padrão de sono (gatos infetados podem chegar a dormir menos 50%), admitindo-se que a última se deve a infeção de células da microglia e astrócitos. Neste caso, é rara a presença de sinais sistémicos como febre ou anorexia (Próspero-García et al., 1994; Gunn-Moore et al., 1996; Power et al., 1997; Steigerwald et al., 1999; Fletcher et al., 2011; Hartmann, 2012a; Liem et al., 2013). É frequente observar-se uveíte ligeira, muitas vezes associada à inflamação da íris e a um aumento da opacidade do humor aquoso, devido à deposição de complexos imunes na câmara anterior do olho (inflamação da pars plana), (Willis, 2000; Stiles, 2013), ainda que possam ser encontradas anomalias também no segmento posterior. O glaucoma, associado ou não a uveíte, está também descrito. As alterações do segmento posterior podem englobar a pars planitis (infiltração leucocitária na câmara vítrea posterior à lente),
21
degenerescência retinal focal e hemorragias retinais (O’Neil et al., 1991; Lappin et al., 1992; English et al., 1995; Willis, 2000).
As alterações hematológicas mais frequentes são neutropenia (a mais consistente), trombocitopenia (que pode ser primária ou secundária a neoplasia), aumento do tempo de tromboplastina parcial ativada e do tempo de trombina, coagulação intravascular disseminada (CID) (geralmente secundária a infeção ou neoplasia), anemia não regenerativa e hiperglobulinemia policlonal (Linenberger & Abkowitz, 1995; Hartmann, 2012a).
5. Diagnóstico
5.1 Métodos Indiretos
Como o organismo produz anticorpos em resposta aos antigénios FIV, estes podem ser facilmente detetados recorrendo a testes indiretos (menos laboriosos e prontamente acessíveis), sendo estes o mais comumente utlizados na prática clínica (Ammersbach & Bienzle, 2011; Kennedy & Little, 2012).
5.1.1 Teste de Anticorpos
A maioria dos gatos produz anticorpos dentro de sessenta dias, no entanto, o desenvolvimento de anticorpos detetáveis pode estar retardado em alguns casos, chegando a demorar quatro meses. Uma vez que o FIV causa infeção persistente da qual os gatos não recuperam, gatos infetados desenvolvem geralmente elevadas quantidades de anticorpos FIV-específicos. Estes são geralmente detetados na prática clínica recorrendo a testes ELISA ou de imunocromatografia (Poli et al., 1992; Hartmannet al., 2007). Os testes de rotina detetam anticorpos que reconhecem as proteínas estruturais virais (tal como a p24 da cápside ou o péptido gp41 do envelope) e podem assumir a forma de ELISA ou imunocromatografia. A análise por Western Blot é tida como o “gold standard” na serologia do FIV e é utilizada para confirmar resultados inconclusivos (Dunham & Graham, 2008; Hosie et al., 2009).
O teste ELISA baseia-se na deteção de anticorpos que reconhecem as proteínas p24 e a transmembranar, enquanto o teste de imunocromatografia deteta apenas a presença de anticorpos que reconhecem péptidos pequenos da proteína transmembranar (Hosie et al., 2009). Os kits disponíveis comercialmente apresentam elevadas sensibilidade e especificidade (>90%), em gatos não vacinados contra o FIV (Levy et al., 2004; Hartmann et al., 2007).
22
No Western Blot, o FIV é purificado e separado por eletroforese de gel nos seus constituintes proteicos, sendo estes detetados individualmente por anticorpos. Poderão ocorrer resultados falsos positivos se a técnica for realizada incorretamente ou se for utilizado sangue total em vez de soro (Hosie et al., 2009; Sellon & Hartmann, 2012).
A pesquisa de antigénios é ineficaz, uma vez que a quantidade de vírus circulante é baixa após a fase aguda de infeção (Richards, 2005; Kennedy & Little, 2012).
5.1.2 Limitações do Teste de Anticorpos:
Os testes disponíveis não distinguem anticorpos maternos e anticorpos vacinais de anticorpos por infeção natural. Ou seja, um resultado positivo no teste a gatinhos antes dos seis meses de idade poderá resultar num falso positivo, pelo que este deve ser apenas realizado, ou confirmado, no caso de efetuado previamente, a esta idade, altura em que os anticorpos maternais não estão certamente presentes (MacDonald et al., 2004; Richards, 2005; Levy et al., 2008b, Hosie et al., 2009; Ammersbach & Bienzle, 2011; Sellon & Hartmann, 2012). Se for necessário obter um resultado definitivo antes dos seis meses de idade, pode ser utilizada a PCR. Dever-se-á testar a progenitora paralelamente, para garantir que a estirpe infetante é detetada pela PCR (Hosie et al., 2009; Sellon & Hartmann, 2012). Por outro lado, o desenvolvimento e comercialização de uma vacina contra o FIV em alguns países, nomeadamente Estados Unidos, Canadá, Austrália, Nova Zelândia e Japão, poderão também originar resultados falsos positivos, uma vez que os anticorpos vacinais se mantêm por mais de um ano e, em alguns casos, até quatro (Levy et al., 2004; Levy et al., 2008b). Apesar de esta preocupação não ser comum na Europa, convém fazer a ressalva no caso de gatos importados.
Uma vez que os anticorpos não se desenvolvem imediatamente após a infeção, é recomendável que os gatos sejam novamente testados findos sessenta dias, para garantir que decorreu tempo suficiente para a ocorrência de seroconversão (Ammersbach & Bienzle, 2011).
Como não são 100% sensíveis nem específicos, qualquer resultado positivo numa população de prevalência baixa (ex. gatos jovens, com pedigree e confinados ao lar) deverá ser confirmado, por exemplo recorrendo ao Western Blot, já que a probabilidade de o gato não estar efetivamente infetado é superior a 50%. Por outro lado, um resultado positivo num gato proveniente de um grupo de alto risco (exemplo, macho inteiro, com acesso ao exterior e maduro) será provavelmente correto, uma vez que a frequência de gatos efetivamente positivos é superior à de falsos positivos neste grupo (Dunham & Graham, 2008; Hosie et al., 2009).
23
Na fase terminal da doença, é possível obter resultados falso negativos, devido à exaustão do sistema imunitário, ou quando a carga viral no sangue é tão elevada que ocorre sequestro dos anticorpos anti-FIV em imunocomplexos (Hosie et al., 2009; Lairmore, 2011).
5.2 Métodos Diretos
O isolamento do vírus é um método de diagnóstico fidedigno, mas é laborioso e dispendioso, pelo que fica de parte no panorama da prática clínica. Baseia-se na cultura celular em linfócitos T felinos por duas a três semanas, sendo a presença do vírus confirmada pela mensuração dos níveis de proteínas virais nos fluidos da cultura (Hosie et al., 2009).
A PCR permite detetar o ADN proviral, no entanto, a sua eficácia está condicionada pela estirpe do vírus, apresentando maior sensibilidade para a estirpe A. A sua sensibilidade geral é de 41% a 93% e a sua especificidade de 81% a 100% (sendo ligeiramente inferior em gatos vacinados contra o FIV) (Slater et al., 2005; Crawford & Levy, 2007; Ammersbach & Bienzle, 2011; Bienzle et al., 2013).
5.3 Interpretação de Resultados Discrepantes de PCR e Serologia
5.3.1 Seropositivo/PCR negativo: esta situação pode ser explicada pela presença de um subtipo de FIV não detetado pela PCR e não pela ausência de infeção ou no caso de gatinhos jovens que possuam anticorpos maternais.
5.3.2 Seronegativo/PCR positivo: este resultado pode ser obtido quando gatos que vivam em contacto próximo com gatos infetados seropositivos se tornam provírus positivos sem desenvolverem anticorpos ou manifestarem doença. Estes gatos estão infetados e sofrerão geralmente seroconversão em semanas ou meses (Dandekar et al., 1992; Hosie et al., 2009).
6. Prevenção e Maneio Geral
A prevenção passa naturalmente por evitar a exposição de gatos não infetados a gatos potencialmente infetados ou de estatuto desconhecido, pelo que a adoção de novos gatos deve ser responsável e consciente e o estilo “outdoor” evitado. Além disso, a castração funciona também como uma medida preventiva, na medida em que diminui a agressividade, as tentativas de fuga, e a possibilidade de confrontos com outros gatos (Hosie et al., 2009).
24
Embora se trate de uma doença crónica incurável, um teste com resultado positivo nunca deverá ser tido como motivo de eutanásia, uma vez que existem evidências de que animais infetados poderão ter uma esperança média de vida semelhante à de gatos não infetados, tal como comprovado por um estudo realizado na Alemanha, ao longo de nove anos, em que gatos infetados apresentam uma esperança média de vida de 784,8 dias, comparável à esperança média de vida de gatos não infetados de 625,0 dias (Hosie et al., 2009; Gleich et al., 2009). Adicionalmente, um gato FIV positivo poderá ter uma fase assintomática longa ou até permanente e, mesmo após o aparecimento de sinais clínicos, a doença pode ser controlada por meses, conferindo uma boa qualidade de vida ao animal (Hosie et al., 2009). Por outro lado, um estudo realizado nos Estados Unidos da América, ao longo também de nove anos, demonstrou uma esperança média de vida de 4,9 anos para gatos infetados face à de 6,0 para gatos não infetados (Addie et al., 2000).
Quando um gato é FIV-positivo, uma das medidas mais protetoras é a de isolamento. Isto é, o gato deverá ser confinado ao interior da casa, evitando assim o seu contacto com outros gatos, minimizando a sua exposição a outros agentes infeciosos e, por sua vez, evitando a disseminação do vírus. Se o gato partilhar a casa com outros gatos com outras condições infeciosas, é aconselhável separá-lo dos de mais. A castração de gatos seropositivos saudáveis é encorajada, já que diminui a agressividade e, por conseguinte, o risco associado de transmissão de FIV, e a probabilidade de fuga e consequente contacto com outros gatos (Levy et al., 2008b; Hosie et al., 2009)
Em termos de cuidados clínicos, recomendam-se exames realizados pelo médico veterinário pelo menos de seis em seis meses, sendo aconselháveis exames laboratoriais (hematologia, bioquímica, urianálise e fecal) no mínimo uma vez por ano. O controlo do peso deve ser exímio, uma vez que este é frequentemente o primeiro sinal de progressão da doença. Deve dar-se particular atenção ao exame da boca, olhos e linfonodos. Se houver necessidade de internamento de um gato seropositivo, este não deve ser colocado na unidade de doenças infetocontagiosas, por ser mais suscetível, e sim na ala comum numa jaula independente. Ainda em ambiente hospitalar, todos os instrumentos potencialmente contaminados com sangue ou saliva, incluindo comedouros/bebedouros, devem ser esterilizados (Levy et al., 2008b; Hosie et al., 2009; Sellon & Hartmann, 2012).
A nutrição de um gato infetado deve excluir carne crua e leite não pasteurizado ou ovos, por apresentarem risco de infeção por bactérias ou parasitas e devendo ser completa e equilibrada. Os esquemas de desparasitação interna e externa devem ser escrupulosamente respeitados (Levy et al., 2008b; Hosie et al., 2009).
25
Numa fase inicial da infeção, a maioria dos gatos mantém a capacidade de desenvolver uma resposta imunitária adequada aquando da vacinação, pelo que o intervalo entre doses poderá ser mantido (Richards et al., 2006; Hosie et al., 2009). Não obstante, é aconselhável a utilização de vacinas inativadas em detrimento das habituais vivas atenuadas, pelas segundas representarem risco de desenvolvimento de novo poder patogénico. Na Europa, não está disponível qualquer vacinação contra o FIV (Richards et al., 2006; Hosie et al., 2009; Sellon & Hartmann, 2012).
Vírus da Leucemia Felina (FeLV)
1. Propriedades
O Vírus da Leucemia Felina (FeLV) foi identificado pela primeira vez em 1964 num gato com linfoma, tendo, por isso, sido integrado na subfamília Oncoviridae. As subfamílias Retroviridae foram entretanto reorganizadas e o FeLV é agora classificado como um
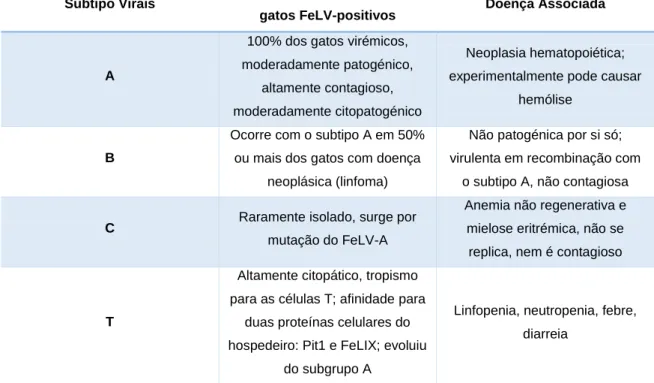
gammaretrovirus. O FeLV é, por sua vez, subdivido nos subtipos A, B, C e T, de acordo com
as diferenças existentes na sequência do gene env e as suas células-alvo no hospedeiro (ver tabela 1). O subtipo A é ubiquitário, sendo o único associado à transmissão horizontal entre felinos. Para além da forma exógena do FeLV, estão descritas duas formas endógenas: o enFeLV e o RD-114. O primeiro combinando-se com o FeLV-A origina o FeLV-B (que representa cerca de 50% das infeções por FeLV), enquanto o segundo é tido como não patogénico, apesar de ser capaz de se replicar e de se transmitir entre gatos quando aliado ao FeLV-A e originar infeções mais graves, com um aumento considerável de doenças neoplásicas (cerca de 30% dos animais desenvolve linfomas). O enFeLV terá tido origem há cerca de dez milhões de anos devido à integração do Vírus da Leucemia Murina (MuLV) nas células germinais do gato doméstico após a ingestão ou mordedura do ancestral de um rato, no deserto do Norte de África. Como o seu genoma é incompleto, é incapaz de provocar doença por si só. Pensa-se que o RD-144 tenha tido origem em primatas há centenas de milhares de anos e que influencie a diferenciação fetal. O subtipo C (cerca de 1% das infeções por FeLV) desenvolve-se a partir de uma mutação pontual no gene env e provoca uma anemia fatal em poucas semanas, enquanto o subtipo T assume esta designação devido ao seu tropismo para os linfócitos T, sendo este uma variante do subtipo A que provoca imunossupressão severa. Apesar de os subtipos B, C e T não serem transmissíveis, estes poderão sofrer mutações/recombinações dando origem ao subtipo A. Os diferentes subtipos apresentam morfologia distinta, no entanto, não são distinguíveis por nenhum teste de
26
diagnóstico. O FeLV, para além de infetar o gato doméstico, pode também atingir o gato-montês, o Lince Ibérico e o Lince Europeu (Benveniste et al., 1975; Barbacid et al.1977; Norsworthy, 1993; Gwynn et al., 2000; Miyazawa, 2002; Ravazollo & Costa, 2007; Lutz et al., 2009; Costa & Norsworthy, 2011; Hartmann, 2012b; Kennedy & Little, 2012).
Tabela 1: Classificação dos subtipos de FeLV. Adaptado de Kennedy & Little, 2012
À semelhança dos restantes retrovírus, o FeLV possui uma cadeia de ARN simples que por intermédio de uma transcriptase reversa é transcrita em ADN, o então provírus subsequentemente integrado no genoma celular, e com uma estrutura genómica bastante elementar, constituída apenas pelos genes env, pol e gag. O gene env codifica as proteínas do envelope viral, as designadas proteína 70 (gp70) e a proteína transmembranar 15E (p15E). A primeira define o subgrupo do vírus e, por ser extremamente antigénica, determina o grau de patogenicidade; a segunda é responsável pela ligação da gp70 à membrana celular do hospedeiro e pela imunodepressão e anemia não regenerativa observável em gatos com viremia persistente. O gene pol, por sua vez, define a transcriptase reversa, a protease e a integrase. Por fim, o gene gag assume principal relevância no diagnóstico de FeLV, por codificar a proteína p27, produzida nas células infetadas pelo vírus de forma exuberante,
Subtipo Virais Frequência de Isolamento em
gatos FeLV-positivos Doença Associada
A
100% dos gatos virémicos, moderadamente patogénico,
altamente contagioso, moderadamente citopatogénico
Neoplasia hematopoiética; experimentalmente pode causar
hemólise
B
Ocorre com o subtipo A em 50% ou mais dos gatos com doença
neoplásica (linfoma)
Não patogénica por si só; virulenta em recombinação com
o subtipo A, não contagiosa
C Raramente isolado, surge por
mutação do FeLV-A
Anemia não regenerativa e mielose eritrémica, não se replica, nem é contagioso
T
Altamente citopático, tropismo para as células T; afinidade para
duas proteínas celulares do hospedeiro: Pit1 e FeLIX; evoluiu
do subgrupo A
Linfopenia, neutropenia, febre, diarreia
27
estando presente em grandes quantidades também no sangue de gatos infetados. Por este motivo, os testes ELISA e de imunofluorescência são conseguidos para detetar esta proteína no sangue ou intracelular, respetivamente. A p27 livre não circula no sangue, mas é libertada nas lágrimas e saliva, onde também pode ser detetada (Hardy et al., 1976; Lairmore, 2011; Hartmann, 2012a).
A importância do FeLV em Medicina Veterinária prende-se em grande parte ao facto deste apresentar diversos mecanismos oncogénicos. Isto é, o FeLV possui oncogenes virais (ex., v-myc), que podem ativar proto-oncogenes do hospedeiro, contrariam a ação de genes supressores de tumores e induzem a mutagénese através da inserção de ADN viral no genoma do hospedeiro, alterando a sua estrutura e/ou função de genes geralmente envolvidos na regulação do ciclo celular (Coffin et al., 1997; Lee & Reddy, 1999).
2. Epidemiologia
2.1 Prevalência
A infeção por FeLV existe em gatos domésticos por todo o mundo. Segundo os estudos de prevalência, apenas os gatos da ilha de Granada (Caraíbas) e Ilha Isabela (Galápagos) estão livres de infeção (Levy et al., 2008c; Kelly et al., 2009). Contrariamente ao FIV, no qual a prevalência varia de forma significativa, a taxa de infeção por FeLV em gatos errantes é semelhante em todo o globo, variando entre 1% e 8% em gatos saudáveis. Se forem incluídos só gatos doentes, a prevalência chega a atingir 38%. Inicialmente, algumas doenças, como o linfoma, eram associadas a elevadas taxas (até 75%) de infeção por FeLV. Na maioria dos países europeus, Estados Unidos da América e Canadá, estima-se uma prevalência de cerca de 1%. Apesar da prevalência se manter relativamente constante em gatos errantes, independentemente do ponto geográfico, numa casa com vários gatos, sem medidas de controlo, pode atingir os 20%, sendo a maior variável a densidade populacional. Nas últimas décadas, a prevalência, bem como a importância, da infeção por FeLV tem diminuído grandemente na Europa, devido à prática de medidas de controlo, das quais se destacam o uso de testes diagnósticos fiáveis, os programas de “teste e remoção”, e a vacinação (Lutz et al., 1990; Hosie et al., 2000; Harrus et al., 2002; Bandecchi et al., 2006; Levy et al., 2006; Solano-Gallego et al., 2006; Gleich & Hartmann, 2009; Little et al., 2009; Lutz et al., 2009; Ettinger & Feldman, 2010).
28
Não obstante, salvas raras exceções, os estudos de prevalência de FeLV são única e exclusivamente baseados na deteção do antigénio p27 no sangue recorrendo a ELISA ou testes de imunocromatografia semelhantes. No entanto, a patogénese do vírus é complexa, e o antigénio livre pode apenas ser encontrado no sangue de gatos em fase de viremia, uma vez que os que sofrem infeção regressiva alojam o provírus apenas nas células da medula óssea após ultrapassarem a antigenemia. Assim, o teste de antigénios pode subestimar a real prevalência da infeção (Rojko et al., 1992; Hartmann, 2012a).
Dos estudos mais recentes, destacam-se um na Polónia com 676 gatos e cuja prevalência de FeLV foi de 6,4% (Rypula et al., 2014), e um nos Estados Unidos da América, com 18000 gatos, dos quais 2,3% testaram positivo (Levy et al., 2006).
Na realidade portuguesa têm sido apresentadas taxas de prevalência de FeLV elevadas face ao restante panorama, ainda que constantes. Dois estudos em Lisboa apontam para uma taxa de infeção de 10% e 10,2%, enquanto um realizado na Moita refere uma prevalência também de 10%. Os últimos estudos indicam uma taxa de 5,7% em gatos errantes na zona metropolitana de Lisboa e de 0,6% em gatos errantes e assilvestrados em alto risco na ilha de S. Miguel (Rosado, 2009; Duarte, 2010; Rodrigues, 2012; Turras, 2014; Botelho, 2014).
2.2 Transmissão
O FeLV é excretado na saliva (onde a sua concentração é superior à do plasma), secreções nasais, fezes, urina e leite. A transmissão horizontal ocorre maioritariamente através de comportamento mútuo, como o “grooming”, a partilha de taças de comida e água e de caixas de areia, assumindo a saliva o papel mais relevante, e podendo também acontecer por mordedura (à semelhança do FIV). A transmissão vertical é passível de acontecer durante a gestação e lactação, contudo, resulta geralmente em morte embrionária e nados-mortos. Até 20% dos gatinhos infetados verticalmente podem sobreviver e tornar-se adultos persistentemente infetados. Se a progenitora estiver infetada de forma regressiva latente, a probabilidade de transmissão do vírus às crias é diminuta, apesar de algumas delas poderem ser virémicas após o nascimento, uma vez que este se mantém latente na glândula mamária até ao seu desenvolvimento no final da gravidez, e de o vírus poder ser transmitido pela saliva durante os rituais de limpeza. Crias provenientes de gatas com infeção regressiva com eliminação da infeção adquirem anticorpos que lhes conferem imunidade por dois a três meses (Hardy et al., 1976; Grant et al., 1980; Pacitti et al., 1986, Lutz et al., 2009, Costa & Norsworthy, 2011; Hartmann, 2012).
29
A transmissão por fómites é pouco provável, no entanto, a infeção iatrogénica com material infetado (ex., agulhas) ou por transfusão sanguínea pode acontecer (Levy et al., 2001; Levy et al., 2008b; Lutz et al., 2009; Costa & Norsworthy, 2011; Hartmann, 2012a).
As pulgas são consideradas uma potencial fonte de infeção, uma vez que o ARN viral foi já isolado a partir das mesmas, assim como as fezes, apesar das últimas, à semelhança da urina, não serem consideradas fontes importantes de infeção (Vobis et al., 2003; Cattori et al., 2009; Gomes-Keller et al., 2009; Hartmann, 2012a).
2.3 Fatores de Risco
A resistência à infeção persistente aumenta com a idade, mas o grau de resistência natural permanece desconhecido. Gatinhos com menos de dezasseis semanas de idade apresentam maior probabilidade de ficarem persistentemente infetados após exposição. Não obstante, gatos adultos podem ser suscetíveis à infeção por FeLV após exposição contínua (Grant et al., 1980; O’Connor et al., 1991; Levy et al., 2006; Grenacher et al., 2009; Hartmann, 2012b; Kennedy & Little, 2012).
Doenças concomitantes, elevada densidade populacional, falta de higienização ambiental e acesso ao exterior integram também os fatores de risco. À semelhança do FIV e pelos mesmos motivos, gatos machos adultos parecem mais predispostos à infeção por FeLV, no entanto, alguns autores opõem-se a esta teoria (Grant et al., 1980; Levy et al., 2001; Lutz et al., 2009; Ettinger & Feldman, 2010; Bande et al., 2012; Hartmann, 2012a).
3. Patogénese
O resultado de uma infeção por FeLV está condicionado por vários fatores, como a idade do animal aquando da exposição ao vírus, a carga e o subtipo virais, e ainda possíveis doenças concomitantes (Lutz et al., 2009; Lairmore, 2011).
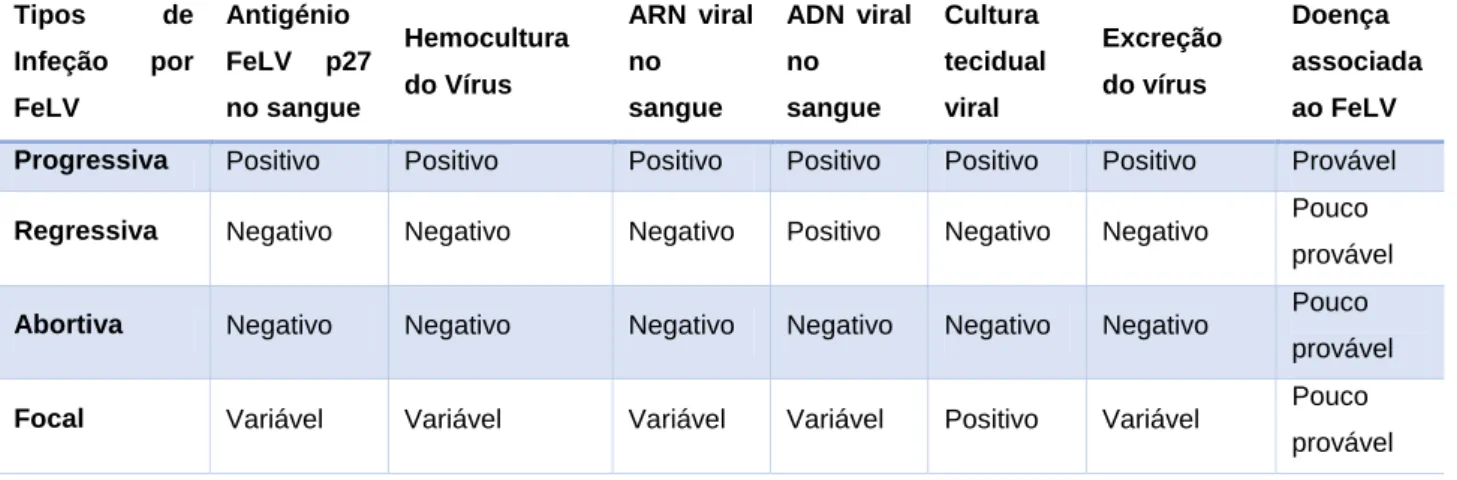
Recentemente, face aos estudos realizados, a infeção por FeLV foi diferenciada em quatro tipos: Infeção Abortiva (comparável aos antigos gatos regressivos), Infeção Regressiva (equivalente à antiga virémica transiente seguida de infeção latente), Infeção Progressiva (equiparável à anterior virémica persistente) e Infeção Focal. Antigamente, pensava-se que 1/3 dos gatos expostos se tornariam virémicos persistentes, enquanto 2/3 conseguiriam eliminar a infeção. Hoje, acredita-se que a maioria dos gatos expostos fiquem virémicos para
30
toda a vida, mas que possam, no entanto, regredir para um estado avirémico (infeção regressiva), na qual não sejam detetados antigénios ou vírus cultivável no sangue, mas onde se pode identificar ADN proviral FeLV no sangue, recorrendo a técnicas de PCR sensíveis (ver Tabela 2) (Hofmann-Lehmann et al., 2001; Torres et al., 2005; Hofmann-Lehmann et al., 2007; Pepin et al., 2007; Hofmann-Lehmann et al., 2008; Lutz et al., 2009; Hartmann, 2012a).
3.1 Infeção Abortada
Após a infeção inicial, que geralmente ocorre pela via oronasal, o vírus replica-se no tecido linfoide e na orofaringe. Em alguns gatos imunocompetentes, a replicação viral pode ser interrompida, ficando limitada ao tecido linfóide orofaríngeo, por uma resposta imunitária celular e humoral; estes gatos nunca serão virémicos. Esta exposição abortada tem acontecido após inoculações experimentais e caracteriza-se por resultados negativos em testes de antigénio, cultura do vírus, ARN viral e ADN proviral, sem que ocorra a disseminação sistémica. Em natureza, desconhece-se com que frequência acontece, uma vez que estudos mais recentes utilizando métodos de PCR afirmam que os gatos antigamente tidos como regressivos podem na realidade recuperar o vírus e sugerem que nenhum gato consiga eliminar o vírus por completo. Não obstante, a probabilidade de reexcreção de FeLV ou de desenvolvimento de doença associada ao vírus é extremamente baixa, uma vez que gatos nestas circunstâncias apresentam uma esperança média de vida semelhante à de gatos não infetados. Estes dados justificam o facto de numa população de gatos, a maioria apresentar evidência de exposição ao vírus pela presença de anticorpos após contacto com o FeLV, mas apenas uma pequena parte se torne virémica. Neste caso, a resposta imunitária estabelecida protege o animal de exposições subsequentes, provavelmente durante anos, ou até durante toda a sua vida (Torres et al., 2005; Lutz et al., 2009; Major et al., 2010; Hartmann, 2012a; Hartmann, 2012b).
3.2 Infeção Regressiva
Ocorre uma resposta imunitária eficaz, em que a replicação viral e a virémica são interrompidas antes ou logo após a infeção da medula óssea. Depois da infeção inicial, o FeLV em replicação dissemina-se sistemicamente nas células mononucleares (linfócitos e monócitos). Durante este primeiro episódio de viremia, o antigéno FeLV p-27 é detetável e os gatos são positivos nos testes deste tipo (ex.: ELISA), podendo excretá-lo. A viremia inicial caracteriza-se por desconforto, febre, ou linfadenomegalia, devido a hiperplasia linfocítica. O vírus difunde-se até aos tecidos-alvo, que incluem o timo, o baço, os linfondos, a as glândulas salivares. Neste caso, a viremia termina dentro de semanas a meses (durando geralmente 3 a 6 semanas). Durante este período, um gato infetado excreta o FeLV e é infecioso, deixando de o fazer assim que esta fase termina. O risco de desenvolver doenças relacionadas com o
31
FeLV é baixo, apesar de este estar integrado no seu genoma (e, por isso, ser detetado por PCR). Quando a viremia é mais prolongada, as células da medula óssea desenvolvem a infeção, impossibilitando a eliminação do vírus do organismo, mesmo que a viremia termine, uma vez que o ADN proviral está presente nas células estaminais da medula óssea. Classifica-se esta situação como infeção latente. Apesar de o ADN proviral se manter, o vírus não se replica ativamente e os resultados de testes de antigénio são negativos, pelo que um diagnóstico só pode ser feito por cultura in vitro de células da medula óssea ou por pesquisa de provírus através de PCR. Neste caso, a infeção viral produtiva poderá ser reativada (até um ano após infeção e sendo pouco provável dois após a mesma) espontaneamente ou como resposta a imunodepressão (incluindo durante a gestação), e os gatos podem tornar-se virémicos e exibir resultados positivos em testes de antigénio, novamente. Gatos infetados de forma regressiva e latente não excretam o FeLV, nem são infeciosos, e os sinais clínicos (salvo raras exceções de neoplasias ou mielossupressão) são inexistentes (Rojko et al., 1982; Pedersen et al., 1984; Dunham & Graham, 2008; Lutz et al., 2009; Hartmann, 2012a; Hartmann, 2012b).
3.3 Infeção Progressiva
Neste caso, a infeção por FeLV não é debelada no seu início. Desta forma, a infeção decorre ao longo de seis etapas, sendo que as primeiras três se desenvolvem entre os primeiros dois a doze dias após a exposição. O vírus penetra o organismo através da orofaringe, replicando-se nos tecidos linfoides locais (1ª etapa), seguido dos monócitos e linfócitos (2ª etapa), alcançando a medula óssea e outros órgãos linfoides, como o timo, o baço e os linfonodos distantes (3ª etapa) por via sanguínea, onde se replica de forma célere nas células em mitose (4ª etapa). Quatro a seis semanas depois, difunde-se pelo organismo através do plasma (5ª etapa), infetando células de tecidos epiteliais glandulares e mucosas, onde é posteriormente excretado nos fluídos corporais, dos quais se destaca a saliva (6ª etapa). Gatos com infeção progressiva desenvolverão doenças associadas ao FeLV, e a sua maioria sucumbirá dentro de poucos anos. Esta pode ser distinguida da regressiva pela repetição de testes de antigénio no sangue periférico; no caso da regressiva, gatos infetados tornam-se negativos no máximo ao fim de dezasseis semanas após a infeção, enquanto nesta permanecem positivos. Inicialmente, ambas exibem persistência de ADN proviral no sangue recorrendo a PCR, mas mais tarde estão associadas a diferentes cargas virais quando medidas por PCR quantitativo (Torres et al., 2005; Pepin et al., 2007; Lutz et al., 2009; Hartmann, 2012a; Rodrigues, 2012).
32
3.4 Infeção Focal
Também designada “Infeção Atípica” e apesar de ocorrer em 10% dos gatos infetados experimentalmente glândulas mamárias, bexiga, olhos), podendo levar à produção de antigénios p27 intermitente ou de baixo grau, pelo que gatos com este tipo de infeção apresentam resultados fracamente positivos ou discordantes em testes de antigénio, ou resultados positivos e negativos alternados. Gatas com esta infeção atípica das glândulas mamárias poderão transmitir o vírus às crias através do leite, na fase de resultados negativos em testes de antigénio (Hoover& Mullin, 1991; Levy et al., 2008; Hartmann, 2012a)., estima-se que estima-seja rara em natureza. Caracteriza-estima-se pela replicação viral local atípica (ex.,
Tabela 2: Tipos de infeção por Vírus da Leucemia Felina (FeLV), adaptado de Hartmann, 2012a
Tipos de Infeção por FeLV Antigénio FeLV p27 no sangue Hemocultura do Vírus ARN viral no sangue ADN viral no sangue Cultura tecidual viral Excreção do vírus Doença associada ao FeLV Progressiva Positivo Positivo Positivo Positivo Positivo Positivo Provável
Regressiva Negativo Negativo Negativo Positivo Negativo Negativo Pouco provável
Abortiva Negativo Negativo Negativo Negativo Negativo Negativo Pouco provável
Focal Variável Variável Variável Variável Positivo Variável Pouco provável
4. Sinais Clínicos
A idade do gato aquando da infeção é a principal determinante no resultado clínico: com o aumento da idade, os gatos vão ficando cada vez menos suscetíveis. Neonatos desenvolvem atrofia tímica marcada, levando a imunodepressão grave, exaustão e morte prematura. Fatores inerentes quer ao vírus quer ao hospedeiro, tais como o subtipo de vírus e a resposta imunitária mediada por células, influenciam a patogénese. Assim, a maioria dos gatos afetados tem aproximadamente entre dois e quatro anos e infeção progressiva, pelo que o prognóstico é mau (70% a 90% destes terão morrido dentro de dezoito meses a três anos) (Hardy et al,. 1976; Hoover et al., 1976; Lutz et al., 2009; Ettinger & Feldman, 2010; Hartmann, 2012a).
33
Apesar da sua designação, o FeLV é capaz de desencadear múltiplas patologias, sendo que a maioria dos gatos chega às clínicas veterinárias não pela existência de tumores, mas sim por anemia ou imunodepressão. Num estudo nos Estados Unidos da América, com 8642 gatos, os achados clínicos mais comuns foram várias coinfecções (incluindo peritonite infeciosa felina, FIV, infeção do trato respiratório superior, micoplasmose hemotrópica, e estomatite) (15%), seguidas de anemia (11%), linfoma (6%), leucopenia ou trombocitopenia (5%), e leucemia ou doença mieloproliferativa (4%) (Cotter, 1991).
O FeLV desempenha uma ação principal na tumurogénese por mutagénese insercional (a integração do provírus no genoma da célula do hospedeiro ativa um oncogene celular ou destrói um gene supressor de tumor), sendo que gatos infetados apresentam uma probabilidade 62% superior de desenvolvimento de linfoma (tipicamente das células T) ou leucemia do que gatos não infetados. Antigamente, até 80% dos linfomas e leucemias eram tidos como relacionados com o FeLV. No entanto, nas últimas décadas, tem-se assistido a uma diminuição da sua prevalência em gatos com linfoma, sobretudo devido à diminuição da prevalência de FeLV na generalidade da população felina, graças à vacinação e à prática de programas de teste e eliminação. No entanto, a ocorrência de linfomas provocados pelo FeLV poderá ser superior à indicada pelos testes de antigénio convencionais, uma vez que o ADN proviral foi detetado em linfomas de gatos que testaram negativo para o antigénio p27 (Cotter et al.,1975; Francis et al., 1977; Francis et al., 1979; Hardy et al., 1980; Shelton et al., 1990; Jackson et al., 1993; Mauldin et al., 1994; Poli et al., 1994; Callanan, 1996; Moore et al., 1996; Hartmann et al.1998; Harrus et al., 2002; Gamoh et al., 2003; Hartmann, 2012a).
Os linfomas são classificados segundo a sua localização anatómica, em mediastínicos (ou tímicos; mais característicos em animais jovens), alimentares (associados ao trato gastrointestinal; mais comuns em animais geriátricos), multicêntricos (linfonodos), ou extranodais (rins, Sistema Nervoso Central, pele), afetando tipicamente os linfócitos T e originando lesões de tamanho variável, firmes e homogéneas compostas por linfócitos neoplásicos, independentemente da sua localização. Por vezes, o linfoma está disseminado, com envolvimento orgânico múltiplo e invasão local. Quando o fígado, baço, medula óssea, sangue e/ou órgãos não linfoides estão afetados, o prognóstico é mau, enquanto formas sem infeção por FeLV detetável apresentam um melhor prognóstico. Fibrossarcomas múltiplos em gatos virémicos jovens têm sido ocasionalmente associados à infeção por vírus do sarcoma felino (FeSV), que resulta da integração de oncogenes celulares no genoma do FeLV-A. As leucemias classificam-se geralmente de acordo com a origem celular (ex. eritroide, granulocítica, mielocítica), podendo afetar várias linhagens celulares (no caso do envolvimento de células estaminais). Praticamente, todos os animais com leucemia
34
linfoblástica aguda são FeLV-positivos. (Donner et al., 1982; Reinacher & Thelen, 1987; Boretti et al., 2004; Louwerens et al., 2005; Dunham & Graham, 2008; Fujino et al., 2008; Ettinger & Feldmann, 2010; Kennedy & Little, 2012; Hartmann, 2012a).
As leucemias associadas ao FeLV podem afectar as várias linhas medulares, afectando elementos eritróides (eritroleucemia, reticuloendoteliose), mielóides (leucemias granulocíticas, monocíticas ou mielomonociticas) ou megacariócitos. Se houver envolvimento de células estaminais pode ainda afectar várias linhagens celulares (Carmichael et al., 2002; Levy et al., 2006b; Lutz et al., 2009). Outros tumores associados ao FeLV incluem osteocondromas múltiplos, que, apesar de benignos, podem causar morbidade significativa se localizados em zonas como as vértebras, exercendo pressão sobre a medula espinal ou raízes nervosas (Hartmann, 2012a).
As alterações hematológicas descritas incluem anemia (não regenerativa ou regenerativa), neutropenia persistente, transitória ou cíclica, anomalias plaquetárias (trombocitopenia e anomalias da função plaquetária), anemia aplástica (pancitopenia), e síndrome semelhante à da panleucopenia (Hartmann, 2012a).
A anemia é a principal condição não neoplásica associada ao FeLV, sendo a maioria não regenerativa (apenas 10% são regenerativas e geralmente consequência de infeções secundárias ou processos imunomediados, que provocam hemólise dos eritrócitos), resultante do efeito imunossupressor sobre a medula óssea devido à infeção primária das células estaminais hematopoiéticas e das células do estroma (Jackson et al, 1993; Gleich & Hartman, 2009; Stützer al, 2011).
A síndrome semelhante à da panleucopenia caracteriza-se por leucopenia grave (<3000 céls/µl), com enterite e destruição do epitélio das criptas intestinais, tal como na infeção pelo vírus da panleucopenia. Desconhece-se se esta se deve a coinfecção por FeLV e vírus da panleucopenia ou se o FeLV por si só a possa desencadear. Os sinais clínicos são geralmente gastrointestinais e incluem diarreia hemorrágica, vómito, ulceração oral ou gengivite, anorexia e perda de peso (Lutz et al., 1995; Kipar et al., 2000; Kipar et al., 2001).
A maior parte dos sinais neurológicos é provocada por linfoma ou infiltrações linfocíticas no cérebro ou medula espinal, causando compressão, apesar de, por vezes, não ser detetado qualquer tumor nem em exame post-mortem, o que sugere neurotoxicidade induzida pelo FeLV. Os sinais clínicos mais comuns de doença neurológica distinta de linfoma do Sistema Nervoso Central, são anisocoria, midríase, cegueira central, ou síndrome de Horner. Foram também observados vocalização anormal, hiperestesia, parese progredindo para parálise, e incontinência urinária (Carmichael et al., 2002; Hartmann, 2012a).