ANALOGIA NO
ANALOGIA NO
DE OXIDAÇÃO
REDUÇÃO
Lindinalva Nunes Sirqueira
Mestrado em Física e Química em Contexto EDepartamento de Química 2018
Orientador
Professor Doutor João Carlos de Matos Paiva, Professo
O ENSINO
O ENSINO
O –
Escolar
Todas as correções determinadas pelo júri, e só essas, foram efetuadas. O Presidente do Júri,
FACULDADE DE CIÊNCIAS DA UNIVERSIDADE DO PORTO
Departamento de química
ANALOGIA NO ENSINO DE OXIDAÇÃO - REDUÇÃO
LINDINALVA NUNES SIRQUEIRA
FACULDADE DE CIÊNCIAS DA UNIVERSIDADE DO PORTO
Departamento de Química
Lindinalva Nunes Sirqueira
ANALOGIA NO ENSINO DE OXIDAÇÃO – REDUÇÃO
Dissertação submetida para satisfação parcial dos requisitos do grau de mestre em Física e Química em Contexto Escolar.
ORIENTADOR: PROFESSOR JOÃO CARLOS DE MATOS PAIVA; MESTRADO EM FÍSICA E QUÍMICA EM CONTEXTO ESCOLAR
FACULDADE DE CIÊNCIAS DA UNIVERSIDADE DO PORTO Porto, Setembro de 2018
AGRADECIMENTOS
Gostaria de expressar os meus sinceros agradecimentos:
Agradeço a Deus, primeiramente, pela grande oportunidade de cursar este mestrado e pelas tantas coisas boas que me concedeu ao longo deste curso e na vida.
Ao Professor Doutor João Carlos de Matos Paiva, orientador desta tese, pelo encorajador acompanhamento, pela compreensão, pela sua disponibilidade, pela ajuda prestada na leitura e revisão do texto e nas sugestões apresentadas durante o curso.
Ao Professor Doutor Emerich Michel Sousa, pela ajuda imprescindível na fase inicial deste projeto.
A todos os professores deste mestrado, pelo esforço que desempenharam ao longo do curso.
E à minha família, principalmente minha irmã Lindinei Nunes Sirqueira, pela compreensão e por todo o apoio prestado durante a realização deste trabalho, o meu agradecimento em especial. Sem a sua ajuda, nada disso teria sido possível
LISTA DE ABREVIATURAS
C.A: conceção alternativa TWA: Teaching With Analogies
PCN: Parâmetros Curriculares Nacionais
DCNM: Diretrizes Curriculares Nacionais o Ensino Médio PCQ: Parâmetros Curriculares de Química
Resumo
Neste trabalho aborda-se a oxidação-redução no processo de ensino-aprendizagem de Química.
Apresenta-se uma revisão de literatura sobre o tema e são apresentadas algumas conceções alternativas geradas no processo de ensino-aprendizagem. De seguida, apontamos a importância do papel pedagógico das analogias como metodologia alternativa de ensino e também da possibilidade do surgimento de conceções alternativas, quando mal abordada em sala de aula.
Este trabalho apresenta uma nova proposta de ensino de oxidação-redução, através da analogia desenvolvida “baralho químico”. Utilizamos um jogo de baralho adaptado para o tema, constituído por um conjunto de cartas e regras, abordando a oxidação-redução.
O estudo foi desenvolvido com o apoio e sugestões de alguns professores do ensino público em Portugal, através de uma entrevista semiestruturada, individual orientada por um guião, após a apresentação das regras e do “baralho químico”.
Este trabalho qualitativo pretendeu lançar uma “nova analogia para o ensino de oxidação-redução” para os alunos do 11º ano em Portugal e do 2º ano no Brasil.
Os resultados das entrevistas como os professores, revelaram que feitas algumas adaptações nas regras e nas cartas, a analogia poderá ser aplicada em sala de aula como uma nova metodologia de ensino para oxidação-redução.
No final é feita uma análise autocrítica da analogia desenvolvida, apresentadas as adaptações nas regras e nas cartas para melhorar a compreensão das regras e facilitar a compreensão do jogo.
Palavra Chave: Analogia Oxidação-Redução, Química, Professores de Física - Química, Portugal
Abstract
In this work the oxidation-reduction in the teaching-learning process of Chemistry is approached.
A review of the literature on the subject is presented and some alternative concepts generated in the teaching-learning process are presented. Next, we point out the importance of the pedagogical role of analogies as an alternative methodology of teaching and also of the possibility of the emergence of alternative conceptions, when poorly addressed in the classroom.
This work presents a new proposal of teaching of oxidation-reduction, through the analogy developed "chemical deck". We use a deck game adapted to the theme, consisting of a set of cards and rules, addressing oxidation-reduction.
The study was developed with the support and suggestions of some teachers of public education in Portugal, through a semi-structured interview, individual guided by a script, after the presentation of the rules and the "chemical deck
This qualitative work intends to launch a "new analogy for the teaching of oxidation-reduction" for the students of the 11th year in Portugal and the 2nd year in Brazil.
The results of the interviews as the teachers revealed that some adjustments were made in the rules and in the letters, the analogy could be applied in the classroom as a new teaching methodology for oxidation-reduction.
In the end, a self-critical analysis of the developed analogy is made, adapting the rules and the cards to improve understanding of the rules and facilitate the understanding of the game.
Keyword: Oxidation-Reduction Analogy, Chemistry, Physics Teachers - Chemistry,
Índice
1. Introdução ... 14 1.1.Introdução ... 14 2. Revisão de literatura ... 17 2.1.Introdução ... 17 2.2.Oxidação – Redução ... 17 2.2.1. Oxidante e redutor ... 19 2.2.2. Número de Oxidação ... 202.2.3. Regras para atribuição do número de oxidação: ... 21
2.2.4. Tipos de Reações Redox. ... 22
2.3.Pilhas e baterias. ... 24
2.3.1. Pilhas galvânicas ou células eletroquímicas ... 24
2.3.2. Estrutura das Células Galvânicas ... 25
2.3.3. Potenciais padrão de eléctrodo ... 28
2.4.Corrosão e Deposição ... 30
2.5. Equação de redox ... 32
2.5.1. Equações redox ... 33
2.5.2. Balanceamento das equações redox ... 33
2.5.3. Balanceamento em meio ácido. ... 34
2.5.4. Balanceamento em meio básico. ... 36
2.6.Calculando a tensão da célula ... 38
2.7.Enquadramento curricular de redox ... 39
2.7.1. Curricula ... 39
2.7.2. Curricular no Brasil ... 39
Manual escolar brasileiro ... 42
2.7.3. Curricular em Portugal ... 43
2.8.Conceções alternativas em redox ... 50
Generalidades sobre conceções alternativas (C.A.) ... 50
2.9.Analogias no Ensino de química ... 62
2.9.1. Analogias em Ciências: modelo científico e analogias no ensino ... 62
2.9.2. Sobre o conceito e objetivos da Analogia ... 64
2.9.3. Modelo centrado no professor... 67
2.9.5. Analogias em química ... 69
2.9.6. Analogias em redox ... 90
2.9.7. Analogias desenvolvidas no contexto desta investigação. ... 94
2.9.8. Regras do jogo e analogia desenvolvida para explicar a formação de pares químicos em contexto de oxidação-redução. ... 95
2.9.9. Analogia para explicar as condições das equações na formação de pares químicos em contexto de oxidação-redução... 98
V.I O aluno terá que tentar “desfazer” os pares de acordo com os valores de potencial de oxidação de cada metal, fornecido nas cartas. ... 102
2.9.10. Usando o modelo TWA, para explicar a analogia desenvolvida ... 102
2.9.11. Analogia redox I: baralho químico ... 104
2.10. Possíveis conceções alternativas geradas pela analogia apresentada “baralho químico” ... 112
2.10.1. Conceções que poderão ser desenvolvida pelos alunos durante o uso da analogia e que devem ser discutida pelo professor: ... 113
3. Aplicação e avaliação de algumas alternativas didáticas no terreno escolar ... 115
3.1.Caracterização da amostra ...115
3.2.– Descrição dos procedimentos ...115
3.3.Guião de entrevistas ...117
3.4.Resultados ...118
3.4.1 - Tratamento dos resultados ... 118
3.4.2 - Avaliação da analogia baralho químico para explicar os pares redox ... 120
3.4.3 - Avaliação da analogia baralho químico para explicar as condições das equações redox espontâneas ... 121
4. Notas finais ... 122
4.1.Algumas conclusões ...122
4.2.- Auto – Crítica e reformulações ...123
4.3.Projetos Futuros ...127
5. REFERÊNCIAS BIBLIOGRÁFICAS ... 128
6. ANEXOS ... 134
6.1.anexo i - BARALHO QUÍMICO ...134
6.2.anexo ii - GUIÃO DE ENTREVISTA ...137
Índice de figuras
Figura 1 - Célula galvânica zinco-cobre. (Russel. J. B. 2000, p.267)... 26
Figura 2 - Eléctrodo de hidrogénio. (Russel. J. B. 2000, p. 274) ... 28
Figura 3- Formação da ferrugem. (Atkins, 2006, p. 365) ... 29
Figura 4 - Célula galvânica zinco-prata. (Caramel e Pacca. 2011). ... 61
Figura 5 - Analogia entre chave e fechadura. (Júnior. 2007, p.552)... 69
Figura 6 - Analogia entre sapo/escada e o modelo atómico de Bohr. (Silva, Lima e Lima, 2010). ... 71
Figura 7 - Analogia entre as pás das hélices e orbital molecular. (Silva, Lima e Lima, 2010). ... 73
Figura 8 - Analogia entre a bola e a estrutura do C60. (Silva, Lima e Silva, 2010). ... 73
Figura 9 - Analogia entre as bolinhas e os estados físicos da matéria. (Silva, Lima e Silva, 2010). ... 75
Figura 10 - Analogia utilizada para explicar as ligações de hidrogénio numa proteína. (Silva, Lima e Silva. 2010). ... 77
Figura 11 - Analogia utilizada para explicar o compartilhamento de eletrão numa ligação covalente. (Silva, Lima e Silva. 2010). ... 78
Figura 12 - Representação da disputa de elétrons por dois átomos. (Silva, Lima e Silva. 2010). ... 78
Figura 13 - Analogia utilizada para explicar o potencial de ionização (Silva, Lima e Silva. 2010). ... 79
Figura 14 - Analogia para explicar o mecanismo da ação enzimática (enzima/substrato). (Monteiro e Justi. 2000, p.205). ... 82
Figura 15 - Analogia para explicar a Lei de Hess através da escalada de uma montanha por dois caminhos diferentes. (Monteiro e Justi. 2000, p.138). ... 83
Figura 16 – Analogia para explicar o modelo atómico de Thonsom usando o pudim de passas.(Monteiro e Justi, 2000, p. 69). ... 84
Figura 17 - Analogia para explicar a velocidade das reações não elementares através do fluxo de água numa instalação hidráulica. (Monteiro & Justi, 2000, p.69). ... 85
Figura 18 - Analogia para explicar o funcionamento de uma pilha. (Salgado, 2015.) ... 90
Figura 19 - Analogia para abordar os pares redox através dos bonecos. (Salgado, 2015)... 93
Figura 20 - Analogia para explicar o comportamento de bola/comportamento do elétron (Valdinei, 2005) ... 109
Índice de tabelas
Tabela 1- Potenciais de redução padrão a 25ºC. (Russel, J. B. 2000, p.299) ... 23
Tabela 2 - Erros e conceções dos alunos. (Gondim e Mendes, 2006.) ... 56
Tabela 3 - TWA para explicar ação enzima/substrato a partir da chave/fechadura. ... 70
Tabela 4 - TWA para explicar analogia modelo atómico de Bohr/sapo subindo uma escada. ... 72
Tabela 5- TWA analogia para explicar orbital molecular/par de hélice. ... 73
Tabela 6- TWA para explicar a estrutura do C60/estrutura da bola ... 74
Tabela 7- TWA para explicar o princípio da exclusão de Pauli/endereço de uma pessoa. ... 75
Tabela 8- TWA para explicar mudança de estado físico da matéria/"bolinhas" representando a estrutura da água. ... 76
Tabela 9- TWA para explicar ligações de hidrogénio/pontos tracejados. ... 77
Tabela 10- TWA para explicar ligações covalentes/corda simbolizando o compartilhamento de eletrões. ... 79
Tabela 11- TWA para explicar potencial de ionização/força aplicada pela pessoa... 80
Tabela 12- Apresentação analógica segundo os passos do modelo TWA. Rosa, Pimentel e Terrazan, 81 Tabela 13- TWA para ação enzimática num substrato com ação chave na fechadura. ... 83
Tabela 14- TWA para lei de Hess/escalada numa montanha ... 84
Tabela 15- TWA para explicar conceito do modelo atómico de Thonsom/pudim de passas. ... 85
Tabela 16- TWA para explicar velocidade de reações não-elementares/fluxo de água numa hidráulica. ... 86
Tabela 17- TWA para explicar o estado fundamental/energia cinética e energia potencial. ... 87
Tabela 18- TWA para explicar o movimento gasoso/movimento da bola de bilhar. ... 88
Tabela 19 - TWA para explicar velocidade de reações não-elementares/velocidade da fila de um restaurante. ... 89
Tabela 20- TWA para explicar analogia desenvolvida funcionamento da pilha de Daniel. ... 92
Tabela 21- TWA simplificada para explicar o funcionamento da analogia. ... 93
Tabela 22- Simulação das cartas dos alunos numa ronda do jogo. ... 95
Tabela 23- Simulação dos possíveis "pares” formados. ... 95
Tabela 24- Orientação do jogo. ... 97
Tabela 25- Testando o aprendizado/reatividade dos metais. ... 101
Tabela 26- TWA simplificada ... 107
Tabela 27- TWA simplificada/similaridade ... 107
CAPÍTULO I
14
1.
Introdução
1.1.
Introdução
Com o processo da globalização a sociedade está cada vez mais conectada com tudo o que acontece no mundo. Esta conexão influência o comportamento das pessoas, provocando contante transformações.
A responsabilidade pela mudança é de todos, mas a escola também é um dos grandes agentes responsáveis pelas mudanças que estão a ocorrer, necessitando modernizar-se para acompanhar a evolução do processo de ensino-aprendizagem. Então é necessário um ensino que não se limite apenas em transmitir um conjunto de conceitos, teorias e leis, mas que estimule a construção do conhecimento científico, que professor e aluno assuma o papel de agente transformador da sociedade e que ambos consigam desenvolver uma Ciência que atenda as necessidades da sociedade. Neste trabalho, pretende-se avaliar uma nova metodologia de ensino em química sobre oxidação-redução, através da analogia desenvolvida, com o intuito de promover um ensino mais eficaz e estimular a aprendizagem em sala de aula. Destacamos a colaboração dos professores entrevistados com o intuito de aperfeiçoar e otimizar o trabalho para facilitar a aplicação em sala de aula.
A oxidação-redução é um assunto importante dentre da química, desde a presença e a importância dos metais como matéria prima na construção civil, na construção de pontes, nos transportes aéreos, terrestres e fluviais. No comércio, como na produção de: portas, janelas, computadores, telemóveis, etc. A importância, a dificuldade e a complexidade desse tema e a pouca disponibilidade de novos materiais didáticos que apoie e facilite o professor no processo de ensino-aprendizagem desse assunto, por si só, já é motivo de escolha deste tema.
Este trabalho inicia-se com uma abordagem científico-pedagógico de oxidação-redução (2.), apresentando os conceitos do tema (2.1).
15 De seguida, procede-se ao enquadramento do ensino de oxidação-redução (2.7), enfatizando a ligação do tema no ensino médio no Brasil e no ensino secundário em Portugal, apresentando as diretrizes curriculares do 2º ano do ensino médio no Brasil e os conteúdos programáticos e/ou objetivos gerais da disciplina de Físico-Química do 7º ano, 11º ano e 12º ano de escolaridade em Portugal.
Ao explicar esse tema o professor deverá ter o cuidado de levar em consideração o que os alunos já sabem, e as dificuldades dos alunos para evitar que se forme conceções alternativas sobre oxidação-redução (2.8). De seguida, apresentamos a importância das analogias para o ensino de Ciência e alguns exemplos no ensino de química (2.9), valorizando-se a utilização das analogias e aplicação e avaliação de algumas alternativas didáticas no terreno escolar.
No terceiro capítulo abordam-se aplicação e avaliação de algumas alternativas didáticas no terreno escolar (3.), inicialmente, procede-se a uma caracterização da amostra de professores (3.1), de seguida, apresentamos analogia desenvolvida, explicamos as regras do jogo e os professores simulam o jogo entre eles (3.2), a participação dos professores, na avaliação da analogia, é realizada por meio de uma entrevista semiestruturada, orientada por um guião (3.3), procede-se a transcrição da entrevista (3.4).
De seguida, é feita uma análise dos resultados (4.0), destas entrevistas são retiradas algumas conclusões: analogia apresenta potencial para ser desenvolvida em sala de aula, desde que realizadas algumas adaptações (4.1), algumas reformulações nas regras e modificações nas cartas, sugeridas pelos professores para ajudar na aplicação da analogia em sala de aula são relatadas (4.2), logo após, são feitas algumas observações para desenvolver no futuro.
Para complementar e/ou fundamentar a exposição ao longo dos capítulos são apresentados alguns anexos (6.). No anexo (6.1), apresenta-se a analogia desenvolvida: baralho químico. No anexo (6.2), apresenta-se o guião de entrevista que orientou o trabalho desenvolvido e no anexo (6.3), o baralho químico reformulado.
CAPÍTULO II
17
2.
Revisão de literatura
2.1.
Introdução
Neste capítulo procede-se a uma contextualização científico-pedagógico de oxidação-redução. Descrevem-se alguns conceitos fundamentais de oxidação-redução, conceitos associados ao tema e algumas aplicações de redox no nosso dia-a-dia. Posteriormente, procede-se ao enquadramento curricular do ensino de redox no Brasil e em Portugal e nos manuais escolares dos respetivos países. De seguida, apresentamos as referências de literatura, tentando abordar a sequência como vem sendo apresentado o conteúdo nos livros. Apresentamos algumas estratégias usando analogia para trabalhar o tema de uma maneira mais eficaz e divertida.
2.2.
Oxidação – Redução
A
s reações de oxidação-redução (adequadamente redox) constituem uma importante categoria das transformações químicas, são reações que envolvem a “tendência” de transferência de eletrões em uma reação química, esta tendência depende das espécies envolvidas e da sua concentração. Pertencem a esta categoria certas reações do domínio biológico e outras de interesse industrial como: a fotossíntese, as células a combustíveis, purificação de metais e a oxidação da glucose (fornece-se energia para a síntese de proteínas, para transporte de fluídos e para atividade muscular). A combustão é também uma reação redox: existe combustível (fornece energia para a queima, madeira, papel, alguns metais, etc) e comburente, substância que reage quimicamente com o combustível (geralmente oxigénio). Além do combustível e comburente, é necessário ter um terceiro elemento: a temperatura de ignição. Muitos metais são extraídos dos respetivos minérios através das reações redox. Sendo reações em que ocorre transferência de eletrões, utilizam-se algumas delas para produzir corrente elétrica (pilhas).Oxidação é um processo em que uma espécie química doa eletrões para outra espécie, recebendo eletrões. Para mostrar a remoção de eletrões de uma espécie que está
18 sendo oxidada em uma reação redox, escrevemos a equação química de uma semi-reação de oxidação. Por exemplo:
Mg(s) Mg+2(aq) + 2e- Eq.1
Uma semi-reação de oxidação é uma maneira conceitual de representar uma oxidação: os eletrões nunca estão realmente livres. Na equação de uma semi-reação de oxidação, os eletrões perdidos sempre aparecem do lado direito da seta. O seu estado não é dado porque eles estão em trânsito e não têm um estado físico definido. As espécies reduzidas e oxidadas, juntas, formam um par redox. No exemplo o par redox é Mg+2 e Mg e é representado por Mg+2/Mg. Um par redox tem sempre a forma Ox/Red, em que Ox é a forma oxidada da espécie e Red é a forma reduzida.
Também podemos escrever semi-reações para a redução (ganho de eletrões). Por exemplo, para mostrar o ganho de eletrões na redução de iões Fe+3 a iões Fe+2, escrevemos
Fe+3 (aq) + e- Fe+2(aq) Eq.2
Esta semi-reação também é concetual: os eletrões nunca estão realmente livres. Na equação de uma semi-reação de redução, os eletrões ganho sempre aparecem à esquerda da seta. Neste exemplo, o par redox é Fe+3/Fe+2. As semi-reações expressam as duas contribuições (oxidação e redução) de uma reação redox completa.
Todas as transferências de eletrões de uma substância para outra podem envolver reações redox (oxidação-redução). É o caso da maior parte dos metais e não metais que são obtidos dos seus minerais por processos redox.
Considere-se a formação do óxido de cálcio (CaO) a partir do cálcio do oxigénio.
2Ca (s) + O2 (g) 2CaO(s) Eq.3
O óxido de cálcio (CaO) é um composto iónico formado pelos iões Ca2+ e O2-. Nesta reação, dois átomos de Ca dão ou transferem quatro eletrões a dois de O (em O2). Por
simplicidade, este processo pode ser separado em duas etapas, uma envolvendo a perda dos quatros eletrões os átomos de Ca e a outra envolvendo o ganho de quatro eletrões pela molécula de O2:
19 2Ca 2Ca2+ + 4e- Eq.4 O2 + 4e- 2O2- Eq.5
Cada uma destas etapas é denominada semi-reação e apresenta a forma explícita os eletrões envolvidos. A somatória das semi-reações dá a reação global:
2Ca + O2 + 4e- 2Ca2+ + 2O2- + 4e- Eq.6
Ou, se eliminarmos os eletrões que aparecem em ambos os lados da equação,
2Ca + O2 2Ca2+ + 2O2- Eq.7
Finalmente, os iões Ca2+ e O2- combinam-se para formar o CaO:
2Ca2+ + 2O2- 2CaO(s) Eq.8
É costume não colocar as cargas na fórmula de um composto iónico, e assim o óxido de cálcio é normalmente representado por CaO em vez de Ca2+O2-. A semi-reação que envolve perda de eletrões é denominada reação de oxidação. A semi-reação que envolve ganho de eletrões é denominada de reação de redução. Neste exemplo, o cálcio é oxidado e diz-se que atua como uma agente redutor visto doar dois eletrões ao oxigénio, causando a sua redução. O oxigénio é reduzido e atua como um agente oxidante porque ganha eletrões do cálcio, causando a sua oxidação. Notem que o número de eletrões perdidos por um agente redutor deve ser igual ao número de eletrões ganhos por um agente oxidante.
2.2.1.
Oxidante e redutor
A espécie que provoca oxidação numa reação redox é chamada agente oxidante (ou simplesmente “oxidante”). Ao agir, o oxidante aceita os eletrões liberados pelas espécies que se oxidam. Por outras palavras, o oxidante contém um elemento no qual o número de oxidação diminui.
Oxidante em uma reação redox é a espécie que é reduzida. Por exemplo, o oxigénio aceita eletrões do cálcio (eq.7). Como o oxigénio aceita esses eletrões, seu número de oxidação diminui de 0 a 2 (uma redução). O oxigénio é, portanto o agente oxidante nessa reação. Os oxidantes podem ser elementos, iões ou compostos.
20 A espécie que produz redução é chamado agente redutor (poder redutor). Como o redutor, fornece os eletrões para a espécie que está sendo reduzida, o redutor perde eletrões. Isto é, o redutor contém um elemento no qual o número de oxidação aumenta. Em outras palavras, o agente redutor numa reação redox é a espécie que é oxidada.
Para identificar o redutor e o oxidante em uma reação redox, é necessário comparar os números de oxidação dos elementos antes e depois da reação, para ver o que mudou. O reagente que contém um elemento que é reduzido na reação é o agente oxidante, e o reagente que contém um elemento que é oxidado é o agente redutor. Por exemplo, quando um pedaço de zinco é colocado em uma solução de cobre (II), a reação é: Zn (s) + Cu+2 (aq) Zn+2(aq) + Cu(s) Eq.9 O número de oxidação do zinco aumenta de 0 a +2 (oxidação) e o do cobre diminui de +2 a 0 (redução). Portanto, como o zinco se oxida, o metal zinco é o redutor nesta reação, e, como o cobre se reduz, o ião cobre (II) é o oxidante.
2.2.2.
Número de Oxidação
A definição de oxidação e redução em termos da perda e ganho de eletrões aplica-se à formação de compostos iónicos tais como o CaO. No entanto, estas definições não caracterizam corretamente por exemplo a formação de ácido clorídrico (HCl) e de decaóxido de tetrafósforo (P4O10):
H2(g) + Cl2(g) 2HCl(g) Eq.10
P4(S) + 5 O2(g) P4O10(s) Eq.11
O HCl e o P4O10(s) não são compostos iónicos, mas sim moleculares. Assim, não ocorre
transferência de eletrões na formação destes compostos, como acontece com o CaO. Apesar disso, os químicos acham conveniente tratar estas reações como reações redox porque existem indicações de que há uma transferência parcial de eletrões (do H para o Cl em HCl e do P para o O em P4O10).
21 Para acompanhar o percurso dos eletrões nas reações redox, é conveniente atribuir números de oxidação aos reagentes e aos produtos. O número de oxidação (também denominado estado de oxidação ou nox) refere-se ao número de cargas que um átomo teria numa molécula (ou num composto iônico) se houvesse transferência completa de eletrões. Por exemplo, podemos reescrever as equações anteriores para a formação do HCl e do P4O10(s) da seguinte maneira:
H02(g) + Cl02(g) 2H1+Cl1- Eq.12
P0(s) + 50O2(g) P5+4O2-10(g Eq.13
Os números por cima dos símbolos dos elementos são os números de oxidação. Em ambas as reações não existem cargas sobre os átomos das moléculas dos reagentes. Portanto, os seus números de oxidação são zero. No entanto, para os produtos, considera-se que houve uma transferência completa de eletrões e que os átomos ganharam ou perderam eletrões. Os números de oxidação refletem o número de eletrões “transferidos”.
Estas considerações permitem-nos identificar, rapidamente, os elementos que são oxidados (aumento do número de oxidação) e reduzidos (diminuição do número de oxidação). Os elementos que apresentam um aumento no número de oxidação, o hidrogénio e o fósforo nos exemplos anteriores, são oxidados nas reações. O cloro e o oxigénio são reduzidos, pelos que seus números de oxidação mostram uma diminuição em relação aos seus valores iniciais. Notem que o somatório dos números de oxidação do H e Cl em HCl (1+ e 1-) é zero. Da mesma forma, se adicionarmos as cargas de todos os quatros átomos de P [4x(5+)] e dos dez átomos de O [10x(2-)], o total é zero. Isto acontece porque as moléculas de HCl e de P4O10 são neutras, pela, soma das cargas
tem de ser nula.
2.2.3.
Regras para atribuição do número de oxidação:
I - No estado fundamental (substância simples), o número de oxidação é zero. Exemplo Na(s) = 0
22 II - Para os iões monoatómicos o número de oxidação é a própria carga. Exemplo Na(s)1+ 1+
III A família dos alcalinos (1 A), alcalinos terrosos (2A) e a prata, zinco e alumínio tem número de oxidação fixo. 1 A =1+; 2 A=2+; Al = 3+; Zn = 2+ e Ag = 1+. Quando formam compostos.
IV - Número de oxidação do hidrogénio é 1+ (HCl), exceto quando formar compostos binários com os metais onde terá número de oxidação 1-. Exemplo NaH.
V - Os calcogénios geralmente apresentam número de oxidação 2-. Exceto, em alguns casos quando formar um composto binário com os metais de nox fixo, podendo vir a ter nox 1-. (formar um peróxido (H2O2) ou superóxido (X2O4). Nas outras situações os
calcogénios e oxigénio terá carga 2-.
VI - Numa molécula neutra, o somatório dos números de oxidação de todos os átomos tem de ser zero. Nos iões poliatómicos o somatório tem que ser igual a carga do ião. Exemplo: NH4+ o número de oxidação do N é 3- e o H 1+, assim, o somatório do número
de oxidação é [-3 + 4 (+1)] = +1.
2.2.4.
Tipos de Reações Redox.
A
s reações redox podem ser comparadas com as reações de ácido-base (envolvem sempre um ácido e uma base). Para identificar uma reação redox o único caminho seguro é o de comparar o número de oxidação das espécies envolvidas. Se houver variação no número de oxidação, a reação é de natureza redox.a. Reações de combinação, síntese ou síntese: se dois reagentes A ou B forem uma substância simples, trata-se então de uma reação redox. Assim, todas as reações de combustão, que envolvem oxigénio elementar, bem como muitas reações envolvendo outros elementos são reações redox:
S(g) + O2(g) SO2(g) Eq.14
b. Reações de decomposição ou análise: quebra de um composto em dois ou mais componentes. Por exemplo:
23 2NaH(s) 2Na(s) + H2g) Eq.15
c. Reações de deslocamento, ou simples troca ou substituição: um ião ou átomo de um composto é substituído por um ião ou átomo de outro elemento. A maior parte das reações de deslocamento incluem-se numa das três subcategorias: deslocamento de hidrogénio, deslocamento de metal ou deslocamento de halogénio. Porém para a reação ocorrer existe uma série eletroquímica (ver tabela 1) que permite saber quais são os metais mais reativos, que tem mais “força” para deslocar um outro metal.
Tabela 1- Potenciais de redução padrão a 25ºC. (Russel, J. B. 2000, p.299)
Exempl: 2Zn(s) + Cu(SO4)2(aq) 2 ZnSO4(aq) + Cu(S) Eq.16
24
Ca
(s)+ NaBr
(aq)CaBr
2(aq)+ Na
(s) Eq.17d. Casos especiais de redox (auto-oxidação ou dismutação)
São um tipo especial de reação redox. Um elemento num dado estado de oxidação é simultaneamente oxidado e reduzido. Um reagente numa reação de auto-oxidação contém sempre um elemento que pode ter pelo menos três estados de oxidação. O reagente está num estado de oxidação intermédio; isto é, para este elemento existe um estado de oxidação mais elevado e outro mais baixo. A decomposição do peróxido de hidrogénio é um exemplo.
2H2 O2(aq) 2H2O(l) + O2(g) Eq.18
Neste caso, o número de oxidação do oxigénio no reagente é 1- aumenta para zero em O2 e diminui para 2- em H2O(g).
2.3.
Pilhas e baterias.
S
ão células eletroquímicas que utilizam reações espontâneas de óxido-redução para produzir a interconversão de energia química e elétrica. A pilha é um sistema formando por dois eléctrodos, mas constitui apenas uma unidade (uma única célula). Já a bateria é formada por um conjunto de pilhas ligadas em série ou paralelo.2.3.1.
Pilhas galvânicas ou células eletroquímicas
As células galvânicas: estão associadas ao funcionamento de um computador portátil, uma calculadora, relógio de pulso, celulares, indústria automobilística e até mesmo as células de combustíveis. Conseguimos imaginar a magnitude das células eletroquímicas.
Em geral, uma célula eletroquímica é um dispositivo em que uma corrente elétrica o fluxo de eletrões através de um circuito é produzida por uma reação química espontânea ou é usada para forçar a ocorrência de uma reação não-espontânea. Uma célula galvânica é uma célula eletroquímica em que uma reação química espontânea é
25 usada para gerar uma corrente elétrica (realizar trabalho elétrico). O dispositivo experimental usado para produzir eletricidade a partir de uma reação redox é designado por pilha eletroquímica, também chamada de pilha voltaica, na qual se produz eletricidade a partir de uma reação redox espontânea. Tecnicamente, uma “bateria” é uma coleção de células galvânicas unidas em série para que a voltagem produzida sua capacidade de forçar uma corrente elétrica através de um circuito seja a soma das voltagens de cada célula.
2.3.2.
Estrutura das Células Galvânicas
Como pode uma reação espontânea ser usada para gerar uma corrente elétrica? Podemos começar a responder esta questão examinando a reação redox entre o metal zinco e iões cobre (II).
Zn (s) + Cu2+ (aq) Zn2+(aq) + Cu (s) Eq.19
Se colocássemos um pedaço do metal zinco numa solução de sulfato de cobre (II) em água, veríamos uma camada do metal cobre começar a se depositar sobre a superfície do zinco. Se pudéssemos acompanhar a reação no nível atómico, veríamos que, à medida que a reação ocorre, eletrões são transferidos dos átomos de Zn para os iões Cu+2 que estão próximos na solução. Esses eletrões reduzem os iões Cu+2 a átomos Cu. Os eletrões se transferem e a energia livre do sistema diminui à medida que a reação se aproxima do equilíbrio. Entretanto, embora energia seja liberada como calor, nenhum trabalho elétrico é feito. Suponha-se, porém, que separamos os reagentes mas arranjamos um caminho que permite que os eletrões passem do metal zinco para iões cobre (II). Os eletrões podem, agora, executar trabalho, por exemplo, acionar um motor elétrico, ao passar da espécie que oxida para a espécie que se reduz. Isso é o que acontece quando a reação ocorre em uma célula galvânica. Uma célula galvânica consiste em dois eléctrodos, ou condutores iónicos, dentro da célula. Em um condutor iônico uma corrente elétrica é carregada pelo movimento dos iões. O eletrólito é tipicamente uma solução de um composto iônico em água. A oxidação ocorre em um eléctrodo, onde a espécie que está sendo oxidada cede eletrões para o condutor metálico. A redução acontece no outro eléctrodo, onde a espécie que está sendo reduzida capta eletrões do condutor metálico. Podemos imaginar a reação química
26 total como eletrões sendo empurrados para um eléctrodo e sendo puxados do outro eléctrodo. Esse processo de empurra-puxa provoca um fluxo de eletrões no circuito externo que une os dois eléctrodos e essa corrente pode ser usada para realizar trabalho elétrico.
O eléctrodo em que a oxidação ocorre é chamado de ânodo. O eléctrodo em que ocorre a redução é chamado de cátodo. Os eletrões são liberados pela semi-reação de oxidação no ânodo, passam pelo circuito externo e reentram na célula no cátodo, no qual são usados na semi-reação de redução. Uma célula galvânica comercial tem o cátodo marcado com o sinal positivo (+) e o ânodo com sinal negativo (-).
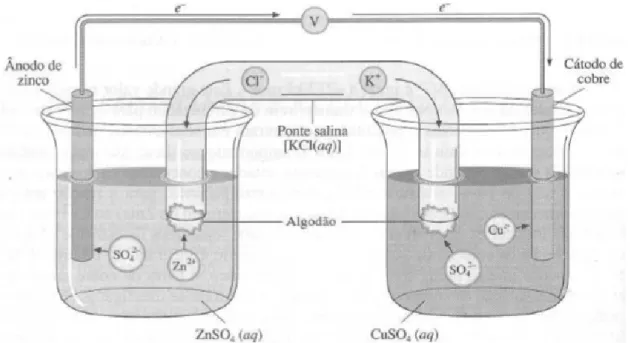
A célula de Daniel é um exemplo antigo de célula galvânica que usa a oxidação do cobre pelos iões zinco. Ela foi inventada pelo químico britânico John Daniell, em 1836, quando o avanço da telegrafia criou a necessidade urgente de uma fonte de corrente elétrica confiável e estável. Para que os eletrões passem dos átomos Zn para os iões Cu2+ e permitam que a reação espontânea ocorra, eles tem de passar pelo circuito externo. Os iões Cu2+ convertem-se em átomos Cu no cátodo através da semi-reação de redução (fig. 1).
Figura 1 - Célula galvânica zinco-cobre. (Russel. J. B. 2000, p.267)
27 Ânodo Zn (s) Zn2+(aq) + 2e- Eq.21
Célula: Cu2+(aq) + Zn(s) Cu(s) + Zn2+(aq) Eq.22
As células galvânicas são representadas mediante uma notação simplificada chamada
diagrama de célula.
Zn(s) | Zn2+(aq) || Cu2+(aq) | Cu(s)
Cada símbolo e fórmula representa a fase em que a substância ou espécie se encontra e as linhas verticais representam interfases e a ponte salina. A convenção geralmente seguida apresenta o ânodo na esquerda do diagrama. Isto significa que os eletrões deixam a célula para entrar no circuito externo, partindo do eléctrodo que está escrito à esquerda. As duas barras representam as pontes salinas, seguida do ânodo à direita onde os eletrões chegam e provocam a redução.
O facto dos eletrões se moverem de um eléctrodo para o outro indica a existência de uma diferença de potencial entre dois eléctrodos. Esta diferença de potencial entre eléctrodos, chamada força eletromotriz, ou f.e.m ( Ɛ), pode ser medida ligando um voltímetro a ambos os eléctrodos. A f.e.m. de uma pilha galvânica é normalmente expressa em volt; é também por vezes designada por tensão de pilha ou potencial de pilha.
A ponte salina tem três funções básicas: separar fisicamente os compartimentos eletródicos, permitir a continuidade elétrica (caminho continuo para a migração dos aniões e dos catiões) na célula e reduzir o potencial de junção líquida, uma diferença de potencial produzida quando duas soluções diferentes são postas em contacto entre si. Esta diferença se origina pelo facto do anião e do catião migrarem através da região de contacto ou junção líquida, com velocidades diferentes. Se o anião ou catião migrassem com velocidades praticamente iguais, o potencial de junção líquida seria minimizado, e isto simplificaria o potencial de junção líquida de uma pilha.
28
2.3.3.
Potenciais padrão de eléctrodo
Quando ambas as concentrações dos iões Cu2+ e Zn2+ são 1.O M, verifica-se que a f.e.m. da pilha representada na figura 1 é 1,10 V a 25oC. Como podemos relacionar esta tensão com a reação redox? Tal como a reação global da pilha pode ser considerada como a soma de duas reações de meia-pilha, também a f.e.m. obtida pode ser considerada como a soma destes potenciais elétricos nos eléctrodos de Zn e Cu. Conhecendo um destes potenciais de eléctrodo, poderíamos obter o outro por subtração ( de 1,10 V). Não é possível medir o potencial de um único eléctrodo, mas se fixarmos arbitrariamente em zero o valor do potencial de um eléctrodo em particular, poderemos usá-lo para determinar os potenciais relativos de outross eléctrodos. O eléctrodo de hidrogénio, representado na figura 3, serve como padrão para este fim. Borbulha-se hidrogénio gasoso numa solução de ácido clorídrico a 25oC. o eléctrodo de platina tem duas funções. Em primeiro lugar, proporciona uma superfície na qual poderá ocorrer a dissociação das moléculas de hidrogénio:
H2(g) 2H+(aq) + 2e- Eq.22
Em segundo lugar, funciona como condutor elétrico para o circuito exterior. Em condições padrão (isto é, quando a pressão de H2 é 1 bar e a concentração da soluação
de HCl é 1 M) o potencial da seguinte reação de redução a 25oC é definido como sendo exatamente zero.
2H+(aq, 1M) + 2e- H2(g, 1atm) Ɛ = 0 V Eq.23
29 Quando todos os solutos são 1 M e todos os gases estão a 1 bar, a tensão associada a uma reação de redução a ocorrer num eléctrodo é designada por potencial de redução padrão. Portanto, o potencial de redução padrão do eléctrodo de hidrogénio é definido como sendo zero. O próprio eléctrodo é designado por eléctrodo padrão de hidrogénio (EPH).
Podemos usar o EPH para medir os potenciais de outros tipos de eléctrodos. A figura 3 mostra uma pilha galvânica com um eléctrodo de zinco de EPH. A experiência mostra que o eléctrodo de zinco é o ânodo e o EPH o cátodo. Concluímos isso pelo facto da massa do eléctrodo de zinco diminuir ao longo do funcionamento da pilha, facto esse que é consistente com a perda de zinco para a solução através da reação de oxidação: Zn(s) Zn2+(aq) + 2e- Eq.24
O diagrama de pilha é
Zn(s)|Zn2+(aq, 1M)|KCl(sat)|H+(aq, 1M)|H2(g, 1bar)|Pt(s)
Quando todos os reagentes estão nos seus estados padrão (isto é, H2 a 1bar, iões H+ e
Zn2+ a 1M), a f.e.m. da pilha é 0,76 V. Podemos escrever as reações de meia-pilha da seguinte forma:
Ânodo: Zn(s) Zn2+(aq, 1M) + 2e- Ɛ oZn/Zn2+
Cátodo: 2H+(aq, 1M) +2e- H2(g, 1bar) Ɛ oH+/H2
Global: Zn (s) + 2H+(aq, 1 M) Zn2+ (aq, 1M) + H2(g, 1bar) Ɛopilha Eq.25
Em que Ɛ oZn/Zn2+ (Zn/Zn2+ significa Zn Zn2+ + 2e-) é o potencial de oxidação
padrão da semi-reação de oxidação:
Zn(s) Zn2+(aq, 1M) + 2e- Eq.24 ƐoH+/H2 (H+/H2 significa 2H+ + 2e- H2) o potencial de redução padrão
previamente definido para o EPH. A f.e.m. padrão da pilha, Ɛ opilha, é soma do potencial
de oxidação padrão com o potencial de redução padrão: Ɛ opilha = Ɛ oox + Ɛ ored
30 que os índices “ox” e “red” significam, respetivamente, oxidação e redução. Para a nossa pilha galvânica,
Ɛ opilha = Ɛoox + Ɛ ored
0,76 V = Ɛ oZn/Zn2+ + 0
Portanto o potencial de oxidação padrão do zinco é 0,76 V.
Podemos obter o potencial de redução padrão do zinco, EoZn2+/Zno, invertendo a
semi-reação de oxidação:
Zn2+ (aq, 1M) + 2e- Zn(s) Ɛ oZn2+/Zno = - 0,76 Eq.25
2.4.
Corrosão e Deposição
A corrosão é a oxidação indesejada de um metal. Ela diminui a vida útil de produtos metálicos como aço, pontes, automóveis, etc. A substituição do metal corroído custa bilhões de dólares por ano. A corrosão é um processo eletroquímico e a série eletroquímica (tabela 1) nos dá uma indicação do porquê a corrosão ocorre e como ela pode ser prevenida.
Umas das fontes de corrosão pela corrosão é a água. Uma semi-reação que devemos levar em conta é:
2H2O (l) + 2e- H2 (g) + 2OH-(aq) Ɛ 0= -0,83V Eq.26
Esse potencial padrão é para a concentração de 1mol.L-1 OH-, que corresponde ao pH=14, isto é, uma solução fortemente básica. Porém, em pH = 7, esse par terá Ɛ 0 = - 0,42 V. Qualquer metal com potencial padrão mais negativo do que - 0,42V pode reduzir a água, em pH = 7. Em outras palavras, neste pH, qualquer metal com tais caraterísticas pode ser oxidado pela água.
Como Ɛ 0 = - 0,44V para Fe2+(aq) + 2é Fe(s), a tendência do ferro e ser
oxidado pela a água em pH = 7, é pequena. Por essa razão, o ferro pode ser usado em encanamentos de sistema de abastecimento de água e pode ser guardado em água livre de oxigénio sem enferrujar.
31 Quando o ferro é exposto no ar húmido, isto é, na presença de oxigénio e água, a semi-reação
O2(g) + 4H+(aq) + 4e - 2H2O(l) Ɛ 0 = 1,23V Eq.27
tem de ser considerada. O potencial dessa semi-reação, em pH = 7, é 0,82V, muito acima do valor do ferro. Nessas condições, o ferro pode reduzir o oxigénio dissolvido em água. Por outras palavras, oxigénio e água, juntos, podem oxidar o ferro a iões ferro (II). Eles podem, subsequentemente, oxidar o ferro (II) a iões ferro (III).
Porque Ɛ0 = 0,77V para Fe3+(aq) + e- Fe+2(aq) Eq.28
Vejamos, em detalhe, o processo envolvido.
Figura 3- Formação da ferrugem. (Atkins, 2006, p. 365)
Uma gota de água na superfície do ferro pode agir como eletrólito da corrosão numa pequena célula eletroquímica, nas bordas das gotas o oxigénio dissolvido oxida o ferro. O processo será:
32 O2(g) + 4H+(aq) + 4e- 2H2O(l) Eq.27
Total: 2Fe(s) + O2(g) + 4H+(aq) 2Fe2+(aq) + 2H2O(l) Eq.30
Os eletrões retirados do metal pela oxidação podem ser substituídos por eletrões de outra parte do metal condutor – em particular, pelo ferro que está coberto pela região pobre em oxigénio do centro da gota. Os átomos do ferro que estão nessa posição perdem seus eletrões para formar iões Fe2+, e dissolvem-se na água vizinha. Esse processo leva a formação de minúsculos buracos na superfície. Os iões Fe2+, são, depois, oxidados da Fe3+ pelo oxigénio dissolvido. Como mostra a equação:
2Fe2+(aq) 2Fe3+(aq) + 2e- Eq.31
½O(g) + 2H+(aq) + 2e- H2O(l)
Eq.27
Total 2Fe2+(aq) + 1/2O2(g) + 2H+(aq) 2Fe3+(aq) + H2O(l) Eq.32
Esses iões precipitam com óxidos de ferro (III) hidratado, Fe2O3.H2O a substância
vermelha insolúvel, conhecida como ferrugem. A provável origem dos iões óxidos é a desprotonação das moléculas de água. Eles forma imediatamente o sólido hidratado pela precipitação dos iões Fe3+, segundo a reação Eq.32.
4H2O(l) + 2Fe3+(aq) 6H+(aq) + Fe2O3.H2O(s) Eq.33
2.5.
Equação de redox
As reações de redox (oxidação-redução) são aquelas em que ocorrem transferência de eletrões. Uma espécie perde eletrões (oxida) e a outra espécie recebe eletrões (reduz) formando um par redox.
Semi-reação
Oxidação: Zn(s) Zn2+(aq) + 2e- Eq.21
Redução: Cu2+(aq) + 2e- Cu(s) Eq.20
33
2.5.1.
Equações redox
As equações discutidas anteriormente são relativamente fáceis de acertar. No entanto, no laboratório, defrontamo-nos muitas vezes com reações redox mais complexas, reações que envolvem oxianiões tais como os iões (CrO42-), dicromato (Cr2O72-),
permanganato (MnO4-), nitrato (NO3-) e sulfato (SO42-). Essas equações são mais
difíceis do que uma equação redox normal. Para balancear esta equação usaremos o método ião-eletrão. Nesta abordagem a reação global é dividida em duas reações, uma para a oxidação e outra para a redução. As equações para as duas semi-reações são acertadas separadamente e depois adicionadas de maneira a obter-se a equação global acertada.
2.5.2.
Balanceamento das equações redox
Uma vez identificados todos os reagentes e produtos da reação, e tendo escrito corretamente as suas fórmulas, podemos agrupá-los na sequência convencional – os reagentes no lado esquerdo separados dos produtos no lado direito por uma seta. A equação escrita desta maneira poderá não estar acertada; ou seja, o número de cada de átomos em ambos os lados da equação não é igual. Em geral, podemos acertar uma equação química seguindo os seguintes passos:
I. Identificar todos os reagentes e produtos da reação e escrever suas fórmulas corretas no lado esquerdo e direito da equação, respetivamente.
II. Começar o acerto da equação experimentando coeficientes adequados que nos deem o mesmo número de átomos de cada elemento em ambos os lados da equação. Podemos mudar apenas os coeficientes estequiométricos e nunca o índice (atomicidade).
III. Olhar para os elementos que aparecem apenas uma vez em cada lado da equação e com um número igual de átomos em cada lado – as fórmulas contendo esses elementos devem ter o mesmo coeficiente.
IV. Em seguida, olhar para os elementos que aparecem apenas uma vez em cada lado da equação mas com número de átomos diferente. Acertar estes elementos.
34 V. Finalmente, acertar os elementos que aparecem em duas ou mais fórmulas de
um mesmo lado da equação.
Verificar a equação acertada para se certificar que o número total de cada tipo de átomos em ambos os lados da seta da equação é o mesmo.
Exemplo: Balancear a seguinte equação.
KClO3 KCl + O2 Eq.34
Observamos que os três elementos aparecem apenas uma vez em cada lado da equação, mas apenas K e Cl aparecem em igual número de átomos em cada lado. Assim, KClO3 e KCl devem ter o mesmo coeficiente. O passo seguinte é fazer com que o
número de átomos de O seja o mesmo em ambos os lados da equação. Visto que há três átomos de O na esquerda e dois átomos de O na direita da equação, podemos acertar os átomos de O colocando um 2 antes de KClO3 e uma 3 antes de O2.
2KClO3 KCl + 3O2 Eq.35
Finalmente, acertando os átomos de K e Cl colocando um 2 antes do KCl:
2KClO3 2KClO + 3O2 Eq.36
Para equações de redox simples podemos usar o método descrito acima, para equações mais complexas usaremos os métodos descritos abaixo.
2.5.3.
Balanceamento em meio ácido.
Suponha-se que nos é pedido para acertar a equação que representa a oxidação dos iões Fe2+ a iões Fe3+ pelos iões (Cr2O72-), em meio ácido. Os iões Cr2O72- são reduzidos a
iões Cr3+. As etapas seguintes ajuda-nos a realizar a tarefa solicitada.
Passo 1. Escrever a equação não acertada da reação na forma iónica.
Fe2+ + Cr2O72- Fe3+ + Cr3+ Eq.37
35 Oxidação: Fe2+ Fe3+ Eq.38 Redução: Cr6+2O2-7 Cr3+ Eq.39
Passo 3. Acertar todos os átomos, a exceção de O e H separadamente em cada semi-reação.
A semi-reação de oxidação já está acertada para os átomos de Fe. Na semi-reação de redução multiplicamos o Cr3+ por 2 de forma a acertar os átomos
Cr2O72- 2Cr3+ Eq.40
Passo 4. Para reações em meio ácido, acrescentar H2O para acertar os átomos de O e
H+ para acertar os átomos de H. Como a reação ocorre em meio ácido, adicionamos sete moléculas de H2O ao lado direito da semi-reação de redução para acertar os
átomos de O.
Cr2O72- 2Cr3+ + 7H2O Eq.41
Para acertar os átomos de H, adicionamos quatorze ião de H+ no lado esquerdo da equação.
14H+ + Cr2O72- 2Cr3+ + 7H2O Eq.42
Passo.5. Adicionar eletrões a um dos lados de cada semi-reações para acertar as cargas.
Se necessário, igualar o número de eletrões nas duas semi-reações multiplicando uma ou ambas as reações pelos coeficientes apropriados.
Para a semi-reação de oxidação escrevemos
Fe2+ Fe3+ + e- Eq.43 Adicionamos um eletrão do lado direito de formar a haver uma carga 2+ em ambos os lados das semi-reação.
Na semi-reação de redução existem doze cargas positivas no lado esquerdo da equação e apenas seis cargas positivas do lado direito. Portanto, adicionamos seis eletrões do lado esquerdo.
36 14H+ + Cr2O72- + 6e- 2Cr3+ + 7H2O Eq.44
Para igualar o número de eletrões em ambas as reações, multiplicamos a semi-reação de oxidação por 6:
6Fe2+ 6Fe3+ + 6e- Eq.45 Passo 6. Adicionar as duas semi-reações e verificar se a equação final está acertada. Os eletrões em ambos os lados devem anular-se mutuamente. As duas semi-reações são adicionadas para dar
14H+ + Cr2O72- + 6Fe2+ + 2e- 2Cr3+ + 6Fe3+ + 7H2O + 6e- Eq.46
Os eletrões em ambos os lados eliminam-se e obtemos a equação iónica global:
14H+ + Cr2O72- + 6Fe2+ 2Cr3+ + 6Fe3+ + 7H2O Eq.47
Passo 7. Verificar se a equação contém o mesmo número de cada tipo de átomos bem como as mesmas cargas em ambos os lados da equação.
2.5.4.
Balanceamento em meio básico.
Para equações em meio básico, acertam-se primeiro os ácidos como se procede em meio ácido (passo 4). Em seguida, por cada ião H+, adicionar um igual número de iões de OH- a ambos os lados da equação. No lado da equação em que se encontram simultaneamente os iões H+ e OH- combine-os para dar H2O.
Exemplo: escrever a equação iónica acertada que representa a oxidação do ião iodeto (I-) pelo ião permanganato (MnO4-), em solução básica, para originar iodo molecular
(I2) e óxido de manganês (IV) (MnO2).
Passo 1. A equação não acertada é
MnO-4 + I- MnO2 + I2 Eq.48
Passo 2. Oxidação I- I20 Eq.49
37 Passo 3. Para a acertar os átomos de 1 na semi-reação de oxidação, escrevemos
2I- I2 Eq.49
Passo 4. Na semi-reação de redução, para acertar os átomos de O acrescentamos duas moléculas de H2O ao lado direito:
MnO-4 MnO2 + 2H2O Eq.51
Para acertar os átomos de H, acrescentamos quatro iões H+ ao lado esquerdo
MnO-4 + 4H+ MnO2 + 2H2O Eq.52
Como a reação ocorre em meio básico e existem quatro iões H+, adicionamos quatro iões OH- em ambos lados da equação.
MnO-4 + 4H+ + 4OH- MnO2 + 2H2O + 4OH- Eq.53
Combinando os iões H+ e OH- para dar H2O, obtemos
MnO-4 + 2 H2O MnO2 + 4OH- Eq.54
Passo 5. Em seguida, acertamos as cargas das suas semi-reações da seguinte maneira: 2I- I2 + 2é Eq.55
MnO-4 + 2H2O + 3é MnO2 + 4OH- Eq.56
Para igualar o número de eletrões, multiplicamos a semi-reação de oxidação por 3 e a semi-reação de redução por 2:
6I- 3I2 + 6e- Eq.55
2MnO-4 + 4H2O + 6e- 2MnO2 + 8OH- Eq.57
Passo 6. As duas semi-reações são adicionadas para dar
6I- + 2MnO-4 + 2MnO-4 + 4H2O + 6e- 3I2 + 2MnO2 + 8 OH- 6e- Eq.58
Depois eliminamos os eletrões em ambos os lados, obtemos
38 Passo 7. A revisão final mostra que a equação está acertada que em termos de átomos quer em termos de cargas.
2.6.
Calculando a tensão da célula
Sabemos que cada metal tem uma capacidade própria de doar eletrão, e que alguns metais tem uma maior tendência em doar eletrões (oxidar), tornando-se um metal mais reativo. E que outros metais tem uma tendência maior em receber eletrões (reduzir). A IUPAC (União Internacional da Química Pura e Aplicada) aconselha que se trabalhe preferencialmente com potencial-padrão de redução. Para determinarmos o potencial padrão de uma célula, ou a voltagem de uma célula, devemos conhecer os valores dos potenciais-padrão de oxidação ou redução. O potencial-padrão de oxidação e redução é igual para o mesmo metal, só muda o sinal positivo (+) para oxidação e negativo (-) para redução.
Irá oxidar ou reduzir aquele metal que tiver maior potencial para oxidar. Determinado qual metal tem o maior tendência em ganhar (redução) o outro metal sofrerá uma oxidação (oxida). O próximo passo é escrever cada equação com os seus respetivos potenciais. A equação de oxidação (anódica) e a equação de redução (catódica). A equação global consiste na soma das duas semi-reações.
Ânodo: A(s) A+(aq) + e- Ɛ 0oxi
Cátodo: B+(aq) + e- B(s) Ɛ 0red
Célula: A(s) + B+(aq) A+(aq) + B(s) Ɛ 0 = célula
Exemplo:
Cu+2(aq)+ 2e- Cu(s) Ɛ 0 = + 0,34V Eq.60
Ni+2(aq) +2e- Ni(s) Ɛ 0 = - 0,25V Eq.61
O potencial fornecido foi o de redução, então como o cobre (Cu) tem maior poder de redução que o níquel (Ni), o cobre reduzirá e o níquel oxidará. Então devemos inverter a equação do níquel de redução, para oxidação.
39 Cátodo: Cu+2(aq) + 2e- Cu(s) Ɛ 0 = +0,34V Eq.60
Ânodo: Ni(s) Ni+2(aq) + 2e- Ɛ 0 = +0,25V Eq.61
Equação da célula: Cu+2(aq) + Ni(s) Cu(s) + Ni+2(aq) Ɛ 0 = 0,59V Eq.62
Ao longo desse capítulo procedeu-se a uma contextualização científico-pedagógica relacionando os aspetos científicos com os curricula e com o que surge nos manuais escolares do 11º e 12º ano. Em (2.7.) desenvolve-se estes aspetos com mais detalhes, apresentando os conteúdos e objectivos do Ministério da Educação do Brasil e de Portugal, para cada um dos anos letivos no qual é discutido oxidação-redução. Apresenta-se também um resumo de como é abordado este tema dentro de alguns manuais para o 7º, 11º e 12º ano de escolaridade.
2.7.
Enquadramento curricular de redox
2.7.1.
Curricula
A oxidação-redução (redox) está presente nos programas da componente de Química do 1º ano do ensino médio e no 2º ano do ensino médio no Brasil. Em Portugal, está presente de maneira discreta, dentro do subdomínio “reações químicas”, abordada na componente de Química do 8º ano de escolaridade, na componente de Química A do 11º ano de escolaridade, dentro do subdomínio “reação de oxidação-redução”, na componente de Química A do 12º ano de escolaridade, dentro do subdomínio “degradação dos metais”.
Os respetivos conteúdos e objetivos do Ministério da Educação, para cada um dos anos letivos, são apresentados de seguida.
2.7.2.
Curricular no Brasil
Os Parâmetros Curriculares Nacionais para o Ensino Médio (PCNEM) e as Diretrizes Curriculares Nacionais do Ensino Médio (DCNEM), fazem referência explícita às disciplinas, vinculadas às três áreas do conhecimento, Linguagens e Códigos e suas Tecnologias (LCT), Ciências da Natureza, Matemática e suas Tecnologias (CNMT) e
40 Ciências Humanas e suas Tecnologias. Essas três áreas devem ser trabalhadas para contemplar os três conjuntos de competências gerais exigidas para o ensino médio no Brasil. Para CNMT a competência atribuída é a investigação e compreensão. Esta competência envolve medidas, escalas, construção de modelos representativos e explicativos, que contribuem para a compreensão das leis naturais e de sínteses teóricas, além de outros aspetos inerentes ao aprendizado científico (PCQEM, 2013). A química é abordada dentro área Ciências da Natureza e suas Tecnologias. O primeiro contacto dos estudantes brasileiros com a disciplina de química é a partir do 9º ano do ensino fundamental. No 1º ano do ensino médio o conceito de oxidação é trabalhada de uma maneira mais superficial. O conteúdo de oxidação-redução é trabalhado de uma forma mais detalhada no 2º ano do ensino médio. De seguida, apresentaremos os conteúdos os objetivos do Ministério da Educação para o ensino de oxidação-redução no Brasil, de acordo com as Diretrizes Curriculares de Química. (Ministério da Educação, 2006)
Tema: Processos de oxidação e redução Expectativa de aprendizagem:
• Reconhecer processos de oxidação e redução no cotidiano;
• Identificar o número de elétrons envolvidos nos processos de oxidação e redução e a atribuição do número de oxidação das espécies químicas;
• Identificar espécies químicas presentes em transformações de oxidação e redução;
• Classificar os processos químicos, como oxidação ou redução, de acordo com a variação de carga elétrica das espécies;
• Relacionar a carga dos iões à relação entre o número de prótons e eletrões; • Relacionar o movimento de elétrons e de iões com a condução de corrente
elétrica;
• Identificar os metais e ametais, respetivamente, como doadores e receptores de eletrões;
41 • Diferenciar processos espontâneos ou não espontâneos por meio da diferença
de potencial nos processos de oxirredução;
• Representar as reações eletroquímicas, tanto as semirreações como a reação global por meio de equações;
• Identificar o potencial de oxidação e redução das espécies químicas, medido em eV ou Volt;
• Compreender os procedimentos utilizados para efetuar cálculos de força eletromotriz de pilhas;
• Calcular a força eletromotriz gerada durante o funcionamento de uma pilha; • Identificar os polos positivo e negativo, como catodo e anodo, respetivamente; • Reconhecer as transformações químicas não espontâneas, que ocorrem pela
passagem de corrente elétrica por um sistema;
• Compreender o princípio de funcionamento de uma pilha eletroquímica;
• Consultar tabelas de potencial eletroquímico, para fazer previsões sobre a ocorrência das transformações;
• Conhecer os constituintes das pilhas e das baterias mais utilizadas e o seu funcionamento;
• Compreender o processo de eletrólise utilizado na obtenção de alumínio e de outros metais, a partir de aplicações tecnológicas, como cromação, galvanização;
• Reconhecer o impacto ambiental gerado pelos processos de obtenção de metais e de descartes de pilhas e baterias;
Ao final do 1º ano do Ensino Médio, os estudantes devem reconhecer as evidências de reações químicas, que indicam o aparecimento de novas substâncias, associando as reações oxidação-redução com as reações de combustão, corrosão de metais e a respiração. Ao final do 2º ano do ensino médio, o conhecimento que deve estar consolidado, diz respeito ao movimente de eletrões, ou seja, às reações de oxidação-redução, funcionamento de pilhas e baterias e a eletrólise. No 2º ano do ensino médio, todo o conteúdo de oxidação-redução é abordado e aprofundado, desde a produção de eletricidade a partir de reações químicas até os riscos do descarte de pilhas e baterias, contendo substâncias tóxicas para o ambiente. Procede-se de seguida, o
42 enquadramento escolar deste tema num dos livros adotados atualmente para 2º ano do Ensino Médio no Brasil.
Manual escolar brasileiro
Manual escolar (Ciscato, Pereira, Chemello & Proti (2016)
Neste manual a unidade oxidação-redução começa por associar a oxidação-redução aos processos de corrosão e aos danos económicos deste processo. De seguida, faz-se uma abordagem da ocorrência de fenómenos espontâneos de oxidação e redução. Definindo oxidação como a espécie química que perde um ou mais eletrão numa reação química e redução como a espécie química que ganha um ou mais eletrão numa reação química. Usa-se uma solução de nitrato de prata (AgNO3) com uma barra
metálica de cobre (Cu) para mostrar a oxidação e redução de acordo com a equação abaixo:
Cu(s) + AgNO3(aq) CuNO3(aq) + Ag0(s) Eq.63
Para explicar o número de oxidação nas espécies químicas o autor explica novamente um conteúdo que é abordado no 1º ano do Ensino Médio, a eletronegatividade. Associando este conceito, as cargas que surgem ao redor do átomo durante uma ligação química. Explica as ligações iónicas e covalentes com base na diferença de eletronegatividade e aborda o surgimento das cargas (nox) nos átomos envolvidos. Por fim, ressalta que o fenómeno de oxidação-redução estão interligados, os eletrões recebidos pela espécie que é reduzido são doados pela outra espécie que oxidou. Nesta parte, aborda-se o conceito de agente oxidante (espécie química que promove a oxidação é aquela que é reduzida) e agente redutor (espécie química que promove a redução é aquela que é oxidada). De seguida, faz-se uma abordagem sobre a determinação do nox em diferentes espécies químicas. A unidade é finalizada com questões sobre o tema.
43
2.7.3.
Curricular em Portugal
Os respetivos conteúdos e objetivos do Ministério da Educação, para cada um dos anos letivos, são apresentados de seguida.
1) 8º ANO DE ESCOLARIDADE (Ministério da Educação, 2014)
O assunto oxidação-redução vem abordado de uma maneira discreta nas metas curriculares e nas orientações curriculares do 3º ciclo do ensino básico.
Domínio: Reações químicas
Subdomínio: Tipos de reações químicas Objetivos:
2.3. Associar as reações de combustão, a corrosão de metais e a respiração a um tipo de reações químicas que se desginam por reações de oxidação-redução.
11º ANO DE ESCOLARIDADE (Ministério da Educação, 2014 ) Componente de Química A
Domínio: Reações em sistemas aquosos Subdomínio: Reações de oxidação-redução
Objetivo geral: reconhecer as reações de oxidação-redução como reações de transferência de eletrões e interpretar a ação de ácidos sobre alguns metais como um processo de oxidação-redução.
Conteúdos:
Caracterização das reações de oxidação-redução • conceitos de oxidação e redução
• espécie oxidada e espécie reduzida • oxidante e redutor o número de oxidação • semirreações de oxidação e de redução
44 Força relativa de oxidantes e redutores
• reação ácido-metal
• poder redutor e poder oxidante • série eletroquímica
Metas curriculares
Reações de oxidação-redução
• Reconhecer as reações de oxidação-redução como reações de transferência de eletrões e interpretar a ação de ácidos sobre alguns metais como um processo de oxidação-redução;
• Associar oxidação à cedência de eletrões e redução ao ganho de eletrões; • Interpretar reações de oxidação-redução como reações de transferência de
eletrões;
• Identificar, numa reação de oxidação-redução, as espécies químicas oxidada (redutor) e reduzida (oxidante);
• Identificar estados de oxidação de um elemento em substâncias elementares; compostas e em espécies iónicas a partir do cálculo do seu número de oxidação;
• Usar o conceito de número de oxidação na identificação de reações de oxidação-redução;
• Acertar equações químicas de oxidação-redução em casos simples;
• Interpretar uma reação de oxidação-redução como um processo em que ocorrem simultaneamente uma oxidação e uma redução, escrevendo as semiequações correspondentes;
• Associar a ocorrência de uma reação ácido-metal à oxidação do metal com redução simultânea do ião hidrogénio;
• Comparar o poder redutor de alguns metais;
• Prever se uma reação de oxidação-redução ocorre usando uma série eletroquímica adequada;
45 12º ANO DE ESCOLARIDADE (Minsitério da Educação 2014)
Componente de Química A Domínio: metais e ligas metálicas
Subdomínio: estrutura e propriedades dos metais; degradação dos metais; metais, ambiente e vida.
Degradação dos metais
1. Objetivo geral: Consolidar e ampliar conhecimentos sobre reações de oxidação-redução como transformações que envolvem transferência de eletrões e energia elétrica.
2. Conteúdos
a) Corrosão: uma oxidação indesejada
• corrosão como uma oxidação de oxidação-redução • importância dos meios numa reação de oxidaçao-redução b) Pilhas e baterias: um oxidação útil
• pilhas como fonte de energia
• reatividade dos metais e o potencial padrão de redução
• extensão das reações redox As pilhas no quotidiano: pilhas alcalinas, pilhas recarregáveis, baterias e acumuladores
• As pilhas do futuro: pilhas de combustível ou a combustão à distância c) Protecção de metais
• As ligas metálicas e a resistência à corrosão • A protecção catódica