75
RESUMO
O objetivo desta pesquisa foi avaliar o efeito do uso da própolis sobre a presença de bac-térias Gram-positivas e negativas no líquido ruminal de bovinos. O experimento foi con-duzido utilizando cinco bovinos mestiços, distribuídos em delineamento quadrado latino 4x4 recebendo uma dieta base, suplementada com quatro tratamentos distintos: controle, LLOS B3+, LLOS C1+ e LLOS C1++, sendo os LLOS a base de própolis. Foi coletado líquido ruminal de bovinos para a extração e amplificação do gene 16S rDNA das bactérias. Atra-vés da amplificação, foi observada a presença de bactérias das espécies Fibrobacter succino-genes, Ruminococcus flavefaciens, Streptococcus bovis, Prevotella ruminicola, Eubacterium rumi-nantium e Anaerovibrio lipolytica. Os tratamentos controle e LLOS B3+ foram positivos para 50% das 30 amostras testadas. LLOS C1++foi positivo para 40%, e o tratamento LLOS C1+ foi positivo para 63% das amostras testadas. Pode-se concluir que os produtos utilizados como aditivos neste experimento podem influenciar na característica da flora ruminal, alterando a composição de suas bactérias, entretanto, os tratamentos à base de própolis não selecionaram apenas bactérias Gram-positivas, como sugerido nas literaturas.
Termos para indexação: Amplificação, flavonoides, microbiologia ruminal.
Efeito do uso de própolis sobre a
presença de bactérias gram-positivas e
negativas no líquido ruminal de bovinos
Stefania Caroline Claudino da Silva1*;
Eliane Gasparino2;
Ana Paula Del Vesco1;
Valério Balini3;
Lucia Maria Zeoula2;
Fernanda Tanamati1;
André Luiz Seccatto Garcia4;
1 Alunas do Programa de Pós-Graduação em Zootecnia (PPZ), Universidade Estadual de Maringá (UEM); 2 Professoras do departamento de Zootecnia (DZO), UEM;
3 LaboratórioSão Camilo- Biotecnologia; 4 Aluno de graduação de Zootecnia, UEM; * E-mail: stefania_caroline@hotmail.com;
76
Effect of propolis on the presence of
bacteria in bovine rumen fluid
ABSTRACT
The aim of this research was to evaluate the effect of monensin and propolis use on the presence of bacteria in rumen fluid of cattle. The experiment was conducted using Hols-tein cows, allotted in a 4x4 Latin square receiving, a basal diet supplemented with four different treatments: control, LLOS B3 +, LLOS C1+ and LLOS C1 ++. We collected bovine rumen fluid for the bacteria 16S rDNA extraction and amplification. By amplification was observed the occurrence of bacterial species Fibrobacter succinogenes, Ruminococcus-flavefaciens, Streptococcus bovis, Prevotellaruminicola, andEubacteriumruminantium, Anaero-vibriolipolytica. The control and LLOS B3 + groups were positive for 50% of the 30 samples tested. Monensin and LLOS C1 ++ groups were positives for 40%, and LLOS C1+ group was positive for 63% of samples. We concluded that the products used as additives in this experiment can influence the characteristic of the ruminal flora, altering their bacterial composition.
77
1 INTRODUÇÃO
Para melhorar a eficiência alimentar de ruminantes, é possível oferecer vantagem seletiva às bactérias de interesse através da utilização de aditivos e modificadores da fermentação microbiana ruminal (Stradiot-ti Jr., 2004). Uma alterna(Stradiot-tiva é aumentar a produção de ácido propiônico, reduzir a degradação da proteína dietética e dimi-nuir a produção de metano(Nacional Rese-archCouncil - NRC, 1989), pois esta produ-ção de metanos pode corresponder a uma perda energética de até 13% do alimento ingerido (Russell, 1987).
Alguns ionóforos, como a monenzina, re-duzem a produção ruminal de amônia pela inibição da população de bactérias gram-positivas, fermentadoras obrigató-rias de aminoácidos e com alta capacida-de capacida-de produção capacida-de amônia (Russell, 2002). De forma semelhante, Keskin et al (2001) verificaram que extratos de própolis apre-sentaram atividade antibacteriana contra bactérias Gram - positivas (Streptococcus au-reus e Streptococus) e fraca atividade contra bactérias Gram - negativas (Escherichia coli e Pseudomonasaeruginosa), e que este efeito pode estar relacionado à composição quí-mica dos concentrados de própolis, com ênfase no conteúdo de flavonóides. (Salo-mão et al., 2008).
Entretanto, diversos estudos têm sugerido dúvidas sobre o mecanismo exato de ação da própolis, sugerindo a existência de algu-ma ação alternativa sobre as bactérias rumi-nais que não a seleção pela coloração Gram
(Oliveira et al., 2004, 2005, 2006 e 2007; Mirzoevaet al., 1997; kikuni et al., 1993). Assim, o objetivo desse trabalho foi verifi-car a presença de algumas bactérias gram positivas e negativas no liquido ruminal de bovinos alimentados com própolis, uti-lizando a técnica molecular de polymerase-chainreaction (PCR).
2 MATERIAL E MéTODOS
A pesquisa foi realizana Fazenda Experi-mental, no Laboratório de Nutrição e Ali-mentação Animal e Laboratório de Biolo-gia Molecular da Universidade Estadual de Maringá, PR. Utilizou-se cinco bovinos mestiços, castrados, com peso médio 295 kg, cânulados no rúmen, alojados em baias individuais com 10 m2 de piso de concreto, cobertas, providas de cocho e bebedouro. Os animais foram distribuídos em um de-lineamento em quadrado latino 5x5, onde os tratamentos constituíram-se de diferen-tes aditivos alimentares: dieta controle, monensina sódica (Rumensin®), produto à base de própolis LLOSB3+, LLOSC1+ e LLOSC1++, que contém, respectivamen-te, 0,022 mg/g, 0,036 mg/g e 0,054 mg/g de flavonóides totais medidos em crisina, em HPLC. Os produtos à base de própolis foram preparados de acordo com a meto-dologia desenvolvida por Franco e Bueno (1999) e foi solicitada a concessão de pa-tente ao Instituto Nacional da Propriedade Industrial (INPI), cujo número do Depó-sito Nacional de Pedido de Patente foi PI 0605768-3. Os produtos à base de própolis LLOS diferem na concentração de própolis
78
(B < C), na diluição alcoólica (1 < 3) e na dosagem (+ < ++). O fubá de milho foi usa-do como excipiente, de forma que as usa-doses diárias ficassem em 10 g de produto final. A monensina foi fornecida na quantidade indicada pelo fabricante. A dose diária foi dividida em duas metades, uma metade foi depositada diretamente no rúmen, pela cânula, no mesmo horário da alimentação matutina e a outra, da mesma forma na ali-mentação vespertina.
Os animais receberam uma dieta base con-tendo 47% de volumoso (silagem de lho) e 53% de concentrado à base de mi-lho moído, farelo de soja e sal mineral. A dieta possuiu 12,7% de PB, 74% de NDT, 30% de FDN e 16% de FDA. A alimenta-ção era fornecida duas vezes ao dia, restrita em proporção de 2,1% do peso vivo/dia. Os animais foram adaptados aos aditivos por 14 dias. Após esse período foi realizada a coleta manual do conteúdo ruminal no pe-ríodo da manhã, antes da alimentação ma-tinal, e retirado uma alíquota de 14mL do material ainda fresco. Entre cada período foi adotado um período de “washout” de sete dias, onde todos os animais receberam a dieta controle.
O líquido ruminal foi utilizado para extra-ção e amplificaextra-ção do gene 16S rDNA das bactérias Fibrobactersuccinogenes, Rumino-coccusflavefaciens, Streptococcusbovis, Pre-votellaruminicola, Eubacteriumruminantium e Anaerovibriolipolytica, por apresentarem amplitude de produtos e nichos primários, totalizando 30 amostras.
As amostras foram processadas
individual-mente, sendo inicialmente centrifugadas a 10.000 rpm por 2 minutos. Logo após, o sobrenadante foi vertido e adicionou-se 50 mL de metanol. Em seguida, as amostras foram armazenadas em freezer a -20ºC. A extração de DNA foi segundo o protocolo proposto por Boom et al. (1990), para as amostras frescas (recém coletadas) e conser-vadas em metanol. Inicialmente 50 μL de líquido ruminal foram lavados em 200 μL de TE, em seguida, centrifugados a 8.000 rpm por 2 minutos. 20 μL da suspensão de bactérias foram retirados para a extração de DNA. Para lise celular foram utilizados 1.000 μL de tampão L6 (120g de Isoticiana-to, 100 mL de Tris HCl (0,1M e pH 6,4), 22 mL de EDTA (0,2M e pH 8,0) e 2,6 mL de Triton X100, juntamente com 20 μL de síli-ca e 20 μL de amostra. A amostra foi agita-da no vórtex por 10 minutos e em seguiagita-da centrifugada a 14.000 rpm, por 30 segun-dos. O sobrenadante foi descartado. O pel-let de sílica foi lavado com 500 μl de tam-pão L2 (120g de Isoticianato, 100mL de Tris HCl (0,1M e pH 6,4)), misturado no vórtex e centrifugado a 14.000 rpm, durante 30 segundos, a lavagem com L2 foi realizada 2X. Posteriormente, foram realizadas duas lavagens com etanol 70% gelado. Para fina-lizar, procedeu-se uma lavagem com aceto-na absoluta, no qual 1 mL de acetoaceto-na gela-da e foi adicionagela-da a amostra, seguigela-da de agitação vigorosa e centrifugação a 14.000 rpm, por 30 segundos, o sobrenadante foi descartado. A amostra foi deixada em 37°C durante 10 minutos para secagem da síli-ca. Logo após foram adicionados 80 μL de água ultra-pura, agitou-se vigorosamente e
79
deixou-se em banho-seco a 56°C, por 15 minutos. Logo após centrifugou-se as amostras a 14.000 rpm, por 2 minutos e recuperou-se 40 μL do sobrenadante.
Para a detecção das bactérias, foram utilizados primers específicos propostos por Tajima et al. (2001) para Fibrobacter succinogenes, Ruminococcus flavefaciens, Streptococcu sbovis, Prevo-tella ruminicola, Eubacterium ruminantiume Anaerovibrio lipolytica. O programa de amplifi-cação foi o mesmo para todos os primers, mudando apenas a temperatura de anelamento (Tabela 1).
Tabela 1: Primers para amplificação, temperaturas de anelamento e tamanho de fragmento.
Bactérias Primer Anelamento(°C)
Tamanho do Fragmento
(pb) F. succinogenes GGTATGGGATGAGCTTGC – FGCCTGCCCCTGAACTATC – R 64 445 R. flavefaciens GGACGATAATGACGGTACTT – FGCAATCYGAACTGGGACAAT – R 64 835 S. bovis CTAATACCGCATAACAGCAT – FCACTACTCATGGCAACAT – R 57 869 P. ruminicola GGTTATCTTGAGT GAGTT – FCTGATGGCAACTAAAGAA – R 53 485 E. ruminantium GCTTCTGAAGAATCATTTGAAG – F TCGTGCCTCAGTGTCAGTGT – R 63 671 A.lipolytica TGGGTGTTAGAAATGGATTC – F CTCTCCTGCACTCAAGAATT – R 63 597
O volume total de reação foi de 15 μL, contendo concentrações variadas de MgCl2 e primers(Tabela 2). Como controle interno da reação foi utilizado os primers das mesmas bactérias em análise cujo tamanho do fragmento não se sobrepunha.
Tabela 2: Concentrações de reagentes utilizados nas reações de PCR, para cada primer.
F.succinogenes R.flavefaciens S.bovis P. ruminicola E. ruminantium A. lipolytica
PCR buffer 1 X 1 X 1 X 1 X 1 X 1 X MgCl2 2,33 mM 2,33 mM 2,33 mM 1,66 mM 1,66 mM 1,66 mM Primer F 333 nM 833 nM 833 nM 166 nM 833 nM 666 nM Primer R 333 nM 833 nM 833 nM 166 nM 833 nM 666 nM dNTPs 0,33 mM 0,33 mM 0,33 mM 0,33 mM 0,33 mM 0,33 mM TaqDNA 0,5 U 0,5 U 0,5 U 0,5 U 0,5 U 0,5 U H2O 9,8μL 9,8μL 10,2μL 11,2μL 10,6μL 10,6μL Amostra 1μL 1μL 1μL 1μL 1μL 1μL
As condições da PCR foram de uma etapa inicial a 95°C por 3 minutos, seguido de 35 ciclos, de 95°C por 30 segundos, anelamento por 30 segundos, variando a temperatura
80
de anelamento de cada primer e extensão de 72°C por 30 segundos, seguido de uma extensão final de 72°C por 1 minuto. Após as reações de amplificações, as amostras foram visualizadas em gel de agarose 2%e coradas com Brometo de Etídeo.A análise estatística foi realizada utilizando o progra-ma StatisticalAnalysis System (2000). Os resultados foram submetidos ao teste de Kruskal-Wallis (p < 0,05).
3 RESULTADOS E DISCUSSÃO
Através da amplificação do gene 16S rDNA, pode ser observada a ocorrência de bacté-rias das espécies Fibrobacter succinogenes, Ruminococcus flavefaciens, Streptococcus bo-vis, Prevotella ruminicola, Eubacterium rumi-nantium e Anaerovibrio lipolytica (Figura 1).
Figura 1: Gel de agarose. Canaleta 1: Padrão de 100 pb. Canaleta 2 e 3: Multiplex Primer (Fibrobacter
succinogenes, 445 pb e Ruminococcus flavefaciens,
835 pb). Canaleta 4 e 5 Streptococcus bovis (869 pb). Canaleta 6 e 7: Prevotella ruminicola, (485 pb). Canaleta 8 e 9: Eubacterium ruminantium, (671 pb). Canaleta 10 e 11: Anaerovibrio lipolytica (597 pb). Os tratamentos utilizados interferiram na presença ou ausência das diferentes espé-cies de bactérias analisadas nas amostras de líquido ruminal,entretanto não foiverifica-da diferença estatística (p<0,05). Erros de
reação foram descartados através da utiliza-ção de controle interno de reautiliza-ção.
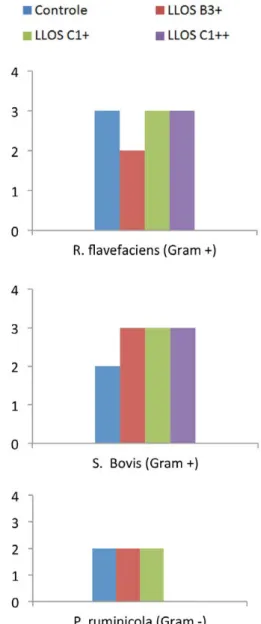
Neste estudo,o tratamento controle apre-sentou amplificação positiva para50% das amostras das espécies testadas, sendo três amostras de F. succinogenes, três de R. fla-vefaciens, duas de S. bovis, duas de P. Rumi-nicola, três de E. ruminantium e duas amos-tras de A. lipolytica,totalizando 15 amosamos-tras com amplificação positiva (Figura 2).
81
Figura 2: Número de amostras amplificadas a cada quatro amostras testadas para F. succinogenes, R.
flavefaciens, S. bovis, P. ruminicola, E. ruminantium e A. lipolytica, nos quatro tratamentos avaliados.
Por não apresentar aditivo alimentar e por tratar-se de alimentação controlada de vo-lumoso-concentrado, e considerando-se a constante presença dos substratos necessá-rios, esperava-se que o tratamento controle apresentasse 100% de amplificação para os primers dos genes das bactérias analisadas, sugerindo diferentes composições de bacté-rias ruminais, provavelmente pela capaci-dade de superposição das bactérias em fer-mentar vários substratos (Church, 1993). O tratamento LLOS B3+ foi positivo para 50% das 30 amostras testadas, LLOS C1++ positivos para 40%, e o tratamento LLOS C1+
foi positivo para 63% das amostras testadas. Nos padrões de amplificação do gene 16S rDNA da dieta contendo LLOS B3+ à dieta controle, observa-se um aumento de am-plificação para as espécies S. bovis (Gram - positivas) e A. lipolítica (Gram - negativa). A espécie A. lipolítica é uma fermentadora de lactato e produtora de acetato (Russel, 2002) que atua sobre os ácidos graxos este-rificados (Valinote et al., 2005). Já a S. bovis é uma fermentadora de lactato Gram-posi-tiva, e de acordo com o suposto mecanismo de ação da própolis, deveria ser inibida. De forma semelhante, a adição de LLOS C1+ a dieta promoveu aumento da amplificação para as espécies S. bovis (Gram - positivas), A. lipolítica (Gram - negativas), e também da espécie Fibrobacter succinogenes (Gram – negativa). A F. succinogenes é uma bactéria celulolítica Gram - negativa que tem como substratos as β-glucanas, e seu produtos in-cluem o formato, acetato e succinato (Jun et al., 2007), entretanto, apesar de ter au-mentado a presença destas duas bactérias Gram-negativas, o tratamento com LLOS C1+ também aumentou a presença da bac-téria Gram-positiva.
Para o tratamento com LLOS C1++ observa-mos aumento nas amplificações para as es-pécies S. bovis (Gram - positivas), e F. succi-nogenes (Gram – negativa), como observado no tratamento com LLOS C1+, e ausência total de amplificação para a espécie P. ru-minicula (Gram – negativas), um gênero de bactérias anaeróbias generalistas ou não-es-pecíficas, que degradam a uma ampla gama de polímeros, com grande participação no
82
líquido ruminal. Whitford et al (1998),rea-lizando experimentos de clonagem da re-gião 16S rDNA das bactérias do rúmen de bovinos alimentados com dieta contendo forragem e grãos, verificou que aproxima-damente 30% das bactérias totais foram re-lacionadas com as bactérias do grupo dos bacteróides Prevottela. Dessa forma, sugere-se que a própolis possa ter sugere-seu mecanismo de ação relacionado, de alguma forma, com as bactérias desta espécie.
Aguiar et al (2009), ao avaliarem caracterís-ticas de carcaça e desempenho em bovinos confinados suplementados ou não com LLOSC1 e LLOSC1+, não encontraram di-ferença entre os tratamentos suplementa-dos com própolis e o tratamento controle. Prado et al (2010), avaliaram o crescimento de cepas bacterianas tolerantes a monensi-na e produtos à base de própolis (LLOSC1, LLOSB3, LLOSD1, LLOSA2 e LLOSC3) na presença substratos específicos, e verifi-caram que, aparentemente, a tolerância à própolis foi maior nas cepas Gram-positi-vas, discordando do proposto por Pinto et al (2001) que constataram maior ação antibacteriana da própolis sobre bactérias Gram-positivas, sendo pouco eficaz contra as Gram-negativas. De modo geral, obser-vamos que os produtos à base de própolis não se mostraram eficientes na redução das bactérias Gram - positivas.
4 CONCLUSÃO
Concluímos que os aditivos de própolis usados neste experimento podem influen-ciar as características da flora ruminal,
al-terando a composição de suas bactérias, porém, de maneira diferente do esperado, sugerindo que, de fato, o mecanismo de atuação da própolis seja diferente do modo de atuação dos ionóforos, selecionando bactérias Gram-positivas. Neste contexto, novos estudos são necessários acerca da uti-lização da própolis como aditivo alimentar, a fim de compreender seus efeitos sobre a manipulação das bactérias ruminais e, con-secutivamente, determinar as condições de uso mais adequadas na alimentação de ru-minantes.
83
REFERêNCIAS
Aguiar, S.C. Produtosa base de própolis (LLOS) na dieta de bovinos mestiços não castrados em confinamento. 2009. 59p. Dissertação (Mestrado). Universidade Estadual de Maringá. CHURCH, D.C. Fisiologia digestiva y nutrición de los ruminantes. Zaragoza: Acríbia, 1993. 641p.
Duffield, T.F. e Bagg, R.N. Use of ionophores in lactating dairy cattle: a review. Canadian-Veterinary Journal, v.41, n.5, p.388-394, 2000. Disponível em: <http://www.ncbi.nlm.nih. gov/pmc/articles/PMC1476247/pdf/canvetj00017-0078.pdf>. Acesso em 06 de out. 2012. Franco, S.L. e Bueno J.H.F. Otimização de processo extrativo de própolis. Infarma, v,11. n.11/12, p. 48-51, 1999.
Jun, H. S., Qi, M., Ha, J. K., & Forsberg, C. W. Fibrobacter succinogenes, a dominant fi-brolytic ruminal bacterium: transition to the post genomic era. Asian Australasian Jour-nal Of Animal Sciences, 20(5), 802, 2007. <https://www.ajas.info/upload/pdf/20-112. pdf.> Acessoem 25 de maio de 2017.
KIKUNI, n.b.t.; Schilcher, h. Electron microscopic and microcalorimetric investigations of the possible mechanism of antibacterial action of a defined propolisproveance. Planta Medicinal, v.60, p. 222-227, 1993. Disponível em: <https://www.thieme-connect.com/ ejournals/pdf/10.1055/s-2006-959463.pdf>. acesso em 22 de out. 2012.
Keskin, N.,Hazir,S.;Baser,K.H.C.; et al.Antibacterial Activity and Chemical Composition of Turkish Propolis. Zeitschriftfur Naturforschung, vol.56, p.111-112, 2001.Disponível em: <http://www.ncbi.nlm.nih.gov/pubmed/11837665>. Acesso em 10 de out. 2012. MIRZOEVA, O.K.; GRISHANIN, R.N.; CALDER, P.C. Antimicrobial action of propolis and some of its components: the effects on growth, membrane potencial and motility of bac-teria. Microbiology Research, v.152, n.3, p.239-246, 1997. Disponível em: <http://www. ncbi.nlm.nih.gov/pubmed/9352659>. Acesso em14 de out. 2012.
Nagaraja, T.G. and Taylor, M.B.Susceptibility and Resistance of Ruminal Bacteria to Antimi-crobial Feed Additivest . Applied and Environmental Microbiology, p.1620-1625, 1987. Disponívelem: <http://www.researchgate.net/publication/20039217_Susceptibility_and_re-sistance_of_ruminal_bacteria_to_antimicrobial_feed_additives.> Acesso em 01 de out. 2012. NRC - Nutrient requirements of dairy cattle. 6. ed. Rev.atual. Washington, 1989. OLIVEIRA, J.S.; LANA, R.P.; BORGES, A.C.; et al. Efeito da monensina e extrato de própo-lis sobre a produção de amônia e degradabilidade in vitro da proteína bruta de diferentes fontes de nitrogênio. Revista Brasileira de Zootecnia, v. 33, p. 504-510,2004. Disponível em: <http://www.scielo.br/pdf/rbz/v33n2/21265.pdf>. Acesso em 29 de out. 2012.
84
OLIVEIRA, J.S.; ZANINI, A.M.; SANTOS, E.M. Uso de aditivos na nutrição de ruminan-tes. REDVET, v.6, n. 9, 2005. Disponível em: <http://www.veterinaria.org/revistas/redvet/ n111105/110505.pdf>. Acesso em 30 de out. 2012.
OLIVEIRA, S. J.; QUEIROZ, S. A.; LANA, P. R. Efeito da monensina e da própolis sobre a atividade de fermentação de aminoácidos in vitro pelos microrganismos ruminais. Revista brasileira de Zootecnia, v.35, n.1, p. 275-281, 2006. Disponível em: <http://www.scielo.br/ scielo.php?script=sci_arttext&pid=S1516-35982006000100035>. Acesso em 07 de out. 2012. OLIVEIRA, J.S.; ZANINI, A.M.; SANTOS, E.M. Diversidade microbiana no ecossistema ru-minal. REDVET, v.8, n. 6, 2007. Disponível em: <http://www.veterinaria.org/revistas/red-vet/n060607/060703.pdf>. Acesso em 11 de out. 2012.
Prado, O.P.P.;Zeoula,L.M.; Moura, L.P.P.; et al. Isolamento e caracterização expedita morfo-lógica, bioquímica e cinética de bactérias ruminais tolerantes a própolis. Revista Brasileira de Zootecnia, v.39, n.9, p. 2048-2054, 2010. Disponível em: <http://www.scielo.br/scielo. php?pid=S1516-35982010000900025&script=sci_arttext>. Acesso em 11 de out. 2012. Palmquist, D.L.Digestibility of cotton lint fiber and whole oilseeds by ruminal microorganis-ms. Animal Feed Science Technology, v.56, p.23l-242, 1995. Disponível em: <http://www. sciencedirect.com/science/article/pii/0377840195008306>. Acesso em 16 de out. 2012. Pinto, M.S.;Faria, J.E.; Message,D.;et al.Efeito de extratos de própolis verde sobre bactérias patogênicas isoladas do leite de vacas com mastite. Brazilian Journal of Veterinary Re-search and Animal Science. v.38, n.6, 2001.Disponível em: <http://www.scielo.br/scielo. php?script=sci_arttext&pid=S1413-95962001000600006>. Acessoem15 de out. 2012. Russell, J. B.Protonmotive Force Ruminant Bacterial Growth: Effects on Ion Flux and A Proposed Mechanism of Monensin Action in Inhibiting. Journal of Animal Science, v.64, p.1519-1525, 1987. Disponível em: <http://www.animal-science.org/content/64/5/1519. short>. Acesso em 15 de out. 2012.
Russell, J. B. Rumen Microbiology and its role ruminant nutrition. Ithaca, 2002. NY.119p. Stradiotti Jr, D.; Queiroz, A.C.; Lana,R.P.; et al.Ação do extrato de própolis sobre a fermen-tação in vitro de diferentes alimentos pela técnica de produção de gases. Revista Brasileira de Zootecnia, v.33, n.4, p.1093-1099, 2004. Disponível em: <http://www.scielo.br/scielo. php?script=sci_arttext&pid=S1516-35982004000400030>. Acessoem 02 de out. 2012. Tajima, K., Aminov, R.I.; Nagamine, T.Diet-Dependent Shifts in the Bacterial Population of the Rúmen Revealed with Real-Time PCR. Appliedand Envonmental Microbiology, v.67, n.6 p.2766-2774, 2001. Disponível em: <http://aem.asm.org/content/67/6/2766. full.pdf+html>. Acesso em 03 de out. 2012.
85
Valinote, AC.; Nogueira Filho, JCM.; Leme, PR. et al.Fontes de lipídeos e monensina na alimentação de novilhos nelore e sua relação com apopulação de protozoários ciliados do rúmen1. Revista Brasileira de Zootecnia, v.34, n.4, p.1418-1423, 2005. Disponível em: <http://www.scielo.br/pdf/rbz/v34n4/26415.pdf>. Acessoem02 de out. 2012.
Whitford, M.F.; Forster, R.J.; Beard, C.E.; et al.Phylogenicanalises of rúmen bacteria by com-parative sequence analyses of cloned 16s rRNA genes. Anaerobe. v.4, p.153-163, 1998. Dis-ponível em: <http://www.sciencedirect.com/science/article/pii/S107599649890155X>. Acesso em 25 de out. 2012.