QUIM II – MATERIAIS – P3 – 1S 2017
1) Compare e explique o que ocorrerá com a temperatura de duas amostras após cada uma ganhar 1200J de calor em volume constantes. Sabendo-se que uma amostra é 1 mol de N2 e a outra é 1 mol de CH4, que estão em balões idênticos nas separados, cuja temperatura inicial é 500 K.
2) É liberado uma energia de 67 kJ.mol-1 na formação do trinitro-tolueno (TNT). Sabendo-se que a densidade do TNT é igual a 1,65 g.cm-3, calcule a entalpia liberada por litro na queima completa do TNT, cuja fórmula molecular é C7H5N3O6.
3) Analise e discuta a transformação cis-trans do ácido maléico (cis-1,4-butanodióico) em ácido fumárico (trans-1,4-butanodiócio), sabendo-se que na combustão do ácido maléico e do ácido fumárico é liberado, respectivamente, 1355,2 kJ.mol-1 e 1334,7 kJ.mol-1.
ácido fumárico ácido maléico
4) Os amino-ácidos são oxidados por oxigênio molecular, dentro dos organismos vivos, produzindo uréia sólida, CO(NH2)2, gás carbônico e água líquida.
a) Calcule a entalpia da oxidação da glicina sólida, C2H5O2N, e da alanina sólida, C3H7O2N, utilizando a entalpias de formação da tabela do apêndice 2.
b) Compare e analise a espontaneidade entre as reações do ponto de vista entálpico e entrópico.
5) Analise os dados da Tabela de capacidades caloríficas (Cp) abaixo e responda: Substância Cp (J.oC-1.g-1)
Água sólida 2,03
Água gasosa 2,01
Água líquida 4,184
Etanol líquido 2,42
a) Explique porque a água sólida apresenta um Cp próximo do Cp da água gasosa.
b) Explique porque o Cp da água líquida é aproximadamente o dobro dos valores de capacidade calorífica da água sólida.
c) Explique porque a água líquida apresenta maior capacidade calorífica específica que o etanol líquido.
QUIM II / Materiais – Prova 3 – 2S/2016
1) Explique a teoria das Colisões e porque ela não é adequada para sistemas reais e a teoria do Complexo ativado nesse contexto.
2) O dissulfeto de carbono pode ser preparado a partir de coque (uma forma impura de carbono) e do enxofre elementar:
4 C(s) + S8(s) 4 CS2(l) Ho = +358,8 kJ
(a) Calcule o calor absorvido na reação de 197g de carbono com excesso de enxofre. (b) Se o calor fornecido para a reação for de 415 kJ, quantos mols de CS2 serão produzido?
3) Calcule a entalpia de formação do Trinitro-tolueno (TNT, C7H5N3O6), sabendo-se que a explosão (queima
completa) de 1Kg de TNT libera 14503KJ de energia.
Dados : Hf0 (H2O(g)) = -241,82 kJ/mol, Hf0 (CO2 (g)) = -393,51 kJ/mol
4) Observe os dados da Tabela abaixo e responda:
Cp (J.ºC-1.g-1) Cp
m (J.K-1.mol-1) Hvapº (kJ/mol)
Água líquida 4,184 43,5
Benzeno líquido 136 30,8
a) Complete os dados da Tabela, apresente todas as contas necessárias.
b) Após o preenchimento da Tabela, explique a diferença entre os valores de Cp.
c) Após o preenchimento da Tabela, explique a diferença entre os valores de Cpm.
d) Explique a diferença entre o calor específico molar e a entalpia de vaporização.
4) Duas amostras, uma de 1 mol de N2 e a outra de 1 mol de CH4, estão em balões idênticos nas separados,
cuja temperatura é 500 K. Cada um deles ganha 1200 J de calor em volume constante.
a) Será que a temperatura final das duas amostras é a mesma? Se não, qual dos dois chega à temperatura mais alta? Justifique o seu raciocínio.
b) Esse calor medido é a entalpia, energia interna ou o calor? Justifique o seu raciocínio, baseando-se na análise das seguintes equações:
𝐶 =∆𝑇 , 𝑠𝑜𝑏 𝑣á𝑐𝑢𝑜𝑞 𝐶𝑣=∆𝑈
∆𝑇 , 𝑝𝑎𝑟𝑎 𝑣𝑜𝑙𝑢𝑚𝑒 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒 𝐶𝑝= ∆𝐻
MATERIAIS - QUIM II P3 2S 2014
1) Explique a diferença na capacidade calorífica entre a água sólida (2,03 J.(
oC)
-1.g
-1), líquida
(4,184 J.(
oC)
-1.g
-1) e gasosa (2,01 J.(
oC)
-1.g
-1).
2) Duas amostras, uma de 1 mol de N2 e a outra de 1 mol de CH4, estão em balões idênticos e separados,
cuja temperatura é 500 K. Cada um deles ganha 1200 J de calor em volume constante.
a) Será que a temperatura final das duas amostras é a mesma? Se não, qual dos dois chega à temperatura mais alta? Justifique o seu raciocínio.
b) Esse calor medido é a entalpia? Justifique o seu raciocínio.
3) Calcule a entalpia de reação da formação do cloreto de alumínio anidro, a partir da reação do alumínio metálico com gás cloro. Utilize as seguintes informações:
a reação de um mol de alumínio metálico com ácido clorídrico aquoso com a formação de cloreto
de alumínio aquoso e gás hidrogênio libera 1049 kJ de energia;
a transformação de 1 mol de cloreto de hidrogênio gasoso em ácido clorídrico aquoso libera 74,8 kJ
de energia;
a reação de 1 mol de gás hidrogênio com gás cloro com a formação de cloreto de hidrogênio
gasoso libera 185 kJ de energia;
a transformação de 1 mol de cloreto de alumínio anidro sólido em cloreto de alumínio aquoso
libera 323 kJ de energia.
4) Sabendo-se que a explosão (queima completa) de 1Kg de Trinitro-tolueno sólido (TNT, C7H5N3O6) libera
14503KJ de energia e a entalpia de formação padrão da água e do gás carbônico são, respectivamente, -241,82 kJ/mol e -393,51 kJ/mol, responda:
a) Escreva a reação balanceada da explosão de 1 kg de TNT com a sua respectiva energia liberada;
b) Calcule a entalpia de formação padrão do TNT sólido.
5) Uma amostra de água do mar contém cátions de magnésio 0,050 mol.L-1 e cátons de cálcio 0,010 mol.L-1.
Use as informações da Tabela 11.4 para:
a) determinar e justificar a ordem em que cada íon precipita com a adição progressiva de hidróxido de sódio sólido.
Química II – P3 – 1S/2014
Questão 1.
Duas amostras, uma de 1 mol N2 e a outra de 1 mol CH4, estão em balões idênticos mas separados,
cuja temperatura é 500 K. Cada um deles ganha 1200 J de calor em volume constante. Faça uma análise comparativa entre essas amostras.
Questão 2.
As entalpias padrão de combustão da grafita e do diamante são -393,51 KJ.mol-1 e -395,41 KJ.mol-1, respectivamente. Calcule a variação na entalpia molar da transição grafita → diamante.
Questão 3.
Explique detalhadamente o significado do resultado obtido na questão 2.
Questão 4.
Analise os dados da Tabela de capacidades caloríficas (Cp) abaixo e responda:
Substância Cp (J.oC-1.g-1) Cp (J.K. mol-1)
Água sólida 2,03
Água gasosa 2,01
Água líquida 4,184
Etanol líquido 2,42
e) Explique porque a água sólida apresenta um Cp próxido do Cp da água gasosa.
f) Explique porque o Cp da água líquida é aproximadamente o dobro dos valores de capacidade calorífica da água sólida.
g) Calcule a capacidade calorífica molar da todas as substâncias e preencha a Tabela.
h) Explique porque a água líquida apresenta maior capacidade calorífica específica que o etanol líquido.
Química II – P3 – 2S/2013
Q
nF
RT
E
E
o
ln
,t
F
n
t
Q
i
.
, R = 8,315 J.K-1.mo1-1, F = 96485 C.mol-11) Num banho eletrolítico, conectou-se no anodo um pedaço de fio de cobre e no catodo um pedaço de
arame de ferro. O peso inicial do fio de cobre era de 1,5432 g e do pedaço de arame era de 0,7347
g. O banho eletrolítico foi inicialmente preparado com 2,0 g de NaCl em 25 ml de água destilada com
pH = 7. Em seguida, realizou-se uma eletrólise com um conversor de voltagem de 12 V e 500 mA.
Após 20 minutos de eletrolise, responda:
a) Estime o valor teórico da massa do fio de cobre e do pedaço de arame.
b) Qual será o pH do meio? Explique.
c) Escreva todas as reações de oxido-redução que poderiam ocorrer na eletrólise descrita.
d) Explique porque não é possível ocorrer a formação do sódio metálico nesse sistema.
2) Com relação ao sistema da questão 1, quanto tempo aproximadamente seria necessário para
terminar o processo de eletrólise do sistema proposto? Explique.
3) Calcule a massa estequiométrica de alumínio metálico que poderia reagir com 25 mL de ácido nítrico
2 molar.
4) Explique a resistência química dos aços inoxidáveis e porque essa resistência diminui no cordão de
solda.
5) Escreva todas as etapas (mecanismo) da corrosão do ferro exposto ao ambiente e explique como a
formação da ferrugem acelera o processo de corrosão. Sabendo que a etapa da formação da
ferrugem é da seguinte forma: 2Fe3+
Química II – P3 – 1S/2013
1) A oxidação de nitrogênio gerado no exaustor quente de motores de jatos e de automóveis ocorre pela reação: N2 (g) + O2 (g) 2 NO (g) Hº= +180,6 kJ
a. Calcule o calor envolvido na formação de 1,55 mol de NO.
b. Quando a oxidação do nitrogênio a monóxido de nitrogênio foi completada em um calorímetro de bomba, o calor absorvido medido foi igual a 492 J. Calcule a massa de nitrogênio oxidada.
c. Calcule o calor absorvido na oxidação de 5,45 L de nitrogênio, em 1,00 atm a 0ºC.
2) As entalpias de combustão da grafita e do diamante são, respectivamente, -393,51 kJ/mol e -395,41 kJ/mol. A entalpia molar da transição grafita diamante é endotérmica ou exotérmica? Calcule o valor dessa entalpia e relacione o valor obtido com a mudança na estrutura da matéria.
3) Observe os dados abaixo e responda:
Cp (J.ºC-1.g-1) Cp
m (J.K-1.mol-1) Hvapº (kJ/mol)
Água líquida 4,184 75 43,5
Benzeno líquido 1,05 136 30,8
a. Interprete o Cp entre a água líquida e o benzeno e explique a diferença nesses valores.
b. Interprete o Cpm entre a água líquida e o benzeno e explique a diferença nesses
valores.
c. Explique a diferença entre o calor específico molar e a entalpia de vaporização. d. Explique a diferença entre os valores de Hvapº entre a água e o benzeno.
4) Entre a água líquida e o benzeno líquido, qual dessas substâncias apresenta maior entropia? De acordo com a sua resposta, o calor específico é diretamente proporcional ou inversamente proporcional com a entropia? Explique todo o seu raciocínio.
5) Para entender como uma reação química acontece é necessário analisar as variáveis termodinâmicas e cinéticas. Explique esta afirmação.
QUIM II – Prova 3 – 2S/2012 Tabela 1.
Capacidade calorífica Hvaporização Hfusão
Substâncias J.(oC)-1.g-1 J.K-1.mol-1 kJ.mol-1 kJ.mol-1
água
2,03 (sólido)
44,0 6,01 4,184 (líquido)
2,01 (vapor)
benzeno 1,05 (líquido) 30,8 10,59
1) Explique a diferença na capacidade calorífica entre a água sólida, líquida e gasosa.
2) Qual é a diferença entre Hfusão e Hvaporização com a capacidade calorífica? Explique a partir da comparação entre água e benzeno.
3) Por que a capacidade calorífica das substâncias pode ser descrita por três equações matemáticas diferentes dependendo das condições experimentais?
𝐶 =∆𝑇𝑞 , 𝑠𝑜𝑏 𝑣á𝑐𝑢𝑜 𝐶𝑣=∆𝑇∆𝑈, 𝑝𝑎𝑟𝑎 𝑣𝑜𝑙𝑢𝑚𝑒 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒 𝐶𝑝=∆𝐻∆𝑇, 𝑝𝑎𝑟𝑎 𝑝𝑟𝑒𝑠𝑠ã𝑜 𝑐𝑜𝑛𝑠𝑡𝑎𝑛𝑡𝑒
4) Analise e compare as velocidades de consumo dos reagentes e velocidade da reação global entre a reação de neutralização de ácido sulfúrico com hidróxido de alumínio com a reação de neutralização de ácido sulfúrico com hidróxido de sódio.
5) Quais são os principais fatores que influenciam a velocidade de uma reação e qual a relação desses fatores com as teoria das Colisões e a teoria do Complexo ativado?
QUIM II – Prova 3 – 1S/2012
1) A glicina (NH2CH2COOH) sólida pode reagir com o oxigênio, no organismo, formando a uréia
(H2NCONH2) sólida, dióxido de carbono gasoso e água líquida. Será que essa reação é uma fonte
de calor para o corpo? Justifique.
2) Quando 0,113 g de benzeno, C6H6, queimam em excesso de oxigênio, em um calorímetro de
pressão constante calibrado, cuja capacidade calorífica é de 551 J/oC, a temperatura do
calorímetro aumenta 8,60 oC. Escreva a equação termoquímica e calcule a entalpia da reação da
equação balanceada.
2A B + C
, a constante de velocidade da reação direta de formação de B é 265 L.mol-1.min-1,
e a constante da velocidade da reação inversa é 392 L.mol-1.min-1. A energia de ativação da
reação direta é 39,7 kJ.mol-1 e a da reação inversa é 25,4 kJ.mol-1. Calcule a constante de
equilíbrio e discuta sobre o seu valor, relacionando com as concentrações dos produtos e reagentes e as constantes de velocidade.
4) Analise e discuta as seguintes afirmações.
(a) Um catalisador muda a trajetória de uma reação de modo a torná-la mais exotérmica.
(b) Um catalisador deve ser cuidadosamente escolhido de modo a aumentar a quantidade de produtos.
5) Considere a reação: C4H9Br(aq) + OH-(aq) → C4H9OH(aq) + Br-(aq).
Quando a concentração de C4H9Br dobra, a velocidade da reação aumenta 2 vezes.
Quando as concentrações de C4H9Br e OH-1 dobram, o aumento da velocidade é o mesmo, isto é,
duas vezes. Determine a ordem da velocidade de cada reagente e interprete o seu significado com relação à velocidade de reação.
QUIM II – Prova 3 – 1S/2011
1) Calcule a entalpia de reação da formação do cloreto de alumínio anidro, 2 Al(s) + 3 Cl2(g)→ 2 AlCl3(s) a partir dos seguintes dados:
2Al(s) + 6 HCl(aq)→ 2 AlCl3(aq) + 3H2(g) ∆Ho = -1049 KJ HCl(g)→ HCl(aq) ∆Ho = -74,8 KJ H2(g) + Cl2(g)→ 2 HCl(g) ∆Ho = -185 KJ AlCl3(s)→ AlCl3(aq) ∆Ho = -323 KJ
2) Calcule a entalpia de formação do Trinitro-tolueno (TNT), sabendo-se que a explosão (queima completa) de 1Kg de TNT libera 14503KJ de energia.
4 C7H5N3O6(s) + 21 O2(g)→ 28 CO2(g) + 10 H2O(g) + 6 N2(g)
Dados : Hf0 (H2O(g)) = -241,82 kJ/mol, Hf0 (CO2 (g)) = -393,51 kJ/mol
a) Será que a temperatura final das duas amostras é a mesma? Se não, qual dos dois chega à temperatura mais alta? Justifique o seu raciocínio.
b) Esse calor medido é a entalpia? Justifique o seu raciocínio.
4) Na reação reversível, em uma etapa,
2A B + C
, a constante de velocidade da reação direta de formação de B é 265 L.mol-1.min-1, e a constante da velocidade da reação inversa é 392 L.mol-1.min-1. A energia de ativação da reação direta é 39,7 kJ.mol-1 e a da reação inversa é 25,4 kJ.mol-1.
a) Explique se o valor da constante de equilíbrio deve ser maior, menor ou igual a 1, sem utilizar relações matemáticas e somente através da análise conceitual dos valores da constante de velocidade e da energia de ativação apresentados.
b) Qual e a ordem da reação inversa e direta? Justifique a sua resposta.
5) Explique o que é a teoria das colisões e quais são suas contribuições e limitações com relação a sistemas reais?
QUIM II – Prova 3 – 2S/2010
2Al(s) + 6 HCl(aq)→ 2 AlCl3(aq) + 3H2(g) ∆H = -1049 kJ
AlCl3(s)→ AlCl3(aq) ∆H = -323 KJ
HCl(g)→ HCl(aq) ∆H = -74,8 KJ
H2(g) + Cl2(g)→ 2 HCl(g) ∆H = -185 KJ
2 NO(g) + 3 O2(g) 2N2O5(g) H = -338,2 kJ
Hf0 (NO) = +90,25 kJ/mol
Hf0 (NO2) = +33,18 kJ/mol R = 0,082 L.atm.mol-1.K-1
Questão 1.
Calcule o calor envolvido na reação de óxido-redução de 150 g de alumínio com 150 g de gás cloro, cujo o produto é o cloreto de alumínio sólido.
Questão 2.
Num experimento, qual será o calor medido da decomposição completa de 20L de gás N2O5, a 2,5 atm e 20oC, sabendo-se que os produtos formados são dióxido de nitrogênio gasoso e oxigênio gasoso?
Questão 3.
Analise, discuta e explique os valores da tabela abaixo relacionando com a estrutura da matéria. Sólidos (J.g-1.K-1) (J.mol-1.K-1)
Ouro, Au 0,129 25,4 Carbono grafite, Cgr 0,685 8,23
Questão 4.
Em cinética química, para uma reação do tipo aA + bB → cC
o que significa a ordem de uma reação? Como se determina a ordem de uma reação? O que significa reações de ordem zero, primeira ordem, segunda ordem e ordem negativa?
Questão 5.
De acordo com as teorias termodinâmicas e cinéticas, quais são os requisitos para que uma reação ocorra. Justifique sua resposta.
QUIM II – Prova 3 – 2S/2010
2Al(s) + 6 HCl(aq)→ 2 AlCl3(aq) + 3H2(g) ∆H = -1049 kJ
AlCl3(s)→ AlCl3(aq) ∆H = -323 KJ
HCl(g)→ HCl(aq) ∆H = -74,8 KJ
H2(g) + Cl2(g)→ 2 HCl(g) ∆H = -185 KJ
2 NO(g) + 3 O2(g) 2N2O5(g) H = -338,2 kJ
Hf0 (NO) = +90,25 kJ/mol
Hf0 (NO2) = +33,18 kJ/mol
R = 0,082 L.atm.mol-1.K-1
Questão 1.
Calcule o calor envolvido na reação de óxido-redução de 150 g de alumínio com 150 g de gás cloro, cujo o produto é o cloreto de alumínio sólido.
Questão 2.
Num experimento, qual será o calor medido da decomposição completa de 20L de N2O5, a 2,5 atm e 20oC?
2 N2O5(g) 4 NO2(g) + O2(g)
Questão 3.
Analise, discuta e explique os valores da tabela abaixo relacionando com a estrutura da matéria. Sólidos (J.g-1.K-1) (J.mol-1.K-1)
Alumínio, Al 0,897 24,2
Ferro, Fe 0,444 25.1
Ouro, Au 0,129 25,4
Carbono grafite, Cgr 0,685 8,23
Questão 4.
Questão 5.
De acordo com as teorias termodinâmicas e cinéticas, quais são os requisitos para que uma reação ocorra. Justifique sua resposta.
Química II - Prova 3 – 11/12/2008 1) Na reação reversível, em uma etapa,
2A B + C
, a constante de velocidade da reação direta de formação de B é 265 L.mol-1.min-1, e a constante da velocidade da reação inversa é 392 L.mol-1.min-1. A energia de ativação da reação direta é
39,7 kJ.mol-1 e a da reação inversa é 25,4 kJ.mol-1. (a) Qual é a constante de equilíbrio da reação?
(b) A reação é exotérmica ou endotérmica?
(c) Qual será o efeito do aumento da temperatura nas constantes de velocidades direta e inversa e na constante de equilíbrio?
2) Indique quais das seguintes declarações sobre catálise são verdadeiras. Se a declaração for falsa, explique por quê.
(a) A constante de equilíbrio de uma reação é maior na presença de um catalisador, mas as constantes de velocidade das reações diretas e inversa diminuem.
(b) O catalisador não é consumido durante a reação.
(c) Um catalisador muda a trajetória de uma reação de modo a torná-la mais exotérmica..
(d) Um catalisador deve ser cuidadosamente escolhido de modo a mudar o equilíbrio na direção dos produtos.
3) Complete as afirmações seguintes, relativas à produção de amônia pelo processo Haber, cuja reação total é N2(g) + 3 H2(g) 2 NH3(g).
(a) A velocidade de desaparecimento de N2 é ______ vezes a velocidade de desaparecimento de H2. (b) A velocidade de formação de NH3 é _____ vezes a velocidade de desaparecimento de H2.
(c) A velocidade de formação de NH3 é _____ vezes a velocidade de desaparecimento de N2.
4) O dissulfeto de carbono pode ser preparado a partir de coque (uma forma impura de carbono) e do enxofre elementar:
4 C(s) + S8(s) 4 CS2(l) Ho = +358,8 kJ (a) Qual é o calor absorvido na reação de 1,25 mol de S8?
(b) Calcule o calor absorvido na reação de 197g de carbono com excesso de enxofre. (c) Se o calor absorvido na reação foi de 415 kJ, quanto CS2 foi produzido?
N2(g) + 2 O2(g) 2 NO2(g) Ho = +66,4 kJ Calcule a entalpia de reação da oxidação do óxido nítrico e dióxido de nitrogênio.
2 NO(g) + O2(g) 2 NO2(g)
QUIM II – Prova 3 – 1S/2009
1a) Calcule a entalpia de decomposição do pentóxido de dinitrogênio.
2 N2O5(g) 4 NO2(g) + O2(g)
A partir das seguintes reações:
NO(g) + 3/2 O2(g) N2O5 H = -169,2 KJ
2 NO(g) + O2(g) 2 NO2
1b) Num experimento, uma quantidade de N2O5 foi colocado num recipiente de 0,750L. O calor medido da
decomposição completa de N2O5 foi de 5405 J. Calcule a quantidade de pentóxido de dinitrogênio inicial.
1c) Qual é a lei de velocidade, o valor da velocidade inicial, e o tempo de meia vida da decomposição de
N2O5 do experimento do item 1b, sabendo-se que a constante de velocidade dessa decomposição, na
temperatura do experimento, é de 5,2 x 10-3 s-1.
2) Concorde ou discorde das seguintes afirmativas e explique por quê.
a) No equilíbrio, as constantes de velocidade das reações direta e inversa são iguais.
b) O aumento da concentração de um reagente aumenta a velocidade de uma reação porque aumenta a
constante de equilíbrio da reação direta.
c) A constante de equilíbrio de uma reação é maior na presença de um catalisador, mas as constantes de
velocidade das reações diretas e inversa diminuem.
d) Um catalisador muda a trajetória de uma reação de modo a torná-la mais exotérmica.
3) Os dados da reação CO(g) + NO2(g) CO2(g) + NO(g) estão organizados na tabela abaixo:
Experimento Concentração (mol/L) velocidade inicial
(mol.L-1.h)
[CO] [NO2]
1 5,0 x 10-4 0,36 x 10-4 3,4 x 10-8
2 5,0 x 10-4 0,18 x 10-4 1,7 x 10-8
3 1,0 x 10-3 0,36 x 10-4 6,8 x 10-8
4 1,5 x 10-3 0,72 x 10-4 ?
a) Qual é a lei de velocidade da reação, a constante de velocidade e a velocidade inicial do experimento 4?
b) Qual é a entalpia da reação?
c) Se a reação inversa puder ocorrer, o aumento da velocidade de reação com o aumento da temperatura é
QUIM II – Prova 3 – 2S/2009 Dados: Hf0 (NO) = +90,25 kJ/mol
Hf0 (NO2) = +33,18 kJ/mol
2 NO(g) + 3 O2(g) 2N2O5(g) H = -338,2 kJ
CO(g) + 3H2(g) CH4 (g) + H2O(g) H = -206,10 kJ
2H2(g) + CO(g) CH3OH(l) H = -128,33 kJ
2H2(g) + O2(g) 2H2O(g) H = - 483,64 kJ
1) O metanol é um combustível líquido de queima limpa, que está sendo considerado substituto da gasolina. Suponha que ele pode ser produzido na reação controlada de oxigênio do ar com metano.
(a) Determine a entalpia padrão de reação da formação de 1 mol de CH3OH(l) a partir de metano e oxigênio.
(b) Qual é o volume de oxigênio necessário para reagir com metano e produzir metanol, quando a energia envolvida na reação for de 250 kJ. Considere 25 0C e 1 atm.
2) Considere a reação de decomposição do pentóxido de dinitrogênio: 2 N2O5(g) 4 NO2(g) + O2(g)
a) Calcule a entalpia da reação decomposição.
b) Num experimento, uma quantidade de N2O5 foi colocado num recipiente de 0,750L. O calor medido da
decomposição completa de N2O5 foi de 5405 J. Calcule a concentração molar de pentóxido de dinitrogênio inicial. c) A velocidade de formação de NO2 é ______ vezes a velocidade de decomposição de N2O5. Por quê?
d) Sabendo-se que a constante de velocidade dessa decomposição, na temperatura do experimento, é de 5,2 x 10-3 s-1, qual é a lei de velocidade, o valor da velocidade inicial, e o tempo de meia vida da decomposição de N2O5 do
experimento do item b.
3) Concorde ou discorde das seguintes afirmativas e justifique.
a) No equilíbrio, as constantes de velocidade das reações direta e inversa são iguais.
b) O aumento da concentração de um reagente aumenta a velocidade de uma reação porque aumenta a constante de equilíbrio da reação direta.
c) A constante de equilíbrio de uma reação é maior na presença de um catalisador, mas as constantes de velocidade das reações diretas e inversa diminuem.
d) Um catalisador muda a trajetória de uma reação de modo a torná-la mais exotérmica.
4) Explique pela termodinâmica o que é entalpia e qual a sua relação com a energia interna do sistema.
6) Qual é a diferença entre um intermediário e um estado de transição?
QUIM II – Prova 3 – 1S/2010
1) Calcule a entalpia de reação da formação do cloreto de alumínio anidro, 2 Al(s) + 3 Cl2(g)→ 2 AlCl3(s), a partir dos
seguintes dados:
2Al(s) + 6 HCl(aq)→ 2 AlCl3(aq) + 3H2(g) ∆Ho = -1049 KJ
HCl(g)→ HCl(aq) ∆Ho = -74,8 KJ
H2(g) + Cl2(g)→ 2 HCl(g) ∆Ho = -185 KJ
AlCl3(s)→ AlCl3(aq) ∆Ho = -323 KJ
2) Calcule a entalpia de formação do Trinitro-tolueno (TNT), sabendo-se que a explosão (queima completa) de 1Kg de TNT libera 14503KJ de energia.
4 C7H5N3O6(s) + 21 O2(g)→ 28 CO2(g) + 10 H2O(g) + 6 N2(g)
Dados : Hf0 (H2O(g)) = -241,82 kJ/mol, Hf0 (CO2 (g)) = -393,51 kJ/mol
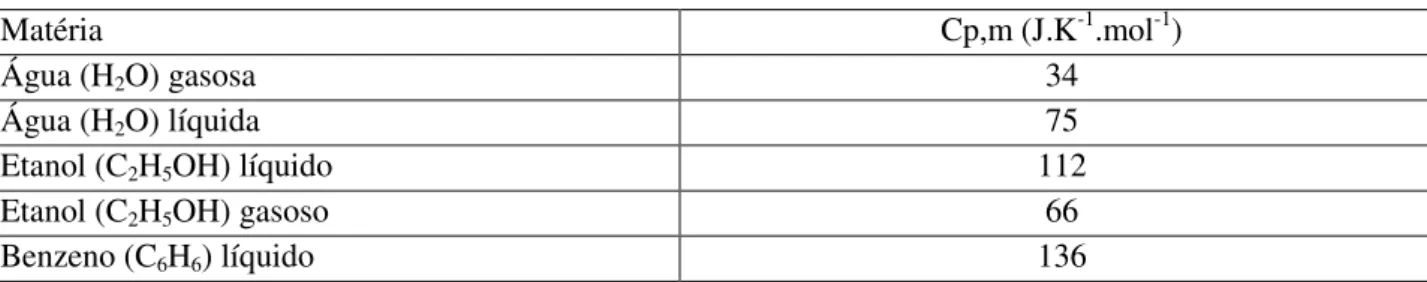
3) Sabendo-se que a capacidade calorífica é a relação entre variação de energia com a variação de temperatura e que pode ser descrita por: 𝐶 = 𝑞
∆𝑇 , 𝑜𝑢 𝐶𝑣= ∆𝑈
∆𝑇, 𝑜𝑢 𝐶𝑝= ∆𝐻 ∆𝑇 a) Explique o que é a entalpia e qual a sua aplicação prática, de um modo geral.
b) A partir da interpretação das equações acima e dos dados da tabela abaixo, defina o que é a capacidade calorífica em termos da estrutura química e física da matéria.
Tabela 1. Capacidade calorífica molar de algumas substâncias.
Matéria Cp,m (J.K-1.mol-1)
Água (H2O) gasosa 34
Água (H2O) líquida 75
Etanol (C2H5OH) líquido 112
Etanol (C2H5OH) gasoso 66
Benzeno (C6H6) líquido 136
4) Na reação reversível, em uma etapa,
2A B + C
, a constante de velocidade da reação direta de formação de B é 265 L.mol-1.min-1, e a constante da velocidade da reação inversa é 392 L.mol-1.min-1. A energia de ativação da reação direta é 39,7 kJ.mol-1 e a da reação inversa é 25,4 kJ.mol-1.
a) Calcule a constante de equilíbrio químico e interprete equilíbrio químico em função da cinética de reação. b) Defina e explique se a reação direta é endotérmica ou exotérmica.
c) Dê duas explicações do efeito do aumento da temperatura na concentração de reagentes e produtos: uma explicação pela cinética química, sabendo-se que 𝑙𝑛𝑘 = 𝑙𝑛𝐴 −𝐸𝑎
5) Explique o que é exigência estérica e complexo ativado? Qual a origem dessas duas definições?
Química II - Prova 3 – 11/12/2008
4) O dissulfeto de carbono pode ser preparado a partir de coque (uma forma impura de carbono) e do enxofre elementar:
4 C(s) + S8(s) 4 CS2(l) Ho = +358,8 kJ (a) Qual é o calor absorvido na reação de 1,25 mol de S8?
(b) Calcule o calor absorvido na reação de 197g de carbono com excesso de enxofre. (c) Se o calor absorvido na reação foi de 415 kJ, quanto CS2 foi produzido?
5) Na preparação de ácido nítrico pela oxidação da amônia, o primeiro produto é óxido nítrico, que é depois oxidado a dióxido de nitrogênio. A partir das entalpias padrão de reação,
N2(g) + O2(g) 2 NO(g) Ho = +180,5 kJ N2(g) + 2 O2(g) 2 NO2(g) Ho = +66,4 kJ Calcule a entalpia de reação da oxidação do óxido nítrico e dióxido de nitrogênio.
2 NO(g) + O2(g) 2 NO2(g)
1a) Calcule a entalpia de decomposição do pentóxido de dinitrogênio.
2 N2O5(g) 4 NO2(g) + O2(g)
A partir das seguintes reações:
NO(g) + 3/2 O2(g) N2O5 H = -169,2 KJ
2 NO(g) + O2(g) 2 NO2
1b) Num experimento, uma quantidade de N2O5 foi colocado num recipiente de 0,750L. O calor medido da
decomposição completa de N2O5 foi de 5405 J. Calcule a quantidade de pentóxido de dinitrogênio inicial.
5) Na preparação de ácido nítrico, o primeiro produto é óxido nítrico, que é depois oxidado a dióxido de nitrogênio.
2 NO(g) + O2(g) 2 NO2(g)
Determine se a reação é endotérmica ou exotérmica e calcule o calor da reação de 5,0 L de óxido nitrico, a 1 atm e 25oC, com excesso de oxigênio. Sabendo-se que:
2 N2O5(g) 4 NO2(g) + O2(g) REAÇÃO 1
a) Calcule a entalpia da reação a partir da reação 2:
2 NO(g) + 3/2 O2(g) N2O5 H = -169,2 KJ REAÇÃO 2
b) No experimento, calor medido da decomposição completa de N2O5 foi de 5405 J. Calcule a quantidade em
massa de pentóxido de dinitrogênio inicial da REAÇÃO 1.
Dados: Hf0 (NO) = +90,25 kJ/mol
Hf0 (NO2) = +33,18 kJ/mol
2 NO(g) + 3 O2(g) 2N2O5(g) H = -338,2 kJ
CO(g) + 3H2(g) CH4 (g) + H2O(g) H = -206,10 kJ
2H2(g) + CO(g) CH3OH(l) H = -128,33 kJ
2H2(g) + O2(g) 2H2O(g) H = - 483,64 kJ
1) O metanol é um combustível líquido de queima limpa, que está sendo considerado substituto da gasolina. Suponha que ele pode ser produzido na reação controlada de oxigênio do ar com metano.
(a) Determine a entalpia padrão de reação da formação de 1 mol de CH3OH(l) a partir de metano e oxigênio.
(b) Qual é o volume de oxigênio necessário para reagir com metano e produzir metanol, quando a energia envolvida na reação for de 250 kJ. Considere 25 0C e 1 atm.
2) Considere a reação de decomposição do pentóxido de dinitrogênio: 2 N2O5(g) 4 NO2(g) + O2(g)
a) Calcule a entalpia da reação decomposição.
b) Num experimento, uma quantidade de N2O5 foi colocado num recipiente de 0,750L. O calor medido da
decomposição completa de N2O5 foi de 5405 J. Calcule a concentração molar de pentóxido de dinitrogênio inicial.
4) Explique pela termodinâmica o que é entalpia e qual a sua relação com a energia interna do sistema.
Dados:
Q
nF
RT
E
E
o
ln
, R = 8,315 J.K-1.mo1-1, F = 96485 C.mol-1Hf0 (NO(g)) = +90,25 kJ/mol
Hf0 (NO2(g)) = +33,18 kJ/mol
Hf0 (CO(g)) = -110,53 kJ/mol
Hf0 (CO2(g)) = -393,51 kJ/mol
CO(g) + 3H2(g) CH4 (g) + H2O(g) H = -206,10 kJ 2H2(g) + CO(g) CH3OH(l) H = -128,33 kJ 2H2(g) + O2(g) 2H2O(g) H = - 483,64 kJ
entalpia padrão de reação da formação de 1 mol de CH3OH(l) a partir de metano e oxigênio. Apresente todas as etapas necessárias.
2) Os dados da reação CO(g) + NO2(g) CO2(g) + NO(g) estão organizados na tabela abaixo:
Experimento Concentração (mol/L) velocidade inicial
(mol.L-1.h)
[CO] [NO2]
1 5,0 x 10-4 0,36 x 10-4 3,4 x 10-8
2 5,0 x 10-4 0,18 x 10-4 1,7 x 10-8
3 1,0 x 10-3 0,36 x 10-4 6,8 x 10-8
4 1,5 x 10-3 0,72 x 10-4 ?
a) Qual é a lei de velocidade da reação (I), a constante de velocidade (II) e a velocidade inicial do experimento 4 (III)?
b) Qual é a entalpia da reação?
6.24) Explique por que as capacidades caloríficas molares do metano e do etano diferem dos valores
esperados para um gás monoatômico ideal e, também, uma da outra. Os valores são 35,309 J.mol-1.K-1 para
o metano e 52,63 J.mol-1.K-1 para o etano.
6.30) Duas amostras, uma de 1 mol de N2 e a outra de 1 mol de CH4, estão em balões idênticos nas
separados, cuja temperatura é 500 K. Cada um deles ganha 1200 J de calor em volume constante. Será que
a temperatura final das duas amostras é a mesma? Se não, qual dos dois chega à temperatura mais alta?
Justifique o seu raciocínio.
6,49) a entalpia de formação do trinitro-tolueno (TNT) é -67 kJ.mol-1 e, a densidade é 1,65 g.cm-3. Calcule a
densidade de entalpia (a entalpia liberada por litro) na reação