Universidade de Trás-os-Montes e Alto Douro
Inflamação e cancro: estudo da expressão
da COX-2 em lesões pré-neoplásicas de
murganhos transgénicos K14-HPV16
Dissertação de Mestrado em Bioquímica
Magda Sofia da Silva Moutinho
Orientador
Professor Doutor Rui Miguel Gil da Costa Oliveira
Coorientador
Professor Doutor Bruno Jorge Antunes Colaço
Universidade de Trás-os-Montes e Alto Douro
Inflamação e cancro: estudo da expressão
da COX-2 em lesões pré-neoplásicas de
murganhos transgénicos K14-HPV16
Dissertação de Mestrado em Bioquímica
Magda Sofia da Silva Moutinho
Orientador
Professor Doutor Rui Miguel Gil da Costa Oliveira
Laboratório de Engenharia de Processos, Ambiente e Energia, FEUP
Coorientador
Professor Doutor Bruno Jorge Antunes Colaço
Departamento de Zootecnia, UTAD
Composição do Júri:
Presidente: Professora Doutora Amélia Maria Lopes Dias da Silva Escola das Ciências da Vida e Ambiente, UTAD
Vogais: Professora Doutora Margarida Duarte Cerqueira Martins Araújo Instituto de Ciências Biomédicas Abel Salazar, UP
Professor Doutor Rui Miguel Gil da Costa Oliveira Faculdade de Engenharia, UP
V
Declaração
Nome: Magda Sofia da Silva Moutinho Cartão de Cidadão: 14197522
Mestrado: Bioquímica da Escola de Ciências da Vida e do Ambiente da Universidade de Trás-os-Montes e Alto Douro
Título: Inflamação e cancro: estudo da expressão da COX-2 em lesões pré-neoplásicas de murganhos transgénicos K14-HPV16
Orientadores: Professor Doutor Rui Miguel Gil da Costa Oliveira Professor Doutor Bruno Jorge Antunes Colaço Ano de conclusão: 2017
Declaro que esta dissertação de mestrado é resultado da minha pesquisa e trabalho pessoal e das orientações dos meus orientadores. O seu conteúdo é original e todas as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição para obtenção de qualquer grau académico.
VII
Parte do conteúdo desta dissertação foi publicado em: Gil da Costa RM, Aragão S, Moutinho M, Alvarado A, Carmo D, Casaca F, Silva S, Ribeiro J, Sousa H, Ferreira F, Nogueira-Ferreira F, Pires MJ, Colaço B, Medeiros R, Venâncio C, Oliveira MM, Bastos MMSM, Lopes C, Oliveira PA (2016): HPV16 induces a wasting syndrome in transgenic
IX
Tenta! Nada nem ninguém pode proibir de tentar! Jorge Luís Oliveira Castro
XI
Agradecimentos
Ao meu orientador Professor Doutor Rui Oliveira agradeço pela sua boa disposição e convívio, pela confiança depositada, pelos elogios e pelo incentivo de terminar esta fase. Ao meu coorientador Professor Doutor Bruno Colaço agradeço pelo seu bom humor, a sua dedicação e pelas palavras certas e de amizade em dois momentos do meu percurso que foram definitivamente fulcrais na minha vida. A Professora Doutora Paula Oliveira os seus ensinamentos, a disponibilidade e o imenso carinho, sendo o melhor exemplo que uma aluna pode ter como fonte de inspiração como profissional e como mulher. A Professora Doutora Isabel Pires pela preocupação, apoio e amparo sem qualquer hesitação, como a Professora Doutora Felisbina Queiroga pela sua ajuda e que comprovou ser possível.
Aos meus pais Emília Moutinho e Horácio Moutinho, ao meu irmão Nuno Moutinho, a minha cunhada Anabela Ribeiro e ao meu sobrinho Rafael Moutinho pela tolerância e amor, sem eles nada disto seria possível, não existindo palavras para expressar a gratidão por trabalharem incansavelmente para me proporcionar as melhores oportunidades na vida.
Ao meu melhor amigo Jorge Castro expresso o meu profundo agradecimento por preencher as lacunas e eliminar as variáveis que pudessem interferir ao longo deste período, como o cuidado incondicional nas aflições, necessidades e me proporcionar imensos risos.
Agradeço aos meus amigos, Catarina Lopes, Marie-line Santos, Bárbara Lopes, Filipa Cardoso, Daniela Carneiro, Tiago Silva e João Leite pelas palavras calorosas, pelas boas risadas, pelas conversas e o suporte nos momentos de ansiedade ao longo do caminho, por me compreenderem tão bem, presencialmente e em espirito. Ao Filipe Perestrelo e ao António Silva por aquele dia de janeiras que definitivamente deu algo nada esperado e que me fizeram divertir e perder-me no tempo.
A Ana Faustino, Antonieta Alvarado e Catharina Batista pelas partilhas, pelas palavras sábias, pelos momentos de compreensão e pelas horas de conversa e descontração vividas. A Doutora Tânia Martins também isto e aperceber-se muitas vezes que precisava de uma mãozinha quando não via o passo a seguir.
Ao Miguel Cardoso, a Milene Ribeiro e a Carolina Fonseca que foram completamente compreensíveis com uma pessoa que mal conheciam, a conseguir terminar esta fase e pela vossa descontração, não esquecendo os fazeres sempre importantes.
As pessoas que de forma direta ou indireta também ajudaram a finalizar esta etapa o meu muito obrigada.
XIII
Resumo
A infeção pelo vírus do papiloma humano (HPV) induz múltiplas lesões benignas e malignas na pele e mucosas dos seus hospedeiros. Entre estas lesões, destacam-se, pela sua gravidade e elevada incidência, o cancro do colo do útero, do ânus e certos carcinomas da cabeça e pescoço. Estas lesões estão, frequentemente, associadas a intensos processos inflamatórios, que apoiam a progressão tumoral. Assim, o uso de compostos anti-inflamatórios surge como uma estratégia interessante para a prevenção e terapia destas lesões. No presente trabalho, pretendeu-se estudar o efeito de dois compostos anti-inflamatórios naturais, de origem vegetal habitualmente presentes na dieta humana e com perfis toxicológicos muito favoráveis - a rutina e a curcumina.
Para isto, foram usados murganhos transgénicos para o HPV16, um conhecido modelo
in vivo para o estudo deste vírus e das lesões por ele induzidas. Às seis semanas de idade, os
animais experimentais, todos fêmeos, foram divididos em 4 grupos: controlo negativo (animais wild-type, n=12), controlo positivo (animais transgénicos sem tratamento, n=13), animais transgénicos tratados com rutina (n=12), animais transgénicos tratados com curcumina (n=13). A rutina e a curcumina foram incorporadas na dieta dos murganhos através de uma técnica de coating, a uma concentração de 2,0mg/g e administradas durante 24 semanas consecutivas. O peso dos animais, bem como o seu consumo de água e comida, foram controlados semanalmente durante o período experimental. No fim deste período, os animais foram necropsiados e foram colhidas amostras de pele para análise histológica e para a analisar imunohistoquimicamente a expressão da ciclooxigenase-2 (COX-2).
Os animais transgénicos sem tratamento (controlo positivo) exibiram elevada mortalidade, que foi completamente prevenida nos grupos tratados com rutina e curcumina. Os animais transgénicos sem tratamento exibiram também lesões hiperplásicas e displásicas da epiderme. Os compostos administrados não alteraram a incidência destas lesões relativamente ao controlo positivo. No entanto, verificou-se uma redução da expressão da COX-2 nas lesões presentes nos grupos tratados com curcumina e rutina, em comparação com o controlo positivo.
Importa realizar estudos adicionais, usando outras doses dos mesmos compostos, para verificar a possibilidade de combater o desenvolvimento das lesões induzidas pelo HPV. Poderá também ser interessante testar outros compostos anti-inflamatórios, já aprovados para uso terapêutico em doentes.
Palavras-chave: bioquímica, inflamação, cancro, vírus do papiloma humano, rutina, curcumina,imuno-histoquimica.
XV
Abstract
Infection by human papilloma virus (HPV) induces multiple benign and malignant lesions in the skin and mucosal areas of its hosts. Among these lesions, cervical and anal cancers, as well as some head and neck cancers, assume a prominent position, due to their high incidence and associated mortality. These lesions are frequently associated with intense inflammatory processes, which support tumour progression. Thus, the use of anti-inflammatory compounds is an interesting strategy for preventing and treating these lesions. In this work, we aimed to study the effects of two natural compounds of vegetable origin, rutin and curcumin, which are naturally present in the human diet and show favourable toxicological profiles.
For this purpose, we employed a well-known in vivo model of HPV-induced disease, HPV16-transgenic mice. At 6 weeks-old, the experimental animals (all female) were divided into 4 groups: negative control (wild-type, n=12), positive control (transgenic without treatment, n=13), transgenic treated with rutin (n=12), transgenic treated with curcumin (n=13). Rutin and curcumin were incorporated into the animal's diet using a coating technique, at 2.0mg/g, and administered during 24 consecutive weeks. The animal's weight, as well as their food and water consumption were monitored weekly during the experimental period. Following this period, the animals were sacrificed and necropsied. Skin samples were taken for histological examination and for studying the expression of cyclooxigenase-2 (COX-2) immunohistochemically.
Positive control animals showed high mortality, which was completely abrogated in the groups treated with rutin and curcumin. Untreated transgenic animals also showed hyperplastic and dysplastic skin lesions. Rutin and curcumin administration didn't change the incidence of these lesions, compared with the positive control. However, rutin and curcumin did reduce the expression of COX-2 in the cutaneous lesions.
Further studies are warranted to determine the efficacy of other rutin and curcumin doses against lesions induced by HPV. Additionally, it may also be useful to study the effects of other anti-inflammatory compounds, already approved for clinical use.
Key-words: biochemistry, inflammation, cancer, human papilloma virus, rutin, curcumin, immunohistochemistry.
XVII
Índice Geral
Declaração ... V Artigo Cientifico publicado ... VII Dedicatória ... IX Agradecimentos ... XI Resumo ... XII Abstract ... XV Índice de Figuras ... XIX Índice de Tabelas ... XXI Índice de Gráficos ... XXIII Lista de Siglas e Abreviaturas ... XXV
I. Introdução ... 1
1.1 - O cancro e o processo de carcinogénese ... 1
1.2 - Epidemiologia do cancro e de agentes cancerígenos biológicos ... 2
1.3 - Vírus do papiloma humano (HPV)... 4
1.3.1 - Definição e classificação de papilomavirus ... 4
1.3.2 - Genoma do HPV16 ... 7 1.3.3 - Infeção e manifestação ... 9 1.3.4 - Ciclo de vida ... 9 1.3.5 - Mecanismo de carcinogénese ... 11 1.4 - Murganhos K14-HPV16 ... 12 1.5 - Curcumina ... 13 1.6 - Rutina ... 14 II. Objetivos ... 17
III. Material e métodos ... 19
3.1 - Animais ... 19
3.2 - Compostos ... 19
3.3 - Desenho experimental ... 20
3.4 - Necropsia e recolha das amostras biológicas ... 21
3.5 - Análise histológica ... 21
XVIII
3.7 - Analise Estatística ... 23
VI. Resultados ... 25
4.1 - Mortalidade ... 25
4.2 - Consumo de comida e água e evolução do peso corporal ... 25
4.3 - Avaliação histológica das lesões cutâneas ... 28
4.4 - Imunoexpressão da COX-2 ... 29
V. Discussão e conclusões ... 33
VI. Perspetivas futuras ... 35
XIX
Índice de Figuras
Figura 1 - Árvore filogenética de acordo com a evolução do vírus do papiloma humano, divididos em cinco gêneros: de acordo com o artigo de Doobar et al., 2012. Dados de
sequências de HPV foram obtidos a partir PaVE (adaptado de Egawa et al., 2015) ... 5
Figura 2 - Representação do genoma do HPV 16: Genes Early (E1, E2, E4, E5, E6 e E7) genes Late (L1 e L2) e região regulatória (URR) (adaptado Bravo e Félez-Sánchez, 2015) .... 8
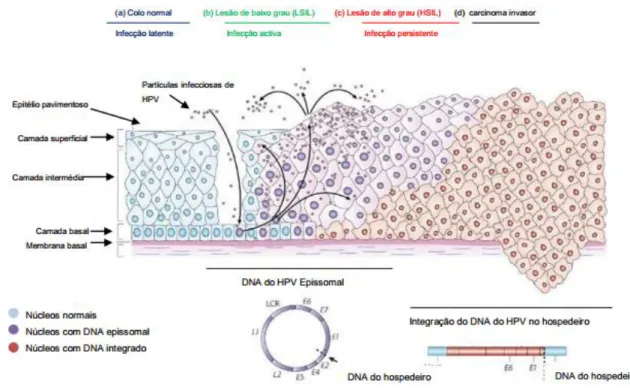
Figura 3 - O vírus do papiloma humano infeta as células da membrana basal através de lesões no epitélio. Os genes early são expressos e o ADN viral replica-se de forma epissomal. Nas camadas superiores do epitélio são expressos os genes late L1 e L2. As proteínas L1 e L2 permitem a formação da cápside viral para a criação de novos viriões. O virião pode assim iniciar uma nova infeção. A progressão para carcinoma invasivo deve-se à perda de E4 e parte do E2 consequentemente a expressão descontrolada dos oncogenes E6 e E7 (Adaptado de Woodman et al, 2007) ... 10
Figura 4 - Ação das oncoproteínas E6 e E7 e relação com o ciclo celular. As proteínas E6 e E7 ligam-se às proteínas celulares p53 e pRb respetivamente, alterando as suas funções e as vias de regulação do ciclo celular (adaptado de Burd, 2003) ... 12
Figura 5 - Estrutura da curcumina (adaptado de Gil da Costa et al., 2016) ... 14
Figura 6 - Estrutura da rutina (adaptado de de Gil da Costa et al., 2016) ... 15
Figura 7 - Protocolo experimental realizado ... 20
Figura 8 - Curvas de Kaplan-Meier refletindo a sobrevida dos animais de cada grupo experimental ... 25
Figura 9 - Histologia da pele entre os animais experimentais às 30 semanas de idade (H&E, 200x) ... 28
Figura 10 - Imunomarcação para a COX-2, animal do grupo 1. DAB - hematoxilina de Gill, 40x ... 30
Figura 11 - Imunomarcação para a COX-2, animal do grupo 2. DAB - hematoxilina de Gill, 200x ... 30
Figura 12 - Imunomarcação para a COX-2, animal do grupo 3. DAB - hematoxilina de Gill, 200x. ... 31
Figura 13 - Imunomarcação para a COX-2, animal do grupo 4. DAB - hematoxilina de Gill, 200x. ... 31
XXI
Índice de tabelas
Tabela 1 - Características das vacinas Gardasil e Cervarix de acordo com os genótipos abrangidos, a idade estipulada e a prevenção das respetivas enfermidades (adaptado da European Medicines Agency 2016ª,b) ... 4 Tabela 2 - Função dos genes do HPV 16 (adaptado Bravo e Félez-Sánchez, 2015; Egawa. et
al., 2015) ... 8
Tabela 3 - Distribuição dos murganhos k14-HPV16 pelos diferentes grupos experimentais 20 Tabela 4 - Análise semi-quantitativa da imunomarcação para a COX-2 em todos os grupos experimentais ... 29
XXIII
Índice de Gráficos
Gráfico 1 - O gráfico realça uma elevada percentagem de neoplasias malignas associada à infeção dos agentes apresentados, nomeadamente do Helicobacter pylori, Vírus do Papiloma Humano e da Hepatite B em comparação com os restantes (adaptado de Plummer et al., 2016) ... 3 Gráfico 2 - Consumo médio de comida por grupo ... 26 Gráfico 3 - Consumo médio de água por grupo ... 27 Gráfico 4 - Peso médio de murganhos ... 27
XXV
Lista de Siglas e Abreviaturas
ADN - Ácido desoxirribonucleico ATP - Trifosfato de adenosina COX-2 - Ciclooxigenase-2 DAB - Diaminobenzidina 3,3 E - Region Early
EU - União Europeia
EUA - Estados Unidos da América
FELASA - Federation for Laboratory Animal Science Associations HPV - Papiloma Vírus Humano
IARC - International Agency for research on Cancer ICTV - International Committee on Taxonomy of Viruses K14 - Citoqueratina 14
L - Region Late
MHC - Complexo maior de histocompatibilidade
n – Número
NF-κB - Fator Nuclear kappa B PaVE – Papilloma Virus Episteme PBS - Tampão fosfato
PCR – Polymerase Chain Reaction pH - Potencial de hidrogénio PV- Papilomavirus
SPSS - Statistical Package for the Social Sciences URR - Região regulatória
Introdução
- 1 -
I.
Introdução
1.1 – O cancro e o processo de carcinogénese
Em geral, as neoplasias podem dividir-se em benignas ou malignas, sendo estas últimas frequentemente designadas como "cancro". No primeiro caso, o crescimento da lesão dá-se de forma comummente vagarosa, expansiva e com limites bem definidos. Apesar de não invadirem os tecidos vizinhos, as neoplasias benignas podem comprimir os órgãos e os tecidos adjacentes. Por outro lado, as neoplasias malignas são capazes de invadir tecidos adjacentes e até distantes. De facto, algumas células das neoplasias malignas têm a capacidade de invadir a corrente sanguínea ou linfática e formar tumores secundários, denominadas metástases, em outros locais do corpo, que podem ser resistentes ao tratamento e causar a morte do individuo (Alberts et al., 2010; INCA, 2012). A este processo de formação chama-se de carcinogénese ou oncogénese.
O processo de carcinogénese (Chabner et al., 1996; Foye et al., 1996; Spence et al, 2001), ocorre lentamente, podendo levar vários anos para que uma célula origine uma massa detetável (tumor). Para que isto aconteça a célula passa por algumas fases (Almeida et al., 2005; Carvalho, 2009):
- Fase de iniciação - caracteriza-se por alteração das células que sofrem o efeito de um agente carcinogénico, provocando modificações em alguns dos seus genes. Nesta fase as células encontram-se geneticamente alteradas, contudo ainda não é possível detetar-se um tumor clinicamente;
- Fase de promoção - as células geneticamente modificadas sofrem o efeito dos agentes cancerígenos classificados como promotores, ou seja alteram o controlo da proliferação celular, da morte celular programada e da conservação da integridade do genoma, de forma lenta e gradual, sendo necessário um longo e continuo contato com o agente cancerígeno promotor. A suspensão do contato muitas vezes interrompe o processo nesta fase;
- Fase de progressão - é irreversível como também caracteriza-se pela multiplicação descontrolada, pela inativação de alguns genes e sobreexpressão de outros, o que origina células independentes da regulação local e central do organismo que proliferam sem inibição. Nesta fase o cancro já está estabelecido e surgem as primeiras manifestações clínicas.
O processo de carcinogénese inicia-se numa célula comum que sofre mutações genéticas, ou seja, alterações no seu ADN. As alterações podem ocorrer em genes
Introdução
- 2 -
denominados proto-oncogenes ou genes supressores tumorais, que são responsáveis por funções celulares essenciais, como a proliferação, a reparação do ADN e a morte celular programada. No processo de carcinogénese, os proto-oncogenes são ativados e tornam oncogenes, enquanto os genes supressores tumorais são inativados, deixando de realizar a sua função e permitindo a transformação neoplásica (Feller et al., 2010, INCA, 2012).
Uma das características do cancro é o facto de a sua evolução variar de pessoa para pessoa e existirem vários tipos de neoplasia, sendo que a sua incidência em determinados órgãos ou tecidos diverge de acordo com a localização geográfica, fatores demográficos como a idade, sexo, estatuto socioeconómico, raça ou etnia, como também estão dependentes dos fatores etiológicos como o tabaco, alimentação, falta de atividade física, radiação ionizante, medicamentos, poluição ambiental, como também agentes infeciosos, bactérias, parasitas ou vírus (Goldman e Schafer, 2013).
1.2 – Epidemiologia do cancro e de agentes cancerígenos biológicos
Segundo a Organização Mundial de Saúde a taxa anual de incidência de cancro para ambos os sexo e todas as localizações foi de 14,1 milhões de novos casos/ano em 2012 e a taxa de mortalidade foi de 8,2 milhões de mortes/ano (Torre et al., 2015). Estima-se que em 2030 ocorrerão 21,4 milhões de novos casos e 13,2 milhões de mortes por cancro (INCA, 2014). Em Portugal, em 2012, estima-se que a incidência para ambos os sexos terá sido de 49174 novos casos e a mortalidade de 24112 mortes (WHO, 2016). Estima-se que cerca dos 14 milhões de novos casos de cancro ocorridos em todo o mundo em 2012, aproximadamente 2,2 milhões (15,4%) sejam atribuíveis a agentes infeciosos. Destes, 23,4% ocorreram nas regiões menos desenvolvidas e 9,2% nas regiões mais desenvolvidas. Onze agentes biológicos (Plummer et al., 2016) integram o grupo número 1 de agentes cancerígenos identificados pela Agência Internacional de Investigação do Cancro (IARC), situação que se pretende ilustrar com o Gráfico 1.
Introdução
- 3 -
Gráfico 1 – O gráfico realça uma elevada percentagem de neoplasias malignas associada à infeção dos agentes
apresentados, nomeadamente do Helicobacter pylori, Vírus do Papiloma Humano e da Hepatite B em comparação com os restantes (adaptado de Plummer et al., 2016).
No contexto dos agentes cancerígenos biológicos, o vírus do papiloma humano (HPV) assume um lugar de destaque, mas a sua identificação como agente etiológico de vários cancros foi um processo longo e difícil. Em 1949, Maurice Strauss e outros pesquisadores, observaram partículas semelhantes aos vírus em amostras retiradas de papilomas da pele. Um ano mais tarde, Strauss e colaboradores identificaram o papiloma vírus humano como o agente etiológico das verrugas (Garfield, 1988). Desde a década de 70, em estudos epidemiológicos e biológicos subsequentes foram identificados diversos tipos de HPV em várias lesões de pele e de mucosas – verrugas, displasias epiteliais, bem como cancros anal, peniano, vulvar, vaginal e da faringe (Doorbar e Sterling, 2001, Tommasino, 2014). Um destes estudos levou à atribuição do prémio Nobel da Medicina e da Fisiologia em 2008 ao professor Harald Zur Hausen que evidenciou pela primeira vez uma relação entre o cancro humano através de isolamento de tipos específicos de HPV em biópsias de cancro cervical (Zur Hausen, 2002) possibilitando o desenvolvimento de vacinas.
7,8% 19,2% 29,5% 35,4% 5,5% 2,0% 0,1% 0,1% 0,3% 2,4%
Novos casos de cancro em 2012 atribuidos a agentes infeciosos
Virus da Hepatite C Vírus da Hepatite B Vírus do Papiloma Humano Helicobacter pylori Vírus Epstein-Barr Herpes Vírus Humano tipo 8
Virus linfotrópico da células T humanas tipo 1 Opisthorchis viverrini e Clonorchis sinensis Schistosoma haematobium
Introdução
- 4 -
Estima-se que 118 milhões de mulheres no mundo inteiro tenham sido alvo de um programa de vacinação contra o HPV entre 2006 e 2014 (Bruni et al., 2016).
No nosso país, as vacinas entraram no plano nacional de vacinação em Outubro de 2008, existindo dois tipos como esta mencionado na tabela 1.
Tabela 1 – Características das vacinas Gardasil e Cervarix de acordo com os genótipos abrangidos, a idade
estipulada e a prevenção das respetivas enfermidades (adaptado daEuropean Medicines Agency 2016ª,b).
Gardasil Cervarix
Genótipos 6,11,16 e 18 16 e 18 Idade Mulheres entre 9 a 45 anos
Homens entre os 9 e 26 anos
Mulheres entre 10 e 25 Prevenção Lesões pré-cancerosas do colo do
útero e cancro do colo do útero Lesões pré-cancerosas da vagina e cancro da vagina
Lesões pré-cancerosas da vulva e cancro da vulva
Lesões pré-cancerosas do ânus e cancro do ânus
Condilomas genitais
Lesões pré-cancerosas do colo do útero e cancro do colo do útero Lesões pré-cancerosas da vagina e cancro da vagina
Lesões pré-cancerosas da vulva e cancro da vulva
Associadamente, entre 2009 e 2011, decorreu uma campanha de vacinação para mulheres com 17 anos (Gameiro et al., 2016). Até 31 de Dezembro de 2013 mais de 85% das jovens de idades entre 14 e 21 anos já estavam vacinadas contra o cancro do colo uterino e outras doenças associadas aos genótipos 6, 11, 16 e 18 de HPV (DGS, 2014).
1.3 - Vírus do papiloma humano (HPV)
1.3.1 - Definição e classificação de papilomavirus
Os papilomavirus (PV) são capazes de infetar seres humanos e um enorme número de animais, como alguns répteis (Herbst et al., 2009), aves (Terai et al., 2002) e numerosas espécies de mamíferos (Bernard et al., 2010), sendo o homem o hospedeiro mais extensivamente estudado (De Villiers et al., 2004). Os papilomavirus são altamente específicos por estirpe e são raros os exemplos em que uma espécie causa infeção a outra
Introdução
- 5 -
espécie (Doorbar, 2005). O International Committee on Taxonomy of Viruses (ICTV) expõe a família Papillomaviridae com 49 géneros e 116 espécies distintas (ICTV, 2016). No âmbito de uma espécie podem ser reconhecidos vários tipos. Para um papilomavírus ser reconhecido como um novo tipo, o genoma completo deve ser clonado e a sequência de nucleótidos do gene de L1 desse mesmo vírus deve diferir mais de 10% de quaisquer outros tipos (De Villiers et al., 2004; Bernard et al., 2010). Linhagens distintas dentro do mesmo tipo são definidas por uma diferença na sequência de nucleótidos de cerca de 1,0-10,0%. Do mesmo modo, as diferenças de 0,5-1,0% são utilizados para identificar sublinhagens (Chen et al., 2009).
A região L1 nem sempre contém informação suficiente para distinguir os papilomavírus. Nesse sentido, a nomenclatura comum para os múltiplos tipos está a ser implementada usando todo o seu genoma (Chen et al., 2011; Chen et al., 2013; Burk et al., 2013). Desde 19 de Fevereiro de 2016 International Human Papillomavirus Reference Center apresenta 216 tipos diferentes de HPV. A árvore filogenética abaixo (Figura 1) pretende demonstrar esta classificação e a sua complexidade.
Figura 1 - Árvore filogenética de acordo com a evolução do vírus do papiloma humano, divididos em cinco
gêneros: de acordo com o artigo de Doobar et al., 2012. Dados de sequências de HPV foram obtidos a partir PaVE (adaptado de Egawa et al., 2015).
Introdução
- 6 -
O grupo filogenético pode refletir semelhanças biológicas e patológicas mas ocorrem frequentes divergências, ou seja, espécies e diferentes tipos de um mesmo gênero podem exibir características completamente diferentes e ainda assim pertencer ao mesmo gênero (De Villiers et al., 2004; Chen et al., 2013). Os HPV podem pertencer a vários géneros. Neste caso o tipo 16 pertence ao Alfapapillomavirus e à espécie Alphapapillomavirus 9 (Chen et al., 2015).
Os HPV podem ser agrupados de acordo com a sua afinidade pelos diferentes tecidos: em mucosotrópicos, que exibem maior afinidade por mucosas; e epidermotrópicos ou cutaneotrópicos, que manifestam maior afinidade pela epiderme (Almeida e Faria, 2016). As mucosas são mais frequentemente infetadas por serem locais com maior probabilidade de microtraumatismo (Scheurer et al., 2005). Importa ter em atenção que, ocasionalmente, alguns tipos genitais de HPV podem ser detetados na pele e o contrário também é possível (Leto et al., 2011).
Existem vários tipos de HPV cutâneos, por exemplo o HPV2 que é responsável por verrugas comuns da pele, e os tipos 6 e 11, que são principalmente ligadas a verrugas genitais benignas (Ghittoni et al., 2011). Estes ainda são suspeitos de estar envolvidos, em associação com a radiação ultravioleta, com o desenvolvimento de cancro de pele não-melanoma (Accardi et al., 2014; Smola, 2014). Acredita-se que o HPV desempenha um papel importante na carcinogénese da pele na população em geral, embora isto não tenha sido demonstrado com claridade. Métodos baseados em PCR permitiram a deteção de sequências de ADN do HPV e lesões de epidermodisplasia verruciforme e em carcinoma de células escamosas em aproximadamente 40% dos pacientes imunocompetentes e 80% de doentes imunocomprometidos (De Villiers, 1997; Berhhout et al., 2000).
Os HPV mucosotrópicos são ainda classificados em tipos de alto risco e de baixo risco, referindo-se à sua associação com o cancro cervical de acordo com o IARC:
- Baixo Risco (não oncogénicos) - Este tipo de infeção pode causar alterações benignas, verrugas genitais e papilomas da laringe. O tipo mais visível de verruga é condiloma acuminado, que é uma massa elevada com uma superfície irregular. Essas verrugas são altamente infeciosas e podem causar dor, sangramento, obstrução genital ou da uretra e complicações durante a gravidez (Huether e McCance, 2012). As verrugas genitais têm um impacto físico e psicossocial na saúde da mulher. As mulheres podem sentir-se envergonhadas e constrangidas o que desenvolve baixa autoestima (Jeynes et al., 2009).
Introdução
- 7 -
- Alto Risco (oncogénicos) - induzem infeções persistentes e alguns subtipos tem sido largamente implicados no desenvolvimento do cancro do colo do útero devido a anormalidades resultantes de células cervicais, como também vulvar, vaginal, peniana, anal e de orofaringe (Markowitz et al., 2014; CDC, 2016).
1.3.2 - Genoma do HPV16
O vírus do papiloma humano é um vírus não envelopado com ADN cadeia dupla circular e com capacidade de infetar o epitélio estratificado (Brendle et al., 2014). O HPV16 contém 7904 pares de bases (Skeedorf et al., 1985) e o seu virião mede cerca de 55 nm (IARC, 2007). O genoma viral pode ser dividido em três regiões (WHO, 2007; Chow et al., 2010; Tomassino, 2014) (Tabela 2 e Figura 2):
- Região regulatória (upstream regulatory region - URR) - é uma região regulatória, não codificadora, de 400 a 1.000 pares de bases e que se situa entre os genes L1 e E6. É nesta região pouco conservada que estão localizadas as sequências reguladoras e que iniciam a replicação viral;
- Região precoce (Early - E) - constituída pelos genes E1, E2, E4, E5, E6 e E7, que estão envolvidos na replicação viral, no controlo da transcrição e na oncogénese;
Introdução
- 8 -
Tabela 2 - Função dos genes do HPV 16 (adaptado Bravo e Félez-Sánchez, 2015; Egawa. et al., 2015).
Genes e regiões
genómicas Função
URR Contém locais de ligação dos fatores de transcrição; Controla a expressão dos genes virais.
E1 Atividade ADN helicase dependente de ATP; Papel na replicação do ADN viral.
E2
Co-ativador da replicação do ADN viral; Repressor de transcrição de HPV E6 e E7; Regula o ciclo celular e apoptose;
Interage com cromatina para a segregação de genoma viral. E4 É incorporado dentro do gene E2;
Liga-se a proteínas do citoesqueleto e interrompe a sua estrutura.
E5
Pequena proteína transmembranar; Induz a proliferação de células infetadas; Contribui para a evasão da apoptose;
Regula negativamente a expressão de MHC.
E6
Promove a imortalização celular por ativação da telomerase; Envolvido na evasão imune;
Promove a transformação neoplásica pela degradação de p53.
E7
Promove a degradação pRb, permitindo a progressão de células de fase S do ciclo celular;
Induz instabilidade cromossómica. L1 Proteína menor da cápside.
L2 Proteína principal da cápside; Facilita a entrada do vírus.
Evidências consistentes sugerem que o genoma dos papilomavírus é estático e mudanças na sua sequência por mutação ou recombinação são eventos muito raros. Alterações por mutações parecem acontecer com uma frequência semelhante à que ocorre no genoma do hospedeiro infetado (De Villiers et al., 2004).
Introdução
- 9 -
Figura 2 – Representação do genoma do HPV 16: Genes Early (E1, E2, E4, E5, E6 e E7) genes Late (L1 e L2) e
região regulatória (URR) (adaptado Bravo e Félez-Sánchez, 2015).
1.3.3 - Infeção e manifestação
Quando um organismo é infetado pode reagir de três maneiras (Ges, 2016):
- O sistema imunológico elimina o vírus sem que suceda nenhuma manifestação clínica na maioria dos organismos;
- O vírus pode provocar uma infeção persistente e o aparecimento de lesões pré-neoplásicas e pré-neoplásicas;
- O vírus pode permanecer latente por vários anos, sem causar nenhuma lesão. A diminuição da imunidade pode desencadear o aparecimento de lesões.
1.3.4 - Ciclo de vida
Através de fissuras ou feridas, o HPV penetra até aos estratos basais do epitélio (Figura 3). Num epitélio normal, as células do estrato basal são as únicas que mantêm a capacidade mitótica. Após a divisão celular, as células basais originam células filhas que se deslocam da camada basal para os estratos mais externos, diferenciando-se ao longo do percurso (Stubenrauch e Laimins, 1999; Thomas et al., 1999; Kisseljov, 2010; Silva et al., 2003).
Depois da penetração do vírus, ocorre o desnudamento do virião no interior da célula, permitindo o transporte do ADN viral para o núcleo. Depois disto, o genoma viral é
Introdução
- 10 -
estabilizado na forma de ADN epissomal (Hebner e Laimins, 2006). Nesta fase, as proteínas virais impedem a saída das células do ciclo celular, possibilitando que ocorra a produção de novo genoma viral (Stubenrauch e Laimins, 1999). Assim, através da divisão de cada célula da camada basal, ocorre a multiplicação dos epissomas do HPV, permanecendo o genoma viral na forma de componentes extracromossómicos no núcleo, e aumenta o número de cópias virais até cerca de 50 por célula. Na mitose, as células infetadas distribuem equitativamente o ADN do vírus para as células filhas. Uma das células filhas desloca-se para a camada basal e inicia o programa de diferenciação celular. As outras células filhas continuam dividindo-se na camada basal e servem de reserva de ADN viral para as próximas divisões celulares (Stubenrauch e Laimins, 1999; Thomas et al., 1999; Fhermann et al., 2003).
Figura 3 – O vírus do papiloma humano infeta as células da membrana basal através de lesões no epitélio. Os
genes early são expressos e o ADN viral replica-se de forma epissomal. Nas camadas superiores do epitélio são expressos os genes late L1 e L2. As proteínas L1 e L2 permitem a formação da cápside viral para a criação de novos viriões. O virião pode assim iniciar uma nova infeção. A progressão para carcinoma invasivo deve-se à perda de E4 e parte do E2 consequentemente a expressão descontrolada dos oncogenes E6 e E7 (adaptado de Woodman et al., 2007).
Após a infeção viral, os primeiros genes a serem expressos são os E1 e E2, que estão envolvidos na replicação do genoma vírico. Estes genes agem independentemente, contudo poderão ocorrer interações entre as proteínas E1 e E2, formando um complexo multimérico
Introdução
- 11 -
que auxilia na replicação viral (Villa, 1998; Stubenrauch e Laimins, 1999). Inicia-se em seguida a expressão das proteínas estruturais L1 e L2, para que ocorra a formação da cápside viral (Doorbar, 2005). A integração do genoma do vírus no genoma da célula hospedeira faz com que haja deleção do gene E4 e parte do gene E2. Este último codifica uma proteína responsável pela regulação da expressão dos genes E6 e E7. A integração do genoma vírico e a deleção do gene E2 são, portanto, eventos cruciais para o processo de carcinogénese, por aumentarem descontroladamente a expressão dos genes E6 e E7, com elevada capacidade transformante (Gouveia, 2009).
1.3.5 - Mecanismo de carcinogénese
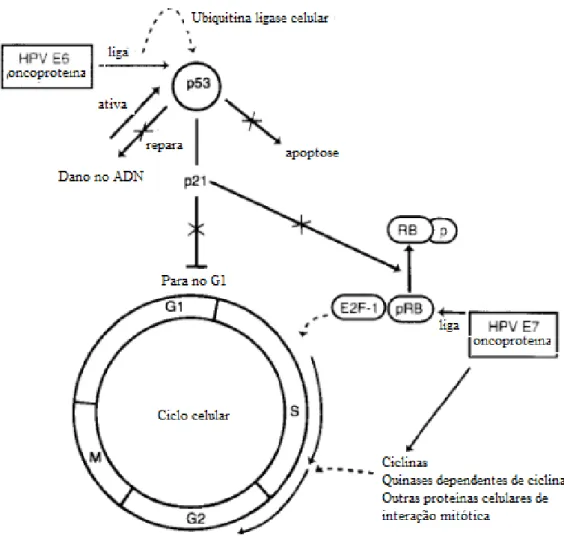
Os genes E6 e E7 codificam oncoproteínas que induzem a transformação da célula hospedeira (Ganguly e Parihar, 2009), pois interagem com as proteínas reguladoras do ciclo celular codificadas por genes supressores tumorais. Embora outros genes da região Early também pareçam desempenhar algum papel na carcinogénese, este encontra-se menos caracterizado, enquanto as funções dos genes E6 e E7 são bem conhecidas e tidas como essenciais (Figura 4).
A proteína E6 do HPV induz e mantém a transformação celular e tem sido identificada por ligar-se e induzir a degradação da proteína p53, comprometendo a integridade do ADN replicado, causando danos ao ADN e instabilidade a nível cromossómico. O aumento da expressão da E6, causa imortalização da célula, proliferação celular, replicação de ADN defeituoso com acumulação de mutações e inibição da resposta imunológica das células tumorais, levando em última analise à transformação da célula hospedeira (Ganguly e Parihar, 2009).
A proteína E7 inibe a atividade da proteína do retinoblastoma (pRB), cujo papel principal é a manutenção da célula na fase G1 do ciclo celular, impedindo a proliferação celular. A pRB exerce a sua função formando complexos estáveis com o fator de transcrição E2F. O E2F quando livre, desencadeia o processo de replicação do ADN (Klaes et al., 2001; Ganguly e Parihar, 2009). A inativação da pRB desregula a proliferação celular no epitélio infetado (Hamid et al., 2009). A proteína E7 também é capaz de ligar-se à p21 e p27, o que impede o controlo do ciclo celular em distintos pontos (Kumar, 2010; Ganguly e Parihar, 2009). A inativação destas proteínas celulares (p53 e pRb) pelas proteínas do vírus impede a
Introdução
- 12 -
reparação do ADN, o que origina a instabilidade genética, acumulação de mutações e em última instância ao desenvolvimento de neoplasias. Este mecanismo tem sido várias vezes descrito como crucial para a transformação e proliferação de cancros (Zhang et al., 2009; Mansur, 2001)
As oncoproteínas E6 e E7 têm também a capacidade de modular a resposta imunitária do hospedeiro, criando condições favoráveis ao desenvolvimento tumoral. Em particular, estas oncoproteínas ativam o fator de transcrição nuclear kapa B (NF-κB), cujas vias de sinalização levam a intensos fenómenos inflamatórios, que promovem o desenvolvimento tumoral (Gil da Costa et al., 2016). A importância da inflamação nas várias fases da carcinogénese justifica o interesse pelo uso de compostos anti-inflamatórios para a prevenção e terapia do cancro, nomeadamente das lesões induzidas pelo HPV.
Figura 4 - Ação das oncoproteínas E6 e E7 e relação com o ciclo celular. As proteínas E6 e E7 ligam-se às
proteínas celulares p53 e pRb respetivamente, alterando as suas funções e as vias de regulação do ciclo celular (adaptado de Burd, 2003).
Introdução
- 13 - 1.4 - Murganhos K14-HPV16
Ao longo dos anos, os ensaios experimentais com animais permitiram estudar potenciais agentes cancerígenos, assim como estudar características farmacológicas de diversos compostos e estabelecer a relação dose-resposta a possíveis agentes terapêuticos (Steele et al., 2010). O murganho tem sido utilizado com frequência como modelo, visto que é facilmente manuseado, é fácil manter grupos suficientemente grandes para obter resultados estatisticamente significativos, tem um genoma bem estudado, o seu tamanho é pequeno, os custos de manutenção são baixos, possui curto tempo de gestação e de vida e alta capacidade de reprodução (Lopes, 2009; Oliveira et al., 2011).
Vários modelos de murganhos transgénicos foram desenvolvidos para investigar a biologia de tumores mediada por HPV (Arbeit et al., 1994; Herber, 1996; Song et al., 1999). Os murganhos transgénicos condicionais K14-HPV16 (Arbeit et al., 1994) expressam todos os genes da região early do HPV16, sob o controlo do promotor do gene da citoqueratina 14, nos epitélios queratinizados (Lambert et al., 1993). Estes murganhos já permitiram realizar grandes avanços no estudo das lesões provocadas pelo HPV, especificamente em epitélio escamoso estratificado, incluindo o do cérvix uterino e da pele (Brake et al., 2003). Nestes animais é possível observar histologicamente os tumores (Elson et al., 2000), que exibem padrões histológicos e de expressão de biomarcadores semelhantes aos dos seres humanos (Brake et al., 2003).
Quando expostos a suplementação prolongada por estrogénios, os murganhos fêmea K14-HPV16 desenvolvem carcinomas do colo do útero (Arbeit et al., 1996). Foi realizada uma investigação que concluiu que a administração do anti-estrogénico índole-3-carbinol inibe a carcinogénese do colo do útero neste modelo (Jin et al., 1999). Já as lesões cutâneas observadas neste modelo, desenvolvem-se sem necessidade de suplementação hormonal.
No modelo K14-HPV16, o desenvolvimento das lesões pré-neoplásicas e neoplásicas é acompanhado por uma resposta dos linfócitos B, com deposição de imunoglobulinas nos tecidos lesionais e recrutamento de células inflamatórias, com o desenvolvimento de uma inflamação crónica que acompanha e apoia a progressão tumoral (De Visser et al., 2005).
Introdução
- 14 - 1.5. Curcumina
A curcumina (Figura 5), com o nome sistemático de 1,7-bis(4-hidroxi-3-metoxifenil)-1,6-heptadieno-3,5-diona é um diferoilmetano com a fórmula química C21H20O6 e massa
molecular de 368,4 g/mol (Rosa, 2009). O pH entre 3 e 7, a curcumina apresenta uma estrutura b-dicetona, atuando como potente dador de hidrogénio. O pH superior a 8, a forma enólica da curcumina predomina, atuando como dador de eletrões (Sharma et al., 2005)
Figura 5 - Estrutura da curcumina (adaptado de Gil da Costa et al., 2016).
A curcumina é extraída da Curcuma lunga Linn., planta herbácea da família
Zinigiberaceae, do sudoeste da Asia, mais conhecida como açafrão-da-índia (Filho et al.,
2000), que contém 2,5% a 8,1% da curcumina e tem uma cor amarelada (Rosa, 2009). É utilizada nos mercados de perfumaria, medicinal, têxtil, condimentar e alimentício (Filho et
al., 2000).
Para além de ser um ótimo agente anti-inflamatório e antioxidante, tem a capacidade de anular a proliferação de algumas células tumorais, a iniciação tumoral e a metástase. Atua como inibidor de ativação de fatores de transcrição que regulam a expressão de genes relacionados com tumores. Influência a regulação da expressão de várias moléculas associadas a cancros e a regulação de recetores de fatores de crescimento. Em outros estudos também houve a inibição da atividade de várias enzimas que contribuem para o desenvolvimento de tumores e sua metastização (Pintão e Silva, 2008).
Atividades científicas já realizadas indicam que a curcumina não apresenta efeitos toxicológicos mesmo em doses altas, não sendo genotóxica e mutagénica. Ratos alimentados com curcumina e extrato alcoólico de curcumina foram examinados ao longo de três gerações e não foram averiguadas diferenças no índice de fertilidade, gestação, peso das crias e lactação entre os diferentes grupos experimentais (Bhavanishankar e Murthy, 1987).
Introdução
- 15 - 1.6 - Rutina
A rutina (Figura 6), cujo nome sistemático é 3-o-rutinosídeo-quercetina, é um flavonóide usado como antioxidante e anti-inflamatório (Bruneton, 1991). A sua fórmula química é C27H30O16 (Rolim, 2006) eapresenta cor amarelada no estado físico de cristais em
agulha (Barreto, 2005). Foi detetada na Ruta gravedens em 1842 e então isolada. Posteriormente descoberto na Caparis spinosa como ácido rutínico, denominação utilizada para este composto por se apresentar solúvel em soluções alcalinas (Rolim et al., 2005).
Figura 6 – Estrutura da rutina (adaptado de Gil da Costa et al., 2016).
Pode-se encontrar em numerosos alimentos como as cebolas, a uva, o trigo sarraceno, o feijão vermelho, as maçãs, os tomates, o vinho tinto e o chá preto (Hollman et al., 1996; Thomson et al., 1999). Somente um pequeno número de fontes contem quantidades suficientes para a extração em escala industrial que são: a Sophora japónica L., uma árvore encontrada no norte e centro da China em botões e flores (Pedriali, 2005); a Fagopyrum
esculentum, que é um pseudocereal de origem chinesa cultivado na Europa (Couch et al.,
1946) e aDimophandra mollis nos seus frutos (Chaves e Usberti, 2003).
As indústrias farmacêuticas estão bastante interessadas neste flavonóide devido aos seus resultados em algumas pesquisas (Pedriali, 2005), pois tem bastante eficiência no tratamento da artrite por Cândida albicans e atividade anti-candida (Han, 2009), atividade anti-hiperlepidêmica (Santos et al., 1999), efeito anti-convulsivante em ratos (Nassiriasl et al., 2008), supressão da imunidade celular (Middleton et al., 2000), atividade anti-carcinogénica (Machado, 2006), efeito anti-inflamatório (Guardia et al., 2001), prevenção ou tratamento da insuficiência venosa ou linfática e da fragilidade ou permeabilidade capilar (Bruneton, 1991; Velasco et al., 2008). Outros sintomas de fragilidade capilar também são melhorados, entre eles a perda da acuidade visual e alterações do campo visual (Pathak et al., 1991).
Introdução
- 16 -
Objetivos
- 17 -
Objetivos
O objetivo geral deste trabalho foi estudar os potenciais efeitos terapêuticos da curcumina e da rutina sobre as lesões induzidas pelo HPV16, num modelo murino transgénico k14-HPV16.
Em particular, pretendeu-se:
1 - Estudar os efeitos da administração oral prolongada de ambos os compostos sobre a sobrevida e os parâmetros fisiológicos (consumo de água e comida, peso vivo) dos animais;
2 - Estudar histologicamente os efeitos de ambos os compostos sobre a evolução das lesões cutâneas dos animais;
3 - Estudar por técnicas de imuno-histoquimica a expressão de um marcador da inflamação - a ciclooxigenase-2 - nas lesões destes animais.
Material e métodos
- 19 -
II.
Material e métodos
3.1 – Animais
Para a elaboração deste trabalho experimental, foram utilizados 50 murganhos (Mus
musculus) da estirpe FVB/n e do sexo feminino, dos quais 38 transgénicos (hemizigóticos
HPV16+/-) e 12 wild-type (hemizigóticos HPV16-/-). Os animais foram obtidos por reprodução a partir da colónia desta estirpe, estabelecida previamente no biotério da Universidade de Trás-os-Montes e Alto Douro. Esta colónia foi estabelecida a partir de 3 casais de animais generosamente doados pelos Drs. Jeffrey Arbeit e Douglas Hanahan, da Universidade da Califórnia, através do EUA National Cancer Institute Mouse Repository. A genotipagem dos animais foi realizada no Instituto Português de Oncologia do Porto, através de métodos já publicados (Paiva et al., 2015).
Os animais foram mantidos de acordo com a legislação nacional (Decreto-Lei 113, 7 de Agosto) e europeia (Diretiva 2010/63/EU), sobre a proteção de animais para experimentação, após aprovação pela comissão de ética da UTAD (10/2013) e pela Direcção-Geral de Agricultura e Veterinária (autorização número 0421/000/000/2014). As condições de saúde de cada animal foram avaliadas semanalmente. As instalações foram mantidas a uma temperatura de 21 ± 1ºC e a humidade relativa de 55%, com um ciclo de 12 horas de luz e 12 horas de escuridão por dia.
3.2 - Compostos
Os compostos a testar - rutina e curcumina (Sigma-Aldrich, Saint-Louis, Missouri) - foram dispersados em óleo de girassol (3.0% w/w), que serviu como veículo e incorporados na ração. Os compostos foram incorporados através de uma técnica de coating (revestimento) dos pellets da ração, com ajuda de um misturador industrial, para uma concentração final de 2,0 mg/g de cada composto. Foi estimada uma ingestão alimentar diária de 5 g/murganho, permitindo assim uma ingestão de 10 mg diários de rutina ou curcumina.
Material e métodos
- 20 -
3.3 - Desenho experimental
Os murganhos utilizados tinham, no início da experiência, 6 semanas de vida. Os animais foram divididos em 4 grupos experimentais (Tabela 3) e alimentados com as rações tratadas com curcumina e rutina ou com a ração de controlo (só com óleo), durante 23 semanas consecutivas. Ao longo desse tempo registou-se semanalmente o peso dos murganhos, o peso da comida e o peso da água consumidas por cada grupo.
Tabela 3 – Distribuição dos murganhos k14-HPV16 pelos diferentes grupos experimentais.
Grupos experimentais Número de animais Tratamento 1 12 Controlo negativo (HPV16
-/-) com comida com óleo de girassol
2 13 Controlo positivo (HPV16
-/+
) com comida com óleo de girassol
3 12 HPV16-/+ com comida com rutina 4 13 HPV16-/+ com comida com curcumina
O desenho experimental do protocolo encontra-se descrito na figura 7.
Material e métodos
- 21 -
No fim dos procedimentos experimentais, às 30 semanas de idade dos animais, os grupos experimentais foram sacrificados, por overdose de pentobarbital por via intraperitoneal, seguido por punção cardíaca e exsanguinação, tal como o recomendado pela FELASA.
3.4 - Necrópsia e recolha das amostras biológicas
Após a eutanásia, os animais foram necropsiados, tendo sido colhidas amostras dos órgãos internos de cada animal, bem como as mostras de pele utilizadas neste trabalho. As amostras foram fixadas em formaldeído tamponado a 10% e processadas para análise histológica e imuno-histoquimica.
3.5 - Análise histológica
O material foi processado de acordo com o procedimento de rotina para a microscopia ótica e incluído em blocos de parafina. Dos blocos de parafina foram realizados cortes com 2μm de espessura num micrótomo de rotação Leica® 20035. As preparações foram desparafinadas em xilol, hidratadas em álcoois de concentração decrescente e coradas pela hematoxilina e eosina, após o que se procedeu à sua desidratação (álcoois de concentração crescente), diafanização (em xilol) e avaliação histológica. As preparações histológicas foram avaliadas independentemente por dois investigadores e foram classificadas como pele normal, hiperplasia epidérmica e displasia epidérmica.
3.6 - Imuno-histoquimica
Para a análise imuno-histoquimica da expressão da COX-2, foram utilizados cortes adesivados. Procedeu-se à desparafinação dos cortes em xilol durante 20 minutos, à sua rehidratação através da passagem por álcoois em concentrações decrescentes e a duas vezes a sua lavagem em água destilada. A técnica de imuno-histoquimica foi realizada recorrendo ao kit Ultravision Detection System, segundo as instruções do fabricante.
Material e métodos
- 22 -
A recuperação antigénica por tratamento térmico foi realizada em tampão citrato (pH 6.0) no micro-ondas a 750W em 3 ciclos durante 5 minutos cada, com intervalos de 2 minutos. Após um período de arrefecimento de 30 minutos, foi realizado o bloqueio da peroxidase presente nos tecidos, uma vez que o método de deteção tira partido da ação da enzima peroxidase. Para o bloqueio da peroxidase endógena incubaram-se as amostras numa solução aquosa de peroxido de hidrogénio a 3.0% durante 3 minutos.
Foi realizada duas lavagens em PBS (Tampão fosfato salino, pH=7.4) durante 5 minutos cada, seguida de incubação com uma solução de bloqueio das imunoglobulinas endógenas (Ultra V Block), à temperatura ambiente durante 5 minutos, para evitar ligações inespecíficas.
Depois, realizou-se a incubação com um anticorpo primário anti-COX-2 diluído com PBS, com diluição de 1:300 durante 2 horas, à temperatura ambiente.
Após o período de incubação e duas lavagens de 5 minutos com PBS, a amostra foi incubada com um anticorpo secundário biotinilado (Biotinylated Goat Polyvalent Secundary) durante 10 minutos. Depois de mais duas lavagens de 5 minutos com PBS, foi realizada a incubação com o complexo streptavidina – peroxidase durante 10 minutos, após os quais se realizaram novas lavagens com PBS.
Iniciou-se então a reação de detecção, adicionando uma solução de diaminobenzidina, durante um período de 5 minutos, preparada segundo as instruções do fabricante, depois da qual se procedeu à lavagem com água corrente durante 5 minutos e uma posterior com agua destilada.
A contra-coloração foi feita com hematoxilina de Gill durante um minuto. Por fim, procedeu-se à desidratação dos cortes com álcoois de concentrações crescentes durante 3 minutos e xilol durante 5 minutos, e à montagem com Entellan (Merck). As amostras foram avaliadas em microscopia óptica por dois investigadores independentes. Para a avaliação semi-quantitativa da imunoexpressão da COX-2, na derme e a epiderme, foram tidas em conta a intensidade da imunomarcação (classificada como 1 - fraca, 2- moderada e 3 - intensa) e a extensão da imunomarcação (1 a 4, por ordem crescente de extensão). Foi ainda obtido um
score de imunomarcação, multiplicando o valor relativo à extensão pelo valor relativo à
Material e métodos
- 23 -
3.7 – Analise Estatística
Os resultados foram analisados estatisticamente utilizando o Statistical Package for
the Social Sciences (SPSS) versão 17 (SPSS Inc., EUA). Realizou-se o teste de Levene, de
forma a verificar se existia homogeneidade de variâncias. Quando se verificou uma homogeneidade de variâncias as diferenças dos vários parâmetros entre os grupos foram interpretadas utilizando a análise de variância (one way anova) e teste de Bonferroni. Quando foi observada uma heterogeneidade de variâncias efetuou-se o teste de Games O’Well. Para comparação de grupos dois a dois foi utilizado o teste t de Student. Onde adequado, os valores foram expressos sob a forma de média ± desvio padrão. O tempo de sobrevida do primeiro dia de tratamento até ao fim do estudo foi estimado pelo método de Kaplan-Meier. Os valores obtidos foram considerados como significativos para valores de p <0,05.
Resultados
- 25 -
III.
Resultados
4.1 - Mortalidade
Neste estudo deve-se mencionar que morreram 5 dos 13 animais iniciais no grupo de controlo positivo, restando assim 8 murganhos no fim do período experimental (Figura 8). Em relação aos outros grupos, os murganhos sobreviveram até ao final do estudo.
Figura 8 – Curvas de Kaplan-Meier refletindo a sobrevida dos animais de cada grupo experimental.
4.2 - Consumo de comida e água e evolução do peso corporal
Não foram observadas diferenças entre grupos relativamente ao consumo de comida (Gráfico 2). Já em relação ao consumo de água ao longo das 23 semanas (Gráfico 3), nota-se que no caso dos murganhos transgénicos, os valores são sempre superiores aos do controlo negativo e aumentam progressivamente ao longo do período experimental. No entanto, o
Resultados
- 26 -
consumo dos controlos positivos (grupo 2) diminui abruptamente a partir da vigésima primeira semana, enquanto o dos transgénicos alimentados com curcumina e rutina mantém a tendência anterior de aumento. Por último, o peso corporal destes animais (Gráfico 4) foi muito semelhante ao longo da investigação, embora os controlos negativos (HPV-/-) exibam um peso superior ao dos restantes grupos (HPV+/-).
Gráfico 2 - Consumo médio de comida por grupo.
15,00 17,00 19,00 21,00 23,00 25,00 4 8 12 16 20 24 Co m ida ( G ra m a s) Semanas Consumo de comida HPV (-/-): Comida com óleo (Grupo 1) HPV (+/-): Comida com óleo (Grupo 2) HPV (+/-): Comida com rutina (Grupo 3) HPV (+/-): Comida com curcumina (Grupo 4)
Resultados
- 27 -
Gráfico 3 - Consumo médio de água por grupo.
Gráfico 4 - Peso médio de murganhos.
y = 0,5016x + 19,301 R² = 0,7135 y = 2,652x + 25,758 R² = 0,8915 15,00 20,00 25,00 30,00 35,00 40,00 45,00 4 8 12 16 20 24 Ág ua ( g ra m a s) Semanas Consumo de água HPV (-/-): Comida com óleo (Grupo 1) HPV (+/-): Comida com óleo (Grupo 2) HPV (+/-): Comida com rutina (Grupo 3) HPV (+/-): Comida com curcumina (Grupo 4) Linear (HPV (-/-): Comida com óleo (Grupo 1)) Linear (HPV (+/-): Comida com curcumina (Grupo 4)) 15 17 19 21 23 25 27 29 0 4 8 12 16 20 24 P eso co rpo ra l (g ra m a s) Semanas Peso corporal HPV (-/-): Comida com óleo (Grupo 1) HPV (+/-): Comida com óleo (Grupo 2) HPV (+/-): Comida com rutina (Grupo 3) HPV (+/-): Comida com curcumina (Grupo 4)
Resultados
- 28 -
4.3 - Avaliação histológica das lesões cutâneas
Histologicamente, todos os murganhos HPV16-/- (grupo 1) apresentaram pele histologicamente normal e todos os murganhos HPV16+/- (grupos 2, 3 e 4) apresentaram lesões pré-neoplásicas, classificadas como hiperplasia e displasia epidérmicas (Figura 9). A hiperplasia foi caracterizada pelo espessamento da epiderme, com acantose, hiperqueratose ortoqueratótica e ocasional papilomatose, bem como pela retenção da normal diferenciação dos queratinócitos. A inflamação dérmica era leve, com alguns macrófagos, linfócitos e mastócitos presentes na derme superficial. As lesões displásicas ocorreram como pequenos focos displásicos epidérmicos num fundo hiperplásico ou como displasia difusa da epiderme. As lesões displásicas foram caracterizadas por perda da diferenciação e polaridade normal dos queratinócitos com disqueratose, hiperqueratose paraqueratótica e pleomorfismo nuclear moderado a intenso, bem como pela presença de mitoses em estratos celulares superiores ao estrato basal. Estas lesões também apresentaram um aumento dos fenómenos inflamatórios presentes na derme, com abundantes infiltrados inflamatórios compostos por macrófagos, linfócitos, mastócitos, plasmócitos e neutrófilos. Não foram observadas diferenças na distribuição das lesões histológicas entre os grupos de animais HPV16+/- tratados (grupos 3 e 4) e não tratados (grupo 2): todos os animais apresentaram lesões displásicas, focais ou difusas, intercaladas com áreas hiperplásicas.
Figura 9 - Histologia da pele entre os animais experimentais às 30 semanas de idade (H&E, 200x). As imagens
Resultados
- 29 -
4.4 - Imunoexpressão da COX-2
Nos animais do grupo 1 (HPV-/-), não se observou imunomarcação da epiderme, nem da derme em 100.0% dos animais. Já no grupo 2 (HPV+/-), observou-se imunomarcação epidérmica, moderada a forte, de padrão citoplasmático difuso. A derme apresentou imunomarcação difusa e intensa. Os animais tratados com rutina (grupo 3) exibem menor intensidade de marcação dérmica e epidérmica, em comparação com o grupo 2. Os animais do grupo 4 (tratados com curcumina) apresentam redução da marcação epidérmica, mas não foram observadas diferenças na derme, relativamente ao grupo 2 (Tabela 4 e Figuras 10 a 13).
Tabela 4 - Análise semi-quantitativa da imunomarcação para a COX-2 em todos os grupos experimentais.
Grupo Derme Epiderme
Extensão Intensidade Score Extensão Intensidade Score
1 (n=12)HPV-/- 0±0a 0±0a 0±0a 0±0a 0±0a 0±0a 2 (n=8) HPV+/- 3,75±0,46 3,00±0,0 11,25±1,39 3,50±0,76c 2,88±0,35d 10,00±2,33d 3 (n=12) HPV+/- Rutina 3,08±0,67 b 2,58±0,51 7,83±1,90b 2,67±0,89 1,83±0,72 4,50±1,24 4 (n=12) HPV +/-Curcumina 3,83±0,39 2,75±0,45 10,50±1,88 2,08±0,67 2,17±0,39 4,50±1,51
a - Diferenças estatisticamente significativas dos grupos 2,3 e 4 (p<0.05); b - Diferenças estatisticamente significativas dos grupos 2 e 4 (p<0.05); c Diferenças estatisticamente significativas do grupo 4 (p<0.05); d -Diferenças estatisticamente significativas dos grupos 3 e 4 (p<0.05).
Resultados
- 30 -
Figura 10 - Imunomarcação para a COX-2, animal do grupo 1. DAB - hematoxilina de Gill, 40x.
.
Figura 11 - Imunomarcação para a COX-2, animal do grupo 2. DAB - hematoxilina de Gill, 200x.
Resultados
- 31 -
Figura 12 - Imunomarcação para a COX-2, animal do grupo 3. DAB - hematoxilina de Gill, 200x.
Discussão e conclusões
- 33 -
IV.
Discussão e conclusões
Neste estudo, verificou-se o desenvolvimento de lesões pré-neoplásicas cutâneas em todos os animais transgénicos, mantendo os animais wild-type a histologia normal da pele. No entanto, a incidência de lesões cutâneas não foi alterada pela administração de curcumina ou de rutina - estes compostos não foram eficazes na prevenção da displasia induzida pelo HPV16.
Estes resultados contrastam com a conhecida atividade anti-neoplásica da curcumina (Pintão e Silva, 2008), pelo que, no futuro, poderá ser testada a eficácia de doses superiores do mesmo composto neste modelo.
A imuno-histoquimica pode ser aplicada na oncologia veterinária, como ferramenta auxiliar, para o diagnóstico exato de neoplasmas indiferenciados e determinação da origem de metástases (Werner et al., 2005; Ramos-Vara et al., 2008). A identificação de recetores celulares e moléculas relacionadas com a progressão tumoral permite caracterizar o imunofenótipo das células neoplásicas (Mohammed et al., 2011), constituindo fatores prognósticos importantes (Werner et al., 2005; Ramos-Vara et al., 2008). Esta técnica baseia-se na utilização de anticorpos para identificação de um antigénio in situ (Leong e Wright, 1987; Ramos-Vara, 2008; Ramos-Vara, 2011).
No presente estudo, a expressão da COX-2 foi estudada por imuno-histoquimica nos quatro grupos experimentais. Verificou-se que os animais transgénicos para o HPV16 exibem uma elevada expressão da COX-2 nas células pré-neoplásicas da epiderme, quando comparados com os controlos wild-type. Os mesmos animais exibem também intensa imunomarcação da derme subjacente às lesões, provavelmente associada à intensa inflamação que ali se desenvolve. Estes resultados estão de acordo com a observação de que as lesões induzidas pelo HPV neste modelo exibem intensa inflamação, dado que a COX-2 produz prostaglandina E2, um importante mediador da inflamação.
A administração de rutina e curcumina conseguiu reduzir a expressão da COX-2 nas lesões cutâneas, sobretudo na epiderme. No entanto, como referido acima, este efeito não foi suficiente para impedir o desenvolvimento de displasia epidérmica.
Apesar de não terem reduzido a incidência de lesões pré-neoplásicas, a rutina e a curcumina aumentaram a sobrevivência dos animais. De facto, nenhum dos animais tratados com estes compostos morreu durante o estudo, enquanto entre os animais não tratados, a mortalidade foi elevada. Neste contexto, os animais transgénicos sem tratamento
Discussão e conclusões
- 34 -
manifestaram uma redução drástica da ingestão de água nas últimas semanas de vida, que não se verificou nos animais tratados. Conforme já publicado, a curcumina e a rutina conseguiram também reduzir a inflamação sistémica nos animais tratados, o que se manifestou por números mais reduzidos de leucócitos circulantes no sangue periférico, bem como por fenómenos inflamatórios menos expressivos no baço e no fígado (Gil da Costa et al., 2016). Esta atenuação da inflamação sistémica é uma causa provável da maior sobrevivência dos animais tratados com curcumina e rutina. Permanece por determinar se a redução da inflamação sistémica está relacionada com a menor expressão da COX-2 a nível cutâneo, que provavelmente terá levado a uma menor libertação de prostaglandina E2, com a consequente atenuação dos fenómenos inflamatórios.
Assim, é possível concluir deste trabalho que:
1 - As lesões induzidas pelo HPV16 neste modelo animal sobre-expressam a COX-2 a nível dérmico e epidérmico;
2 - Esta sobre-expressão pode ser, pelo menos parcialmente, reduzida através da administração oral de curcumina e rutina;
3 - Estes compostos, nas doses administradas, não apresentaram efeitos sobre a incidência das lesões víricas;
4 - Apesar disso, os dois compostos melhoraram significativamente a sobrevida dos animais.
Perspetivas futuras
- 35 -
V.
Perspetivas futuras
Tendo em conta os resultados do presente trabalho, torna-se pertinente estudar, no futuro próximo:
- Os efeitos de doses superiores de curcumina e rutina neste modelo, tentando estabelecer relações dose-efeito;
- Estudar os níveis de prostaglandina E2 nas lesões destes animais, usando-os como marcador do efeito dos anti-inflamatórios;
- Estudar os níveis de mediadores inflamatórios no sangue (ex. interleucina 1).
Num futuro mais afastado, perspetiva-se o estudo de outros compostos anti-inflamatórios neste modelo, de forma a comparar a sua eficácia e segurança.