UNIVERSIDADE FEDERAL DA PARAÍBA CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS NATURAIS E SINTETICOS BIOATIVOS
AVALIAÇÃO DOS EFEITOS ANTICANCERÍGENOS DOS
1,2,3-TRIAZÓIS DERIVADOS DO NÚCLEO 1,4-NAFTOQUINONA EM
LINHAGENS LEUCÊMICAS HUMANAS
TANGBADIOA HERVÉ COULIDIATI
JOÃO PESSOA-PB
TANGBADIOA HERVÉ COULIDIATI
AVALIAÇÃO DOS EFEITOS ANTICANCERÍGENOS DOS
1,2,3-TRIAZÓIS DERIVADOS DO NÚCLEO 1,4-NAFTOQUINONA EM
LINHAGENS LEUCÊMICAS HUMANAS
Orientador:
Prof. Dr. Demétrius Antonio Machado de Araújo
Co-orientador:
Prof. Dr. Eduardo de Jesus Oliveira
JOÃO PESSOA-PB
2014
TANGBADIOA HERVÉ COULIDIATI
AVALIAÇÃO DOS EFEITOS ANTICANCERÍGENOS DOS 1,2,3-TRIAZÓIS DERIVADOS DO NÚCLEO 1,4-NAFTOQUINONA EM LINHAGENS
LEUCÊMICAS HUMANAS
BANCA EXAMINADORA
Prof. Dr. Demétrius Antonio Machado de Araújo (Orientador) PgPNSB/UFPB
Profa. Dra. Márcia Regina Piuvezam (Membro interno) PgPNSB/UFPB
Profa. Dra. Sandra Rodrigues Mascarenhas (Membro interno) PgPNSB/UFPB
Prof. Dr. Celso de Amorin Camara (Membro externo) UFRPE
Profa. Dra. Patricia Mirella da Silva Scardua (Membro externo) DBM/UFPB
Dedico essa tese
o meu Pai, a minha mãe
e os meus irmãos,
A gradecimentos
Primeiramente, quero agradecer profundamente ao convênio T WA S -C N Pq, F R number: 3240223361, pela oportunidade que eles me ofereceram com a bolsa de
doutorado, o que permitiu a realização desse trabalho.
M eus agradecimentos ao C N Pq e ao C A PE S pelo apoio financeiro ao laboratório que também permitiu à realização desse trabalho.
A gradeço a U niversidade F ederal da Paraíba, através do Programa de Pós-graduação em Produtos N aturais e S intéticos B ioativos para me aceitar como estudante de doutorado em convênio.
M eus sinceros agradecimentos ao Prof. D r. D emetrius A ntonio M achado de A raújo (O rientador), pela dedicação ao ensino, à pesquisa e pela orientação segura e paciente que possibilitou a realização desse trabalho, pela convivência diária e amizade sincera e atenciosa.
M eus sinceros agradecimentos ao Prof. D r. E duardo de J esus O liveira, co-orientador dessa tese. É com você que tudo iniciou desde o dia que respondeu a minha mensagem sem mesmo me conhecer. O brigado para essa oportunidade que me ofereceu e para ter sido me colocado em contacto com o Prof. D r. D emetrius.
A gradeço ao Prof. D r. Valdir de A ndrade B raga pelos encorajamentos e em aceitar de fazer parte da minha banca de qualificação.
M euss agradecimentos a todos os professores do programa, especificamente a aqueles com quem paguei as disciplinas do doutorado.
M eus agradecimentos ao Prof. D r. J uan C arlos com que estabeleci uma verdadeira amizade. O brigado por tudo e também de me apresentar aos integrantes das nossas peladas de baskete, especialmente o L eandro, meu parceiro quando quero tomar umas.
M eus agradecimentos a essas pessoas maravilhosas que sempre tiveram comigo no laboratório e com quem aprendi muito: G laucia, B runa e D ra. A letheia.
M eus agradecimentos à D ra. T eresa C ristina (T C ris) que sempre quis me ver feliz. M uito obrigado pelo apoio moral. A o Itacío pela convivência no laboratório e pelas explicações quando quero tirar duvidas.
M eus agradecimentos a todos os membros do laboratório: A liny, Refany, C aio, C arol, Priscilla, L ais, K atyana, Izabela e A ndressa pela convivência diária no laboratório.
M eus agradecimentos ao Prof. D r. E néas e à D ra. A line pelas suas contribuições preciosas nos experimentos de PC R e de microscopia de fluorescência.
M eus agradecimentos a todos os estudantes africanos em J oão Pessoa, Recife e N atal com quem tive uma relação de fraternidade aqui no B rasil.
Lista de Figuras
Figura 1: Capacidade biológica adquirida por células cancerosas durante o processo
de tumorigênese. ... 19
Figura 2: Localização dos pontos de interrupção nos genes ABL e BCR e a estrutura dos RNAm quiméricos resultantes. ... 25
Figura 3: Representação esquemática do ciclo celular da mitose. ... 26
Figura 4: O processo de controle do ciclo celular. ... 29
Figura 5: Micrografias eletrônicas ilustrativas dos tipos de morte celular e as suas características morfológicas. ... 33
Figura 6: As duas principais vias que levam a apoptose. ... 35
Figura 7: Classificação das quinonas. ... 44
Figura 8: Estrutura do núcleo 1H-1,2,3-triazol não substituído. ... 46
Figura 9: A reação de síntese do anel 1,2,3-triazol. ... 47
Figura 10: Presencia do núcleo 1,2,3-triazóis em várias moléculas com atividades biológicas. ... 49
Figura 11: Estruturas químicas das 1,2,3-triazol-1,4-naftoquinonas (C2-C8) e seu precursor azida (C1). ... 54
Figura 12: Analise da fragmentação do DNA por eletroforese nas células HL-60 e K562. ... 79
Figura 13: indução da condensação do material genético. ... 80
Figura 14: Efeito do C2 e C3 na externalização da fosfatidilserina ... 86
Figura 15: Efeito de C2 e C3 na expressão das proteínas associadas a apoptose nas células HL-60. ... 88
Figura 16: Efeito de C2 e C3 na expressão da proteína ERK em células HL-60. ... 99
Figura 17: Proposição do mecanismo de ação dos compostos C2 e C3 na linhagem de leucemia mielóide aguda (HL-60). ... 109
Lista de Grafícos
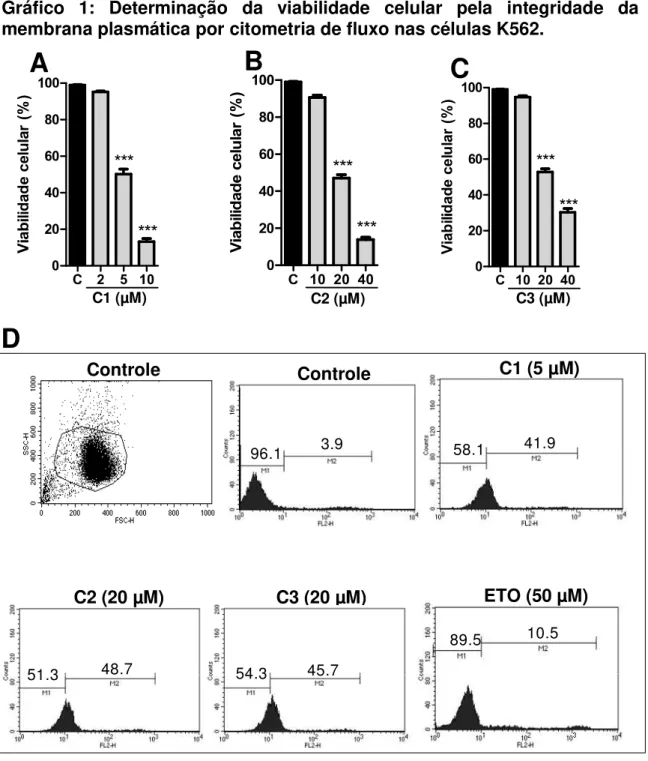
Gráfico 1: Determinação da viabilidade celular pela integridade da membrana
plasmática por citometria de fluxo nas células K562. ... 72 Gráfico 2: Determinação da viabilidade celular pela integridade da membrana
plasmática por citometria de fluxo nas células HL-60. ... 73 Gráfico 3: Determinação da viabilidade celular pela integridade da membrana
plasmática por citometria de fluxo nas PBMCs. ... 74 Gráfico 4: Histogramas representativos do efeito dos compostos C2 e C3 na
distribuição do ciclo celular em PBMC após 24 horas de incubação. ... 78 Gráfico 5: Avaliação do efeito de C2 e C3 sobre a despolarização da membrana
mitocondrial. ... 82 Gráfico 6: Avaliação do efeito de C2 e C3 sobre a despolarização da membrana
Lista de Tabelas
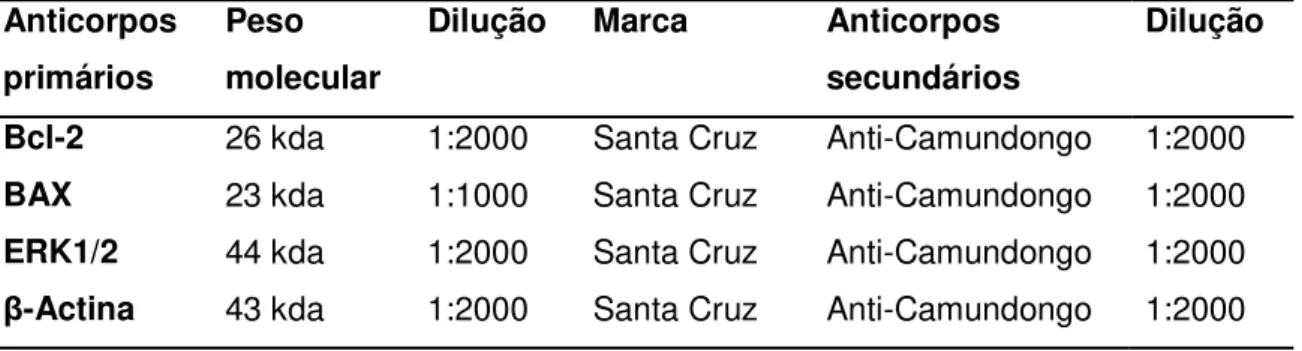
Tabela 1: Classificação Franco-Americo-Britanico dos vários subgrupos de Leucemia Mielóide Aguda. ... 23 Tabela 2: Sequencia dos primers utilizados na realização de PCR em K562. ... 65 Tabela 3: Anticorpos primários e secundários usados na técnica de Western Blot, e respectivas diluições. ... 66 Tabela 4: Atividade citotóxica em IC50 dos compostos e etoposideo (ETO) em
Lista de Abreviaturas
ABL: Abelson leucemia vírus
AIF: Fator de indução da apoptose
APAF: Apoptotic protease activating factor
ASXL1: Additional sex combs like transcriptional regulator 1
ATP: Adenosine triphosphate
BAX:Bcl2-associated X
Bcl-2: B-cell lymphoma 2
BCR: Breakpoint cluster region
BSA: Albumina de soro bovina
CDKIs: Inibidores de CDKs
CDKs: Quinases dependente de ciclinas
CEBPA: CCAAT/enhancer-binding protein alpha
CMA: autofagia mediada por chaperoninas
CTHs: Células-tronco hematopoiéticas
DCF: Diclorofluoresceina
DMSO: Dimetilsulfoxido
DNA: Acido desoxiribonucleico
DTT: Ditiotreitol
EDTA: Ácido etilenodiamino tetra-acético
ERK: Quinases reguladas por sinais externos
EROS: Espécies reativas de oxigênio
FAB: Sistema franco-americo-britânico
FLT3: FMS-like tyrosina quinase 3
H2O2: Peróxido de hidrogênio
IAF: Fator de inibição da apoptose
IP: Iodeto de propídeo
Kv1.3: Canal de potássio dependente de voltagem, tipo 1.3
LLA: Leucemia linfóide aguda
LLC: Leucemia linfóide crônica
LMA: Leucemia mielóide aguda
LMC: Leucemia mielóide crônica
MAPKs: Proteínas quinases ativadas por mitogênos
MDR: Resistência a multidroga
MTT: Brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio
NAC: N-acetil cisteina
NPM1: Nucleophosmin
PBMC: Células mononucleares do sangue periférico
PBS: Tampão fosfato salina
PD98059: inibidor de ERK
PTP: Poro de permeabilidade transitório
RNA: Acido ribonucleico
SB203580: inibidor de p38 MAPK
SDS: Dodecilsulfato de sódio
SBF: Soro bovino fetal
TBS-T: Tampão salina de tris
TGF-β: Tumor growth factor β
TMRM: Tetrametilrodamina metil ester
TNF: Fator de necrose tumoral
TNFR1: Fator de necrose tumoral receptor 1
COULIDIATI, T.H. Avaliação dos efeitos anticancerígenos dos 1,2,3-triazóis derivados do núcleo 1,4-naftoquinona em linhagens leucêmicas humanas. 2014. 129f. Tese de Doutorado – Universidade Federal da Paraíba, João Pessoa.
Resumo
O núcleo triazol e seus derivados têm atraído uma atenção considerável nessas últimas décadas devido ao seu potencial quimioterápico. Mais especificamente, tem se verificado o interesse em moléculas que contêm o grupo 1,2,3-triazol, isto porque esta classe de heterocíclicos é conhecida por exibir uma vasta gama de atividades biológicas, tais como, anti-proliferativo e anti-neoplásico. O objetivo desse trabalho foi o de avaliar o potencial anticancerígeno de novos triazóis derivados do 1,4-naftoquinona, elucidando as suas citotoxicidades e o mecanismo de morte envolvido. Os resultados obtidos revelaram que, das cinco linhagens cancerígenas testadas, as linhagens leucêmicas HL-60 e K562 foram as mais sensíveis, e dentre os oito compostos (denominados C1 a C8) testados, C2 e C3 foram os mais citotóxicos, apresentando CI50 de 14 μM e 41 μM, em HL-60 e de 24 μM e 81 μM em K562, respectivamente. Entretanto, os compostos foram menos citotóxicos nas células normais do sangue periférico humano com CI50 acima 80 μM. Investigando o tipo de morte induzido pelos compostos nas duas linhagens, foi demonstrado que os compostos C2 e C3 induziram apoptose em HL-60. Já nas células K562, este dois derivados provocaram a parada do ciclo celular na fase S e necrose. A parada do ciclo celular na fase S em K562 foi relacionada com a expressão do gene p21. Foi revelado a diminuição da expressão da proteína Bcl-2 e o aumento da expressão da proteína BAX nas células HL-60, e ainda verificou-se a liberação do citocromo c sugerindo a participação da via intrínseca na indução da apoptose em HL-60. A ativação dessa via pode ser via inibição da fosforilação da proteína ERK. Os resultados mostraram também que durante uma hora de pré-tratamento das células HL-60 com o N-acetil cisteina (1 mM), houve a redução da citotoxicidade dos compostos C2 e C3 de 30,83% e 26,47% respectivamente; indicando que a indução da apoptose em HL-60 é mediada pelo aumento da produção das espécies reativas de oxigênio intracelulares. Dessa forma, pode-se concluir que os compostos C2 e C3 apresentaram efeitos citotóxicos frente às linhagens HL-60 e K562, então, podem ser considerados como protótipo de moléculas anti-leucêmicas.
Palavras chave: Apoptose; Ciclo celular; Citotoxicidade; Citometria de fluxo;
COULIDIATI, T.H. Evaluation of anticancer effects of 1,2,3-triazoles derivates to the nucleus 1,4-naphthoquinone in human leukemic cell lines. 2014. 129f. PhD thesis. Federal University of Paraíba – João Pessoa.
Abstract
The triazole nucleus and its derivatives have attracted considerable attention in recent decades for their chemotherapeutic potentials. Specifically, the interest in molecules containing the 1,2,3-triazole as chemotherapeutic agents for various diseases has increased, because they are known to exhibit a wide range of biological activities, such as anti-proliferative and anti-neoplastic. The aim of this study was to evaluate the potencial anti-cancer effect of new triazole derivatives from 1,4-naphthoquinone, elucidating their cytotoxicity and cell death mechanisms involved. From five cancer cell lines tested, leukemic cells (HL-60 and K562) were the most sensitive, and between the eight triazole compounds tested (called C1 to C8), compounds C2 and C3 showed the best IC50 of 14 μM and 41 μM for HL-60 cells and 24 μM and 81 μM for K562 cells, respectively. However, these two compounds showed very little cytotoxic effect towards PBMC normal cells with IC50 superior to 80 μM. Investigating the type of cell death induced by compounds C2 and C3, it was showed that compounds induced apoptosis in HL-60 cells and cell cycle arrest in the S-phase, and necrosis in K562 ones. Cell cycle arrest in S phase was related to the expression of the p21 gene in K562. Results revealed a reduced expression of Bcl-2 protein and an increased expression of BAX protein in HL-60 cells. Moreover, it was found cytochrome c release, suggesting involvement of the intrinsic pathway in apoptosis induction in these cells. Activation of this pathway may be through inhibition of ERK phosphorylation. Our results also showed that pre-treatment of HL-60 cells with N-acetyl cysteine (1 mM) for 1 hour reduced the cytotoxic effect of compounds C2 and C3 for 30,83% and 26,47% respectively; indicating that the induction of apoptosis in HL-60 is mediated by increased production of intracellular ROS. Thus, it can be concluded that C2 and C3 compounds showed cytotoxic effects on HL-60 and K562 cells, so, can be considered as prototype anti-leukemic molecules.
Keywords: Apoptosis; Cell cycle; Cytotoxicity; Flow cytometry; Myeloid
Sumário
1. Introdução ... 16
1.1 Tumor ... 16
1.2 Câncer ... 16
1.2.1 Definição ... 16
1.2.2 A transformação maligna ... 17
1.2.3 As características do câncer ... 18
1.3 Epidemiologia do câncer ... 19
1.4 Leucemia ... 21
1.4.1 Leucemia mielóide aguda ... 22
1.4.2 Leucemia mielóide crônica... 23
1.5 Ciclo celular ... 25
1.5.1 Divisão celular ... 25
1.5.2 Sistema de controle do ciclo celular ... 27
1.6 Morte celular ... 29
1.6.1 Autofagia ... 30
1.6.2 Senescência ... 31
1.6.3 Mitose catastrófica ... 31
1.6.4 Necrose ... 32
1.6.5 Apoptose ... 33
1.6.5.1 Alterações morfológicas e bioquímicas da apoptose. ... 34
1.6.5.2 Mecanismo da apoptose ... 35
1.7 Mitocôndria ... 37
1.8 Sinalização celular em modelos de câncer ... 39
1.9 Espécies reativas de oxigênio ... 40
1.10 Quimioterapia do câncer ... 42
1.11 Derivados triazóis de quinonas ... 44
1.11.1 Naftoquinonas ... 44
1.11.2 1,2,3-triazóis ... 45
1.11.2.1 Estrutura e síntese ... 45
2. Objetivos ... 50
2.1 Objetivo geral ... 50
2.2 Objetivos específicos ... 50
3. Material e Métodos ... 51
3.1 Material ... 51
3.1.1 Equipamentos ... 51
3.1.2 Reagentes e compostos utilizados ... 52
3.1.3 Soluções ... 52
3.1.4 Compostos estudados ... 53
3.1.5 Linhagens celulares ... 54
3.1.5.1 Linhagens leucêmicas (HL-60, K562, K562-Lucena) ... 54
3.1.5.2 Linhagens de adenocarcinoma de mama (MCF-7) e de cólon (HT-29) ... 55
3.1.5.3 Células do sangue periférico (PBMC) ... 55
3.2 Métodos ... 56
3.2.1 Teste de viabilidade preliminar das culturas celulares ... 56
3.2.2 Teste de viabilidade celular pelo método colorimétrico do MTT ... 57
3.2.3 Ensaio da integridade da membrana plasmática por citometria ... 58
3.2.4 Análise do ciclo celular por citometria ... 58
3.2.5 Avaliação da fragmentação do DNA ... 59
3.2.5.1 Extração do DNA ... 59
3.2.5.2 Eletroforese em gel de agarose ... 59
3.2.6 Análise da condensação da cromatina por microscopia de fluorescência ... 60
3.2.7 Avaliação do potencial da membrana mitocondrial por citometria ... 60
3.2.8 Teste da externalização da fosfatidilserina por citometria ... 61
3.2.9 Análise da externalização da fosfatidilserina por microscopia de fluorescência ... 62
3.2.10 Avaliação da produção das espécies reativas de oxigênio ... 62
3.2.11 Análise da expressão relativa do gene p21. ... 63
3.2.12 Análise da expressão de proteínas por Western blot ... 65
3.2.12.1 Preparo das amostras ... 65
3.2.12.2 Dosagem de proteína (Método de Bradford): ... 65
3.2.12.3 Eletroforese e electrotransferência ... 65
3.2.12.4 Imunodeteção de proteínas com anticorpos específicos... 66
3.3 Análise estatística ... 68
4. Resultados ... 69
4.1 Efeito citotóxico dos compostos ... 69
4.2 Análise da viabilidade celular pela avaliação da integridade da membrana celular. ... 71
4.3 Efeito dos compostos no ciclo celular ... 75
4.4 Avaliação do dano do material genético ... 79
4.5 Efeito dos compostos na despolarização do potential da membrana mitocondrial 81 4.6 Avaliação da exteriorização da fosfatidilserina ... 84
4.7 Avaliação da expressão do RNAm do p21 ... 87
4.8 Análise da expressão das proteínas BAX e Bcl-2 ... 88
4.9 Avaliação da via de indução da apoptose em HL-60 ... 89
4.10 Nível de EROS intracelulares e efeito do NAC ... 91
4.11 Investigação da via de MAPK ... 97
Discussão ... 100
Conclusão ... 111
1. Introdução
1.1 Tumor
Em Patologia, tumor é qualquer massa anômala observada nos tecidos. Se a massa, formada por células, apresenta uma taxa de crescimento persistente e que ultrapassa a taxa de crescimento dos tecidos normais, define-se uma neoplasia. As neoplasias são classificadas em benignas e malignas. Enquanto neoplasias benignas tendem a crescer de maneira circunscrita ao seu tecido de origem; neoplasias malignas caracterizam-se pelo crescimento invasivo e sua disseminação por vasos sanguíneos ou linfáticos, dando origem às metástases. As neoplasias malignas são conhecidas como cânceres (HANAHAN & WEINBERG, 2000).
1.2 Câncer
1.2.1 Definição
1.2.2 A transformação maligna
A transição de uma célula normal para o estado transformado, ou tumoral, é devida principalmente a uma combinação de eventos genéticos. Especificamente, a transformação maligna é devido a uma acumulação de mutações aleatórias e espontâneas em genes diferentes (normalmente mais de dez) dentro da mesma linhagem celular (LOWE et al., 2004). Essa transformação maligna precisa ser codificada de forma estável de modo que os eventos ontogênicos possam acumular-se nas linhagens clonais. Os mecanismos de mutações genéticas como as alterações, as inserções, as deleções e as recombinações são capazes de induzir mudanças fenotípicas persistentes a uma célula transformada. Por esta razão, o câncer tem sido visto como uma doença baseada principalmente na genética (PONDER, 2001; HAHN & WEINBERG, 2002). No entanto, os eventos genéticos ocorrem em baixa frequência e não são, portanto, um dispositivo particularmente eficaz para a transformação maligna. Também, algumas células superam a transformação maligna por meio da aquisição de processo de reparo do defeito do DNA.
1.2.3 As características do câncer
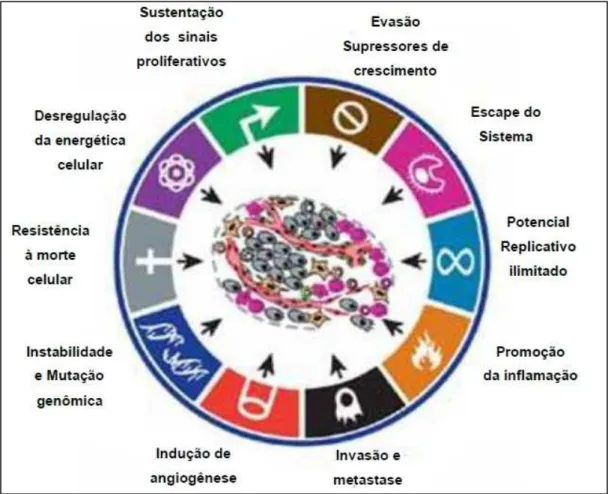
As células malignas atingem o fenótipo tumoral, em grande parte, pela reativação e modificação de muitos programas celulares existentes normalmente, que são utilizados durante o desenvolvimento celular. Esses programas controlam processos coordenados, tais como a proliferação, a migração, a polaridade, a apoptose e a diferenciação durante o desenvolvimento embrionário e a homeostase do tecido (LUO et al., 2009). Assim, danos nesses programas importantes podem resultar, para a célula e a sua progenitora, numa vantagem seletiva sobre as células vizinhas e, desse modo, numa vantagem proliferativa (LOWE et al., 2004). A célula cancerosa resultante evolui devido às alterações genéticas, seguido da seleção clonal das células anormais que podem sobreviver e proliferar em circunstâncias que, normalmente conduziriam a morte celular (LUO et al., 2009; STRATTON et al., 2009).
Figura 1: Capacidade biológica adquirida por células cancerosas durante o processo de tumorigênese.
(Adaptado de HANAHAN & WEINBERG, 2011)
1.3 Epidemiologia do câncer
O câncer é um importante problema de saúde pública em países desenvolvidos e em desenvolvimento, sendo responsável por mais de seis milhões de óbitos a cada ano, representando cerca de 12% de todas as causas de morte no mundo. Embora as maiores taxas de incidência de câncer sejam encontradas em países desenvolvidos, dos dez milhões de casos novos anuais de câncer, cinco milhões e meio são diagnosticados nos países em desenvolvimento (OMS, 2002).
relacionadas ao câncer ocorreu em 2012, em comparação com 12,7 milhões e 7,6 milhões, respectivamente, em 2008. As estimativas de prevalência para 2012 mostram que houve 32,6 milhões de pessoas, com idade superior a 15 anos, vivas que tiveram um câncer diagnosticado nos últimos cinco anos (FERLAY et al., 2013). Os cânceres mais comumente diagnosticados em todo o mundo foram os de pulmão (1,8 milhões, 13,0% do total), de mama (1,7 milhões, 11,9%), e do cólon (1,4 milhões, 9,7%). As causas mais comuns de morte por câncer foram os cânceres de pulmão (1,6 milhões, 19,4% do total), fígado (0,8 milhão, 9,1%) e estômago (0,7 milhão, 8,8%) (FERLAY et al., 2013). Projeções com base nas estimativas GLOBOCAN 2012 prevêem um aumento substancial de 19,3 milhões de novos casos de câncer por ano até 2025, devido ao crescimento e envelhecimento da população global. Mais da metade de todos os cânceres (56,8%) e mortes por câncer (64,9%), em 2012 ocorreram em regiões menos desenvolvidas do mundo, e essas proporções irão aumentar ainda mais em 2025 (Ferlay et al., 2013).
As leucemias foram relatadas na nona e na décima posições, dentre os cânceres comuns em homens e mulheres, respectivamente (JEMAL et al., 2011). Acometem indivíduos de todas as idades e raças, entretanto mais de 50% dos casos ocorrem até os 20 anos de idade, apesar de ser a forma mais comum de leucose no adulto e compreender 10-15% dos casos de leucemia aguda na infância. Esta patologia é rara acima dos 80 anos de idade. Verifica-se predomínio na raça branca e 60% dos casos são no Verifica-sexo masculino (OLANIYI & UMAR, 2013).
Tem sido relatado que indivíduos com síndrome de Down, síndrome de Patau, anemia de Fanconi, síndrome de Kostmann, síndrome de Bloom, síndrome de Klinefelter, neurofibromatose, hemoglobinúria paroxística noturna, policitemia vera, síndromes mielodisplásicas têm predisposição de desenvolver leucemias (RAJABLI et al., 2013).
HIV e HTLV-1) também predispõem ao aparecimento das leucemias agudas (RAJABLI et al., 2013).
1.4 Leucemia
O sistema hematopoiético é organizado a partir de uma hierarquia mantida por células-tronco hematopoiéticas raras (CTHs), que se auto-renovam e se diferenciam para produzir linhagens sanguíneas maduras, garantindo a produção de sangue durante o tempo da vida do organismo (WARNER et al., 2005). As CTHs dão origem a um grupo de células progenitoras que não têm mais o papel de se auto-renovar, que por sua vez dão origem as células que são mais limitadas nos seus potenciais de diferenciação, e finalmente para células maduras funcionais (PASSEGUÉ et al., 2003). Quando os sinais que regem esses processos normais tornam-se desregulados, as leucemias resultam em um acúmulo de células blásticas imaturas, que não conseguem se diferenciar em células funcionais (WARNER et al., 2005). A célula, em que os eventos de transformação acontecem, é desconhecida para a maioria dos tipos de cânceres, mas certos tipos de leucemias surgem devido às mutações que se acumulam nas CTHs (PASSEGUÉ et al. 2003). Assim, a leucemia é uma doença heterogênea, em nível molecular, resultante de uma variedade de alterações de numerosos genes importantes para o crescimento celular, a diferenciação e a morte celular (LI et al., 2005).
1.4.1 Leucemia mielóide aguda
A leucemia mielóide aguda (LMA) é caracterizada pela acumulação de grandes números de células anormais que não conseguem diferenciar-se em granulócitos ou monócitos (BONNET & DICK, 1997). A LMA é uma doença fenotipicamente e geneticamente heterogênea que pode se classificar de M0 a M7 (Tabela 1), de acordo com a classificação FAB (sistema Franco-Americo-Britânico). Grande progresso tem sido feito para compreender os mecanismos de leucemogênese na LMA. Uma das hipóteses mais relevante é a implicação das células-tronco hematopoiéticas primitivas ou as células progenitoras capazes de se transformar numa célula-tronco leucêmica, que mantém a capacidade de se auto-renovar (RENNEVILLE et al., 2008). As duas características fundamentais da LMA, incluem a proliferação desregulada e a sobrevivência celular por ativação dos oncogenes ou desativação dos genes supressores de tumores e o bloqueio da diferenciação causada pela redução da função dos fatores de transcrição, que são especificamente importantes para a diferenciação terminal das linhagens celulares derivadas da célula progenitora mielóide comum (RECKZEH et al., 2012).
Tem sido proposto que, de acordo com os seus papéis na patogênese, as anormalidades genéticas de leucemia podem ser agrupadas em duas categorias:
(1) mutações que envolvem as vias de transdução de sinal, dando origem às vantagens proliferativas para clones da leucemia (classe I);
(2) aquelas que afetam os fatores de transcrição ou cofatores e prejudicam a diferenciação (classe II).
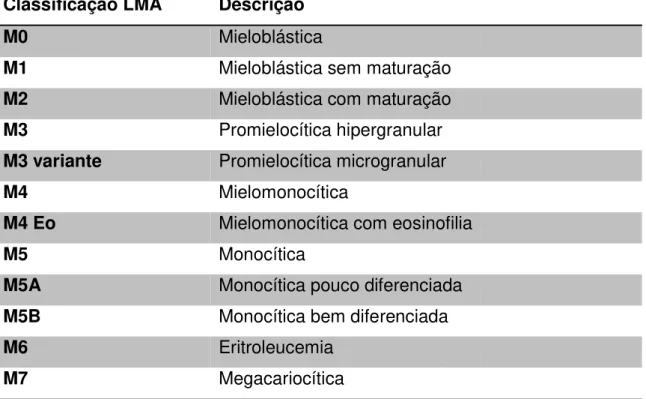
Tabela 1: Classificação Franco-Americo-Britanico dos vários subgrupos de Leucemia Mielóide Aguda.
Classificação LMA Descrição
M0 Mieloblástica
M1 Mieloblástica sem maturação
M2 Mieloblástica com maturação
M3 Promielocítica hipergranular
M3 variante Promielocítica microgranular
M4 Mielomonocítica
M4 Eo Mielomonocítica com eosinofilia
M5 Monocítica
M5A Monocítica pouco diferenciada
M5B Monocítica bem diferenciada
M6 Eritroleucemia
M7 Megacariocítica
1.4.2 Leucemia mielóide crônica
A leucemia mielóide crônica (LMC) é uma doença clonal maligna caracterizada por uma excessiva proliferação da linhagem mielóide (Fase Crônica), seguida por uma perda progressiva da diferenciação celular (Fase Acelerada) e terminando num quadro de leucemia aguda (Fase Blástica). A doença é associada a uma anormalidade citogenética específica conhecida como cromossomo Philadelphia (Ph). O cromossomo Ph ocorre em mais de 90% dos casos de LMC. Embora observado em outras leucemias e até mesmo em condições neoplásicas não hematopoéticas, ele é reconhecido como marcador citogenético da LMC e sua detecção tem implicações no diagnóstico, prognóstico e na terapêutica da doença (CHEN et al., 2010; BERGANTINI et al., 2005).
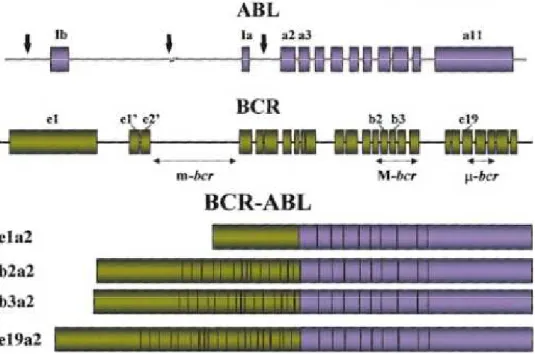
justapõe o oncogene ABL (Abelson Leukemia Vírus), mapeado no cromossomo
9, ao gene BCR (Breakpoint Cluster Region) mapeado no cromossomo 22.
(Figura 2). Em condições normais, o gene BCR codifica uma proteína com função relacionada à regulação do ciclo celular, enquanto o gene ABL codifica uma proteína tirosina quinase. A oncoproteína quimérica resultante da fusão (BCR-ABL) apresenta uma atividade tirosina-quinase elevada, responsável pela patogênese da doença (BERGANTINI et al., 2005; DEININGER et al., 2000).
Figura 2: Localização dos pontos de interrupção nos genes ABL e BCR e a estrutura dos RNAm quiméricos resultantes.
(Fonte: DEININGER et al., 2000)
1.5 Ciclo celular
1.5.1 Divisão celular
interfase inclui as fases G1, S e G2. A replicação do DNA ocorre numa parte específica da interfase chamada fase S. A fase S é precedida pela fase G1 durante a qual a célula se prepara para a síntese do DNA e é seguido pela fase G2 durante a qual a célula se prepara para a mitose. As fases G1, S, G2 e M são as subdivisões tradicionais de um ciclo celular normal (Figura 3). Células em G1 podem, antes da replicação do DNA, entrar em um estado de repouso chamado G0 (VERMEULEN et al., 2003).
Nas células normais, a progressão do ciclo celular pode ser controlada em resposta a diversos estímulos mitogénicos e anti-mitogénicos, o que resulta na modulação de diversos mecanismos moleculares. As diferentes cascatas de sinalização podem regular as proteínas do ciclo celular, a expressão de genes, as modificações pós-traducionais e a degradação de proteínas.
Figura 3: Representação esquemática do ciclo celular da mitose.
1.5.2 Sistema de controle do ciclo celular
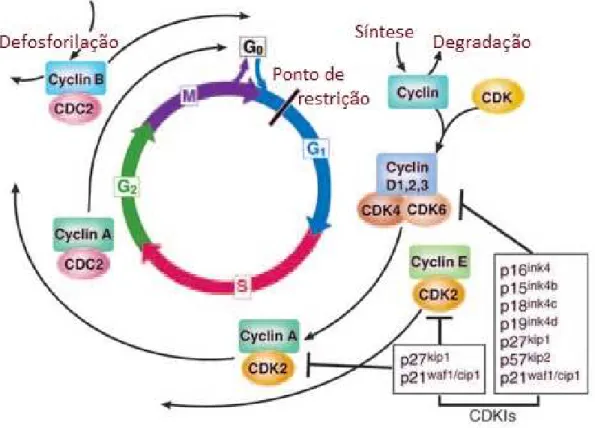
A transição de uma fase do ciclo celular para outro ocorre de forma ordenada e é regulada por diferentes proteínas celulares. As principais proteínas reguladoras são as quinases dependentes das ciclinas (CDKs), que são uma família de proteínas serina/treonina quinases ativadas em pontos específicos do ciclo celular. Até agora, nove CDKs foram identificadas e, dessas, cinco são ativas durante o ciclo celular. Entre elas temos as CDK4, CDK6 e CDK2 ativas durante a fase G1, a CDK2 ativa durante a fase S e a CDK1 ativa na fase G2 e M (Figura 4). Os níveis de proteínas CDK permanecem estáveis durante o ciclo celular, em contraste com as suas proteínas de ativação, as ciclinas. As ciclinas são sintetizadas e destruídas em períodos específicos durante o ciclo celular, regulando assim a atividade das quinases de uma forma conveniente. Diferentes ciclinas são necessárias nas diferentes fases do ciclo celular. As três ciclinas de tipo D (ciclina D1, ciclina D2, ciclina D3) se ligam às CDK4 e CDK6, e os complexos CDK-ciclina D são essenciais para a entrada na fase G1. Ao contrário das outras ciclinas, a ciclina D não é expressa constitutivamente, mas é induzida, enquanto a estimulação pelos fatores de crescimento persistir. Outra ciclina do G1 é a ciclina E, que se associa com CDK2 para regular a progressão do ciclo da fase G1 para a fase S. A ciclina A se liga com CDK2 e esse complexo é necessário durante a fase S. No final da interfase (fase G2), a ciclina A se complexa com CDK1 para promover à entrada na fase M. A mitose é ainda regulada pela ciclina B em complexo com CDK1 (VERMEULEN et al. 2003; SCHWARTZ & SHAH, 2005; HOCHEGGER et al., 2008; MALUMBRES & BARBACID, 2009).
a ativação da CDK1 e a progressão através do ciclo celular (VERMEULEN et al. 2003).
Figura 4: O processo de controle do ciclo celular.
A progressão através do ciclo celular é promovida pelas quinases dependentes de ciclinas (CDK), que são reguladas positivamente ou negativamente pelas ciclinas e pelos inibidores de CDK (CDKIs). O ponto de restrição é o ponto em que as células progridem através do ciclo celular independente de estímulos externos (Fonte: SCHWARTZ & SHAH, 2005).
1.6 Morte celular
desenvolvimento e o envelhecimento e também como um mecanismo homeostático para manter a população celular nos tecidos (ZIEGLER & GROSCURTH, 2004).
Durante muito tempo, a morte celular foi considerada como um processo passivo de caráter degenerativo, que ocorre em situações de lesão celular, infecção e ausência de fatores de crescimento. Como consequência, a célula altera a integridade de sua membrana plasmática, aumenta o seu volume e perde as suas funções metabólicas. Entretanto, nem todos os eventos de morte celular são processos passivos. Os organismos multicelulares são capazes de induzir a morte celular programada ou regulada como resposta a estímulos intracelulares ou extracelulares. Os processos de morte celular podem ser classificados de acordo com suas características morfológicas e bioquímicas em: autofagia, senescência, mitose catastrófica, necrose, e apoptose (EDINGER & THOMPSON, 2004; GRIVICICH et al., 2007).
1.6.1 Autofagia
A autofagia é um mecanismo catabólico que envolve a degradação de componentes celulares de células desnecessárias ou disfuncionais por meio dos lisossomos. Durante a autofagia, porções do citoplasma e das organelas são encapsuladas por membrana, originando estruturas denominadas autofagossomos. Estes irão se fusionar com os lisossomos. A seguir, o conteúdo dos autofagossomos será degradado pelas hidrolases lisossomais (KROEMER et al., 2010; MAIURI et al., 2007).
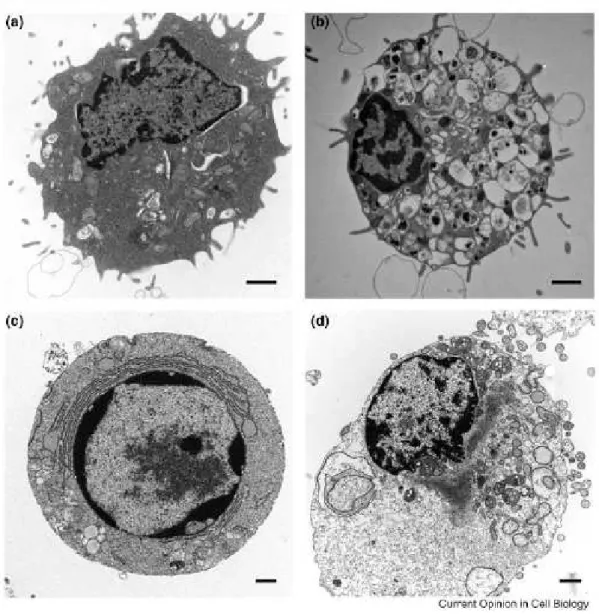
No contexto da doença, a autofagia tem sido vista como uma resposta adaptativa para a sobrevivência, enquanto que, em outros casos, parece promover a morte celular. “A morte celular autofágica” é morfologicamente definida (especialmente por microscopia eletrônica de transmissão) como um tipo de morte celular que ocorre na ausência de condensação da cromatina, mas acompanhada por uma vacuolização autofágica massiva do citoplasma (Figura 5d) (JANKU et al., 2011; KROEMER et al., 2010).
organelas de uma forma generalizada ou visar especificamente organelas distintas. Existem três formas diferentes de autofagia que são comumente descritas; a macro-autofagia, a micro-autofagia e a “chaperone-mediated”
autofagia (CMA). A macro-autofagia é a via principal, ocorrendo principalmente para erradicar organelas celulares danificadas ou proteínas não utilizadas. A micro-autofagia, por outro lado, envolve a imersão direta do material citoplasmático para o lisossomo. CMA é uma via muito complexa e específica, a qual envolve o reconhecimento pelo complexo contendo hsc70 (GLICK et al.,
2010; GRIVICICH et al., 2007; JANKU et al., 2011).
1.6.2 Senescência
A senescência é caracterizada pela parada irreversível do crescimento das células na fase G1 do ciclo celular. Morfologicamente, as células em senescência são maiores em tamanho e possuem maior granularidade. Ela é um processo metabólico ativo essencial para o envelhecimento. Ocorre por meio de uma programação genética que envolve deterioração dos telômeros e ativação de genes supressores tumorais. As células que entram em senescência perdem a capacidade proliferativa após um determinado número de divisões celulares (COLLADO & SORRANO, 2004; MOOI & PEEPER, 2006; SARETZKI, 2010).
1.6.3 Mitose catastrófica
morte (CASTEDO et al., 2004; GALLUZZI et al., 2012; GRIVICICH et al., 2007; KROEMER et al., 2009).
1.6.4 Necrose
A necrose é o resultado final de uma catástrofe bioenergética decorrente da degradação do ATP a um nível incompatível com a sobrevivência da célula. A necrose pode ser iniciada principalmente por agentes tóxicos ou danos físicos. Ela é caracterizada morfologicamente por vacuolização do citoplasma, quebra da membrana plasmática e uma indução de inflamação ao redor da célula atribuível à liberação do conteúdo celular e moléculas pró-inflamatória. As células que morrem por necrose frequentemente exibem alterações na morfologia nuclear, mas não a condensação da cromatina e a fragmentação organizada do DNA em fragmentos de 200 pb que é característica da morte celular por apoptose (EDINGER & THOMPSON, 2004; GOLSTEIN & KROEMER, 2006). A Figura 5b, c ilustra as diferenças morfológicas entre as células que morrem por apoptose e necrose.
Figura 5: Micrografias eletrônicas ilustrativas dos tipos de morte celular e as suas características morfológicas.
As características morfológicas de a) uma célula saudável, b) uma célula necrótica, c)
uma célula apoptótica e d) uma célula autofágica. Barra de escala:1 μm (Fonte:
EDINGER & THOMPSON, 2004).
1.6.5 Apoptose
(SAIKUMAR et al., 1999). É um processo coordenado e, muitas vezes dependente de energia, que envolve a ativação de um grupo de cisteína proteases chamado "caspases" e uma cascata complexa de eventos que ligam desde a iniciação dos estímulos até o desaparecimento final da célula. A apoptose foi descrita pela primeira vez pelo KERR et al. (1972), e as células que sofrem apoptose exibem uma série de alterações morfológicas e bioquímicas características que permitem a diferenciação com os outros tipos de morte celular (DANIAL & KORSMEYER, 2004; GREEN, 2005; KROEMER et al., 2009).
1.6.5.1 Alterações morfológicas e bioquímicas da apoptose.
De um modo geral, a apoptose é um fenômeno bastante rápido: ocorre uma retração da célula que causa perda da aderência com a matriz extracelular e células vizinhas. As organelas celulares mantêm as suas morfologias, com exceção, em alguns casos, das mitocôndrias, que podem apresentar ruptura da membrana externa. A cromatina sofre condensação e se concentra junto à membrana nuclear, que se mantém intacta. Em seguida, a membrana celular forma prolongamentos (blebs) e o núcleo se desintegra em fragmentos
envoltos pela membrana nuclear. Os prolongamentos da membrana celular aumentam de número e tamanho e rompem, originando estruturas contendo o conteúdo celular. Estas porções celulares envoltas pela membrana celular são denominadas corpos apoptóticos. Os corpos apoptóticos são rapidamente fagocitados por macrófagos e removidos sem causar um processo inflamatório (ZIEGLER & GROSCURTH, 2004).
Outra característica bioquímica da apoptose é a ativação de um grupo de enzimas chamado caspases. Quando ativadas, as caspases clivam muitas proteínas celulares e também ativam as DNAses que futuramente podem degradar o DNA nuclear (WONG, 2011).
1.6.5.2 Mecanismo da apoptose
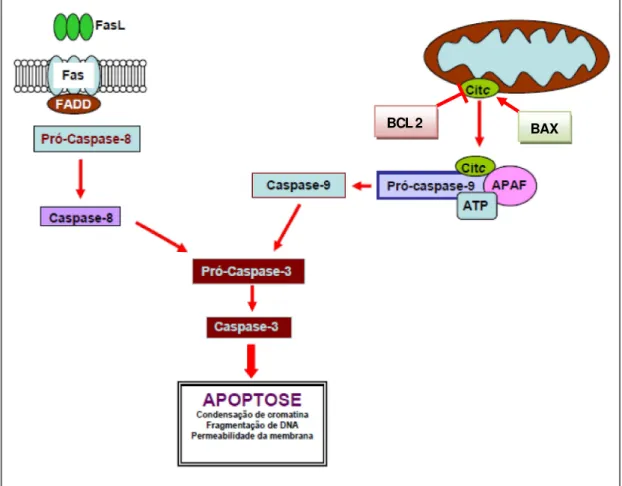
As caspases são fundamentais para o mecanismo da apoptose, pois são ambos iniciadores e executores. Existem três vias através das quais as caspases podem ser ativadas. As duas principais vias de iniciação da apoptose geralmente descritas são a via intrínseca (ou mitocondrial) e a via extrínseca (ou receptor de morte). Ambas as vias, eventualmente, levam a uma via comum ou à fase de execução da apoptose (Figura 6).
Figura 6: As duas principais vias que levam a apoptose.
Os reguladores-chave implicados nas vias de sinalização extrínseco e intrínseco da apoptose são destacados (Fonte: Wong, 2011).
A via intrínseca
Como o próprio nome indica, a via intrínseca é iniciada dentro da célula. Estímulos internos, como os danos genéticos irreparáveis, a hipóxia, as concentrações extremamente altas de cálcio citosólico e o estresse oxidativo grave são alguns disparadores do início da via mitocondrial, resultando num aumento da permeabilidade mitocondrial. Esses estímulos apoptóticos podem desencadear a liberação de fatores apoptogênicos do espaço intermembranar mitocondrial para o citosol, como o citocromo C. Esta via é estreitamente regulada por um grupo de proteínas que pertencem à família de Bcl-2. Existem dois grupos de proteínas da família Bcl-2 (as proteína pró-apoptóticas e anti-apoptóticas), que regulam a via. As proteínas pró-apoptóticas são Bax, Bak, Bad, Xs, Bid, Bik, Bim e Hrk e as proteínas anti-apoptóticas são 2, Bcl-XL, Bcl-W, Bfl-1 e Mcl-1. As proteínas pró-apoptóticas promovem a liberação de citocromo C da mitocôndria enquanto que as proteínas anti-apoptóticas promovem seu bloqueio (SANKARI et al., 2012; WONG, 2011).
Assim que o citocromo C é liberado no citoplasma, ele forma o complexo apoptossomo (composto de citocromo C, Apaf-1 e caspase-9) que vai ativar a caspase-3. Outros fatores apoptóticos que são liberados a partir do espaço intermembranar mitocondrial para o citoplasma incluem as proteínas AIF, Smac/Diablo e Omi/HtrA2. Smac/Diablo ou Omi/HtrA2 promovem a ativação das caspases ligando-se as proteínas inibidoras da apoptose (IAPs), que posteriormente leva ao rompimento na interação dos IAPs com a caspase-3 ou -9 (SANKARI et al., 2012; WONG, 2011).
A via extrínseca
(TRADD) e domínio de morte associada à Fas (FADD), assim como as proteases de cisteína, como a caspase 8. A ligação do ligante ao receptor de morte resulta na formação de um local de ligação para uma proteína adaptadora e todo o complexo formado pelo ligante, o receptor e a proteína-adaptadora é conhecido como o complexo de sinalização indutor de morte (DISC). O DISC inicia a montagem e a ativação de pró-caspase-8. A caspase-8 ativa, em seguida, processa as caspases efetoras (como a caspase-3) que posteriormente clivam substratos específicos, resultando na morte celular (SANKARI et al., 2012; WONG, 2011).
A via comum
A fase de execução da apoptose envolve a ativação de uma série de caspases. A caspase “upstream” da via intrínseca é a caspase 9, enquanto que
a da via extrínseca é a caspase 8. As vias intrínseca e extrínseca convergem para a caspase 3. Em seguida, a caspase 3 cliva o inibidor da desoxirribonuclease ativada por caspase, que é responsável pela apoptose nuclear. Além disso, as caspases “downstream” induzem a clivagem das
proteínas quinases, às proteínas do citoesqueleto, as proteínas de reparação do DNA e as subunidades inibidoras das proteínas da família endonuclease. Eles também têm um efeito sobre o citoesqueleto, o ciclo celular e as vias de sinalização, que em conjunto contribuem para as alterações morfológicas típicas da apoptose (WONG, 2011).
1.7 Mitocôndria
resultar a partir da permeabilização da membrana mitocondrial externa, que é regulada pelas proteínas da família Bcl-2. A maneira com que as proteínas da família Bcl-2 controlam a permeabilização da membrana mitocondrial externa e favorecem a liberação das proteínas do espaço intermembranar mitocondrial está sendo muito investigada. Recentemente, a literatura aponta que a mitocôndria pode liberar as proteínas de seu espaço intermembranar através de dois mecanismos diferentes. Em primeiro lugar, através da permeabilização da membrana externa mediada pelos membros da família Bcl-2. Em segundo lugar, através da indução da transição de permeabilidade mitocondrial, que ocorre principalmente em resposta à liberação do cálcio do retículo endoplasmático (KUWANA & NEWMEYER, 2003).
O mecanismo pelo qual a proteína BAX, ou BAK, permeabiliza a membrana externa da mitocôndria para permitir o efluxo de proteínas maiores ainda não é claro, apesar de vários modelos terem sido propostos. Esses modelos revelam que a BAX, sozinha ou combinada com outras proteínas, forma canais de dimensões suficientes para permitir a passagem do citocromo C e outras proteínas (MARTINOU & YOULE, 2011). Outra função alternativa dessas proteínas seria de regular a atividade de alguns canais pré-existentes na membrana da mitocôndria, como o canal Kv1.3, favorecendo assim a permeabilidade da membrana mitocondrial (GROSS, 2001).
1.8 Sinalização celular em modelos de câncer
As proteínas quinases ativados por mitógenos (MAPKs) é uma família de enzimas serina/treonina-quinases conservadas, que são consideradas como sendo os blocos centrais das redes de sinalização intracelular. Há mais de uma dúzia de MAPKs conhecidos em mamíferos, e estas enzimas existem em várias isoformas. Os mamíferos expressam quatro grupos de MAPKs distintamente reguladas: ERK 1/2, p38, JNK/SAPK, ERK5 (CHANG & KARIN, 2001; SHAUL & SEGER, 2007). As MAPKs estão envolvidas na transmissão de sinais a partir de uma grande variedade de estímulos extracelulares, incluindo os fatores de crescimento, hormonios, citocinas e neurotransmissores. De fato, as MAPKs são os principais componentes das vias de sinalização que regulam a grande variedade de eventos intracelulares, tais como a proliferação, a diferenciação, o desenvolvimento, a sinalização aguda em resposta aos hormonios, ao estresse, à morte celular programada e à expressão gênica (GEEST et al., 2009; KIM & CHOI, 2010; MANNA et al., 2007).
ERK está associada com a apoptose (BACUS et al., 2001; WANG et al., 2000). No entanto, o papel da sinalização de MAPK majoritariamente depende dos estímulos e do tipo de célula (CHANG & KARIN, 2001).
A p38 MAPK é ativado em resposta a vários produtos químicos e estresses ambientais (COULTHARD et al., 2009). Além disso, a ativação do p38 MAPK, sob condições de estresse celular, pode induzir à apoptose por fosforilação ou indiretamente, diminuindo os níveis das proteínas de sobrevivência, como Bcl-2 (ROSINI et al., 2000; WATSON et al., 2010). Por outro lado, a via da ERK é essencial para a proliferação e a sobrevivência celular (XIA et al., 1995).
1.9 Espécies reativas de oxigênio
O termo espécies reativas de oxigênio (EROS) é usado para entidades difusíveis de vida curta como os radicais: hidroxila (•OH), alcoxila (RO•) ou peroxila (ROO•) e para algumas espécies de radicais de vida médios, como o superóxido (O2-•) ou o radical nitroxil (NO•). Também inclui os não-radicais, tais o peróxido de hidrogênio (H2O2), os hidroperóxidos orgânicos (ROOH) e o ácido hipocloroso (HOCl) (SIMON et al., 2000, WANG & YI, 2008).
Como consequência do metabolismo aeróbico, pequenas quantidades de EROS são geradas constantemente no organismo. Os antioxidantes celulares agem em conjunto para desintoxicar essas espécies, mas, quando o equilíbrio é rompido, uma condição conhecida como estresse oxidativo acontece. Se o estresse oxidativo persistir, isso pode levar ao dano de biomoléculas críticas (incluindo o genoma). Esses danos acumulam-se e, eventualmente, resultam em vários efeitos biológicos que variam de alterações na transdução do sinal e a expressão do gene para a mitogênese, a transformação, a mutagênese e a morte celular (MATÉS & SÁNCHEZ-JIMÉNEZ, 2000, RAY et al., 2012).
produção intracelular de EROS ou são inibidas por meio da adição de antioxidantes (MATÉS & SÁNCHEZ-JIMÉNEZ, 2000).
O papel de EROS, como intermediários para a sinalização de apoptose está bem relatada em numerosas investigações, incluindo 1) os antioxidantes inibem a apoptose induzida por uma variedade de agentes apoptóticos, 2) os niveis de EROS estão elevados em células em apoptose 3) as EROS exógenos podem induzir a apoptose nos diversos tipos de células, e 4) a inibição dos níveis de antioxidantes intracelulares, promove a morte celular por apoptose (MOUNGJAROEN et al., 2006).
A indução de apoptose tem sido uma estratégia popular para a terapia do câncer. As melhores drogas contra o câncer levam as células tumorais a morrer seja diretamente ativando as vias pró-apoptóticas ou desativando as vias anti-apoptóticas (COTTER, 2009). No entanto, induzir seletivamente as células tumorais a morrer continua a ser uma grande preocupação e desafio para o tratamento do câncer.
As EROS têm um papel importante na indução da apoptose em ambas as condições fisiológicas e patológicas. Recentemente, induzir à produção de EROS tornou-se uma nova abordagem para tratar o câncer. A vantagem desta estratégia reside na sua boa seletividade. As células cancerosas estão geralmente sob estresse oxidativo e, portanto, têm um nível basal relativamente elevado de EROS. Uma pequena indução de EROS nas células tumorais pode empurrar o nível de EROS sobre o limiar da vida e da morte, e induzir a morte celular, enquanto que as células normais podem tolerar melhor os insultos oxidativos devido ao seu nível basal inferior de EROS e suas capacidades antioxidantes mais eficientes (SUN et al., 2013).
Contudo, a indução da produção de EROS intracelular como estratégia anticâncer ainda está no seu inicio. As formas pelas quais os compostos induzem a produção de EROS são diversas, e os efeitos dos indutores de EROS não são idênticos, mas o mecanismo detalhado é incerto. Mais agentes indutores de EROS com diferentes mecanismos são necessários para compreender plenamente os seus potenciais de aplicação no tratamento do câncer (SUN et al., 2013).
1.10 Quimioterapia do câncer
As primeiras aplicações da quimioterapia para controlar o câncer foram relatadas nos anos 1940, e décadas após, o tratamento de doentes com produtos químicos tóxicos amplamente representou um dos pilares da oncologia médica, apesar dos efeitos colaterais severos frequentemente associados com tais tratamentos (BAGNYUKOVA et al., 2010; SAK. 2012) .
Por definição, o tratamento quimioterapeutico deve interferir com o programa bioquímico que está envolvido ou comprometido com a multiplicação celular e causar seletivamente a morte celular, e a célula hospedeira deve ser capaz de se adaptar e se recuperar da toxicidade. Muitos agentes quimioterapeuticos matam as células cancerosas por via oxidativa por meio da produção de espécies reativas de oxigênio e a indução de apoptose ou necrose nessas células tumorais, enquanto outros agem em vários componentes do metabolismo celular que influenciam as atividades de diferentes enzimas necessárias para a divisão celular (SAK, 2012).
As categorias mais importantes de agentes quimioterapêuticos incluem agentes alquilantes (por exemplo, ciclofosfamida, ifosfamida, melfalano, busulfano), antimetabolitos (por exemplo, 5-fluorouracil, capecitabina, metotrexato, gemcitabina), antibióticos anti-tumorais (por exemplo, daunorubicina, doxorubicina, epirubicina), inibidores da topoisomerase (por exemplo, topotecano, irinotecano, etoposido, teniposido), e inibidores de mitose (por exemplo, paclitaxel, docetaxel, vinblastina, vincristina). A maioria dos fármacos quimioterapêuticos atua na maquinaria do ciclo celular baseando na diferença de frequência de divisão celular entre as células cancerosas e as células normais (SAK, 2012).
Apesar dos últimos avanços, sabe-se que a instabilidade genética e a alta taxa de mutação nas células cancerosas devido ao uso prolongado da quimioterapia, ainda carrega um alto risco de seleção de clones de células resistentes aos medicamentos (URRUTICOECHEA et al., 2010).
1.11 Derivados triazóis de quinonas
1.11.1 Naftoquinonas
As quinonas (Figura 7) representam uma das maiores famílias de agentes antitumorais. Embora a maioria das drogas anticâncer atuais tenha sido descoberta empiricamente, muitos conhecimentos foram adquiridos sobre os mecanismos pelos quais muitos desses compostos afetam o crescimento celular (ASCHE, 2005; BOUTROS et al., 2007). O conhecimento básico resultante dos estudos das quinonas foi usado para projetar novas drogas anticâncer, melhorando a seletividade e proporcionando uma aplicação terapêutica mais racional desses agentes (FRY & JACOB, 2006; GARRETT & WORKMAN, 1999; DA SILVA JUNIOR et al., 2010).
1,4-Benzoquinona 1,4-Naftoquinona Antraquinona
Figura 7: Classificação das quinonas.
abordagem promissora para a eliminação seletiva de células cancerosas (SMITH et al., 1985).
Os derivados de quinonas podem ser tóxicos para as células por vários mecanismos, incluindo o sistema do ciclo redox, a arilação, a intercalação, o dano de DNA e a geração de radicais livres (MILLER et al., 1986). Como consequência, a estrutura molecular de um grande número de produtos farmacêuticos e de compostos biologicamente importantes contêm um núcleo quinona. Os exemplos representativos desta classe de compostos são os fármacos anti-cancerígenos conhecidos da série de antraciclina, a doxorubicina e a mitoxantrona. Acredita-se que o efeito desses derivados ocorre através da inibição da enzima topoisomerase II (D'ARPA & LIU, 1989; FOGLESONG et al., 1992). Além disso, uma série de análogos de naftoquinona como a plumbagina, shikonina e naftazarina, bem como a β-lapachona, também são inibidores das topoisomerases (FUJII et al., 1992; KRISHNAN & BASTOW, 2000; YANG et al., 2006).
As naftoquinonas são consideradas estruturas privilegiadas em química medicinal, devido às suas atividades biológicas e propriedades estruturais (DE CASTRO et al, 2011; PADHYE et al, 2012). O núcleo 1,4-naftoquinona é um potente inibidor do crescimento do câncer e é sugerida como útil na terapia do câncer (KAYASHIMA et al., 2009). No entanto, está bem estabelecida que este núcleo apresente toxicidade em hepatócitos normais. A substituição por um grupo hidroxila no anel quinóide da 1,4-naftoquinona, diminui a toxicidade, enquanto que a substituição com uma hidroxila na posição β no anel benzeno aumenta a toxicidade (OLLINGER & BRUNMARK, 1991). Dessa forma, usando o núcleo 1,4-naftoquinona para obter novos derivados com atividade seletiva têm sido um desafio.
1.11.2 1,2,3-triazóis
1.11.2.1 Estrutura e síntese
de bibliotecas para a triagem biológica. O núcleo 1,2,3-triazol não foi isolado de compostos naturais, no entanto, o radical 1,2,3-triazol tem sido utilizado em muitas aplicações industrial e farmacêutica. As aplicações de 1,2,3-triazóis são generalizadas, tornando os derivados de 1,2,3-triazol uma classe de molécula altamente estudada (MAYOT et al., 2005).
Os triazóis pertencem a uma classe de compostos chamados azóis. Um azol contém um anel aromático de cinco membros com pelo menos um átomo de nitrogênio e outro heteroátomo tal como enxofre, ou oxigênio. A estrutura de 1,2,3-triazol (Figura 8) contém três átomos de nitrogênio adjacentes com três locais disponíveis para substituição encontrados nas posições 1, 4 e 5 (KHARB et al., 2011).
Figura 8: Estrutura do núcleo 1H-1,2,3-triazol não substituído.
Figura 9: A reação de síntese do anel 1,2,3-triazol.
1.11.2.2 Efeitos farmacológicos
O triazol e seus derivados têm atraído atenção considerável nessas últimas décadas devido aos seus potenciais quimioterápicos (KHARB et al., 2011). A utilização dos triazóis tem sido encontrada em várias áreas e está crescendo continuamente (KOLB & SHARPLESS, 2003). De acordo com a literatura, os derivados triazóis (Figura 10) possuem uma ampla variedade de atividades farmacológicas, tais como antimicrobiana, analgésica, anti-inflamatória, anestésica local, anticonvulsiva, anti-neoplásica, antimalárica, antiviral e antiproliferativa (KHARB et al., 2011).
O anel triazol é um importante heterociclo pentacíclico, com três átomos de nitrogênio e possui aromaticidade e um sistema rico em elétrons. Este tipo de estrutura única favorece os derivados triazóis de ligarem facilmente com uma variedade de enzimas e receptores no sistema biológico através de interações fracas, tais como ligações de coordenação, ligações de hidrogênio, íons-dipolo, efeito hidrofóbico, van der Waals, etc. e, assim, apresentar um amplo espectro de atividades biológicas (ZHOU & WANG, 2012).
solúveis em água do que os compostos aromáticos normais, e são estáveis em sistemas biológicos.
Além disso, o anel triazol pode ser usado como elo para combinar diferentes fragmentos farmacóforos para produzir medicamentos inovadores bifuncionais, o que proporciona uma via conveniente e eficaz para o desenvolvimento de várias moléculas bioativas e funcionais (ZHOU & WANG 2012). Realmente, a combinação do anel triazol com outros heterociclos tem sido uma abordagem bem conhecida para obtenção de drogas inéditas com novos perfis farmacológicos. Isto pode ser conseguido, por meio do reforço da sua ação ou diminuindo sua toxicidade (KHARB et al., 2011). De fato, a artemisinina (um composto natural), que é uma importante droga antimalárica, não possui atividade anticâncer, mas a incorporação do anel triazol na posição da carbonila dotou o composto resultante de uma atividade inibidora contra diversas células malignas (ZHOU & WANG, 2012). Além disso, a podofilotoxina é conhecida por inibir a montagem da tubulina em microtúbulos através da ligação com a tubulina. No entanto, a sua toxicidade elevada limitou a sua aplicação como um fármaco na quimioterapia contra o câncer. A introdução do anel 1,2,3-triazol na molécula podofilotoxina resultou em um composto de baixa toxicidade, com uma boa atividade antitumoral contra linhagens de células tumorais humanas, como Hela, K562 e K562/A02 (ZHOU & WANG, 2012).
Antihipertensivo Atividade muscarínica Atividade anticâncer
Atividade anti-HIV Atividade hipocolesterolêmica Antagonista do receptor NMDA
Antagonista h-NK1 Inibidor do receptor tirosina quinase VEGF
Figura 10: Presencia do núcleo 1,2,3-triazóis em várias moléculas com atividades biológicas.
2. Objetivos
2.1 Objetivo geral
Avaliar o potencial anticancerígeno de novos derivados triazóis, sintetizados a partir do núcleo 1,4-naftoquinona.
2.2 Objetivos específicos
Determinar a citotoxicidade de oito compostos derivados do núcleo 1,4-naftoquinona em linhagens cancerígenas e normais,
Elucidar o mecanismo de morte induzido pelos compostos nas linhagens mais sensíveis,
Investigar a expressão das proteínas da família Bcl-2 e do citocromo C,
Analisar a produção de EROS intracelular e seus papéis na indução da citotoxicidade dos compostos,
3. Material e Métodos
3.1 Material
3.1.1 Equipamentos
Agitador de placa Certomat ® MO, EUA
Agitador de placa MS1 MINISHAKER, IKA, EUA Agitador magnético TE-088 TECNAL, BRASIL Autoclave, PHOENIX LUFERCO, BRASIL
Balança analítica MODELO FA2104N, CELTAC, BRASIL Banho Maria com agitação, MULTITEMP III, BRASIL
Centrífuga refrigerada, HERMLE Labortedrik GMBH, ALEMANHA CFX96 Real Time System, BIO-RAD, EUA
Citômetro de fluxo BD FACS CALIBUR, EUA Espectrofotômetro UV1101, BIOTECH
Estufa de CO2 HF 212 UV, ULTRASAFE, CHINA Estufa de secagem, De Leo, BRASIL
Fluxo laminar PACHANE, BRASIL
Freezer -20ºC FE26, ELECTROLUX, BRASIL Freezer -80ºC ULT390-3-D31 INDREL. EUA Leitora de ELISA ELx800, BIOTEK, ALEMANHA Microondas Panasonic, BRASIL
Microscópio de fluorescência, CARL ZEISS, ALEMANHA Microscópio óptico de inversão XS201, TAIMIN, BRASIL pHmetro PHS-3B, LABMETER, BRASIL
3.1.2 Reagentes e compostos utilizados
2-desoxi-D-ribose, ácido etilenodiaminotetraacético (EDTA), Amresco, EUA Peróxido de hidrogênio (H2O2), Vetec, EUA
2’,7’-diclorofluoresceína-diacetato (DCFH-DA), Invitrogen, EUA Albumina sérica bovina (BSA), Sigma, EUA
Duodecil sulfato de sódio (SDS), Fisher Scientific, EUA Ficoll hipaque, GE Healthcare
Iodeto de propídeo (IP), Sigma, EUA
Brometo de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazólio (MTT), Amresco, EUA Fitohemaglutinina, Cultilab, Brasil
Acido clorídrico (HCl), Vetec, EUA Penicilina, Sigma, EUA
Estreptomicina, Sigma, EUA
Soro bovino fetal (SBF), Cripion, Brasil Etoposídeo, Sigma, EUA
Tetrametilrodamina, Invitrogen, EUA Kit Annexina V/IP, Invitrogen, EUA SYBR Green, Applied Biosystems, UK
3.1.3 Soluções
Solução Tampão de Fosfato (PBS)
Foi utilizada como meio de lavagem no cultivo de células que crescem em monocamada em cultivo in vitro e também depois do tratamento das células
com as drogas. Esta solução é livre de Ca2+ e Mg2+, e contém NaCl (137mM), KCl (2,7mM), Na2HPO4 (10mM), KH2PO4 e água MilliQ e o pH desta solução foi ajustado em 7,4. A solução foi esterilizada em autoclave e conservada a 4°C.
Solução de Tripsina-EDTA
contém PBS, Tripsina e EDTA. O pH foi ajustado em 7,2 e foi esterilizado por filtração com membranas de 0,4 mm de diâmetro (Millipore) e a conservação das alíquotas foi à temperatura de -20°C.
Corante Azul de Trypan 0,4%
Esta solução foi preparada utilizando NaCl 0,81% K2HPO4 0,06% e azul de trypan comercial. Estas substâncias foram dissolvidas em 100 mL de água MilliQ, filtradas com membranas de 28 mm de diâmetro e a conservação das alíquotas foi a 4°C. Este corante foi utilizado para corar as células mortas, diferenciando-as das células vivas, para contagem da viabilidade celular em Câmara de Neubauer.
Dimetilsulfóxido (DMSO)
O DMSO é usado na medicina como solvente por apresentar baixa toxicidade, age como criopreservante em concentração de 5%. Foi utilizado para dissolver todos os compostos e também para o congelamento das linhagens celulares.
3.1.4 Compostos estudados
O
O
N3 O
O N
N
N O
O
N NN OMe
O
O
N NN OH O O N N N OH O O N N N O O O O
N NN
N O O O AcO OAc O O N N N O
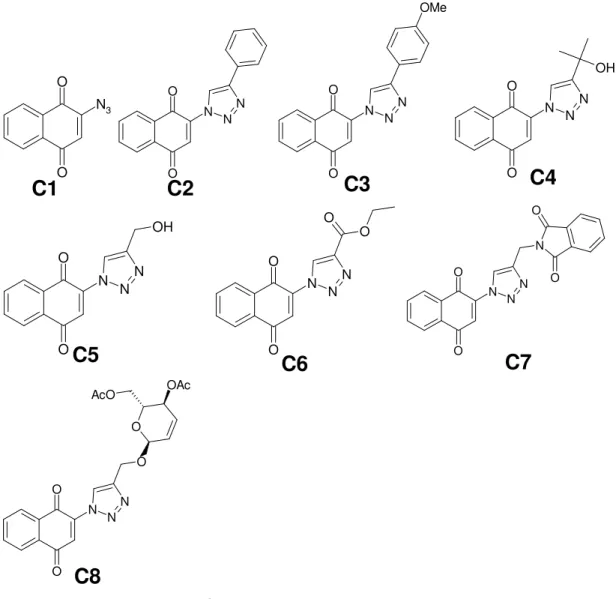
Figura 11: Estruturas químicas das 1,2,3-triazol-1,4-naftoquinonas (C2-C8) e seu precursor azida (C1).
3.1.5 Linhagens celulares
3.1.5.1 Linhagens leucêmicas (HL-60, K562, K562-Lucena)
HL-60 é uma linhagem de leucemia mielóide aguda (LMA) humana e, K562 é uma linhagem de leucemia mielóide crônica (LMC) humana. A linhagem K562-Lucena é a forma resistente de K562 que superexpressa a glicoproteina-P (glicoproteina-P-gp). Todas essas linhagens foram cultivadas em suspensão em frascos estéreis contendo o meio de cultura RPMI 1640, suplementado com 10% de
C1
C2
C3
C4
C5
C6
C7
soro bovino fetal (SBF) e com antibióticos (100 U/mL de penicilina, 0,1 mg/mL de estreptomicina). As linhagens foram mantidas em estufa a temperatura de 37°C e uma atmosfera úmida de 5% de CO2. O meio da linhagem K562-Lucena foi acrescido da vincristina para manter a sua resistência. O meio de cada linhagem foi trocado a cada 48 horas para isso a cultura celular foi centrifugada a 400xg, o sobrenadante descartado e o precipitado resuspendido em um novo
meio. Essas linhagens celulares foram adquiridas do Banco de Células do Rio de Janeiro/RJ/Brasil (BCRJ).
3.1.5.2 Linhagens de adenocarcinoma de mama (MCF-7) e de cólon (HT-29)
As duas linhagens são de origem humana e possuem características de células aderentes e crescem em monocamada. Essas células foram cultivadas em frascos estéreis na presença de meio de cultura, DMEM (HT-29) ou RPMI 1640 (MCF-7), contendo 10 % de soro fetal bovino e com antibióticos 100 U/mL de penicilina, 0,1 mg/mL de estreptomicina (meio completo) e mantidas a 37 °C em atmosfera úmida contendo CO2 (5%). O meio de cada linhagem foi trocado a cada 48 horas. Uma vez que essas células são aderentes e atingem a confluência (80% de crescimento), foi necessário fazer a remoção dessas com a solução de tripsina (0,25% + EDTA 1 mM) em tampão PBS, pH 7,4. Em seguida, foram transferidas para tubos cônicos contendo meio de cultura completo. Após centrifugação a baixa rotação, o meio de cultura e tripsina foram desprezados e as células ressuspendidas em um novo meio completo. Essas linhagens celulares foram também adquiridas do Banco de Células do Rio de Janeiro/RJ/Brasil (BCRJ).
3.1.5.3 Células do sangue periférico (PBMC)
adicionado a um tubo contendo Histopaque, na proporção de 5,0 ml sangue/4,5 ml Histopaque. Os tubos foram centrifugados (400 g), em temperatura de 4°C,
até a completa separação das bandas celulares. A camada de células mononucleares foi coletada com o auxílio de micropipeta e a seguir as células foram lavadas com meio de cultura RPMI-1640 (Sigma Chemical, EUA) contendo soro fetal bovino (SFB) 10%, através de centrifugação (400 g, 10 min,
4°C), procedimento que foi repetido outras duas vezes. Em seguida, as células foram ressuspensas em 1 ml do mesmo meio.
Os procedimentos experimentais foram feitos com o acordo do Comitê de Ética em Pesquisa com Seres Humanos da Universidade Federal da Paraíba (CEP / HULW / UFPB), protocolo n 655/10-318119.
3.2 Métodos
3.2.1 Teste de viabilidade preliminar das culturas celulares
Antes da exposição das células com aos compostos, a viabilidade celular das culturas foi determinada pelo método de exclusão com o corante vital, azul de tripano. Este método é baseado no princípio de que as células viáveis com membranas celulares intactas não coram de azul, surgindo brilhantes quando observadas ao microscópio, enquanto as células mortas ou danificadas surgem coradas de azul.
Para determinar a viabilidade das culturas celulares procedeu-se do seguinte modo: após centrifugação das culturas celulares, o precipitado resultante foi ressuspendido em 2 mL de meio de cultura completo. A 90 μL da suspensão celular foram adicionados 10 μL de azul de tripano e 10 μL desse conteúdo resultante foi aplicado numa câmara de Neubauer, procedendo-se a