Resumo
A infertilidade afeta cerca de 10 a 15% dos casais em idade fértil, dos quais uma parte não encontra na Procriação Medicamente Assistida (PMA) uma solução eficaz, o que põe em evidência a necessidade de serem encontradas novas abordagens terapêuticas. Neste contexto, surgiu a gametogénese in vitro (GIV), enquanto uma técnica inovadora que promete criar gâmetas totalmente fora do corpo humano, a partir de células estaminais pluripotentes. Para além de permitir obter gâmetas com a mesma informação genética do indivíduo infértil, várias outras vantagens tornam este conceito potencialmente aliciante. Este trabalho pretendeu rever a literatura acerca deste tema, de forma a compreender o estado da arte e a aplicabilidade clínica da GIV.
Nos últimos anos, alguns progressos foram conseguidos, nomeadamente a recriação in vitro da oogénese e da espermatogénese em ratinhos, com posterior obtenção de descendência saudável e fértil. Em modelo humano também foi demonstrada a obtenção de células haploides, cuja fertilização não foi testada.
Apesar destas conquistas, o perfil de segurança dos protocolos é uma preocupação e muitas limitações permanecem por ultrapassar. Deste modo, adivinha-se ainda um longo caminho a percorrer antes que a GIV possa chegar à clínica.
Palavras-chave: Infertilidade, Células estaminais pluripotentes induzidas, Gametogénese in vitro, Oogénese, Espermatogénese
Abstract
Infertility affects about 10 to 15% of couples of reproductive age and some do not find an effective solution through Assisted Reproductive Technology, which highlights the need to find new therapeutic approaches. Considering this scenario, in vitro gametogenesis (IVG) appears as an innovative technique that might permit the creation of gametes outside the human body, using pluripotent stem cells. Besides the generation of gametes with the same genetic information of the infertile patient, several other advantages make this concept potentially attractive. This work aimed to review the literature on this subject, in order to understand the state of the art and the clinical applicability of IVG.
In the last decade, some progress has been accomplished, in particular the in vitro recreation of both oogenesis and spermatogenesis in mice, with the subsequent generation of healthy and fertile offspring. In the human model, the derivation of haploid cells was also demonstrated, however these cells’ fertilization capacity wasn’t tested.
Despite these recent achievements, the security profile of protocols is a concern and many limitations need to be overcome. Thus, one can guess a long way to go before IVG can reach the clinic.
Keywords: Infertility, Induced pluripotent stem cells, In vitro gametogenesis, Oogenesis, Spermatogenesis
I. Índice
II. Abreviaturas...5 III. Introdução...6 1. Panorama da Infertilidade...6 2. Células Estaminais...6 3. Gametogénese in vitro...8§ Vantagens da implementação da GIV...8
4. Objetivos...11 IV. Métodos...12 V. Resultados...13 VI. Discussão...14 1. Modelo Animal...14 i. Transplante in vivo...14
ii. Exclusivamente in vitro...16
2. Modelo Humano...18
i. Diferenças Humano/Ratinho...18
ii. Estudos com células humanas...18
3. Utilização de ASCs...20
4. Obtenção de gâmetas do sexo oposto...22
5. Aneuploidias...24
VII. Conclusões e Perspetivas Futuras...25
VIII. Agradecimentos...27
IX. Anexos...28
II. Abreviaturas
§ AM-MSCs – Células estaminais mesenquimatosas da membrana amniótica § ASCs – Células estaminais adultas
§ COC – Complexo oócito-cumulus oophorus § DGPI – Diagnóstico genético pré-implantação § DPN – Diagnóstico pré-natal
§ EpiLCs – Células do epiblasto-like § EpiSCs – Células estaminais do epiblasto § ESCs – Células estaminais embrionárias § FISH - Hibridização in situ por fluorescência § FIV – Fertilização in vitro
§ GCs – Células germinativas § GIV – Gametogénese in vitro
§ hESCs – Células estaminais embrionárias humanas § hiPSCs – Células pluripotentes induzidas humanas § hPGCs – Células germinativas primordiais humanas
§ hUCPVCs – Células peri-vasculares do cordão umbilical humano § ICSI – Injeção intracitoplasmática de espermatozóides
§ iPSCs – Células estaminais pluripotentes induzidas § MCI – Massa celular interna
§ mEpiSCs – Células estaminais do epiblasto de ratinho § mESCs – Células estaminais embrionárias de ratinho § MIV – Maturação in vitro
§ MSCs – Células estaminais mesenquimatosas § OMS - Organização Mundial de Saúde
§ PGCLCs – Células germinativas primordiais-like § PGCs – Células germinativas primordiais
§ PMA - Procriação Medicamente Assistida § RA – Ácido retinóico
§ SCs - Células estaminais
§ SLCs – Células espermatídios-like
§ SNCT- Transferência do núcleo de uma célula somática § VG – Vesícula germinal
III. Introdução
1. Panorama da Infertilidade
O conceito de infertilidade foi definido pela Organização Mundial de Saúde (OMS) como a incapacidade de um casal para alcançar uma gravidez, após pelo menos um ano de relações sexuais regulares, sem a utilização de qualquer método contracetivo.[1] Estima-se
que este problema afete cerca de 48,5 milhões de casais em todo o mundo,[2] o que
representa 10 a 15% do número total de casais em idade reprodutiva.[3] Quanto às causas
de infertilidade, 30% dos casos são atribuíveis a um fator masculino, 30% a um fator feminino, 30% a um fator misto e os restantes 10% a uma causa desconhecida.[4]
Aproximadamente metade dos casais inférteis procura ajuda médica, mas somente 22% acaba por ter acesso à mesma.[5] Anualmente e em todo o mundo, nascem em média
400.000 bebés, em resultado das técnicas de Procriação Medicamente Assistida (PMA).[6]
No entanto, este número representa apenas 50-60% dos casais que usufruem destas técnicas, apesar de se ter verificado um aumento progressivo da sua taxa de sucesso.[7] E se
considerarmos apenas os tratamentos autólogos (sem que exista o envolvimento de um dador), a taxa de sucesso ronda os 30%.[7] Perante este panorama epidemiológico, surge a
necessidade de encontrar novas soluções na área da PMA, com vista a dar uma resposta mais eficaz aos casais inférteis que, de uma forma crescente, continuam a procurar a intervenção médica na sua resolução.
2. Células Estaminais
Nos últimos anos, vários grupos de investigação têm-se dedicado ao estudo das possíveis aplicações das células estaminais (SCs) no tratamento da infertilidade.[8] Estas,
enquanto células não especializadas, com capacidade de autorrenovação e com potencial de diferenciação em vários tipos celulares, têm vindo a ganhar destaque no seio da comunidade científica e atualmente apresentam-se como uma promessa no futuro da medicina regenerativa. [9]
As SCs são classificadas quanto ao seu potencial de diferenciação em totipotentes, pluripotentes, multipotentes e unipotentes.[10] Também podem ser classificadas em células
estaminais embrionárias (ESCs) ou em células estaminais adultas (ASCs), de acordo com a sua origem:
§ As ESCs são células provenientes de embriões, isoladas a partir da massa celular interna (MCI) ou embrioblasto no 5º dia pós-fecundação. Não podem ser encontradas em adultos nem em fetos. São células pluripotentes, o que significa que têm potencial para dar origem a tecidos das três camadas germinativas, nomeadamente oócitos e espermatozóides. [11, 12]
§ As ASCs são células raras e podem ser encontradas juntamente com células diferenciadas num tecido ou órgão de um indivíduo, quer seja um feto, criança ou adulto. Exemplos concretos desses tecidos são a medula óssea, os vasos sanguíneos, o sangue, o coração, o músculo esquelético, o cérebro, os dentes, a pele, o tecido adiposo, o fígado, o intestino, os ovários e os testículos. São células multipotentes, isto é, têm uma capacidade limitada de autorrenovação e de diferenciação, que está geralmente confinada a todos os tipos celulares de uma determinada linhagem, já que a sua função é a manutenção e reparação dos tecidos onde se encontram. [10]
Recentemente há evidência de que algumas ASCs são capazes de se diferenciar em células das 3 camadas embrionárias. [13]
Em 2006, pela primeira vez, foi possível gerar um novo tipo de células estaminais através de um processo de “reprogramação” ou “desdiferenciação” – as Células Estaminais Pluripotentes Induzidas (iPSCs). As iPSCs são células semelhantes às ESCs, mas derivam de células adultas (diferenciadas) que foram geneticamente reprogramadas, através da expressão de genes que lhes conferem propriedades idênticas às ESCs.[14] Nesse estudo,
Shinya Yamanaka e a sua equipa demonstraram que era possível gerar iPSCs a partir de fibroblastos de ratinhos adultos, ao introduzi-los em cultura na presença de 4 fatores de transcrição: Oct3/4, Sox2, c-Myc e Klf4.[15] Em 2007, o mesmo grupo conseguiu reproduzir
esse resultado utilizando fibroblastos dérmicos humanos.[16] Esta descoberta valeu ao
japonês o Prémio Nobel da Medicina em 2012 e veio demonstrar que é possível “voltar atrás no tempo” no grau de diferenciação celular.[17] Mais tarde, para além de células da
pele, foi demonstrada a criação de iPSCs a partir de células provenientes de amostras de sangue periférico[18], de cabelo (queratinócitos)[19] e até de urina[20].
3. Gametogénese in Vitro
Quando a conceção natural não é conseguida por um casal, a PMA pode intervir no sentido de facilitar ou recriar os processos fisiológicos que ocorrem na reprodução in vivo, como são exemplo a ejaculação, a fecundação e a nidação.[21] Atualmente, os tratamentos
de última linha de que dispomos são a Injeção Intracitoplasmática de Espermatozóides (ICSI) e a Fertilização in Vitro (FIV), que reproduzem em laboratório o fenómeno da fecundação.[22] Pensa-se que o próximo passo na evolução da PMA poderá passar pela
reconstituição da oogénese ou a espermatogénese fora do corpo humano. Essa técnica adquire o nome de Gametogénese in Vitro (GIV). A GIV seria particularmente útil em casais com anomalias da gametogénese, quer sejam alterações estruturais importantes ou défices de produção absolutos ou relativos. [23]
A GIV requer a manipulação de PSCs, de forma a diferenciá-las em gâmetas viáveis, que terão a mesma informação genética do indivíduo infértil e que serão posteriormente fecundados através da FIV ou ICSI.[24] Até à descoberta das iPSCs, a
técnica da GIV passaria pela transferência do núcleo de uma célula somática do indivíduo para um oócito anucleado, ao qual se teria retirado previamente o núcleo (SNCT), de forma a obter-se um embrião geneticamente idêntico ao indivíduo (clone).[25] Assim que o
embrião atingisse a fase de blastocisto, poderiam derivar-se células germinais primordiais a partir das células do embrioblasto, que depois sofreriam diferenciação e maturação num meio de cultura apropriado.[26] No entanto, este método enfrenta problemas éticos como a
manipulação de embriões, a clonagem e o facto de, no caso da obtenção de gâmetas femininos, estes partilharem o DNA mitocondrial do dador do oócito anucleado, o qual transmitirão à descendência. A partir da conquista das iPSCs, ficou em aberto a possibilidade de as utilizar na concretização da GIV. [27]
Que vantagens traria a implementação da GIV?
Do ponto de vista teórico, a GIV apresenta uma série de vantagens, que tornam aliciante a sua introdução na prática clínica:
§ Descendência geneticamente relacionada com ambos os progenitores
Atualmente muitos casais não conseguem beneficiar da PMA sem a intervenção de um terceiro indivíduo, o dador de gâmetas.[28] Apesar de esta ser uma solução muitas vezes
eficaz, permanece frequentemente o desejo de obter descendência biológica de ambos os elementos do casal, para além do problema da (in)disponibilidade dos bancos de gâmetas e das questões éticas inerentes à sua doação e utilização.[3, 25] A GIV, ao recorrer única e
exclusivamente a células do próprio indivíduo infértil, permitiria que este partilhasse 50% da informação genética do futuro bebé.
§ Derivação de gâmetas do sexo oposto no caso dos casais homossexuais
Em teoria, perspetiva-se que a GIV permita a geração de oócitos a partir de iPSCs de origem masculina e espermatozóides a partir de iPSCs de origem feminina. Tal permitiria que os casais homossexuais pudessem, pela primeira vez, ter filhos biológicos de ambos os elementos do casal.[29] Um dos elementos participaria na procriação através de gâmetas do
sexo oposto derivados in vitro (com a sua informação genética) e o outro elemento participaria com os seus gâmetas naturais, de forma a que se gerasse um embrião que partilhasse 50% do genoma com cada progenitor.[30] No caso dos casais masculinos, estes
continuariam a necessitar de uma gestação de substituição.
§ Reprodução de indivíduos fora da idade fértil
Dado que a fonte das iPSCs são células somáticas, em teoria, a GIV possibilitaria antecipar a reprodução em mulheres no período pré-menarca, assim como estendê-la para além da menopausa. [31]
§ Indivíduos que pretendem a reprodução a solo
Atualmente já se permite que mulheres solteiras recorram à PMA para serem mães, utilizando esperma de um dador. No caso de estas mulheres não produzirem oócitos viáveis, a GIV manteria a possibilidade de gerarem um filho geneticamente relacionado.
Além disso, a GIV abre as portas ao conceito de “Solo IVG”, em que uma criança é gerada utilizando a informação genética de apenas um progenitor (os seus gâmetas naturais fecundariam um gâmeta do sexo oposto obtido in vitro com a sua informação genética). [32]
A criança resultante não partilharia 50% da informação genética com o progenitor, mas também não se trataria de um clone (100% idêntico). Na verdade, o grau de semelhança dos genomas encontrar-se-ia algures entre 50% e 100% e dependeria da aleatoriedade da
combinação de gâmetas durante a fecundação.[17] O que aconteceria é que todos os alelos
herdados pela criança estariam presentes no genoma do progenitor, no entanto, a combinação dos mesmos seria diferente. Em alguns loci, a criança teria duas cópias do alelo proveniente da avó, noutros loci teria duas cópias provenientes do avô e nos restantes loci cada um dos alelos teria uma origem diferente, ou seja, exatamente a mesma combinação que o progenitor apresenta. Para além das questões éticas, colocam-se preocupações do ponto de vista da saúde, já que estaríamos a aumentar a probabilidade de que mutações heterozigóticas num indivíduo se tornassem homozigóticas no embrião resultante, contribuindo para que as crianças geradas através da “Solo IVG” estivessem em risco de sofrer mais frequentemente de doenças de transmissão genética do tipo recessivo.[33]
§ Reprodução poligâmica ou “Multiplex-parenting”
Do ponto de vista teórico, a GIV permitiria também gerar crianças que fossem geneticamente relacionadas com mais do que 2 indivíduos. Na verdade, qualquer número de indivíduos seria possível, no entanto, quanto maior o número de indivíduos, menor seria o grau de semelhança genética entre a criança e cada um dos progenitores. Imaginando que se trataria de um quarteto, o que aconteceria é que cada um dos dois pares formaria um embrião através dos seus gâmetas. A partir destes dois embriões gerados in vitro, seriam extraídas ESCs que posteriormente seriam manipuladas no sentido de gerar gâmetas. Recorrendo à FIV ou à ICSI, os oócitos derivados de um dos embriões seriam fecundados por espermatozóides com origem no outro embrião, o que resultaria em novos embriões que partilhariam 25% do seu genoma com cada um dos quatro indivíduos. Do ponto de vista genético, saltar-se-ia uma geração e os indivíduos progenitores seriam, na verdade, os avós das crianças resultantes.[34] Este conceito desafia a reprodução humana como a
conhecemos.[32] Apesar disso, a sociedade está em constante mudança e exemplo disso foi
a aprovação de uma lei, em 2013 na Califórnia, que prevê o direito de uma criança a ter mais do que dois pais legais. Em algumas culturas a poligamia é vulgarmente aceite, pelo que seria nas famílias com esses ideais que o “Multiplex-parenting” seria particularmente útil. [33]
§ Facilitar o Diagnóstico Genético Pré-implantação (DGPI)
A GIV promete criar um número de gâmetas substancialmente maior do que a quantidade que hoje temos disponível a partir da punção ovárica ou da ejaculação no
homem.[3] Por essa razão, mais embriões poderiam ser criados, aumentando a probabilidade
de se formar um que apresente as características geneticamente desejáveis: sem uma dada mutação e sem aneuploidias. Esse facto pode ser visto também como uma desvantagem do ponto de vista ético, no sentido em que mais embriões seriam criados mas também destruídos.[25, 35] Há quem imagine que no futuro se possa contornar esse problema,
testando os gâmetas criados in vitro ao invés dos embriões, no entanto, ter-se-ia de garantir que a viabilidade dos gâmetas testados não seria comprometida. [17]
4. Objetivos
Dada a necessidade e a procura crescentes pela intervenção médica na procriação, urge a pesquisa e oferta de novas soluções aos casais inférteis. Ao tratar-se de uma técnica extremamente recente, inovadora e que desafia a reprodução humana como a conhecemos, a Gametogénese in vitro pode ser ainda encarada como pura ficção científica. No entanto, foi a acreditar que é possível transpor o domínio da ficção para a realidade, que tantos avanços se fizeram ao longo da história da Medicina. Por essa razão e no âmbito do trabalho final de mestrado, proponho-me a contribuir para a literatura com uma visão holística e simplificada do tema, através da revisão dos artigos publicados nos últimos anos acerca da derivação de gâmetas a partir de células estaminais. Pretende-se sobretudo conhecer o estado da arte desta técnica e especular sobre a sua implementação futura na prática clínica.
IV. Métodos
Foi realizada uma pesquisa da literatura na base de dados eletrónica PubMed, utilizando múltiplas combinações das seguintes palavras-chave em língua inglesa: “infertilidade”, “reprodução medicamente assistida”, “células estaminais”, “células estaminais pluripotentes”, “células estaminais pluripotentes induzidas”, “células estaminais embrionárias”, “células estaminais adultas”, “derivação”, “diferenciação,” “gametogénese in vitro”, “oogénese”, “espermatogénese”, “espermatozóides”, “oócitos”, “gâmetas”, “gâmetas artificiais”, “gâmetas do sexo oposto”, “descendência”, “humano”, “ratinho”.
A pesquisa permitiu selecionar artigos com potencialidade para serem incluídos no propósito desta revisão. Aqueles mais pertinentes foram integralmente examinados e a sua respetiva lista de referências revista, de forma a identificar outros estudos com relevância para serem abordados neste trabalho.
V.
Resultados
Foram identificados 43 artigos na literatura, dos quais 25 foram excluídos por não se incluírem no propósito desta revisão. 18 artigos foram selecionados para uma leitura integral e, a partir da revisão das suas referências bibliográficas, outros 9 artigos foram manualmente introduzidos. No total, foram utilizados 27 artigos, cujo ano de publicação se situa no intervalo de tempo 2003-2018 e, dos quais, 2 constituem trabalhos de revisão e 25 correspondem a estudos originais.
VI. Discussão
Gametogénese in vitro
1. Modelo animal
Os estudos na área da derivação de gâmetas a partir de SCs iniciaram-se há mais de uma década, em modelo de ratinho. Pela primeira vez, em 2003, Hubner et al. conseguiram gerar células oócitos-like numa cultura bi-dimensional a partir de ESCs [36],
enquanto outros estudos reportaram a formação de PGCs ou células espermatídios-like. No entanto, estes resultados foram obtidos através da indução aleatória da diferenciação, com subsequente seleção das raras células que expressavam marcadores de GCs (<1%). A baixa eficácia impossibilitava prosseguir com mais estudos e não se tinha conseguido provar que as células obtidas tivessem capacidade de gerar descendência. [37]
i. Transplante in vivo
Em 2006, Nayernia et al. conseguiram, pela primeira vez, originar descendência a partir de espermatozóides derivados de ESCs, obtidos após um transplante in vivo de espermatogónias para os testículos de ratinhos inférteis. No entanto, todas as 7 crias morreram prematuramente (entre os 5 dias e 5 meses após o nascimento). Além disso, a progenia mostrou também alterações fenotípicas - apresentavam estatura quer aumentada, quer diminuída, face aos ratinhos controlo. [38]
A contribuição de gâmetas gerados in vitro para a obtenção de descendência saudável viria a ser demonstrada apenas em 2011, por Hayashi et al. Este grupo começou por diferenciar células germinais primordiais-like (PGCLCs), em modelo de ratinho, a partir de ESCs (linhagens BVSC e AAG) e de iPSCs (linhagens 20D17, 178B-5 e 492B-4). Obtiveram, numa fase intermédia, células do epiblasto-like (EpiLCs), que embora sejam distintas das células estaminais epiblásticas (EpiSCs), encontram-se num estado celular semelhante às células do epiblasto, sendo altamente competentes para prosseguir a via de diferenciação germinal, dando origem a PGCLCs. No seu estudo, identificaram 2 marcadores de PGCLCs: Integrin-β3 e SSEA1, que permitiram o isolamento eficaz destas células. A fim de testar a sua capacidade em iniciar a espermatogénese, transplantaram-nas em testículos de ratinhos inférteis. Após 8 a 10 semanas, verificaram que os túbulos seminíferos dos ratinhos transplantados com PGCLCs derivadas de ESCs continham espermatozóides em abundância e com uma morfologia normal (presentes em 50% dos
testículos da linhagem BVSC e em 83% da linhagem AAG). Através de ICSI, fertilizaram óvulos wild-type com os gâmetas obtidos, culminando em descendência aparentemente saudável e fértil, de ambos os sexos. Já nos testículos transplantados com células derivadas de iPSCs: a espermatogénese não ocorreu nas linhagens 178B-5 e 492B-4, todavia, 3 dos 18 (17%) testículos da linhagem 20D17 (a única derivada a partir da introdução do transgene c-Myc) exibiram espermatozóides normais, que permitiram obter descendência fértil. No entanto, algumas crias morreram precocemente devido a tumores na região do pescoço. Dois testículos da linhagem 178B-5 desenvolveram teratomas.
Como controlo utilizaram EpiSCs extraídas diretamente de epiblastos de ratinho ao E5.75, a partir das quais derivaram PGCs. A eficiência da colonização pelas PGCLCs foi comparável à das PGCs. [39]
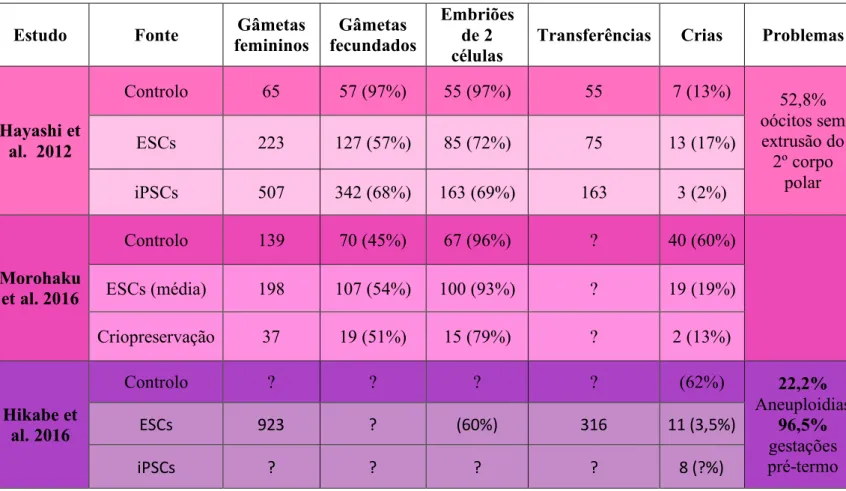
Em 2012, o mesmo grupo de investigação (Hayashi et al.) executou um protocolo semelhante, a fim de gerar gâmetas femininos in vitro. Fizeram duas experiências controlo: extraíram PGCs diretamente de embriões ao E12.5 e colheram oócitos de ratinhos wild-type com 3 semanas. No que diz respeito ao transplante in vivo, agregaram as PGCLCs/PGCs a células somáticas de gónadas embrionárias (proporção de 1:10) para formar “ovários reconstituídos”, que posteriormente transplantaram para o mesovário ou corpúsculos renais de ratinhos hospedeiros. Após 4 semanas e 4 dias, estes ovários reconstituídos exibiram um crescimento considerável, boa vascularização e a presença de células oócitos-like, que na sua maioria exibiam uma vesícula germinal (VG) totalmente desenvolvida e rodeada por várias camadas de células da granulosa e da teca. Isolaram manualmente as células resultantes dos ovários reconstituídos: 65% dos oócitos wild-type foram isolados enquanto um complexo oócito-células do cumulus (COC), porém 60% dos oócitos-like encontravam-se desnudados. Além disso, exibiam uma forma elíptica anormal com maior frequência do que os oócitos wild-type, o que aponta para uma instabilidade na formação do COC e fragilidade do citoesqueleto. Os oócitos de todas as linhagens sofreram maturação in vitro (MIV) e aqueles que atingiram a metáfase II foram fertilizados com espermatozóides através de FIV. A transferência dos embriões de duas células resultantes para as trompas de fêmeas wild-type permitiu obter descendência saudável e fértil e as crias de todos os grupos cresceram de forma semelhante. Estudaram a meiose nos oócitos derivados de PGCLCs e perceberam que estes tinham dificuldade em expulsar o 2º corpo polar, o que resultou em zigotos triploides em 52,8% dos casos. A triploidia constitui uma explicação possível para o reduzido número de crias derivadas de ESCs e iPSCs. [23]
Apesar de ter sido a primeira vez que se conseguiu obter descendência fértil a partir de ESCs e iPSCs, o protocolo de Hayashi et al. apresenta alguns problemas inerentes, nomeadamente a necessidade de sacrificar fêmeas grávidas para obter células somáticas gonadais a partir dos seus embriões e de realizar uma cirurgia de transplante das PGCLCs para as gónadas de ratinhos hospedeiros, os quais também serão posteriormente sacrificados, a fim de colher os respetivos gâmetas. Além disso, a gametogénese não foi recriada inteiramente in vitro, tendo-se somente produzido PGCLCs, num processo que requer apenas 5-6 dias, enquanto sobram 4-5 semanas adicionais da oogénese. Nesse período, as interações entre os oócitos e as células somáticas são de extrema importância para que ocorra a meiose, o desenvolvimento folicular e para o crescimento dos oócitos, tornando-o mais complexo e difícil de recriar. No entanto, todos os estudos que tinham tentado fazer um bypass ao transplante in vivo até então, não tinham obtido descendência.
[41]
ii. Exclusivamente in vitro
Em 2016, a equipa Zhou et al. levou a cabo um protocolo que dispensou finalmente o transplante in vivo, através da formação de uma co-cultura in vitro constituída por PGCLCs (com origem em ESCs) e células testiculares de ratinhos recém-nascidos (colhidas 2-8 dias após o parto) na proporção 1:1. Após 8 dias de diferenciação in vitro, observavam-se espermatócitos primários. A fim de validar a integridade genómica, realizaram a sequenciação completa do genoma de 8 espermatídios escolhidos aleatoriamente: 6 eram haploides, sem alterações estruturais aparentes; 1 era haploide, mas revelou deleções cromossómicas e 1 era diploide. Injetaram oócitos wild-type com os espermatídios obtidos in vitro e compararam-se os resultados obtidos para cada linhagem. Todas as crias foram submetidas à análise do cariótipo que mostrou ser normal, assim como sequenciação bissulfito que indicou um padrão genético com contribuição paterna e materna. Todas as crias se desenvolveram até à idade adulta e mostraram capacidade para gerar a sua própria descendência. Assim, a espermatogénese decorria, pela primeira vez, exclusivamente in vitro. [42]
Por sua vez, Morohaku et al. conseguiram, ainda no mesmo ano, reproduzir a oogénese inteiramente in vitro, a partir do isolamento de ovários fetais femininos (colhidos ao 12.º dia pós-coito) e posterior cultura in vitro. Após 17 dias, mais de 100 oócitos foram encontrados em cada ovário, no entanto, apenas 4 a 6 folículos secundários foram isolados com sucesso. Verificaram a existência de algumas anomalias foliculares: invólucros de
laminina incompletos, partilha da mesma teca e/ou camada granulosa com folículos vizinhos e folículos contendo mais do que um oócito. Na suspeita de que se trataria de uma consequência da desregulação dos níveis de estrogénio, numa segunda experiência, adicionaram à cultura um antagonista dos recetores de estrogénio. Esta alteração levou a um aumento em 7 vezes o número de folículos secundários, face aos números da experiência original e promoveu também a formação de um invólucro de laminina completo nos folículos individuais. Adicionaram ainda colagenase (necessária para digerir as camadas externas dos folículos), o que resultou na proliferação das células da granulosa. Induziram a meiose usando gonadotrofinas e um fator de crescimento epidermal, obtendo gâmetas haploides que posteriormente foram fertilizados. Foram obtidas entre 0.7-3.3 crias, por cada gónada. Seccionaram também ovários fetais e criopreservaram-nas através de vitrificação e colocação em nitrogénio líquido durante 3 dias. Após este período, as gónadas foram reaquecidas e colocadas numa cultura igual à usada para as gónadas frescas. Embora se tenha formado um número menor de gâmetas, estes deram origem a descendência igualmente normal. Deste modo, demonstraram a exequibilidade da criopreservação de gónadas e a subsequente produção de oócitos, que se espera vir a ser uma fonte alternativa de gâmetas no futuro. [43]
Em 2016, Hikabe et al. também desenvolveram um sistema para estabelecer a oogénese inteiramente in vitro, ao formar “ovários reconstituídos” através da cultura simultânea de PGCLCs femininas (derivadas de ESCs e iPSCs de ratinho) e de células somáticas de ovários fetais. A evolução das subfases da meiose foi controlada através de uma análise de imunofluorescência: o não-emparelhamento de cromossomas homólogos ocorreu mais frequentemente in vitro (53,8%) do que in vivo (5.3%), o que pareceu estar relacionado com a constituição da própria cultura, já que o mesmo resultado se verificou em oócitos obtidos de gónadas wild-type, colocados numa cultura semelhante (controlo). A frequência de aneuploidias foi superior ao normal, mas 77,8% dos oócitos gerados in vitro eram euploides. Para testar a capacidade destes oócitos para originar descendência, foram submetidos a FIV, originando vários embriões de duas células, que de seguida foram transferidos para o útero de fêmeas wild-type. Apenas 3.5% das gestações foram de termo, número discrepante dos 61.7% verificados na reprodução in vivo. Apesar disso, todas as crias cresceram normalmente, sem anomalias aparentes, tendo permanecido vivos durante pelo menos 11 meses, sem qualquer ocorrência de mortes prematuras.
Alguns oócitos gerados in vitro foram utilizados para gerar embriões e extrair ESCs que posteriormente também derivaram gâmetas, o que permitiu reconstituir um ciclo completo da linha germinal feminina. [44]
Uma das vantagens vulgarmente apontadas à gametogénese in vitro é a potencialidade de formar milhares/milhões de gâmetas e embriões, o que seria particularmente útil como técnica adjuvante do DGPI. No entanto, os estudos existentes permitiram apenas produzir dezenas a centenas de oócitos maduros e perspetiva-se que seja difícil ultrapassar este número e chegar aos milhares, dado que o isolamento das estruturas foliculares a partir dos ovários reconstituídos, é feita manualmente, de forma a evitar desnudar os oócitos. [45]
2. Modelo humano
i. Diferenças Humano/Ratinho
Podem ser observados dois estados de pluripotência distintos nas SCs embrionárias de ratinho: um estado “naïve”, do qual são exemplo as mESCs (derivadas da MCI de embriões pré-implantação ao E3-4) e o estado “primed”, representado pelas mEpiSCs (derivadas do epiblasto de embriões pós-implantação ao E5-6). As hESCs e as hiPSCs identificam-se mais com as mEpiSCs do que com as mESCs, embora as hESCs sejam obtidas ainda numa fase pré-implantação. As principais diferenças entre estes dois estados prendem-se com a morfologia das colónias, a necessidade de fatores de crescimento diferentes para manter o seu estado de pluripotência, a inativação do cromossoma X nas fêmeas (no caso do estado “primed”) e a incapacidade em contribuir para formar quimeras quando injetadas em blastocistos (células pluripotentes “primed”). A maioria do conhecimento atual baseia-se em estudos realizados com mESCs, o que perante estas diferenças dificulta as comparações com o modelo humano. Além disso, a concretização da GIV em humanos pode ser complicada pelo estado de pluripotência “primed” das hPSCs. Apresentam-se de seguida alguns trabalhos recentes, no contexto da derivação de gâmetas a partir de SCs humanas.
[25, 39, 46]
ii. Estudos com células Humanas
Em 2011, Eguizabal et al. conseguiram pela primeira vez, completar a diferenciação de hiPSCs de diferentes origens (queratinócitos e sangue periférico) em células
pós-meióticas. Ao fim de 10 semanas em cultura, obtiveram de forma consistente células haplóides, resultado esse confirmado por FISH, com verificação da presença de 0.4% a 2.3% de células haplóides por amostra. A expressão de genes era semelhante à dos espermatozóides wild-type. [47]
Em 2012, Easley et al. colocaram hESCs e hiPSCs (origem em fibroblastos do prepúcio) numa co-cultura contendo espermatogónias indiferenciadas provenientes de ratinhos. Posteriormente, observaram a sobre-expressão de marcadores da espermatogénese, incluindo marcadores de espermatogónias diferenciadas, espermatócitos pré-meiose, espermatócitos meióticos e pós-meiose e espermatídios. A análise de citometria de fluxo também indicou a existência de uma população haploide. Os resultados apoiam uma metodologia para diferenciar rápida e diretamente PGCs humanas em células da linha germinal, incluindo espermatídios redondos, usando apenas fatores extrínsecos e sem manipulação genética, o reduz o tempo necessário e se torna numa vantagem, no caso de se aplicar futuramente na clínica. [48]
Em 2015, Irie et al. demonstraram a derivação de células hPGCLCs a partir de iPSCs e ESCs, na presença de SOX17 (um regulador chave da diferenciação em hPGCLCs) e de BLIMP, que reprime genes somáticos e da endoderme durante a diferenciação. O estudo contribuiu para perceber a divergência evolutiva nos estados de pluripotência no ratinho e no humano, com diferenças nos mecanismos de especificação e na decisão. Por esta razão, os mecanismos de decisão precoce da linhagem a seguir em ratinhos não podem ser extrapolados para o modelo humano. [49]
Em 2017, Cheng desenvolveu um método para diferenciar hPGCs a partir de hESCs masculinas, usando CHIR99021 (um inibidor da cinase 3 da síntese de glicogénio) e ácido retinóico (RA). A proteína Dazl e outros marcadores de PGCs foram detetados, assim como SCP3, um biomarcador da prófase I da meiose. Através da análise FISH verificou-se a formação de uma pequena percentagem de células haploides. [50]
Em 2018, Zhao et al. executou um protocolo para a derivação de SLCs humanas a partir de hPGCs, recorrendo apenas a meios de cultura livres de substratos derivados de outras espécies animais e dispensando a utilização de células somáticas (como as células de testículos neonatais etc). Para a derivação de iPSCs usaram duas fontes diferentes de células adultas diferenciadas, uma das quais o sangue periférico de um homem (células sangue mononucleares). A eficiência da formação de SLCs a partir de iPSCs foi semelhante usando as duas fontes. Realizaram DNA spreading assays, usando anticorpos anti-SYCP3 e CENPA (um componente do centrómero) enquanto marcadores da meiose.
Aproximadamente 5% das células geradas tornaram-se haploides. Algumas dessas células foram testadas aleatoriamente e mostraram-se positivas para ACR, um marcador do acrossoma com localização peri-nuclear nos espermatídios, assim como para PRM1, a proteína histona repositora de protamina em espermatídios. O DNA da população haploide foi analisado através de FISH e constataram que apenas continham um X ou um Y e uma cópia única dos cromossomas 7 e 18. [51]
3. Utilização de ASCs
Devido aos problemas éticos e imunológicos associados à utilização de ESCs, mas também aos problemas de segurança relativos às iPSCs, alguns investigadores começaram a incluir diferentes tipos de ASCs nos seus estudos (na sua maioria, são células estaminais mesenquimatosas [MSCs] da medula óssea).[8]
Em 2007, Drusenheimer et al. demonstraram que uma pequena população das células da medula óssea é capaz de sofrer transdiferenciação para células germinativas masculinas, com expressão comprovada de alguns marcadores precoces desta linhagem celular (Dazl, TSPY, Piwil2 and Stra8). [52]
Em 2008, Bunnell et al. verificaram que o tecido adiposo é uma fonte rica e acessível de ASCs, cuja diferenciação foi testada através da adição de cocktails de citoquinas e outros indutores químicos. Embora se pensasse que, sendo multipotentes, teriam uma capacidade limitada de diferenciação, recentemente há evidência de que são capazes de se diferenciar em células das 3 camadas germinativas. [13, 53]
Em 2016, Afsartala et al. publicaram o primeiro estudo sobre o papel das células estaminais mesenquimatosas da membrana amniótica (AM-MSCs) na indução da diferenciação de GCs. Uma vez presentes em tecidos biológicos habitualmente desperdiçados, as AM-MSCs são amplamente disponíveis, o que representa uma vantagem em relação às ASCs da medula óssea. Neste estudo, foram isoladas da membrana embrionária de ratinhos machos, através de digestão enzimática. Foram cultivadas durante 5 dias com BMP4 e posteriormente, com ácido retinóico (RA) durante 12 dias. Através de RT-PCR verificaram a sobreexpressão de marcadores específicos de GCs: Itgb1, Dazl, Sta8, Piwil2, Mvh, Oct4 e c-Kit. Por citometria de fluxo e coloração de imunofluorescência, confirmaram a expressão de Mvh e Dazl a nível proteico: 23% e 46% de células positivas
respetivamente. A morfologia das células também se alterou para uma forma arredondada e formação de colónias, à semelhança do que se verifica nas colónias testiculares.[54]
Ainda em 2016, Shirazi et al. isolaram células mononucleares SSEA-1+ (stage-specific embryonic antigen 1 positive) da medula óssea de ratinhos com 2-4 semanas de idade, através de MACS (magnetic-activated cell sorting). A sua pluripotência foi demonstrada através da expressão de marcadores específicos e da sua diferenciação em células das 3 camadas germinativas. Foram cultivadas na presença de RA, a fim de testar a sua diferenciação em GCs. Através de RT-PCR verificaram que as células resultantes expressavam marcadores de PGCs (Oct4, Dppa3 e Mvh), assim como marcadores de GCs pré-meiose (Dazl, Sta8, Piwil2) e da meiose inicial (SYCP3). Foram, no entanto, negativas para c-Kit e marcadores de meiose (Pgk2) e pós-meiose (TP2). Os autores sugerem que as células diferenciadas necessitariam de um ambiente apropriado para continuar a meiose e produzir células haploides. Concluíram também que as MSCs não se conseguem diferenciar em GCs, mas que, pelo contrário, estas são geradas a partir de PSCs (VSEL ou SSEA-1+) existentes na medula óssea. [55]
Em 2017, Shlush et al. reportaram pela primeira vez a diferenciação de ASCs humanas em células Sertoli-like e GCs. Colheram células perivasculares do cordão umbilical humano (hUCPVCs), quer durante o primeiro trimestre de gestação, quer após o nascimento de termo. Para induzir a sua diferenciação, as células foram cultivadas utilizando um protocolo inovador que pretendeu recriar os sinais fisiológicos presentes durante o desenvolvimento testicular. Após 3 semanas, surgiram dois tipos de células morfologicamente distintos que sobre-expressavam marcadores específicos de GCs (VASA, Dazl, GPR125 e GFR1alfa) e de células de Sertoli (FSHR, SOX9 e AMH). Após 5 semanas adicionais em cultura, 10-30% das células eram haploides e tinham adotado a morfologia típica de espermatídios. Estudos com ratinhos já tinham demonstrado que as GCs têm origem no epiblasto proximal, as células de Sertoli provêm da mesoderme e as hUCPVCs da mesoderme extraembrionária. Atendendo à multipotência das hUCPVCs, a sua capacidade para se diferenciarem em duas linhagens testiculares nas mesmas condições, parece estar inerente à sua heterogeneidade. Nesse âmbito foi identificada uma subpopulação de células embrionárias-like (VSELs- very small embryonic-like cells) no cordão umbilical e outros tecidos, que expressam Oct4A e SSEAA e que exibem pluripotência. [56]
4. Obtenção de gâmetas do sexo oposto
A derivação de gâmetas do sexo oposto apresenta-se como uma das possíveis aplicações e vantagens da GIV, principalmente útil no contexto da reprodução homossexual. Formar-se-iam oócitos a partir de SCs 46, XY e espermatozóides a provenientes de SCs 46, XX.
Sabe-se que o seguimento da via da espermatogénese ou da oogénese em PGCs é estritamente regulada pelo ambiente gonadal nos testículos ou ovários, cujo desenvolvimento é determinado, respetivamente, pela presença ou ausência do cromossoma Y (mais especificamente o gene SRY). Nesse sentido, parece improvável a formação de oócitos XY num ambiente testicular e de espermatozóides XX num ambiente ovárico. De seguida apresentam-se vários trabalhos no âmbito da geração de gâmetas do sexo oposto a partir de SCs.
Segundo Taketo et al., as fêmeas XY de ratinho (com Y e SRY intactos) são geralmente inférteis, apesar de desenvolvem frequentemente ovários, com formação de oócitos. O problema é que, ao contrário do que acontece nos espermatócitos, os cromossomas X e Y não se emparelham na maioria dos oócitos, levando a que grande parte destas células seja eliminada no final da profase, por um mecanismo de sobrevivência subsequente à asinapse. Ainda assim, alguns sobrevivem e sofrem foliculogénese, mas após o nascimento, as crias do sexo feminino apresentam uma reserva folicular já muito reduzida. Acredita-se que o problema resida também em defeitos do ooplasma. [57]
Em 2003, Hubner et al. mostraram que ESCs de ratinhos machos podem diferenciar-se em oogónias que entram na meiose, recrutam células adjacentes para formar estruturas folículos-like e que, mais tarde, culminam em estruturas semelhantes a blastocistos. Não verificou se estas células podiam ser fertilizadas nem se sofreram um imprinting específico do sexo feminino. Sabe-se que na ausência da expressão apropriada do gene SRY nas gónadas, as PGCs seguem a via germinal feminina e frequentemente entram na primeira fase da meiose, parando na prófase I. Neste estudo só detetaram a expressão de SRY nas culturas num período mais tardio, o que pode significar que o gene não foi eficientemente regulado nas áreas onde houve diferenciação em GCs femininas. [36]
Em 2007, Kerkis et al. tentaram produzir ambos os tipos de gâmetas a partir de ESCs de ratinho masculinas, sem recorrer a qualquer manipulação genética e colocando-as sob as mesmas condições de cultura. À cultura adicionaram apenas RA (um potente ativador do crescimento de mPGCs in vitro) e vários fatores de crescimento como BMP-4
e GDF-9. Após duas semanas, na mesma placa de Petri onde já tinham previamente observado GCs e espermatídios (redondos e alongados), presenciaram estruturas semelhantes a folículos ováricos precoces. [58]
No mesmo ano, Qing et al. demonstraram a derivação in vitro de células oócitos-like a partir de ESCs de ratinhos machos, após a elaboração de uma co-cultura com células da granulosa. Os resultados foram apoiados por análises de Imunohistoquímica e RT-PCR, que evidenciaram a expressão de marcadores específicos de GCs (Mvh e SCP3), assim como de genes habitualmente expressos em oócitos (Figα, GDF-9 e ZP1-3). Pelo contrário, não houve expressão de genes testiculares. Além disso, as ESCs colocadas numa cultura controlo, sem células da granulosa, não expressaram nenhum dos marcadores supracitados.
[59]
Em 2011, Eguizabal et al. conseguiram obter células haploides pós meióticas, com expressão de marcadores de espermatozóides, tendo como ponto de partida hiPSCs humanas de ambos os sexos. [47]
Em 2017, Honda et al. publicaram um estudo dedicado a uma espécie de roedores,
Tokudaia osimensis, vulgarmente denominada de rato-ouriço-das-Léquias, que pode ser
apenas encontrada na ilha japonesa Amami-Oshima e a qual tem a particularidade de os machos e as fêmeas partilham o mesmo cariótipo XO (2n=25). Não existem indivíduos com o cariótipo XX nem OO e o sexo é distinguível através da morfologia e da posição dos genitais. Esta espécie perdeu o cromossoma Y e o gene SRY durante a sua evolução e, relativamente a outros genes relacionados com a espermatogénese que habitualmente se encontram nesse cromossoma, esses foram translocados para o único cromossoma X, comum a ambos os sexos. Isto significa que a espécie adquiriu outro mecanismo determinante do sexo, provavelmente a partir dos autossomas e que, até ao momento tem permanecido desconhecido. Para tentar estudar esse mecanismo, geraram iPSCs a partir de fibroblastos da ponta da cauda de fêmeas, que foram utilizadas para produzir quimeras através da sua introdução em blastocistos de ratinho. Passadas 8 semanas, procuraram a distribuição das células derivadas de iPSCs nas quimeras adultas (através da pesquisa de um sinal DsRed por elas expresso, após manipulação genética), e verificaram a presença de oócitos secundários DsRed positivos, sugerindo que as iPSCs contribuíram para a linhagem germinal feminina. Dissecaram também os testículos de quimeras masculinas, onde verificaram a presença de espermatócitos DsRed+, embora muito raramente. Comprovaram que esta espécie tem uma grande plasticidade sexual através da qual as
células somáticas de fêmeas podem ser convertidas em células da linha germinal masculina, no entanto, o mecanismo determinante do sexo continuou por esclarecer.[60]
5. Aneuploidias
Em 2017, Hirota et al. quiseram a estudar infertilidade em casos de trissomia dos cromossomas sexuais, pelo que geraram ratinhos com os cariótipos XXY e XYY. Tal como verificado no Homem, os ratinhos revelaram-se inférteis. Colheram-se fibroblastos, de modo a obter iPSCs. Todavia, durante o processo de reprogramação, grande parte das iPSCs exibiu perda espontânea de cromossomas: no caso da linhagem XXY, observaram-se as variantes XY, XX e XO, enquanto que no caso da linhagem XYY, obobservaram-servaram-observaram-se as variantes XY e XO. A perda cromossómica foi superior nas iPSCs trissómicas, relativamente às iPSCs derivadas de ratinhos euploides (XY e XX). As iPSCs deram origem a PGCLCs, que foram posteriormente transplantadas para testículos de ratinhos inférteis. Após 9-10 semanas, verificaram que a espermatogénese tinha ocorrido em ambas as linhagens. Apesar disso, desenvolveram-se teratomas em alguns testículos após o transplante (29% dos XXY e 50% dos XYY). A fertilização de oócitos através de ICSI permitiu obter zigotos que se desenvolveram em embriões de 2 células in vitro e que foram transferidos para fêmeas wild-type, dando origem a descendência (eficiência 46.9% - 59.4%). As crias das linhagens XXY e XYY mostraram um crescimento semelhante às crias controlo XY e todas revelaram ser euploides (XY) através da análise do cariótipo. Algumas crias fêmeas foram cruzadas com crias masculinas e concluiu-se que todas eram férteis.
Repetiram a experiência, em ratinhos manipulados para apresentarem trissomia 21, dos quais criaram iPSCs a partir de fibroblastos: 62.5% das linhagens apresentaram perda do cromossoma 21 extra em mais de 10% das células. Também testaram fibroblastos humanos provenientes de pacientes com Síndrome de Klinefelter e Trissomia 21. Observaram iPSCs XY e XX no caso das iPSCs provenientes de Klinefelter e iPSCs euploides provenientes de fibroblastos trissómicos. [61]
VII. Conclusões e Perspetivas Futuras
Até à data, os trabalhos publicados mostram que, em modelo animal, já se conseguiu praticar a oogénese e a espermatogénese, exclusivamente in vitro, quer a partir de iPSCs, quer de ESCs e com geração de descendência saudável e fértil (ainda que com uma baixa eficácia). No entanto, estes resultados foram obtidos à custa de co-culturas com células somáticas gonadais obtidas a partir de embriões, o que constitui uma grande limitação, principalmente se se tiver em vista a aplicação desta técnica na clínica. Não só por implicar sacrificar embriões, mas também porque algumas células germinais endógenas podem não ser completamente eliminadas durante a purificação das células gonadais somáticas, existindo a probabilidade de nascer uma criança relacionada geneticamente com o dador dessas células e não com o indivíduo infértil. Pensa-se que a derivação destas células a partir de ESCs/iPSCs (a par dos gâmetas), seria uma possível solução para ultrapassar este problema.
Existem diferenças entre ratinhos e humanos no que diz respeito ao estado de pluripotência das SCs, assim como aos fatores de crescimento necessários e ao tempo que as células requerem em cultura, pelo que estes resultados obtidos em ratinhos não podem ser extrapolados para o Homem.
Em modelo humano, foi reportada a geração in vitro de vários tipos de células da linha germinal, principalmente masculinas, como células haplóides espermatídios-like. Estes resultados tiveram como ponto de partida ESCs, iPSCs e alguns tipos de ASCs e, pelo menos um estudo, reportou a utilização de uma cultura sem quaisquer substratos ou células animais. Todavia, a fertilização dos gâmetas não foi tentada, além de que seria também essencial testar a sua capacidade para gerar descendência. Porém, ao contrário do que sucede com o modelo animal, não se pode simplesmente fertilizar estes gâmetas e transferir os embriões resultantes para o útero de uma mulher.
Relativamente à derivação de GCs femininas a partir de SCs XY e de GCs masculinas com origem em SCs XX, ainda que com uma eficácia muito reduzida, alguns estudos em modelos animal e humano, conseguiram demonstrá-lo. Uma pequena parte destas células provou ser haplóide, após sofrer a meiose num ambiente gonadal do sexo oposto.
Um estudo concluiu também que células somáticas de ratinhos e humanos inférteis com trissomia de autossomas ou cromossomas sexuais, perdem o cromossoma extra durante a reprogramação, produzindo iPSCs euploides, que originam posteriormente descendência
com fenótipo e genótipo normais, saudável e fértil. Os mecanismos que levam a esta perda cromossómica são desconhecidos.
Este é o estado da arte para a GIV e, embora se tenham alcançado avanços extraordinários nos últimos anos, persistem ainda muitas limitações técnicas que necessitam de ser ultrapassadas.
Principalmente no que diz respeito ao perfil de segurança, é preocupante qualquer possibilidade de se vir a gerar descendência com anomalias geno e fenotípicas, existindo ainda um longo caminho a percorrer até que esta seja considerada uma técnica suficientemente segura para ser utilizada na clínica. Para diminuir esse risco, não se pode analisar o perfil (epi)genético dos gâmetas, se se pretender usá-los posteriormente. Porém, o DPGI parece constituir uma forma lógica de controlar a qualidade dos embriões futuramente obtidos após fertilização de gâmetas derivados de SCs. Ainda assim, tal como em todas as terapias inovadoras, será impossível eliminar o risco por completo.
Será também preciso melhorar a eficácia dos protocolos, pois atendendo ao alto custo financeiro dos meios de cultura e restantes materiais, esta técnica não apresentaria uma relação custo/benefício favorável e justificativa da sua introdução num sistema de saúde público. Em todo o caso, é previsível que não se tratará nunca de uma técnica a aplicar largamente, pelo que nem todos os indivíduos e casais serão elegíveis para usufruir dela. Poderá, sim, vir a constituir uma técnica de 3ª linha, à qual se recorrerá quando todas as outras técnicas não são aplicáveis ou não foram eficazes.
De outro prisma, a criação de gâmetas in vitro levanta novas questões que desafiam as normas éticas e legais atuais e que, no futuro, iniciarão certamente longos debates.
Por fim, se por agora a GIV permanece enquanto uma realidade distante, é previsível que, ainda antes do final do século, a notícia da primeira criança gerada a partir de “gâmetas artificiais” venha ocupar as manchetes dos media espalhados por todo o mundo.
VIII. Agradecimentos
Agradeço profundamente ao meu orientador por ter embarcado comigo neste desafio, pela sua disponibilidade incrível e pelas palavras de motivação, que foram fundamentais na minha tarefa de levar este trabalho a bom porto.
À minha família, pelo amor e apoio incondicionais que me dedicaram desde o meu primeiro dia. Obrigada por estarem prontos a deixar-me voar e a aplaudir-me nos altos voos, tendo o cuidado de deixar sempre montada a maior rede de segurança para aparar as quedas acidentais.
Ao Tomás, por escapar comigo nas maiores aventuras e me conceder momentos em que o tempo para, mesmo quando, na verdade, nunca andou tão depressa.
A todos os meus amigos, mas em particular à Beatriz Morgado, pelo companheirismo e partilha dos momentos mais agridoces, pela preocupação e pela entreajuda que sempre me ofereceu ao longo deste percurso.
IX. Anexos
Tabela 1 – Resultados dos estudos sobre a espermatogénese em ratinhos.
Estudo Fonte fecundados Oócitos de 2 células Embriões Transferências Crias Problemas Nayernia et al. 2006 ESCs 210 65 ? 7 Morte prematura e alterações da estatura Hayashi et al. 2011 Controlo 41 37 20 (54%) - ESCs BVSC ? 151 145 32 (22%) - AAG ? 63 63 33 (52%) - iPSCs 20D17 ? 27 27 7 (26%) Morte Prematura: Tumores do pescoço Zhou et al. 2016 Controlo 160 148 (93%) 148 14 (9,5%) ESCs SGPD1 63 51 (80%) 51 1 (2%) SGPD2 125 107 (86%) 107 5 (4,7%) BVSC 191 159 (83%) 159 3 (1,9%)
Tabela 2- Resultados dos estudos sobre a oogénese em ratinhos.
Estudo Fonte femininos Gâmetas fecundados Gâmetas
Embriões de 2
células Transferências Crias Problemas
Hayashi et al. 2012 Controlo 65 57 (97%) 55 (97%) 55 7 (13%) 52,8% oócitos sem extrusão do 2º corpo polar ESCs 223 127 (57%) 85 (72%) 75 13 (17%) iPSCs 507 342 (68%) 163 (69%) 163 3 (2%) Morohaku et al. 2016 Controlo 139 70 (45%) 67 (96%) ? 40 (60%) ESCs (média) 198 107 (54%) 100 (93%) ? 19 (19%) Criopreservação 37 19 (51%) 15 (79%) ? 2 (13%) Hikabe et al. 2016 Controlo ? ? ? ? (62%) 22,2% Aneuploidias 96,5% gestações pré-termo ESCs 923 ? (60%) 316 11 (3,5%) iPSCs ? ? ? ? 8 (?%)
X.
Bibliografia
1. Zegers-Hochschild, F., Adamson, G.D., de Mouzon, J., Ishihara, O., Mansour, R., Nygren, K., et al. (2009) International Committee for Monitoring Assisted Reproductive Technology (ICMART) and the World Health Organization (WHO) revised glossary of ART terminology, 2009∗. Fertility and Sterility, 92, 1520–1524. http://www.ncbi.nlm.nih.gov/pubmed/19828144 (19 April 2018).
2. Mascarenhas, M.N., Flaxman, S.R., Boerma, T., Vanderpoel, S. and Stevens, G.A. (2012) National, Regional, and Global Trends in Infertility Prevalence Since 1990: A Systematic Analysis of 277 Health Surveys. PLoS Medicine, 9, e1001356. http://dx.plos.org/10.1371/journal.pmed.1001356 (19 April 2018).
3. Fattahi, A., Latifi, Z., Ghasemnejad, T., Nejabati, H.R. and Nouri, M. (2017) Insights into in vitro spermatogenesis in mammals: Past, present, future. Molecular
Reproduction and Development, 84, 560–575.
http://www.ncbi.nlm.nih.gov/pubmed/28436137 (22 January 2018).
4. World Health Organization. (2010) WHO laboratory manual for the examination and
processing of human semen. World Health Organization.
http://apps.who.int/iris/bitstream/handle/10665/44261/9789241547789_eng.pdf?seq uence=1 (19 April 2018).
5. Boivin, J., Bunting, L., Collins, J.A. and Nygren, K.G. (2007) International estimates of infertility prevalence and treatment-seeking: potential need and demand for infertility
medical care. Human Reproduction, 22, 1506–1512.
http://academic.oup.com/humrep/article/22/6/1506/609340/International-estimates-of-infertility-prevalence (19 April 2018).
6. Adamson, G.D. (2014) International Perspective on IVF. In Annual Meeting and Educational Conference Oral Abstract. International Committee Monitoring ART. 7. Vanni, V.S., Viganò, P., Papaleo, E., Mangili, G., Candiani, M. and Giorgione, V. (2017)
Advances in improving fertility in women through stem cell-based clinical platforms.
Expert Opinion on Biological Therapy, 17, 585–593.
http://www.ncbi.nlm.nih.gov/pubmed/28351161 (22 January 2018).
8. Ghasemzadeh-Hasankolaei, M., Eslaminejad, M.B. and Ghasemzadeh-Hasankolaei, M. (2017) Functional Germ Cells From Non-Testicular Adult Stem Cells: A Dream or
http://www.eurekaselect.com/156876/article (21 January 2018).
9. Mishra, S., Kacin, E., Stamatiadis, P., Franck, S., Van der Jeught, M., Mertes, H., et al. (2018) The role of the reprogramming method and pluripotency state in gamete differentiation from patient-specific human pluripotent stem cells. MHR: Basic
science of reproductive medicine, 24, 173–184.
http://www.ncbi.nlm.nih.gov/pubmed/29471503 (1 June 2018).
10. Khanlarkhani, N., Baazm, M., Mohammadzadeh, F., Najafi, A., Mehdinejadiani, S. and Sobhani, A. Multipotent Stem Cell and Reproduction. Journal of stem cells, 11, 219– 229. http://www.ncbi.nlm.nih.gov/pubmed/28296874 (5 May 2018).
11. Bethesda, MD: National Institutes of Health, U.S.D. of H. and H.S. (2016) NIH Stem
Cell Information Home Page. Stem Cell Information, 2016.
https://stemcells.nih.gov/info/basics/1.htm (23 April 2018).
12. Mouka, A., Tachdjian, G., Dupont, J., Drévillon, L. and Tosca, L. (2016) In Vitro Gamete Differentiation from Pluripotent Stem Cells as a Promising Therapy for
Infertility. Stem Cells and Development, 25, 509–521.
http://www.ncbi.nlm.nih.gov/pubmed/26873432 (5 May 2018).
13. Sobhani, A., Khanlarkhani, N., Baazm, M., Mohammadzadeh, F., Najafi, A., Mehdinejadiani, S., et al. (2017) Multipotent Stem Cell and Current Application. Acta
medica Iranica, 55, 6–23. http://www.ncbi.nlm.nih.gov/pubmed/28188938 (30 May
2018).
14. Fang, F., Li, Z., Zhao, Q., Li, H. and Xiong, C. (2018) Human induced pluripotent stem cells and male infertility: an overview of current progress and perspectives. Human
Reproduction, 33, 188–195.
https://academic.oup.com/humrep/article/33/2/188/4791141 (1 May 2018).
15. Takahashi, K. and Yamanaka, S. (2006) Induction of Pluripotent Stem Cells from Mouse Embryonic and Adult Fibroblast Cultures by Defined Factors. Cell, 126, 663– 676. http://www.ncbi.nlm.nih.gov/pubmed/16904174 (11 April 2018).
16. Takahashi, K., Tanabe, K., Ohnuki, M., Narita, M., Ichisaka, T., Tomoda, K., et al. (2007) Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors. Cell, 131, 861–872. http://www.ncbi.nlm.nih.gov/pubmed/18035408 (20 April 2018).
17. Main, H., Munsie, M. and Clark, A. (2017) Reproduction and Fertility: How could stem cells help? | Eurostemcell. 2017. https://www.eurostemcell.org/reproduction-and-fertility-how-could-stem-cells-help (1 June 2018).
18. Staerk, J., Dawlaty, M.M., Gao, Q., Maetzel, D., Hanna, J., Sommer, C.A., et al. (2010) Reprogramming of human peripheral blood cells to induced pluripotent stem cells.
Cell stem cell, 7, 20–4. http://www.ncbi.nlm.nih.gov/pubmed/20621045 (20 April
2018).
19. Aasen, T., Raya, A., Barrero, M.J., Garreta, E., Consiglio, A., Gonzalez, F., et al. (2008) Efficient and rapid generation of induced pluripotent stem cells from human
keratinocytes. Nature Biotechnology, 26, 1276–1284.
http://www.nature.com/articles/nbt.1503 (20 April 2018).
20. Zhou, T., Benda, C., Duzinger, S., Huang, Y., Li, X., Li, Y., et al. (2011) Generation of induced pluripotent stem cells from urine. Journal of the American Society of
Nephrology : JASN, 22, 1221–8. http://www.ncbi.nlm.nih.gov/pubmed/21636641 (20
April 2018).
21. Jouannet, P. (2009) [Evolution of assisted reproductive technologies]. Bulletin de
l’Academie nationale de medecine, 193, 573–82.
http://www.ncbi.nlm.nih.gov/pubmed/19883012 (25 April 2018).
22. Ishii, T. (2014) Human iPS Cell-Derived Germ Cells: Current Status and Clinical
Potential. Journal of clinical medicine, 3, 1064–83.
http://www.ncbi.nlm.nih.gov/pubmed/26237592 (1 May 2018).
23. Hendriks, S., Dancet, E.A.F., van Pelt, A.M.M., Hamer, G. and Repping, S. (2015) Artificial gametes: a systematic review of biological progress towards clinical
application. Human Reproduction Update, 21, 285–296.
http://academic.oup.com/humupd/article/21/3/285/676033/Artificial-gametes-a-systematic-review-of (1 May 2018).
24. Ilic, D., Ogilvie, C., Noli, L., Kolundzic, N. and Khalaf, Y. (2017) Human embryos from induced pluripotent stem cell-derived gametes: ethical and quality
considerations. Regenerative Medicine, 12, 681–691.
http://www.futuremedicine.com/doi/10.2217/rme-2017-0052 (22 January 2018). 25. Rombaut, C., Mertes, H., Heindryckx, B. and Goossens, E. (2017) Human in vitro
spermatogenesis from pluripotent stem cells: in need of a stepwise differentiation protocol? MHR: Basic science of reproductive medicine, December 13, 2017:
10.1093/molehr/gax065.
http://academic.oup.com/molehr/advance-article/doi/10.1093/molehr/gax065/4735140 (21 January 2018).
26. Kurimoto, K. and Saitou, M. (2015) Mechanism and Reconstitution In Vitro of Germ Cell Development in Mammals. Cold Spring Harbor symposia on quantitative
biology, 80, 147–54. http://www.ncbi.nlm.nih.gov/pubmed/26642855 (25 April
2018).
27. Smajdor, A., Cutas, D. and Takala, T. (2018) Artificial gametes, the unnatural and the
artefactual. Journal of medical ethics, 44, 404–408.
http://www.ncbi.nlm.nih.gov/pubmed/29507052 (29 May 2018).
28. Hendriks, S., Dancet, E.A.F., van Pelt, A.M.M., Hamer, G. and Repping, S. (2015) Artificial gametes: a systematic review of biological progress towards clinical
application. Human Reproduction Update, 21, 285–296.
http://academic.oup.com/humupd/article/21/3/285/676033/Artificial-gametes-a-systematic-review-of (29 May 2018).
29. Advena-Regnery, B., Dederer, H., Enghofer, F., Cantz, T. and Heinemann, T. Framing the ethical and legal issues of human artificial gametes in research, therapy, and assisted reproduction: A German perspective. Bioethics, 32, 314–326. https://onlinelibrary.wiley.com/doi/full/10.1111/bioe.12433 (30 May 2018).
30. Segers, S., Mertes, H., Pennings, G., de Wert, G. and Dondorp, W. (2017) Using stem cell-derived gametes for same-sex reproduction: an alternative scenario. Journal of
Medical Ethics, 43, 688–691. http://www.ncbi.nlm.nih.gov/pubmed/28122990 (4
May 2018).
31. Segers, S., Mertes, H., de Wert, G., Dondorp, W. and Pennings, G. (2017) Balancing Ethical Pros and Cons of Stem Cell Derived Gametes. Annals of Biomedical
Engineering, 45, 1620–1632. http://www.ncbi.nlm.nih.gov/pubmed/28091967 (22
January 2018).
32. Carbone, J. (2016) Peer commentary: in vitro gametogenesis: just another way to have
a baby. Journal of law and the biosciences, 3, 673–679.
http://www.ncbi.nlm.nih.gov/pubmed/28852547 (21 January 2018).
33. Suter, S.M. (2016) In vitro gametogenesis: just another way to have a baby? Journal of
law and the biosciences, 3, 87–119. http://www.ncbi.nlm.nih.gov/pubmed/27774234
(22 January 2018).
34. Bredenoord, A.L. and Hyun, I. (2017) Ethics of stem cell-derived gametes made in a dish: fertility for everyone? EMBO molecular medicine, 9, 396–398. http://www.ncbi.nlm.nih.gov/pubmed/28279974 (1 June 2018).
35. Bourne, H., Douglas, T. and Savulescu, J. (2012) Procreative beneficence and in vitro
gametogenesis. Monash bioethics review, 30, 29–48.
36. Hubner, K., Fuhrmann, G., Christenson, L.K., Kehler, J., Reinbold, R., De La Fuente, R., et al. (2003) Derivation of Oocytes from Mouse Embryonic Stem Cells. Science, 300, 1251–1256. http://www.ncbi.nlm.nih.gov/pubmed/12730498 (29 May 2018). 37. Saitou, M. and Miyauchi, H. (2016) Gametogenesis from Pluripotent Stem Cells. Cell
Stem Cell, 18, 721–735. http://www.ncbi.nlm.nih.gov/pubmed/27257761 (22 January
2018).
38. Nayernia, K., Nolte, J., Michelmann, H.W., Lee, J.H., Rathsack, K., Drusenheimer, N., et al. (2006) In Vitro-Differentiated Embryonic Stem Cells Give Rise to Male Gametes that Can Generate Offspring Mice. Developmental Cell, 11, 125–132. http://www.ncbi.nlm.nih.gov/pubmed/16824959 (1 June 2018).
39. Hayashi, K., Ohta, H., Kurimoto, K., Aramaki, S. and Saitou, M. (2011) Reconstitution of the mouse germ cell specification pathway in culture by pluripotent stem cells. Cell, 146, 519–32. http://www.ncbi.nlm.nih.gov/pubmed/21820164 (11 April 2018). 40. Hayashi, K., Ogushi, S., Kurimoto, K., Shimamoto, S., Ohta, H. and Saitou, M. (2012)
Offspring from oocytes derived from in vitro primordial germ cell-like cells in mice.
Science (New York, N.Y.), 338, 971–5.
http://www.ncbi.nlm.nih.gov/pubmed/23042295 (30 April 2018).
41. Hayashi, K. and Saitou, M. (2013) Generation of eggs from mouse embryonic stem cells and induced pluripotent stem cells. Nature Protocols, 8, 1513–1524. http://www.nature.com/doifinder/10.1038/nprot.2013.090 (11 April 2018).
42. Zhou, Q., Wang, M., Yuan, Y., Wang, X., Fu, R., Wan, H., et al. (2016) Complete Meiosis from Embryonic Stem Cell-Derived Germ Cells In Vitro. Cell Stem Cell, 18, 330–340. http://www.ncbi.nlm.nih.gov/pubmed/26923202 (22 January 2018).
43. Morohaku, K., Tanimoto, R., Sasaki, K., Kawahara-Miki, R., Kono, T., Hayashi, K., et al. (2016) Complete in vitro generation of fertile oocytes from mouse primordial germ cells. Proceedings of the National Academy of Sciences of the United States of
America, 113, 9021–6. http://www.ncbi.nlm.nih.gov/pubmed/27457928 (22 January
2018).
44. Hikabe, O., Hamazaki, N., Nagamatsu, G., Obata, Y., Hirao, Y., Hamada, N., et al. (2016) Reconstitution in vitro of the entire cycle of the mouse female germ line.
Nature, 539, 299–303. http://www.ncbi.nlm.nih.gov/pubmed/27750280 (22 January
2018).
45. Hayashi, K., Hikabe, O., Obata, Y. and Hirao, Y. (2017) Reconstitution of mouse oogenesis in a dish from pluripotent stem cells. Nature Protocols, 12, 1733–1744.