Exposição de felídeos selvagens a agentes
infecciosos selecionados
Exposição de felídeos selvagens a agentes
infecciosos selecionados
Tese apresentada ao Programa de Pós-graduação em Patologia Experimental e Comparada da Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo para obtenção do título de Doutor em Ciências
Departamento:
Patologia
Área de concentração:
Patologia Experimental e Comparada
Orientador:
Prof. Dr. José Luiz Catão-Dias
DADOS INTERNACIONAIS DE CATALOGAÇÃO-NA-PUBLICAÇÃO
(Biblioteca Virginie Buff D’Ápice da Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo)
T.1729 Filoni, Claudia
FMVZ Exposição de felídeos selvagens a agentes infecciosos selecionados / Claudia Filoni. – São Paulo: C. Filoni, 2006.
126 f. : il.
Tese (doutorado) - Universidade de São Paulo. Faculdade de Medicina Veterinária e Zootecnia. Departamento de Patologia, 2006.
Programa de Pós-graduação: Patologia Experimental e Comparada. Área de concentração: Patologia Experimental e Comparada. Orientador: Prof. Dr. José Luiz Catão-Dias.
Nome: FILONI, Claudia
Título: Exposição de felídeos selvagens a agentes infecciosos selecionados
Tese apresentada ao Programa de Pós-graduação em Patologia Experimental e Comparada da Faculdade de Medicina Veterinária e Zootecnia da Universidade de São Paulo para obtenção do título de Doutor em Ciências
Data: ___/___/_____
Banca Examinadora
Prof. Dr. ______________________________ Assinatura: ____________________________
Instituição: _______________________ Julgamento: ______________________
Prof. Dr. ______________________________ Assinatura: ____________________________
Instituição: _______________________ Julgamento: ______________________
Prof. Dr. ______________________________ Assinatura: ____________________________
Instituição: _______________________ Julgamento: ______________________
Prof. Dr. ______________________________ Assinatura: ____________________________
Instituição: _______________________ Julgamento: ______________________
Prof. Dr. ______________________________ Assinatura: ____________________________
Marcela, de seis anos
- ao Prof. Catão, não apenas como Diretor Técnico-Científico da FPZSP e pelo livre acesso
à sua sala na FMVZ-USP durante todo o período do doutorado mas, principalmente, por
sua orientação serena e competente que me descortinou o mundo científico e que me iniciou
na arte de escrever cientificamente, pelo que sou profundamente grata;
- à Regina Hofmann-Lehmann e Hans Lutz que se interessaram pelo projeto, confiaram em
mim e não mediram esforços para que todos os complexos trâmites referentes à minha viagem
e ao transporte das amostras à Vetsuisse Faculty, University of Zurich se efetivassem;
-
à minha mãe Maria Fernanda, meu pai Luiz Carlos e minha avó Anna que também não
mediram esforços para que eu dispusesse de tempo e dos mínimos recursos para trabalhar
Registrar agradecimentos a todas as pessoas que colaboraram na execução de um
trabalho de quatro anos é uma tarefa gratificante, mas essencialmente propensa a omissões
involuntárias, pois foram muitas as pessoas e instituições com quem travei contato neste
período, muitas das quais também têm o objetivo de contribuir para o processo
conservacionista. Assim, correndo o risco de omitir alguém que deveria figurar nesta lista,
agradeço:
- a todos que foram muito solícitos na Fundação Parque Zoológico de São Paulo (FPZSP),
como Dr. Paulo Magalhães Bressan, Dr. João Batista Cruz, Maria José Caldeirane , José
Daniel Luzes Fedullo, Sandra Helena Ramiro Corrêa, Rodrigo Hidalgo Friciello Teixeira
(atualmente de volta ao Zôo de Sorocaba), Ariela Priscila Setzer, Mara Cristina Marques,
Kátia Cassaro, Denise Martins Sanches e Haroldo Soares Barbosa;
- todos os que conheci em com quem trabalhei no Clinical Laboratory, Vetsuisse Faculty,
University of Zurich, como Gert Bay, Valentino Cattori, Marina Meli, Ravi Tandon,
Yousef Ahmed, Maria Alice Gomes-Keller, E. Gönczi, T. Meili Prodan, Elisabeth e Edith,
pela amizade e pela excelente assistência técnica.
- o CENAP–IBAMA e a todos os pesquisadores que colheram e depositaram as amostras
utilizadas em seus projetos de campo por todo o País. Em especial, Rose Lilian Gasparini
Morato e Otávio Borges Maia pela pronta disposição em ajudar na condução de todas as
licenças internacionais requeridas, Ronaldo Gonçalves Morato, Rogério Cunha de Paula e
Rodrigo Silva Pinto Jorge pelo auxílio e prontidão em providenciar amostras de material de
disponibilidade em fornecer as informações requeridas sobre as amostras e confiança dada
para a execução deste projeto;
- o Prof. Edison Luiz Durigon que permitiu a utilização de seu laboratório e materiais para
o processamento de amostras durante os dois anos iniciais do projeto e continua
mostrando-se disposto a apoiar novas pesquisas na área;
- o Prof. Dr. Jean Carlos Ramos Silva, Maria Fernanda Vianna Marvulo, caros amigos e
Prof. Dr. José Soares Neto pela concordância na utilização de parte das amostras de
felídeos selvagens mantidos em cativeiro no Brasil colhidas previamente em seus trabalhos;
- as instituições Coordenação de Aperfeiçoamento de Pessoal de Nível Superior – CAPES,
Pró-Reitoria de Pós-Graduação da Universidade de São Paulo e ao International Relations
Office, University of Zurich, Switzerland.
- as pessoas vinculadas à FMVZ-USP pelo seu apoio, como minha querida amiga agora
recém Profa. Dra. Lílian Rose Marques de Sá, tão perspicaz, lúcida e prestativa em suas
muitas sugestões; o Prof. Dr. Marcelo Alcindo B. V. Guimarães pelas nossas conversas na
lanchonete e nas filas do cafezinho nos eventos da Faculdade, onde já tivemos boas idéias
que gostaríamos de concretizar; Sandra Freiberger Affonso pela amizade desde nosso
ingresso no Programa de Doutorado, em que sempre compartilhamos dificuldades nas nossas
pesquisas; o Prof. Dr. Arthur Gruber, sincero e atencioso quando procurado por mim para
solicitação de opiniões sobre minha pesquisa; Silvia Sochiarelli, Dayse M. A. Flexa e
Cláudia Lima pela ajuda nos trâmites burocráticos da Pós-Graduação; Elza M. R. B.
Faquim, Maria Inês Chiarelli de Camargo e Elena A. Tanganini pelo auxílio na recuperação
de informação bibliográfica e disposição do trabalho dentro das diretrizes adotadas pela
concluírem seus trabalhos acadêmicos;
- o amigo Carlos Yamashita pelas muitas digressões sobre evolução;
- a caríssima amiga de infância, a policial militar Célia Regina Modollo Custódio pelo
auxílio e incentivo na época de conclusão desta tese;
- o Jeep Clube do Brasil, por ter disponibilizado as instalações de sua sede rural para a
A história chegou tarde a praticamente todos os encontros entre o homem e a
vida selvagem. Quando Colombo fez a primeira vistoria da costa antilhana, mais de dez mil
anos de ocupaçào humana já a haviam transformado de maneira incomensurável até para os
mais dedicados esforços arqueológicos. Apesar disso, de todos os continentes tropicais, a
América do Sul foi o último a ser invadido pelo homem, e o domínio humano de suas
florestas foi muito menos intenso e duradouro que o da Ásia, África e Austrália. Por isso, os
europeus em seu Novo Mundo encontraram uma natureza mais pura que a de outros pontos
dos trópicos e, assim, uma parte muito maior do processo de degradação ocorreu em uma era
de registros escritos. A América do Sul é, portanto, o campo de batalha mais recente para o
historiador florestal, no qual todos os que tombaram ainda jazem insepultos e os vencedores
ainda vagueiam por toda parte, saquando e incendiando o entulho.
A história florestal corretamente entendida é, em todo o planeta, uma história
de exploraçào e destruição. O homem reduz o mundo natural a entornos domesticados,
aparados e moldados para se adequarem a algum uso prático ou à estética convencional (...).
As intervençòes humanas quase nunca realizam as expectativas humanas. Seus campos se
empobrecem, seus pastos se tornam magros e lenhosos, suas cidades entram em colapso. O
mundo natural, simplificado, em desacordo, com os desejos humanos, mas em resposta a seus
atos, converte-se em uma enorme macega cosmopolita de luto. (...)
A preservação de florestas deve (...) basear-se em algo além do argumento do
auto-interesse cultural, ambiental ou econômico; talvez em uma concepção de interesse que
apenas se poderia definir por um autoconhecimento mais perspicaz e uma compreensão mais
profunda e filosófica do mundo natural. Muitos prevêem, com mal-estar, a iminente
extinção das florestas tropicais do planeta.
racistas violam o princípio de igualdade quando, ao surgir um conflito entre seus interesses e
os dos representantes de uma outra raça, atribuem mais peso aos interesses dos
representantes da própria raça. Os sexistas violam o princípio de igualdade ao privilegiar os
interesses de pessoas do mesmo sexo que eles. Da mesma forma, os especistas permitem que os
interesses de sua própria espécie sobrepujem os maiores interesses dos membros de outras
espécies. Nos três casos, trata-se do mesmo tipo de comportamento.
Paul Singer
Enquanto o programa dos ecologistas profundos assenta por inteiro na rejeição do
antropocentrismo cartesiano ou utilitarista em nome dos direitos da ecosfera, a lógica de sua
própria postura leva-os a recair numa das mais extravagantes formas de antropomorfismo
(...) Não são eles mesmos antropocentristas quando pretendem saber qual é o melhor para o
meio ambiente natural? Ao imaginarem que o bem está inscrito no ser das coisas, eles
acabam esquecendo que toda valorização , inclusive a da natureza, é obra dos homens, e que,
por conseguinte, toda ética normativa é, de algum modo, humanista e antropocentrista. (...)
O projeto de uma ética normativa anti-humanista é uma contradição em si. (...) Quereriam
conservar a idéia de valor e suprimir suas condições de possibilidade: esquecem, de passagem,
que são eles, enquanto seres humanos, quem valoriza a natureza e não o inverso, que é
impossível fazer abstração deste momento subjetivo ou humanista para projetar no próprio
universo um “valor intrínseco” qualquer. (...) É nessa operação pela qual pretende abstrair a
subjetividade que a filosofia da natureza cede às ilusões do antropomorfismo. (...)
FILONI, C. Exposição de felídeos selvagens a agentes infecciosos selecionados. [ Exposure of wild felids to selected infectious agents]. 2006. 127 f. Tese (Doutorado em Ciências) – Faculdade de Medicina Veterinária e Zootecnia, Universidade de São Paulo, São Paulo, 2006.
Este estudo avaliou a exposição de 12 espécies de felídeos selvagens de vida livre (n=22) e mantidas em cativeiro (n=210) no Brasil a 16 agentes potencialmente patogênicos para membros da família Felidae, como herpesvírus felino 1 (FHV 1), calicivírus felino (FCV), parvovírus felino (FPV), coronavírus felino (FCoV), vírus da leucemia felina (FeLV), vírus da imunodeficiência felina (FIV), lentivírus de puma (PLV), vírus da cinomose canina (CDV), Bartonella henselae, Ehrlichia canis, Anaplasma phagocytophilum, Mycoplasma haemofelis, ‘Candidatus Mycoplasma haemominutum’, Candidatus Mycoplasma turicensis’, Theileria sp e Cytauxzoonsp, através do emprego de IFA, Western blot, ELISA e TaqMan® PCR e RT-PCR em amostras de soro, sangue, fezes e suabes orais, conforme as amostras disponíveis para cada animal. A detecção direta de patógenos ou de anticorpos demonstrou que populações de felídeos selvagens no Brasil estão expostas pelo menos ao FHV 1, FCV, FPV, FCoV, FeLV e lentivírus felinos, Bartonella henselae, Ehrlichia canis, Mycoplasma haemofelis, ‘Candidatus Mycoplasma haemominutum’ e Cytauxzoon sp, ou agentes relacionados, quais provavelmente contribuem em quadros não diagnosticados de morbidade e/ou mortalidade das populações de felídeos selvagens no País. A presença de patógenos comuns de carnívoros domésticos em felídeos selvagens aponta para a necessidade de cuidadoso monitoramento destas infecções através de uma abordagem integrada e multidisciplinar.
FILONI, C. Exposure of wild felids to selected infectious agents. [Exposição de felídeos selvagens a agentes infecciosos selecionados]. 2006. 127 f. Tese (Doutorado em Ciências) – Faculdade de Medicina Veterinária e Zootecnia, Universidade de São Paulo, São Paulo, 2006.
This study evaluated exposure of 12 nondomestic felid species, both free-ranging (n=22) and captive (n=210) in Brazil to 16 potential pathogenic agents for members of Felid family, as feline herpesvirus 1 (FHV 1), feline calicivirus (FCV), feline parvovirus (FPV), feline coronavirus (FCoV), feline leukemia virus (FeLV), feline immunodeficiency virus (FIV), puma lentivirus (PLV), canine distemper virus (CDV), Bartonella henselae, Ehrlichia canis, Anaplasma phagocytophilum, Mycoplasma haemofelis, ‘Candidatus Mycoplasma
haemominutum’, CandidatusMycoplasma turicensis’, Theileria sp, and Cytauxzoonsp, using IFA, Western blot, ELISA, and TaqMan® PCR and RT-PCR in serum, blood, feces and oral swabs, according to available samples for each animal. The antibody or agents detection demonstrated that Brazilian wild felid populations are exposed to at least FHV 1, FCV, FPV, FCoV, FeLV, puma lentivirus (PLV), Bartonella henselae, Ehrlichia canis, Mycoplasma haemofelis, ‘Candidatus Mycoplasma haemominutum’, and Cytauxzoon sp, related agents, which probably contribute to undiagnosed morbidity and/or mortality scenarios for the Brazilian populations of wild felids. The presence of common domestic carnivore pathogens in wild felids address the need of close monitoring of such infections throughout an integrative and multidisciplinary approach.
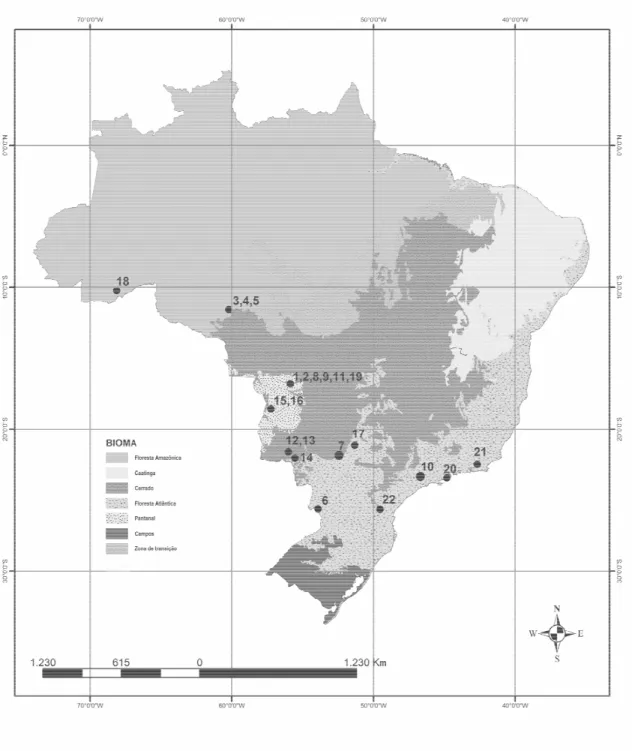
Figura 1 - Mapa mostrando as áreas geográficas no Brasil em que as amostras dos 22 felídeos de vida livre foram colhidas. São Paulo, 2004... 47
Figura 2 - As amostras de ácidos nucléicos (DNA e TNA) dos felídeos de cativeiro foram agrupadas utilizando um equipamento robotizado MagNAPure LC (Roche, Rotkreuz, Suíça) de acordo com os esquemas de pipetagem explicitados nas figuras 2a e 2b para realização dos testes conforme demonstrado na figura 2c. São Paulo, 2004... 57
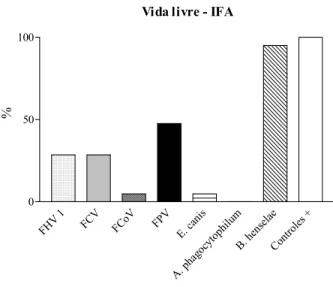
Figura 3 - Representação gráfica do percentual em que foram detectados anticorpos para FHV 1 (28,57%), FCV (28,57%), FCoV (4,76%), Ehrlichia canis (4,76%), Anaplasma phagocytophilum (0) e Bartonella henselae (95,0%),através de testes de imunofluorescência indireta (IFA), nas 21 amostras de soro provenientes de felídeos de vida livre no Brasil. São Paulo, 2004... 61
Figura 4 - Representação gráfica do percentual em que foram detectados anticorpos para FHV 1 (19,04%), FCV (50,79%), FCoV (64,59%), FPV (69,84%), Ehrlichia canis (0,47%) e Bartonella henselae (48,29%), através de testes de imunofluorescência indireta (IFA), nas amostras de soro provenientes de felídeos mantidos em cativeiro no Brasil, tomadas em conjunto. São Paulo, 2004... 61
Figura 5 - Representação gráfica do percentual em que foram detectados anticorpos para FCoV (72,10%), Ehrlichia canis (0) e Bartonella henselae(48,29%), através de testes de imunofluorescência indireta (IFA), nas 147 amostras de soro provenientes de felídeos mantidos na Fundação Parque Zoológico de São Paulo (FPZSP). Também estão representados os resultados para o espécime de Oncifelis colocolo, CAD 28505, que ainda não havia sido vacinado por ocasião da colheita de material, o qual também se apresentou soronegativo para FHV 1, FCV e FPV. São Paulo, 2004... 62
Quadro - 1 Testes realizados para 11 patógenos em amostras de material biológico dos felídeos de vida livre. São Paulo, 2004... 48
Quadro 2 - Testes realizados para 14 patógenos em amostras de material biológico dos felídeos mantidos na Fundação Parque Zoológico de São Paulo (FPZSP). São Paulo, 2004... 49
Quadro 3 – Testes realizados para seis patógenos em amostras de material biológico dos felídeos mantidos em cativeiro cedidas pela Associação Mata Ciliar (AMC). São Paulo, 2004... 50
Tabela - 1 Número amostral e instituições cedentes de amostras de felídeos selvagens mantidos em cativeiro e de vida livre. São Paulo, 2004... 46
Tabela 2 - Resultados dos testes sorológicos realizados para as amostras de felídeos de vida livre, distribuídos em função dos métodos empregados e dos patógenos pesquisados. São Paulo, 2004... 59
Tabela 3 – Resultados dos testes sorológicos realizados nas amostras provenientes dos felídeos da Fundação Parque Zoológico de São Paulo (FPZSP), distribuídos em função dos métodos empregados e dos patógenos pesquisados. São Paulo, 2004... 59
Tabela 4 – Resultados dos testes sorológicos realizados nas amostras de felídeos cedidas pela Associação Mata Ciliar (AMC), distribuídos em função dos métodos empregados e dos patógenos pesquisados. São Paulo, 2004... 60
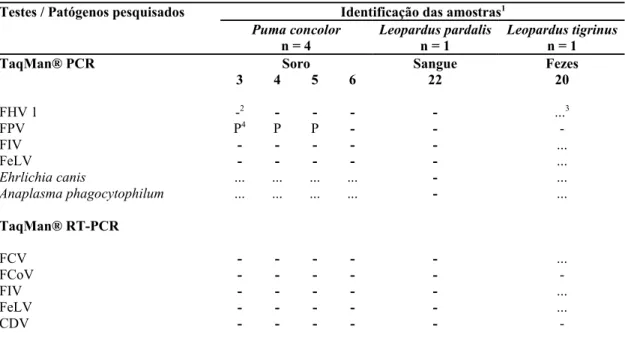
Tabela 5 – Resultados dos testes TaqMan® PCR e RT-PCR realizados para seis amostras de felídeos de vida livre, distribuídos em função das amostras utilizadas e dos patógenos pesquisados. São Paulo, 2004... 60
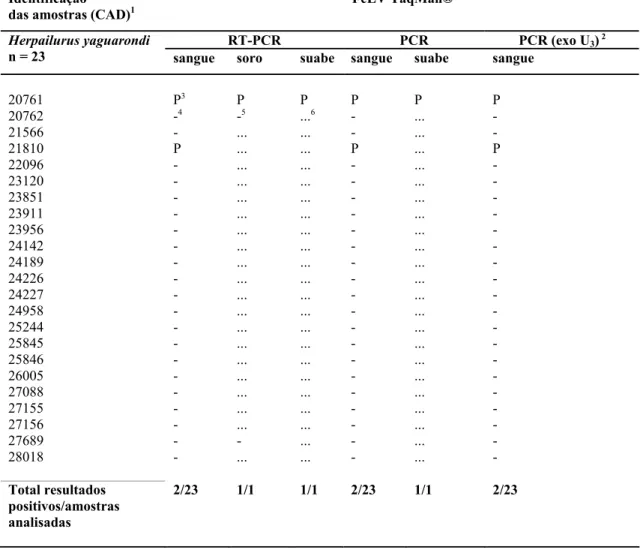
Tabela 6 - Resultados dos testes TaqMan® PCR e RT-PCR para FeLV nos jaguarundis(Herpailurus yaguarondi) mantidos na Fundação Parque Zoológico de São Paulo (FPZSP), distribuídos em função das provas efetuadas e das amostras utilizadas. São Paulo, 2004... 63
Instituições e organizações
AMC Associação Mata Ciliar
CENAP Centro Nacional de Pesquisas para Conservação de Predadores Naturais CGEN Conselho de Gestão do Patrimônio Genético
CITES Convention on International Trade in Endangered Species - Convenção sobre o Comércio Internacional de Espécies da Flora e Fauna Selvagens em Perigo de Extinção
FMVZ Faculdade de Medicina Veterinária e Zootecnia FPZSP Fundação Parque Zoológico de São Paulo
IATA International Air Transport Association – Associação Internacional de Transporte Aéreo
PI 650 diagnostic specimen – amostra diagnóstica
IBAMA Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis IUCN International Union for the Conservation of Nature – União Internacional
para a Conservação da Natureza LAPCOM Laboratório de Patologia Comparada ONG organização não-governamental SZB Sociedade de Zoológicos do Brasil USP Universidade de São Paulo
VPT Departamento de Patologia
Agentes patogênicos, amostras, unidades de medida e outras substâncias empregadas nos testes diagnósticos
µl microlitro
16S subunidade de RNA
CAD número de cadastro individual dos animais na FPZSP CDV canine distemper virus - vírus da cinomose canina
CrFK crandell feline kidney cells - células de rim felino de Crandell DNA ácido desoxirribonucléico
EDTA ácido dietilenodiaminotetracético ELISA enzyme linked immunosorbent assay
FCoV feline coronavirus – coronavírus felino FCV feline calicivirus – calicivírus felino
FeLV feline leukemia virus – vírus da leucemia felina FHV 1 feline herpesvirus 1 – herpesvírus felino 1 FITC isotiocianato de fluoresceína
FIV feline immunodeficiency virus – vírus da imunodeficiência felina FPV feline parvovirus – parvovírus felino
gp70 glicoproteína de peso molecular 70 IFA imunofluorescência indireta IM intramuscular
p15 proteína de peso molecular 15 p24 proteína de peso molecular 24 p27 proteína de peso molecular 27 p58 proteína de peso molecular 58
PBS phosphate buffered saline solution - solução salina fosfatada tamponada
PCR polymerase chain reaction - reação de polimerização em cadeia FECV coronavírus entérico felino
FIPV vírus da peritonite infecciosa felina PIF peritonite infecciosa felina
PLV puma lentivirus – lentivírus de puma RNA ribonucleic acid - ácido ribonucléico
rRNA ribossomic ribonucleic acid - ácido ribonucléico ribossômico RT-PCR reverse transcriptase polymerase chain raction – reação de
polimerização em cadeia submetida à ação da transcriptase reversa SB studbook – registro individual internacional
TGEV transmissible gastroenteritis virus -vírus da gastroenterite transmissível TNA total nucleic acids - ácidos nucléicos totais
PD - 5 linhagem de células de rim suíno
G gammaglobulin - imunoglobulina tipo gama
H+L high – pesada e light - leve
Unidades da Federação Brasileira e outras unidades geopolíticas
AC Acre AM Amazonas
CA California - Califórnia
DF Distrito Federal EUA Estados Unidos da América GO Goiás
MG Minas Gerais MS Mato Grosso do Sul MT Mato Grosso PA Pará
PE Pernambuco PR Paraná RJ Rio de Janeiro RO Rondônia RS Rio Grande do Sul
SC Santa Catarina SP São Paulo
UK United Kingdom - Reino Unido
°C graus Celsius ® marca registrada
™ Trade mark
Os ideais que embasaram esta tese foram constituídos nas últimas décadas do século
XX, enquanto as questões ligadas à conservação da natureza tomavam vulto. Entretanto, o
século XXI se iniciou gerando um grande ceticismo de que a natureza viesse a ser mais
respeitada e admirada que meramente espoliada.
Agravaram-se a devastação, o descaso e a displicência dispensados à natureza.
Aqueles que dirigem países ainda não investem ou pensam em sustentabilidade
sócio-ambiental, mas concordam em modificar cruelmente os ambientes naturais em nome de
interesses econômicos progressistas, acreditam erroneamente que a melhora da qualidade de
vida humana está ligada à exploração ilimitada dos chamados recursos naturais, não
enxergam os problemas ligados ao crescimento urbano, e sequer se incomodam com o ritmo
de destruição dos ecossistemas e do cerceamento de todas as áreas selvagens da Terra.
Quisera a sobrevivência humana viesse a ser pautada pela lógica da sustentabilidade
planetária, e não mais pela arbitrariedade econômica. Que os custos ambientais estivessem
sempre presentes nas transações comerciais. Que a humanidade, que foi capaz de realizar
um salto tecnológico tão significativo em tão poucas décadas, quiçá fosse também capaz de
voltar seu olhar para os demais componentes da natureza, ou, pelo menos, olhar para si
mesma a longo prazo.
Apesar deste panorama, existem pessoas dispostas a trabalhar em prol da
conservação, como muitas daquelas que auxiliaram na execução deste projeto. Assim,
acredito que este trabalho seja útil e interessante aos profissionais veterinários e de áreas
afins que se interessam pela metodologia técnico-científica empregada e pela problemática
que envolve a questão da preservação e conservação dos felídeos selvagens em seu meio
1 INTRODUÇÃO... 22
2 OBJETIVOS... 24 2.1 OBJETIVOS GERAIS... 24
2.2 OBJETIVOS ESPECÍFICOS... 24
2 REVISÃO DE LITERATURA... 26 2.1 A FAMÍLIA FELIDAE... 26
2.2 DOENÇAS E CONSERVAÇÃO... 27 2.3 AGENTES VIRAIS... 29
2.3.1 Herpesvírus felino 1 (FHV 1) e calicivírus felino (FCV)... 30
2.3.2 Parvovírus felino (FPV)... 32
2.3.3 Coronavírus felino (FCoV)... 33
2.3.4 Vírus da leucemia felina (FeLV), vírus da imunodeficiência felina
(FIV) e lentivírus de puma (PLV)... 34
2.3.5 Vírus da cinomose canina (CDV)... 36 2.4 AGENTES BACTERIANOS... 38
2.4.1 Bartonella henselae... 38
2.4.2 Ehrlichia canis e Anaplasma phagocytophilum... 39
2.4.3 Hemoplasmas: Mycoplasma haemofelis, ‘Candidatus Mycoplasma haemominutum’ e ‘CandidatusMycoplasma turicensis’... 40 2.5 PROTOZOÁRIOS PIROPLASMAS: Theileria sp E Cytauxzoonsp... 41 2.6 AS TÉCNICAS LABORATORIAIS... 42
3 MATERIAIS E MÉTODOS... 44 3.1 ANIMAIS E OBTENÇÃO DAS AMOSTRAS... 44
3.2 PATÓGENOS PESQUISADOS... 48 3.3 TESTES DIAGNÓSTICOS... 50
3.3.1 Testes sorológicos... 51 3.3.1.1 Reações de imunofluorescência indireta (IFA)... 51 3.3.1.1.1 Controle de qualidade das lâminas para IFA... 52 3.3.1.2 Ensaios imunoenzimáticos... 52 3.3.1.3 Western blot... 55
5.1 AMOSTRAGEM... 65 5.2 ANÁLISE DOS RESULTADOS OBTIDOS PARA FELÍDEOS DE
VIDA LIVRE... 67 5.3 ANÁLISE DOS RESULTADOS OBTIDOS PARA FELÍDEOS
MANTIDOS EM CATIVEIRO... 71 5.4 CONSIDERAÇÕES FINAIS ... 73
6 CONCLUSÕES... 76
7 REFERÊNCIAS... 78
1 INTRODUÇÃO
O estudo do papel das doenças constitui um eixo importante das estratégias para a conservação dos animais selvagens, seja em ambiente natural ou de cativeiro. Estudos ecológicos reconhecem as doenças como fatores regulatórios de populações naturais, embora os fatores envolvidos nestas cadeias regulatórias raramente sejam conhecidos. Animais mantidos em cativeiro são acometidos freqüentemente por doenças de causa nem sempre elucidada, o que geralmente requer um diagnóstico etiológico para que medidas terapêuticas e profiláticas possam ser tomadas. Finalmente, as doenças que acometem animais selvagens também podem ser causadas por agentes zoonóticos, que devem ser identificados para que medidas preventivas adequadas possam ser tomadas pelas pessoas que lidam diretamente com os animais ou amostras de seus materiais clínicos.
Considerando-se que toda a família Felidae encontra-se ameaçada (NOWEL; JACKSON, 1996), que os hábitats reduzem-se progressivamente e que há um número considerável de felídeos mantidos em cativeiro, torna-se necessário conhecimento acumulado e aplicabilidade imediata deste conhecimento para resolver questões referentes à saúde desta família de carnívoros para sua conservação. Embora já exista de fato conhecimento acumulado na literatura científica, tais dados ou relatos não são extensivos o suficiente para cobrir as diversas populações ou permitir uma correta avaliação clínica em caso de doenças. Tratados individualmente ou como populações, a abordagem clínica ou terapêutica dos animais deve se fundamentar em dados epidemiológicos e laboratoriais.
Os felídeos selvagens são animais carnívoros de topo de cadeia alimentar que em ambiente natural percorrem extensos territórios em busca de alimentação e abrigo. Conseqüentemente, estão expostos a uma ampla gama de patógenos presentes no ambiente ou provenientes de seus contactantes, sejam estes presas, outros competidores, elementos de sua própria espécie e, muito recentemente em termos biogeográficos e evolutivos, também a animais domésticos.
idades dos animais, procedências, estados clínicos e outras. Porém, a amostragem refletiu de forma consistente o universo populacional de felídeos selvagens disponível no Brasil para acesso científico.
Foram utilizadas técnicas diagnósticas baseadas em detecção indireta e direta de patógenos. Foram utilizadas técnicas indiretas sorológicas, capazes de indicar se as amostras testadas apresentavam anticorpos específicos contra substâncias antigênicas constituintes de determinados patógenos, revelando desta forma se os animais haviam sido, em algum momento de suas vidas, expostos a tais substâncias. Entre as técnicas de detecção direta, foram utilizados procedimentos sorológicos diretos, direcionados para detecção de substâncias antigênicas constituintes dos patógenos e por fim, técnicas moleculares capazes de detectar fragmentos específicos de ácidos nucléicos (DNA ou RNA) dos patógenos nas amostras.
2 OBJETIVOS
2.1 OBJETIVOS GERAIS
Constituíram objetivos gerais deste trabalho:
1) avaliar a exposição de felídeos selvagens de vida livre ou mantidos em cativeiro no Brasil, mediante técnicas diagnósticas laboratoriais adequadas, a 16 potenciais patógenos:
a) virais: herpesvírus felino 1 (FHV 1), calicivírus felino (FCV), parvovírus felino (FPV), coronavírus felino (FCoV), vírus da leucemia felina (FeLV), os seguintes lentivírus: vírus da imunodeficiência felina (FIV) e lentivírus de puma (PLV), o vírus da cinomose canina (CDV);
b) bacterianos: Bartonella henselae, Ehrlichia canis, Anaplasma phagocytophilum, os hemoplasmas Mycoplasma haemofelis, ‘Candidatus Mycoplasma haemominutum’ e ‘CandidatusMycoplasma turicensis’;
c) protozoários piroplasmas: Theileria sp e Cytauxzoonsp;
2) fornecer parâmetros para a adoção de protocolos preventivos para o manejo de felídeos selvagens no País.
2.2 OBJETIVOS ESPECÍFICOS
1) investigar se doenças infecciosas causadas pelos patógenos pesquisados podem contribuir nos quadros de morbidade e/ou mortalidade das populações de felídeos selvagens no País;
2) verificar se patógenos associados a carnívoros domésticos circulam em populações de felídeos selvagens;
3) verificar se as populações de felídeos selvagens no País representam risco para transmissão de zoonoses
2 REVISÃO DE LITERATURA
Neste capítulo, serão apresentadas a família Felidae, questões ligadas à doenças e conservação e os agentes patogênicos e princípios gerais das técnicas diagnósticas utilizadas.
2.1 A FAMÍLIA FELIDAE
A família Felidae pertence à Ordem Carnivora e seus membros apresentam entre 1,3 a mais de 300 kg de massa corporal. A taxonomia do grupo tem sido debatida, ilustrando as inconsistências filogenéticas não resolvidas sobre o aspecto evolucionário da família (NOWAK, 1999; WERDELIN, 1996). Estudos recentes utilizando análises morfológicas e moleculares esclareceram muitos aspectos dos relacionamentos evolucionários dos felídeos, mas ainda não foram incorporados em novos esquemas taxonômicos (OLIVEIRA et al., 2001). Desta forma, o esquema taxonômico proposto por Wozencraft (1993) foi considerado por Werdelin (1996) o que melhor refletia a variação entre as espécies, tendo sido adotado pela União Internacional para a Conservação da Natureza (International Union for the Conservation of Nature – IUCN) e também é adotado no presente trabalho para referir-se às
espécies de felídeos.
estas duas últimas espécies listadas não ocorrem naturalmente no Brasil. Contudo, apesar de amplamente distribuídas, todas as espécies selvagens de felídeos encontram-se em algum grau ameaçadas (NOWAK, 1999; NOWELL; JACKSON, 1996; OLIVEIRA; CASSARO, 1997) e portanto, considera-se que todas devam ser alvo de medidas conservacionistas. Entre as 37 espécies de felídeos reconhecidas, apenas para o gato doméstico (Felis catus), aspectos clínicos e padrões fisiopatológicos de doenças infecciosas são relativamente bem compreendidos. Por este motivo, o gato doméstico, que apresenta evidências de descender de uma subespécie de gato-selvagem africano e do sudoeste asiático (Felis silvestris lybica) e que posteriormente se miscigenou com o gato-selvagem europeu (Felis silvestris silvestris) (NOWAK, 1999) é utilizado como parâmetro para o estudo das enfermidades que podem acometem os membros selvagens da família.
2.2 DOENÇAS E CONSERVAÇÃO
Entre os principais fatores causais de ameaça aos felídeos de todo o mundo, estão a perda de hábitat, perseguição direta em forma de caça e redução ou eliminação de suas presas naturais. No entanto, com a deterioração ambiental, a ocorrência de doenças tem emergido como um problema central na conservação de carnívoros (FUNK et al., 2001; NOWELL E JACKSON, 1996). As doenças infecciosas são também particularmente relevantes para a conservação de carnívoros porque muitas espécies ou populações já estão seriamente ameaçadas pela perda de hábitats e perseguição, e desta forma mesmo aquelas menos severas podem apresentar efeitos devastadores se ocorrerem em populações já pequenas ou em declínio. Os efeitos das doenças podem ser agravados quando interagem com outros fatores comuns em populações ameaçadas, como má nutrição, estresse e endogamia (MURRAY et al., 1999). Conclui-se que a ocorrência de doenças infecciosas em populações naturais tende a aumentar à medida que os hábitats diminuem e os animais se concentram em parques e reservas (DOBSON; GRENFELL, 1995).
crônicas e persistentes que podem causar declínios através de efeitos negativos na fecundidade e recrutamento (CLEAVELAND et. al, 2003). No primeiro caso, situam-se as doenças infecciosas causadas por patógenos com períodos infecciosos curtos, que geralmente se disseminam através de contágio direto e que, se não forem letais, tendem a induzir em seus hospedeiros imunidade de longa duração contra reinfecções; persistem apenas em populações grandes e estruturadas de hospedeiros, que oferecem continuamente novos indivíduos susceptíveis através dos nascimentos para a manutenção do ciclo. No segundo caso, situam-se as doenças infecciosas causadas por patógenos que induzem doenças de decurso crônico, que se valem de diversas estratégias indiretas para disseminação e normalmente são causadas por patógenos mais complexos com grande variabilidade antigênica que desta forma tendem a inibir a imunidade duradoura de seus hospedeiros. Tais patógenos não necessitam necessariamente de grandes populações para persistirem, pois podem permanecer viáveis no ambiente por longos períodos e repetidamente reinfectar os hospedeiros (DIAMOND, 1999).
Conseqüentemente ao fato de que os patógenos que causam alta mortalidade não podem ser mantidos em populações pequenas de hospedeiros, as populações de felídeos ameaçadas, tipicamente pequenas e isoladas, não são capazes de manter tais patógenos. Porém, estes podem atingir as espécies ameaçadas se são mantidos em populações mais comuns e numerosas, como populações de carnívoros domésticos, que agem como potenciais reservatórios. O rápido crescimento populacional humano e a crescente mobilização de humanos e animais domésticos não apenas ameaçam diretamente os hábitats e as espécies vulneráveis, como também favorecem a disseminação e persistência de doenças infecciosas. (CLEAVELAND et. al., 2003).
Devido ao mecanismo de transmissão inter-específica, os patógenos que apresentam risco maior para as espécies ameaçadas são os generalistas, que podem infectar diversas espécies diferentes, e não aqueles mais específicos. (CLEAVELAND et al, 2003). O contato com gado (Bos sp), cães (Canis familiaris), gatos e outros animais domésticos abrem possibilidades de transmissão inter-específica de agentes infecciosos (DASZAK et al., 2000; FIORELLO et al., 2004; MENDES-DE-ALMEIDA et al., 2003; MURRAY et al., 1999).
pois são potencialmente expostas a uma grande variedade de patógenos, generalistas e específicos, uma vez que no ambiente de cativeiro felídeos das mais diversas origens geográficas são mantidos próximos, em alta densidade populacional, comumente sob estresse (CLUBB; MASON, 2003) e em muitos casos em contato ocasional com gatos domésticos. Em situação de vida livre, a invasão dos hábitats por carnívoros domésticos, como cães e gatos, favorecem a disseminação e persistência de patógenos nestas populações, seja mediante contato direto, como por predação (JESSUP et al., 1993) ou contaminação ambiental.
Apesar das implicações das infecções na conservação de espécies selvagens serem difícieis de serem acessadas, é amplamente aceito que o monitoramento destas infecções seja uma importante ferramenta de manejo para populações ameaçadas (DASZAK et al., 2000; MUNSON, 2000; MURRAY et al., 1999). O conhecimento sobre doenças infecciosas em felídeos neotropicais é muito pequeno, e o impacto de qualquer infecção nestas espécies é desconhecido. Entre os felídeos neotropicais, as onças-pintadas,suçuaranas e jaguatiricas de vida livre são melhor representadas em projetos de campo que lidam com carnívoros no Brasil; mas ainda assim há grande falta de informações referentes à ocorrência de doenças nos animais monitorados (BRASIL, 2004). A obtenção de informações sobre a exposição de felídeos de vida livre a potenciais agentes infecciosos deve auxiliar projetos ecológicos e conservacionistas, assim como fornecer informações para programas de manejo in situ e ex situ. Na década de 1990, o Grupo de Trabalho Especial idealizou o Plano de Manejo
Integrado para Pequenos Felinos Brasileiros (BRASIL, 1995), quando se iniciaram estudos sistemáticos com felinos neotropicais mantidos em cativeiro. Foi verificado que muitas enfermidades relacionadas com felídeos neotropicais cativos em zôos e criadouros no Brasil eram associadas com manejo, como condições sanitárias inadequadas e deficiências nutricionais (ADANIA et al., 1998; OLIVEIRA et al. 2001); entretanto, o estudo de doenças infecciosas nestas populações ainda é incipiente.
2.3 AGENTES VIRAIS
infectando felídeos selvagens de vida livre e mantidos em cativeiro na África, Europa, América do Norte e Japão (ARTOIS e REMOND, 1994; DANIELS et al., 1999; FROMONT et al., 2000; HOFMANN-LEHMANN et al., 1996; LEUTENEGGER et al., 1999a; MOCHIZUKI et al., 1990; NISHIMURA et al., 1999; OLMSTED et al., 1992; OSTROWSKI et al., 2003; PAUL-MURPHY et al., 1994; ROELKE-PARKER et al., 1996). Dados referentes a infecções virais em felídeos neotropicais brasileiros são esparsos e se concentram principalmente em retrovírus felinos. Os vírus mais importantes que infectam gatos domésticos e felídeos selvagens são: herpesvirus felino 1 (FHV 1), calicivirus felino (FCV), parvovírus felino (FPV), coronavirus felino (FCoV), virus da leucemia felina (FeLV) e virus da imunodeficiência felina (FIV) (HOFMANN-LEHMANN et al., 1996). Felídeos selvagens também podem ser susceptíveis ao vírus da cinomose canina (CDV) (ROELKE et al., 1996).
2.3.1 Herpesvírus felino 1 (FHV 1) e calicivírus felino (FCV)
Os principais vírus implicados no desenvolvimento de doenças respiratórias em felídeos são o FHV e o FCV. Apesar de pertencerem a diferentes famílias (FHV: Herpesviridae e genoma de DNA; FCV: Caliciviridae, genoma de RNA), determinam, em seus hospedeiros, sinais clínicos semelhantes, que incluem pirexia, depressão, espirros, hipersalivação, descargas oculares e nasais, conjuntivite, dispnéia, e tosse, traqueíte, anorexia, letargia. Ocasioalmente, pode ocorrer pneumonia viral primária ou doença generalizada, particularmente em animais jovens e debilitados. Manifestações mais raras incluem doença ocular, como ceratite intersticial e ulcerativa. Úlceras cutâneas já foram descritas em gatos domésticos e em guepardos. Estudos experimentais sugeriram que os abortos, quando ocorrem, são resultado da natureza sistêmica severa da infecção, e não de um efeito direto do vírus. (GASKELL; WILLOUGHBY, 1999). Salivação excessiva e úlceras na córnea sugerem infecção por FHV 1, enquanto úlceras na língua, pálato e faringe são mais comumente encontradas em infecções por FCV.
O FHV 1 infecta apenas membros da família Felidae. O principal hospedeiro é o gato doméstico, mas foram obtidos isolados de felídeos selvagens, como os guepardos (Acinonyx jubatus)e há crescente evidência sorológica de infecção disseminada em felídeos de vida livre
indicado que o FHV se encontra disseminado em populações de vida livre de leões, pumas e guepardos (PAUL-MURPHY et al., 1994). Igualmente, o vírus acomete populações de felídeos mantidas em cativeiro. Cerca de metade dos gatos que apresentam doença respiratória tem infecção pelo FHV 1 e outra metade apresenta infecção pelo calicivírus felino. Investigações têm demonstrado que a presença de anticorpos para FHV 1 em colônias de gatos é cerca de 70%, enquanto que para gatos domiciliados é de menos de 50%. (GASKELL; WILLOUGHBY, 1999)
que neste caso o diagnóstico definitivo é menos impotante. Em contraste, nas síndromes crônicas associadas ao FHV 1, a presença de vírus é elusiva, dificultando o diagnóstico. Finalmente, gatos absolutamente normais podem eliminar grandes quantidades de vírus a qualquer momento. Isto tudo faz com que o diagnóstico individual de FHV 1 seja um desafio no manejo das doenças crônicas relacionadas ao FHV 1. (MAGGS, 2005)
O FCV ocorre mundialmente e todos os felídeos são susceptíveis. Supõe-se que a infecção por FCV em felídeos selvagens seja epidemiologicamente similar à que ocorre em gatos domésticos. A transmissão natural ocorre via aerossol e fômites. Os vírus são liberados pelos gatos infectados em grandes quantidades; gatos convalescentes continuam a liberar vírus por muitos meses. O estresse pode precipitar a recrudescência da doença e a liberação continuada. Linhagens diferentes de FCV variam em virulência; algumas linhagens estão associadas principalmente com infecções brandas ou doença do trato respiratório anterior; linhagens altamente virulentas regularmente produzem pneumonia, especialmente em filhotes. (HURLEY; SYKES, 2003)
2.3.2 Parvovírus felino (FPV)
Todos os felídeos são susceptíveis à infecção pelo FPV (BARKER; PARRISH, 2001; STEINEL et al., 2001; WACK, 2003). Levantamentos sorológicos têm indicado a presença de FPV em pumas e bobcats (Lynx rufus) de vida livre nos Estados Unidos da América (EUA), e em leões na África do Sul. (BARKER; PARRISH, 2001). Entretanto, a maioria dos relatos de doença clínica associada a FPV em felídeos selvagens refere-se a animais mantidos em cativeiro.
natureza, a transmissão do FPV através de sítios contaminados seria a principal forma de disseminação dos vírus, devido aos hábitos solitários e densidades populacionais caracteristicamente baixas. O FPV também pode acometer outros carnívoros (BARKER; PARRISH, 2001).
O FPV apresenta tropismo por células em divisão (ASTELL, 1999; PARRISH, 1999). Sendo assim, as doenças causadas pelos parvovírus envolvem citotoxicidade em tecidos com alta taxa mitótica. Após infecção oronasal, a replicação viral ocorre em células da orofaringe e tonsilas, linfonodos, timo, baço e Placas de Peyer em todo o intestino. Ocorre linfocitólise e depleção celular, com regeneração destes tecidos em animais que sobrevivem. Grande quantidade de vírus é eliminada pelas fezes. (BARKER; PARRISH, 2001; PARRISH, 1999; STEINEL et al., 2001) Os sinais clínicos envolvem pirexia, anorexia, depressão, letargia, diarréia, vômitos, desidratação, desequilíbrio eletrolítico e hipoproteinemia. Tipicamente, ocorre linfopenia ou panleucopenia. (BARKER; PARRISH, 2001) Porém, as infecções por parvovírus em carnívoros freqüentemente são assintomáticas ou os sinais são brandos. Pode ocorrer morte por desidratação ou endotoxemia ou na ausência de qualquer sinal. (ASTELL, 1999; PARRISH, 1999) Em gatos domésticos, existe uma forma hiperaguda da doença seguida de morte em menos de 12 horas, mimetizando intoxicação (HAGIWARA; ELIAS, 2003). A eliminação dos vírus pelas fezes é suprimida quando se desenvolve uma resposta imune; nestes casos geralmente não persistem seqüelas, mas extensivo dano intestinal pode determinar diarréia crônica (PARRISH, 1999).
Uma pequena proporção das infecções por parvovírus em gatos refere-se parvovírus caninos (CPV-2a e CPV-2b); seqüências genômicas destes parvovírus caninos já foram detectadas em guepardos, em bobcats e em um tigre-siberiano (P.tigris altaica) apresentando sinais clínicos (BARKER; PARRISH, 2001; STEINEL et al., 2001).
2.3.3 Coronavírus felino (FCoV)
gatos-maracajá e um gato-palheiro mantidos em cativeiro, assim como uma jaguatirica de vida livre apresentaram-se soropositivas para FCoV (SCHMITT et al., 2003).
Os efeitos da infeçcão podem ser inaparentes ou pode haver um período transitório de diarréia ou acometimento respiratório, podendo ocorrer também episódios severos de vômitos ou diarréia, levando à perda de peso ou ainda culminar com a peritonite infecciosa felina (PIF), responsável por alta taxa de mortalidade (EVERMANN; BENFIELD, 2001). A PIF é uma doença imunomediada e fatal que acomete felídeos ocasionada pelo FCoV. São conhecidos duas variantes biológicas de FCoVs: o vírus da peritonite infecciosa felina (FIPV) e o coronavírus entérico felino (FECV). Estudos sugerem que o FIPV se originou de uma mutação do FECV (BENETKA et al., 2004). O FCoV apresenta também dois sorotipos (I e II) baseados em características de replicação em cultura de células e antigenicidade; o sorotipo II associa-se mais freqüentemente com sinais clínicos e desenvolvimento de PIF (KUMMROW et al., 2005)
Há fortes evidências da existência carreadores assintomáticos que podem excretar o vírus por meses ou anos. Tais animais representam reservatórios para o vírus, constituindo um problema na prevenção de FIP em ambientes de alta densidade de gatos. (BENETKA et al., 2004) Entre 5 a 10% dos gatos soropositivos desenvolvem FIP, mas há maior incidência em guepardos e determinadas raças e linhagens de gatos domésticos, sugerindo uma predisposição genética para a doença. (BENETKA et al., 2004)
2.3.4 Vírus da leucemia felina (FeLV), vírus da imunodeficiência felina (FIV) e lentivírus de puma (PLV)
O FeLV quanto e os demais lentivírus felinos, como o FIV e PLV, pertencem à família Retroviridae; associam-se com uma variedade de síndromes, envolvendo tumores malignos de longa latência, doenças de emagrecimento progressivo, desordens neurológicas e imunodeficiências, e determinam altos coeficientes de morbidade e mortalidade em gatos domésticos no mundo todo (WORLEY, 2001).
atravessam um período assintomático, sucedendo-se então disfunções linfocitárias, imunológicas e neurológicas (KENNEDY-STOSKOPF, 1999).
Acredita-se que exclusivamente para o gato-selvagem-europeu (F. silvestris silvestris), em que o FeLV é consistentemente encontrado em populações de vida livre, o vírus não apresenta alta patogenicidade. A alta prevalência gatos-selvagens-europeus soropositivos sugere que o vírus é mantido nestas populações. A possibilidade de que a infecção por FeLV seja constantemente adquirida através de contato com gato doméstico é pouco provável, uma vez que a prevalência em gatos-selvagens-europeus é constantemente maior que aquelas para gatos domésticos nas respectivas regiões estudadas (HOFMANN-LEHMANN, comunicação pessoal; DANIELS et al., 1999; FROMONT et. al., 2000; LEUTENEGGER et. al. 1999a). Entretanto, o FeLV foi também associado com doença severa em um espécime de puma (JESSUP et al., 1993) e de guepardo (MARKER et al., 2003). Apesar de ser raramente encontrado infectando outros felídeos selvagens que não o gato-selvagem-europeu, se estabelecido nestas populações, pode ter efeitos devastadores (ARTOIS; REMOND, 1994; WORLEY, 2001).
extinguir a infecção. No entanto, a maior parte dos animais desenvolve infecção autolimitante, albergando provírus latentes integrados em células da medula óssea, podendo haver resposta imune parcial. O risco de reativação espontânea e de desenvolvimento de doenças relacionadas ao FeLV, nos animais com este tipo de infecção, é pequeno. Nesse caso, não há replicação e excreção de vírus, a não ser que o animal experimente um estado de imunossupressão. (FILONI; CATÃO-DIAS, 2005a; 2005b; GOMES-KELLER et al., 2006)
A infecção por lentivírus relacionados ao FIV, em leões e pumas, na África, América do Norte e Europa, foi demonstrada por Olmsted et al. (1992) e Spencer e Morkel (1993), entre outros autores. O gene poldo vírus da imunodeficiência felina (FIV) obtido a partir de uma suçuarana mantida em um zoológico brasileiro foi seqüenciado (CARPENTER et al., 1996). Antes disso, Brown et al. (1993) havia detectado anticorpos para FIV em um espécime de suçuarana brasileira de vida livre. Adicionalmente, Leal e Ravazzolo (1998) detectaram provírus de FIV em onça-pintadas, suçuaranas, jaguarundis, jaguatiricas, gatos-maracajá, gatos-palheiro e gatos-do-mato-pequenos no Brasil.Em um estudo sorológico conduzido em populações de pequenos felinos neotropicais mantidas em cativeiro no Estado de São Paulo, não foram encontradas evidências de exposição aos retrovírus FeLV e FIV (FILONI, 2001; FILONI et al., 2003a). Desde então, foram encontrados três espécimes de felídeos neotropicais virêmicos para FeLV (um gato-maracajá e dois gatos-palheiros) em um levantamento conduzido em zoológicos norte-americanos (KENNEDY-STOSKOPF, 1999). Foram encontrados, no Brasil, onça-pintadas, suçuaranas, gatos-maracajá e um gato-palheiro mantidos em cativeiro, assim como uma jaguatirica de vida livre, soropositivos para FeLV (SCHMITT et al., 2003). Mais recentemente, Carvalho et al. (2004) encontraram leões soropositivos para lentivírus felinos na população de felídeos da Fundação Parque Zoológico de São Paulo (FPZSP) (APÊNDICE D).
2.3.5 Vírus da cinomose canina (CDV)
espécies susceptíveis à infecção pelo CDV (DEEM et al., 2000). O virus da cinomose canina (CDV) tem se mostrado um problema mundial afetando uma ampla gama de carnívoros. Uma onça-pintada foi infectada por CDV durante uma epizootia ocorrida em felídeos mantidos em cativeiro na América do Norte (APPEL et al., 1994, CLEAVELAND et al., 2003; FUNK et al., 2001).
Os felídeos em geral apresentam um comportamento de menor risco para a transmissão-interespecífica de patógenos. Entretanto, algumas espécies, como as suçuaranas, podem ser encontradas tanto em áreas preservadas quanto em áreas periurbanas e rurais, podendo entrar em contato e mesmo predar animais domésticos, potenciais fontes de infecção. A susceptibilidade de gatos domésticos ao CDV foi demonstrada mediante infecção experimental, mas os gatos infectados apresentam apenas um discreto aumento de temperatura corporal e não eliminam vírus (APPEL; SHEFFY; PERCY, 1974). Por isso, por muito tempo pensou-se que que o CDV não poderia provocar doença em felídeos. Embora atualmente haja indicativos de que a infecção por CDV possa contribuir para a ocorrência de doenças respiratórias e hepáticas em gatos domésticos ( IKEDA et al., 2001), foi somente quando uma uma epizootia por CDV acometeu diversas espécies de felídeos em zoológicos norte-americanos, entre 1991 e 1992, que a importância deste patógeno foi reconhecida para a família Felidae. Naquela ocasião, uma alta mortalidade se concentrou em grandes felídeos, como tigres (Panthera tigris), leões (Panthera leo) e leopardos (Panthera pardus), além de uma onça-pintada,enquanto outras espécies, como suçuaranas, bobcats , servais (Leptailurus serval) e gatos-maracajá apenas soroconverteram (KENNEDY-STOSKOPF, 1999). Em seguida a esta epizootia, houve outra epizootia com efeitos devastadores na população de leões de vida livre no ecossistema do Serengeti, África, que eliminou cerca de 30% desta população em 1994 (ROELKE-PARKER et al., 1996). Os grandes felídeos do gênero Panthera evidenciam-se como mais susceptíveis ao curso letal da infecção pelo CDV
(APPEL et al., 1994; KENNEDY-STOSKOPF, 1999). Nestes casos, foi demonstrado que os morbilivírus responsáveis por estas ocorrências eram relacionados com os que circulavam em outros carnívoros selvagens e cães domésticos locais (BARRET, 1999; HAAS et al., 1996). No ambiente de cativeiro, pode haver contato com outras fontes de infecção, como carnívoros domésticos; já foi reportada infecção por CDV em filhotes de tigre que tiveram contato com cães (APPEL et al., 1994; KENNEDY-STOSKOPF, 1999).
manifestam, incluindo convulsões, tremores, mioclonia, desorientação, fraqueza, ataxia, paraparesia, hiperreflexia e coma. A duração dos sinais clínicos varia de um dia a várias semanas na maioria dos felídeos, mas já foi observado um caso de desenvolvimento de sinais neurológicos progressivos ao longo de mais de um ano. Alguns animais podem apresentar anorexia, letargia, descarga nasal e ocular mucopurulenta, diarréia sanguinolenta ou não. Leões de vida livre apresentam anemia, linfadenopatia, condições precárias corporal e do pelame e presença de múltiplos ferimentos. Felídeos acometidos podem apresentar alterações comportamentais, podendo se mostrar deprimidos ou com aumento de agressividade. (MUNSON, 2001; ROELKE-PARKER et al., 1996) Os felídeos do gênero Panthera desenvolvem sinais mais severos e apresentem um prognóstico pior. Apenas sinais gastrointestinais e respiratórios brandos foram observados em pumas, enquanto outras espécies de felinos menores, como bobcats, servais e gatos-maracajás apresentaram-se soropositivos e saudáveis. (APPEL et al., 1994)
2.4 AGENTES BACTERIANOS
2.4.1 Bartonella henselae
gatos errantes apresentam soroprevalências maiores que de gatos domiciliados (BREITSCHWERDT; KORDICK, 2000; JACOMO et al., 2002).
Embora o patógeno possa permanecer como parte da microbiota intravascular de gatos saudáveis, evidências recentes sugerem uma associação deste patógeno com manifestações insidiosas de doenças renais crônicas (GLAUS et al., 1997). Outras anormalidades relatadas em gatos infectados com B. henselae incluem febre, discreta anemia transitória, eosinofilia, linfadenomegalia, colangite, difunção neurológica, lesões cardíacas e falhas na reprodução (BREITSCHWERDT; KORDICK, 2000; ROTSTEIN et al., 2000).
Estudos têm demonstrado a exposição de uma variedade de felídeos de vida livre e mantidos em cativeiro à B. henselae, incluindo felídeos neotropicais mantidos em zoológicos da América do Norte (KELLY et al., 1998; MOLIA et. al, 2004; YAMAMOTO et al., 1998; PRETORIUS et al., 2004; ROTSTEIN et al., 2000). A soroprevalência nestas populações de felídeos selvagens são comparáveis às encontradas para gatos domésticos (BREITSCHWERDT; KORDICK, 2000; ROTSTEIN et al., 2000). Um levantamento extensivo conduzido nas Américas detectou suçuaranas soropositivas através da maioria das áreas de ocorrência natural da espécie. (CHOMEL et al., 2004b); a soroprevalência geral relatada em suçuaranas da América do Sul foi de 22.4%. O estudo incluiu amostras de 11 suçuaranas brasileiras de três estados (São Paulo, Tocantins e Goiás); porém não foram mencionados resultados individuais, áreas exatas de colheita ou condições de vida dos animais.
2.4.2 Ehrlichia canis e Anaplasma phagocytophilum
Recentemente foi demonstrado que gatos domésticos são susceptíveis à infecção e doença causada por Ehrlichia canis e Anaplasma phagocytophilum. A erliquiose em gatos domésticos tem sido reconhecida cada vez com maior freqüência no mundo todo , inclusive no Brasil (ALMOSNY; MASSARD, 1999; DAGNONE et al., 2003; TARELLO, 2005).
1999). Os sinais clínicos são semelhantes para os dois agentes, incluindo anorexia, hiperestesia, letargia, perda de peso, dores articulares, dispnéia, linfadenomegalia, anemia e hipergamaglobulinemia (TARELLO, 2005). As pulgas (C. felis) são consideradas potenciais vetores na transmissão destes agentes em gatos (LAPPIN et al, 2006), assim como carrapatos.
Pouco é conhecido sobre erliquioses de forma geral em animais selvagens, especialmente felídeos. Se em linces-eurasianos (Lynx lynx), um levantamento sorológico realizado para populações de vida livre no norte da Europa demonstrou uma prevalência de 4% (RYSER-DEGIORGIS et al., 2005), é razoável supor que o clima quente e úmido em pelo menos parte do ano no Brasil favoreça a transmissão destes agentes pelos vetores e a doença esteja presente com alta morbidade em nosso meio sem ser reconhecida. Entretanto, de acordo com nosso conhecimento, não há relatos prévios de infecções por E. canis e A. phagocytophilum em felídeos neotropicais, seja em animais cativos ou de vida livre.
2.4.3 Hemoplasmas: Mycoplasma haemofelis, ‘Candidatus Mycoplasma haemominutum’ e ‘CandidatusMycoplasma turicensis’
e esplenomegalia. Co-infecções com os agentes virais imunossupressivos FIV ou FeLV podem favorecer a hemólise observada em gatos infectados. (HAEFNER et al., 2003; KEWISH et al., 2004; MESSICK, 2003; WILLI et al., 2005; 2006). Evidências recentes demonstram a presença das três espécies de hemoplasmas em diversas espécies de felídeos selvagens nos continentes europeu, africano e americano, sugerindo que todas as espécies de felídeos sejam susceptíveis. (HAEFNER et al., 2003; WENGI et al., em elaboração).
Pulgas (C. felis) e carrapatos são tidos como potenciais vetores destes microorganismos (LAPPIN et al., 2006). Foi demonstrado que infecções verticais intra-uterinas, durante o parto ou durante a lactação podem ocorrer em gatos domésticos, assim como transmissões horizontais iatrogênicas, mediante transfusões sangüíneas e agulhas contaminadas (HAEFNER et al., 2003). Os animais infectados que são submetidos a antibioticoterapia ou que desenvolvem evidente resposta imune, provavelmente permanecem como portadores crônicos (MESSICK, 2003). O diagnóstico etiológico tradicionalmente baseia-se na identificação citológica de esfregaços sangüíneos corados, juntamente com a análise de hemogramas completos e sinais clínicos compatíveis. Entretanto, o desenvolvimento dos métodos moleculares facilitaram a identificação e quantificação destes agentes, de maneira sensível e específica, e a PCR é considerada atualmente o método de escolha para o diagnóstico destas infecções (WILLI et al., 2005; 2006).
2.5 PROTOZOÁRIOS PIROPLASMAS: Theileria sp E Cytauxzoonsp
formam pequenas agregações ou são únicos nestas células e induzem os linfócitos a se transformarem em linfoblastos, provocando contínua proliferação. Os esquizontes de Cytauxzoon sp, diferentemente, reproduzem-se em células fagocíticas mononucleares e formam agregações maiores. Os esquizontes desenvolvem-se como merozoítas, que são endocitados por eritrócitos e, ao adquirir um aspecto pleomórfico, passam a ser referidos como piroplasmas (BONDY et al., 2005). As manifestações clínicas das infecções por piroplasmas são inespecíficas e similares aos de hemoplasmas, incluindo anorexia, letargia, icterícia, palidez de mucosas, dispnéia, taquipnéia, taquicardia, febre, esplenomegalia, hepatomegalia, e nos estágios finais da doença, hipotermia, vocalização, convulsões e coma. Em função da similaridade dos sinais clínicos, métodos diagnósticos moleculares são recomendados para o diagnóstico e diferenciação destes agentes (BONDY et al., 2005; CRIADO-FORNELI, et al., 2003)
A espécie Cytauxzoon felis infecta exclusivamente felídeos, tendo sido diagnosticada desde os anos 1970 em gatos domésticos e diversas espécies de felídeos selvagens mantidos em cativeiro, como bobcats, guepardos, pumas e tigres (GLENN et al., 1983; KETZ-RILEY et al., 2003). Os bobcats da subespécie L. rufus rufus geralmente desenvolvem um curso clínico discreto quando infectados, e são tidos como reservatórios do agente na América do Norte (BONDY et al., 2005). Mais recentemente, também foram diagnsticados morfologicamente em felídeos selvagens exóticos e neotropicais no Brasil, como leões, onças-pintadas e gatos-do-mato-pequenos (SOARES, 2001). Um piroplasma relacionado mas não identificado como C. felis foi diagnosticado através de métodos moleculares em gatos-de-Pallas (Otocolobus manul) capturados em vida-livre na Mongólia em 2000 (KETZ-RILEY et al., 2003), sugerindo que devam existir outras espécies de piroplasmas relacionadas.
2.6 AS TÉCNICAS LABORATORIAIS
testes sorológicos indiretos como o enzyme linked immunosorbent assay (ELISA) indireto, Western blot e imunofluorescência indireta (IFA). Entre os testes de detecção direta, foram
utilizados ELISA diretos e testes de reação de polimerização em cadeia (PCR) ou reações de polimerização em cadeia submetidas à ação da transcriptase reversa (RT-PCR) em tempo real TaqMan®.
Também foram utilizados testes sorológicos imunoenzimáticos comerciais, representados pelo o Snap™ Combo FeLV Antigen/FIV Antibody Test Kit (IDEXX Laboratories, Inc., Westbrook, Maine 04092, USA), que em um único dispositivo combinam dois testes diferentes: um direto para o antígeno viral p27 do FeLV e um indireto para anticorpos contra lentivírus felinos.
3 MATERIAIS E MÉTODOS
3.1 ANIMAIS E OBTENÇÃO DAS AMOSTRAS
Foram utilizadas amostras de material biológico de 232 felídeos selvagens, sendo 22 de vida livre e 210 mantidos em cativeiro. As espécies e número amostral utilizado podem ser verificados na tabela 1.
As amostras dos 22 animais de vida livre foram fornecidas pelo Banco de Amostras Biológicas do Centro Nacional de Pesquisas para Conservação de Predadores Naturais (CENAP), Centro Especializado do Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA), sendo provenientes de quatro biomas diferentes, e colhidas em 13 localidades situadas nas regiões Norte, Sul, Sudeste e Centro-Oeste do Brasil, entre 1998 e 2004 (Fig. 1, APÊNDICE A). As amostras dos animais de cativeiro foram fornecidas pela FPZSP e pela organização não-governamental (ONG) Associação Mata Ciliar (AMC). Entre 2002 e 2004, foram colhidas amostras de 125 felídeos mantidos na FPZSP; também foram incluídas amostras de um animal necropsiado em 2001 (animal CAD 19696, APÊNDICE B). Em 2004, a AMC cedeu amostras de 62 felídeos, as quais haviam sido obtidas entre 1996 e 2002, na vigência do Programa de Identificação e Imunização do Plano de Manejo para Felinos Selvagens Brasileiros. Estas últimas foram provenientes de 22 zoológicos brasileiros e cinco centros de conservação (APÊNDICE C).
mantidas a -18°C até o momento de sua cessão ao presente projeto, sendo que a partir deste momento até a utilização ficaram armazenadas a -80°C.
Todas as amostras utilizadas foram transportadas obedecendo as instruções internacionais da Associação Internacional de Transporte Aéreo (International Air Transport Association – IATA) como amostras diagnósticas (PI 650) e em completo acordo com licenças federais específicas como a Convenção sobre o Comércio Internacional de Espécies da Flora e Fauna Selvagens em Perigo de Extinção (Convention on International Trade in Endangered Species – CITES) (números de licença 0112928BR e 1562/04), Conselho de
Gestão do Patrimônio Genético (CGEN) e Ministério da Agricultura (CSI 1530/2004).
As amostras dos felídeos de vida livre foram colhidas a campo no próprio local de captura, enquanto se realizaram exames físicos completos e colocação de colares transmissores. Os felídeos de maior porte (suçuaranas) foram capturados com a utilização de cães treinados, enquanto que para os pequenos felinos utilizaram-se armadilhas com presas vivas como iscas. Os animais foram quimicamente imobilizados com o auxílio de dardos e uma combinação 10 mg/kg IM de tiletamina e zolazepam (Telazol®, Fort Dodge, Iowa, USA). Após a recuperação anestésica, os animais foram soltos no local de captura para posterior monitoramento (MORATO, comunicação pessoal).
Tabela 1 – Número amostral e instituições cedentes de amostras de felídeos selvagens mantidos em cativeiro e de vida livre. São Paulo, 2004
Espécies Nomes comuns Procedência
Cativeiro Vida livre
Neotropicais FPZSP1 AMC2 Sub-total CENAP3 Total
Puma concolor suçuarana 2 12 14 18 32
Herpailurus yagouarondi jaguarundi 23 10 33 0 33
Leopardus pardalis jaguatirica 6 10 16 2 18
Leopardus tigrinus gato-do-mato-pequeno 33 10 43 2 45
Leopardus wiedii gato-maracajá 10 10 20 0 20
Oncifelis geoffroyi gato-do-mato-grande 13 10 23 0 23
Oncifelis colocolo gato-palheiro 10 0 10 0 10
Sub-total 97 62 159 22 181
Exóticos
Panthera leo leão 30 0 30 NA4 NA
Panthera pardus leopardo 4 0 4 NA NA
Acynonyx jubatus guepardo 2 0 2 NA NA
Panthera tigris altaica tigre-siberiano 13 0 13 NA NA
Uncia uncia leopardo-das-neves 2 0 2 NA NA
Sub-total 51 0 51 NA NA
Total 148 62 210 22 232
1FPZSP = Fundação Parque Zoológico de São Paulo. 2
AMC = Associação Mata Ciliar.
3CENAP = Centro Nacional de Pesquisas para a Conservação de Predadores Naturais, Centro Especializado do Instituto
Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA).
4
Identificação das amostras no Banco de Amostras Biológicas do Centro Nacional de Pesquisas para a Conservação de Predadores Naturais (CENAP), Centro Especializado do Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA): 1 = B61c1609; 2 = 061c6047; 3 = 061bc05f; 4 = 0610a655; 5 = 0610a16c; 6 = PNI Juliana; 7 = Totti 7/6/98; 8 = 061c6683; 9 = 0610d9a3; 10 = 0001f9adf1; 11 = 06110af3b; 12 = 000610d48f; 13 = 000610a00a; 14 = 000610a3b; 15 = 00061c4d0f; 16 = 000610c60e; 17 = 1013; 18 = 004; 19 = 061bd88c; 20 = 003; 21 = 61431; 22 = 301.
3.2 PATÓGENOS PESQUISADOS
Pesquisou-se um total de 16 patógenos diferentes utilizando-se diversos testes diagnósticos em diferentes números amostrais. O número de animais avaliados para cada patógeno estão apresentados nos quadros 1 a 3.
Patógenos Testes sorológicos Número de animais testados Testes TaqMan® Número de animais testados Vírus de DNA
FHV 1 IFA 21 PCR 5
FPV IFA 21 PCR 6
Vírus de RNA
FCV IFA 21 RT-PCR 5 FCoV IFA 21 RT-PCR 6 FeLV ELISA direto
ELISA indireto Western blot 21 21 21 PCR RT-PCR 5 5
FIV Western blot 21 PCR
RT-PCR
5 5 PLV ELISA indireto 21 ...1 ...
CDV ... ... RT-PCR 6
Bactérias
Ehrlichia canis IFA 21 PCR 1
Anaplasma phagocytophilum
IFA 21 PCR 1
Bartonella henselae IFA 20 ... ...
1
... = Testes não realizados.
Patógenos Testes sorológicos Número de animais testados Testes TaqMan® Número de animais testados Vírus de DNA
FHV 1 IFA 1 ...1 ...
FPV IFA 1 ... ...
Vírus de RNA
FCV IFA 1 ... ... FCoV IFA 147 ... ...
FeLV Western blot
ELISA indireto Snap™ Combo2
25 147 148
PCR RT-PCR PCR (exo U3)
24 24 109
FIV Western blot
Snap™ Combo 10 148
PCR 1
Bactérias
Ehrlichia canis IFA 147 PCR 109
Anaplasma phagocytophilum ... ... PCR 109
Bartonella henselae IFA 147 PCR 109
‘Candidatus Mycoplasma
haemominutum’
... ... PCR 109
Mycoplasma haemofelis ... ... PCR 109
‘Candidatus Mycoplasma
turicensis’
... ... PCR 109
Piroplasmas
Theileria sp ... ... PCR 109
Cytauxzoon sp ... ... PCR 109
1… = Testes não realizados. 2
Snap™ Combo FeLV Antigen/FIV Antibody Test Kit (IDEXX Laboratories, Inc., Westbrook, Maine 04092, USA).
Patógenos Testes sorológicos Número de animais testados (n) Vírus de DNA
FHV 1 IFA 62
FPV IFA 62
Vírus de RNA
FCV IFA 62
FCoV IFA 62
FeLV Western blot
ELISA indireto
3 62
Bactérias
Ehrlichia canis IFA 62
Quadro 3 – Testes realizados para seis patógenos em amostras de material biológico dos felídeos mantidos em cativeiro cedidas pela Associação Mata Ciliar (AMC). São Paulo, 2004
3.3 TESTES DIAGNÓSTICOS
Os testes diagnósticos foram realizados em 2004 no Clinical Laboratory, Vetsuisse Faculty, University of Zurich, Suíça, com exceção dos testes imunoenzimáticos Snap™
Combo FeLV Antigen/FIV Antibody Test Kit, que foram executados no momento de colheita das amostras na FPZSP.