UNIVERSIDADE FEDERAL DO CEARÁ
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA (RENORBIO) DOUTORADO EM BIOTECNOLOGIA
JÚLIO CÉSAR MARTINS XIMENES
BIOTRANSFORMAÇÃO DE RESÍDUOS DA CARCINICULTURA EM PRODUTOS DE ALTO VALOR AGREGADO
FORTALEZA – CE
BIOTRANSFORMAÇÃO DE RESÍDUOS DA CARCINICULTURA EM PRODUTOS DE ALTO VALOR AGREGADO
Tese apresentada ao Curso de Pós-Graduação em Biotecnologia da Universidade Federal do Ceará (RENORBIO-UFC), como parte dos requisitos para obtenção do título de Doutor. Área de concentração: Biotecnologia Industrial. Orientadora: Profa. Dra. Vânia Maria Maciel Melo.
Co-orientadora: Profa. Dra. Denise Cavalcante Hissa
Aos meus pais Ximenes e Eurenice e a minha irmã Graziela por sempre terem me ajudado, pela educação que me deram com a qual pude enfrentar todas as dificuldades impostas pela vida de forma justa, pela preocupação diária com meu bem estar, pelos momentos alegres convividos, pelos momentos tristes dos quais pude tirar lições de vida, pelo apoio financeiro, por todo sacrifício feito para que eu chegasse até aqui, pela vida respeitosa que têm e na qual me espelho e por todo amor que me foi dado.
À minha esposa Iana pela a qual não há palavras suficientes para descrevê-la. Nossa história se confunde com o doutorado, desde o início do namoro pouco antes do início do curso até o noivado e o casamento. Nesse tempo enfrentamos de tudo e só com a sua ajuda que pude superar tudo o que apareceu no nosso caminho. A ela só posso deixar toda a minha plena gratidão e desejos de muitos mais desafios e vitórias no nosso caminho. Junto a ela, também, agradeço ao nosso Johnny que foi meu companheiro em tempo integral na escrita da tese.
À Professora Drª. Vânia Maria Maciel Melo, pela orientação, pelos constantes conselhos e incentivos edificantes, pela compreensão em certos momentos, pelas cobranças em outros, pela dedicação e carinho demonstrado, por contribuir para meu desenvolvimento pessoal e profissional.
À ProfessoraDrª. Denise Cavalcante Hissa,por ter aceitado unir-se a este trabalho como Co-orientadora e ter ajudado a pensar e executar as estratégias para a identificação molecular das linhagens estudadas neste trabalho. Além disso, por sua amizade que ultrapassa as fronteiras da Universidade, sendo uma grande amiga e uma das melhores há mais de 12 anos. À ProfessoraDrª. Maria Valderez Ponte Rocha por ter cedido seu laboratório para a realização de parte dos experimentos deste trabalho. Pela sua orientação durante os mesmos com toda a sua experiência, pelo conhecimento transmitido, além de sua paciência e compreensão em explicar coisas não tão usuais a mim.
À ProfessoraDrª. Elenise Gonçalves Oliveira por ter cedido seu laboratório para o desenvolvimento de uma das fases mais complexas deste trabalho. Pela sua orientação, experiência e paciência transmitida a mim antes, durante e após os experimentos. Além de todo o seu empenho e dedicação a este trabalho.
acadêmica desde sempre com bons conselhos e ensinamentos.
A todos meus amigos que trabalham e trabalharam no Laboratório de Ecologia Microbiana e Biotecnologia (LEMBIOTECH), ao longo desses quatro anos, Bárbara Cibelle, Camila Nascimento, Gabrielly Oliveira, Gustavo Amaral, Hortência Barroso, Jamile Lima, Jonathan Araújo, Laís Machado, Lara Azevedo, Lidianne Leal, Leonardo Normando, Luína Benevides, Lyanderson Aquino, Melissa Sanders, Mirella Pereira, Natália Falcão, Raissa Bezerra, Santigo Moura, Samuel Oliveira, Sasha Gabrielle, Vanessa Câmara, Vanessa Nogueira, Yara Dias.
Aos amigos do Laboratório de Bioprospecção, em especial a Berenice Alves, Gabrielle Freire, Igor Almeida, Jackeline Medeiros, Lady Clarissa Rocha, Luis Carlos Almeida, Nathanna Mateus, Nayana Soares, Paulo Sousa, Pedro Matheus Tabosa, Thiago Almeidae do Grupo de Pesquisa e Desenvolvimento de Processos Biotecnológicos (GPBio), em especial ao Álvaro Pinheiro, Fátima Matos, Ítalo Lima, Jessyca Aline, Jocélia Mendes e Tiago Albuquerque. Por sempre serem tão solícitos e pelo apoio na execução dos trabalhos.
Ao Luis Henrique Ribeiro que participou diretamente da execução deste trabalho e que sem ele a grande parte desses experimentos não teriam sido concluída. Uma pessoa a qual eu tinha responsabilidades profissionais, mas que se tornou um grande amigo.
Ao Dr. Alysson Lira, Caio Leão e Glauber Melo, por serem os melhores amigos. Porque cada um com suas diferenças e semelhanças, mas sempre com atenção, altruísmo, força e vontade de ajudar uns aos outros, faz com que os dias sejam mais divertidos e melhores.
Aos de longa data e os novos amigos de doutorado Rômulo Castro, Samantha Pinheiro, Simone Semionato e Wal Melgaço por fazerem as disciplinas e o próprio doutorado em si parecerem mais leves e interessantes. Muito obrigado pelos momentos compartilhados e pela cumplicidade nesses anos.
A todos os amigos que fiz na faculdade, com atenção e carinho muito especial a Aline Coelho, André Leão, Felipe Monteiro, Geórgia Barguil, Jadson Pinto, Juliana Lucena, Lara Queiroz, Lia Araújo, Lívia Mendes, Lucas Brito, Mariana Lima, Natasha Wanderley, Pedro Bastos, Rubens Sabóia, Tallita Tavares, Tatyane Bandeira, Thiago Amorim e Vadjah Moraes. Agradeço a eles por esta amizade vivida há tantos anos, com muitos aprendizados acadêmicos e de vida, servindo como uma segunda família.
que alguns nunca nem leiam tal dedicatória, no entanto são pessoas que merecem tal homenagem por terem sido tão importantes nesse período e que continuarão sendo por muitos anos.
Ao Seu Valdenor, por ser um funcionário exemplar que nunca falta ou atrasa, além de estar sempre de bem com a vida. Por sempre fazer companhia com conversas engraçadas e de futebol nos muitos dias e finais de semana de trabalho.
• Rede Nordeste de Biotecnologia (RENORBIO).
• Fundação Cearense de Apoio ao Desenvolvimento Científico e Tecnológico (FUNCAP) e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pela concessão das bolsas e auxílio à pesquisa.
“ As pessoas que vencem neste mundo são as que procuram as circunstâncias de que precisam e, quando não as encontram, as criam. ”
A carcinicultura é o segmento da aquicultura que mais cresce no mundo. No Brasil, o Ceará é o maior produtor com 50% de toda a produção. Sabe-se que aproximadamente 40% do peso do camarão sejam considerados resíduos, como a cabeça, a cauda e a casca, gerando grandes quantidades de resíduos que devem ser descartados adequadamente. Assim, o reaproveitamento de resíduos da carcinicultura através de recursos biotecnológicos surge como uma alternativa inovadora para reduzir a poluição ambiental causada por essa atividade. O presente estudo teve por objetivo aperfeiçoar um processo biotecnológico baseado na utilização de consórcio bacteriano capaz de fermentar os resíduos da carcinicultura transformando-os em líquor para ser utilizado na alimentação de pós-larvas de Tilápia do Nilo (Oreochromis niloticus) em fase de reversão sexual. As linhagens de bactérias láticas utilizadas foram identificadas através do sequenciamento dos genes RNAr 16S, rpoA e pheS e por testes bioquímicos envolvendo a habilidade de fermentar carboidratos. Para a seleção do consórcio foram realizados estudos de cinética química, modelos matemáticos de Monod, Andrews e Levenspiel para determinar possíveis tipos de inibição do processo de fermentação lática de cabeças de camarão. Para avaliar o potencial do líquor resultante da fermentação como suplemento na alimentação de pós-larvas de tilápia foram confeccionadas rações com inclusões de líquor na proporção de 15, 30 e 45 %, monitorando-se a qualidade da água e os parâmetros de temperatura, oxigênio dissolvido, pH, salinidade, nitrogênio amoniacal total, nitrito, nitrato e ortofosfato, além do desempenho zootécnico. Para tanto, foram avaliados a taxa de sobrevivência, taxa de crescimento específico, ganho em peso e comprimento, fator de conversão alimentar e seleção por tamanho. Como resultados deste trabalho foram identificadas linhagens de lactobacilos nomeadas Lact7, Lact8, Lact9 e Lact14 como pertencentes a espécie Lactobacillus plantarum, Lact6 como L. futsaii e Lact11 como Pediococcus acidilactici. Quantos aos parâmetros cinéticos da fermentação, as linhagens Lacts6, Lact7 e Lact14 apresentaram os melhores resultados e não houve indícios de inibição pelo substrato ou produto. Durante a fermentação das cabeças de camarão o consórcio formado pelas linhagens Lact6 e Lact14 produziram os mais altos rendimentos de ácido lático, cerca de 100 g.L-1. Inclusões do líquor resultante da fermentação lática dos resíduos de camarão nas proporções de 15 e 30 % proporcionaram os melhores resultados para sobrevivências, ganho em peso e comprimento, taxa de crescimento específico e biomassa de pós-larvas de Tilápia do Nilo. A conversão alimentar não diferiu entre os tratamentos. Nitrito, nitrato e ortofosfato aumentaram significativamente ao longo das semanas, embora as concentrações tenham se mantido em níveis aceitáveis, bem como os demais parâmetros se mantiveram dentro do recomendado durante o desenvolvimento da tilápia. Os dados desse estudo mostraram que é tecnologicamente viável transformar resíduos da carcinicultura em produtos de valor agregado por fermentação lática. O líquor resultante da fermentação, rico em proteínas, pigmentos e minerais pode ser incorporado na proporção de até 30% na ração, sem causar nenhum impactado no desenvolvimento de pós-larva da tilápia e portanto, trazendo benefícios econômicos e destinação apropriada para resíduos da carcinicultura.
Shrimp farming is the fastest growing segment in aquiculture in the world. In Brazil, Ceara is the largest producer with 50 % of all production. Approximately 40 % of the shrimp weight is considered waste as the head, tail and bark, generating large amounts of waste that must be properly discarded. Thus, the reuse of shrimp farming waste through biotechnological resources emerges as an innovative alternative to reduce environmental pollution caused by that activity. This study aimed to perform a biotechnological process based on bacterial consortium capable to fermenting shrimp waste turning them into a liquor used in feed for Nile tilapia (Oreochromis
niloticus) post-larvae in sex reversal process. Lactic acid bacteria strains used were identified
by sequencing of the 16S rRNA, rpoA and pheS genes and biochemical tests involving the ability to ferment carbohydrates. For the consortium selection some studies were performed such as chemical kinetics use of Monod, Andrews and Levenspiel mathematical models to determine possible types of inhibition. To evaluate the liquor potential from fermentation as a supplement in feed for tilapia post-larvae were prepared feed diets with liquor inclusions of 15, 30 and 45 %, by monitoring the water quality and temperature parameters, dissolved oxygen, pH, salinity, total ammonia nitrogen, nitrite, nitrate and orthophosphate in addition to growth performance. For that, we evaluated the survival rate, specific growth rate, weight and length gain, feed conversion factor and selection by size. This work identified lactobacilli strains named Lact 7, Lact 8, Lact 9 and Lact 14 as belonging to Lactobacillus plantarum species, Lact 6 as L. futsaii and Lact 11 as Pediococcus acidilactici. As to fermentation kinetic parameters, Lact 6, Lact 7 and Lact 14 strains showed the best results and there was no evidence of inhibition by substrate or product. During shrimp heads fermentation Lact 6 and Lact 14 consortium produced the highest lactic acid yields, about 100 g.L-1. Liquor inclusions of 15 and 30 % provided the best results for survival, weight and length gain, specific growth rate and biomass of Nile tilapia post-larvae. Feed conversion did not differ between treatments, being slightly higher in treatment with 30 % of liquor. Nitrite, nitrate and orthophosphate increased significantly over the weeks, although concentrations have remained at acceptable levels and other parameters remained within the recommended during the tilapia development. The data from this study showed that it is technologically feasible to transform shrimp farming waste into added-value products by lactic fermentation. The resulting liquor fermentation, rich in protein, minerals and pigments can be incorporated in a proportion of up to 30% in tilapia feed, without causing, any impact the development of tilapia post-larvae and thus bringing economic benefits and proper disposition of shrimp farming waste.
ABCC Associação Brasileira dos Criadores de Camarão
ANOVA Análise de Variância
ARDRA Análise de Restrição de DNA Ribossomal Amplificado
BAL Bactérias do Ácido Lático
BLAST Basic Local Alignment Search Tool
CA Conversão Alimentar
CLAE Cromatografia Líquida de Alta Eficiência
CTAB Brometo de cetil-trimetilamônio
DGGE Eletroforese em Gel de Gradiente Desnaturante
DHA Ácido docosa-hexaenóico
DNA Ácido desoxirribonucleico
DNOCS Departamento Nacional de Obras Contra as Secas
EMBRAPA Empresa Brasileira de Pesquisa Agropecuária
EPA Ácido eicosapentaenoico
FAO Food and Agriculture Organization
FCA Fator de Conversão Alimentar
GC Ganho em Comprimento
GP Ganho em Peso
IMNV Vírus Infeccioso Mionecrose
LCTA Laboratório de Ciência e Tecnologia Aquícola
LEMBIOTECH Laboratório de Ecologia Microbiana e Biotecnologia
MPA Ministério da Pesca e Aquicultura
MRS Man, Rogosa e Sharpe
NAT Nitrogênio Amoniacal Total
p Nível de significância
pb Pares de Bases
PB Proteína Bruta
PCR Reação Cadeia da Polimerase em cadeia
pH Potencial Hidrogeniônico
pheS Subunidade α da Fenilalanina-tRNA Sintetase
PL Pós-larvas
PUFA Ácidos graxos poliinsaturados
R2 Coeficiente de determinação
RAPD Reação de Amplificação Polimórfica Aleatória de DNA
RSD Desvio Padrão Residual
rpoA Subunidade α da RNA Polimerase
RNAr Ácido Ribonucleico Ribossomal
SSCP Polimorfismo de Conformação de Filamento Único
T0 Ração Controle
T15 Tratamento com 15% de Inclusão de Líquor
T30 Tratamento com 30% de Inclusão de Líquor
T45 Tratamento com 45% de Inclusão de Líquor
TCE Taxa de Crescimento Específico
tRNA Ácido Ribonucleico Transportador
1 APRESENTAÇÃO DO PROBLEMA ... 21
2 REVISÃO BIBLIOGRÁFICA ... 22
2.1 Aquicultura no mundo e no Brasil ... 22
2.2 Aquicultura e a Tilápia do Nilo (Oreochromis niloticus) ... 24
2.3 Nutrição e alimentação de Tilápias do Nilo ... 26
2.4 A carcinicultura no Brasil ... 28
2.5 Composição dos resíduos do camarão branco do Pacífico ... 30
2.6 Tecnologias para reciclagem de resíduos da carcinicultura ... 32
2.7 Bactérias do ácido lático (BAL) ... 34
2.8 Aplicações biotecnológicas de Lactobacillus ... 35
2.9 Cinética química e modelagem matemática aplicada à fermentação lática... 37
3 OBJETIVO GERAL ... 40
3.1 Objetivos Específicos ... 40
4 MATERIAIS E MÉTODOS ... 41
4.1 Bactérias do ácido lático (BAL) ... 41
4.2. Resíduos da carcinicultura ... 41
4.3 Identificação molecular das linhagens de BAL ... 41
4.3.1 Extração do DNA genômico ... 41
4.3.2 Amplificação e sequenciamento dos genes RNAr 16S, rpoA e pheS ... 41
4.3.3 Análise Filogenética ... 43
4.4 Identificação Bioquímica das BAL ... 43
4.5 Crescimento das linhagens de bactérias láticas (BAL) em meio MRS modificado ... 43
4.5.1 Determinação das concentrações de sacarose e ácido lático ... 44
4.5.2 Determinação da biomassa seca ... 45
4.6. Parâmetros cinéticos da fermentação lática em caldo MRS modificado ... 45
4.9. Fermentação de resíduos de camarão (escala de 2 kg de resíduos) ... 48
4.10 Confecção da ração de tilápia ... 49
4.11 Análises bromatológicas ... 49
4.12 Cultivo de alevinos de tilápia ... 50
4.13 Monitoramento limnológico ... 51
4.14 Análises de desempenho zootécnico ... 52
4.15 Análises Estatísticas ... 53
5 RESULTADOS ... 54
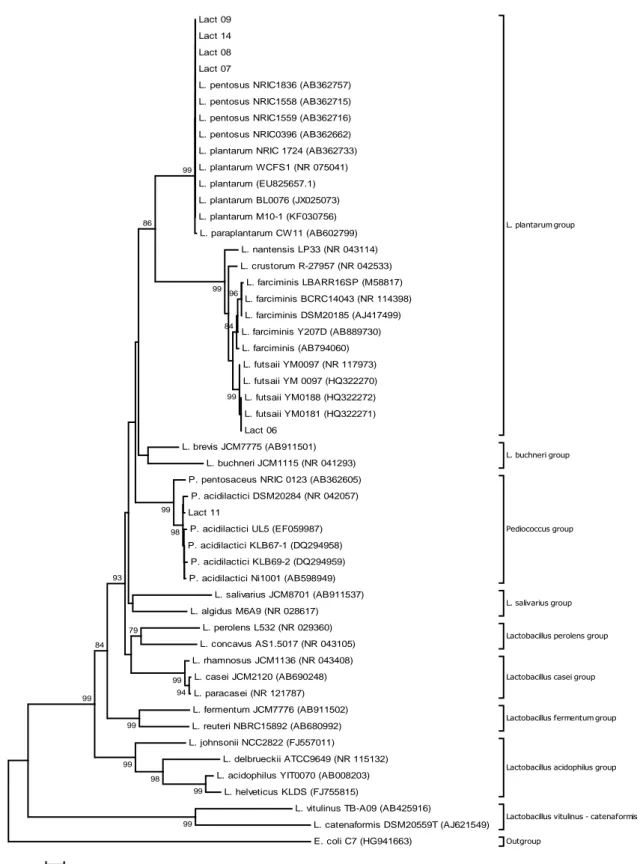
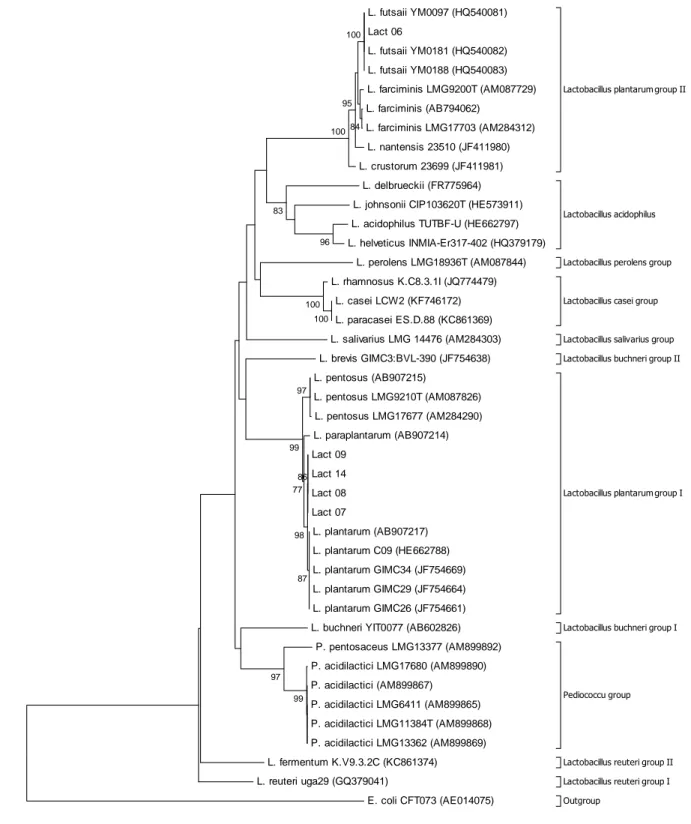
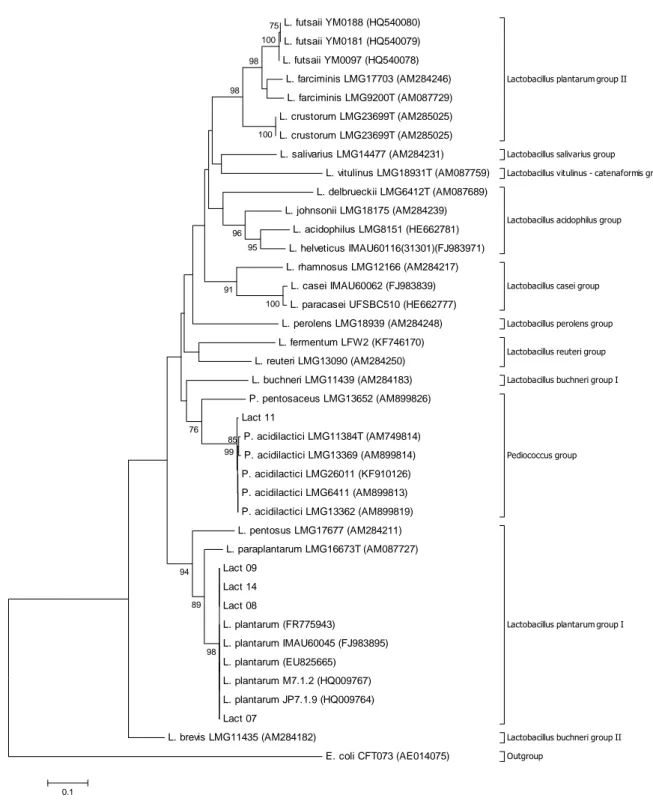
5.1 Identificação molecular das linhagens de BAL e análise filogenética ... 54
5.2 Caracterização e identificação bioquímica das linhagens de BAL... 60
5.3 Crescimento de linhagens de BAL em meio MRS modificado... 61
5.4 Cálculo do rendimento e parâmetros cinéticos da fermentação lática em meio MRS modificado ... 66
5.5 Modelos matemáticos para fermentaçãoo lática ... 69
5.6 Fermentação semi-sólida de cabeças de camarão... 75
5.7 Desempenho do consórcio de BAL na fermentação das cabeças de camarão ... 79
5.8 Preparo das rações de alevinos de tilápia ... 81
5.9 Parâmetros limnológicos ... 83
5.10 Desempenho zootécnico dos alevinos de Tilápia ... 85
6 DISCUSSÃO ... 94
7 CONCLUSÕES ... 118
8 CONSIDERAÇÕES FINAIS ... 119
1 APRESENTAÇÃO DO PROBLEMA
A carcinicultura é o segmento da aquicultura que mais cresce no mundo, no Brasil e, em particular, no Nordeste. A região Nordeste concentra 88% dos produtores de camarão e é responsável por 93 % da produção nacional. Nesse cenário, o Ceará desponta como o Estado que mais produz camarão em cativeiro. A produção do Estado em 2014 foi aproximadamente 100 mil toneladas, superando as 85 mil toneladas registradas em 2013. Tal volume tem capacidade de gerar um fluxo de até R$ 600 milhões em negócios e mais de 15 mil empregos diretos.
Concomitante ao crescimento da carcinicultura cresce a produção de resíduos líquidos e sólidos gerados nessa cadeia. A produção de resíduos sólidos é inevitável, pois cerca de 40 a 50 % do peso do camarão, correspondente a cabeça, cauda, casca, olhos e antenas, que são descartados como resíduos. Como se trata de um resíduo muito perecível, requer imediata e adequada disposição para evitar contaminação ambiental. Portanto, a carcinicultura enfrenta um grande desafio, que é combinar o crescimento da produção com a redução dos impactos ambientais. Nessa equação, a reciclagem é uma alternativa viável e ecologicamente correta para tratar esses resíduos e representa a melhor opção para os municípios produtores se adequarem rapidamente a nova lei brasileira de resíduos sólidos.
Dentre as formas de reciclagem, a fermentação lática surge como uma boa opção para a transformação de resíduos de carcinicultura em produtos de alto valor agregado, tais como quitina, proteínas, pigmentos e minerais, principais constituintes do exoesqueleto dos crustáceos. O processo fermentativo, entretanto, apresenta gargalos tecnológicos que precisam ser vencidos antes de se tornar uma atividade econômica.
Nesse contexto, esse estudo se aprofundou no processo de fermentação lática para reciclar cabeças de camarão descartadas pela carcinicultura no Ceará, investindo no estudo de novas linhagens de bactérias do ácido lático e na análise do modelo matemático do processo fermentativo, visando sua otimização. Como inovação e avanços trazidos por esse estudo destacam-se formação de um consórcio de bactérias láticas que apresentam maior produção de ácido lático e a incorporação do líquor resultante da fermentação, na ração de alevinos de tilápia em fase de reversão sexual.
2 REVISÃO BIBLIOGRÁFICA
2.1 Aquicultura no mundo e no Brasil
A produção de pescado no mundo é subdividida em pesca e aquicultura. A pesca, de acordo com a finalidade econômica e social, pode ser considerada como amadora, industrial ou artesanal (BRASIL, 2013). Ela pode ser definida como a extração de organismos aquáticos do hábitat onde eles vivem, como rios, lagos, oceanos e mares, para fins como alimentação, recreação, ornamentação e para a fabricação de insumos para a indústria de ração animal (OLIVEIRA; SANTOS, 2011).
A aquicultura compreende a produção em cativeiro de qualquer organismo, como peixes, anfíbios, crustáceos e moluscos, cujo ciclo de vida ocorra, integral ou parcialmente, em ambiente aquático (RANA, 1997).
Atualmente, as possibilidades concretas de expansão do setor pesqueiro natural estão praticamente esgotadas. A aquicultura torna-se uma alternativa para o suprimento deste mercado que apresenta tendência crescente devido ao fato do pescado representar um alimento saudável e de elevado interesse pela população em todas as faixas de renda (EMBRAPA, 2005; MPA, 2011). A aquicultura, em 2012, respondeu por 90,4 milhões de toneladas de pescado produzido no mundo. Desse total 41,9 milhões de toneladas foram produzidas pela aquicultura continental, sendo que os peixes de escama representaram 57,9% (38 milhões de toneladas) da produção aquícola mundial (FAO, 2006).
No Brasil, semelhantemente à ordem mundial, a exploração dos recursos pesqueiros apresentou um decréscimo superior a 30%, entre 1975 a 2005. Enquanto isso, a aquicultura vem apresentando um crescimento gradual ano após ano (KUBITZA, 2008).
A aquicultura, no Brasil, é uma atividade zootécnica que vem se destacando como alternativa econômica para o pequeno e médio produtor, sendo propícia ao aproveitamento de áreas improdutivas, transformando-as e elevando sua potencialidade e produtividade (FIGUEIREDO; VALENTE, 2008). Ademais, o potencial brasileiro para o desenvolvimento da aquicultura é imenso, pois o país é constituído por 8.400 km de costa marítima, 5.500.000 ha de reservatórios de água doce, 12% da água doce disponível no planeta, clima extremamente favorável para o crescimento dos organismos cultivados, mão-de-obra abundante e crescente demanda por pescado no mercado interno (OLIVEIRA et al., 2006).
%, enquanto a aquicultura mundial cresceu 187 %. Neste mesmo período, o Brasil que se encontrava na 36ª colocação em 1990 ocupou a 19ª posição em 2001 (FAO, 2006).
Em 2010, a produção aquícola nacional foi de 479.399 t representando um incremento de 15,3 % em relação à produção de 2009. Seguindo a tendência de anos anteriores, a maior parcela da produção aquícola foi oriunda da piscicultura que representou 82,3 % da produção total nacional. Em 2010, a Região Sul assinalou a maior produção de pescado do país, com 133.425 toneladas, respondendo por 33,8% da produção aquícola nacional. Em seguida, por ordem decrescente, as principais regiões produtoras de peixes provenientes de cultivo foram Nordeste, Sudeste, Centro-Oeste e Norte registrando produção de 78, 70, 61 e 41 mil toneladas, respectivamente. A análise da produção nacional de pescado por Unidade da Federação em 2010 demonstrou que todos os estados brasileiros apresentaram um incremento na produção de origem aquícola de 2009 para 2010. O Ceará é líder na produção de pescado, apresentando uma produção de 25.726 toneladas. As principais espécies de peixes utilizadas na aquicultura dessas regiões são: tilápia (Oreochromis niloticus), carpa (Cyprinus carpio), tambaqui (Colossoma
macropomum) e curimatã (Prochilodus lineatus) (MPA, 2011). Seguindo esta linha, em 2011
a produção atingiu a marca de 628 mil toneladas (PINHEIRO, 2014). Ainda em 2011, a produção de pescado atingiu 253 mil toneladas, representando 40,24 % da produção aquícola brasileira (GONÇALVES, 2014).
A taxa de crescimento/ano da aquicultura supera todas as outras atividades zootécnicas e, nesse contexto, o Brasil apresenta crescimento superior a 25 % ao ano (FAO, 2006). Este cenário de crescimento pode ser atrelado ao desenvolvimento do setor aquícola em consequência da ampliação de políticas públicas que facilitaram o acesso aos programas governamentais existentes, tais como o Plano Mais Pesca e Aquicultura desenvolvido pelo Ministério da Pesca e Aquicultura (MPA, 2011). No entanto, embora o Brasil apresente condições de produzir, de maneira sustentável, 20 milhões de toneladas de pescados por ano, o principal entrave para o país alcançar posição de destaque na aquicultura mundial é a baixa competitividade para exportação, especialmente de tilápias, necessitando, portanto, de investimentos no setor e consolidação do segmento como ocorreu na área de frigoríficos de carne bovina (MENDES; VELOSO, 2012).
estivessem envolvidos com o setor (SCORVO FILHO, 2006). Atualmente, existe uma tendência crescente de intensificação e fortalecimento de integração entre os setores pesqueiros, especialmente, em decorrência da demanda crescente por produtos com elevado valor nutritivo como aqueles preparados a base de pescado. Desta forma, torna-se necessária a realização de pesquisas direcionadas para obtenção de uma produção cada vez mais eficiente e sustentável (REIS NETO, 2012).
2.2 Aquicultura e a Tilápia do Nilo (Oreochromis niloticus)
As tilápias apresentam escamas grandes, pouco brilhantes, listras nítidas verticais, colorações esbranquiçadas no ventre e prateada no dorso. Além disso, aceitam uma variedade ampla de alimentos, tendendo a onívoros e, a temperatura da água de cultivo que pode variar de forma ótima entre 28 a 32 ºC (JUNIOR, 2006; MONTEIRO, 2013).
Na década de 80 as tilápias foram taxonomicamente agrupadas em dois gêneros principais, de acordo com suas características reprodutivas: Oreochromis e Sarotherodon. No entanto, apenas quatro espécies do gênero Oreochromis atingiram destaque na aquicultura mundial: a tilápia do Nilo (O. niloticus); a tilápia de Moçambique (O. mossambicu); a tilápia azul ou áurea (O. aureus) e a tilápia de Zanzibar (O. urolepis hornorum) (KUBITZA, 2000a).
No Brasil, a tilápia do Nilo (Figura 1) devido a características essenciais para a piscicultura, como fácil adaptação a diversos tipos de criação, precocidade da maturação sexual e elevado índice de conversão alimentar, se tornou um empreendimento de sucesso (MARENGONI, 2006; FITZSIMMONS, MARTINEZ-GARCIA; GONZALES-ALANIS, 2011).
Figura 1 - Tilápia do Nilo (Oreochromis niloticus).
Em 1971, a tilápia foi introduzida no Nordeste do Brasil, sendo o estoque formado por 60 indivíduos provenientes da Estação de Piscicultura de Bouaké, Costa do Marfim, África, por meio do Departamento Nacional de Obras Contra as Secas (DNOCS), em Pentecoste, estado do Ceará (SIMÕES et al., 2007).
Neste mesmo período, surgiram os empreendimentos pioneiros e a tilapicultura firmou-se como atividade empresarial no país. O Paraná foi o primeiro estado brasileiro a promover uma organização racional desta atividade, inclusive com a implantação de frigoríficos especializados no beneficiamento dessa espécie (FIGUEIREDO; VALENTE, 2008).
A tilápia desova de forma espontânea quando em cativeiro e devido à precocidade reprodutiva e baixa ingestão de alimento ou mesmo ausência de alimentação pela fêmea no período em que adota cuidado parental, notadamente nas fases de ovo, larva e pós-larva, a preferência é por criar machos. Os machos podem ser obtidos mediante administração de hormônio esteroide. Nessa técnica o hormônio sintético androgênico é empregado antes ou durante a fase de diferenciação sexual, vindo os peixes a desenvolverem testículos e a apresentarem características sexuais masculinas quando maduros (FERDOUS; ALI, 2011).
O hormônio androgênico 17α–metiltestosterona, administrado oralmente via incorporação na ração, é o mais empregado (ASAD et al., 2010). A ração utilizada apresenta consistência de pó (SILVA, 2009), com teores de proteína bruta que variam de 30 % (ASAD et
al., 2010), 45 % (ZANARDI et al., 2011) a 56% (MATOS, 2003), sendo administrada por 21
(KUBITZA, 2000b), 28 (FERDOUS; ALI, 2011) e até por 30 dias (ASAD et al., 2010), na taxa alimentar de 15 a 20 % do peso vivo por dia e parcelada em quatro ou mais refeições (SILVA, 2009).
Comercialmente, o ciclo de produção da tilápia inicia-se com os alevinos até atingirem em média 30 gramas e, em seguida, tem-se a fase de engorda e, posteriormente, o abate (MONTEIRO, 2013). A tilápia do Nilo é comercializada com peso entre 400 a 700 g, variando em função do mercado consumidor, podendo ser vendido até com 1200 g. O tempo necessário para que atinja o tamanho comercial pode variar de cerca de quatro meses a um ano, em função de uma série de fatores, como o tipo de alimentação, temperatura, qualidade da água de cultivo, densidade de estocagem, entre outros (LEITE, 2009).
-1, crescerem bem em águas com salinidade de 0 a 15, sobreviverem em água com pH variando entre 6 e 9 e serem mais tolerantes a nitrito (FIGUEIREDO; VALENTE, 2008; FITZSIMMONS, MARTINEZ-GARCIA; GONZALES-ALANIS, 2011). Além disso, referida espécie possui carne de qualidade superior, tais como ausência de espinhas em “Y”, carne branca de textura firme, sabor delicado e agradável (CONTE, 2002), resultando em elevada aceitação dos consumidores no mercado nacional e internacional (PEREIRA; GAMEIRO, 2007).
Em relação ao valor nutritivo, o filé de tilápia do Nilo possui em média 75% de água, entre 3,4 a 8,5 % de lipídeos, 20 % de proteína e 2 % de minerais, sendo que a composição nutricional pode variar em função da composição da dieta, do manejo alimentar, da idade e do tamanho dos peixes (MONTEIRO, 2013).
Atualmente, a tilápia (O. niloticus) é a espécie mais cultivada no Brasil, podendo ser produzida em praticamente todo o território nacional. Em 2010, representou 39,4 % do total de pescado proveniente da piscicultura nacional, totalizando 155.450 toneladas, ultrapassando a produção de carpas que contribuiu com 94.579 toneladas neste mesmo ano (MPA, 2011).
2.3 Nutrição e alimentação de Tilápias do Nilo
Em ambientes confinados, os peixes não dispõem de alimento em quantidade e de qualidade que atendam às exigências nutricionais para desempenho produtivo e reprodutivo ótimos. Em função disto, faz-se necessário o uso de rações comerciais que atendam às exigências em energia e nutrientes para garantir adequado desempenho produtivo e retorno econômico. No entanto, as rações podem compor 40 a 70 % do custo de produção, representando o principal item de custo na piscicultura intensiva de tilápias. Portanto, uma das maneiras mais eficazes dos produtores minimizarem este custo é ajustar adequadamente a qualidade das rações e o manejo alimentar às diferentes fases de produção, sistema de cultivo utilizado, a linhagem, estado fisiológico, parâmetros físico-químicos da água e, principalmente, respeitando o tipo de alimento e sua proporção na composição das rações o que influencia diretamente nas exigências nutricionais dos peixes (KUBITZA, 1999; FURUYA et al., 2010).
melhora a tolerância dos peixes ao manuseio e transporte vivo; aumenta o desempenho reprodutivo das matrizes e a qualidade das pós-larvas e alevinos; e, consequentemente, possibilita aperfeiçoar a produção e maximizar as receitas da piscicultura (KUBITZA, 1999).
Através dos alimentos disponíveis ou oferecidos, os animais devem obter suficientes quantidades de nutrientes essenciais de forma a garantir a normalidade de seus processos fisiológicos e metabólicos, assegurando adequado crescimento, saúde e reprodução. De uma forma geral, com algumas particularidades dependendo da espécie, é reconhecido que os peixes apresentam exigências em pelo menos 44 nutrientes essenciais, que incluem a água, aminoácidos essenciais, energia, ácidos graxos essenciais, vitaminas, minerais e carotenoides (KUBITZA, 1999).
A proteína é o principal componente visceral e estrutural do organismo animal, sendo necessário seu contínuo suprimento alimentar para atender às exigências de manutenção e produção. A composição de aminoácidos é extremamente importante na ração para assegurar o máximo crescimento dos animais (FURUYA et al., 2010). Sinais indicativos da deficiência em proteínas e aminoácidos é o atraso no crescimento, piora na conversão alimentar, redução no apetite e, em alguns casos, deformidades na coluna e aparecimento de catarata (KUBITZA, 1999).
Paralelamente, os animais necessitam de energia para a manutenção de processos fisiológicos e metabólicos vitais, para as atividades rotineiras, o crescimento e a reprodução. Esta energia provém do metabolismo de carboidratos, lipídios e proteínas. Os peixes são mais eficientes no uso da energia comparados às aves e aos mamíferos, pois não gastam energia para regular a temperatura corporal. Desta forma, grande parte da energia é utilizada para crescimento. Este é um dos fatores que explicam os melhores índices de conversão alimentar dos peixes (0,9 a 1,8) comparados às aves (1,6 a 1,9) e suínos (2,5 a 2,9) (KUBITZA, 1999). Tilápias aproveitam bem carboidratos e gorduras como fonte de energia, poupando assim a proteína das rações para o crescimento ao contrário do que ocorre com os peixes carnívoros, que utilizam os lipídios mais eficientemente que os carboidratos como fonte de energia (FURUYA et al., 2010).
composição corporal, o padrão de lipoproteínas plasmáticas, a função imunológica e melhora a conversão alimentar em tilápias (BOSCOLO et al., 2004). Além disso, servem como fonte de energia, principalmente para as espécies carnívoras que apresentam baixa capacidade de aproveitamento de carboidratos. Os sinais de deficiência em ácidos graxos são atraso no crescimento, redução na eficiência alimentar, podridão das nadadeiras, síndrome do choque, reduzido desempenho reprodutivo e alta mortalidade (KUBITZA, 1999).
Minerais e vitaminas desempenham papel importante na formação dos tecidos ósseos e sanguíneos, no crescimento muscular e em diversos processos metabólicos e fisiológicos essenciais para o adequado crescimento, saúde e reprodução dos animais. Embora as exigências minerais e vitamínicas dos principais peixes cultivados já sejam conhecidas, até o momento pouca atenção foi dada a este assunto na nutrição das tilápias. Uma das razões está no fato da maioria dos sistemas de cultivo destes peixes contarem com a contribuição de alimentos naturais, reduzindo os problemas nutricionais devido à deficiência de minerais e vitaminas nas rações. No entanto, as exigências da maioria dos minerais são satisfeitas através dos minerais presentes nos alimentos naturais e nas rações (KUBITZA, 1999). Vale ressaltar, que a exigência nutricional em minerais dos peixes é atendida, em grande parte, pela absorção pelas brânquias e pele, como por exemplo, a absorção do cálcio. Porém, esta absorção pode ser afetada pela composição química da água e pelas características das espécies (FURUYA et al., 2010).
2.4 A carcinicultura no Brasil
Figura 2– Camarão branco do Pacífico (Litopenaeus vannamei, Boone, 1931).
Fonte: www.ictioterm.es
Este crescimento continua vigoroso, e se deu em muitos aspectos, nos moldes do que já havia ocorrido nos países do sudeste asiático, sem ordenamento adequado, sem regulamentação, com forte incentivo governamental e geração de impactos ambientais e sociais graves. Em 2004, a Associação Brasileira de Criadores de Camarão (ABCC) previu a continuidade desta tendência no crescimento da aquicultura, a previsão de cobertura de 30.000 ha área até 2007. Porém, com a diminuição do valor do dólar e a propagação do vírus causador da mionecrose infecciosa (IMNV), a atividade estagnou (ABCC, 2005).
No entanto, os números demonstram a magnitude que esta atividade vem retomando no país, pois encontramos hoje uma área de aproximadamente 20.000 ha de viveiros implantados, contrastando com pouco mais de 3.500 ha em 1997, um crescimento superior a 500% no período (ABCC, 2013). Isto levou o Brasil a se tornar o maior produtor da América Latina. O prognóstico é de continuidade desta tendência de crescimento (SANTOS, 2005; QUEIROZ et al., 2013). Além disso, outra característica deste setor é que cerca de 80% dos produtores são considerados micro ou pequenos produtores. Vale ressaltar que com as dificuldades de exportação, em 2011 aproximadamente 99 % de toda a produção foi absorvida pelo mercado interno, e este aumento da procura interna continua nos últimos anos (ABCC, 2010).
O Ceará ocupa o primeiro lugar na produção nacional, com o estado do Rio Grande do Norte, como segundo produtor, produzindo em 2011, aproximadamente 18.000 toneladas. Vale ressaltar que o Ceará ocupa o primeiro lugar em produtividade, com 4.855 kg/ha/ano, superior à média nacional em aproximadamente 40 % (QUEIROZ et al., 2013).
A carcinicultura representa uma opção valiosa para o Nordeste, podendo levar ao aumento da oferta proteica de baixo custo para a população e ao aumento da oferta de empregos (CARVALHO, 2010). Entretanto, a intensificação da carcinicultura tem gerado sérios problemas ambientais, intensificados pelos conflitos com as comunidades tradicionais e a utilização de áreas de manguezais. Além disso, os danos ambientais também estão relacionados com a diminuição da produtividade pesqueira, liberação acidental de espécies exóticas de camarão, competição com as espécies nativas, disseminação de doenças, lançamento de efluentes sem prévio tratamento nos corpos hídricos, salinização do solo e do lençol freático (SANTOS, 2005; POLIDORO et al., 2010).
Aproximadamente 40-50% do peso total dos crustáceos, como camarão, caranguejo e lagostas se transformam em resíduos. Consequentemente, esta atividade gera uma grande quantidade de resíduos durante o beneficiamento. A falta de um destino adequado, visto que esses resíduos são geralmente despejados a céu aberto ou enterrados de forma inapropriada na zona costeira, ocasiona mais um sério problema de poluição ambiental (BHASKAR et al., 2007). Considerando que esses resíduos contêm de 15-20 % de quitina, 25-40 % de proteínas e 40-55 % de sais inorgânicos, além de pigmentos carotenoides, constata-se que estes resíduos na verdade são produtos com grande potencial econômico e que toneladas destes estão sendo desperdiçadas. Assim, o reaproveitamento de resíduos da carcinicultura pode significar uma forma inovadora e rentável para reduzir a poluição ambiental causada por essa atividade (CARVALHO, 2010; SONGSIRIRITTHIGUL et al., 2010; GHORBEL-BELLAAJ et al., 2013).
2.5 Composição dos resíduos do camarão branco do Pacífico
A quitina é a segunda maior fonte de carboidratos na natureza, é amplamente distribuído como um componente estrutural de exoesqueletos de insetos e crustáceos, outros artrópodes, bem como um componente das paredes celulares de alguns fungos e algas. É um homopolímero linear insolúvel de β -(1 → 4) N-acetil-d-glucosamina (GlcNAc) e não tóxico. A unidade estrutural de repetição de quitina é um dímero de GlcNAc (MUZZARELLI et al., 2012). A quitina e seus derivados, como a quitosana e os oligoquitossacarídeos, tem muitas aplicações importantes nas áreas de alimentos, farmacêutica, agricultura, bioengenharia, cosméticos e outras áreas afins (DUAN et al., 2012). A quitina é um produto natural de composição variável quanto ao comprimento das cadeias, unidades de glicosamina acetiladas e desacetiladas e quanto a sua distribuição ao longo das cadeias. Além disso, podem ocorrer variações na composição da quitina em função da espécie de crustáceo considerada, bem como do estágio de desenvolvimento do animal (CARVALHO, 2010).
Os pigmentos presentes no exoesqueleto de crustáceos pertencem à classe dos carotenoides. A astaxantina é o carotenoide lipossolúvel mais abundante em animais aquáticos, tais como salmão, truta, camarão e lagosta. Quanto à saúde humana, os seus potenciais estão associados com suas propriedades antioxidantes. Tem sido relatado que a astaxantina tem até dez vezes mais atividade antioxidante do que os outros carotenoides, tais como zeaxantina, luteína, cantaxantina e caroteno. Assim como os crustáceos, os mamíferos, incluindo os seres humanos, são incapazes de sintetizar carotenoides ou de convertê-los em vitamina A, e, consequentemente, devem ser fornecidos na dieta. Além disso, têm importantes aplicações em fármacos, indústrias de cosméticos, alimentos e como fonte de pigmentação na aquicultura (de crustáceos e salmonídeos), sendo este último seu principal mercado. Apesar de mais de 95% da astaxantina utilizado na aquicultura ser fornecida por via sintética, existe uma necessidade crescente por alimentos naturais, visto que esses pigmentos naturais são mais facilmente absorvidos do que os sintéticos. Inclusive, o custo elevado dos pigmentos sintéticos tem estimulado pesquisas de fontes naturais para este ingrediente nutracêutico, com bom potencial para a industrialização (HANDAYANI et al., 2008; CAHÚ et al., 2012; SÁNCHEZ-CAMARGO et al., 2012).
doenças coronarianas, diabetes, artrite, alguns tipos de câncer e osteoporose. Na última década, a importância de um consumo equilibrado deste tipo de PUFA foi reconhecida e recomendada por diferentes organizações de saúde de todo o mundo (SIMOPOULOS, 2008; SAHENA et al., 2009; SÁNCHEZ-CAMARGO et al., 2012).
2.6 Tecnologias para reciclagem de resíduos da carcinicultura
A criação de camarão em cativeiro gera uma grande quantidade de resíduos sólidos, pois a cabeça, a casca e a cauda são geralmente removidos durante o beneficiamento do camarão, e esses resíduos representam aproximadamente 40 a 50 % do peso da matéria prima inicial (GHORBEL-BELLAAJ et al., 2011). Esses resíduos são um excelente meio de cultura para os microrganismos, pois apresentam fatores intrínsecos e extrínsecos que favorecem o crescimento microbiano, sendo, por isso, facilmente contaminados, a menos que sejam rapidamente e adequadamente tratados por métodos químicos (ABDOU; NAGY; ELSABEE, 2008), enzimáticos (GHORBEL-BELLAAJ; JELLOULI; YOUNES, 2011), ou microbiológicos (GHORBEL-BELLAAJ et al., 2012).
Os métodos químicos envolvem a desmineralização com ácidos fortes (HCl), seguido da desproteinização com bases fortes (NaOH) a 90 °C - 100 °C (GHORBEL-BELLAAJ
et al., 2013). Esse processo, entretanto, além de gerar resíduos líquidos poluentes, provocam
demasiada hidrólise da quitina (despolimerização), resultando em uma quitina de baixa qualidade, além do que as proteína e pigmentos são perdidos durante o tratamento.
O aumento da demanda social por práticas mais amigáveis aos ecossistemas tem impulsionado o desenvolvimento de novas tecnologias. Assim, as metodologias enzimáticas (SYNOWIECKI; AL-KHATEEB, 2000) e fermentativas (RAO; MUÑOZ; STEVENS, 2000; CIRA; HUERTA; SHIRAI, 2002; CIRA et al., 2002; PRAMEELA et al., 2010) para o reaproveitamento dos resíduos da carcinicultura têm atraído grande interesse.
O método enzimático inclui o tratamento dos resíduos com enzimas como alcalases (endopeptidases serínicas), tripsina, papaína ou pepsina. No entanto, o alto custo das enzimas e a baixa eficácia de extração são alguns dos problemas desta tecnologia (GHORBEL-BELLAAJ
et al., 2013).
substrato, acidifica o meio, inibindo o desenvolvimento de microrganismos deteriorantes. O ácido lático reage com o carbonato de cálcio ligado à quitina levando à formação de lactato de cálcio, que precipita e pode ser removido por lavagem, deixando a quitina livre. A desproteinização ocorre pela ação combinada de enzimas proteolíticas da própria cultura adicionada no processo fermentativo e de proteases de origem do camarão e presentes no resíduo. Pigmentos e proteínas são extraídos juntos e compõem o líquor resultante da fermentação, podendo ser subsequentemente separados por métodos químicos. A eficiência da fermentação depende de vários fatores, incluindo o tipo e quantidade do inóculo, fonte de carbono usado como substrato (tipo e concentração), pH inicial e evolução durante a fermentação e o tempo de fermentação (RAO; MUÑOZ; STEVENS, 2000; OH et al., 2007; PRAMEELA et al., 2010)
Assim, ao final do processo de fermentação láctica de resíduos de camarão se obtêm duas frações, uma sólida, formada basicamente de quitina, e uma líquida, denominada “líquor” rico de proteínas hidrolisadas e pigmentos. Vale ressaltar que a hidrólise proteica se refere a qualquer método em que as proteínas são quebradas por enzimas, diminuindo o seu tamanho, tornando este produto uma fonte mais disponível de aminoácidos. Esses hidrolisados encontram aplicações em produtos farmacêuticos, na nutrição humana, na alimentação animal, ou em cosmética. Além disso, também são úteis como fonte de nitrogênio em meios de crescimento para microrganismos. Recentemente, hidrolisados proteicos, extraídos de subprodutos marinhos, tornaram-se populares na indústria de alimentos devido à valiosa composição de aminoácidos (BUENO-SOLANO et al., 2009; CHEUNG; LI-CHAN, 2014; ROBERT et al., 2014).
2.7 Bactérias do ácido lático (BAL)
Bactérias do ácido lático (BAL) compreendem bastonetes e cocos gram-positivos, não formadores de esporos, anaeróbios facultativos ou microaerófilos, ácido-tolerantes, fastidiosos, geralmente catalase-negativos, com metabolismo estritamente fermentativo, tendo o ácido lático como principal produto final do metabolismo dos carboidratos (KLEIN et al., 1998; GIRAFFA, CHANISHVILI; WIDYASTUTI, 2010). São classificadas como homofermentativas, quando produzem apenas ácido lático, e heterofermentativas, quando convertem os açúcares em ácido lático , ácido acético, etanol e dióxido de carbono (POT e TSAKALIDOU, 2009; GIRAFFA, CHANISHVILI; WIDYASTUTI, 2010).
Filogeneticamente, as BAL pertencem ao filo Firmicutes, classe Bacilli, ordem Lactobacillales, que compreende as famílias Aerococcaceae, Carnobacteriaceae, Enterococcaceae, Lactobacillaceae, Leuconostocaceae e Streptococcaceae. Atualmente, são reconhecidos cerca de 20 gêneros de BAL, dentre os quais, Aerococcus, Carnobacterium,
Enterococcus, Lactobacillus, Lactococcus, Leuconostoc, Oenococcus, Pediococcus,
Streptococcus, Tetragenococcus, Vagococcus e Weissella são considerados os principais
gêneros associados com alimentos (AXELSSON, 2004).
A família Lactobacillaceae, descrita por Winslow et al. (1917), filogeneticamente compreende os gêneros Lactobacillus, Paralactobacillus e Pediococcus (SCHLEIFER; LUDWIG, 1995). A diversidade da família Lactobacillaceae é profundamente influenciada pela riqueza de espécies do gênero mais abundante, Lactobacillus, que apresenta características variáveis em termos de morfologia, motilidade, habilidade fermentativa, requerimentos nutricionais e tolerância ao oxigênio. Dentro desse gênero são reconhecidas centenas de espécies, cuja identificação requer, na maioria dos casos, análises morfológicas, bioquímicas e moleculares complementares.
Tradicionalmente, a classificação de microrganismos se inicia pela análise de suas características fenotípicas (SINGH et al., 2009), como a forma das células e das colônias, presença de endosporos ou inclusões, o número e o tipo de flagelos, o tamanho das células etc (POT; TSAKALIDOU, 2009).
baseados em características fisiológicas e bioquímicas, tais como API 20 STREP, API 50 CH (BioMérieux), Diatabs (Rosco) ou BIOLOG GP MicroPlate (BIOLOGI Inc.) (POT; TSAKALIDOU, 2009), que auxiliam na identificação precisa de espécies de alguns gêneros de bactérias e leveduras.
Dentre os métodos independentes de cultivo ou moleculares para identificação de microrganismos, destacam-se a reação em cadeia da polimerase (PCR) e suas variações, tais como análise de ribotipagem (CHAGNAUD et al., 2001); PCR-multiplex (KWON et al., 2004), reação de DNA polimórfico amplificado aleatoriamente (RAPD) (ONECA et al., 2003), eletroforese em gel de gradiente desnaturante (DGGE) (THEUNISSEN et al., 2005), ou polimorfismo de conformação de filamento único (SSCP) (GODON; MONTEL, 2003); ou ainda métodos baseados na combinação destas duas abordagens, como análise de restrição de DNA ribossomal amplificado (ARDRA) (SOTO et al., 2010); e abordagens por sequenciamento, como sequenciamento de regiões variáveis dentro do gene RNAr 16S ou de regiões intergênicas espaçadoras 16S-23S (SINGH et al., 2009; TSAI et al., 2010). Embora o sequenciamento do gene RNAr 16S seja o método mais utilizado para a identificação de bactérias, sabe-se também que a resolução taxonômica deste gene muitas vezes não é suficiente para identificar com precisão em nível de espécie, e isto também ocorre com as linhagens de BAL (CACHAT; PRIEST, 2005). Para contornar este problema inerente ao gene RNAr 16S, sugere-se a utilização de genes de manutenção (housekeeping), tais como a subunidade α da fenilalanina-tRNA sintetase (pheS) e a subunidade α da RNA polimerase (rpoA) (NASER et
al., 2007; NGUYEN et al., 2013).
2.8 Aplicações biotecnológicas de Lactobacillus
As espécies de Lactobacillus podem ser encontrados em uma grande variedade de nichos ecológicos, como plantas, animais, e alimentos, como laticínios, carnes e bebidas. A capacidade de colonizar tal variedade de hábitats é uma consequência direta da grande versatilidade metabólica deste grupo. Devido a estas características, as bactérias deste genêro normalmente são usadas funcionalmente como probióticos, iniciadores lácteos, conservantes alimentares e inoculantes em silagens (AGUIRRE-EZKAURIATZA et al., 2010; GIRAFFA, CHANISHVILI; WIDYASTUTI, 2010).
potencialmente prejudiciais e reforçam os mecanismos de defesa natural do organismo. Muitos estudos têm demonstrado a eficácia dos probióticos em oferecer uma alternativa adequada para o uso de antibióticos no tratamento de infecção entérica (NEMETH; FAJDIGA, 2006) e redução dos sintomas da diarreia (SRINIVASAN; MEYER, 2006). Atualmente existem muitas evidências sobre os efeitos positivos dos probióticos para a saúde humana (AGUIRRE-EZKAURIATZA et al., 2010; GIRAFFA, CHANISHVILI; WIDYASTUTI, 2010; GUIDONE
et al., 2014).
Os iniciadores lácteos são intencionalmente adicionados ao leite para criar um produto final desejado, que na maioria das vezes ocorre devido às atividades metabólicas dos microrganismos. O uso mais comum desses iniciadores é para a produção de ácido lático a partir da lactose presente no leite, o qual auxilia na coagulação das proteínas do leite devido a diminuição do pH. Além disso, certos iniciadores são adicionados especificamente para a produção de compostos aromatizantes, bacteriocinas e exopolissacarídeos que podem influenciar no sabor, textura e qualidade nutricional dos produtos através da hidrólise de proteínas, gorduras e outros componentes do leite. A diminuição do pH dos produtos fermentados pode ajudar na inibição de determinados microrganismos que poderiam causar a deterioração da matéria prima, embora a inibição também esteja associada com outros produtos derivados, tais como peróxido de hidrogênio. Os iniciadores usados hoje na indústria de laticínios são compostos de linhagens de BAL, que estavam originalmente presentes como parte integrante da microbiota do leite(DE VRIES et al., 2006; AGUIRRE-EZKAURIATZA et al., 2010; GIRAFFA, CHANISHVILI; WIDYASTUTI, 2010).
Os lactobacilos também são bastante utilizados na fermentação e produção de alimentos sólidos, devido à ação conservante dos ácidos, sendo usados para o aperfeiçoamento do sabor, textura e nutrição. Os lactobacilos são usados como culturas iniciadoras ou complementares para diversas variedades de alimentos, como vegetais fermentados, como a mostarda (CHAO et al., 2012), o capim (HEINL et al., 2012) e o milho (REICH; KUNG, 2010), carnes fermentadas, como salsichas (RUBIO et al., 2014), e na produção de pão, vinhos e cervejas. Além disso, também são utilizados na transformação de resíduos em produtos com alto valor agregado, como nas fermentações de resíduos do abate de frangos (DE SÁ et al., 2011), mexilhão (VÁZQUEZ et al., 2010) e cabeça de camarão (DUAN et al., 2012; PROBST
et al., 2013).
o pH da forragem e inibe o crescimento de microrganismos aeróbicos contaminantes. A silagem requer várias semanas para finalizar, além disso é um processo complexo e, por vezes imprevisível, pois envolve muitas espécies de BAL, sendo possível que ocorram interações inesperadas entre elas (GIRAFFA, CHANISHVILI; WIDYASTUTI, 2010; GEBREHANNA
et al., 2014).
2.9 Cinética química e modelagem matemática aplicada à fermentação lática
No processo de fermentação lática em batelada simples a cultura é desenvolvida primeiramente em uma série de frascos e finalmente o inóculo final é transferido para o fermentador. O tamanho do inóculo geralmente é de 5 a 10 % (v/v) do volume do fermentador e a cultura é geralmente mantida entre 35 e 45 °C, com pH 5 - 6.5.
Além dos parâmetros fermentativos supracitados, uma série de outras variáveis podem ser otimizadas na produção de ácido lático, pois é sabido que a produtividade também é afetada pelo tempo de fermentação, o nível de substrato, a concentração dos açúcares e a velocidade de agitação, por exemplo. Assim, o estudo da cinética do processo fermentativo é essencial para o entendimento das transformações que ocorrem durante o processo, possibilitando assim quantificar a taxa de crescimento celular, o consumo de substrato e formação de produtos, além de avaliar a influência de fatores externos como pH, temperatura e inibidores e relacioná-los por meio de equações matemáticas (PINHEIRO, 2011; TANYILDIZI
et al., 2012; GHAFFAR et al., 2014).
A modelagem matemática de processos busca a proposição de um conjunto de relações entre as variáveis capaz de representar de forma adequada, dentro da precisão requerida, cada caso em particular, ou seja, organizar informações desconexas e identificar quais sistemas e interações são relevantes. Assim, é possível descobrir novas estratégias que permitam descrever o comportamento do processo em determinadas condições e entender as características qualitativamente importantes. Os modelos são estruturas que tentam descrever de forma aproximada a realidade. Esta descrição aproximada é função da necessidade do modelo se basear em um conjunto de observações experimentais, as quais são corrompidas por erros de medidas ou incertezas experimentais (PINHEIRO, 2011; MENDES; VALDMAN; SOUZA JÚNIOR, 2011).
Um modelo matemático é um conjunto de relações entre as variáveis em um sistema em estudo e geralmente pode predizer as variáveis de saída e o estado do sistema a partir das variáveis de entrada. Estas relações são normalmente expressas na forma de equações matemáticas, as quais são usadas na operação de um processo. Assim, as equações de balanço especificam como os materiais fluem dentro e fora do volume de controle e como são convertidos no interior do mesmo. Essa conversão interna no volume de controle é representada pelas equações cinéticas e, juntamente com o balanço de massa, especificam o modelo completo (MENDES; VALDMAN; SOUZA JÚNIOR, 2011).
A elaboração do modelo, juntamente com sua aplicação na simulação, reúne uma série de vantagens no momento de conhecer e melhorar o processo, tais como entender o comportamento do sistema, já que abrange as evoluções que seguem as diferentes variáveis, de modo a formular um modelo; a exploração do modelo mediante simulação ajuda a planejar o experimento, pois em pouco tempo se pode obter uma visão de quais variáveis afetam o processo e, portanto, estabelecer o tempo de duração para atingir os objetivos propostos; nesse sentido, a predição da evolução do processo permite detectar em que momento a operação vai mudar sua trajetória, de modo que se possam tomar decisões a tempo de corrigir e direcionar o processo para a produção ótima. O modelo, portanto, permite projetar estratégias de operação e controle; finalmente, a sua utilização didática, pois permite traçar diferentes situações do processo e, portanto, facilitar sua compreensão e estudo, o que de forma experimental seria mais difícil e demorado (MENDES; VALDMAN; SOUZA JÚNIOR, 2011)
3 OBJETIVO GERAL
Este estudo teve por objetivo desenvolver uma ração para alevinos de tilápia do Nilo contendo em sua composição um hidrolisado rico em proteínas e pigmentos carotenoides obtido a partir da fermentação de resíduos de cabeças de camarão por um consórcio selecionado de bactérias láticas.
3.1 Objetivos Específicos
• Identificar em nível de espécie as linhagens de bactérias láticas selecionadas usando dos métodos bioquímicos e moleculares;
• Selecionar linhagens de BAL mais eficientes para a produção de ácido lático baseada na análise de parâmetros cinéticos e modelagem matemática;
• Avaliar as linhagens de bactérias láticas quanto à eficácia na fermentação semissólida de resíduos de camarão em frascos;
• Montar, testar e analisar o melhor consórcio para a fermentação lática dos resíduos de camarão em biorreator;
• Confeccionar rações para alevinos de tilápia do Nilo contendo diferentes proporções do líquor obtido da fermentação de cabeça de camarão pelas BAL; • Avaliar as rações quanto aos parâmetros da qualidade de água e de desempenho
4. MATERIAIS E MÉTODOS
4.1 Bactérias do ácido lático (BAL)
As linhagens de BAL usadas neste trabalho foram previamente isoladas de diferentes amostras ambientais (CARVALHO, 2010) e estão depositadas na coleção de bactérias do Laboratório de Ecologia Microbiana Biotecnologia (LEMBIOTECH) do Departamento de Biologia, Universidade Federal do Ceará (Ceará, Brasil). Essas culturas são mantidas estocadas a -80 °C em meio Man, Rogosa e Sharpe (MRS) (MAN; ROGOSA; SHARPE, 1960) com 20 % de glicerol (m/v).
4.2. Resíduos da carcinicultura
Os resíduos usados nesse estudo foram constituídos unicamente de cabeças de camarão da espécie Litopenaeus vannamei, doados pelo frigorífico Cajucoco Aquacultura e Agroindústria localizado na Fazenda Santa Rita, Acaraú, Ceará.Esses resíduos foram mantidos congelados até o momento do uso.
4.3 Identificação molecular das linhagens de BAL
4.3.1 Extração do DNA genômico
O DNA genômico das linhagens de BAL foi extraído usando o protocolo do brometo de cetil-trimetilamônio (CTAB) (WARNER, 1996). As concentrações e qualidades das extrações de DNA foram avaliadas em espectrofotômetro Nanodrop® ND-1000 (NanoDrop, Wilmington, DE, EUA).
4.3.2 Amplificação e sequenciamento dos genes RNAr 16S, rpoA e pheS
O DNA genômico foi usado para amplificar os genes do RNAr 16S, da subunidade
μL contendo 100 ng de DNA genômico (molde), 20 mM Tris-HCl (pH 8,4), 50 mM KCl, 3,0 mM MgCl2, 0,2 mM de cada dNTP, 0,5 µM de cada iniciador e 0,04 unidades de Taq DNA Polimerase (MBI Fermentas Inc., USA). As reações de PCR foram feitas em termociclador programado para uma etapa de desnaturação inicial de 4 min a 94 °C, seguido de 35 ciclos de 1 min a 94 °C, 1 min a 55 °C e 2 min a 72 °C. O último ciclo foi seguido por uma extensão final de 10 min a 72 °C.
Os genes rpoA e pheS foram amplificadas por reação em cadeia da polimerase (PCR) usando os iniciadores 21-F (5’- ATG ATY GAR TTT GAA AAA CC -3’) e rpoA-23-R (5’- ACH GTR TTR ATD CCD GCR CG-3’); pheS-21-F (5′-CAY CCN GCH CGY GAY ATG C-3′) e pheS-23-R (5'-GGR TGR ACC ATV CCN GCH CC-3′) (NASER et al., 2007), respectivamente. A reação de PCR foi preparada para um volume final de 30 μL contendo 100 ng de DNA genômico (molde), 20 mM Tris-HCl (pH 8.4), 50 mM KCl, 3 mM MgCl2, 0,2 mM de cada dNTP, 0,5 μM de cada iniciador e 0,04 unidades de Taq DNA Polimerase (MBI Fermentas Inc., USA). As reações de PCR foram feitas em termociclador programado para uma etapa de desnaturação inicial de 5 min a 95 °C, seguido de 3 ciclos de 1 min a 95 °C, 2 min e 15 segundos a 46 °C e 1 min e 15 segundos a 72 °C, complementado por mais 30 ciclos de 35 segundos a 95 °C, 1 min e 15 segundos a 46 °C e 1 min e 15 segundos a 72 °C. O último ciclo foi seguido por uma extensão final de 10 min a 72 °C. Foi realizado uma modificação para a amplificação do gene rpoA para Lact 6, onde a temperatura de anelamento nos dois conjuntos de ciclos foi 56 °C.
Os produtos das amplificações foram analisados por eletroforese em gel de agarose 1% (m/v) corado com SYBR® Safe DNA (Invitrogen, USA). Os produtos foram purificados usando o Wizard® SV Gel e PCR Clean-up System (Promega Corporation, Madison, WI, USA). A concentração dos produtos finais foi determinada medindo-se a absorbância a 260 nm (A260) em espectrofotômetro Nanodrop® ND-1000.
Os produtos de PCR foram precipitados em etanol e enviados para sequenciamento na empresa Macrogen Inc., Seul, Coréia. As reações de sequenciamento foram realizadas utilizando os iniciadores 27F, 1525R, 518F (5'-CCA GCA GCC GCG GTA ATA CG-3 ') e 800R (5'-TAC CAG GGT ATC TAA TCC-3') para o gene RNAr 16S; e rpoA-21-F (5’- ATG ATY GAR TTT GAA AAA CC -3’) e rpoA-23-R (5’- ACH GTR TTR ATD CCD GCR CG-3’); pheS-21-F (5′-CAY CCN GCH CGY GAY ATG C-3′) e pheS-23-R (5′-GGR TGR ACC ATV CCN GCH CC-3', e o kit ABI PRISM® BigDyeTM Terminator Cycle
Sequencing (Applied Biosystems, Foster City, CA, EUA) em sequenciador ABI 3730 (Applied
As sequências parciais fornecidas pela empresa Macrogen Inc. foram de alta qualidade (Phred>20) e utilizadas para gerar sequências consenso usando o pacote Codon Code Aligner 5.1 (EWING; GREEN, 1998; EWING et al., 1998; GORDON, ABAJIAN; GREEN, 1998).
4.3.3 Análise Filogenética
A busca por sequências homólogas depositadas em bancos de dados públicos foi realizada usando o programa Basic Local Alignment Search Tool (BLAST) (ALTSCHUL, S.
et al., 1990). As sequências consenso obtidas foram alinhadas e comparadas com outras dos
gêneros Lactobacillus e Pediococcus para os genes RNAr 16S, pheS e rpoA depositadas no
GenBank (www.ncbi.nlm.nih.gov/). Todas as sequências obtidas neste estudo foram
depositadas no GenBank. O alinhamento múltiplo das sequências foi realizado com a ferramenta ClustalW (THOMPSON; HIGGINS; GIBSON, 1994) do programa BioEdit versão 7.1.3.0 (HALL, 1999). Os alinhamentos múltiplos obtidos foram então utilizados para gerar árvores filogenéticas utilizando o programa MEGA, versão 6.0 (TAMURA et al., 2013). O método Neighbor-Joining (SAITOU; NEI, 1987) foi utilizado usando o modelo Kimura 2-parâmetros de evolução de sequências para calcular as distâncias. A estabilidade dos clados gerados foi avaliada pelo teste de bootstrap (FELSENSTEIN, 1985) com 1000 reamostragens.
4.4 Identificação Bioquímica das BAL
Para a realização desse teste foram utilizados os sistemas de galeria API 50 CH (BioMérieux) e o meio para Lactobacillus API 50 CHL (BioMérieux) de acordo com as instruções do fabricante, realizadas a 37 °C, utilizando subcultivos em meio Agar MRS modificado por 24 h.
4.5 Crescimento das linhagens de bactérias láticas (BAL) em meio MRS modificado
O meio MRS modificado tem a seguinte composição (Tabela 1):
Tabela 1 – Composição do meio MRS modificado.
Componente Composição (g.L-1)
Sacarose 20
Peptona 10
Extrato de carne 10
Extrato de levedura 5
Polisorbato 80 1
Citrato de amônio 2
Acetato de sódio 5
Sulfato de magnésio 0,1
Sulfato de manganês 0,05
Fosfato dipotássio 2
pH final 6,5
Fonte: Autor
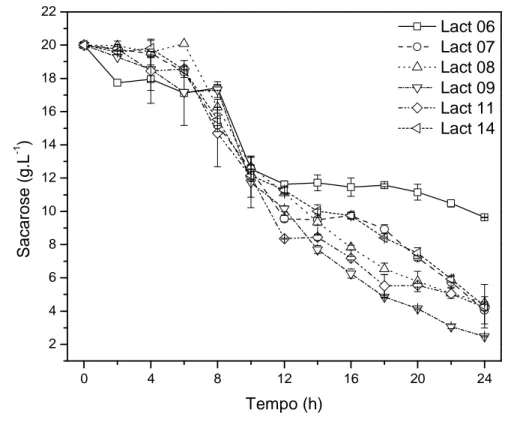
As linhagens de BAL foram retiradas do estoque a -80 °C e inoculadas em 10 mL do meio MRS modificado por 16 h e encubado a 37 °C. Após esse tempo, as culturas foram transferidas para agar MRS modificado e crescidos por 48 h a 37 °C, para a obtenção de colônias isoladas. Posteriormente, três colônias isoladas foram transferidas para 10 mL de meio MRS modificado e incubado a 37 °C com agitação de 150 rpm por 16 h. Essa cultura teve sua absorbância ajustada em espectrofotômetro para 0,1 a 600 nm o que corresponde a 107 UFC.mL -1, como previamente determinado por contagem de unidades formadoras de colônias. Vinte mL dessa cultura foram inoculados em frascos contendo 80 mL de caldo MRS modificado que ficou sob agitação de 150 rpm a 37 °C por 48 h. A cada duas horas, uma alíquota de 2 mL foi retirada para realizar medidas de absorbância, pH, concentração de sacarose e de ácido lático. Para determinação da absorbância, as alíquotas foram lidas em espectrofotômetro (Thermo Scientific – Genesys 6 – Waltham, Estados Unidos) a 600 nm e essa mesma amostra foi utilizada na análise de pH em pHmetro (Digimed DM-22).
4.5.1 Determinação das concentrações de sacarose e ácido lático
sacarose e ácido lático foram identificadas pela comparação com os tempos de retenção de soluções padrão da Sigma.
4.5.2 Determinação da biomassa seca
Durante a curva de crescimento das bactérias um frasco foi preparado nas mesmas condições descritas no item 4.5, exceto que não foram retiradas alíquotas deste frasco para que não ocorresse perda de massa. Ao final da curva de crescimento, o meio de cultura foi centrifugado por 10 min a 10.000 g e a massa sedimentada obtida foi lavada com água destilada estéril e centrifugada novamente por 10 min a 10.000 g, sendo esse processo repetido três vezes para retirar o meio de cultura das células sedimentadas.
Após isso, 10 mL de água destilada estéril foram adicionados à massa de células que foram homogeneizadas (suspensão estoque). A partir dessa suspensão 2 mL foram usados para determinar a massa seca, em triplicata, após incubar a 100 °C por 24 h. De posse da massa seca foi possível determinar a concentração da suspensão estoque. Consequentemente, foi possível realizar as diluições a partir da suspensão estoque e construir um gráfico da relação entre a massa seca (g.L -1) e a absorbância analisadas em espectrofotômetro a 600 nm. Através da medida de absorbância foi possível determinar a massa seca em todos os pontos da curva de crescimento.
4.6 Parâmetros cinéticos da fermentação lática em caldo MRS modificado
Os dados obtidos experimentalmente (biomassa seca, substrato e produto) foram utilizados para determinação dos parâmetros cinéticos da fermentação. A produtividade volumétrica de ácido lático (Qp, g.L-1.h-1) foi calculada como a razão da concentração máxima de ácido lático obtida (Pmáx, g.L-1) e o tempo de fermentação no qual Pmáx foi alcançado (t, h), conforme apresentado na equação 1.
Q = á Eq.1.
A conversão do açúcar consumido em ácido lático (YP/S, g.g-1) foi definido de acordo com a equação 2.