1
ÍNDICE
Agradecimentos i
Resumo/ Abstract ii
Introdução 2
1. Elevação do Seio Maxilar 4
1.1. Anatomia do Seio Maxilar 4
1.2. Técnicas de Elevação do Pavimento do seio maxilar 6
1.3. Complicações cirúrgicas 9 2. Enxertos ósseos 11 2.1. Osso Autógeno 12 2.2. Osso Alógeno 14 2.3. Xenoenxertos 15 2.4. Materiais Aloplásticos 17
3. Membranas reabsorvíveis e não reabsorvíveis 19
4. Considerações cirúrgicas 22
4.1. Ausência de infeção 22
4.2. Encerramento de tecido mole 23
4.3. Manutenção do espaço 23
4.4. Imobilização do enxerto 24
4.5. Fenómeno de aceleração regional (FAR) 24
4.6. Vascularização do osso 24
4.7. Fatores de crescimento 25
4.8. Proteínas morfogénicas ósseas 26
4.9. Tempo de cicatrização 26 4.10. Tamanho do defeito 26 Discussão 27 Conclusão 30 Bibliografia 31 Anexo I 37 Anexo II 38 Anexo III 39
2
INTRODUÇÃO
Hoje em dia deparamo-nos com inúmeras questões no que se refere a cirurgias de colocação de implantes, nomeadamente, atrofia dos maxilares por edentulismo prolongado. (Mira et al., 2012). Pacientes que sofreram extrações parciais ou totais da maxila, especialmente na região posterior, apresentam frequentemente deficiência óssea em altura para a eventual colocação de implantes (Guirado et al., 2006).
A técnica de elevação do seio maxilar, permite a instalação do implante por meio de um enxerto ósseo (Sekine et al., 2007). O procedimento de elevação do pavimento do seio maxilar envolve o seu aumento, onde a altura óssea alveolar é uma barreira anatómica para a reconstrução protética da maxila com implantes dentários. As duas principais abordagens cirúrgicas para a elevação do seio maxilar são a lateral e crestal. Embora a escolha do material de enxerto permaneça controverso, autores como Misch, Kent e Block Smiler, postulam que a elevação do pavimento do seio em associação com enxertos ósseos é um procedimento previsível que visa proporcionar volume ósseo adequado para a colocação de implantes dentários. O procedimento clássico para este aumento inclui a preparação na parede lateral do osso maxilar, de modo a criar uma porta de acesso para elevar a membrana de Schneider. O espaço criado por baixo desta membrana é então preenchido com enxertos ósseos diferentes. A partir deste ponto, os implantes dentários podem ser colocados imediatamente ou a sua colocação ser adiada após um período inicial de cicatrização (Sakka e Krenkel, 2011).
A utilização de enxertos ósseos visa a regeneração óssea após um procedimento cirúrgico (Baldini et al., 2010). Os enxertos ósseos de substituição podem ser classificados consoante a sua origem humana ou enxertos de substituição óssea. Sendo assim, podem ser classificados em autoenxertos, aloenxertos, xenoenxertos e materiais aloplásticos (Sukumar et al., 2011).
Enxertos ósseos autógenos são um material seguro e confiável para enxerto em cirurgia reconstrutiva. No entanto, o procedimento para se retirar osso autógeno é invasivo, muitas vezes exigindo uma segunda cirurgia na área dadora. Os substitutos ósseos representam uma alternativa possível para osso autógeno em numerosas situações. As características ideais para um substituto ósseo são: biocompatibilidade, ausência de efeitos antigénicos e possibilidade de esterilização associada a propriedades
3
mecânicas, bem como a manutenção de um espaço fácil de manipular durante as fases cirúrgicas (Baldini et al., 2010).
No grupo de osso de origem natural, xenoenxerto, destaca-se o osso inorgânico bovino (BiO-Oss), amplamente apoiado pela literatura científica, que tem sido testado extensivamente in vitro e in vivo. BiO-Oss é um derivado de osso bovino, desproteínizado que tem sido sugerido devido à sua capacidade osteocondutora. A reabsorção óssea devido a uma atividade osteoclástica associada a este material é uma desvantagem (Baldini et al., 2010).
Materiais aloplásticos são materiais de substituição óssea de origem sintética, inorgânicos e biocompatíveis. Estes materiais podem auxiliar na regeneração óssea, por um processo chamado de osteocondução. O Beta-tricálcio fosfato é um dos primeiros compostos de cálcio a ser utilizado como substituto ósseo. Outro material composto de cálcio utilizado como substituto ósseo é o sulfato de cálcio, usado por Dreesman em 1892. Ambos podem funcionar como coadjuvantes a serem utilizados com outro material de enxerto para a regeneração óssea guiada (Sukumar et al., 2011).
Desde 1960, membranas poliméricas têm sido usadas experimentalmente em animais para facilitar a cicatrização óssea. Tem sido sugerido que a membrana atua como barreira para impedir que o tecido conjuntivo impregne no defeito ósseo e assim permita a formação de novo osso (Gogolewski et al., 2000). Como a membrana deve ser implantada no corpo, é suposto preencher um conjunto de pré-requisitos, como: biocompatibilidade, não imunogénica e não tóxica. De forma a evitar a remoção da membrana após cura, seria preferível usar um material biodegradável (Park et al., 2009). Um certo número de materiais tem sido desenvolvido para membranas envolvidas na regeneração óssea guiada, incluindo membranas não reabsorvíveis (poliláctico politetrafluoroetileno, PTFE) e reabsorvíveis sintéticos (ácido poliláctico, PLA e seus copolímeros com ácido poliglicólico, PGA) ou ainda polímeros de base natural (como colagénio e quitosana) (Lee et al., 2009).
Assim, o objetivo deste trabalho é criar uma alternativa de reabilitação oral para maxilares atrofiados mediante uma pesquisa bibliográfica relativa aos materiais de substituição óssea utilizados na técnica de elevação do seio maxilar associados ou não a membranas de recobrimento.
4
1. ELEVAÇÃO DO SEIO MAXILAR:
1.1. Anatomia do Seio Maxilar:
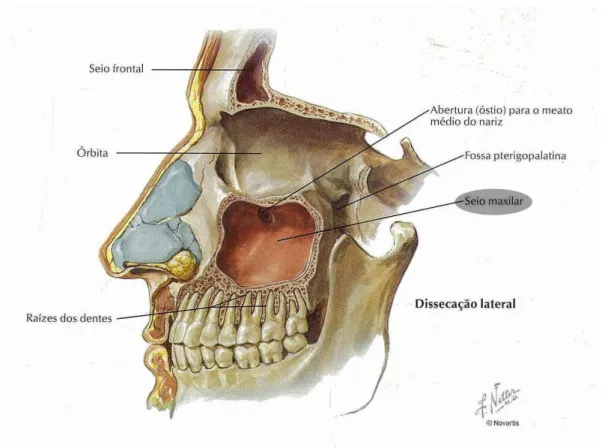
O seio maxilar trata-se de uma grande cavidade, com forma piramidal, cujas paredes finas, correspondem às órbitas, processos alveolares e, à porção facial e infratemporal da maxila. O ápice relaciona-se com o osso zigomático, encontrando-se muitas vezes dentro da maxila. A sua parede posterior contém o canal alveolar, conduzindo as veias alveolares posteriores e superiores, bem como os nervos para os dentes molares (Bannistar et al., 1995).
A parede superior do seio maxilar corresponde ao assoalho da órbita. Nesta parede destaca-se uma crista óssea que abriga o canal infraorbitário, o qual contém o nervo infraorbitário e vasos sanguíneos associados. Pode estar presente uma deiscência da câmara óssea, resultando num contacto direto entre as estruturas infraorbitárias e a mucosa do seio. Quando tal acontece, o paciente pode vir a desenvolver sintomas oculares resultantes de infeções ou tumores na região superior da mucosa do seio. A parede posterior desta estrutura anatómica corresponde à região pterigomaxilar, separando o seio da fossa infratemporal. Nesta parede surgem várias estruturas vitais, incluindo a artéria maxilar interna, plexo pterigóideo, gânglio esfenopalatino e nervo palatino maior. Desta forma, implantes pterigóideos instalados através desta parede aproximam-se inevitavelmente destas estruturas anatómicas vitais, aumento o risco associado à cirurgia para a sua colocação. A parede medial do seio maxilar é a mais complexa e coincide com a parede lateral da cavidade nasal. Na porção nasal, o compartimento inferior da parede corresponde ao meato inferior e ao assoalho da fossa nasal e a porção superior ao meato médio. Ao nível da porção superior desta parede, encontra-se o óstio primário ou maxilar e é através desta estrutura que o seio maxilar escoa as suas secreções pelo infundíbulo do etmoide através do hiato semilunar no meato médio da cavidade nasal. Podem ainda ser encontrados óstios menores, secundários e acessórios, que normalmente se encontram no meato médio posterior em relação ao óstio principal e resultam de uma situação patológica resultado de uma inflamação crónica do seio e colapso da membrana da mucosa, estando presente em cerca de 30% dos crânios. A parede lateral do seio maxilar forma o processo
5
zigomático, na sua porção posterior. Nesta parede encontra-se uma importante anastomose endóssea da artéria alveolar póstero-superior e da artéria infraorbitária. Por fim, a parede inferior do seio maxilar está diretamente relaciona com os ápices dos processos alveolares dos molares e pré-molares superiores. Normalmente estes dentes estão separados do seio maxilar por uma porção fina de osso e pela mucosa do seio. Em pacientes dentados, o pavimento do seio maxilar está aproximadamente ao nível do assoalho nasal, enquanto em pacientes desdentados, está a cerca de 1 cm abaixo do nível do assoalho nasal (Misch, 2008).
Primeiros e segundos molares são os dentes que se projetam mais frequentemente contra o pavimento, podendo muitas vezes perfurar a cavidade do seio. As raízes do primeiro e segundo pré-molares, terceiro molar e, ocasionalmente a raiz do canino podem também perfurar esta cavidade. O tamanho do seio varia, mesmo dos dois lados de um crânio individual. Quando grande, o seu ápice pode invadir o processo zigomático. As suas medidas médias variam entre 3.5 cm de altura vertical, 2.5 cm de largura transversal e 3.2 cm de profundidade ântero-posterior (Bannistar et al., 1995).
Segundo Gousau et al., 2009, o volume do seio maxilar pode variar entre 5 a 22ml, sendo que a média se situa nos 12.5 ml. É evidente uma diferença de género entre sexos, no que se refere ao volume, com os homens a apresentar um volume ligeiramente superior que as mulheres. O conhecimento detalhado do volume do seio maxilar, bem como a sua localização, morfologia e altura é relevante para cirurgias que envolvem esta cavidade, como por exemplo, cirurgias de elevação do pavimento do seio maxilar (Gosau et al., 2009).
O suprimento sanguíneo do seio maxilar é proveniente da artéria maxilar (ramo da artéria carótida externa). Esta artéria nutre o osso, bem como a membrana que envolvem o seio maxilar, através dos seus ramos, que incluem a artéria alveolar póstero-superior e artéria infraorbitária, que formam anastomoses quer endósseas, quer extraósseas, rodeando esta cavidade. A formação desta cadeia de anastomoses é denominada como arco artéria duplo. A anastomose endóssea encontra-se ao nível da parede lateral do seio maxilar, garantindo a nutrição desta zona anatómica e também a porção lateral da membrana do seio. Já a anastomose extraóssea, menos comum e superior à endóssea, é encontrada próxima ao periósteo da parede lateral. De salientar que, a anastomose endóssea pode variar numa distância de 5 a 20 mm a partir da crista do rebordo residual, o que significa que durante o procedimento cirúrgico de elevação
6
do pavimento do seio maxilar, através da criação de uma janela lateral, este suporte arterial pode ser invadido, contudo, este facto é de pequena importância, dado que pode ser até benéfico para o suporte sanguíneo de um enxerto ósseo no pós-operatório. A porção medial e posterior da mucosa do seio maxilar recebe o seu suporte sanguíneo através da artéria nasal lateral posterior (ramo da artéria esfenopalatina) (Rouvière e Delmas, 1997; Misch, 2008).
O suprimento nervoso do seio maxilar é realizado por diversas ramificações do nervo trigémeo, que incluem o nervo alveolar posterior, palatino anterior e infraorbitário. Na cirurgia de elevação do pavimento do seio, o nervo infraorbitário assume um papel importante devido à sua posição anatómica, que penetra na órbitra através da fissura orbital inferior e continua anteriormente, percorrendo um sulco no assoalho orbital, isto é, na parede superior do seio maxilar antes de sair através do forâmen infraorbitário (Rouvière e Delmas, 1997; Misch, 2008).
1.2. Técnicas de Elevação do Pavimento do Seio Maxilar:
Uma arcada superior e posterior desdentada apresenta redução do osso em altura, processo esse devido à atrofia e pneumatização do seio maxilar, o que torna impossível a colocação de implantes nesta área. Também a qualidade de osso nesta zona é muitas vezes diminuída, devido à baixa densidade óssea, sendo esta uma das possíveis causas de insucesso de implantes (Thor et al., 2007; Sul et al., 2008; Sul et al., 2009; Guirado et al., 2010; Jang et al., 2010). Outro problema que podemos ainda encontrar nesta zona é o facto de o osso nesta zona ser fino e mais medular comparativamente com a mandíbula (Guirado et al., 2006).
Após a perda gradual dos dentes bem como a redução das forças mastigatórias ao nível da maxila, a parede do seio maxilar torna-se gradualmente mais fina como resultado do aumento do volume, por pneumatização do seio maxilar. A duração do edentulismo é decisiva para a extensão da crista alveolar, reabsorção e pneumatização do seio. Após a perda de um dente inicia-se o processo de reabsorção óssea, resultante, em parte, de um reforço da atividade osteoclástica da membrana de Schneider. Em casos extremos apenas uma fina camada de osso separa a cavidade oral do seio maxilar. Quando o osso alveolar está totalmente reabsorvido, a mucosa do seio pode estar em contato imediato com a mucosa oral. Esta é uma condição muito difícil, em que a
7
membrana de Schneider normalmente não pode ser mantida intacta. Este facto pode levar a perfurações da membrana de Schneider durante um procedimento cirúrgico no seio maxilar, tornando o procedimento muito difícil e por vezes até impossível de se realizar. Nestes casos uma tomografia axial computorizada pré-operatória é fundamental (Zijderveld et al., 2008).
Elevação do pavimento do seio maxilar é um procedimento de reconstrução que tem como principal objetivo um aumento da maxila posterior, permitindo a posterior colocação de implantes dentários (Jeong et al., 2009; Lozada et al., 2011). Trata-se de um método, através do qual é possível estabelecer uma correta altura vertical na região posterior da maxila para posterior colocação de implantes dentários (Hallman et al., 2005; Xu et al., 2005; Mojón et al., 2012)
As cirurgias de elevação do seio maxilar podem ocorrer recorrendo à porção inferior do seio (rebordo alveolar) ou através de uma janela lateral (Sekine et al., 2007; Mira et al., 2012).
Os métodos convencionais para ter acesso à cavidade do seio e posterior colocação de enxertos ósseos consistem em procedimentos que usam instrumentos rotatórios, instrumentos piezoelétricos e osteótomos. Alguns autores indicam que é necessário mais tempo cirúrgico para realizar osteotomia com instrumentos piezoelétricos do que com instrumentos rotatórios convencionais. No entanto, instrumentos piezoelétricos têm a capacidade de cortar a janela óssea evitando o risco de perfuração da membrana. A principal limitação destes instrumentos parece ser o fator tempo, isto porque a eficácia de corte destes instrumentos é substancialmente menor em comparação com os instrumentos convencionais (Lozada et al., 2011).
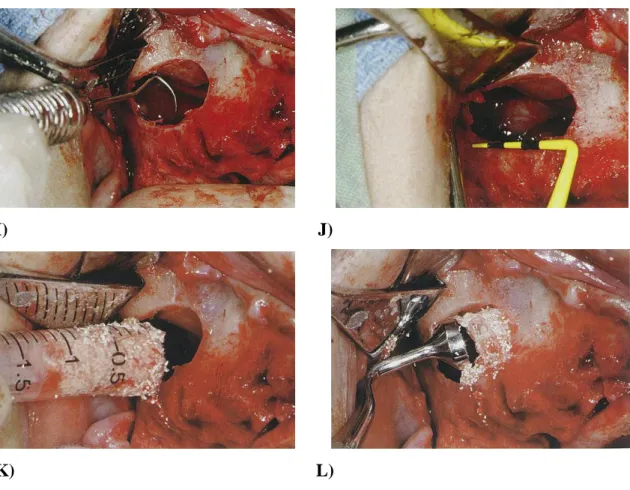
Após uma anestesia eficaz que bloqueie o nervo maxilar, procede-se então à incisão e deslocamento do retalho mucoperiósteo. Uma incisão na crista alveolar é efetuada, que inclui a porção desdentada da maxila posterior até um dente anterior à parede do seio maxilar. Em rebordos muito reabsorvidos, ter em atenção, uma vez que a artéria palatina maior, nestes casos, encontra-se muito próxima ao rebordo alveolar. Duas incisões de descarga verticais são efetuadas, uma em posterior (distal da incisão para ter acesso cirúrgico à tuberosidade maxilar) e outra em anterior. A porção palatina do retalho é primeiramente descolada, seguindo-se a porção vestibular, para exposição completa da parede lateral do osso maxilar. Toda a quantidade de tecido fibroso deve ser devidamente removida, sob pena de contaminação de tecido mole no enxerto ósseo.
8
A partir deste momento e após uma avaliação através de uma tomografia computorizada, o esboço da janela de acesso lateral é efetuado através de uma peça de mão rotatória sob irrigação abundante de solução salina estéril. A primeira broca usualmente utilizada é de calibre nº6, que efetua o esboço da janela e sua dimensão. Esta broca é seguida por uma broca diamantada de calibre nº 4, que regulariza o osso. A linha de marcação do limite inferior da janela óssea, é colocada aproximadamente a cerca de 2 a 5 mm acima do pavimento do seio maxilar (que está a cerca de 5 a 10 mm de distância da crista). A porção superior da janela óssea deve ficar aproximadamente entre 8 a 10 mm acima da linha de marcação do seu limite inferior. A linha vertical anterior da janela de acesso é marcada aproximadamente 5 mm distal à parede vertical anterior do pavimento. Esta linha é de aproximadamente 15 mm na região posterior desdentada da maxila a partir do limite anterior da janela. Uma janela de acesso lateral maior possui inúmeras vantagens, de entre elas, menor tensão sobre a membrana e a facilidade da sua elevação, devido ao acesso direto, o que facilita a colocação de enxertos ósseos. Os cantos da janela são, normalmente arredondados em vez de retos ou agudos sob pena de perfuração da membrana. Uma vez delineada a janela de acesso, uma broca rotatória continua a marcar os esboços sob irrigação abundante, até que seja observada uma coloração azulada abaixo da broca ou hemorragia no local. Estes indicadores são sinais de aproximação à membrana de Schneider. A partir deste ponto um cuidado adicional deve ser tido e conta e evitar preparar a janela de acesso em demasiada profundidade, uma vez que o risco de perfuração da membrana é eminente. Para a correta elevação da membrana, um instrumento perfurador de extremidade plana e um martelo são suavemente utilizados com o objetivo de, suavemente, fraturar a janela de acesso lateral de osso circundante, enquanto esta permanece aderida à membrana do seio. O perfurador é posicionado no centro da janela óssea e uma leva batida deve ser efetuada de forma a provocar uma fratura de galho verde, libertando a janela. Para proceder à elevação da membrana do seio, usa-se uma cureta de lâmina curta para tecido mole, desenhada com duas curvas de ângulo reto. Esta é introduzida ao longo da margem da janela com a sua porção curva colocada contra a janela, ao passo que a extremidade afilada é colocada entre a membrana do seio e a margem da parede interna do pavimento, a uma profundidade de cerca de 2 a 4 mm. A cureta é deslizada ao longo da margem do osso, assegurando a libertação da membrana das paredes circundantes ao seio. A membrana é geralmente de facilmente elevada, uma vez que
9
possui poucas fibras elásticas e não se encontra presa à parede cortical. Um elevador periosteal curvo ou um elevador da membrana do seio é introduzido pela janela de acesso lateral ao longo do bordo inferior. A porção curva é colocada contra a janela e a margem cortante da cureta é arrastada ao longo do assoalho do seio, enquanto eleva a membrana. Uma vez elevada a mucosa do assoalho do seio, as paredes lateral, distal e medial são observadas. A cureta é empurrada contra o osso, que facilmente descola a membrana. A janela de acesso lateral é posicionada como parte da parede superior no local do enxerto, uma vez em posição final. Os tecidos moles devem ser reaproximados com o cuidado de não fazer pressão, permitindo uma cicatrização de primeira intenção (Misch, 2008).
Após os procedimentos acima descritos, a membrana é então elevada. Em todas as técnicas, a irrigação contínua é necessária e fundamental durante o corte para evitar o aquecimento excessivo do osso. Existe um risco de perfuração da membrana quando esta é pressionada pela broca, que ocasionalmente leva à sua reparação ou interrupção do procedimento (Díaz et al., 2007).
1.3. Complicações cirúrgicas:
A complicação cirúrgica mais comum é a perfuração da membrana do seio que ocorre em cerca de 10 a 60% dos procedimentos (Zijderveld et al., 2008). Outras complicações incluem dor aguda ou sinusite crónica bacteriana, edema, hemorragia, deiscência do material de enxerto, uma interrupção da função fisiológica do seio, sinusite pós-operatória, ou mesmo formação incompleta de novo osso (Felisati et al., 2010; Lee et al., 2010; Lozada et al., 2011).
Perfuração da membrana do seio
Perfuração da membrana do seio é a complicação mais prevalente durante procedimentos de elevação do pavimento do seio maxilar, acontece entre 10 a 60% dos casos. A integridade da membrana sinusal é essencial para a manutenção da função normal e saudável do seio maxilar. O aparelho mucociliar protege o seio contra infeções por remoção de microrganismos através do muco. A membrana atua também como uma barreira biológica. Possíveis causas
10
de perfuração da membrana incluem um rompimento aquando a osteotomia da janela lateral, elevação da membrana, presença de septos e ainda extravasamento do material de enxerto. Possíveis fatores de risco foram documentados e incluem irregularidades do pavimento do seio, formações de raízes, cirurgia anterior do seio e uma baixa altura da crista óssea. Segundo Ardekian et al., uma crista residual com altura inferior a 3 mm sofre 85% de probabilidade de perfuração da membrana, contra 25% caso tenhamos uma crista alveolar com altura mínima de 6mm.Quando assistimos a uma pequena perfuração da membrana, isto é, menor que 2 mm, numa área localizada, a membrana elevada é dobrada e cicatriza naturalmente. No entanto, mesmo numa fina perfuração da membrana de Schneider, os autores preferem usar uma membrana de colagénio reabsorvível para a cobrir. Em perfurações maiores está quase sempre indicado o uso de uma membrana como barreira.
Hemorragia A lesão de um vaso pode constituir uma limitação em termos de visualização da membrana de Schneider. Embora a maxila seja um osso densamente vascularizado em pacientes jovens e dentados, o fornecimento de sangue ao osso diminui com a idade. Durante o procedimento, se ocorrer hemorragia, esta pode ser controlada por pressão com uma gaze. O processo de cauterização para controlo da hemorragia deve ser evitado sob o riso de perfuração da membrana. As extensões verticais devem ser evitadas tanto quanto possível e o periósteo deve ser preparado com o maior cuidado possível de forma a minimizar o trauma vascular, isto porque na parede lateral do seio está presente uma anastomose extraóssea das artérias que suprimem o seio localizada em média a uma distância de 23 mm a partir do rebordo alveolar.
11
Da mesma forma curetagens excessivas devem ser evitadas. Uma outra forma de hemorragia intra ou pós-operatória que pode surgir é uma epistaxis, indicando uma perfuração na membrana.
Sinusite pós-operatória
Surpreendentemente, a taxa de sinusite pós-operatória é uma complicação rara, com apenas 1% de prevalência. Pode surgir como um efeito transitório ou persistente após uma elevação do pavimento do seio maxilar, quando a membrana de Schneider é levantada
Tabela 1 - Resultados de complicações baseadas num estudo feito por Zijderveld et al., 2008, onde 100 pacientes (36 homens e 64 mulheres) com uma idade média de 50 anos (idades compreendidas entre os 17 e 73 anos) foram sujeitos a cirurgias de elevação do pavimento do seio maxilar. Todos os procedimentos cirúrgicos foram realizados pelo mesmo cirurgião.
2. ENXERTOS ÓSSEOS
Os princípios básicos para a regeneração óssea com enxertos ósseos são: osteogênese, osteocondução e osteoindução. Osteogénese ocorre quando osteoblastos ou células percussoras de osteoblastos são transplantadas como material de enxerto para os locais de defeito ósseo. Osso autógeno é um exemplo claro desta propriedade. Osteocondução ocorre quando um material de enxerto não-vital serve como suporte para o crescimento de células percursoras de osteoblastos para o interior do defeito. A osteoindução envolve a formação de um novo osso pela diferenciação local das células mesenquimais indiferenciadas em células formadoras de osso sob a influência de um ou mais agentes indutores. No processo de formação/ regeneração óssea frequentemente os três processos estão envolvidos, nomeadamente, a osteogénese é impossível de ocorrer sem a osteocondução e osteoindução (Lindhe et al., 2005).
A utilização de enxertos ósseos visa facilitar a cicatrização e regeneração óssea após um procedimento cirúrgico. Provavelmente o melhor material de enxerto seria osso autógeno, devido à sua capacidade osteogénica, osteoindutora e osteocondutora. No
12
entanto, o procedimento para se retirar osso autógeno é invasivo. Substitutos ósseos representam uma alternativa possível para osso autógeno em numerosas situações. Existe um grande número de substitutos ósseos disponíveis para utilização clínica, tanto de origem animal como sintética. De acordo com a origem humana ou não, enxertos ósseos podem ser classificados da seguinte forma de acordo com Sukumar e Drizhal, 2008:
Osso humano:
Enxerto autógenos:
Enxertos alógenos:
Substitutos ósseos:
Xenoenxertos: Hidroxiapatite de origem bovina. Materiais aloplásticos:
2.1 Osso Autógeno:
Enxertos autógenos preenchem uma série de requisitos, que os tornam uma excelente opção. Estas propriedades incluem a capacidade osteogénica (estimulação de osteoblastos sobreviventes), capacidade osteocondutora (servir de suporte para o ingresso do osso vizinho) e capacidade osteoindutora (diferenciação de células mesenquimais em osteoblastos) (Jang et al., 2010; Keles et al., 2010; Yadav et al., 2011).
Após o procedimento clássico para a elevação do seio maxilar, que inclui a preparação de uma janela óssea para levantar a membrana de schneider na parede lateral do seio, o espaço criado por baixo dessa membrana levantada é então preenchido com enxertos diferentes, como o osso autógeno. Neste ponto, os implantes podem ser colocados de imediato ou tardiamente, após um período de cicatrização. A limitação do uso de substitutos ósseos para este procedimento cirúrgico é a sua fraca capacidade
- Osso fresco congelado; - Osso liofilizado;
- Osso liofilizado desmineralizado. - Intra-orais;
- Extra-orais.
- Reabsorvíveis; - Não reabsorvíveis.
13
regenerativa, quando comparada com osso autógeno. Entre as áreas dadoras atualmente utilizadas em cirurgia, a calote craniana tem sido a preferida por muitos cirurgiões, incluindo Tessier desde 1980. Este tipo de enxertos tem sido amplamente utilizados para a reconstrução de rebordos alveolares severamente reabsorvidos. Apesar do osso ilíaco ter a capacidade de retenção do seio, não responde tão bem como o osso do crânio, quando colocado na crista alveolar. Além disso, a reabsorção de enxertos ósseos derivados do crânio é geralmente mínima e esta área dadora é relativamente livre de dor no pós-operatório além de que, causa uma reação mínima do local dador. A colheita de osso da calote craniana requer treinamento especializado para evitar maiores complicações neurológicas e a avaliação da sua espessura é fundamental. Para uma regeneração óssea bem-sucedida associada à elevação do pavimento do seio maxilar, a integridade da membrana de Schneider é essencial. Estudos histológicos e morfogénicos revelam uma integridade e incorporação óssea bem-sucedida quando se opta pelo uso de osso autógeno associado a esta técnica cirúrgica. Os autores observaram uma reabsorção óssea mínima neste procedimento (Sakka e Krenker, 2011).
As desvantagens deste tipo de enxertos incluem a necessidade de hospitalização, caso a área dadora seja extra-oral ou a exigência de um segundo local cirúrgico intra-oral, o que aumenta a duração do tempo de cirurgia e a morbidade associada com o procedimento. Com os locais dadores apenas fornecem uma quantidade de osso limitada, muitas vezes, este osso é misturado com outras fontes de materiais de enxerto (aloenxerto, xenoenxerto ou materiais aloplásticos). A proporção de osso autógeno e de outros materiais de enxerto é dependente principalmente da quantidade disponível de osso autógeno. Uma maior proporção de osso autógeno, melhora o potencial de osteogénico na mistura de enxerto (Jang et al., 2010).
Osso autógeno foi declarado por muito tempo como uma opção de excelência devido às suas capacidades osteocondutor, osteoindutor e osteogénica, no entanto a sua incapacidade de suportar a pressão de ar exercida pelo seio, bem como a perda do seu volume e altura, têm sido relatadas na primeira semana após implementação (Cabbar et al., 2011; Ribeiro et al., 2012).
Para que osso autógeno transplantado possua tecido osteoide, terá de ser mantido vital. Para tal, o local recetor deve ser preparado primeiramente de forma a reduzir o tempo entre a remoção do enxerto e a sua instalação. Portanto o local ideal para a sua colocação é diretamente no local recetor após este ter sido descorticalizado
14
com broca cirúrgica. Caso não seja possível a sua colocação imediata na área recetora, osso autógeno removido do local dador pode ser mantido numa solução salina estéril ou numa solução de Ringer lactato, para a manutenção da sua vitalidade celular (Misch, 2008).
Del Fabbro et al. (2004) verificaram que com a utilização de osso autógeno, a taxa de sobrevivência de implantes foi de 87.7% e a taxa de sobrevivência de implantes numa mistura entre osso autógeno e materiais de substituição óssea foi de 95.98% (Del Fabbro et al, 2008). Mais tarde, num estudo efetuado por Mojón et al, 2012, a taxa de sobrevivência de implantes no seio maxilar associado à colocação de implantes dentários com osso autógeno é de 93%, já a taxa de sobrevivência quando este material é colocado misturado com substitutos ósseos é de 95.6%. A diferença pode ser explicada pelo volume insuficiente de material de enxerto autógeno colocado (Mojón et al., 2012).
2.2 Osso Alógeno:
Enxertos ósseos alógenos são enxertos ósseos derivados da mesma espécie recetora mas com genótipo diferente, o que significa que para a espécie humana, osso de cadáveres é uma opção (Misch, 2008). Devido ao risco inerente de contágio de doenças e infeção cruzada, a forma de osso fresco congelado tem sido descartada em periodontologia. A literatura científica mostra que osso alógeno liofilizado reduz abruptamente a reação antigénica e mostra resultados satisfatórios no tratamento de defeitos ósseos periodontais (Sukumar e Drizhal, 2008).
Tendo em conta que a porção esponjosa de osso alógeno é mais antigénica que a porção cortical, prefere-se o uso desta última forma de modo a minimizar qualquer reação anti-inflamatória. Também o facto da porção cortical de osso alógeno possuir matriz óssea torna-a mais indutora comparativamente à porção esponjosa. Além de osteoindutor, este material de enxerto liofilizado possui propriedades osteocondutoras (Sukumar e Drizhal, 2008).
Aloenxertos desmineralizados surgiram, resultantes do bloqueio do efeito de fatores de crescimento, que estimulam o crescimento ósseo, associados a aloenxertos liofilizados. Estudos em animais, postulam que aloenxertos desmineralizados liofilizados têm potencial osteogénico (Sukumar e Drizhal, 2008).
15
Comercialmente, osso alógeno liofilizado e osso alógeno desmineralizado são comercializados sob duas formas, respetivamente FDB e DFDB. O processo de desmineralização de ambas as formas é semelhante, embora com alguns pontos diferentes. Após a remoção da componente esponjosa, o osso é lavado e triturado em partículas de 500 µm a 5 mm. Depois disto, é mergulhado em etanol a 100% (para remoção da porção lipídica), congelado em nitrogénio e só mais tarde congelado a seco e triturado em partículas menores. Este processo resulta portanto na formação de FDB. O DFDB, possui uma etapa adicional que se destina à desmineralização do osso com ácido hidroclorídrico 0.6 N ou ácido cítrico por um período de 6 a 16 horas. Como resultado deste processo, o osso desmineralizado dispões com mais facilidade as proteínas morfogénicas do osso (BMP’s), com alto potencial osteoindutor. Sendo assim, como os sais minerais do osso são removidos, as BMP’s insolúveis estão disponíveis no ambiente local mais cedo do que o que acontece no osso congelado e seco (Misch, 2008).
A grande vantagem de uso deste tipo de enxertos prende-se com o facto deste material estar disponível em grandes quantidades, descartando-se a necessidade do dador ser o próprio recetor. No entanto, o processo para obtenção destes materiais nas formas liofilizadas e desmineralizadas, reduz a sua integridade e capacidade osteogénica. Uma grande preocupação associada a este material é o facto de existir sempre a possibilidade de contaminação de doenças como HIV e infeção cruzada (Sukumar e Drizhal, 2008).
2.3 Xenoenxerto:
Entre os novos materiais de enxerto alternativos, enxertos ósseos de origem bovina (BBG) têm sido relatados como sendo uma forma segura, biocompatível não antigénica, radiopaca e com propriedades osteocondutoras, cuja taxa de sucesso é consideravelmente boa. Estudos têm demonstrado que este material é uma boa opção para casos de cirurgias de elevação do seio maxilar, fornecendo um quadro ideal para a formação de novo osso, associado a um aumento da densidade das estruturas lamelares ósseas. As taxas de sucesso com o uso deste material e posterior colocação de implantes situam-se entre 89.5% e 100% (Gonçalves et al., 2009; Cabbar et al., 2011). A taxa de sobrevivência de implantes colocados no seio maxilar com xenoenxertos puros, é de
16
85%, concluindo-se que xenoenxertos são tão eficazes como enxertos autógenos (Rokn et al., 2011).
Xenoenxertos são materiais derivados de osso esponjoso desproteínizado de outra espécie, tal como o osso bovino. Dado que o componente orgânico deste substituto ósseo é removido, o risco de patologias como encefalopatia espongiforme bovina é insignificante. Após a remoção da parte orgânica, a componente inorgânica restante constitui uma importante fonte de cálcio para as fases de remodelação óssea. Este tipo de enxertos derivados de hidroxiapatite bovina e associados ao seu potencial osteocondutor, constitui um ótimo apoio, uma vez que contém um teor mineral semelhante ao do osso humano (Sukumar e Drizhal, 2008; Hieu et al., 2010).
Como exemplo de substituto ósseo de origem bovina desmineralizado, usado sob a fora de osso inorgânico, destaca-se o (Bio-Oss), amplamente apoiado pela literatura quer em estudos in vivo como in vitro. Bio-Oss é um derivado de osso bovino que é sujeito a uma temperatura de cerca de 300º com o objetivo de remoção de todos os componentes orgânicos, mantendo a sua arquitetura natural. Estudos em crânios de coelhos, têm demonstrado a biocompatibilidade deste material, pela colocação de osso desproteínizado na calvaria destes animais com a criação de macroporos na sua morfologia, semelhantes ao osso esponjoso natural. Estudos pré-clinicos demonstraram o processo de cicatrização e formação óssea subsequente, verificando-se partículas de Bio-Oss num defeito criado cirurgicamente, reproduzindo um defeito ósseo humana, em cortes histológicos. Estas partículas de Bio-Oss foram detetadas cercadas por uma quantidade variável de osso recentemente formada, tecido osteoide e medula, incluindo vasos sanguíneos (Baldini et al., 2011).
A configuração geométrica e porosidade destes biomateriais podem ser favoráveis na microvascularização, diferenciação e proliferação de células osteoprogenitoras. Primeiramente segundo Urist, 1965, a utilização de proteína óssea morfogénica bovina (BHA) demonstrou propriedades de osteoindução e formação de novo osso em locais ectópicos (tecidos musculares e pele). Estas proteínas são frequentemente utilizadas, devido também à sua grande disponibilidade no mercado, mesmo que, para produção de 1 h de BMP seja necessário cerca de 1 tonelada de osso bovino em pó. Desta forma, este tipo de osso representa uma alternativa à utilização de osso autógeno, diminuindo assim o risco de complicações associadas a cirurgias e limitações do doador (Allegrini et al., 2003).
17
Após um estudo realizado por Allegrini et al., 2003 são necessários cerca de 6 a 8 meses de cicatrização após elevação do seio maxilar com posterior colocação de materiais de enxerto usando 80% de xenoenxerto com 20% de material autógeno. Um outro facto relevante observado foi que uma grande quantidade de xenoenxerto não foi reabsorvida. De acordo com o relatório de Kuboki et al., 1998, a maioria das partículas de Hidroxiapatite de origem natural não apresenta ma reabsorção significativa (Allegrini et al., 2003).
De acordo com Valentini et al, em estudos histomorfogénicos, usando Bio-Oss após a cirurgia de elevação do pavimento do seio maxilar ocorre formação óssea em cerca de 28% associada a uma formação de tecido conjuntivo em 44% e 28% de hidroxiapatite bovina. Estes resultados foram baseados num estudo feito em 15 pacientes com 20 elevações do seio maxilar e num período de cicatrização de 6 meses. Também outro estudo feito por Hallman, demonstrou o comportamento deste material no que diz respeito à sua taxa de reabsorção, cujos resultados apontam para uma reabsorção de cerca de 3.55% por mês nos primeiros 2 anos, decrescendo este valor para cerca de 0.58% por mês nos8 anos seguintes (Somanathan e Simunek, 2006).
As principais vantagens de xenoenxertos são que estes materiais têm propriedades osteocondutoras e estão prontamente disponíveis no mercado. Quanto à desvantagem principal, ainda permanece o potencial deste material transmitir doenças (Sukumar e Drizhal, 2008).
2.4 Materiais Aloplásticos:
Materiais aloplásticos são materiais exclusivamente sintéticos e biocompatíveis. Podem ser classificados em cerâmicas, polímeros e compósitos. As cerâmicas bioativas, como o caso do fosfato de cálcio e fosfatos tricálcicos, constituem a maior família dos materiais aloplásticos usados para enxertos ósseos. Atuam como substratos para o crescimento ósseo com propriedades osteocondutoras (Misch, 2008; Subbaiah e Thomas, 2011).
Os materiais aloplásticos cerâmicos são constituídos principalmente de fosfato de cálcio, cuja proporção de cálcio e fosfato são muito semelhantes às encontradas no osso natural. As duas formas deste tipo de enxertos mais amplamente utilizadas são o fosfato tricálcio e a hidroxiapatite. O fosfato tricálcico trata-se de uma forma porosa de
18
fosfato de cálcio. Apesar de propriedades de reabsorção diferentes, alfa e beta fosfato tricálcico são produzidos do mesmo modo. A forma mais comumente utilizada é a beta tricálcico fosfato, já que a forma alfa é menos estável e tem uma menor proporção de cálcio nos sais de hidroxiapatite (Sukumar e Drizhal, 2008; Sánchez et al., 2010).
Estruturalmente, beta fosfato tricálcio é um material beta-poroso tem uma resistência a forças de compressão e tração muito semelhantes ao do osso esponjoso. Infelizmente a substituição deste material por osso não ocorre de uma forma previsível, isto porque o volume de osso produzido é em regra menor que o volume de material de enxerto utilizado. Por esta razão, beta fosfato tricálcio te sido utilizado como um material coadjuvante a outros substitutos ósseos, cuja taxa de absorção é menos extensa (Sukumar et al., 2011).
Sulfato de cálcio, usado por Dreesman em 1982, é também um material aloplástico de substituição óssea cuja resistência à compressão é maior que o osso esponjoso. Tem sido relatado que este material pode agir como uma barreira reabsorvível, que impede o crescimento epitelial e invasão durante o processo de cicatrização óssea, o que o torna um material para uso como coadjuvante de outros materiais de substituição óssea durante o processo de regeneração óssea (Sukumar et al., 2011; Almasri et al., 2012). Age maioritariamente como uma matriz osteocondutora para o crescimento interno de vasos sanguíneos associado a células com potencial osteogénico. Para tal é necessário que este material esteja associado a um periósteo viável. Durante um período de 5 a 7 semanas, sulfato de cálcio é reabsorvido e pode ser comercializado sob a forma de OSTEOSET (Sukumar e Drizhal, 2008; Lucaciu et al., 2010). A taxa de reabsorção do fosfato de cálcio é condicionada pelo tamanho das partículas envolvidas, bem como pela sua porosidade e composição do material. As partículas maiores necessitam de um longo período para reabsorver, se todos os outros fatores forem iguais (Misch, 2008).
Materiais que combinem o beta fosfato tricálcio e o sulfato de cálcio têm sido utilizados no tratamento de defeitos periodontais intraósseos desde o ano de 2003. Esta combinação de materiais aloplásticos oferece inúmeras vantagens tais como: fácil facilidade do seu uso, tempo cirúrgico reduzido e dispensa uma membrana convencional após a sua implantação, o que o torna mais económico (Sukumar et al., 2011).
Apesar das qualidades mecânicas ósseas associadas aos materiais aloplásticos, bem como a sua pronta disponibilidade comercial, estes substitutos ósseos ainda
19
apresentam algumas limitações oferecendo apenas uma solução para perdas ósseas localizadas (Sukumar et al., 2011). Para gestão de grandes defeitos ósseos, materiais aloplásticos podem ser misturados com substitutos ósseos autógenos ou aloenxertos de forma a alcançar resultados superiores (Sukumar e Drizhal, 2008).
3. MEMBRANAS REABSORVÍVEIS E NÃO REABSORVÍVEIS
Desde 1960, têm sido utilizadas membranas poliméricas com o objetivo de facilitar a cicatrização em defeitos ósseos. Em regeneração óssea guiada, membranas que cobrem defeitos ósseos previamente preenchidos com substitutos ósseos são amplamente utilizadas, na tentativa de prevenir a invasão de tecidos moles circundantes indesejáveis, criando-se um espaço favorável á regeneração óssea (Gogolewski et al., 2000; Cestari et al., 2010; Kim et al., 2011).
Um grande número de materiais poliméricos tem sido desenvolvido para membranas associado a regeneração óssea guiada, incluindo polímeros não reabsorvíveis de politetrafluoroetileno (PTFE), e reabsorvíveis, como o ácido poliláctico, PLA, e seus copolimeros como o ácido poliglicólico (PGA) ou então membranas com polímeros de origem natural, como o caso do colagénio e a quitosana (Lee et al., 2009; Kim et al., 2011).
Como material de membrana, portanto, suposto de ser implantado no corpo deve preencher alguns pré-requisitos como ser biocompatível, não imunológico e não tóxico. Caso se trate de membranas reabsorvíveis, a sua degradação, deve ser suficientemente longa para que a regeneração óssea seja alcançada antes da desintegração da membrana. Outras propriedades, como a integração nos tecidos, potencial de oclusão, transferência de nutrientes, capacidade de manutenção do espaço são essenciais para o sucesso deste tipo de materiais (Park et al., 2009).
O uso de membranas reabsorvíveis ou não reabsorvíveis requer um encerramento primário, a fim de proteger o local do meio oral, o que aumenta a exigência e complexidade cirúrgica. Uma membrana que não exija encerramento primário de alta densidade de politetrafluoretileno (dPTFE) foi introduzida de forma a minimizar este problema. Uma das vantagens associadas a este tipo de membranas é que nenhuma proteção primária será necessária, eliminando portanto a necessidade de incisões adicionais e, consequentemente melhora o desconforto pós-operatório. Além
20
disto, a superfície lisa das membranas de dPTFE torna a sua remoção fácil, sem a necessidade de intervenções cirúrgicas adicionais. No entanto, a sua falta de aderência constitui uma limitação, uma vez que enfraquece a sua função enquanto membrana, comprometendo a regeneração óssea (Nasser et al., 2005; Yun et al., 2011).
A utilização de membranas não reabsorvíveis necessita de uma segunda cirurgia para a sua remoção e é acompanhada por altas taxas de infeções bacterianas quando comparadas com membranas reabsorvíveis. Também o uso de membranas não reabsorvíveis está associado a uma alta taxa degenerativa acompanhada por uma desaceleração na formação de novo osso (Nasser et al., 2005).
Efetivamente, os dados disponíveis na literatura postulam que tanto membranas reabsorvíveis como não reabsorvíveis podem ser utilizadas para tratamento de defeitos ósseos. No entanto, tem sido sugerido que membranas reabsorvíveis são preferidas até porque se pensa que por terem propriedades osteogénicas podem estimular regeneração óssea (Gogolewski et al., 2000). Ácido poli-láctico glicólico (PLGA) tem sido amplamente investigado e usado para várias aplicações médicas devido às suas capacidades de biocompatibilidade de biodegradação. A biodegradação deste material pode ser controlada alterando o seu peso molecular, composição, cristalinidade, bem como outros parâmetros e os produtos resultantes da sua degradação não são considerados tóxicos (Park et al., 2009). Ácido poliláctico, PLA, é o principal componente de várias membranas reabsorvíveis, devido á sua facilidade de manipulação, plasticidade térmica, alta resistência mecânica e biocompatibilidade. No entanto, este material leva cerca de 4 anos a ser completamente reabsorvido, contra aquilo que é desejável, apenas 1 ano. Alguns Co-polímeros foram desenvolvidos na tentativa de contornar este problema, como é o caso ácido glicólico, carbonato de trimetileno, no entanto associado a estes materiais estão desvantagens como, uma fraca rigidez, resistência mecânica insuficiente e alterações de pH, induzindo inflamação do tecido envolvente (Kinoshita et al., 2008). Entre os polímeros reabsorvíveis, a quitosana tem adquirido especial interesse devido às suas propriedades de flexibilidade, biocompatibilidade, biodegradação e propriedades antibacterianas associadas a um custo reduzido, mostrando um capacidade de regeneração óssea favorável. Apesar disto, algumas limitações ao seu uso foram sugeridas, como o caso da sua baixa rigidez e a geração de um ambiente ácido aquando da sua degradação, prejudicial, que pode
21
desencadear reações inflamatórias. Também a sua baixa bioatividade tem sido sugerida como uma limitação (Lee et al., 2009).
Recentemente foram introduzidos no mercado, materiais derivados de colagénio porcino ou bovino. Algumas vantagens do colagénio em relação aos outros materiais incluem a sua função hemostática, que permite a estabilização precoce da ferida, ou as suas propriedades quimiotáticas para atrair fibroblastos, bem como a sua semi-permeabilidade que faculta a transferência de nutrientes (Park et al., 2009). Outras propriedades destes materiais foram descritas, tais como, facilidade de manipulação e uma ótima integração com os tecidos moles. Além disto e devido às suas propriedades biologicamente favoráveis, não necessitam de uma segunda cirurgia para a sua remoção. No entanto, a sua taxa de reabsorção rápida tem levantado algumas preocupações na sua utilização (Guimarães et al., 2010; Yun et al., 2011).
Materiais como parafusos e placas metálicas surgiram durante a década de 1980 numa tentativa de estabilização de membranas. A biocompatibilidade destes materiais foi testada pela observação da interface entre o parafuso e tecido ósseo, dado que estes materiais devem ser inertes e resistentes a forças e movimentos fisiológicos. Algumas desvantagens estão associadas a estes materiais e isso inclui, distorção, migração passiva em crianças. Ao uso destes materiais têm sido relatado a necessidade de uma segunda intervenção cirúrgica em casos de sintomatologia, especialmente associado a jovens adultos, onde são frequentemente implementadas. Por esta razão polímeros biodegradáveis como ácido poliglicólico (PGA), ácido poliláctico (PLA) e homopolímeros têm sido desenvolvidos na tentativa de substituição de dispositivos de titânio para fixação em cirurgia craniofacial. Para além destas propriedades, parafusos reabsorvíveis devem ter uma adequada resistência mecânica capaz de suportar movimentos fisiológicos e manter a sua integridade e função durante as fases críticas de remodelação óssea, o que significa que taxa de reabsorção é um fator importante (Cestari et al., 2010).
No que se refere a taxas de sobrevivência de implantes associados ou não a membranas para encerrar a antrostomia, verificou-se que o uso de membranas é vantajoso, refletindo-se numa maior taxa de sucesso. Num estudo efetuado por Pjetursson et al., 2008, o uso de membranas está associado a uma taxa de sobrevivência de implantes de 97.9% contra, 88.6%, sem o uso de membranas (Pjetursson et al., 2008). Em 2009, num estudo mais recente, elaborado por Jensen e Terheyden,
22
verificou-se que a taxa de sobrevivência associada a membranas é 100% contra 94.7% quando as membranas não são usadas (Jesen e Terheyden, 2009).
4. CONSIDERAÇÕES CIRÚRGICAS PARA ENXERTOS ÓSSEOS
Elementos determinantes num ambiente cirúrgico para a colocação de enxertos ósseos terão de ser respeitados, de forma a garantir o sucesso deste procedimento e incluem (Misch, 2008):
Ausência de infeção;
Encerramento de tecido mole; Manutenção do espaço; Imobilização do enxerto;
Fenómeno de aceleração regional (FAR); Vascularização do osso;
Fatores de crescimento;
Proteínas morfogénicas ósseas (BMP’s); Tempo de cicatrização;
Tamanho do defeito.
4.1. Ausência de Infeção:
Os materiais de enxerto reabsorvem em velocidades diferentes e dependendo do pH do ambiente cirúrgico. Se no local cirúrgico nos depararmos com um quadro de infeção, que pode atingir valores de pH menor que 2, os enxertos ósseos correm maior risco de formações de volume ósseo insuficientes, podendo ainda causar perda óssea na região recetora. Infeções na área recetora ou no enxerto ósseo podem ocorrer a partir de bactérias endógenas, falta de assepsia na técnica cirúrgica ou falha no encerramento primário de tecido mole. Caso seja necessário a administração de antibiótico, o suprimento sanguíneo dentro do enxerto é necessário para assegurar a distribuição eficaz deste medicamento (Misch, 2008).
23
4.2. Encerramento primário de tecido mole:
O encerramento primário de tecido mole está diretamente relacionado com a cicatrização por primeira intenção, o que o torna absolutamente fundamental para sucesso dos procedimentos com enxertos ósseos. Além disto, é de muita importância para o paciente, uma vez que diminui o desconforto no pós-operatório. A abertura da linha de incisão constitui a complicação mais frequente neste tipo de procedimentos, portanto de forma a evitá-la, o tecido sobrejacente deve ser avançado até uma maior área de volume de osso, de modo a evitar que a tensão na linha de incisão afaste o tecido mole. Outro pré-requisito para minimizar a incidência desta complicação diz respeito e, sempre que possível, à colocação da incisão sobre tecido queratinizado. O encerramento primário da ferida deve ser sempre feito sem tensão e o suprimento sanguíneo do retalho deve ser assegurado. O desenho do retalho deve sempre possuir sobre osso correspondente à área recetora e não sobre o enxerto ósseo ou membrana associada. O osso da área recetora tem a vantagem de fornecer fatores de crescimento para as margens, permitindo uma regeneração óssea mais rápida nesta área. A escolha do material de sutura deve ser feita em função do tipo e tamanho do enxerto ósseo. O ácido poliglicólico, por manter a tensão da sutura suficiente por um período de duas semanas e pelo facto de provocar uma leve reação tecidual, é geralmente, o material escolhido para a maior parte dos procedimentos com enxertos ósseos. A combinação entre suturas contínuas e suturas em colchoeiro horizontal pode ser indicada quando se está perante grandes aberturas de tecido mole (Misch, 2008).
4.3. Manutenção do espaço:
Para o processo de regeneração óssea é fundamental a manutenção de um espaço na zona de enxertos ósseos. A manutenção do espaço baseia-se no princípio do espaço ser suficiente, que permita que o osso possa preencher a região desejada. Quando o espaço mantido é preenchido por ar ou sangue, a qualidade inicial de osso é má. A manutenção do espaço pode ser conseguida através da colocação de um material reabsorvível, no entanto, se o material reabsorve antes do tempo necessário para a formação de tecido ósseo, ocorre deposição de tecido conjuntivo em vez de osso (Misch, 2008).
24
4.4. Imobilização do enxerto:
A remodelação óssea apresenta limites ao micromovimento. Durante o processo de remodelação óssea, é fundamental a existência de uma interface rígida para a formação de osso, caso contrário podemos assistir a um enxerto sem fixação ou encapsulamento por tecido fibroso e um pequeno movimento de 20 µm pode ser significativo. Portanto, a estabilização do enxerto é fundamental para a obtenção do volume ósseo previsível. Este facto assegura a adesão do coágulo inicial e os seus fatores de crescimento associados. A fixação do enxerto em bloco pode ser feita com parafusos (Misch, 2008).
4.5. Fenómeno de aceleração regional (FAR):
O FAR, é um processo através do qual o tecido se forma mais rápido do que o esperado, tornando o processo de cicatrização cerca de 2 a 10 vezes mais rápido. Trata-se de uma resposta local a um estímulo nocivo, como a indução de uma fratura, inflamação ou no que diz respeito á colocação de enxertos ósseos, o simples procedimento cirúrgico e fixação interna. Este acontecimento inicia-se nos primeiros dias e geralmente termina ao fim de 4 meses. O local recetor de enxerto ósseo de se preparado com o auxílio de uma broca na porção cortical, de forma a criar perfurações que permitam acesso a vasos sanguíneos do osso trabecular até ao local enxertado (Misch, 2008).
4.6. Vascularização do osso:
Para que o enxerto ósseo participe no processo de regeneração óssea, as suas células têm de permanecer vitais e, tal só é possível se um adequado suporte sanguíneo for mantido. O suprimento sanguíneo pode ser garantindo a partir de duas fontes fundamentais, a cortical do osso recetor, que contém poucas arteríolas e osso esponjoso que possui uma grande rede vascular. No seio maxilar, dado que esta cavidade está circundada por osso e a fonte principal de vascularização provém das paredes ósseas adjacentes, a formação de osso ocorre de uma forma previsível, independentemente do tipo de material que lá é colocado. Uma vascularização eficiente garante o suprimento
25
da área recetora, fornecendo células pluripotentes perivasculares que têm a capacidade de se tornarem osteoblastos. Uma forma de aumentar a quantidade de vasos sanguíneos que chegam à área recetora de um enxerto ósseo passa por descorticalizar esta zona com broca, garantindo aqui uma maior invasão de vasos sanguíneos (Misch, 2008).
4.7. Fatores de crescimento:
Fatores de crescimento são um ótimo coadjuvante no processo de formação óssea, na medida que permitem: a) desencadear formação e mineralização óssea; b) induzir a diferenciação de células mesenquimais indiferenciadas em células ósseas; c) ativar a cascata de reações intracelulares e a libertação de um número de fatores de crescimento adicionais e fatores de estimulação celular. Os fatores de crescimento ligam-se a células-alvo através de recetores de superfície existentes nestas últimas e estão principalmente presentes na matriz óssea, sendo libertados durante a remodelação (Misch, 2008).
Fatores de crescimento derivados de plaquetas, PDGF’s, são produzidos através de macrófagos ativados. Tem alto poder quimiotático que recrutam células mesenquimais para o interior do defeito (Sarment et al., 2006; Misch, 2008; Hout et al., 2011; Kaigler et al., 2011).
Fatores de crescimento fibroblásticos, FGF’s têm funções semelhantes aos fatores de crescimento derivados das plaquetas e funcionam maioritariamente por estimulação da proliferação de osteoblastos, que resulta na formação de osso. FGF-β para se tornar ativo necessita de estar na presença de osso e parece mais efetivo quando associado a PDGF’s (Misch, 2008; Hout et al., 2011).
A maior família de fatores de crescimento é TGF-β. Esta família inclui citoquinas que têm como principal função reparo de tecido conjuntivo e regeneração óssea. Além de quimiotáticos, estes fatores de crescimento estimulam a formação de uma matriz extracelular nas células osteoblásticas e podem até inibir a formação de osteoclastos. A combinação de TGF-β e PDGF auxiliam a cicatrização de tecido mole e duro, já que TGF-β deposita colagénio tipo 1 na ferida, ajudando no reparo destes tecidos (Misch, 2008).
26
Fatores de crescimento derivados da insulina, IGFI, II, são fabricados no fígado e funcionam como um agente quimiotático para células progenitoras mesenquimais derivadas da medula óssea (Misch, 2008).
4.8. Proteínas morfogénicas do osso:
Proteínas morfogénicas do osso, BMP’s encontram-se na matriz óssea extracelular e induzem a diferenciação celular de células mesenquimais de condroblastos e osteoblastos. BMP’s são um conjunto de 15 proteínas, sendo que algumas das quais foram clonadas e replicadas com o objetivo de induzir uma sequência completa de ossificação endocondral num tempo reduzido, mesmo em grandes defeitos (Ripamonti e Reddi, 1997; Misch, 2008; Guimond et al., 2010).
4.9. Tempo de cicatrização:
O tempo necessário para o processo de cicatrização é dependente de inúmeros fatores, tais como, fatores locais, número de paredes ósseas remanescentes, quantidade de osso autógeno empregue e tamanho dos defeitos ósseos. Por exemplo, enxertos de elevadas dimensões associadas a uma menor quantidade de paredes ósseas circundantes e com menos osso autógeno, necessitam de maior tempo de cicatrização. Algumas patologias sistémicas que comprometem a cicatrização tais como diabetes, hiperparatiroidismo, osteoporose, doença de Paget, necessitam de um tempo de cicatrização superior. Regra geral, um tempo de cicatrização entre 4 a 6 meses é necessário para defeitos ósseos inferiores a 5 mm. Já para defeitos ósseos superiores a 5 mm, é mais seguro aguardar cerca de 6 a 10 meses (Misch, 2008).
4.10. Tamanho do defeito:
Um defeito maior quer em altura, quer em largura necessita de um tempo de cicatrização superior para formação e maturação óssea. Também quanto maior o defeito, maior será a necessidade de emprego de uma maior quantidade de osso autógeno (Misch, 2008).
27
DISCUSSÃO
Numa tentativa de ultrapassar rebordos alveolares atrofiados na maxila posterior para reabilitação oral com implantes dentários, a elevação do pavimento do seio maxilar com posterior colocação de materiais de enxertos ósseos têm sido proposto, desde 1980 por Boyne. Vários tipos enxertos ósseos têm sido relatados como possíveis soluções, desde osso autógeno, osso liofilizado desmineralizado, hidroxiapatite, fosfato de tricálcio, osso bovino inorgânico desmineralizado ou mesmo combinações destes e de outros (Handschel et al., 2009).
A técnica convencional para elevações do pavimento do seio maxilar envolve o acesso através da criação de uma janela lateral no osso maxilar. Outra técnica vulgarmente utilizada baseia-se na utilização de osteótomos a partir de uma abordagem na crista óssea, no entanto, devido à visibilidade reduzida resultante, torna-se uma técnica bastante sensível com uma dificuldade acrescida, apesar de estar descrito que envolve menos complicações, comparando-a com a técnica convencional de acesso através da criação de uma janela lateral (Lozada et al., 2011). Uma alternativa à utilização de instrumentos rotatórios para osteotomia e posterior elevação do pavimento do seio maxilar é o uso de instrumentos piezoelétricos, que parecem evitar a perfuração da membrana do seio maxilar durante a sua elevação. Durante todos estes procedimentos, uma irrigação contínua é essencial de forma a reduzir o excessivo calor gerado ao osso (Diaz et al., 2007; Lozada et al., 2011). A complicação cirúrgica mais comum inerente a este procedimento é a perfuração da membrana de Schneider, que acarreta algumas consequências no período pós-operatório, incluindo a sinusite crónica bacteriana, edema, hemorragia, deiscência, perda do material de enxerto e perda do funcionamento fisiológico do seio maxilar (Lozada et al., 2011). Na técnica convencional de elevação do seio maxilar a taxa de sobrevivência de implantes, independentemente do tipo de material de enxerto ósseo utilizado, é elevada, entre os 96.3 e 99.8% (Pjetursson et al., 2008)
Qualquer material de substituição óssea deve potenciar a formação de novo osso, através de propriedades como a osteogénese, osteoindução e osteocondução. Osteogénese é conseguida pelo fornecimento de células osteogénicas e matriz diretamente no enxerto ósseo, como acontece no osso autógeno. Osteoindução postula que o material enxertado é quimiotático para células indiferenciadas produtoras de
28
osteoblastos. Já a osteocondução baseia-se no facto do osso enxertado funcionar como suporte para o crescimento de células osteogénicas (Lozada et al., 2011).
De acordo com a sua origem, enxertos ósseos podem ser classificados em osso humano e substitutos ósseos, podendo ainda ser considerados como autoenxertos, aloenxertos, xenoenxertos e materiais aloplásticos. Osso autógeno é recolhido do próprio paciente a partir de um local cirúrgico diferente daquele que se pretende implantar, como exemplos, temos a tuberosidade maxilar, calote craniana, ramo da mandíbula, crista ilíaca, tíbia, entre outros. O sucesso deste tipo de material tem sido amplamente suportado por vários autores, já que parece reunir propriedades osteoindutoras, osteogénicas e osteocondutoras, aliado ao facto de não ser imunogénico. No entanto, associado à recolha do material de enxerto, está a necessidade da criação de um segundo local cirúrgico, que naturalmente aumenta a morbidade do processo. Aloenxertos, são enxertos ósseos derivados de humanos, a partir de uma pessoa diferente daquela que vai ser enxertada, que atuam por osteocondução. Associado a este processo, está o risco de transmissão de doenças, bem como uma reação antigénica. A liofilização efetivamente reduz a reação antigénica, pelo que este tipo de enxerto é usado sob a forma liofilizada, apesar do processo reduzir a sua integridade. A grande vantagem é que este tipo de material está disponível em grandes quantidades, portanto deixa de haver a necessidade do próprio paciente ser o dador. Xenoenxertos são derivados desproteínizado, de osso esponjoso de origem animal, tal como osso bovino ou porcino. O risco de transmissão de doenças como a encefalopatia espongiforme é uma realidade, mas é insignificante, já que o componente orgânico do substituo ósseo é retirado. Enxertos de substituição óssea de hidroxiapatite derivados de bovinos atuam como uma matriz osteocondutora e têm a vantagem de estarem prontamente disponíveis comercialmente. Os enxertos aloplásticos derivados de cerâmicas, polímeros e compósitos, funcionam como uma matriz osteocondutora, no entanto, são amplamente dependentes da existência de um periósteo viável, o que lhes confere algumas limitações. Normalmente são usados para o preenchimento de grandes defeitos ósseos associados com outros materiais de enxerto, a fim de obter resultados mais satisfatórios. Isto porque, na generalidade, o uso de substitutos ósseos aloplásticos não apresenta resultados muito previsíveis, existe sempre um volume de osso formado inferior ao volume de substituto ósseo reabsorvido (Sukumar e Drizhal, 2008).
29
A escolha do material de enxerto é influenciada pela taxa de sobrevivência de implantes associada. Em estudos recentes, verificou-se que quando usado enxerto autógeno isoladamente, a taxa de sobrevivência de implantes é menor do que quando este material é associado a outros substitutos ósseos como o caso de xenoenxertos, 88.9% e 94.7% respetivamente. Quando usados apenas substitutos ósseos, a taxa de sucesso é de 96.1% (Del Fabbro et al., 2008).
Após a colocação do material de enxerto na janela óssea previamente preparada para acesso ao seio maxilar, uma membrana de recobrimento pode ser utilizada na tentativa de evitar a invasão de tecido fibroso para o local enxertado, o que contribui para o reparo e cicatrização da ferida. Uma grande variabilidade de membranas poliméricas tem sido descrita na literatura, que incluem membranas reabsorvíveis e não reabsorvíveis. Uma membrana reabsorvível é mais vantajosa, já que membranas não reabsorvíveis induzem infeção do seio pós-operatório por terem tendência a acumular uma camada de esfregaço bacteriano, retardando a cicatrização, além que pode necessitar de uma segunda cirurgia para a sua remoção (Nasser et al., 2005; Misch, 2008). Associado a uma membrana de recobrimento está uma taxa de sobrevivência de implantes superior, pelo que o seu uso é recomendado (Jensen e Terheyden, 2009).
30
CONCLUSÃO
De acordo com os resultados da pesquisa bibliográfica efetuada, a regeneração óssea associada a materiais de enxerto no seio maxilar apresenta resultados positivos e previsíveis. Este facto é uma possibilidade real para reabilitação de maxilas atrofiadas, cujo osso se apresenta com pouca altura óssea ou fraca qualidade para o suporte de implantes dentários, caso se trate de zonas edêntulas e em posterior.
No que se refere a cirurgias de elevação do pavimento do seio maxilar, a técnica convencional de acesso lateral, apesar de mais traumática para o paciente, é especialmente recomendada, pois permite uma clara visibilidade, possibilitando a colocação de um material de enxerto ósseo mais eficazmente.
O enxerto ósseo é uma escolha bem reconhecida e documentada por inúmeros autores para reabilitação associado ou não a membranas de barreira. Inúmeros tipos de substitutos ósseos e suas combinações são vulgarmente utilizados com diferentes taxas de sucesso. Osso autógeno foi durante muito tempo considerado como o padrão de excelência, aliando as suas propriedades osteocondutoras e osteoindutoras, no entanto apresenta limitações consideráveis de acesso e atualmente está associado a taxas de sobrevivência de implantes inferiores quando comparado com associações entre substitutos ósseos. De forma a ultrapassar esta limitação, vários substitutos ósseos têm sido sugeridos, como sejam, aloenxertos, xenoenxertos e materiais aloplásticos que agem maioritariamente por osteocondução, promovendo uma regeneração óssea capaz de preencher um defeito, possibilitando assim, uma reabilitação oral bem-sucedida com implantes dentários.
O uso de membranas, reabsorvíveis ou não reabsorvíveis, para encerramento da ferida cirúrgica tem sido amplamente apoiado pela literatura, impedindo a influxo de tecido mole para o interior do defeito ósseo e associado a taxas de sobrevivência de implantes superiores.