Universidade de Lisboa
Faculdade de Medicina de Lisboa
Resposta Humoral na Infecção por VIH-2: Impacto no diagnóstico, prevenção e evolução viral
José Maria Marcelino
Doutoramento em Ciências Biomédicas
Universidade de Lisboa
Faculdade de Medicina de Lisboa
Resposta Humoral na Infecção por VIH-2: Impacto no diagnóstico, prevenção e evolução viral
José Maria Marcelino
Orientador
Prof. Doutor Nuno Taveira Co-Orientadores Charlotta Nilsson, PhD Prof. Doutor Rui MM Victorino
Especialidade em Ciências Biopatológicas
Todas as afirmações efectuadas no presente documento são da exclusiva responsabilidade do seu autor, não cabendo qualquer responsabilidade à Faculdade de Medicina de Lisboa pelos conteúdos nele apresentados.
A impressão desta dissertação foi aprovada pelo Conselho Cientifico da Faculdade de Medicina de Lisboa em reunião de 22 de Fevereiro de 2011.
Dissertação apresentada à Faculdade de Medicina da Universidade de Lisboa, para obtenção do grau de Doutor em Ciências Biomédicas.
A presente dissertação foi realizada na Unidade de Tecnologia de Proteínas e Anticorpos Monoclonais, Instituto Nacional de Engenharia, Tecnologia e Inovação; na Unidade de Retrovírus e Infecções Associadas, Faculdade de Farmácia da Universidade de Lisboa e no Swedish Institute for Infectious Disease Control, Estocolmo, Suécia.
O trabalho aqui apresentado foi financiado pelo POCTI/ESP/48045/2002, Fundação para a Ciência e a Tecnologia.
Bolsa de Doutoramento da Fundação para a Ciência e a Tecnologia, (Referência: SFRH/BD/13892/2003).
Índice Geral Agradecimentos ... i Resumo ... v Summary...xi Capítulo I Introdução ... 1 A Pandemia ... 3 VIH-2 ... 3
Origem, Estrutura e Replicação ... 3
Patogénese da Infecção VIH ... 6
Defesas do Hospedeiro na Infecção por VIH ... 8
Resposta Celular... 9
Resposta Humoral ... 10
O papel dos anticorpos na infecção VIH ... 10
Anticorpos Neutralizantes... 13
Determinantes da neutralização no invólucro do VIH ... 14
Escape à Neutralização ... 18
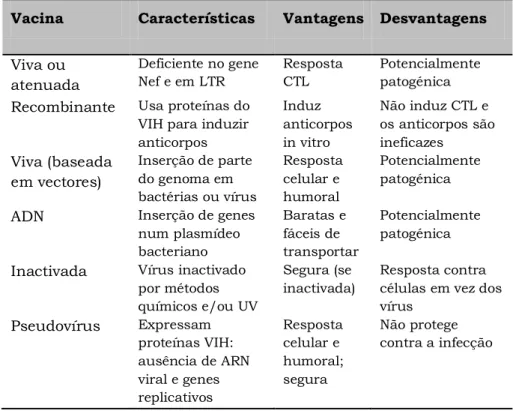
Vacinas para o VIH ... 19
Desafios e dificuldades ... 19
Modelos Animais ... 21
Referências ... 22
Capítulo II Objectivos e Plano de Trabalho ... 41
Objectivos e Plano de Trabalho ... 43
Capítulo III Teste de ELISA específico para o VIH-2 (ELISA-VIH2) ... 47
Resumo ... 49
Abstract ... 51
Capítulo IV
Resposta de anticorpos IgA e IgG inespecíficos e específicos para as
glicoproteínas gp36 e gp125 do VIH-2 ... 67 Resumo ... 69 Abstract ... 71 Introdução ... 73 Material e Métodos ... 74 Resultados... 77 Discussão ... 82 Referências ... 85 CAPÍTULO V Resposta humoral na evolução molecular das regiões C2, V3 e C3 do invólucro do VIH-2 em pacientes crónicos ... 93
Resumo ... 95 Abstract ... 97 Introdução ... 99 Material e Métodos ... 100 Resultados... 103 Discussão ... 108 Conclusões ... 111 Referências ... 113 CAPÍTULO VI Escape à Neutralização na Infecção VIH-2 ... 123
Resumo ... 125 Abstract ... 127 Introdução ... 129 Material e Métodos ... 130 Resultados e Discussão ... 133 Conclusões ... 141
Referências ... 142
CAPÍTULO VII Anticorpos neutralizantes contra isolados VIH-2 primários produzidos em murganhos BALB\c……. ... 149 Resumo ... 151 Abstract ... 153 Introdução ... 154 Material e Métodos ... 155 Resultados... 159 Discussão ... 165 Referências ... 167 CAPÍTULO VIII Discussão Geral e Conclusões ... 177
Discussão Geral e Conclusões ... 179
i
Agradecimentos
Quero agradecer a todos os que contribuíram para a realização deste trabalho e conclusão da minha tese de doutoramento:
Ewa Bjorling, my initial co-supervisor from Microbiology, Tumor and Biology Center (MTC) at Karolinska Institutet in Sweden. Thank you for answer without hesitation to the question I put you by email a few years ago: “Can you receive me at your lab for some weeks? I would like to get some practice with your HIV-2 neutralization method.” You received me without knowing me before and you opened me a door to share extensive knowledge and experience with you and your group. Thank you for encouraging my initial work and for the important support you gave it, which resulted in an important scientific collaboration along these last years between our workgroups. I wish you all the luck for your new professional trails. Charlotta Nilsson, my co-supervisor after Ewa Bjorling and until now, thank you for sharing with me all your scientific experience and for your good suggestions and stimulating discussions about my work. Your enthusiastic new ideas and knowledge on this field have enriched a lot this thesis. Working with you was excellent and I hope we’ll have new opportunities to collaborate again in the future. Rigmor Thorthesson, director of Vaccinology and Immunology Department of SMI, for having received me and having allowed that Charlotta Nilsson substituted Ewa Bjorling as my co-supervisor. All the members of the Swedish group: Qin Lizeng, for nice discussions about work and for the homemade Chinese food, of course. Mia, thanks you for receiving me at a weekend in my first arrival to Stockholm. Kerstin Andersson, for the great support with PBMC’s at P3 security level. Gunnel Biberfield for your sympathy to this foreign PhD student. Samer Sourial and Andreas Mörner for all your support in the months I spent in your lab along these years….and Sam I will never, never forget the triple mortal jump you did in front of my eyes when trying to skiing down the Rocky Mountains in 2002 in Keystone Symposia. If you’ll try to do such things now you wouldn’t do it better!
Nuno Taveira, obrigado por teres aceitado ser meu orientador deste fantástico projecto que teve início alguns anos atrás. Terminei uma
ii
fase desse percurso, mas não sei onde e como vai terminar! Foi bom teres partilhado comigo o teu conhecimento científico numa área tão delicada e exigente, e teres sido fundamental para a evolução da minha carreira científica. Nuno, obrigado pela excelente orientação e pela tua amizade.
Prof. Doutor Rui Victorino (Faculdade de Medicina de Lisboa) é com satisfação que lhe agradeço não só por ter aceitado ser co-orientador deste trabalho, como pela disponibilidade que sempre mostrou para me receber sempre que lho solicitei.
Carlos Novo (director da UTPAM, INETI), gostava de salientar que independentemente das mudanças que a vida nos trás, vais ser sempre a pessoa que me abriu “aquela” porta, a porta por onde um dia entrei para encontrar todas as seguintes, algumas abertas novamente por ti. Pessoas como tu são pouco comuns nos dias que correm. Agradeço-te por teres acreditado em mim desde o início e na confiança que tens depositado em mim ao longo destes anos. A vida está sempre a mudar, e novos desafios a surgirem, mas a verdadeira amizade permanece e não desaparece. Obrigado Carlos.
Dra. Alda Fidalgo (Ex-directora da UTPAM, INETI), quero agradecer-lhe a confiança que depositou em mim e todo o seu empenho em me abrir a porta de entrada no INETI.
Doutor Roseiro (Director do Departamento de Biotecnologia, INETI), quero agradecer-lhe as palavras de incentivo que sempre me dirigiu. Maria Marques, agradeço-te o teu apoio e amizade contínua, as tuas constantes palavras de encorajamento acerca do meu trabalho e as várias conversas de “corredor” que tanto ajudavam a manter o ambiente agradável de trabalho!
Aos restantes colegas da UTPAM, agradeço todo o apoio ao longo do tempo.
Prof. José Moniz-Pereira (Coordenador da URIA, FFUL), agradeço-lhe por ter permitido e apoiado o desenvolvimento da maior parte deste trabalho na URIA.
Prof. Helena Lourenço (Ex-responsável pelo Laboratório de Virologia) a sua capacidade de fazer pelos outros é também infindável. A sua
iii disponibilidade para apadrinhar este projecto foi fundamental, pois sem ela não seria possível realizá-lo. Obrigado pelo seu apoio e amizade.
No grupo de Microbiologia e na URIA, foram várias as pessoas que de uma forma ou outra também contribuíram para a realização deste trabalho, e aos quais quero agradecer a sua amizade e o bom ambiente de trabalho durante estes anos: Prof. Graciete, Prof. Aida, João Vital, José Miguel Pereira, Isabel Portugal, Madalena Pimentel, Elsa Anes, Perpétua Gomes, Ana Clara Ribeiro, Alexandra Maia e Silva, João Gonçalves (e o seu extenso grupo de colaboradores), Acilino Freitas, João Pedro Frade, Helena Barroso, Pedro Borrego, Cheila Rocha, Inês Bártolo, Marta Calado, Paula Matoso, Maria Espírito Santo, Ofélia, Vera, Lena Brás, Dr.ª Paula Resende, Lavínia, Nela (Mana!), D. Noémia, D. Fátima, Dina…e todos aqueles que vou acabar por não mencionar porque a lista já vai longa mas de quem não esqueci.
À Dra. Manuela Doroana e Prof. Doutor Francisco Antunes, do serviço de Doenças Infecciosas do Hospital Santa Maria, e ao Dr. Fernando Maltêz do serviço de doenças infecciosas do Hospital Curry Cabral, quero agradecer-lhes o empenho no recrutamento dos doentes e na obtenção das amostras biológicas para que este trabalho pudesse ter sido realizado.
Aos doentes do Hospital de Santa Maria e do Curry Cabral, a chave deste estudo, que concordaram em participar neste estudo, agradeço-vos o vosso empenho, que foi essencial para podermos compreender mais um pouco desta doença, que afecta milhões de pessoas.
Aos meus pais e irmãs, a vossa presença na minha vida tem sido importante não só para partilhar os bons momentos, mas também para ultrapassar as dificuldades. Os vossos sorrisos e incentivos têm sido importantes ao longo deste percurso e noutros caminhos. Sem vocês, tenho a certeza que a vida seria mais difícil.
Aos meus sogros, quero agradecer a disponibilidade que sempre demonstraram ao longo destes anos, e que em muito contribui para a realização deste trabalho. Obrigado por tudo.
iv
Aos meus filhos, Sara e João, que me incentivam a acreditar e lutar por um futuro melhor, e à Xana, não quero deixar de lhe dizer o quanto a amo e que sem a força e o apoio dela as dificuldades para realizar este trabalho seriam ainda maiores.
Ao meu irmão Henrique, quero que saibas que este objectivo alcançado é também teu, pois muito do caminho que já percorri nesta área, a ti o devo. Queria partilhar contigo este momento, como partilhamos outros, mas não posso, por isso aqui expresso o meu muito obrigado por tudo o que passamos juntos.
v
Resumo
Os indivíduos infectados pelo VIH-2 progridem mais lentamente do que os infectados pelo VIH-1, e estima-se que mais de 95% dos indivíduos infectados por VIH-2 estejam incluídos na definição clínica de long-term nonprogressors. Esta diferença faz do VIH-2 um potencial modelo de estudo de uma infecção VIH atenuada que pode fornecer uma visão única da patogénese da infecção VIH-1. Até ao momento, os mecanismos responsáveis pelo fenótipo atenuado do VIH-2 não são bem conhecidos. A carga viral plasmática é inferior nos indivíduos infectados pelo VIH-2 do que pelo VIH-1. Isto sugere que a principal diferença entre os dois tipos de VIH pode estar no grau de replicação viral, e presume que a resposta imunológica do hospedeiro contribui directamente para um controlo mais eficiente da replicação do VIH-2. Actualmente não existem dúvidas de que a maioria dos indivíduos infectados pelo VIH-1 ou VIH-2 produzem anticorpos neutralizantes (AcNT) autólogos e heterólogos. Contudo, existe alguma controvérsia sobre se os AcNT controlam de facto a replicação viral, uma vez que na maioria dos casos não se observa correlação inversa entre o título de AcNT e a carga viral plasmática. Na realidade, tanto no VIH-1 como no VIH-2, parece haver uma correlação directa entre o título de AcNT e a replicação viral o que sugere que a replicação viral é essencial para a produção de AcNT. Neste contexto, uma questão importante é saber como e quando serão induzidos os AcNT nos indivíduos infectados por VIH-1 e VIH-2 sem carga viral detectável.
Em contraste com o VIH-1, não existem estudos que caracterizem de forma qualitativa e quantitativa a cinética da resposta humoral anti-VIH-2 nos primeiros dias da infecção uma vez que a infecção por este vírus é quase sempre detectada na fase crónica. Obter informação detalhada sobre os vírus que estabelecem as infecções por VIH-2 e sobre a natureza da resposta imunológica durante a fase aguda da infecção por VIH-2 é vital para a produção de uma vacina. Neste contexto, o principal objectivo desta tese foi caracterizar no decurso da infecção VIH-2 aguda e crónica, de forma qualitativa e quantitativa, a natureza e dinâmica da resposta humoral neutralizante e não neutralizante e caracterizar o impacto destes anticorpos na evolução molecular e fenotípica do vírus. Também foram analisados os alvos da resposta neutralizante anti-VIH-2 e o potencial de dois novos imunogénios VIH-2 para uma vacina.
vi
O primeiro estudo (Capítulo III) teve como objectivo caracterizar em detalhe a antigenicidade de dois polipéptidos recombinantes derivados das glicoproteínas de superfície (rpC2-C3) e transmembranar (rgp36) do VIH-2ALI, o isolado primário de referência do grupo A. Utilizando estes dois polipéptidos, produziu-se um novo teste imunoenzimático (ELISA-VIH2) que revelou ter a sensibilidade e especificidade necessárias para diagnosticar serologicamente a infecção por VIH-2. A reactividade dos plasmas VIH-2+ foi significativamente maior para o antigénio rgp36 do que para o rpC2-C3, sugerindo que o ectodomíno da rgp36 é a região antigénica imunodominante no invólucro do VIH-2. A resposta de anticorpos para o rpC2-C3 foi mais variável, permitindo agrupar os doentes conforme a produção de anticorpos seja baixa ou alta. O teste permitiu ainda confirmar a infecção VIH-2 em plasmas que apresentam dupla serologia por testes comerciais. Devido às características evidenciadas, o teste ELISA-VIH2 poderá ser uma excelente alternativa aos testes comerciais de diagnóstico serológicos e de confirmação da infecção por VIH-2. O formato de antigénio duplo apresentado no teste permite ainda caracterizar em termos quantitativos e qualitativos a evolução da produção de anticorpos para as glicoproteínas do invólucro do VIH-2 em doentes infectados. Os antigénios rpC2-C3 e rgp36 produzidos na primeira fase do trabalho foram reagentes essenciais para o segundo trabalho (Capítulo IV), em que a presença de anticorpos IgA e IgG inespecíficos e específicos para as proteínas do Env do VIH-2 foi analisada num grupo de doentes 2 na fase aguda (crianças VIH-2 positivas infectadas via perinatal) e crónica da infecção. Demonstrou-se que, tal como na infecção VIH-1, a activação inespecífica das células B também ocorre na infecção VIH-2 crónica mas só ao nível das células B secretoras de IgG, uma vez que a concentração total de IgA no plasma dos indivíduos positivos para o VIH-2 foi idêntica à dos indivíduos saudáveis não infectados por VIH (grupo controlo). Em relação à resposta humoral específica para as glicoproteínas do invólucro do VIH-2, observou-se uma associação inversa entre os anticorpos IgG anti-rpC2-C3 e o número de linfócitos T CD4+ o que sugere que estes anticorpos reflectem a progressão da infecção VIH-2. A maioria dos indivíduos também produziu anticorpos IgA para os dois polipéptidos, o que identifica pela primeira vez a região C2-C3 como um forte indutor de anticorpos IgA no soro e confirma a forte antigenicidade do ectodomíno da gp36. Apesar da amplitude da resposta IgA, não se
vii observou nenhuma associação entre os anticorpos IgA anti-gp36 ou anti-gp125 e o estádio da doença como foi descrito para a infecção VIH-1. Em termos qualitativos (avidez) e quantitativos (titulo e concentração) a resposta IgG não neutralizante foi maioritariamente dirigida para a gp36. As subclasses de anticorpos IgG produzidas na fase crónica da infecção foram IgG1 (reactivos para ambos os polipéptidos) e IgG3 (reactivo para a gp36). Não se detectou nenhum efeito protector dos anticorpos IgG1 e IgG3 anti-gp36 na evolução clínica da SIDA, como foi sugerido para os anticorpos IgG2 anti-gp41 na infecção VIH-1. Contudo, numa análise longitudinal observou-se uma associação inversa significativaentre os anticorpos IgG anti-C2-C3 e o número de células T CD4+. Estes resultados são consistentes com a função imunoprotectora atribuída à região C2-C3 na infecção VIH-2. Uma vez que a resposta IgG anti-C2-C3 parece reflectir adequadamente o estado imunológico e a evolução clínica da infecção VIH-2, a concentração de anticorpos IgG anti-C2-C3 pode ser um marcador útil para monitorizar a progressão da doença na infecção VIH-2.
O principal promotor da evolução molecular e fenotípica do VIH-1 é a pressão selectiva exercida inicialmente pela resposta celular citotóxica e depois pelos anticorpos neutralizantes. A informação sobre este assunto no VIH-2 é ainda muito limitada. No Capitulo V deste trabalho analisou-se longitudinalmente a evolução molecular das regiões C2, V3 e C3 do Env em 18 doentes VIH-2 recorrendo a métodos filogenéticos e moleculares e correlacionou-se esta evolução com a resposta humoral anti-Env. A média da diversidade nucleotídica intra-hospedeiro aumentou ao longo do curso da infecção na maioria dos pacientes. A diversidade ao nível dos aminoácidos foi significativamente mais baixa para a região V3 e mais elevada para a região C2. A taxa de evolução do VIH-2 na região que compreende os domínios C2, V3 e C3 região foi de 0,014 substituições/local/ano, que é semelhante à que tem sido referida para a infecção VIH-1 crónica. O número e posição dos locais seleccionados positivamente foi muito variável, excepto para os codões 267 e 270 na região C2 que estiveram sob uma pressão selectiva forte e persistente na maioria dos doentes. Os locais de glicosilação ligados á asparagina localizados na C2 e na V3 mantiveram-se conservados em todos os pacientes ao longo do curso da infecção. A variação intra-hospedeiro da resposta IgG específica para as regiões C2, V3 e C3, ao longo do tempo, estava inversamente associada à variação nos nucleótidos e diversidade dos aminoácidos
viii
na região V3-C3. A variação da resposta IgA específica para a C2-V3-C3 estava inversamente associada à variação no número de locais N-glicosilação. Os resultados destes estudos demonstram que a dinâmica evolutiva do invólucro do VIH-2 durante infecções avirémicas crónicas é semelhante à do VIH-1, o que implica que o vírus deve estar em replicação activa nos compartimentos celulares. Contudo, a evolução convergente da N-glicosilação na C2 e V3 e a diversificação limitada da V3, indicam que existem factores funcionais importantes que constrangem a potencial diversidade do invólucro do VIH-2. Na globalidade, os resultados sugerem que: 1) os anticorpos IgG anti-C2V3C3 são potencialmente eficazes no controlo da população viral; 2) a região C3 é um alvo importante para os anticorpos IgA e a N-glicosilação desta região pode prevenir o reconhecimento de epitopos IgA.
Actualmente, está provado que a maioria dos indivíduos infectados cronicamente por VIH-2 produz AcNT de largo espectro. No entanto, conhece-se muito pouco sobre a dinâmica evolutiva desta resposta neutralizante na infecção VIH-2 crónica e existe informação controversa sobre o papel dos AcNT no controlo da replicação viral. O objectivo do trabalho apresentado no Capitulo VI desta tese foi caracterizar a dinâmica evolutiva da resposta neutralizante na infecção VIH-2 crónica e a sua relação com a evolução molecular e fenotípica do VIH-2 e com a evolução da doença. Neste contexto, analisou-se longitudinalmente ao longo de 3-4 anos a resposta neutralizante dirigida contra isolados virais primários autólogos e heterólogos num grupo de doentes VIH-2. A maioria dos doentes (8/12) estava infectada com vírus que utilizavam o coreceptor CCR5 (R5) e apenas quatro doentes estavam infectados com vírus que utilizam o coreceptor CXCR4 (X4). Estes resultados confirmam que o CCR5 é o principal coreceptor utilizado pelo VIH-2 in vivo. A presença de anticorpos IgG neutralizantes contra isolados autólogos foi detectada apenas em doentes infectados com vírus R5. È de realçar que, os quatro doentes infectados com vírus X4 e dois com vírus R5, não produziram anticorpos capazes de neutralizar os vírus autólogos. Estes resultados demonstram pela primeira vez que o escape à neutralização é bastante frequente na infecção crónica por VIH-2 e que há uma forte relação entre tropismo e neutralização (R5> sensibilidade e X4> resistência, P <0.0001) do VIH-2. Com uma única excepção, todos os doentes testados desenvolveram AcNT contra isolados VIH-2 heterólogos de fenótipo R5. A amplitude desta resposta neutralizante heteróloga é superior à que se observa noutros estudos de neutralização em que foram utilizados
ix pseudovírus e isolados primários de VIH-2. Contudo, tal como observado anteriormente, nenhum dos doentes produziu anticorpos neutralizantes contra isolados X4. A ausência de AcNT autólogos e heterólogos para os isolados X4 sugere fortemente que o escape do VIH-2 à neutralização in vivo está associado a alterações no tropismo celular (passagem de R5 para X4). Na infecção VIH-1, os estudos existentes sobre este assunto sugerem que não há uma relação entre a susceptibilidade dos vírus e o escape à neutralização e a utilização de coreceptores.
Demonstrou-se pela primeira, que a potência dos AcNT está inversamente associada com os anticorpos de ligação para a rpC2-C3 (título e avidez) e não para a rgp36. Estes resultados sugerem fortemente que os AcNT anti-VIH-2 têm como principal alvo as regiões C2, V3 e C3 no Env e que a maturidade é um factor importante na sua actividade neutralizante. As diferenças mais significativas entre os vírus R5 sensíveis à neutralização e os vírus X4 resistentes à neutralização ocorreram na região V3. Os vírus resistentes aos AcNT tinham a região V3 mais longa e um número maior de aminoácidos carregados positivamente. Estes dados sugerem que a V3 é o principal alvo dos AcNT dentro do domínio C2-V3-C3.
Tal como acontece com o VIH-1 são necessárias novas estratégias de prevenção da infecção VIH-2. O último objectivo desta tese (Capítulo VII) foi produzir novos imunogénios derivados do isolado de referência do grupo A, VIH-2ALI e avaliar o seu potencial neutralizante a nível pré-clínico em ratinhos. As proteínas nativas ou truncadas do invólucro do VIH-2ALI foram expressas em vírus da vacina e bactérias. A imunização de murganhos Balb\C com a gp125 truncada (gp125t) ou com o polipéptido rpC2-C3 só induziu uma resposta de anticorpos de ligação, semelhante à que o VIH-2 induz no homem, mas não induziu a produção de AcNTs. No entanto, a indução de AcNTs pelas mesmas proteínas monoméricas foi muito eficiente quando se imunizou previamente os animais com o vírus da vacina a expressar quantidades elevadas de gp125t. Os anticorpos desenvolvidos neutralizaram apenas vírus R5, que são, vírus com fenótipo igual ao do vírus que originou os imunogénios vacinais (VIH-2ALI). Os vírus X4 resistentes à neutralização apresentavam alterações importantes na sequência e estrutura da região V3, que divergiam significativamente da sequência aminoacídica, da carga total, tamanho e conformação da região V3 do VIH-2ALI. Globalmente, os resultados destes estudos demonstraram, pela
x
primeira vez, que AcNT amplamente reactivos contra o VIH-2 podem ser obtidos utilizando uma estratégia de imunização que consiste num priming com vírus da vacina recombinante a exprimir a glicoproteína monomérica gp125 seguida de reforços com o polipéptido rpC2-C3. Os resultados sugerem ainda que a região V3 é um domínio neutralizante de largo espectro no VIH-2 e confirmam a ligação existente entre o escape à neutralização e o tropismo X4 na infecção VIH-2 (Capítulo VI).
Em conclusão, os resultados obtidos nesta tese permitem evidenciar o papel central que a região C2-V3-C3 do Env tem na infecção VIH-2 e o impacto que pode ter no diagnóstico, monitorização e prevenção da infecção por este vírus. Por um lado, esta região é altamente antigénica, o que se revelou útil no diagnóstico serológico da infecção. Por outro lado, a associação inversa entre a resposta humoral contra esta região e o número de linfócitos T CD4+ significa que o nível de anticorpos anti-C2V3C3 é útil para monitorizar o estado imunológico e a evolução clínica de indivíduos infectados por VIH-2. As regiões C2, V3 e C3 contêm os determinantes antigénicos responsáveis pela indução de AcNT de elevada potência e ampla reactividade que são comuns nos indivíduos infectados por VIH-2. Estes resultados, em associação com as experiências de imunização em ratinho, sugerem fortemente que uma vacina para o VIH-2 deve direccionar a resposta humoral contra a C2, V3 e C3 na gp125. Contudo, ao contrário do que se presumia até aqui, a emergência de vírus resistentes à neutralização é comum na infecção por VIH-2 e está principalmente associada à emergência de vírus com tropismo X4 e com maior patogenicidade. Isto deve ser tido em conta na concepção de uma vacina para o VIH-2. Estes resultados também são relevantes para a utilização de antagonistas do CCR5 em pacientes VIH-2.
Palavras-chave: Infecção VIH-2; ELISA específico para VIH-2;
Anticorpos IgA e IgG específicos para o invólucro do VIH-2; Resposta neutralizante autóloga e heteróloga na infecção VIH-2 crónica; Escape à neutralização; Indução de anticorpos neutralizantes anti-VIH-2 em ratinhos.
xi
Summary
Individuals infected with HIV-2 progress more slowly than those infected by HIV-1, and it is estimated that over 95% of individuals infected by HIV-2 are included in the clinical definition of long-term
nonprogressors. This difference makes HIV-2 a potential model of an
attenuated HIV infection that can provide a unique insight into the pathogenesis of HIV-1 infection. So far, the mechanisms responsible for the attenuated phenotype of HIV-2 are not well known. Plasma viral load is lower in individuals infected with HIV-2 comparing to those infected with HIV-1. This suggests that the main difference between the two types of HIV may be at the level of viral replication, and assumes that the host immune response contributes significantly to a more efficient replication control of HIV-2. Currently, there is no doubt that the majority of individuals infected with HIV-1 or HIV-2 produce autologous and heterologous neutralizing antibodies (NAb).However there is some controversy over whether the NAb effectively control viral replication, since most cases have not shown an inverse correlation between the titer of NAb and plasma viral load. In fact, both HIV-1 and HIV-2 seems to show a direct correlation between the titer of NAb and viral replication suggesting that viral replication is essential for the production of NAb. In this context, an important question is how and when the NAb are induced in individuals infected with HIV-1 and HIV-2 without detectable viral load.
In contrast to HIV-1, there are no studies that characterize both qualitatively and quantitatively the kinetics of the anti-HIV-2 humoral response in the first days of infection since the infection by this virus is often detected in chronic phase. To get detailed information on viruses that establish HIV-2 infections and on the nature of the immune response during the acute phase of infection by HIV-2 is vital for the production of a vaccine. In this context, the main objective of this thesis was to characterize the course of acute and chronic HIV-2 infection, both qualitatively and quantitatively, the nature and dynamics of the neutralizing and non-neutralizing humoral antibody response and characterize the impact of these antibodies on the molecular and phenotypic evolution of the virus. We also analyzed the anti-HIV-2 neutralizing response targets and the potential of two HIV-2 new immunogens for a vaccine.
The first study (Chapter III) aimed to characterize in detail the antigenicity of two recombinant polypeptides derived from the surface (rpC2-C3) and transmembrane glycoproteins (rgp36) of
HIV-xii
2ALI, the reference group A primary isolate. Using these two polypeptides, a new enzyme linked immunoassay (ELISA-HIV2) was established that had enough sensitivity and specificity to diagnose HIV-2 infection serologically. The reactivity of HIV-2+ plasma was significantly higher for antigen rgp36 than for rpC2-C3, suggesting that the ectodomain of rgp36 is the immunodominant antigenic region in the envelope of HIV-2. The antibody response to the rpC2-C3 was more variable, allowing grouping of patients according to low or high antibody production. The test also allowed us to confirm HIV-2 in plasma samples that have dual serology result with commercial tests. Due to the observed characteristics, the ELISA-HIV2 may be a great alternative to commercial tests for serological diagnosis and for confirmation of infection by HIV-2. The format of double antigen presented in the test also allows for characterization, in a quantitative and qualitative manner, of the evolution of antibody production against the envelope glycoproteins of HIV-2 in infected patients.
The rpC2-C3 and rgp36 antigens produced in the first phase of this study were essential reagents for the second work (Chapter IV) in which the presence of specific and nonspecific IgA and IgG antibodies against HIV-2 Env proteins were analyzed in a group of HIV-2 patients in the acute (HIV-2 positive children perinatally infected) and chronic phase of infection. It was shown that, as in HIV-1 infection, nonspecific activation of B cells also occurs in chronic HIV-2 infection but only at the level of B cells secreting IgG, since the total concentration of IgA in the plasma of positive individuals for HIV-2 was identical to that of healthy individuals not infected with HIV (control group). Regarding the specific humoral response to the envelope glycoproteins of HIV-2, we observed an inverse association between anti rpC2-C3 IgG and the number of CD4+ T lymphocytes which suggests that these antibodies reflect the progression of HIV-2 infection. Most individuals also produced IgA antibodies against both polypeptides, which identifies for the first time C2-C3 region as a strong inducer of IgA antibodies in serum and confirms the strong antigenicity of the ectodomain of gp36. Despite the magnitude of IgA response, there was no association between IgA gp36 or anti-gp125 and the stage of disease as described for the HIV-1 infection. In qualitative (avidity) and quantitative terms (titer and concentration) the non-neutralizing IgG response was mainly directed to the gp36. The subclasses of IgG antibodies produced in the chronic phase of infection were IgG1 (reactive to both
xiii polypeptides) and IgG3 (reactive to gp36). Any protective effect of anti-gp36 IgG1 and IgG3 on clinical AIDS was not detected, as has been suggested for the anti-gp41 IgG2 in HIV-1 infection. However, a longitudinal analysis revealed a significant inverse association between anti-C2-C3 IgG antibodies and the number of CD4+ T cells. These results are consistent with the immune protective role assigned to the C2-C3 region in HIV-2 infection. Since the anti-C2-C3 IgG response seems to adequately reflect the immunological status and clinical outcome of HIV-2 infection, the concentration of anti-C2-C3 IgG may be a useful marker for monitoring disease progression in HIV-2 infection.
The main promoter of molecular and phenotypic evolution of HIV-1 is the selective pressure exerted initially by cytotoxic cellular response and thereafter by neutralizing antibodies. In HIV-2, the information on this subject is still very limited. In Chapter V of this study we analyzed the molecular evolution of C2, V3 and C3 Env regions longitudinally, in 18 HIV-2 patients using molecular and phylogenetic methods and we correlated these changes with anti-Env humoral response. The mean intra-host nucleotide diversity has increased over the course of infection in most patients. The diversity at amino acid level was significantly lower for V3 region and higher for C2 region. The rate of evolution of HIV-2 in the region comprising the C2, V3 and C3 domains was 0.014 substitutions/site/year, which is very similar to what has been referred to for chronic HIV-1 infection. The number and position of positively selected sites was highly variable, except for codons 267 and 270 in the C2 region that were under a strong and persistent selective pressure in most patients. The N-linked glycosylation sites located in C2 and V3 remained preserved in all patients throughout the course of infection. The intra-host specific IgG response for the regions C2, V3 and C3, over time, was inversely associated with variation in nucleotide and amino acid diversity in C2-V3-C3 region. The variation of specific IgA response to C2-V3-C3 was inversely associated with variation in the number of N-glycosylation sites. The results of these studies show that the evolutionary dynamics of HIV-2 envelope during non viremic chronic infections is similar to HIV-1, which implies that the virus must be actively replicating in cellular compartments. However, the convergent evolution of N-glycosylation in C2 and V3 and the limited diversification of V3, indicates that there are important functional factors that constrain the potential diversity of HIV-2 envelope. Overall, the results suggest that: 1)
anti-xiv
C2V3C3 IgG antibodies are potentially effective in controlling viral population; 2) the C3 region is an important target for IgA antibodies and N-glycosylation of this region can prevent recognition of IgA epitopes.
Currently, there is evidence that the majority of individuals chronically infected with HIV-2 produce a wide spectrum of NAb. However, very little is known about the evolutionary dynamics of neutralizing response in chronic HIV-2 infection and controversial information exists on the role of NAb in controlling viral replication. The aim of the work presented in Chapter VI of this thesis was to characterize the evolutionary dynamics of neutralizing response in chronic HIV-2 infection and its relationship with the molecular and phenotypic evolution of HIV-2 and with the evolution of the disease. In this context, we analyzed longitudinally over 3-4 years the neutralizing response directed against autologous and heterologous primary viral isolates in a group of HIV-2 patients. Most patients (8 out of 12) were infected with viruses that used the CCR5 coreceptor (R5) and only four patients were infected with viruses that used the CXCR4 coreceptor (X4). These results confirmed that CCR5 is the principal coreceptor used by HIV-2 in vivo. The presence of neutralizing IgG antibodies against autologous isolates was detected only in patients infected with R5 virus. Remarkably, four patients infected with X4 virus and two with R5 virus, failed to produce antibodies capable of neutralizing autologous viruses. These results show for the first time that neutralization escape is quite common in chronic infection by HIV-2 and there is a strong correlation between tropism and neutralization (R5> sensitive and X4> resistant, P>0.0001) of HIV-2. With only one exception, all patients tested developed NAb against heterologous HIV-2 isolates with R5 phenotype. The breadth of this heterologous neutralizing response is higher than that observed in other neutralization studies where pseudovirus and primary isolates of HIV-2 were used. However, as noted earlier, none of the patients produced neutralizing antibodies against X4 isolates. The absence of autologous and heterologous NAbs against the X4 isolates, strongly suggests that escape of HIV-2 from neutralization in vivo is associated with changes in cell tropism (transition from R5 to X4). In HIV-1 infection, the existing studies on this subject suggest that there is no relationship between virus susceptibility and escape from neutralization and coreceptor usage. We demonstrated for the first time that the potency of NAb response was inversely associated with binding antibodies to rpC2-C3 (titer and avidity) but not to rgp36. These results strongly suggest that the
xv HIV-2 NAb mostly target the C2, V3 and C3 regions in Env and that maturity is an important factor in their neutralizing activity. The most significant differences between the R5 virus sensitive to neutralization and X4 viruses resistant to neutralization occurred in the V3 region. NAb-resistant viruses had the longest V3 region and a larger number of positively charged amino acids. These data suggest that V3 is the main NAb target within the C2-V3-C3 domain.
As for HIV-1, new strategies for prevention of HIV-2 infection are required. The final objective of this thesis (Chapter VII) was to produce new Env immunogens derived from the reference isolate of group A, HIV-2ALI and evaluate their neutralizing potential at a pre-clinical level in the mice model. Native or truncated proteins of the HIV-2ALI envelope were expressed in vaccinia virus and bacteria. The immunization of Balb\C mice with the truncated gp125 (gp125t) or with the polypeptide rpC2-C3 induced a binding antibody response, similar to the one HIV-2 induces in man, but did not induce the production of NAb. However, the induction of NAb from the same monomer proteins was highly efficient when the animals were previously immunized with vaccinia virus expressing high amounts of gp125t.The antibodies developed neutralized only R5 virus, that is, virus with the same phenotype of the virus that originated the vaccine immunogens (HIV-2ALI). X4 viruses resistant to neutralization showed significant changes in the sequence and structure of the V3 region, which diverged significantly from the amino acid sequence, the total charge, size and conformation of the V3 region of HIV-2ALI. Overall, the results of these studies demonstrated, for the first time, that NAb broadly reactive against HIV-2 can be obtained using an immunization strategy consisting of priming with a recombinant vaccinia virus expressing the monomer glycoprotein gp125 followed by boosting immunizations with the polypeptide rpC2-C3. The results also suggest that the V3 region is a broad spectrum neutralizing domain in HIV-2 and confirm the link between neutralizing escape and X4 cell tropism in HIV-2 infection (Chapter VI).
In conclusion, the results obtained in this thesis highlight the central role that the C2-V3-C3 Env region plays in HIV-2 infection and the impact that it may have on the diagnosis, monitoring and prevention of infection by this virus. On one hand, this region is highly antigenic, which has proved useful in serological diagnosis of infection. On the other hand, the inverse association between the
xvi
humoral response against this region and the number of CD4+ T lymphocytes means that the level of anti-C2V3C3 antibodies is useful for monitoring the immune status and clinical outcome of infected individuals by HIV-2. The C2, V3 and C3 regions contain the antigenic determinants responsible for induction of potent and broadly reactive NAb which are common in individuals infected with HIV-2. These results, in combination with immunization experiments in mice strongly suggest that a vaccine against HIV-2 should drive the humoral response against C2, V3 and C3 in gp125. However, unlike what was assumed until now, the emergence of neutralization resistant virus is common in HIV-2 and, most importantly, is associated with the emergence of viruses with X4 tropism and higher pathogenicity. This has to be taken into account in the design of a vaccine against HIV-2. These results are also relevant for the use of CCR5 antagonists in HIV-2 patients.
Keywords: HIV-2 infection; ELISA specific for HIV-2, IgG and IgA
antibodies specific to the envelope of HIV-2, Autologous and heterologous neutralizing response in chronic HIV-2 infection; Neutralization escape; Neutralizing antibodies to HIV-2 in mice induction.
1
CAPÍTULO I
3
A PANDEMIA
A Síndrome da Imunodeficiência Adquirida (SIDA) constitui actualmente um grave problema de Saúde Pública a nível mundial. Desde que foi descrito o primeiro caso de SIDA nos Estados Unidos da América em 1981, já morreram aproximadamente 25 milhões de pessoas em todo o mundo, sendo os países em vias de desenvolvimento os mais afectados, e estima-se que actualmente mais de 33.4 milhões de pessoas estejam infectadas com o Vírus da Imunodeficiência Humana (VIH) em todo o mundo [1].
A SIDA caracteriza-se por uma deterioração progressiva do sistema imunitário e subsequente aparecimento de infecções oportunistas que conduzem à morte do hospedeiro [2]. Estudos epidemiológicos e genéticos confirmam que o VIH é o agente etiológico da SIDA. Há dois tipos de VIH: VIH-1 e VIH-2. O VIH-1 é responsável pela maioria das infecções a nível mundial [3], enquanto a infecção VIH-2 está geograficamente limitada a países da África Ocidental. Portugal é o país da Europa que tem maior prevalência (3.2%) de casos de SIDA notificados. Do total de 15.685 casos de SIDA acumulados até 31 de Dezembro de 2009, 494 foram causados pelo VIH-2 [4].
VIH-2
Origem, Estrutura e Replicação
A colaboração entre clínicos, investigadores portugueses e franceses em 1985 culminou com a identificação de um novo retrovírus, o VIH-2 [5]. Estudos filogenéticos indicam que o VIH-VIH-2 foi introduzido na população humana a partir do sooty mangabey, vírus que induz imunodeficiência no símio, e que o foco inicial (epicentro) terá acontecido na Costa do Marfim entre 1940 e 1950 [6]. Esta infecção é considerada endémica, em particular, na Guiné-Bissau, Senegal, Gâmbia, Gana, Costa do Marfim e Cabo Verde, sendo a Guiné-Bissau o país em que a prevalência de infecção por VIH-2 é maior. Os oito grupos de VIH-2 podem ser classificados como epidémicos (A e B) e não epidémicos (C até H), mas só os vírus do grupo A e B é que têm relevância clínica [7;8]. O grupo A é predominante em todos os países e talvez na Costa do Marfim, e o grupo B na Costa do Marfim [9]. Estruturalmente, as partículas virais do VIH-2 são constituídas por um invólucro externo (com origem na membrana da célula hospedeira), composto pela glicoproteína (gp) transmembranar (TM) e de superfície (SU), uma matriz interna proteica e uma nucleocápside proteica em forma de cone onde se encontram as moléculas de ácido
4
ribonucleico (ARN), e as enzimas necessárias à replicação viral (Figura 1).
Figura 1. Esquema de uma partícula vírica do VIH-2 (Adaptado da
referência [10]).
As glicoproteínas de SU e TM desempenham um papel fundamental na entrada do vírus na célula hospedeira. A infecção inicia-se pela interacção entre a gp-SU (125kDa, gp125) e o receptor celular CD4, originando alterações na conformação da gp125 e subsequente ligação ao coreceptor das quimiocinas, CCR5 (R5) ou CXCR4 (X4). As alterações conformacionais da gp36 ocorrem após interacção do péptido de fusão com a membrana citoplasmática da célula hospedeira (Figura 2). Ao contrário do VIH-1, a maioria dos isolados
Figura 2. Esquema representativo do processo de fusão do VIH
5 VIH-2 primários in vitro conseguem infectar células na ausência do receptor CD4 [12;13] e podem também utilizar uma grande variedade de outros coreceptores celulares para além do R5 e do X4 [14-17].
O ciclo de replicação inicia-se (Figura 3) após a fusão entre a membrana viral e a celular. A cápside viral entra no citoplasma da célula hospedeira, o seu conteúdo é libertado, e o ARN viral é transcrito para uma cadeia dupla de ácido desoxirribonucleico (ADN) pela transcriptase reversa (RT). O ADN proviral é transportado para o núcleo e inserido no cromossoma da célula hospedeira pela integrase viral. Depois da integração o ADN proviral é transcrito, produzindo uma cadeia de ácido ribonucleico (ARN) viral que é transportada do núcleo para o citoplasma, onde o ARNm (mensageiro) viral é traduzido originando na maioria das vezes (porque nem sempre se formam as poliproteínas vif, nef, ver e tat) as poliproteínas que vão dar origem às proteínas virais. A poliproteína precursora gp160 é clivada pela protease na gp125 e gp36 sendo depois transportadas para a membrana plasmática da célula infectada. A associação entre as poliproteínas do Gag (p55) e Gag-Pol (p160) na superfície interna da membrana plasmática e o ARN genómico do VIH vai originar à formação de um novo virião a partir da membrana da célula hospedeira [18].
6
Patogénese da Infecção VIH
A infecção VIH é geralmente caracterizada por uma fase aguda de intensa replicação viral e difusão para os tecidos linfóides, uma fase crónica, muitas vezes assintomática em que a activação imunitária e a replicação viral se mantêm, e uma fase avançada de depleção acentuada das células T CD4+, que leva à SIDA [19]. Durante a infecção VIH ocorre uma depleção profunda de células T CD4+, principalmente, no tecido associado ao intestino (GALT), que é acompanhada por níveis elevados de viremia plasmática e disseminação do vírus para outros órgãos (Figura 4). Neste período, são estabelecidos reservatórios víricos, de que são exemplo as células foliculares dendríticas nos centros germinativos, as células T e macrófagos latentemente infectadas, que possuem o ADN vírico, mas que não expressam proteínas víricas e, por isso, escapam ao sistema imunitário. Durante a fase crónica da infecção, a replicação do VIH também ocorre nos tecidos secundários, resultando numa activação imunitária generalizada, numa produção sustentada de vírus, numa renovação elevada de células T e, finalmente, na destruição do sistema imunitário do hospedeiro e progressão rápida da doença [20].
Figura 4. Principais eventos na progressão da doença associados à
7 Estudos efectuados em modelos animais e no homem sugerem que a activação imunitária é determinante na imunopatogénese do VIH. Este processo pode ser originado, aquando da replicação do VIH no interior do epitélio da mucosa intestinal e consequente danificação, pela alteração do fenótipo e das múltiplas funções das células T, e pela indução de vias moduladoras que regulam negativamente certas funções específicas das células T [21]. Durante o estabelecimento da viremia (Figura 5), as células de ambos os braços do sistema imunitário, imunidade inata e adaptativa, são activadas pelas proteínas virais e pela translocação dos produtos microbianos dos tecidos associados ao intestino (GALT) para o sangue periférico. As células activadas vão produzir quantidades de citocinas pró-inflamatórias, como o factor de necrose tumoral alfa, interferão alfa
Figura 5. Factores associados com a activação imunitária induzida
pelo VIH (Adaptado da referência [20]).
8
(IFN-) e interleucina (IL) -1beta e IL-6, que levam a uma activação imunitária crónica. Além disso, a replicação do VIH e a resposta imunológica do hospedeiro à infecção contribuem também para a activação imunitária. Estes eventos promovem níveis elevados de replicação do VIH, que acabam por levar à exaustão e destruição do sistema imunitário [20].
O VIH-2 também causa a SIDA no hospedeiro. Contudo, o VIH-2 está associado a uma progressão mais lenta da doença [22], em que só 25% dos indivíduos infectados progridem para a fase de SIDA [23]. Apesar do grau de activação imunitária ser semelhante na fase crónica da infecção por VIH-1 e por VIH-2 para o mesmo grau de depleção de células T CD4+ [24;25], os indivíduos infectados pelo VIH-2 têm uma taxa de declínio de linfócitos T CD4+ menos acentuada [26] e uma carga viral plasmática inferior à dos indivíduos infectados por VIH-1 [27;28]. Vários estudos referem que a carga proviral é similar em ambas as infecções [22;29-32]. Contudo, dois estudos recentes sugerem diferenças na carga proviral entre as duas infecções. Um estudo refere que a carga proviral é superior nos indivíduos infectados por VIH-2 comparado com os indivíduos infectados por VIH-1, para contagens de células T CD4+ inferiores a 300 células [33]. O outro estudo refere que a carga proviral é idêntica nas duas infecções para contagens de células T CD4+ inferiores a 300, mas é superior nos indivíduos infectados por VIH-1 para contagem de células T CD4+ superiores a 300 [34]. Recentemente, foi observada uma correlação positiva, entre a frequência de células T CD4 específicas para o VIH-2 e a activação imunológica, e negativa entre frequência de células T CD4 e a carga proviral [35]. A manutenção das células T CD4 durante a infecção VIH-2 crónica poderá estar correlacionada com uma timopoiese mais eficiente [36]. Ao invés do VIH-1, o VIH-2 não afecta a maturação e diferenciação das células dendríticas, essenciais à produção de IFN-, uma citocina importante na estimulação de outras células do sistema imunitário, com capacidade antiviral, e fundamental na ligação entre a imunidade inata e adquirida [37].
Defesas do hospedeiro na infecção por VIH
Durante a fase inicial e aguda da infecção por VIH o hospedeiro desenvolve respostas celulares [38-40] e humorais [41-44] específicas para o VIH, ainda que a maioria dessas respostas não evite a replicação do vírus na maioria dos indivíduos infectados. Nesta fase há selecção de variantes virais que conseguem escapar ao controlo
9 imunitário exercido pela resposta celular [45;46] ou humoral [43;47-49].
A imunidade inata é a primeira linha de defesa a responder à infecção antes do desenvolvimento de uma resposta adaptativa específica [50]. Os macrófagos, as células dendríticas (DC), as células “natural killer” (NK), as células T γδ, as citocinas (IL-2, IL-12, IFNγ, IL-4, IL-10 e IL-15), as quimiocinas (CCR5, CXCR4 e IFN γ) e outras pequenas moléculas circulantes (defensinas) têm um papel fundamental no controlo e replicação do VIH [51;52]. Existem cada vez mais evidências sobre o papel do sistema complemento no controlo da replicação do VIH na fase inicial [53] e em fases posteriores da infecção [54].
Resposta Celular
Apesar de existir alguma controvérsia quanto ao papel da resposta celular no controlo da infecção pelo VIH-1, uma vez que em alguns estudos não foram observadas correlações entre a resposta celular e a carga viral no plasma [55;56]. Contudo, a maioria dos estudos sugere que uma resposta de células T CD8+ especifica para antigénios VIH-1 está associada a um melhor controlo da replicação do vírus, a uma carga viral mais baixa e a uma progressão mais lenta da doença nas fases iniciais da infecção por VIH-1 [57-62]. Na infecção VIH-2, as respostas celulares específicas têm sido documentadas num pequeno número de indivíduos infectados. Comparando as células T CD8+ especificas para o VIH-2 e para o VIH-1 quanto à produção de IFN-γ [63-65], capacidade proliferativa [66], e citoxicidade [64], não foram observadas diferenças significativas, o que sugere que estes aspectos da resposta adaptativa para o VIH-2 não contribuem para um maior controlo do vírus e uma melhor evolução clínica. No entanto, a frequência de células T CD4+ especificas para o VIH-2 com maior capacidade proliferativa e uma maior capacidade de produzir IL-2 é mais frequente na infecção VIH-2 crónica do que na infecção por VIH-1 [65;67;68]. A manutenção da produção de IL-2 pode estar associada a uma maior capacidade de renovação das células T, bem como à diminuição da apoptose na infecção VIH-2, uma vez que na infecção por VIH-1, a diminuição da produção de IL-2 tem sido associada a uma possível redução da renovação das células T e a um aumento da susceptibilidade à apoptose celular [69].
10
Resposta Humoral
O papel dos anticorpos na infecção VIH
Não existem dúvidas quanto ao papel que os anticorpos têm no diagnóstico da infecção VIH [70;71]. Os anticorpos específicos para o VIH podem ser detectados em vários compartimentos como, no sangue, nas mucosas e fluidos genitais. Os primeiros anticorpos surgem aproximadamente 15 dias após o início da infecção (Figura 6) e são a base para a maioria dos testes de despiste da infecção (ex. Elisa). Mais tarde, quando se observa uma redução na virémia e na antigenémia, detectam-se os anticorpos neutralizantes autólogos. Os anticorpos no plasma reagem contra as proteínas do Env, gag, Pol e proteínas reguladoras – vpr, tat, nef. [72]. Durante a infecção VIH são produzidas imunoglobulinas (Igs) do tipo M (IgM), G (IgG) e A (IgA).
Figura 6. Cinética da resposta humoral na fase aguda da infecção
pelo VIH quanto à evolução da carga viral, anticorpos não neutralizante e anticorpos neutralizantes (Adaptado da referência [73]).
A IgM é a primeira Ig a ser produzida, mas apresenta uma baixa afinidade para o antigénio e encontra-se apenas no sangue [74]. A IgA é a Ig predominante na superfície das mucosas no homem e na maioria dos mamíferos, e é a segunda Ig mais abundante em circulação no homem. As múltiplas formas moleculares e as
11 diferentes subclasses da IgA fazem com que seja a mais heterogénea das Ig [75]. No homem existem 3 formas: a monomérica (mIgA) representa mais de 80-90% da IgA no soro; a dimérica (dIgA) ou polimérica (pIgA) e a forma secretora (sIgA). Os dois subtipos de IgA presentes no soro são a IgA1 e a IgA2. A IgA1 representa 85% das IgA totais. Em termos funcionais as IgA podem ser divididas em IgA secretoras em (compartimento da mucosa), ou IgA plasmáticas (compartimento sistémico). Vários estudos têm sugerido que os anticorpos IgA presentes nas mucosas (secreções vaginais e saliva) protegem contra a infecção VIH-1 e VIH-2 [76-81].
A IgG1 é a subclasse predominante no soro de pacientes infectados por VIH-1 [82;83]. Na infecção VIH-1 o título de anticorpos IgG1 contra a p24 e a gp120 é significantemente maior nos pacientes que controlam a replicação comparado com progressores crónicos [82]. A neutralização de isolados VIH-1 R5, X4 ou R5X4 é mais eficaz com a IgG3 do que com a IgG1 ou IgG2, isto deve-se á região que liga o fragmento Fc ao fragmento variável ser maior [82]. Em alguns indivíduos VIH-1 assintomáticos ocorre a produção de anticorpos anti-Tat e a sua presença tem sido correlacionada com o estado de LTNP [84].
Os anticorpos desempenham um papel fundamental no controlo e eliminação das partículas virais e células infectadas pelo VIH. Os anticorpos que se ligam às proteínas do invólucro e inibem directamente a entrada do vírus na célula são denominados de anticorpos neutralizantes (AcNT). A figura 7 exemplifica o modo de
Figura 7. Esquema do modo de acção de alguns AcNT humanos
como o b12 (B), 17b e 2G12 (C) e 2F5 e 4E10 (D), em várias fases do processo de entrada do VIH na célula (Adaptado da referência [85]).
12
acção de alguns AcNT humanos de largo espectro e com uma elevada potência neutralizante. O anticorpo b12 interfere no local de ligação da gp120 ao receptor CD4; o 2G12 é dirigido para um epitopo glicosilado na gp120, o 17b liga-se ao domínio de ligação ao coreceptor que fica exposto após a ligação da gp120 ao receptor CD4, e os anticorpos 2F5 e 4E10 evitam a fusão entre a membrana do vírus e da célula ao ligar-se à gp41 [85].
Os anticorpos não formalmente neutralizantes podem também ter actividade antiviral que é mediada pela região constante (Fc) do anticorpo, e resulta da interacção entre a região Fc do anticorpo e os receptores da região Fc expressos na membrana celular de vários tipos de células (ex. NK, macrófagos, dendríticas e neutrófilos). Estes anticorpos actuam através de um ou mais dos seguintes mecanismos antivirais (Figura 8): citoxicidade dependente do complemento (CDC), citoxicidade celular dependente do anticorpo (ADCC), inibição viral mediada por células e dependente dos anticorpos (ADCVI), e fagocitose [86-91]. O mecanismo de acção antiviral da ADCVI é semelhante ao da ADCC, só que em vez de ocorrer a lise da célula infectada, ocorre a inibição da saída dos viriões das células infectadas [92;93]
Figura 8. Mecanismos antivirais mediados pela região Fc do
13 Numerosos estudos têm demonstrado uma associação inversa entre resposta ADCC e ADCVI e progressão da doença, e uma associação directa com o número de células CD4 e a carga viral em indivíduos positivos para VIH-1 [95].
Anticorpos Neutralizantes
A resposta neutralizante desenvolvida pela maioria dos indivíduos durante a infecção pelo VIH é dirigida contra as glicoproteínas do invólucro do VIH (gp-TM e SU) [96-100]. A presença de AcNT (Figura 9) autólogos no plasma é detectada normalmente ao fim de seis meses após a infecção, enquanto os AcNT heterólogos são normalmente detectados na fase mais avançada da infecção e apenas uma minoria de indivíduos infectados produz AcNT heterólogos com actividade neutralizante para múltiplos isolados VIH-1 primários [85;96;96;101]. Há estudos que associam a presença de anticorpos neutralizantes específicos para o VIH-1 (de amplitude e potencia elevada) com a não progressão da infecção [102-104]. Contudo, noutros estudos não foi possível observar esse efeito no controlo da replicação [105;106]. A progressão da doença VIH-1 tem sido associada à perda da actividade neutralizante, escape viral e a ausência de anticorpos neutralizantes [103;107;108]. A presença de AcNT no plasma de indivíduos infectados por VIH-2 foi demonstrada pela primeira vez por Robin Weiss e colaboradores [109]. Os vários estudos realizados sobre neutralização do VIH-2 têm apresentado algumas lacunas no que respeita ao número de amostras utilizadas nos ensaios, à utilização de isolados adaptados em vez de isolados primários, à falta de correlação clínica e à não utilização de ensaios de neutralização padronizados [110-112].
Figura 9. Evolução da viremia, resposta celular citotóxica e
anticorpos neutralizantes (AcNT) durante a infecção VIH (Adaptado da referência [113]).
14
Apesar destas limitações, os resultados obtidos sugerem que o VIH-2 tem uma menor capacidade de escapar aos AcNT comparado com o VIH-1 [47]. A glicosilação da glicoproteína externa do invólucro, gp125, a infecção não dependente do CD4 e a utilização de coreceptores alternativos in vitro parecem ser factores determinantes para um melhor controlo dos isolados VIH-2 primários pelos AcNT [112;114;115].
A resposta neutralizante autóloga e heteróloga em indivíduos infectados pelo VIH-2 ou pelo VIH-1 tem sido analisada e comparada em vários estudos. Os AcNT contra isolados primários autólogos são mais comuns na infecção VIH-2 do que na infecção VIH-1 [111;116]. Um estudo recente sugere que os indivíduos VIH-2 positivos desenvolvem uma resposta neutralizante heteróloga de grande amplitude, mas com uma potência de neutralização mais baixa [117]. Esta maior amplitude no VIH-2 pode não ter sido originada pela diversidade viral ou pelo escape à neutralização como no VIH-1, mas sim devido a uma propriedade intrínseca do VIH-2 como antigénio. A existência de um repertório de anticorpos neutralizantes mais amplo nos indivíduos VIH-2 positivos pode também ser consequência de um sistema imunitário mais bem preservado. Os AcNT com actividade neutralizante contra isolados VIH-1 primários heterólogos só são encontrados nas fases finais da infecção VIH-1, e a maioria dos indivíduos infectados não conseguem desenvolver uma resposta neutralizante heteróloga que neutralize múltiplos vírus diferentes durante o primeiro da infecção [118].
Existem indivíduos infectados por VIH-1 que se mantêm saudáveis na ausência de terapia anti-retroviral. Estes indivíduos denominados de “long-term non-progressors” [LTNPs] mantêm o número de células T CD4+ dentro dos valores normais durante mais de 10 anos, e representam entre 5 a 15% da população de indivíduos VIH-1 positivos crónicos. Os níveis de ARN viral no plasma dos LTNP são frequentemente baixos. Entre os indivíduos LTNP foram identificados dois subgrupos, os "elitecontrollers" [ECs] que mantêm a carga viral abaixo do limite de detecção (50 cópias de ARN/ml) dos testes comerciais [119] e os "viremic controllers" que persistentemente têm carga viral detectável, mas em níveis muito baixos. Os EC representam menos de 1% da população infectada por VIH-1 [120].
Determinantes da neutralização no invólucro do VIH
A glicoproteína de SU do VIH é composta por 5 regiões hipervariáveis (V1 a V5) separadas por 5 regiões relativamente mais conservadas, regiões C1 a C5 (Figura 10). Nos últimos anos a região V3, denominada o principal determinante da neutralização (PDN), tem
15 merecido especial atenção, uma vez que para além de conter o PDN, esta região também está envolvida na fusão viral e no tropismo celular [121;122]. Durante a fase aguda e crónica da infecção VIH-1 o título de anticorpos específicos contra a região V3 é muito elevado [122].
Figura 10. Estrutura secundária representativa das regiões
constantes e variáveis da glicoproteína de superfície do VIH (Adaptado da referência [123]).
Apesar de esta região ser muito imunogénica, a actividade neutralizante dos anticorpos anti-V3 é muito baixa contra isolados VIH-1 primários, enquanto os isolados adaptados são facilmente neutralizados [124-126].
Figura 11. Desenho esquemático das regiões variáveis da gp120 de
isolados VIH-1 primários A) e adaptados B) com os locais de ligação ao receptor CD4 (R) e ao coreceptor (CoR) R5 ou X4. (Adaptado da referência [126] ).
16
Os epitopos conformacionais presentes na região V3 da gp120 dos isolados VIH-1 primários induzem AcNT com elevada potência neutralizante, frequentemente abaixo de ng/ml, comparado com os anticorpos induzidos por epitopos lineares [127;128].
Está bem definido que a ligação da gp120 do VIH-1 ao receptor CD4 altera as posições das regiões V1/V2 e V3, expondo desta forma as regiões conservadas adjacentes à região V3 [129-131]. Os glicanos existentes nas regiões V1/V2 e na base da V3 restringem o acesso dos anticorpos à região V3 [132-134]. A deleção da região V1/V2 redirecciona a resposta humoral para a região V3 alterando a imunogenicidade da gp120 [135-137]. Estes dados sugerem a existência de dois estados conformacionais da gp-SU. O primeiro estado corresponde a uma estrutura fechada, em que os epitopos nos locais de ligação ao CD4 e ao coreceptor R5 ou X4 não estão expostos aos anticorpos; o segundo estado é uma estrutura aberta, em que os epitopos nos locais de ligação ao CD4 e ao R5 ou X4 ficam expostos aos anticorpos (Figura 11) [126].
Os determinantes da neutralização do VIH-2 não estão tão bem caracterizados como os do VIH-1. Apesar da região V3 do VIH-2 apresentar um elevado grau de similaridade entre os diferentes grupos [138] e da região central da V3 ser muito conservada, o papel da V3 na indução de anticorpos neutralizantes no VIH-2 não tem sido consensual. Alguns trabalhos descrevem que no VIH-2 a utilização de péptidos lineares é suficiente para induzir anticorpos neutralizantes contra a região V3 [139-141]. No entanto, outros estudos não lhe atribuem esse papel [142;143].
As regiões V1/V2 da gp125 dos isolados VIH-2 primários parecem não interferir com a ligação dos anticorpos à região V3, como acontece no VIH-1, uma vez que a deleção desta região não aumenta o acesso dos anticorpos à região V3 do 2 [144]. Os isolados VIH-2 primários mais sensíveis aos AcNT são os que não precisam do receptor celular CD4 para infectar as células [12], enquanto nos isolados VIH-1 primários só a deleção da região V1/V2 é que torna os isolados mais sensíveis à neutralização. As diferenças estruturais entre as glicoproteínas nativas do invólucro de ambos os vírus sugerem que no VIH-2 a gp125 dos isolados primários terá uma estrutura aberta, permitindo deste modo que o domínio de ligação ao coreceptor celular na região V3 fique parcial ou totalmente exposta aos anticorpos (Figura 11) [145]. No entanto este assunto ainda é
17 controverso porque indivíduos infectados por VIH-2 não produzem anticorpos anti-V3.
As características estruturais que as glicoproteínas de SU (gp120) do VIH-1 apresentam, como uma forte glicosilação (50% de glicanos), uma grande variabilidade ao nível da sequência de aminoácidos [47;124;146;147], assim como a não exposição dos locais de ligação ao receptor, têm sido grandes obstáculos à indução de AcNT protectivos de largo espectro para o VIH-1 [47]. A produção de AcNT de amplitude elevada nos indivíduos VIH-1+ é geralmente baixa. Apenas 10 a 30% dos indivíduos VIH-1 infectados desenvolvem AcNT de amplitude elevada [148]. Apesar de terem sido isolados vários anticorpos monoclonais humanos contra o invólucro do VIH, apenas uma pequena percentagem deles neutraliza múltiplos isolados VIH-1 primários [128;149]. Estes anticorpos (Tabela 1) reconhecem epitopos conformacionais no domínio externo da gp120 e na região externa da gp41 próxima da membrana [128;149] Até ao momento não foram ainda isolados anticorpos monoclonais neutralizantes humanos para o VIH-2.
Tabela 1. Anticorpos monoclonais humanos neutralizantes de largo
espectro de neutralização (Adaptado da referência [96]).
Anticorpos neutralizantes Epitopo (local) Características do epitopo
4E10 MPER da gp41 do VIH-1 Região NWFNIT pode ter
reactividade cruzada com a cardiolipina
2F5 MPER da gp41 do VIH-1 Região ELDKWA pode ter
reactividade cruzada com a cardiolipina
Z13 MPER da gp41 do VIH-1 WNWFDITN
447-52D gp120 Epitopo conformacional conservado no domínio externo da gp120 PG9 e PG16 Regiões V1/V2 e V3 na gp120 Conformacional VCR01 Local de ligação ao receptor CD4 Conformacional B12 gp120 Epitopo conformacional conservado no domínio externo da gp120
![Figura 2. Esquema representativo do processo de fusão do VIH (Adaptado da referência [11])](https://thumb-eu.123doks.com/thumbv2/123dok_br/15484182.1039150/36.680.103.588.573.862/figura-esquema-representativo-processo-fusão-vih-adaptado-referência.webp)
![Figura 4. Principais eventos na progressão da doença associados à infecção pelo VIH (Adaptado da referência [20])](https://thumb-eu.123doks.com/thumbv2/123dok_br/15484182.1039150/38.680.87.583.516.853/figura-principais-eventos-progressão-associados-infecção-adaptado-referência.webp)
![Figura 5. Factores associados com a activação imunitária induzida pelo VIH (Adaptado da referência [20])](https://thumb-eu.123doks.com/thumbv2/123dok_br/15484182.1039150/39.680.94.585.358.837/figura-factores-associados-activação-imunitária-induzida-adaptado-referência.webp)
![Figura 6. Cinética da resposta humoral na fase aguda da infecção pelo VIH quanto à evolução da carga viral, anticorpos não neutralizante e anticorpos neutralizantes (Adaptado da referência [73])](https://thumb-eu.123doks.com/thumbv2/123dok_br/15484182.1039150/42.680.86.595.390.667/cinética-infecção-evolução-anticorpos-neutralizante-anticorpos-neutralizantes-referência.webp)
![Figura 7. Esquema do modo de acção de alguns AcNT humanos como o b12 (B), 17b e 2G12 (C) e 2F5 e 4E10 (D), em várias fases do processo de entrada do VIH na célula (Adaptado da referência [85])](https://thumb-eu.123doks.com/thumbv2/123dok_br/15484182.1039150/43.680.107.586.596.853/figura-esquema-acção-humanos-várias-processo-adaptado-referência.webp)
![Figura 8. Mecanismos antivirais mediados pela região Fc do anticorpo (Adaptado da referência [94])](https://thumb-eu.123doks.com/thumbv2/123dok_br/15484182.1039150/44.680.90.590.519.864/figura-mecanismos-antivirais-mediados-região-anticorpo-adaptado-referência.webp)
![Figura 9. Evolução da viremia, resposta celular citotóxica e anticorpos neutralizantes (AcNT) durante a infecção VIH (Adaptado da referência [113])](https://thumb-eu.123doks.com/thumbv2/123dok_br/15484182.1039150/45.680.100.589.655.859/evolução-resposta-citotóxica-anticorpos-neutralizantes-infecção-adaptado-referência.webp)

![Tabela 1. Anticorpos monoclonais humanos neutralizantes de largo espectro de neutralização (Adaptado da referência [96])](https://thumb-eu.123doks.com/thumbv2/123dok_br/15484182.1039150/49.680.84.595.514.893/tabela-anticorpos-monoclonais-neutralizantes-espectro-neutralização-adaptado-referência.webp)