UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS AGRÁRIAS DEPARTAMENTO DE FITOTECNIA
PROGRAMA DE PÓS-GRADUAÇÃO EM AGRONOMIA/FITOTECNIA
DANIEL GOMES COELHO
CINÉTICA DE ABSORÇÃO E ACÚMULO DE ÍONS EM PLANTAS DE SORGO SUBMETIDAS AO ESTRESSE SALINO: REGULAÇÃO MEDIADA PELA FONTE
DE NITROGÊNIO
DANIEL GOMES COELHO
CINÉTICA DE ABSORÇÃO E ACÚMULO DE ÍONS EM PLANTAS DE SORGO SUBMETIDAS AO ESTRESSE SALINO: REGULAÇÃO MEDIADA PELA FONTE DE
NITROGÊNIO
Dissertação apresentada ao Programa de Pós-Graduação em Agronomia/Fitotecnia da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Mestre em Agronomia/Fitotecnia. Área de concentração: Fitotecnia.
Orientador: Prof. Dr. Enéas Gomes Filho. Coorientador (es): Prof. Dr. Rafael de Souza Miranda; Prof. Dr. Humberto Henrique de Carvalho.
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
C615c Coelho, Daniel Gomes.
Cinética de absorção e acúmulo de íons em plantas de sorgo submetidas ao estresse salino : regulação mediada pela fonte de nitrogênio / Daniel Gomes Coelho. – 2018.
64 f. : il. color.
Dissertação (mestrado) – Universidade Federal do Ceará, Centro de Ciências Agrárias, Programa de Pós-Graduação em Agronomia (Fitotecnia), Fortaleza, 2018.
Orientação: Prof. Dr. Enéas Gomes Filho. Coorientação: Prof. Dr. Rafael de Souza Miranda
Prof. Dr. Humberto Henrique de Carvalho.
1. Salinidade. 2. Nutrição nitrogenada. 3. Absorção de íons. 4. Constantes cinéticas de absorção. 5. Sorghum bicolor. I. Título.
DANIEL GOMES COELHO
CINÉTICA DE ABSORÇÃO E ACÚMULO DE ÍONS EM PLANTAS DE SORGO SUBMETIDAS AO ESTRESSE SALINO: REGULAÇÃO MEDIADA PELA FONTE DE
NITROGÊNIO
Dissertação apresentada ao Programa de Pós-Graduação em Agronomia/Fitotecnia da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Mestre em Agronomia/Fitotecnia. Área de concentração: Fitotecnia.
Aprovada em: ___/___/______.
BANCA EXAMINADORA
________________________________________ Prof. Dr. Enéas Gomes Filho (Orientador)
Universidade Federal do Ceará (UFC) _________________________________________ Prof. Dr. Humberto Henrique de Carvalho (Coorientador)
Universidade Federal do Ceará (UFC) _________________________________________
Prof. Dr. Alexandre Bosco de Oliveira Universidade Federal do Ceará (UFC)
_________________________________________ Dr. Fabrício Eulálio Leite Carvalho
Aos meus pais, Agostinha e Geraldo e à minha irmã Natália.
AGRADECIMENTOS
A Deus, Senhor de todas as coisas, detentor de toda a honra e toda a glória.
À minha família, especialmente aos meus pais Agostinha e Geraldo e à minha irmã Natália, pelo amor sem tamanho, compreensão pela minha ausência e esforço para me ajudar a conquistar meus objetivos.
À minha namorada e amiga Jessica Soares, pelo amor, companheirismo e apoio nos bons e maus momentos, e à sua família, que tão bem me acolheu.
Aos patrons Domingos e Moab, com quem dividi, além da moradia em Fortaleza, os momentos de alegria, de angústia e aquela boa e velha pizza no final de semana.
Ao meu orientador, professor Enéas Gomes Filho, pela paciência, dedicação, ensinamentos ao logo desses dois anos de curso e pelo exemplo de humildade.
Ao professor Rafael de Souza Miranda, que além de ser fundamental na concepção e execução desse trabalho, se tornou um grande amigo e a quem tenho grande admiração.
Ao professor Humberto Henrique de Carvalho, pelo incentivo, convívio e por aceitar contribuir com este trabalho na banca examinadora.
Aos demais membros da banca, professor Alexandre Bosco de Oliveira e Dr. Fabrício Eulálio Leite Carvalho, pelas valorosas sugestões para a melhoria do trabalho.
Aos professores do curso de pós-graduação em Fitotecnia, pelas contribuições para a minha carreira profissional e para a minha vida pessoal.
Aos amigos, atuais e ex-integrantes do Laboratório de Fisiologia Vegetal, Cibelle, Cinthia, Dalton, Daniel Farias, Eduardo, Elton, Gyedre, Igor, Isabele, Karol, Lineker, Luckas, Nara, Paulo André, Stelamaris, Valdineia, Valeria, Wallace e Bruno, pelo auxílio durante a pesquisa e os quais me proporcionaram a construção de ótimas amizades, excelente convívio, e tornaram a dura rotina de uma pós-graduação muito mais feliz e harmoniosa.
Aos amigos e colegas dos cursos de pós-graduação em Fitotecnia e Bioquímica, pela troca de experiências, pela ajuda com as disciplinas e análises e pelos momentos de descontração.
Aos amigos das “saídas de sexta”, com quem fortaleci amizades e dividi bons momentos durante esse período de mestrado.
RESUMO
O avanço global da salinização dos solos, principalmente em áreas irrigadas, constitui uma ameaça para a sustentabilidade da produção de alimentos. Em estudos anteriores, o fornecimento de NH4+ como única fonte de nitrogênio foi efetivo para melhorar a tolerância ao
sal em plantas de sorgo. Assim, no presente trabalho foram testadas as hipóteses de que a tolerância à salinidade das plantas de sorgo nutridas com NH4+ está envolvida com o aumento
da absorção de K+, gerando uma homeostase iônica favorável, bem como com uma alta
velocidade máxima de absorção e uma eficiente assimilação do NH4+ em compostos orgânicos
nitrogenados. Para testar tais hipóteses, plantas de sorgo foram cultivadas em solução nutritiva de Hoagland modificada, contendo NO3− ou NH4+ como fonte inorgânica de N, na ausência ou
presença de estresse salino (NaCl a 75 mM). Após 1 e 10 dias de exposição ao NaCl, seis plantas de cada tratamento foram analisadas. Após 1 dia de imposição do estresse salino, a absorção de K+ e suas constantes cinéticas (V
max e Km) foram maiores nas plantas cultivadas com NO3−, em
comparação àquelas nutridas com NH4+. Após 10 dias sob estresse salino, as plantas cultivadas
com NH4+ apresentaram maior conteúdo de K+ e menor conteúdo de Na+, nas raízes e na parte
aérea, e, com isso, apresentaram maior relação K+/Na+. A absorção de NH
4+, em condição de
estresse, apresentou maiores valores de Vmax e maior afinidade (menor Km), comparada à de
NO3−. As plantas de sorgo nutridas com NO3− e submetidas ao estresse salino acumularam altas
quantidades de amônio na parte aérea, enquanto que, nas plantas cultivadas com NH4+, este foi
assimilado nas raízes e uma pequena parte foi carregada no xilema e transportada para os tecidos da parte aérea. Os conteúdos de N-total e de aminoácidos foram maiores na parte aérea de plantas cultivadas com NH4+, principalmente aos 10 dias na presença de NaCl. Dessa forma,
foi constatado que o alto valor de Vmax para o NH4+, bem como sua maior assimilação em
aminoácidos e a melhor distribuição do amônio nos tecidos é fundamental para a redução dos efeitos deletérios da salinidade em plantas de sorgo suplementadas com este íon. A hipótese de que o NH4+ no meio de crescimento melhora a absorção de K+ em condição de estresse salino
foi refutada. No entanto, foi possível inferir que a manutenção de uma maior relação K+/Na+
nas plantas nutridas com NH4+, quando comparada com as nutridas com NO3−, se deve à
redução do efluxo de K+. Os resultados reforçam as evidências que a nutrição com NH
4+ é uma
alternativa promissora para atenuar os efeitos nocivos do estresse salino em plantas de sorgo.
ABSTRACT
The global increase in soil salinization, mainly in irrigated areas, constitutes a threat to sustainability of food production. In previous studies, NH4+-supply as the sole nitrogen source was an effective approach to generate salt tolerance in sorghum plants. In this work, the hypotheses were that NH4+-induced salt tolerance in sorghum plants has been related to the
increase of K+ uptake, generating a favorable ionic homeostasis, as well as a high maximum
uptake rate and an efficient assimilation of NH4+ in organic nitrogen compounds. In order to
investigate these hypotheses, sorghum plants were grown in modified Hoagland’s nutrient solution containing NO3− or NH4+ as an inorganic source of N, in the absence or presence of saline stress (75 mM NaCl). After 1 and 10 days of exposure to NaCl, six plants of each treatment were analyzed. After 1 day of salt exposure, K+ uptake and its kinetic constants (Vmax and Km) were higher in NO3−-fed plants, compared to those fed with NH4+. After 10 days of salt stress, NH4+-grown plants showed higher K+ content and lower Na+ content in shoot and roots, and thereby higher K+/Na+ ratio. NH4+ uptake, under salinity, showed higher values of Vmax and higher affinity (lower Km), compared to that of NO3−. NO3−-grown stressed plants accumulated high amounts of ammonium in the shoot, whereas in NH4+-fed plants, this was assimilated in the roots and a small part was loaded in the xylem and transported to shoot. N-total and free amino acids contents were higher in shoot of NH4+-fed plants, mainly at 10 days, in presence of NaCl. Therefore, it was found that the high Vmax value of NH4+ as well as high assimilation into organic compounds and the better distribution of ammonium in tissues is fundamental for the reduction of deleterious effects of salinity in sorghum plants. The hypothesis that NH4+ improves K+ uptake of sorghum plants under salt stress condition was refuted. However, it was possible to infer that the maintenance of the higher K+/ Na+ ratio in NH4+-grown plants, when compared to NO3−, is due to the reduction of K+ efflux. The results reinforce the evidences that NH4+ nutrition as a promising alternative to attenuate the harmful effects of salt stress in sorghum plants.
LISTA DE FIGURAS
Figura 1 − Redução da concentração (Q) de um determinado íon em função do tempo (t) e aproximações gráficas e regressões utilizadas para calcular Vmax e Km. ... 23 Figure 2 − Net K+ depletion and uptake rates by Sorghum bicolor roots. ... 34 Figure 3 − Kinetics parameters of K+ uptake derived from roots of Sorghum bicolor plants
grown in nutrient solutions containing NO3– or NH4+, in absence or presence of 75 mM NaCl-stress. ... 35 Figure 4 − Values of selective absorption and transport for K+ over Na+ of Sorghum bicolor plants grown in nutrient solutions containing NO3– or NH4+ as inorganic nitrogen source, in presence of 75 mM NaCl-stress. ... 36 Figure 5 − Contents of K+ and Na+ and K+/Na+ ratio in the shoot and roots of Sorghum bicolor plants grown in nutrient solutions containing NO3– or NH4+ as inorganic nitrogen source, in absence or presence of 75 mM NaCl-stress. ... 37 Figure 6 − Concentrations of K+ and Na+ in xylem sap of Sorghum bicolor plants grown in
nutrient solutions containing NO3– or NH4+ as inorganic nitrogen source, in absence or presence of 75 mM NaCl-stress. ... 38 Figure 7 − Net depletion and uptake rates of NO3− and NH4+ by Sorghum bicolor roots. ... 39 Figure 8 − Kinetic parameters of NO3– or NH4+ uptake derived from roots of Sorghum bicolor plants grown in nutrient solutions containing NO3– or NH4+, in absence or presence of 75 mM NaCl-stress.. ... 40 Figure 9 − Contents of nitrate, ammonium, nitrogen-total and free amino acids in shoots and
roots of Sorghum bicolor plants grown in nutrient solutions containing NO3– or NH4+, in absence or presence of 75 mM NaCl-stress. ... 42 Figure 10 − Concentrations of nitrate and ammonium in xylem sap of Sorghum bicolor plants
grown in nutrient solutions containing NO3– or NH4+, in absence or presence of 75 mM NaCl-stress. ... 43 Figura 11 − Modelo proposto para a dinâmica de absorção e assimilação de NO3− e NH4+ e
LISTA DE ABREVIATURAS E SIGLAS
AKT Arabidopsis K+ transporter
AMTs Ammonium transporters
CAT Catalase
CPA Cation proton antiporter
DHAR Redutase do desidroascorbato GOGAT Sintase do glutamato
G-POD Peroxidase do guaiacol GR Redutase da glutationa GS Sintetase da glutamina HKT High-affinity K+ transporter
KT/HAK/KUP K+ Transporter/High-affinity K+ transporter/K+ uptake Protein
MDHAR Redutase do monodesidroascorbato
NHX Na+/H+exchanger
NiR Redutase do nitrito
NPF Nitrate transporter1/peptide transporter family NR Redutase do nitrato
NRT1 Nitrato transporter 1
ROS Reactive oxygen species
SOD Dismutase do superóxido
SOS Salt sensitive overly
SUMÁRIO
1 INTRODUÇÃO ... 11
2 OBJETIVOS ... 13
2.1 Objetivo Geral ... 13
2.2 Objetivos Específicos ... 13
3 FUNDAMENTAÇÃO TEÓRICA... 14
3.1 Salinidade: um desafio global ... 14
3.2 Efeitos do estresse salino nas plantas ... 15
3.3 Nutrição nitrogenada x salinidade ... 18
3.4 Absorção de íons e interações com a salinidade ... 20
3.5 Modelos cinéticos aplicados ao estudo da absorção de íons ... 22
3.6 O sorgo... 24
4 ABORDAGEM EXPERIMENTAL ... 26
5 NO3- AND NH4+ SUPPLY IN SALT-STRESSED SORGHUM PLANTS: UPTAKE, TRANSPORT AND ASSIMILATION ... 27
6 CONSIDERAÇÕES FINAIS... 54
1 INTRODUÇÃO
Nos últimos anos, a produção mundial de alimentos tem enfrentado dois grandes desafios: suprir a crescente demanda em decorrência do aumento populacional e contornar as perdas de produtividade por ocasião do aumento dos registros de eventos extremos, como secas, inundações, altas temperaturas e geadas, impondo às plantas os mais variados estresses abióticos (BISBIS; GRUDA; BLANKE, 2018; MITTLER; BLUMWALD, 2010). Nesse contexto, existe uma pressão pela abertura de novas fronteiras agrícolas e pelo uso dos recursos naturais disponíveis, como os solos e a água, os quais, em muitas regiões, podem apresentar limitações intrínsecas, como o excesso de sais. Esses fatores, aliado ao manejo inadequado da irrigação, são responsáveis pelo avanço global da salinização dos solos, constituindo uma ameaça para a sustentabilidade da produção de alimentos (FAO, 2017).
A salinidade pode inibir o crescimento das plantas devido: ao estresse osmótico, provocado pela redução do potencial hídrico do meio de crescimento e que dificulta a entrada de água na planta; ao estresse iônico, causado pelo acúmulo excessivo de íons tóxicos; e ao estresse oxidativo, gerado pela produção excessiva de espécies reativas de oxigênio (MUNNS; TESTER, 2008). Esses fatores, em conjunto, causam uma série de danos fisiológicos e metabólicos às plantas. Tais danos envolvem a redução na absorção de água, fechamento estomático e degradação de pigmentos, limitando a fotossíntese (YAN et al., 2015); desbalanço nutricional e da homeostase iônica, devido a interferência dos íons Na+ e Cl− na absorção,
translocação e assimilação de nutrientes, alterando principalmente a relação K+/Na+ (WANG et al., 2017). Além disso, pode ocorrer a degradação de macromoléculas, causando danos às membrana e perdas de eletrólitos (GADELHA et al., 2017).
condições de salinidade (FERNÁNDEZ-CRESPO; CAMAÑES; GARCÍA-AGUSTÍN, 2012). Utilizando o sorgo como modelo, uma espécie com aptidões versáteis e moderadamente tolerante ao estresse salino, Miranda et al. (2013; 2016; 2017), observaram que o NH4+ estimula a manutenção da homeostase iônica em plantas sob estresse salino, através da exclusão do Na+ do citosol e sua compartimentalização no vacúolo e ao evitar o seu carregamento no xilema e transporte para os tecidos foliares. No entanto, outros mecanismos podem estar envolvidos nesse processo, a exemplo das diferenças na dinâmica de absorção e assimilação do NO3− e do NH4+. Por exemplo, o processo de assimilação do NO3− exige um gasto energético superior ao de NH4+(ZERIHUN; MCKENZIE; MORTON, 1998). Além disso, enquanto a absorção de NO3− ocorre sempre contra um gradiente eletroquímico gerado através da membrana, tornando necessário o acoplamento energético de H+, a absorção de NH4+ pode ocorrer passivamente pelo sistema de baixa afinidade, através de aquaporinas e canais de cátions, bem como através dos transportadores de alta afinidade, sem o cotransporte de H+ (LOQUÉ; VON-WIRÉN, 2004; TEGEDER; MASCLAUX-DAUBRESSE, 2018).
O estudo da absorção de íons em condições de salinidade envolve interações complexas, como a inibição competitiva entre o Na+ e outros cátions e entre o Cl− e outros ânions (NIU et al., 1995). Além disso, o emprego da nutrição nitrogenada com NO3− ou NH4+ pode alterar a dinâmica da absorção dos principais nutrientes, especialmente o K+ (COSKUN; BRITTO; KRONZUCKER, 2017). Uma interação amplamente relatada é a inibição competitiva de absorção existente entre os íons K+ e NH4+, devido às similaridades das características físico-químicas desses íons (HOOPEN et al., 2010). Por outro lado, Alvarez-Pizarro et al. (2011), verificaram que em plantas de sorgo crescendo em condições de deficiência de K+, a absorção desse íon foi estimulada pela presença de NH4+. O aumento da absorção de K+ foi atribuído ao aumento da atividade das H+-ATPases de membrana plasmática mediada pelo NH4+, contribuindo para o incremento do gradiente de membrana e favorecendo o transporte de K+ pelo sistema de alta afinidade (ALVAREZ-PIZARRO et al., 2011).
Alvarez-Pizarro et al. (2014) confirmaram que a absorção de K+ em plantas anteriormente mantidas sob deficiência desse íon é estimulada pela presença de NH4+ no meio de crescimento, o que foi feito analisando-se as constantes cinéticas da absorção de K+ pelo sistema de alta afinidade. Tais constantes são obtidas através de adaptações do modelo cinético de Michaelis-Menten para as reações enzimáticas e auxiliam bastante no entendimento do comportamento da absorção de íons (CLAASEN; BARBER, 1974).
homeostase iônica sob salinidade; ii) plantas de sorgo nutridas com NH4+ apresentam maior absorção e assimilação de N, em relação àquelas nutridas com NO3−, evitando o acúmulo do íon NH4+ em níveis tóxicos e incrementando o aporte de compostos nitrogenados. A elucidação dessas questões, dada a importância econômica e a versatilidade do sorgo, além dos efeitos promissores da nutrição com NH4+ nessa cultura, já constatados em estudos anteriores, torna-se relevante.
2 OBJETIVOS 2.1 Objetivo Geral
Avaliar a absorção de K+, NO3− e NH4+, o acúmulo e transporte de K+, Na+, NO3− e NH4+ e a dinâmica de assimilação de nitrogênio em compostos orgânicos de plantas de sorgo submetidas ao estresse salino e nutridas com NO3− ou NH4+ como fontes de N.
2.2 Objetivos Específicos
Utilizando-se plantas de sorgo crescendo na ausência ou presença de salinidade e nutridas com NO3− ou NH4+, pretende-se:
Obter as curvas de depleção de K+, NO3− e NH4+;
Estimar as constantes cinéticas de absorção, Vmax e Km, para os íons K+, NO3− e NH4+;
Verificar a influência da fonte de nitrogênio na seletividade de absorção e transporte de K+ ao invés de Na+;
Analisar a homeostase iônica nas raízes e nos tecidos da parte aérea, bem como o carregamento de K+ e Na+ no xilema;
3 FUNDAMENTAÇÃO TEÓRICA 3.1 Salinidade: um desafio global
A salinidade pode ocorrer de forma natural, a qual é oriunda dos sais solúveis no material de origem dos solos ou de sais oceânicos trazidos ao continente pelas chuvas e ventos (PARIHAR et al., 2015). Os sais mais frequentemente encontrados em solos salinizados são formados pelos cátions de magnésio (Mg2+), cálcio (Ca2+), sódio (Na+) e potássio (K+) e pelos os ânions cloreto (Cl−), sulfato (SO42−), bicarbonato (HCO3−) e carbonato (CO32−). Os solos que
possuem natureza salina são usualmente denominados halomórficos ou solos salinos e/ou sódicos, sendo classificados com base no conteúdo de sais solúveis, na condutividade elétrica do extrato de saturação (CE) e na porcentagem de sódio trocável (PST) (RIBEIRO; RIBEIRO-FILHO; JACOMINE, 2016). No solo, a alta concentração de sais causa uma série de alterações em suas propriedades físicas e químicas. O excesso de Na+, por exemplo, causa compactação, através do processo de dispersão das partículas de argila, e com isso, reduz a condutividade hidráulica do solo (AHMAD et al., 2016).
Apesar das áreas salinizadas existirem desde antes da humanidade e da agricultura, esse problema se intensificou pela ação antrópica, principalmente provocada pelo manejo inadequado da irrigação e drenagem ou pelo uso de água de baixa qualidade (BEN-HUR et al., 2001). A título de ilustração, considerando a demanda de uma cultura irrigada de 10.000 m³ de água em um ciclo, e a água de irrigação contendo 0,5 mg g-1 de sais solúveis, a qual é classificada como de boa qualidade, estima-se que ao final do ciclo ocorra a adição de cerca de cinco toneladas de sais por hectare cultivado. Assim, em áreas sem drenagem ou com drenagem ineficiente, os sais se concentram na zona radicular das plantas, condição que é agravada em regiões semiáridas, nas quais as precipitações são pouco frequentes e as taxas de evaporação e evapotranspiração são elevadas (KAJLA et al., 2015).
milhões ha) e Estados Unidos (5,2 milhões ha) (FAO, 2015). Outros países com grandes quantidades de áreas salinizadas incluem Afeganistão, Egito, Iraque, Cazaquistão, México, Síria e Turquia (SQUIRES; GLENN, 2011). No Brasil, existem poucas estatísticas recentes da extensão de solos salinizados. No entanto, sabe-se da ocorrência desses solos no Rio Grande do Sul, na Região do Pantanal mato-grossense e, majoritariamente, na região do Semiárido nordestino, onde diversos perímetros irrigados apresentam cerca de 25% da sua área total intensamente degradados pela salinidade (FREIRE et al., 2014; RIBEIRO; FREIRE; MONTENEGRO, 2003).
O grau da salinização, ou seja, a concentração dos sais no extrato de saturação do solo pode causar desde pequenas reduções no crescimento e na produção das espécies mais sensíveis ou até mesmo levar à morte de espécies mais tolerantes (PARIDA; DAS, 2005). Nesse contexto, a salinidade constitui um dos grandes limitantes à agricultura sustentável, gerando um cenário de impactos econômicos e sociais em todo o mundo. Além disso, a salinização dos solos pode comprometer o equilíbrio dos ecossistemas e a qualidade dos recursos naturais.
3.2 Efeitos do estresse salino nas plantas
O acúmulo de sais no meio de crescimento vegetal provoca um desequilíbrio no gradiente de potencial hídrico entre a planta e o meio externo, bem como modifica a distribuição dos íons a nível celular e entre os órgãos (ZHU, 2001). Esses fenômenos, a depender da natureza dos sais, da espécie vegetal, da variedade, do estádio de desenvolvimento, das condições nutricionais, dentre outros fatores, podem comprometer os principais processos metabólicos das plantas, tais como: a germinação (ALENCAR et al., 2015), a fotossíntese (MITTAL; KUMARI; SHARMA, 2012), as relações hídricas (ROMERO-ARANDA; SORIA; CUARTERO, 2001), o balanço nutricional (KEUTGEN; PAWELZIK, 2009) e, por consequência, o crescimento e a produção vegetal (SEMIZ et al., 2012).
e acúmulo de íons a níveis tóxicos nas células. A toxicidade ocorre em decorrência do desbalanço nutricional causado pela competição desses íons com os nutrientes iônicos essenciais para as plantas (AHMAD; SHARMA, 2008). Por exemplo, o acúmulo excessivo de Na+ promove a redução da absorção de K+ e favorece o seu efluxo, enquanto o excesso de Cl− compete com os ânions sulfato (SO42−) e nitrato (NO3−) (GIMENO et al., 2009; SHABALA et
al., 2010). Concomitantemente, o acúmulo de Na+ e Cl−,pode comprometer indiretamente diversos processos metabólicos, promovendo a degradação de enzimas e de outras macromoléculas, além de causar danos a organelas e membranas, reduzir a síntese proteica, bem como alterar o balanço hormonal (DASZKOWSKA-GOLEC, 2011; DEINLEIN et al., 2014).
A salinidade também promove o estresse oxidativo ao favorecer o acúmulo de espécies reativas de oxigênio (ROS), as quais são oriundas do metabolismo natural, mas que em altas concentrações são danosas às células, principalmente por causar a peroxidação dos lipídeos de membranas, comprometendo a integridade celular (AHMAD et al., 2009; KANGASJÄRVI; KANGASJÄRVI, 2014). As ROS são produzidas pela redução parcial do O2, que é uma molécula estável, mas que ao absorver energia ou receber elétrons, pode formar o oxigênio singleto (1O2), o peróxido de hidrogênio (H2O2) e os radicais superóxido (•O2-) e hidroxil (HO•), espécies altamente instáveis e reativas (APEL; HIRT, 2004; DAS et al., 2015). Os principais sítios de geração de ROS são os cloroplastos e as mitocôndrias, que possuem cadeia transportadora de elétrons, e os peroxissomos, onde ocorrem reações redox (FOYER; NOCTOR, 2003).
As plantas, quando submetidas à condição de salinidade, lançam mão de estratégias para lidar com este estresse. A tolerância à salinidade, portanto, é definida como a capacidade das plantas de crescerem e completarem seu ciclo de vida em um substrato que contém altas concentrações de sais solúveis (PARIDA; DAS, 2005). As plantas classificadas como halófitas são capazes de tolerar concentrações de sais maiores do que as glicófitas, que são a maioria das plantas cultivadas, e esta diferença se deve basicamente a uma maior eficiência das halófitas com relação aos mecanismos de tolerância à salinidade (GREENWAY; MUUNS, 1980).
O ajustamento osmótico se dá basicamente pelo acúmulo seletivo de íons nos vacúolos e de solutos (ou osmólitos) compatíveis no citosol, situação em que ocorre uma redução no potencial hídrico e, dessa forma, facilita a entrada de água para a célula (PARIDA; DAS, 2005). Dentre esses solutos, encontram-se: açúcares simples, como a glicose, a frutose e a sacarose; polióis, como o manitol; aminoácidos, como a prolina; as poliaminas putrescina, espermidina e espermina; os sais quaternários de amônio, betaína e glicina betaína, dentre outros (NOUNJAN; NGHIA; THEERAKULPISUT, 2012; VERSLUES et al., 2006). É importante ressaltar que é controverso o papel da prolina no ajustamento osmótico, sendo a ela atribuída também a função de proteção (osmoprotetor) de macromoléculas, como as proteínas (REDDY et al., 2015; VENDRUSCOLO et al., 2007). Alguns pigmentos como os carotenoides e antocianinas também desempenham a função de osmoprotetores (MANDHANIA; MADAN; SHEOKAND, 2010).
Os mecanismos de recuperação da homeostase iônica, perturbada pela entrada excessiva de Na+, que promove o bloqueio da absorção e, termodinamicamente, favorece o efluxo de K+, são fundamentais para a tolerância à salinidade (WANG et al., 2009). Esses processos compreendem o controle da absorção e efluxo de Na+ das células, a compartimentalização desse íon nos vacúolos e o controle sobre seu transporte à longa distância (DEINLEIN et al., 2014). A redução na concentração de Na+ no citosol depende fundamentalmente da atividade do transportador antiporte NHX1 (Na+/H+ exchanger), localizado no tonoplasto, responsável pela compartimentalização desse íon nos vacúolos, e da ativação da rota de sua exclusão SOS (Salt Sensitive Overly). Essa rota é dependente de Ca2+ e culmina na atividade de um transportador antiporte Na+/H+ (SOS1) de membrana plasmática (HU et al., 2012; ROY; NEGRÃO; TESTER, 2014). O transporte de Na+, tanto no tonoplasto quanto na membrana plasmática, é acoplado ao antiporte de H+, o que faz necessária a geração de um gradiente eletroquímico de prótons. Tal gradiente é gerado por três importantes bombas de prótons: H+-ATPase de membrana plasmática (P-ATPase), H+-ATPase de tonoplasto (V-ATPase) e pirofosfatase (PPase) (APSE; BLUMWALD, 2007).
monodesidroascorbato (MDHAR) e a redutase do desidroascorbato (DHAR), no ciclo do ascorbato-glutationa (AHMAD et al., 2010).
3.3 Nutrição nitrogenada x salinidade
O nitrogênio (N), em termos gerais, é o nutriente requerido em maior quantidade pelas plantas, compondo aminoácidos, proteínas, ácidos nucleicos, pigmentos e participando da regulação de diversos processos metabólicos. A aplicação de fertilizantes nitrogenados, via de regra, reflete no aumento do crescimento vegetativo e da produtividade, considerando que o aporte de N disponível para a absorção nos solos é limitado (CANTARELLA, 2007).
As plantas absorvem várias formas de nitrogênio, incluindo as inorgânicas, como nitrato, amônio e nitrito, e as fontes orgânicas como ureia, aminoácidos e peptídeos. Além disso, plantas da família Fabaceae (leguminosas) fixam N2 atmosférico através de associações simbióticas com bactérias presentes em nódulos radiculares (LARUE; PATTERSON, 1981). No entanto, as principais formas utilizadas são nitrato (NO3−), encontrado maior quantidade na maioria dos solos, e amônio (NH4+), encontrado como forma predominante em ambientes ácidos e/ou anaeróbicos (BLOOM, 2015; TEGEDER; RENTSCH, 2010). Ressalte-se que, na maior parte dos solos, o NH4+ sofre nitrificação em um processo de oxidação mediado por microorganismos e cujo produto final é o NO3−. Por isso, em condições em que se deseja a manutenção da disponibilidade de NH4+ devem ser utilizados inibidores da nitrificação, como o dicianodiamida (DCD) e a 3,4-dimetilpirazole-fosfato (DMPP) (LIU; WHANG; ZHENG, 2013).
A suplementação nitrogenada de forma adequada pode ser uma importante estratégia para mitigar os efeitos danosos da salinidade e incrementar o crescimento e a produtividade das culturas submetidas a essa condição (ASHRAF et al., 2018). O envolvimento do N em diversos mecanismos de tolerância ao estresse salino tem sido extensivamente relatado, a exemplo do ajustamento osmótico (HEIDARI et al., 2007), aumento da atividade antioxidante (HESSINI et al., 2013), proteção da maquinaria fotossintética e incremento na fotossíntese (MIRANDA et al., 2014) e atenuação da toxicidade iônica (BAHMANZADEGAN; ABOUTALEBI, 2013; MIRANDA et al., 2016).
et al., 2008; MENG et al., 2016). A toxicidade ao NH4+ se deve aos processos de acidificação da rizosfera, causando limitação da absorção e disponibilidade de outros cátions, interferência nas cadeias transportadoras de elétrons e alterações no metabolismo hormonal (BRITTO; KRONZUCKER, 2002). Além disso, a assimilação de NO3− é normalmente menos restringida pela salinidade, tendo em vista que pode ocorrer nas raízes e na parte aérea, enquanto a assimilação do NH4+ ocorre quase exclusivamente nas raízes, ambiente diretamente em contato com o meio salino (ASHRAF et al., 2018).
Em contrapartida, o processo de assimilação do NO3− exige alto gasto energético, sendo necessários 20 mols de ATPs por mol de NO3−, comparado ao do NH4+, que custa 5 mols de ATP por mol de NH4+ assimilado (ZERIHUN; MCKENZIE; MORTON, 1998). A assimilação do NH4+ é feita através das reações catalisadas pela sintetase da glutamina (GS) e sintase do glutamato (GOGAT), utilizando uma molécula de 2-oxoglutarato para sintetizar o glutamato, o qual posteriormente pode ser convertido para outros aminoácidos a partir de outros esqueletos de carbono. Já a assimilação do NO3− requer, primeiramente, duas reações: a redução do nitrato a nitrito (NO2−), pela enzima redutase do nitrato (NR) e, posteriormente, a redução do nitrito a NH4+, pela redutase do nitrito (NiR), utilizando energia do NADH ou NADPH (MIFLIN; LEA, 1976). Em adição à vantagem energética de assimilação, evidências apontam para uma função do NH4+ como priming na ativação de rotas de defesa ao estresse, a exemplos dos mecanismos de remoção de ROS (FERNÁNDEZ-CRESPO; CAMAÑES; GARCÍA-AGUSTÍN, 2012; HESSINI et al., 2013).
Nesse sentido, a substituição parcial ou total do NO3− pelo NH4+ tem sido proposta como alternativa para atenuar os efeitos da salinidade em algumas culturas. Zhonghua et al. (2011) verificaram que a relação 50:50 de NO3−:NH4+ melhorou o crescimento e a produção de óleo essencial de Catharanthus roseus, o que foi atribuído à redução do estresse osmótico, através do acúmulo de solutos e manutenção da homeostase iônica, através do controle do acúmulo dos íons Na+ e Cl−. Em outro estudo, o fornecimento em conjunto de NO3− e NH4+ proporcionou o aumento da atividade das enzimas de assimilação do NH4+ e reduziu os efeitos da salinidade em Hordeum vulgare (KANT et al., 2007). Em clones de citros (Citrus sinensis
L. Osbeck × Poncirus trifoliata L.), Fernández-Crespo, Camañes e García-Agustín (2012) demonstraram que a nutrição exclusivamente com NH4+ induz respostas morfogênicas e aumenta a tolerância ao estresse salino. Em plantas de sorgo (Sorghum bicolor), Miranda et al. (2013) verificaram que a manutenção da homeostase iônica proporcionada pela nutrição com NH4+ reduz os efeitos deletérios da salinidade.
NH4+, tem sido elucidada em estudos recentes. Miranda et al. (2017) propuseram, a partir de evidências experimentais, um modelo no qual o controle do acúmulo de Na+ nos tecidos é resultante do estímulo das bombas de prótons (H+-ATPases e H+-PPases) e dos transportadores antiporte Na+/H+ de membrana plasmática (SOS1 ou NHX7) e tonoplasto (NHX1), promovido pelo NH4+. Com isso, as plantas de sorgo supridas com NH4+ conseguem fazer a exclusão do Na+ para o apoplasto nas raízes, bem como evitam o carregamento desse íon no xilema e seu transporte para a parte aérea, mantendo assim, baixos níveis citosólicos de Na+ e uma relação K+/Na+ favorável.
Contudo, os efeitos da nutrição com NO3− e NH4+ e as múltiplas interações existentes entre a absorção dessas formas de N inorgânico com outros nutrientes, como os íons K+, Na+ e Cl−, permanecem pouco compreendidas.
3.4 Absorção de íons e interações com a salinidade
Alterações complexas na absorção de íons, principalmente compreendendo a competição entre Na+ e Cl−, com ânions e cátions, respectivamente, são promovidas pela salinidade (NIU et al., 1995). A homeostase iônica, particularmente regulada pela relação K+/Na+ nas células, sofre grande interferência da salinidade principalmente em decorrência da competição do Na+ pelos sítios de absorção dos transportadores de K+. Essa competição se deve às semelhanças em algumas propriedades físicas, como carga e raio iônico, dificultando a distinção desses íons pelos seus transportadores (RODRÍGUEZ-NAVARRO; RUBIO, 2006).
A absorção de K+ é feita basicamente por dois sistemas de absorção: o sistema de baixa afinidade e o sistema de alta afinidade, que compreendem a absorção de K+ quando este está em altas e baixas concentrações no meio externo, respectivamente. O sistema de baixa afinidade é composto por canais e o processo de absorção ocorre de forma passiva, enquanto o sistema de alta afinidade é governado por carreadores e controla o influxo de K+ contra seu gradiente eletroquímico (EPSTEIN; RAINS; ELZAM, 1963). De forma geral, a maioria dos íons possui comportamento semelhante, no qual os sistemas de alta afinidade são os principais responsáveis pela manutenção da absorção de nutrientes quando as concentrações estão reduzidas no meio de crescimento.
Os transportadores de K+ são classificados basicamente em quatro grupos: o primeiro inclui os canais, tendo como principal representante os membros da família AKT (Arabidopsis K+ Transporter) e os outros três grupos são do sistema de alta afinidade; os
Transporter/High-affinity K+ Transporter/K+ Uptake Protein); e transportadores antiportes CPA (Cation Proton Antiporter) (GIERTH; MÄSER; 2007). Em condições de salinidade, ocorre aumento do influxo de Na+, para o qual não se conhece transportadores específicos e sua absorção é atribuída aos canais catiônicos não seletivos insensíveis à voltagem, VI-NSCC (Voltage-Insensitive Non-Selective Cations Channels), bem como ao processo de cotransporte de K+ mediado pelos transportadores HKT e KT/HAK/KUP (RODRÍGUEZ-NAVARRO; RUBIO, 2006). O acúmulo de Na+ promove a despolarização da membrana e dificulta termodinamicamente a absorção de K+ através dos canais, reduzindo sua concentração nos tecidos (MANSOUR, 2014).
A competição pelos sítios de absorção também é a causa da redução do influxo de nitrogênio em plantas submetidas ao estresse salino. Enquanto o NH4+ sofre competição com o Na+, a absorção de NO3− pode ser inibida pela presença de Cl− (WANG et al., 2012). Termodinamicamente, a absorção de NO3− ocorre sempre contra um gradiente eletroquímico gerado através da membrana, tornando necessário o acoplamento energético, com o fluxo passivo de dois íons H+. Transportadores da família NRT1 (Nitrato Transporter 1), recentemente renomeada como NPF (Nitrate Transporter1/Peptide Transporter Family), regulam o transporte de NO3− de baixa afinidade, enquanto os transportadores NRT2 são responsáveis pelo transporte de alta afinidade (TEGEDER; MASCLAUX-DAUBRESSE, 2018). Por sua vez, a absorção de NH4+ pode ocorrer pelo sistema de baixa afinidade, através de aquaporinas e canais de cátions, bem como através dos transportadores AMTs (Ammonium Transporters), que atuam na absorção de alta afinidade (LOQUÉ; VON-WIRÉN, 2004).
Nesse contexto, a absorção de NH4+ pode ser favorecida em relação à de NO3−, tendo em vista que utiliza o gradiente de potencial eletroquímico existente através da membrana plasmática. Entretanto, ressalte-se que a absorção do NH4+ é finamente regulada, no intuito de manter seus níveis baixos e evitar a toxicidade. Além disso, o influxo de NH4+ gera a saída de um íon H+, para manter o equilíbrio dos potenciais de membrana (COSKUN; BRITTO; KRONZUCKER, 2017).
competitiva entre esses íons, o que poderia explicar a manutenção da homeostase K+/Na+ em plantas de sorgo sob estresse salino na presença de NH4+ (MIRANDA et al., 2016).
3.5 Modelos cinéticos aplicados ao estudo da absorção de íons
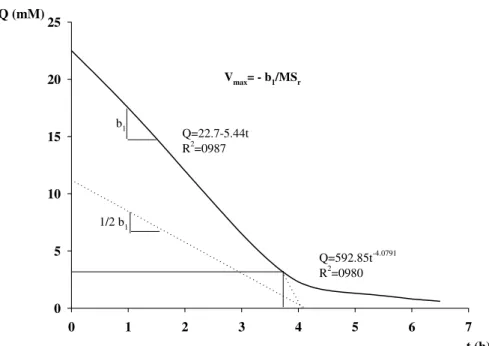
Os sistemas de transporte de alta afinidade dos íons são regidos por componentes saturáveis, ou seja, a velocidade de influxo aumenta até um determinado nível e depois atinge um platô, tendo como limitante a saturação da capacidade dos transportadores (EPSTEIN; RAINS; ELZAM, 1963). Esse mesmo comportamento é visto nas reações catalisadas por enzimas não-halostéricas, o qual foi modelado matematicamente por Michaelis e Menten, em 1913, resultando na equação: Vo = (Vmax [S])/(Km+[S]), em que Vo é a velocidade inicial da reação; [S] é a concentração do substrato e Vmax e Km (parâmetros cinéticos da reação) representam, respectivamente, a velocidade máxima da reação e a concentração de substrato em que a velocidade da reação corresponde à metade de Vmax. Posteriormente, esta mesma equação foi escrita em outra forma, chamada de duplo recíproco ou forma de Lineweaver-Burk, que permite se calcular com mais precisão os valores dos parâmetros cinéticos da reação.
Tendo por analogia a equação de Michaelis-Menten em sua forma do duplo recíproco, Claassen e Barber (1974) desenvolveram um modelo matemático para o estudo da absorção de íons pelas plantas. Nesse modelo, diferentemente do modelo de Michaelis-Menten em que a concentração do substrato é considerada constante, a velocidade de absorção de um determinado íon é relacionada à diminuição da quantidade desse íon na solução de cultivo, em um determinado tempo. Na análise gráfica do modelo, a concentração do íon (Ct) é plotada
versus o tempo de absorção (t), obtendo-se o que comumente denominamos de curva de depleção. A partir dessa curva, pode-se ter a velocidade de absorção ou velocidade de influxo do íon em qualquer ponto da curva, bastando para isso calcular a derivada –dCt/dt e dividi-la pela massa radicular.
1998).
Figura 1. Redução da concentração (Q) de um determinado íon em função do tempo (t) e aproximações gráficas e regressões utilizadas para calcular Vmax e Km nesse exemplo. Adaptado de Ruiz (1982).
O estudo da absorção de íons envolvendo o estabelecimento dos parâmetros cinéticos tem sido aplicado para diversas finalidades, tais como na comparação da absorção de nutrientes por diferentes genótipos (ARAÚJO et al., 2015), na capacidade de diferentes espécies em extrair substâncias poluentes do meio de crescimento (ISLAM; SAITO; KURASAKI, 2015), na absorção de íons em condições de deficiência (ALVAREZ-PIZARRO et al., 2014) e na comparação entre a absorção de diferentes formas de compostos inorgânicos, como o NO3− e o NH4+ (XIAOCHUANG et al., 2015).
A caracterização dos parâmetros cinéticos para a absorção dos íons NO3− e NH4+ é amplamente reportada na literatura, sendo observado que tais parâmetros variam com a espécie. Zhang, Rengel e Meney (2009) verificaram que, em Canna indica, a Vmax para a absorção de NH4+ era de623 µmol g−1 h−1, enquanto para NO3− esse valor era de 338 µmol g−1 h−1; contudo, em Schoenoplectus validus essas duas velocidades máximas não diferiram. Por outro lado, Rocha et al. (2014), em experimento com Helianthus annuus, encontraram maiores valores de Vmax para NH4+, enquanto o Km foi semelhante para NH4+ e NO3−.
Os valores dos parâmetros cinéticos de absorção de K+ foram determinados, sob condições fisiológicas normais, em diferentes espécies, tais como cevada (SANTA-MARÍA; DANNA; CZIBENER, 2000), arroz (BAÑUELOS et al., 2002) e pimenta
(MARTINEZ-t (h)
0 1 2 3 4 5 6 7
Q (mM)
0 5 10 15 20 25
b1
1/2 b1
Q=22.7-5.44t R2=0987
Q=592.85t-4.0791 R2=0980
CORDEIRO; MARTINEZ; RUBIO, 2004), sendo encontrados valores médios de 13 µM e 8,2 µmol g−1 h−1, respectivamente, para Km e Vmax. Plantas de sorgo, sob condições de deficiência de K+, e posteriormente avaliadas quanto à absorção desse íon, apresentaram incremento em Vmax e redução em Km com o passar do tempo, em plantas nutridas com NH4+ (ALVAREZ-PIZARRO et al., 2014). Esses resultados indicam que ocorreu aumento da capacidade de influxo de K+, mediante o aumento do tempo em condição de deficiência de K+ e que, nesta condição, houve indução do sistema de transporte de alta afinidade desse íon, mediado pelo NH4+. No entanto, as características da cinética de absorção desses íons e suas interações são pouco conhecidas em plantas submetidas ao estresse salino.
3.6 O sorgo
O sorgo [Sorghum bicolor (L.) Moench] é uma espécie da ordem Poales, família Poaceae, subfamília Panicoideae e tem seu provável centro de origem e domesticação na África, especificamente nos territórios ao sul do Sudão e Etiópia (deserto do Saara), onde muitas espécies selvagens ancestrais do S. bicolor (Sorghum arundinaceum e Sorghum verticilliflorum) são encontradas (SANTOS; CASELA; WAQUIL, 2005). É uma espécie monoica, autógama e classificada como sendo de dias curtos, ou seja, necessita de noites longas para o seu florescimento (FORNASIERI FILHO; FORNASIERI, 2009).
De acordo com a FAO (2017), a produção mundial média de sorgo no período de 2013 a 2015 foi de 62,4 milhões de toneladas, se consolidando como o quinto cereal mais produzido no mundo, atrás do trigo (Triticum aestivum), arroz (Oryza sativa L.), milho (Zea mays L.) e cevada (Horderum vulgare L). Essa cultura constitui parte da alimentação de mais de 500 milhões de pessoas em países da África e da Ásia, enquanto no ocidente sua utilização é destinada majoritariamente para ração animal e para fabricação de xarope, açúcar e álcool (HARIPRASANNA; RAKSHIT, 2016). No Brasil, a produção de sorgo na safra 2016/2017 foi de 1,8 milhões de toneladas e os estados com maior produção foram Goiás (805 mil toneladas), Minas Gerais (657 mil toneladas) e Bahia (100 mil toneladas) (CONAB, 2018).
elevada produção de biomassa, utilizado como forragem na alimentação de animais (FORNASIERI FILHO; FORNASIERI, 2009).
O sorgo é uma cultura considerada rústica, em virtude de possuir boa tolerância a uma série de estresses ambientais, como a seca e as altas temperaturas. Essa característica é relacionada ao metabolismo fotossintético C4 e adaptações morfológicas, que incrementam a assimilação líquida de carbono e o uso eficiente da água em ambientes restritivos, tornando essa cultura com elevado potencial para o plantio em regiões áridas e semiáridas (MORGADO, 2005). Com relação ao estresse salino, o sorgo é classificado como moderadamente tolerante, com uma salinidade limiar do extrato de saturação do solo, definida como o nível máximo de salinidade que pode ser tolerado pelas plantas sem afetar seu rendimento, de 6,8 dS m−1. Esse valor é superior aos de outros cereais, como o milho (1,7 dS m−1), o arroz (3,0 dS m−1) e o trigo (6,0 dS m−1) e outras culturas importantes, como a soja (5,0 dS m−1) e o feijão (1,0 dS m−1) (DIAS et al., 2016; adaptado de MAAS, 1986).
4 ABORDAGEM EXPERIMENTAL
No presente trabalho, plantas de sorgo foram cultivadas em solução nutritiva contendo NO3− ou NH4+, como fonte inorgânica de nitrogênio. Após 1 e 10 dias da imposição do estresse com a adição de 75 mM de NaCl, as plantas foram avaliadas quanto a absorção de K+, NO3− e NH4+, em que foi possível estabelecer as curvas de depleção e as constantes cinéticas, Vmax e Km, para esses íons.
Posteriormente, foram avaliados o conteúdo de íons K+ e Na+ nos tecidos e no xilema, a relação K+/Na+ nos tecidos e pôde-se determinar os índices de seletividade e transporte de K+ ao invés de Na+. Finalmente, com o objetivo de esclarecer como as plantas de sorgo evitam a toxicidade pelo amônio, mensurou-se o conteúdo de compostos nitrogenados orgânicos e inorgânicos (NO3−, NH4+, N-total e aminoácidos), bem como o carregamento no xilema de NO3− e NH4+.
*Artigo submetido para publicação
5 NO3- AND NH4+ SUPPLY IN SALT-STRESSED SORGHUM PLANTS: UPTAKE, TRANSPORT AND ASSIMILATION*
Abstract: In previous studies, NH4+-supply was an effective approach to generate salt tolerance
in sorghum plants. Our working hypothesis was that a mechanism to improve salt tolerance of NH4+-grown sorghum plants involves a NH4+-induced increase of K+ uptake as well as with a
high maximum velocity of NH4+ uptake and an efficient assimilation of NH4+ in organic
N-compounds. To verify whether our hypothesis is true, sorghum plants were grown in nutritive solutions containing NO3−or NH4+ as inorganic N-form. After 1 and 10 days of exposure to 75
mM NaCl, plants were analyzed. K+ uptake and its kinetic constant were higher in NO3− -supplemented plants, after 1 day of salt exposure. After 10 days of salt stress, NH4+-grown plants showed higher K+ content and lower Na+ content in shoot and roots, and thereby higher K+/Na+. Depletion of NH4+ in the initial times was higher than NO
3− and, consequently,
presented a higher Vmax and greater affinity (lower Km). Sorghum plants supplied with NO3−
accumulated high amounts of ammonium in shoot, whereas in NH4+-supplied plants, the
ammonium was assimilated in the roots and a small part was loaded in the xylem and transported to shoot. Total nitrogen and amino acids were found in higher quantity in shoots of NH4+-grown stressed plants, mainly at 10 days. Our findings provide evidences that reinforcing
the NH4+ nutrition as a practical alternative to mitigate the harmful effects of salt stress in
sorghum plants.
Keywords: Salinity, nitrogen dynamics, ammonium, ions uptake, kinetics parameters,
Sorghum bicolor
Introduction
the plant and substrate solution, making it difficult the water to be uptake by plant cells. The second occurs due to the specific toxicity of ions, especially Na+ and Cl−, which, in excess,
disrupt nutrient homeostasis, alter K+/Na+ ratio in the cells and, therefore, alter several metabolic processes in plants (MUNNS; TESTER, 2008).
Nitrogen (N) availability is related as a strong determinant of plant growth and crop productivity in the most diverse conditions. Physiological and biochemical interactions between different N sources and salt stress have been studied by many researchers. (FERNÁNDEZ-CRESPO; CAMAÑES; GARCÍA-AGUSTÍN, 2012; KANT et al., 2007; LIMA et al., 2017; MENG et al., 2016; MIRANDA et al., 2017a). Plants use several N sources in soils, and its main inorganic forms naturally absorbed by plants are inorganic nitrate (NO3−) and ammonium
(NH4+) (HACHIYA; SAKAKIBARA, 2017; MILLER; CRAMER, 2004).
NO3−is the most available form in soils and more intensely absorbed by most crops.
On the other hand, NH4+ can be a dominant form in some acidic or anaerobic environments. In some species, toxicity occurs with the accumulation of NH4+, mainly because of the rhizosphere acidification and competition for absorption channels with other cations (M’RAH-HELALI et al., 2010). However, a few species can compartmentalize NH4+ in vacuoles and/or assimilate without showing symptoms of toxicity. In these species, nutrition with NH4+ may be advantageous, considering that ammonium utilization greatly decreases the energy consumption required to synthesize organic N compounds compared to nitrate (LOQUÉ et al., 2005; XU; FAN; MILLER, 2012).
An extensively reported interaction in the N uptake is the reciprocal inhibition of absorption between NH4+ and K+, due to the similarities of hydrated diameters, electrical charge and influence on membrane potentials between these ions (COSKUN; BRITTO; KRONZUCKER, 2017; HOOPEN et al., 2010). However, the absorption of K+ in sorghum plants under K+ deficiency was stimulated in presence of NH4+, process correlated with the plasma membrane H+-ATPases activity induction (ALVAREZ-PIZARRO et al., 2011). Furthermore, NH4+ uptake is generally faster compared to that of NO3−, mainly because of the
absence of proton coupling transport (LIN et al., 2008; XIAOCHUANG et al., 2015).
Therefore, our work hypotheses are: i) NH4+ in the growth medium stimulates the K+ uptake of sorghum plants, which helps in the maintenance of ionic homeostasis under salinity; ii) NH4+-grown sorghum plants have efficient N-uptake and assimilation mechanisms, in relation to those fed with NO3−, increasing the pool of nitrogen compounds. Our results show
that NH4+ nutrition under salt stress enhances K+ accumulation in sorghum plants compared to NO3−-grown stressed plants, although this is related to the control of Na+ accumulation and not to increase of K+ uptake. Furthermore, NH4+-grown plants showed higher N-uptake and contents of N-total and amino acids, evidencing the contributions of NH4+ nutrition to salt tolerance of sorghum plants.
Materials and methods
Growth conditions
In the nutrient solution containing NO3−, the other macronutrients were supplied as 0.33 mM MgSO4 and 0.25 mM NaH2PO4, whereas for the nutrient solution containing NH4+, 0.33 mM MgSO4, 0.25 mM (NH4)2HPO4 and 2.5 mM CaCl2 were provided. Micronutrient concentrations were similar in both solutions as follows: 50 μM CaCl2, 12.5μM H3BO3, 1μM MnSO4, 1μM ZnSO4, 0.5μM CuSO4, 0.1μM H2MoO4 and 10μM Fe-EDTA. Salinity imposition was performed at 12 days after sowing, with the addition of NaCl in two steps of 37.5 mM per day, totaling 75 mM of NaCl, according to Miranda et al. (2016). The pH was adjusted daily to 6.0 with 1.0 M NaOH or 1.0 M HCl. All nutrient solutions were renewed every three days. Six homogenous plants of each group were taken for analysis at 1 and 10 days after addition of 75 mM NaCl to the hydroponic solution.
Measurements
Depletion curves and kinetic constants of K+, NO3- and NH4+
The assays for the uptake measurements were performed in controlled-environment room, with air temperature and relative humidity of 24.8 ± 2.2 ºC and 65 ± 5.3%, respectively. Light was provided by five fluorescent lamps (25 W) placed at a distance of 50 cm above the plants. In the early morning (6:00 a.m.), plants maintained in their respective growth solutions on greenhouse were transferred to the conditioned room. After two hours of acclimatization, plants roots were immersed in deionized water for 20 minutes to remove the adsorbed ions and transferred to plastic pots containing 150 mL of nutrient solution. These solutions contained the same concentrations of nutrients under growth conditions, except for the ion analyzed. In the K+ uptake experiment, NO
3- or NH4+ remained at 5 mM and K+ was at 100 µM (high-affinity
uptake range) and in the NO3− or NH4+ uptake experiment K+ remained at 0.75 mM and NO3−
or NH4+ was at 0.75 mM (high-affinity uptake range) and 75 mM NaCl was added to the salt
stress treatments.
External solution aliquots were taken at 0, 30, 60, 90, 120, 180, 240, 300 and 360 minutes after transference to depletion solutions and the concentration of K+
, NO3− and NH4+
were determined as described in section 5.2.2.2. Deionized water was added to the pot to maintain a constant solution volume. Then, plants were divided into shoots (leaves + stems) and roots and placed in an oven at 60 °C until reaching a constant mass.
Depletion curves were plotted, as described by Claassen and Barber (1974) and were estimate the average rates of K+
the difference between the final and initial concentrations. Depletion curves data were used to determine Vmax andKm through the mathematical graphing method proposed by Ruiz (1985),
using the Cinetica Win software. The value of the highest declivity along the depletion curve divided by the dry mass equals Vmax and the tangent, in the curved part, with an equivalent
value to half of this declivity, determined Km.
K+, Na+, NO3− and NH4+in tissues and xylem sap
Extract of inorganic ions in shoots and roots was obtained from 50 mg of the dried powder and added with 5 mL of deionized water. The homogenate was maintained for 1 h at 75 °C in a water bath and centrifuged at 3000 x g for 10 minutes. The extract was conveniently
diluted with deionized water and K+ and Na+ content was determined by flame photometry,
using KCl and NaCl as a standard, adapted from Malavolta, Vitti and Oliveira (1997).
NO3−contents were obtained by nitration of salicylic acid, according to Cataldo et al.
(1975). Aliquots 50 µL of the aqueous extracts were pipetted into test-tube and mixed with 0.1 mL of 5% (w/v) salicylic acid in concentrated H2SO4 (SA- H2SO4). After 20 minutes, 2.35 mL
of 2N NaOH were added slowly to raise the pH above 12. Sampled were cooled at room temperature and absorbance readings at 410 nm were obtained. KNO3 was used as a standard.
NH4+ contents were determined by phenol-hypochlorite reaction with ammonia
according to Weatherburn (1967). The 160 µL extract aliquots were pipetted into test-tube mixed with 1.0 mL of a solution containing 1% (w/v) phenol and 0.005% (w/v) sodium nitroprusside. Then, was added 1.0 ml of second solution [0.125 M NaOH and 0.063% (v/v) sodium hypochlorite. Samples were heated at 37 °C in water bath for 20 minutes and cooled at room temperature for 45 minutes. The absorbance was measured at 625 nm, with a (NH4)2SO4
standard. Values for inorganic ions in tissues are expressed in µmol g−1 dry mass (DM).
For the xylem analyzes, samples were collected according to Shabala et al. (2010) by cutting plant stems near the base (20 mm above the shoot-root transition) and inserting them in a Scholander-type pressure chamber applying a pressure of 10 to 25 bar. The xylem sap was collected and stored in a 1.5 ml Eppendorf tube and determination of K+, Na+, NO
3− and NH4+
were done as previously described.
Indices of selective absorption and selective transport
Indices of selective absorption (SA value) and selective transport (ST value) for K+
SA = (K+/Na+ in whole plant) (K+/Na+ in medium)-1
ST = (K+/Na+ in shoots) (K+/Na+ in root)-1.
Total nitrogen
Total nitrogen content was determined using the colorimetric method proposed by Baethgen and Alley (1989). Initially, 50 mg of shoots and roots dry powder were digested in Kjeldahl tubes with 2.0 mL of concentrated H2SO4 and 1.1 g of catalyst mixture [K2SO4:
CuSO4:Se (100:10:1)] at 350 ºC to convert N-protein in NH4+ inorganic forms. Then, aliquots
200 µL of the extracts; 1.1 mL of solution containing 0.1 M Na2HPO4; 5% (w/v) potassium
sodium tartrate; 1 M NaOH; 0.8 mL of solution containing 15% (w/v) sodium salicylate; 0.03% (w/v) sodium nitroprusside; and 0.4 mL of solution containing 0.31% (v/v) sodium dichloroisocyanurate were mixed vigorously. Samples were heated at 37 °C in water bath for 20 minutes and cooled at room temperature. The N-total values were measured based on absorbance readings at 650 nm using (NH4)2SO4 as standard.
Free amino acids
Amino acids were extracted from shoots and roots in water heated to 75 °C for 1 hour. The aqueous homogenate was centrifuged at 3000 x g for 10 minutes, collected and
filtered. Amino acid concentrations were quantified by the reaction of the α-amino acids with the ninhydrin that produces a compound of purple color according to Yemm and Cocking (1955). 500 µL of extract aliquots, 250 µL of 0.2 M citrate buffer [4% (w/v) citric acid; 0.4 M NaOH], 500 µL of 0.2 mM KCN and 100 µL 2.5% (w/v) ninhydrin were added in test-tubes and mixed. Samples were heated at 100 °C in water bath for 20 minutes and cooled in ice bath. Thus, 650 µL of ethanol were added and absorbance readings at 570 nm were obtained. Free amino acids contents were calculated using glycine as a standard.
Statistical analysis
Experimental design was completely randomized in a 2 x 2 factorial scheme, arranged by the combination of two salinity levels (0 and 75mM NaCl) and two inorganic nitrogen forms (NO3– and NH4+). The number of replications varied depending on the analysis
days of salinity exposure), the data were subjected to analysis of variance (ANOVA-two way) and the mean values were compared by Tukey’s test (p≤ 0.05). For depletion curves, significant
regression equations (p ≤ 0.05) were adjusted.
Results
K+ uptake rate and kinetics
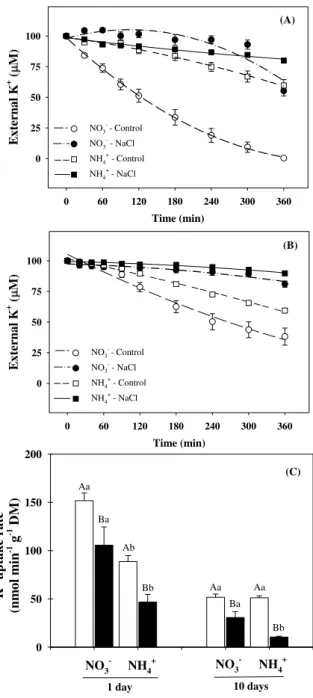
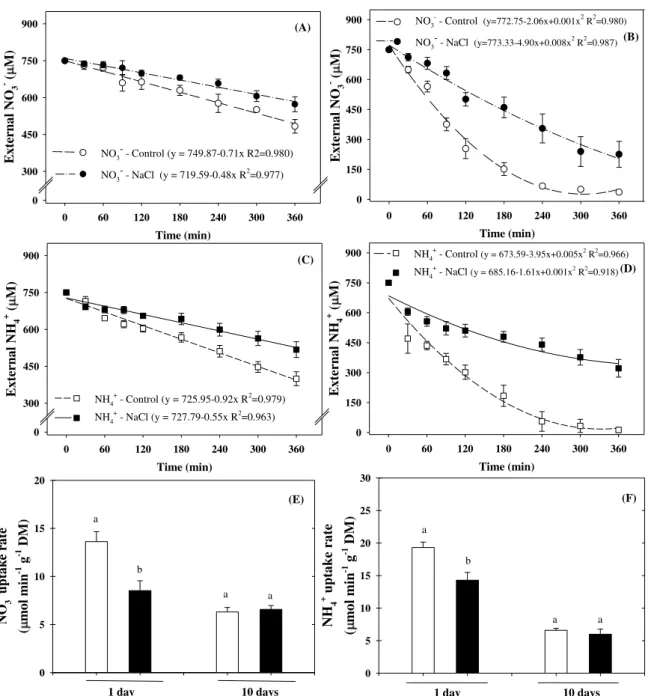
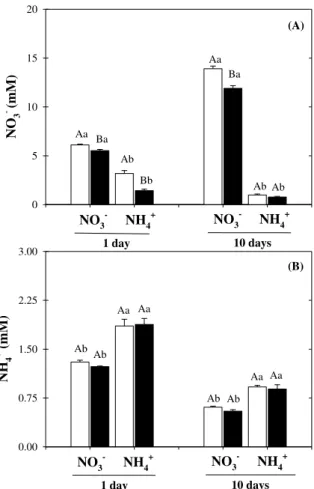
Under control conditions, NO3--fed plants exhibited higher capacity to deplete external K+ than plants grown in the presence of NH4+ after 1 day (Fig. 2A) and 10 days (Fig. 2B) of salt exposure. Salt stress practically abolished the K+ depletion of sorghum plants, regardless of nitrogen source and analyzed time-point (Fig. 2A, B), which resulted in a decreased K+ uptake rate (Fig. 2C). Nonetheless, the net of K+ depletion and uptake rate were significantly higher in NO3--grown stressed plants compared to NH4+-grown plants (Fig. 2).
Figure 2. Net K+ depletion (A, B) and uptake rates (C) by Sorghum bicolor roots. The assays were performed using plants grown in nutrient solutions containing NO3– or NH4+, after 1 (A) and 10 days (B) in absence (control) or presence of 75 mM NaCl-stress. Each curve was drawn with data obtained from six plants. The K+ concentration at each sampling time represents the mean ± SE. (A) NO3–-control (y=98.71–0.456x+0.005x2 R2=0.992); NO3–-stress (y=98.93– 0.06x–0.0001x2 R2=0.990); NH4+-control (y=98.66–0.06x–3.61e–5x2 R2=0.966); NH4+-stress (y=98.26+0.13x–0.0006x2 R2=0.839); (B) NO3–-control (y=105.21–0.247x+0.001x2 R2=0.980); NO3–-stress (y=97.35–0.01x–7.26e–5x2 R2=0.906); NH4+-control (y=101.45–0.09x–5.76e–5x2 R2=0.993); NH4+-stress (y=99.38–0.01x–4.28 e–5x2 R2=0.981). For C, open bar represents control (absence) and closed bar represents salt stress (presence) of 75 mM NaCl-stress; in the same nitrogen source, different capital letters represent statistical differences due to salt stress (control × salt stress) and in the same saline treatment, different lowercase letters show significant differences due to the nitrogen source (NO3– × NH4+) using Tukey’s test (p ≤ 0.05).
Time (min)
0 60 120 180 240 300 360
E xte rnal K + ( M) 0 25 50 75 100 (A) Time (min)
0 60 120 180 240 300 360
E xte rnal K + ( M) 0 25 50 75 100
NO3- - Control
NO3- - NaCl
NH4+ - Control
NH4+ - NaCl
(B)
K
+ u
pt ak e r at e (n m ol m in
-1 g -1 DM)
0 50 100 150 200 NO3 - NH 4 + NO 3 -NH4 +
1 day 10 days
Ab Aa Ba Bb Ba Bb Aa Aa (C)
NO3- - Control
NO3- - NaCl
NH4+ - Control
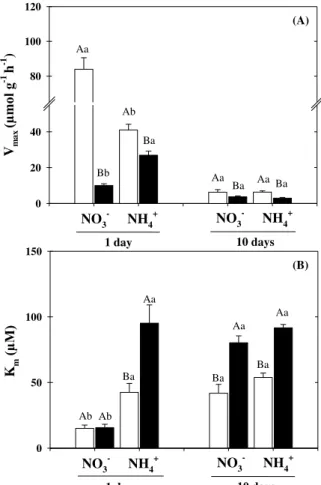
Figure 3. Kinetic parameters of K+ uptake derived from roots of Sorghum bicolor plants grown in nutrient solutions containing NO3– or NH4+, in absence (open bar) or presence (closed bar) of 75 mM NaCl-stress. Vmax (A) Km (B) for K+ were calculated at 1 and 10 days after salinity exposure. Values represent the means of five repetitions ± SE. In the same time-point and nitrogen source, different capital letters represent statistical differences due to salt stress (control × salt stress) and in the same saline treatment, different lowercase letters show significant differences due to the nitrogen source (NO3- × NH4+) using Tukey’s test (p ≤ 0.05).
Selective absorption and transport for K+ over Na+
Under salt stress, plants grown with NH4+ displayed higher selective absorption for K+ over Na+ than those supplied with NO3- at the second analyzed time-point (Fig. 4A, B). In a similar way, selective transport for K+ over Na+ was higher in NH4+-grown stressed plants than in NO3–-grown plants at 1 day and similar at 10 days of salt exposure.
Vm
ax
(µ
m
ol g
-1 h -1 ) 0 20 40 80 100 120
NO3- NH
4
+ NO
3
-NH4+
1 day 10 days
Ab Aa Bb Ba Ba Ba Aa Aa (A) Km (µ M ) 0 50 100 150
NO3- NH
4 + NO 3 - NH 4 +
1 day 10 days
Figure 4. Values of selective absorption (A) and transport (B) for K+ over Na+ of Sorghum
bicolor plants grown in nutrient solutions containing NO3– or NH4+ as inorganic nitrogen source, in presence of 75 mM NaCl-stress. The measurements were done after 1 and 10 days of salinity exposure. Values represent the means of five repetitions ± SE. In the same harvest time, different lowercase letters represent statistical differences due to nitrogen source using Tukey’s test (p ≤ 0.05).
K+/Na+ homeostasis in tissues and xylem sap
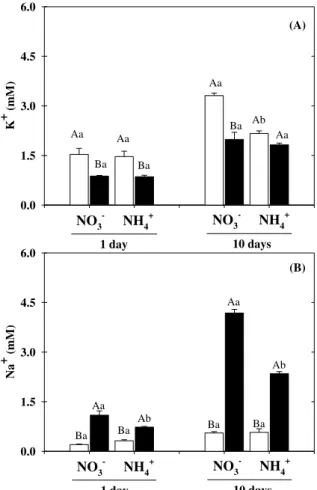
The low K+ uptake in NH4+-grown sorghum plants was not reflected in decreased K+ accumulation (Fig. 5A, B). Indeed, in NaCl absence, plants grown with NH4+ displayed higher K+ content in roots than that of NO3--fed plants. In general, the salinity promoted significant reductions in K+ accumulation in both plant organs, except for shoot of NH4+-fed plants after 1 day of NaCl-stress (Fig. 5A, B).
Na+ contents in shoot and roots were strongly increased under salt stress, regardless of nitrogen source (Fig. 5C, D). Nevertheless, Na+ accumulation in shoot of NH4+-grown plants was found to be 27.8 and 26.2% lower than in NO3--grown plants at 1 and 10 days, respectively (Fig. 5C, D). In roots, after 10 days of salinity, the Na+ accumulation of NH4+-grown stressed plants was decreased by 33.6% in comparison NO3−-grown stressed plants (Fig 5D). Although
Se le ctive abs or ption K ,Na 0 25 50 75 100
NO3- NH 4 + NO 3 - NH 4 +
1 day 10 days
a a b a (A) Se le ctive tr anspor
t K,Na
0.0 1.5 3.0 4.5 6.0
NO3- NH4+ NO3- NH 4
+
1 day 10 days
a
b
a a