UNIVERSIDADE FEDERAL DO CEARÁ – UFC
DEPARTAMENTO DE PATOLOGIA E MEDICINA LEGAL
PROGRAMA DE PÓS-GRADUAÇÃO EM MICROBIOLOGIA MÉDICA
Estudo da distribuição da frequência de genótipos de
Helicobacter pylori
em lesões gástricas
ANA PAULA SANTOS DO CARMO
ANA PAULA SANTOS DO CARMO
Estudo da distribuição da frequência de genótipos de
Helicobacter pylori
em lesões gástricas
Orientadora: Professora Dr
a. Sílvia Helena Barem Rabenhorst
Fortaleza-CE
2011
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
C285i Carmo, Ana Paula Santos do
Estudo da distribuição da frequência de genótipos de Helicobacter pylori em lesões gástricas/ Ana Paula Santos do Carmo. – 2011.
109 f. : il.
Dissertação (Mestrado) – Universidade Federal do Ceará, Faculdade de Medicina, Programa de Pós-Graduação em Microbiologia Médica, Fortaleza, 2011.
Orientação: Profª Drª Sílvia Helena Barem Rabenhorst
1. Helicobacter pylori. I. Título. Gastrite, Gastrite atrófica, Úlcera. CDD 616.33
ANA PAULA SANTOS DO CARMO
Estudo da distribuição da frequência de genótipos de Helicobacter pylori em lesões gástricas
Banca Examinadora
___________________________________________________________
Profª Drª Sílvia Helena Barem Rabenhorst (Orientadora) Universidade Federal do Ceará – UFC
_____________________________________________________________ Profª Drª Maria Inês de Campos Moura Pardini
Universidade estadual Paulista - Unesp
______________________________________________________________ Prof Dr Ricardo Aires Correia
Universidade Federal do Ceará – UFC
_________________________________________________________________ Prof Dr José Telmo Valença Júnior
Agradecimentos
A Deus pelo sublime dom da vida, minha força, minha luz, meu guia e meu caminho. Aos meus pais, Antônio Paixão e Maria Socorro, por todo apoio, incentivo e amor incondicional. À minha filha Ana Beatriz, pela sua doçura, compreensão e cooperação, minha companheirinha. Te amo
demais.
A toda a minha família, especialmente, aos que participaram direta ou indiretamente da realização deste projeto na minha vida.
A Maria Juraci Gois da Silva, por seu profissionalismo, apoio e amizade, sua ajuda foi fundamental. Ao programa de Pós Graduação em Microbiologia Médica representado pelos professores e demais
funcionários pelo empenho na formação científica dos pós-graduandos. A CAPES pelo suporte financeiro.
Aos pacientes incluídos neste estudo e seus familiares, pela atenção concedida.
À professora Dra. Silvia Helena Barem Rabenhorst, pelos ensinamentos, orientação, dedicação e paciência. Sua ajuda foi fundamental para a minha formação como mestre e a realização deste trabalho. À Prof.ª. Fernanda Capelo, ao Dr. Dalgimar Bezerra de Menezes e a Drª Régia Maria Vidal Patrocínio por
sempre nos receberem com atenção.
Ao laboratório BIOPSE® em nome do Dr Dalgimar Bezerra de Menezes e Da Dra Régia Maria Vidal Patrocínio pela prontidão no fornecimento dos laudos histopatológicos;
Ao Hospital Universitário Walter Cantídeo, Hospital São José de Doenças infecciosas e ao Hospital Geral de Fortaleza por nos permitir o acesso para a execução desteestudo;
Aos participantes da banca, por aceitar o convite para participar da avaliação deste trabalho e pelas valiosas contribuições;
À equipe de médicos, enfermeiros e auxiliares do serviço de endoscopia dos hospitais: Hospital Universitário Walter Cantídeo, Hospital São José de Doenças infecciosas e Hospital Geral de Fortaleza, pela contribuição
no desenvolvimento desse estudo;
A doutoranda Rita de Cássia Barbosa, por seu carinho e doçura, sua presença sempre nos alegra. À doutoranda Valeska Portela Lima, pelo apoio de todos os momentos, ensinamentos, presteza, incentivo e
por acreditar em mim. Você é um exemplo de pessoa e de profissional.
À doutoranda Markênia Kélia Santos Alves, por sua amizade, suas palavras de incentivo e por estar sempre pronta a ajudar.
À doutoranda Isabelle Joyce de Lima Silva Fernandes, por seu sorriso contagiante, alegria, apoio e palavras de incentivo. Admiro muito sua disciplina e competência,
À mestranda Debora Menezes Costa, por sua doçura, sempre estar disponível a ajudar e por seu profissionalismo.
Aos alunos de iniciação científica Pedro, Igor e Ana Paula companheiros neste projeto, pela cooperação dedicação e presteza.
Aos amigos do Laboratório de Genética Molecular-LABGEM, Denise, Patrícia, Eduardo, Carol, Érika, Marcio Vinícius, Sâmia, Ingrid, Rogério, Lia e Paulo Roberto pela tão agradável convivência e
ensinamentos compartilhados, que tornarãoeste trabalho menos árduo.
!
"
#$
RESUMO
A bactéria Helicobacter pylori, é um agente etiológico bem estabelecido para o
desenvolvimento de lesões gástricas como gastrite, úlcera péptica, metaplasia e doenças
malignas, com alta incidência de infecção em todo mundo, porém cerca de 80% dos
indivíduos infectados permanecem assintomáticos e apenas uma minoria desenvolve doenças a ela relacionadas. Estudos têm sido realizados na tentativa de identificar a relação
de genes determinantes da patogenicidade de H. pylori, entretanto, até o momento apenas
os genes cagA e o alelo de vacA s1m1 são considerados marcadores de virulência para o
desenvolvimento de lesões gástricas mais graves. A bactéria H. pylori possui uma alta
variabilidade genética,sendo que um dos mecanismos propostos para o desenvolvimento
de lesão seria através da inflamação. Diferenças na intensidade de respostas inflamatórias poderiam ser decorrentes do perfil genotípico da cepa infectante. Recentes trabalhos
apontam a importância dos genes cagE, virB11 de H. pylori, em câncer gástrico.
Entretanto, estudos em lesões gástricas são restritos. Assim, o objetivo deste trabalho foi
determinar o perfil genotípico das cepas de H. pylori quanto a presença dos genes de
virulência cagA, cagE, virB11, vacA e flaA, circulantes no estado do Ceará em 201 casos
de lesões gástricas de diferentes gravidades, coletadas de pacientes dispépticos atendidos
em três hospitais de Fortaleza-CE. A detecção de H. pylori foi feita através da amplificação
do gene ureC, os genes estudados por amplificação de fragmentos específicos, usando a
técnica de PCR, foram observados em gel de agarose 1% e poliacrilamida a 6% e 8%.
Neste estudo houve um predomínio do sexo feminino 59% (119/201), principalmente na
faixa etária (15-44) 30% (61/201), alta taxa de infecção por H. pylori 97,5% (196/201). A
gastrite crônica ativa (GCA) foi a lesão gástrica mais frequente (55,7%;112/201), associada a pacientes na faixa etária de 15-44 (36,6% : 41/112) opondo-se à metaplasia
intestinal em que,a frequência dos casos aumentou com a idade sendo maior em pacientes
mais velhos 46% (16/35), o que concorda com a literatura. O único caso de displasia ocorreu numa paciente > 65 anos. As lesões gástricas foram predominantemente
localizadas no antro. O gene cagA foi mais frequente na gastrite crônica ativa (GCA),
estando também em alta frequência na gastrite atrófica (GA) e metaplasia intestinal (MI).
Na GCA foi observado também alta frequência dos genes cagE, virB11, vacAm1 e flaA,
com diferença estatística, quando comparada com a gastrite crônica inativa (GCI) (cagA
-p=0,007 cagE- p=0,000, virB11 - p=0,005, vacAm1- p=0,047 e flaA - p=0,001), sendo
que os genes virB11 e flaA foram mais frequentes na GCA do que na úlcera. Os alelos s1 e
m1 de vacA , bem como a combinação s1m1 foram os mais frequentes nas lesões gástricas.
Os casos H. pylori positivos foram agrupados de acordo com a presença dos genes
estudados, levando em consideração a presença do alelo s1 e os genes da ilha. Nessas
análises foi observada maior frequência de cepas contendo os genes vacA s1 e [Ia (cagA+,
cagE+ e virB11+ ) + Ib (cagA+ e virB11+; cagE+ e virB11+) ; 47,7% ] na gastrite crônica ativa em relação a gastrite crônica inativa (GCI), esta com maior frequência de cepas dos grupos [Ic (cagA+ ou cagE+ ou virB11+ ou cagA+ e cagE+) +Id (ureC+); 62%]. Adicionalmente, maior frequência de cepas pertencentes aos grupos Ia e Ib foi observada na metaplasia intestinal incompleta, (59%), enquanto que na metaplasia intestinal completa
uma maior frequencia de cepas pertencentes aos grupos Ic + Id, (78%) (p=0,027). Todos os
casos de gastrite atrófica e úlcera eram do grupo I, e um único caso de displasia pertencia ao grupo Ia. Esses dados evidenciam uma associação de cepas com genótipos mais virulentos em lesões com potencialidade de malignização.
Palavras-chave: Helicobacter pylori; lesões gástricas, gene cagA, gene cagE, gene
ABSTRACT
The bacterium Helicobacter pylori is a well-established etiological factor in the
development of gastric lesions such as gastritis, peptic ulcers, metaplasia and malignancy. The incidence of infection by this pathogen is high worldwide, but about 80% of infected individuals remain asymptomatic, and only a minority develops related diseases. Many studies have been conducted in an attempt to identify the involvement of genes in
determining the pathogenicity of H. pylori, but so far, only the genes cagA and vacA allele
s1m1 are considered virulence markers for the development of the more severe gastric
lesions. H. pylori bacteria have a high genetic variability and one of the proposed
mechanisms for lesion development is through inflammation. Differences in the intensity of inflammatory responses could be due to the genotypic profile of the infecting strain.
Recent studies indicate the importance of the genes cagE and virB11, but mostly involving
gastric cancer, while their role in gastric lesions is limited. The objective of this study was
to determine the genetic subtypes of H. pylori strains and the presence of the virulence
genes cagA, cagE, virB11 and flaA genes and vacA alleles, circulating in Ceara state,
Brazil. Samples were collected from 201 cases of gastric lesions of varying severity, in dyspeptic patients treated at three hospitals in Fortaleza, Ceara State.
The detection of H. pylori was performed using ureC gene amplification by PCR, and the
detection of the genes studied was carried out by amplification of gene-specific fragments separated in 1% agarose gels. The sample was predominantly female (59%, 119/201) and
mainly in the age group 15-44 years old (30%, 61/201), and had a high rate of H. pylori
infection (97.5%, 196/201). Active chronic gastritis (ACG) was the most common gastric lesion (55.7%, 112/201), associated with patients aged 15-44 (36.6%, 41/112), unlike intestinal metaplasia, in which the frequency of cases increased with age, being higher in older patients (46%, 16/35), which agrees with the literature. A single case of dysplasia occurred in a patient > 65 years. The lesions were predominantly located in the gastric antrum and 30% of the cases had lesions located in the body and antrum simultaneously.
The cagA gene was more frequent in ACG, showing a statistically significant correlation (r
= 0.220, p = 0.007); it also showed a high frequency in atrophic gastritis and in intestinal
metaplasia. In ACG, a high frequency of the genes cagE, virB11, flaA and vacAm1 was
also statistically associated when compared to chronic inactive gastritis (ICG) (cagA - p =
0.007, cagE - p = 0.000, virB11 - p = 0.005, vacAm1 p = 0.047 and flaA - p = 0.001), and
the genes virB11 and flaA were more frequent in ACG than in ulcer. The vacA alleles s1
and m1, and the combination s1m1, were the most frequent ones in gastric lesions.
Considering the genotypes of H. pylori grouped by the presence of the genes studied, we
observed a higher frequency of the most virulent strains in the ACG group (Ia + Ib, 47.7%) when compared to ICG, the latter showing a higher frequency of less virulent strains (Ic + Id, 62%). Additionally, a higher frequency of more virulent strains, belonging to groups Ia and Ib, was observed in incomplete intestinal metaplasia (59%), while in complete intestinal metaplasia an increased frequency of less virulent strains, belonging to the groups Ic + Id (78%) (p = 0.027), was found. All cases of atrophic gastritis and ulcer were in group I, and the single case of dysplasia belonged to group Ia (high virulence). These data indicate the important role of more virulent strains in potential malignant lesions.
Key-words: Helicobcter pylori, gastric lesions, cagA gene, cagE gene, virB11 gene, flaA
Índice
1 INTRODUÇÃO ... ...7
1.1 HELICOBACTER PYLORI ... 7
1.2 MÉTODOS DE DIAGNÓSTICO DA INFECÇÃO POR HELICOBACTER PYLORI ... 8
1.3 LESÕES GÁSTRICAS ASSOCIADAS À HELICOBACTER PYLORI ... 10
1.3.1 Gastrite crônica ... 11
1.3.2 Gastrite atrófica ... 15
1.3.3 Metaplasia intestinal ... 16
1.3.4 Displasia... 18
1.3.5 Úlcera péptica - gástrica e duodenal ... 21
1.4 VARIABILIDADE GENÉTICA X VIRULÊNCIA DA CEPA ... 23
1.5 ACOLONIZAÇÃO POR HELICOBACTER PYLORI ... 23
1.6 GENES DE VIRULÊNCIA ... 25
1.6.1 Gene vacA ... 25
1.6.2 A ilha de patogenicidade cag-PAI ... 27
1.7 PERGUNTAS DE PARTIDA ... 32
1.8 HIPÓTESE ... 32
2 OBJETIVOS ...32
2.1 OBJETIVO GERAL ... 32
2.2 OBJETIVOS ESPECÍFICOS ... 32
3 MATERIAL E MÉTODOS ...33
3.1 CASUÍSTICA E COLETA DE DADOS ... 33
3.2 ASPECTOS ÉTICOS ... 33
3.3 COLETA DE MATERIAL ... 34
3.4 AVALIAÇÃO HISTOPATOLÓGICA ... 34
3.5 EXTRAÇÃO DO DNA DE ESPÉCIMES CONGELADOS ... 34
3.6 DETECÇÃO DE H. PYLORI ... 35
3.6.1 Presença e subtipos do gene vacA de H. pylori . ... 36
3.6.2 Detecção do gene cagA ... 37
3.6.3 Detecção do gene cagE ... 37
3.6.4 Detecção do gene virB11 ... 38
3.6.5 Detecção do gene flaA ... 38
4 ANÁLISE ESTATÍSTICA ...39
5 RESULTADOS ...40
5.1 CARACTERIZAÇÃO DA AMOSTRA ... 40
5.2 LESÕES GÁSTRICAS:ASPECTOS CLINICO-EPIDEMIOLÓGICOS ... 41
5.3 DETECÇÃO DA INFECÇÃO POR H. PYLORI. ... 44
5.3.1 Genes de virulência ... 46
5.4 ANÁLISE DA ILHA CAG-PAI EM RELAÇÃO AOS GENES ESTUDADOS. ... 52
5.6 ANÁLISES DAS GASTRITES CRÔNICAS CONSIDERANDO A GRADUAÇÃO E OS GENÓTIPOS DE
H. PYLORI AGRUPADOS. ... 58
5.7 ANÁLISE DOS FRAGMENTOS DO SITIO OPOSTO DA LESÃO ... 60
6 DISCUSSÃO ...62
6.1.1 Caracterização da amostra ... 62
6.1.2 Lesões gástricas: aspectos clínico-epidemiológicos ... 63
6.1.3 Detecção da infecção por H. pylori. ... 64
6.1.4 Integridade da ilha cag-PAI em relação aos genes estudados. ... 70
6.1.5 Análises das lesões gástricas estudadas considerando os genótipos de H. pylori agrupados. 71 6.1.6 Análises das gastrites crônicas considerando a graduação e os genótipos de H. pylori agrupados. 73 6.1.7 Análise dos fragmentos do sítio oposto da lesão. ... 73
7 CONCLUSÃO ...75
8 REFERÊNCIAS BIBLIOGRÁFICAS ...76
PARECERES DOS COMITÊS DE ÉTICA E PESQUISA ...93
QUESTIONÁRIO DE COLETA DE DADOS CLÍNICO– EPIDEMIOLÓGICOS ...96
CADASTRO DE PACIENTES SUBMETIDOS À ENDOSCOPIA...97
Lista de Figuras
Figura 1: Prevalência mundial da infecção por helicobacter pylori....8
Figura 2: Fluxograma do modelo de carcinogênese gástrica sugerido por correa...10
Figura 3: Sítios anatômicos do estômago. ...11
Figura 4: Gastrite crônica não atrófica...12
Figura 5: Representação esquemática da distribuição de inflamação e atrofia em diferentes tipos de gastrite crônica atrófica e não atrófica...13
Figura 6: Escala visual analógica de classificação das variáveis morfológicas da gastrite...15
Figura 7: Gastrite atrófica...16
Figura 8: Metaplasia intestinal...17
Figura 9: Microfotografias de metaplasia intestinal...18
Figura 10: Microfotografias de displasia...19
Figura 11: Microfotografia de displasia de baixo grau, do tipo foveolar...20
Figura 12: Microfotografia de displasia de alto grau...21
Figura 13: Microfotografia de úlcera gástrica...23
Figura 14: Helicobacter pylori......24
Figura 15: Fatores de virulência e fatores de colonização de Helicobacter pylori......26
Figura 16: Combinações em mosaico das variáveis alélicas de vaca. ...27
Figura 17: Ilha de patogenicidade contendo genes que mostram marcante variação de sequência...28
Figura 18: Fenótipos e variações de cagA...29
Figura 19: Esquema do sistema de secreção do tipo IV (T4SS)...30
Figura 20: Gel de poliacrilamida a 6% corado com nitrato de prata, gene urec...46
Figura 21: Géis de poliacrilamida a 6% com fragmentos específicos dos genes caga [a], alelos m1 e m2 de vaca [b] os alelos s1 e s2 de vaca, respectivamente [c]...46
Lista de gráficos
Gráfico 01: Distribuição dos casos de lesões gástricas segundo o gênero e faixa etária...41
Gráfico 02: Distribuição das lesões gástricas segundo o gênero...42
Gráfico 03: Distribuição das lesões gástricas segundo a faixa etária e o tipo de lesão...43
Gráfico 04: Distribuição das lesões gástricas de acordo com a localização anatômica...44
Gráfico 05: Positividade do gene da ureC nas lesões gástricas...44
Gráfico 06: Frequência dos genes estudados nas amostras H. pylori positivas...45
Gráfico 07: Frequência do gene da cagA nas lesões gástricas ...47
Gráfico 08: Frequência do gene da cagE nas lesões gástricas ...48
Gráfico 09: Frequência do gene da virB11 nas lesões gástricas ...48
Gráfico 10: Frequência do gene da flaA nas lesões gástricas ...49
Gráfico 11: Frequência dos alelos do gene vacA nas lesões gástricas, (a) s1 e s2; (b) m1 e m2...50
Lista de tabelas
Tabela 1: Dados clínico-epidemiológicos da amostra...40
Tabela 2: Correlação entre diferentes faixas etárias e as lesões gástricas...43
Tabela 3: Frequências dos genes de h. pylori nas lesões ...51
Tabela 4: Genes da ilha cag-PAI estudados na amostra geral...52
Tabela 5: Análise das lesões gástricas estudadas considerando os genótipo de H. pylori...55
Tabela 6: Análise das lesões gástricas estudadas considerando os genótipos de H. pylori...57
Tabela 7: Distribuição das gastrites de acordo com a graduação nos grupos de H. pylori...59
Tabela 8: comparação entre os fragmentos do sítio da lesão e sítio oposto em relação aos grupos de H. pylori ......61
Tabela 9 : Frequência da infecção por H. pylori em estudos realizados no Brasil...65
Lista de quadros
QUADRO 1:VANTAGENS E DESVANTAGENS DE ALGUNS TESTES DIAGNÓSTICOS DE H. PYLORI ... 9
QUADRO 2:CLASSIFICAÇÃO DA GASTRITE CRÔNICA COM BASE NA MORFOLOGIA...12
QUADRO 3: CARACTERÍSTICAS CITOLÓGICAS ENCONTRADAS NA METAPLASIA ... 17
LISTA DE ABREVIATURAS
AINES Anti-inflamatóriosnão esteroidais
cag-PAI Ilha de patogenicidade Cag
CTAB
cagA
cagE DEG GA
Cetyl Trimethyl Ammonium Bromide
(citotoxina associada ao gene A) (citotoxina associada ao gene E) Displasia epitelial gástrica Gastrite atrófica
GCA Gastrite crônica ativa GCI Gastrite crônica ativa MI
MIC MII
Metaplasia intestinal
!
7
1 Introdução
1.1 Helicobacter pylori
A bactéria Helicobacter pylori foi identificada por Warren e Marshall, em 1983
(WARREN et al., 1984). Essa descoberta e seu papel na gastrite e úlcera péptica valeram aos cientistas australianos o Prêmio Nobel de Medicina em 2005 (COELHO et al., 2005).
Anteriormente designada por Campylobacter pylori, Helicobacter pylori é uma bactéria
gram-negativa, microaerófíla, flagelada, apresenta de 0,5 a 0,9 µm de largura e 2 a 4 µm de comprimento, espiralada e curvada, apresenta-se nessa forma em culturas frescas e tem sido descrita também na forma cocóide sobre situação de estresse ou em culturas velhas, embora seja viável (GOLDSTEIN, 2002; PASSARO et al., 2002; LIU et al., 2006). Essa espécie está classificada no Domínio Bacteria, filo Proteobacteria , classe Epsilonproteobacteria, na ordem
Campylobacterales, na família Helicobacteraceae e no gênero Helicobacter (DUNN et al.,
1997; GOODWIN et al., 1989; OWEN, 2001; MONTECUCCO, RAPPUOLI 2001; NCBI).
O gênero Helicobacter é composto por aproximadamente 27 espécies que têm propriedades
comuns, especialmente pela capacidade de colonizar o estômago, podendo alojar-se na região do corpo, no fundo gástrico, estando em maior densidade no antro (BLASER et al., 2001).
Apresenta distribuição cosmopolita e coloniza cerca de metade da população mundial. A colonização geralmente ocorre durante a infância, havendo mais de 3 bilhões de pessoas infectadas. Esse micro-organismo é considerado um dos mais bem sucedidos patógenos bacterianos, podendo permanecer sob infecção assintomática por décadas, uma vez que a bactéria escapa da resposta imune inata e adaptativa do hospedeiro (DOMINIQUE et
al., 2006; SUAREZ et al., 2006; SUERBAUM, JOSENHANS, 2007). A prevalência da
infecção por H. pylori varia com a idade e a etnia, estando fortemente relacionada com as
!
8
Figura1: Prevalência mundial da infecção por Helicobacter pylori.
Fonte: KHALIFA et al., Gut Pathogens 2010; wwww.portalconsular.mre.gov.br/clientes/portalconsular).
Os aglomerados populacionais e os indicadores de má higiene são fatores de risco particularmente importantes. Apesar de não ser completamente entendido como ocorre a transmissão, as vias de transmissão mais aceitas são: (1) a via fecal-oral, característica de países em desenvolvimento, onde a água poderia ser a principal fonte de contaminação; e (2) a via gastro-oral e oral-oral, prevalente em países desenvolvidos (LEHOURS et al., 2007; KHALIFA et al., 2010), podendo também ocorrer por iatrogenia (CAVA et al., 2003).
1.2 Métodos de diagnóstico da infecção por Helicobacter pylori
A alta prevalência mundial da infecção tem estimulado o desenvolvimento de
vários métodos para o diagnóstico da infecção por H. pylori. Tais métodos classificam-se
como invasivos ou não invasivos e estão descritos no quadro um. Contrariamente aos testes não invasivos, os testes invasivos requerem a realização de exame endoscópico (CEREZO et
al., 2006). A seleção de um procedimento, um teste para demonstrar H. pylori, depende da
questão a ser respondida, bem como da indicação. Sempre que a endoscopia é realizada, são coletadas biópsias para realização do teste rápido da urease e do exame histológico para a
confirmação da presença dessa bactéria. Assim, cumprir-se-ia a exigência de dois testes com
resultados positivos para o diagnóstico da infecção por H. pylori. A única exceção a esta regra
!
9
estes testes (urease e histopatológico), devem ser colhidos múltiplos espécimes de biópsias totalizando quatro amostras (duas do antro e duas do corpo), evitando assim resultados falsos positivos (DIXON et al., 1996).
Quadro 1: Vantagens e desvantagens de alguns testes diagnósticos da infecção por H. pylori.
Método Vantagens Desvantagens Refs.
Cultura bacteriana (colônias pequenas, acinzentadas, translúcidas
e fracamente – hemolíticas);
O isolamento da cepa; Invasivo; Baixa Sensibilidade quando
o número de organismos presente é pequeno; Dificuldade em se cultivar
devido à sua natureza fastidiosa e crescimento
lento;
DUNN; COHEN; HE et al. 2002, FISCHBACH et
al. 2009;
Teste rápido da uréase; Rápido;
Barato; Baixa Sensibilidade quando Invasivo; o número de organismos
presente é pequeno; Pode não ser específico na presença de outras bactérias
urease-positivas;
HE et al., 2002;
Teste respiratório com ureia marcada com
carbono 14;
Não Invasivo; Rápido;
Barato;
Baixa Sensibilidade quando o número de organismos
presente é pequeno;
HE et al., 2002;
Histologia; Barato; Baixa Sensibilidade quando
o número de organismos presente é pequeno;
Invasivo;
HE et al., 2002, FISCHBACH et al. 2009;
Teste do antígeno fecal; Não invasivo;
Relativamente barato; Sensível (92-94%) e Específico (92-95%) para
indivíduos não tratados;
Baixa Sensibilidade (40%) cerca de quatro semanas
após a erradicação da bactéria;
CARTÁGENES et al., 2009; HE et al., 2002;
Sorologia; Alta Sensibilidade quando o
número de organismos presente é pequeno;
Não Invasivo;
Pode não diferenciar a infecção ativa de uma
infecção passada; Especificidade 83%
WGO Practice Guidelines, 2006; HE et al., 2002, FISCHBACH et al. 2009;
Reação em cadeia da polimerase (PCR);
Alta Sensibilidade quando o número de organismos
presente é pequeno; Rápido; Altamente Sensível; Altamente Específico; Realizável em material fresco, bem como em
parafina
Invasivo; HE et al., 2002; FRANCISCO-JUNIOR et
!
10
Dentre os vários testes descritos para a detecção de H. pylori, destaca-se a reação
em cadeia da polimerase (PCR), por ser uma técnica altamente sensível, confiável, baseada na amplificação de fragmentos de genes específicos da bactéria (HE et al., 2002; KONEMAN, 2008; CARTÁGENES et al., 2009; WGO, 2006; FRANCISCO-JUNIOR et al., 2004).
1.3 Lesões gástricas associadas à Helicobacter pylori
Desde que foi descoberta, esta bactéria tem sido associada a ocorrência de várias doenças gastroduodenais (DUNN et al., 1997). Apesar da alta incidência em todo o mundo, cerca de 80% dos indivíduos infectados permanecem assintomáticos, somente uma minoria desses indivíduos desenvolve úlcera péptica, gastrite atrófica ou doenças gástricas malignas
(GIUDICEG et al., 2006). As lesões gastroduodenais associadas ao H. pylori podem progredir
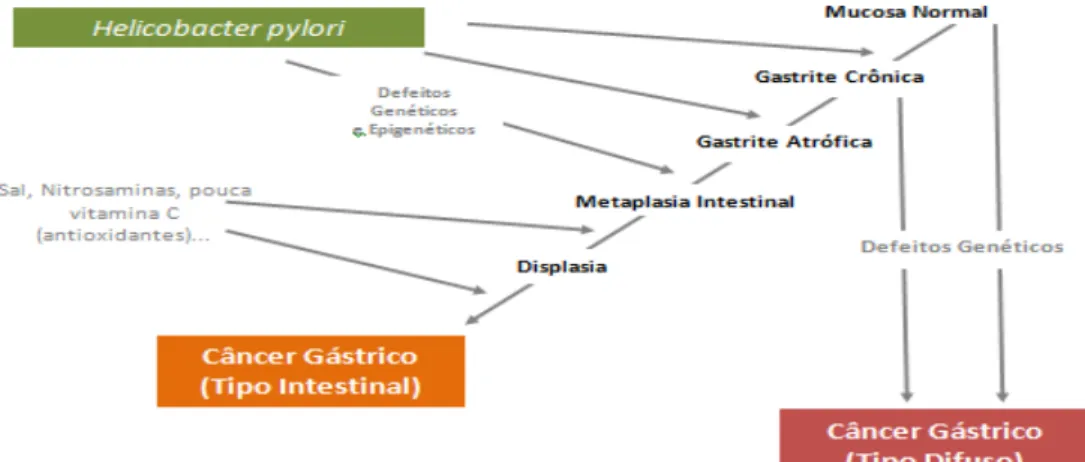
para o câncer gástrico, que resulta de um processo com múltiplas etapas, no entanto essa bactéria tem papéis diferentes na progressão dos tumores intestinais e difusos. Nos tumores intestinais, de acordo com Correa (1992), há alterações morfológicas sequenciais (Cascata de
Correa) que se iniciam pela modificação da mucosa normal para a gastrite crônica, seguida
pelo aparecimento de gastrite atrófica, metaplasia intestinal, displasia e, por fim, adenocarcinoma (Figura 2) (WERNER, 2001; MULLER et al., 2007).
Essas condições podem ocorrer através de anos, sendo comumente associada à presença
de H. pylori (CÉSAR et al., 2002; KONTUREK, 2003). Já a úlcera péptica, lesão
pré-cancerosa importante do estômago, pode ser outra via da carcinogênese gástrica induzida por
H. pylori (TODD et al., 2004).
Figura 2: Fluxograma do modelo de carcinogênese gástrica sugerido por Correa.
!
11
As lesões gástricas podem estar localizadas em qualquer parte do estômago,
o qual se divide em cinco regiões anatômicas (Figura 3), a região da cárdia, uma porção cônica e estreita situada imediatamente após a união gastresofágica, é composta por células mucosas (secretam muco e pepsinogênio I e II). O fundo gástrico é uma região em forma de cúpula do estômago proximal que se estende no sentido superior lateral a região da cárdia, composto basicamente por células parietais (secretam HCl e fator intrínseco) e células principais (secreção de enzimas). O corpo compreende o restante do estômago proximal, que vai até a incisura angularis e é composto pelas células parietais, principais e endócrinas. A
seguir, em seguida encontram-se a região do antro gástrico e a região pré-pilórica, que se
inicia na incisura angularis e termina no duodeno, separando-se pelo piloro. As células que compõem essa região são as células G (secretam gastrina e somatostatina) e células mucosas (KUMAR et al., 2011).
Figura 3: Sítios anatômicos do estômago.
Fonte: SABERNAWEB
1.3.1 Gastrite crônica
!
12
crônicas individuais dispersas (mononucleares) na lâmina própria, dessa forma qualquer
aumento de celularidade indica gastrite crônica (TAN, WON, 2011). O quadro 2 apresenta a classificação atualizada da gastrite crônica com base na topografia, morfologia e etiologia.
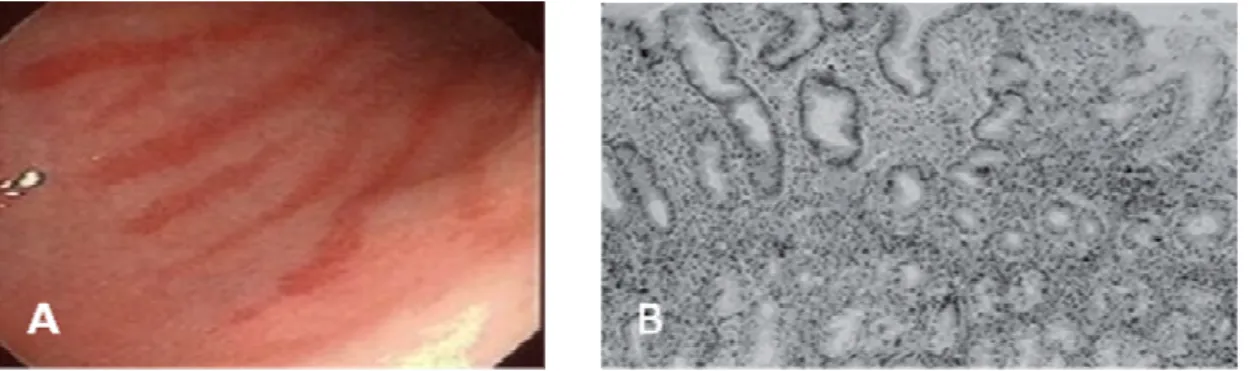
Figura 4: Gastrite crônica não atrófica: A) Aspecto endoscópico gastrite crônica não atrófica. B) Microfotografia de gastrite crônica não atrófica (H-E 200x).
Fonte: www.endoscopiacurso.com.br/imagens/fotografias) (MULLER et al., 2007) .
Quadro 2: Classificação de gastrite crônica com base na morfologia, topografia e etiologia (DIXON et al., 1996).
Tipos de gastrites
Fatores etiológicos Sinônimos de gastrites
Não atrófica Helicobacter pylori
Outros fatores Superficial Gastrite antral difusa Gastrite crônica antral Intersticial-folicular Hipersecretória Tipo B*
Atrófica
Autoimune Autoimunidade Tipo A* Difusa do corpo
Associada a anemia perniciosa
Atrofia multifocal Helicobacter pylori Tipo B*; tipo AB*
Ambiental Metaplásica
Formas especiais
Químicas Irritação química Bile
AINES Outros agentes Reativa Refluxo AINES Tipo C* Radiação
Linfocítica Injúria por radiação Idiopática ? mecanismos imunes Varioliforme (endoscópica) Associada a doença celíaca
Não infecciosas Granulomatosas
Doença de Crohn Sarcoidose
Granuloma de Wegener e outras vasculites
Substâncias estranhas Idiopática
Granulomatosa isolada
Eosinófilica Sensibilidade alimentar
Outros alergénos Alérgica
Outras gastrites infecciosas Bactérias (outras exceto )
Vírus Fungos Parasitas
Flegmonosa
!
13
A gastrite crônica associada ao H. pylori é uma afecção muito comum com larga
e uniforme distribuição mundial, com uma variação de infecção de 70 a 97% em estudos realizados no Brasil (CABRAL et al., 2006; LADEIRA et al., 2008; MOTTA et al., 2008; BARBOSA et al., 2009; ARRUDA et al., 2009; BARTCHEWSKY et al., 2010; KAGUE et
al., 2010; MEINE et al., 2011). Na gastrite por H. pylori, encontra-se um infiltrado celular que
contém efetores da resposta imune, incluindo linfócitos T CD4 e CD8, linfócitos B, plasmócitos, monócitos, mastócitos e eosinófilos (DIXON et al., 1996). A presença de exsudação de neutrófilos caracteriza atividade da gastrite crônica, que pode ser divida em dois tipos: gastrite crônica ativa e gastrite crônica inativa. A gastrite é subdividida em duas categorias principais com base na presença ou ausência de atrofia (Figura 5). Na gastrite não
atrófica por H. pylori, a inflamação é predominantemente antral ou quase uniformemente
distribuídas no antro e no corpo, não havendo atrofia significativa. Na gastrite atrófica por H.
pylori, a inflamação é geralmente menos intensa e similar no antro e no corpo. Nessa lesão,
manchas de atrofia com metaplasia intestinal surgem inicialmente na área da incisura angularis e na zona de transição, podendo expandir proximal e distalmente para formar manchas confluentes da mucosa metaplásica atrófica. Na gastrite autoimune, tanto a
!
14
Figura 5: Representação esquemática da distribuição de inflamação e atrofia em diferentes tipos de gastrite crônica atrófica e não atrófica. (1) Distribuição da inflamação nas gastrites não atrófica, atrófica e autoimune (2) Distribuição da atrofia e metaplasia nas gastrites não atrófica, atrófica e autoimune.
Fonte: (Adaptada de DIXON et al., 1996).
!
15
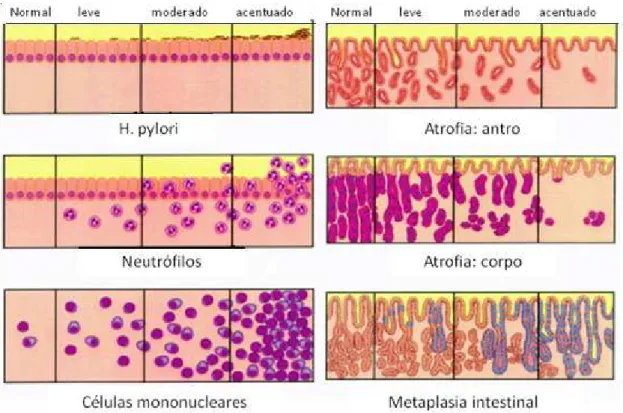
Figura 6: Escala visual analógica de classificação das variáveis morfológicas, com representação esquemática da amplitude de cada característica, classificando-as em normal ou quanto a sua graduação em leve, moderada e acentuada, para as variáveis: H. pylori, atrofia corpo e antro, infiltração de neutrófilos e células mononucleares e presença de metaplasia intestinal.
Fonte: (Adaptada de DIXON et al., 1996).
1.3.2 Gastrite atrófica
A atrofia da mucosa gástrica, definida como perda de tecido glandular, leva ao
afinamento da mucosa que pode ser seguida de erosão ou ulceração da mucosa com
destruição da camada glandular,ou resultar em prolongado processo inflamatório. Esse último
pode se seguir para uma substituição fibrosa ou por um colapso da matriz de apoio (Figura 7) (LAUWERS, SRIVASTAVA, 2007). No câncer gástrico do tipo intestinal encontra-se uma atrofia da mucosa, mesmo na ausência de metaplasia, sugerindo ser a atrofia um melhor
indicador do risco deste tipo de câncer. No entanto,a regressão da atrofia, após o tratamento
para H. pylori, não elimina o risco de câncer por completo (EL-ZIMAITY, 2006). A atrofia da
mucosa do corpo está ligada a perda da secreção ácida, ao desenvolvimento de metaplasia e
!
16
SRIVASTAVA, 2007). Nesse tipo de lesão, tem sido relatada uma positividade da infecção
por H. pylori de 66% e 73% (HAZIRI et al., 2010; HISHIDA et al., 2010).
Figura 7: Gastrite atrófica: A) Aspecto endoscópico da gastrite atrófica B) Microfotografia de gastrite atrófica (H-E 200x).
Fonte: www.endoscopiacurso.com.br/imagens/fotografias) (MULLER et al., 2007).
1.3.3 Metaplasia intestinal
A metaplasia intestinal representa a substituição do epitélio gástrico por epitélio semelhante ao do intestino, sendo essa lesão frequentemente encontrada no trato gastrintestinal, principalmente no estômago e esôfago, geralmente iniciada pela irritação
persistente da mucosa provocada pela infecção por H. pylori, refluxo biliar crônico ou
induzida experimentalmente por irradiação e agentes mutagênicos (Figura 8). Existem vários sistemas de classificação para a metaplasia intestinal (MI), segundo Jass e Filipe pode ser classificada em completa e incompleta. Outra classificação, de acordo com as características morfológicas, bioquímicas e enzimáticas, subdivide a MI nos tipos I, II e III.
A MI do tipo completa ou tipo I (Figura 9-A), é caracterizada pela presença de
!
17
Figura 8: Metaplasia intestinal: A) Aspecto endoscópico da metaplasia intestinal B) Microfotografia de metaplasia intestinal (H-E 200x)
Fonte: www.endoscopiacurso.com.br/imagens/fotografias) (MULLER et al. 2007).
A metaplasia intestinal tipo I está associada a um risco menor de câncer gástrico,
enquanto o tipo III apresenta um risco quatro vezes maior de progredir para essa neoplasia
que aquelas do tipo I (FILIPE et al., 1994; LAUWERS, SRIVASTAVA, 2007). Essa lesão pode aumentar a suscetibilidade a carcinogênese gástrica em até 10 vezes, via sequência: metaplasia – displasia - carcinoma, sendo considerada uma lesão pré-neoplásica (FILIPE et
al., 1994). Tem sido relatada uma positividade da infecção por H. pylori de 72% (HAZIRI et
al., 2010) e 100 % ( LEUNG et al., 2006; MÓDENA et al., 2007) na metaplasia intestinal.
Quadro 3 - Características citológicas encontradas nas metaplasias intestinais.
Metaplasia intestinal completa (tipoI)
Metaplasia intestinal incompleta (tipo II e III)
Células caliciformes Presente Presente
Células absortivas Presente (c/ bordas em escova) Ausência
Células Paneth Presente Poucas ou ausência
Secreção de sialomucinas Sim Sim pequena quantidade
Secreção de sulfomucinas Raramente Sim
Células colunares Presente Presente
!
18
Figura 9: Microfotografias de Metaplasia intestinal: A) Metaplasia intestinal completa B) Atrofia e metaplasia intestinal no corpo (H-E 200x)
Fonte: LAUWERS e SRIVASTAVA, 2007.
1.3.4 Displasia
O desenvolvimento da maioria dos adenocarcinomas ocorre numa sequência bem definida, havendo uma progressão das lesões de gastrite para displasia epitelial gástrica (DEG), que tipicamente precede a carcinogênese. A DEG é uma proliferação epitelial neoplásica caracterizada por variação na arquitetura celular e atipia, é um achado morfológico que pode ser identificado em cortes histológicos de rotina e não necessita de colorações especiais. São exemplos de alterações na arquitetura celular, a distorção e a aglomeração glandular; e de anormalidades celulares, alteração nuclear, alteração da relação núcleo-citoplasmática, hipercromia e número de figuras de mitose. Baseado no padrão arquitetural, a displasia é classificada em: displasia adenomatosa, intestinal ou tipo I, (Figuras 10 A e B), podendo ainda obedecer a uma subclassificação como de baixo grau e alto grau, de acordo
!
19
Figura 10: Microfotografias de Displasia: A) Displasia de baixo grau, do tipo intestinal (limitada complexidade na arquitetura), B) Displasia de baixo grau, do tipo intestinal (núcleos hipercromáticos e pseudo estratificação) (H-E 200x)
Fonte: LAUWERS, SRIVASTAVA, 2007.
A displasia hiperplásica ou tipo II (Figura 11), que é outra variante histológica menos comum de DEG, que está associada mais comumente com o adenocarcinoma pouco diferenciado do tipo intestinal. A displasia também pode se desenvolver na forma de pólipos hiperplásicos gástricos, particularmente aqueles com mais de dois cm de tamanho. Vários estudos têm relatado que alterações displásicas ocorrem em 1,8% a 16,4% dos pólipos hiperplásicos (CARNEIRO et al., 1993; HIZAWA et al., 1995). No quadro quatro encontramos os achados citológicos que classificam as displasias. Na displasia tem sido
!
20
Quadro 4 - Características citológicas encontradas nas displasias gástricas.
Figura 11: Microfotografia de Displasia de baixo grau, do tipo foveolar, formando círculos, núcleo basal, nucléolos inconspícuose estratificação mínima, com citoplasma abundante (H-E 200x)
Fonte: LAUWERS, SRIVASTAVA, 2007.
Tipo de displasia Achados
Displasia baixo grau Presença de desordem arquitetônica mínima, células
displásicas com atipias de leve a moderada e aumento da atividade mitótica.
Displasia alto grau Presença de marcadas anormalidades arquitetônicas como:
(aglomeração glandular, ramificação e brotamento), células displásicas em forma cuboidal, alta relação núcleo-citoplasmática, núcleos arredondados ou ovais, vesiculares com nucléolos proeminentes e distinta perda da polaridade celular, mitoses numerosas e podem ocorrer mitoses atípicas.
Displasia adenomatosa (tipo I) Presença de glândulas tubulares revestidas por células colunares atípicas, com sobreposição, núcleos hipercromáticos, pseudoestratificação e nucléolos inconspícuos.
Displasia hiperplásica (tipo II) Presença de epitélio foveolar não metaplásico ou epitélio tipo glândula pilórica, presença de glândulas de tamanhos e formas varáveis com dilatação cística, invaginações papilares e serrilha.
!
21
Figura 12: Microfotografia de Displasia de alto grau, A) do tipo foveolar, B) do tipo intestinal. Presença de núcleos grandes, com um padrão de cromatina abertas e nucléolos proeminentes. (H-E 200x).
Fonte: LAUWERS, SRIVASTAVA, 2007.
1.3.5 Úlcera péptica - gástrica e duodenal
A infecção por H. pylori é o principal fator ambiental envolvido na etiologia da
úlcera. Essa bactéria é encontrada em cerca de 90% dos pacientes com úlcera duodenal e em
cerca de 70 a 90% daqueles com úlcera gástrica (TYTGAT et al., 1993). H. pylori tem um
importante papel na patogenia da úlcera péptica, fato que contribuiu para modificar o seu
tratamento nas últimas décadas; vários estudos reportam que a erradicação de H. pylori leva a
cicatrização da úlcera sem o risco de recidiva (PENSTON, 1996; LAINE et al., 1998; GISBERT et al., 2000; CHAN et al., 2002; DELANEY et al., 2002; MALFERTHEINER et al., 2007; YEOMANS, 2011).
A úlcera péptica é uma doença heterogênea que afeta cerca de 5-10% da
população infectada por H. pylori (MALFERTHEINER et al., 2007), é um defeito na parede
gastrintestinal que envolve toda a espessura da mucosa e penetra através da parede muscular, é resultante de necrose do tecido, que é originada por isquemia da mucosa, com formação de
radicais livres e a cessação da liberação de nutrientes e diminuição de O2. Todos esses efeitos
!
22
Na maioria dos países, a úlcera duodenal é a forma mais comum de úlcera péptica. Nos Estados Unidos, 8 a 10 % da população sofrem de úlcera duodenal e 1 % de úlcera
gástrica (SZABO et al., 2007). A úlcera péptica ocorre como uma consequência da progressão
da infecção por H. pylori, que leva à gastrite crônica ativa, podendo levar ao aparecimento de
úlceras gástricas ou duodenais (SHIMOYAMA et al., 1997). O status natural de secreção de ácido de uma pessoa parece determinar se ela vai desenvolver úlcera duodenal ou gástrica,
também afetar a distribuição e a severidade da gastrite por H. pylori (EL-OMAR et al., 1995;
EL-ZIMAITY, 2006). As úlceras duodenais são associadas à gastrite predominantemente antral, não-atrófica com hipergastrinemia, hipersecreção de ácido. Pacientes com úlcera duodenal quase nunca desenvolvem a gastrite atrófica do corpo e, consequentemente, mantêm a secreção de ácido robusta. Acredita-se que as úlceras gástricas, inicialmente, estejam associadas com uma gastrite crônica não atrófica, que evolui para gastrite crônica atrófica, que envolve tanto corpo como, invariavelmente, o antro e a diminuição da secreção de ácido (TAN, WONG, 2011). Pacientes com úlcera gástrica com redução no nível de ácido gástrico e pangastrite podem ter um risco 1,8 vezes maior de desenvolver câncer do estômago que indivíduos com úlcera duodenal com níveis elevados de ácido gástrico e gastrite, predominantemente na região antral (HANSSON et al., 1996). Um câncer gástrico pode se apresentar como uma lesão exofítica, com uma infiltração difusa da mucosa gástrica ou mesmo como uma úlcera gástrica, que pode simular uma úlcera gástrica benigna (TODD et al., 2003). Vários fatores ambientais foram relacionados com sua gênese, como o consumo de álcool e cigarro, ácido acetilsalicílico, outros anti-inflamatórios não-esteróidais e corticoesteróides, além de fatores de fundo emocional (SZABO et al., 2007). Na úlcera
péptica tem sido relatada uma positividade da infecção por H. pylori de 68,4% a 100% (ROTA
!
23
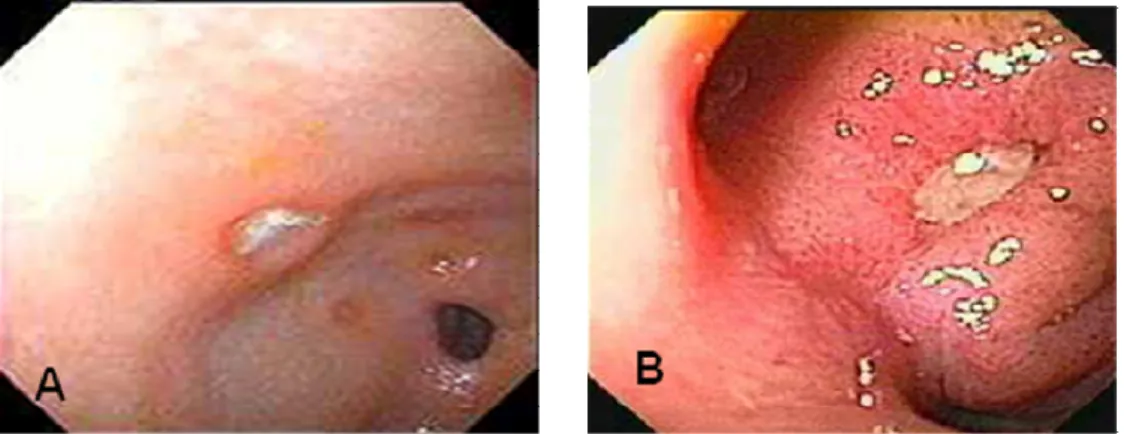
Figura 13: Microfotografia de úlcera gástrica A) Úlcera na região pré-pilorica, B) Úlcera no duodeno.
Fonte: www.endoscopiacurso.com.br/imagens/fotografias).
1.4 Variabilidade genética x virulência da cepa
Desde que H. pylori foi descrita, vários estudos têm sido realizados no sentido de
determinar a patogenicidade deste micro-organismo e sua relação com doenças gástricas, ficando evidente que fatores ambientais e genéticos tanto do hospedeiro como da bactéria, relacionados à virulência da cepa, estejam associados com o aumento da intensidade da inflamação e, consequentemente, o aumento risco de desenvolver lesões de diferentes gravidades (CHEN et al., 2004; HOMAN et al., 2009; HARTGRINK, et al., 2009).
1.5 A Colonização por Helicobacter pylori
A bactéria H. pylori utiliza várias estratégias para colonizar o epitélio gástrico e
algumas dessas estratégias adaptativas contribuem para a progressão da doença. Para o
!
24
Figura 14: Helicobacter pylori a) Micrografia eletrônica b) Representação esquemática mostrando a forma, flagelo polar, urease, canal de uréia e a produção de amônia, a qual neutraliza o ambiente acídico em amarelo, o citosol e o ambiente imediatamente ao redor da bactéria (azul).
Fonte: (Traduzido de MONTECUCCO, RAPPUOLI, 2001).
Para a colonização, a bactéria precisa atravessar a camada de muco que protege o
epitélio gástrico. H. pylori evita a luz do estômago e o ácido, nadando em direção a superfície
celular mucosa, utilizando os seus flagelos polares e os mecanismos de quimiotaxia. Natação e quimiotaxia são importantes para evitar que seja arrastado a microambientes hostis e com
fluxo de muco (AMIEVA, EL-OMAR, 2008). Assim, lipases e proteases sintetizadas por H.
pylori degradam essa camada,facilitando a etapa de colonização (LADEIRA et al., 2003).
Alguns aderem ativamente à superfície de células, usando uma variedade de adesinas específicas (OMP) que reconhecem glicoproteínas na superfície da célula hospedeira. Os fatores de aderência da bactéria contribuem para a sua fixação ao epitélio gástrico, favorecendo também o processo de colonização (PRINZ et al., 2001). As suas características de microaerofilia, produção de urease e motilidade flagelar, fazem da bactéria
H. pylori um micro-organismo bem adaptado para viver na camada de muco do estômago
humano. (PASSARO et al., 2002). Por estar aderida à célula hospedeira a bactéria injeta toxinas que irão modular várias funções da célula hospedeira, e induzirá assim a uma resposta imune do tipo Th1. Vários outros mecanismos de evasão da resposta imune e modulação imune são utilizados por ela, incluindo diversidade da variação alélica das OMP, mimetismo
!
25
reduzir o reconhecimento pelo sistema imune inato do hospedeiro (AMIEVA, EL-OMAR, 2008).
Uma vez que a colonização foi bem sucedida, H. pylori lança mão de vários
fatores de virulência que irão garantir a sua permanência.
1.6 Genes de virulência
O tamanho do genoma de H. pylori varia de 1,6 a 1,73 Mb, a localização variável
de múltiplos genes em mapas genômicos sugere que ocorre um amplo rearranjo do genoma (DUNN et al., 1997). Esta bactéria possui uma notável variabilidade genética entre as cepas, o que pode acarretar respostas distintas do hospedeiro, de maneira que algumas cepas bacterianas podem causar resposta inflamatória mais grave que outras (ZAWILAK, ZAKRZEWSKA-CZERWI SKA, et al., 2001; LADEIRA et al., 2003; PEEK et al., 2005). A
forma e a gravidade, com que as lesões gástricas causadas pela infecção por H. pylori
progridem, dependem dessa diversidade genotípica desta bactéria, cujos produtos desencadeiam o processo inflamatório por meio de mediadores e citocinas (PEEK et al., 2006; LADEIRA et al., 2003).
Dois fatores bacterianos são bem estabelecidos quanto à virulência e à presença
dos genes vacA e cagA (ESLICK et al., 1999). Esses genes são comumente usados como
marcadores da diversidade genética entre as populações (YAMAOKA et al., 2008).Recentes
estudos apontam a importância de outros genes como: cagE, virB11, flaA de H. pylori, em
câncer gástrico(ALVES et al., 2010; LIMA et al., 2010).
1.6.1 Gene vacA
A toxina vacuolizante VacA, que é codificada pelo gene vacA, desempenha um
papel relevante para o sucesso da infecção, pois está relacionada à sua capacidade de
adaptação à mucosa gástrica (PASSARO et al.,2002). Juntamente com a enzima uréase, a
toxina VacA está envolvida no processo de adaptação da acidez gástrica, se comportando
!
26
fator de virulência, visto que contribui para a produção de alcalóides, que podem induzir danos no DNA (Figura 14).
O gene vacA está presente em todas as cepas de H. pylori, entretanto, algumas
cepas produzem quantidades variáveis desta citotoxina (TUMMURU et al., 1993; OGURA et
al., 2000; McNAMARA et al., 2008). O gene vacA compreende duas partes variáveis, “s” e
“m”. A região “s”que codifica o sinal peptídico está localizada no final da cadeia 5’ e possui dois alelos, s1 ou s2, sendo que para o alelo s1 existem três subtipos: s1a, s1b e s1c; a região média (m) possui as variantes m1 ou m2. A combinação em mosaico da região “s”com os alelos da região m resultam em quatro combinações (s1m1, s1m2, s2m2 e s2m1) que determinam a produção de citotoxinas responsáveis pelo grau de virulência da bactéria (Figura 16) (DE FRANCESCO et al., 2009; LIMA, RABENHORST, 2009). As cepas
portadoras do genótipo vacA s1m1 produzem grande quantidade de citotoxina, enquanto as
cepas s1m2 produzem menores quantidades, e s2m2 não tem produção de toxina mensurável.
Estas cepas vacA s1m1 são mais comumente isoladas de pacientes com úlcera péptica, atrofia
gástrica e câncer gástrico (ATHERTON et al., 1995; CESINI et al., 1996).
Figura 15:fatores de virulência e fatores de colonização de Helicobacter pylori. A) Esquema de um bacilo em forma de espiral, único anexados à superfície celular. B) Mostra maior ampliação do local de aderência e entrega de toxinas VacA e CagA à célula hospedeira.
!
27
Figura 16:Representação esquemática da região sinal e do meio do gene vacA de H. pylori e seus subtipos de alelos. b) Esquema da proteína VacA e processamento proteolítica para formação de proteína ativa.
Fonte: Adaptado de Cover; Blanke, 2005
1.6.2 A ilha de patogenicidadecag-PAI
A ilha de patogenicidade cag-PAI é um fragmento do genoma bacteriano com
aproximadamente 40 Kb que codifica cerca de 31 genes, presente em 60% a 90% das cepas mundiais, sendo que alguns desses estão envolvidos nos efeitos lesivos e pró-inflamatórios,
sendo que seis desses genes de cag codificam proteínas que compõem o sistema de secreção
do tipo IV, que é responsável por injetar moléculas efetoras na célula hospedeira, incluindo a expressão de proto-oncogenes (COVACCI et al., 2000; AUDIBERT et al., 2001; AZUMA et
al., 2004; MÓDENA et al., 2007; LIMA, RABENHORST 2009 ). Cepas cag-PAI positivas
!
28
Figura 17: Ilha de patogenicidade contendo genes que mostram marcante variação de sequência.
Fonte:Traduzido de SUERBAUM, JOSENHANS (2007).
1.6.2.1 GenecagA
O primeiro gene cepa-específico, identificado em H. pylori, cagA (citotoxin
associated gene A), está localizado do lado direito da ilha de patogenicidade cag-PAI e
constitui um outro importante fator de virulência de H. pylori. O gene cagA, considerado
marcador de cag-PAI, codifica uma proteína de mesmo nome (CagA), que é uma proteína
altamente imunogênica.
Esta citotoxina é transportada via sistema de secreção do tipo IV para dentro da célula hospedeira (T4SS), que se liga e ativa a integrina 5 1, resultando em ativação local da
quinase de adesão focal (FAK) e, em seguida Src quinase. A quinase ativada fosforila CagA
em resíduos específicos de tirosina, por sua vez ativando Src homologa 2, em domínios locais
contendo tirosina fosfatase 2 (SHP-2) e locais de sinalização, interrompendo assim a sinalização celular e provocando diversas alterações, inclusive no citoesqueleto, resultando no
fenômeno do hummingbird (Beija-flor), que é uma destruição da arquitetura normal da célula
epitelial gástrica, além disso a CagA fosforilada em excesso pode ativar o NF- B e causar outros efeitos na célula hospedeira (Figura 18) (COVACCI, RAPPUOLI, 2003; AZUMA et al., 2004; REYES-LEON et al., 2007, ATHERTON, 2009). Essas alterações estão relacionadas ao surgimento de câncer gástrico.
As cepas cagA positivas tendem a ser mais virulentas e induzem níveis mais altos
!
29
carcinoma gástrico são mais comumente infectados por cepas de cagA positivas. Entretanto,
apesar da associação de cagA com lesões mais graves, certos grupos populacionais da África
do Sul e alguns locais da Ásia possuem alta incidência de infecção por H pylori, cagA(+) sem
associação com lesões mais graves incluindo o câncer gástrico (YAMAOKA et al., 2008).
Figura 18:Fenótipos e variações de CagA, efeitos locais e em toda a célula hospedeira. T4SS, CagA -codificado e sua proteína efetora, cagA.
Fonte: (Adaptado de ATHERTON 2009).
Considerando a ilha cag-PAI, os genes cagE e virB11 são potencialmente
promissores frente a sua localização na ilha de patogenicidade cag e por possuírem função
relevante dentro do sistema de secreção e com alta frequência nas cepas relacionadas com o câncer gástrico (LIMA et al., 2010).
1.6.2.2 Gene cagE
O gene cagE (citotoxin associated ao gene E) é um dos seis genes de cag que está
localizado do lado direito da ilha, é um componente do sistema de secreção do tipo IV, é
também um elemento requerido para a indução de IL-8 (DAY et al., 2000; YAMAZAKI et
al., 2005). O gene cagE induz sinalização pro-inflamatória e proliferativa nas células epiteliais
(DAY et al., 2000). Alguns estudos (MAEDA et al., 1999; IKENOUE et al., 2001;
!
30
pois ele está localizado perto da região promotora do gene cagA. Além disso, o gene cagE é
reorganizado com menos frequência do que o cagA e pode ser usado como um método de
rastreio da estrutura de cag-PAI (YANEZ et al., 2009), confirmando assim a importância
desse gene nos processos patogênicos de H. pylori ( SOZZI et al., 2005; ERZIN et al., 2006).
No Estudo de Módena et al., (2007), foi demonstrada a associação da presença de cagE com
úlcera péptica.
1.6.2.3 Gene virB11
O gene virB11 (ou HP025Cag) está localizado na metade esquerda da cag-PAI,
sendo a virB11 a proteína codificada por esse gene. Esta proteína é um membro da família
das ATPases, associadas com sistemas dedicados à secreção de macromoléculas que é utilizado por patógenos para injetar estas macromoléculas diretamente no interior das células hospedeiras eucarióticas, através do contato direto com as mesmas (KRAUSE et al., 2000; KERSULYTE et al., 2003). Estudos fortalecem a hipótese de que as VirB11 ATPases direcionam a montagem da maquinaria do sistema secreção tipo IV e dirigem a passagem de 23 substratos através do envelope bacteriano por meio de mudanças conformacionais mediadas pela ligação e liberação de ATP (CHRISTIE, CASCALES, 2003; CHRISTIE et al.,
2005).
Figura 19:Esquema do sistema de secreção de secreção do tipo IV, onde se pode visualizar as proteínas cagE e VirB11 compondo este sistema.
!
31
Gene flaA
A motilidade nas bactérias muitas vezes se dá por meio dos flagelos, estruturas complexas extracelulares que exigem grandes quantidades de energia para seu funcionamento. A bactéria se beneficia dos flagelos, utilizando-os apenas quando necessário e regula a sua
atividade de modo a não nadar a esmo. Cepas mutantes flagelares de H. pylori são menos
virulentas do que cepas do tipo selvagem em modelos animais, indicando que os flagelos são cruciais para o processo de infecção desses patógenos. Além disso, as imunoglobulinas
humanas são muitas vezes dirigidas contra proteínas do flagelo do H. pylori (OTTEMANN,
LOWENTHAL 2002). H. pylori possui um tufo de cerca de cinco flagelos embainhados
localizado em um pólo. Cada filamento flagelar é composto de duas flagelinas, FlaA e FlaB. A flagelina, FlaB que está em menor quantidade, localiza-se a base do flagelo, enquanto que a
mais abundante FlaA, encontra-se nas regiões periféricas (KOSTRZYNSKA et al., 1991).
A presença de flagelos é considerada, portanto, outro importante fator de
virulência de H. pylori. Esses flagelos são codificados por vários genes, como flaA e flaB,
sendo o gene flaA o principal fator responsável pela codificação da proteína do filamento
!
32
1.7 Perguntas de partida
o Existe um aumento de frequência de cepas cagA, cagE, virB11, flaA e vacA s1m1
com o aumento da gravidade da lesão ?
o Quais os genótipos das cepas de H. pylori que estão infectando os pacientes com
doenças gástricas como: gastrite crônica atrófica e não atrófica, úlcera, metaplasia e displasia no estado do Ceará.
1.8 Hipótese
A frequência das cepas de H. pylori portadoras dos genes cagA, cagE, virB11, flaA e
vacA s1m1 aumenta de acordo com a gravidade da lesão.
2 Objetivos
2.1 Objetivo Geral
Determinar os subtipos genéticos das cepas de Helicobacter pylori, quanto à presença
de genes de virulência cagA, cagE, virB11, flaA e a variação alélica de vacA, em lesões
gástricas de diferentes gravidades na região estudada.
2.2 Objetivos Específicos
o Detectar a frequência de Helicobacter pylori em material coletado em endoscopia de
pacientes com lesões gástricas: gastrite, úlcera e metaplasias.
o Detectar a frequência dos genes cagA, cagE, virB11, flaA e variação alélica de vacA,
nas amostras de biópsias obtidas através de endoscopia digestiva alta, Helicobacter
pylori positivasagrupando de acordo com a classificação histopatológica.
o Associar os dados relativos à presença dos genes de Helicobacter pylori, acima
mencionados, com os dados epidemiológicos, clínico-histopatológicos nos casos estudados.
o Avaliar a frequência dos genótipos de Helicobacter pylori considerando os genes
estudados em gastrites, úlceras e metaplasias em uma população do Estado do Ceará.
o Comparar a frequência dos genótipos de Helicobacter pylori nas diferentes lesões
!
33
3 Material e Métodos
3.1 Casuística e coleta de dados
Amostras de biópsias gástricas de 201 pacientes submetidos à endoscopia para investigação de doenças gastroduodenais foram obtidas em três hospitais: Hospital Universitário Walter Cantídeo (HUWC), Hospital São José (HSJ) e Hospital Geral de Fortaleza (HGF).
Os pacientes alvos da pesquisa foram pessoas que se dirigiram a um desses hospitais com queixas dispépticas, ou suspeita de doença gástrica e que foram encaminhados ao serviço de endoscopia. Foram excluídos pacientes anteriormente tratados para infecção por H. pylori.
3.2 Aspectos Éticos
O presente estudo faz parte do projeto integrado de pesquisa desenvolvido no Laboratório de Genética Molecular – LABGEM, intitulado: “Polimorfismos de interleucinas e
enzimas do sistema de reparo do câncer gástrico: associação com Helicobacter pylori”, Esta
pesquisa foi aprovada pelo Comitê de Ética em Pesquisa do Hospital Universitário Walter
Cantídio, protocolo nº 047.06.09, e também foi submetida e aprovada pelo comitê de ética
emesquisa do Hospital Geral de Fortaleza, protocolo nº 070714/10. (Anexo I), observando as normas que regulamentam a pesquisa em seres humanos, do Conselho Nacional de Saúde de acordo com as resoluções 196/96, 251/97, 292/99, 303/00, 304/00, 347/05, 346/05.
Os pacientes foram abordados, pelo pesquisador cadastrado junto ao comitê de
!
34
3.3 Coleta de material
Todas as amostras dos pacientes submetidos à endoscopia foram coletadas no setor de endoscopia no momento da realização do exame, em condições ideais de assepsia. Dois fragmentos de biópsia de cada região corpo e antro foram coletados em frasco estéril sem aditivo, os quais foram identificados e rapidamente transportados, em compartimento contendo gelo para o Laboratório de Genética Molecular – LABGEM do Departamento de Patologia e Medicina Legal – DPML, onde foram mantidos em freezer a – 80ºC, até o momento da extração do DNA.
3.4 Avaliação Histopatológica
As biópsias foram realizadas no antro e no corpo gástrico, através de dois
fragmentos obtidos de cada região. O material das lâminas foi corado pelo método da
hematoxilina-eosina (H-E) e as lesões foram classificadas como mucosa normal, gastrite crônica não atrófica (GCNA), gastrite atrófica (GA) e metaplasia intestinal (MI), de acordo com o sistema de Sydney. Os dados histopatológicos foram obtidos através de laudos histopatológicos de pacientes. A metaplasia intestinal foi classificada de acordo com a presença de células absortivas com borda em escova e de células de Paneth.
3.5 Extração do DNA de Espécimes Congelados
A extração de DNA foi realizada no Laboratório de Genética Molecular – LABGEM do Departamento de Patologia e Medicina Legal – DPML. DNA genômico de alto peso molecular foi obtido das amostras de biópsias de tecido gástrico, através da técnica de extração com o uso do detergente CTAB (Cetyl Trimethyl Ammonium Bromide), adaptado do protocolo descrito por Foster e Twell (1996), conforme apresentado a seguir:
o Os fragmentos foram pesados, colocados em volume estabelecido para cada 0,5g de
tecido, usou-se 6 mL de tampão de extração pré-aquecido a 60 °C em banho-maria, ao qual foi adiconado 2-Mercaptoetanol ao tampão CTAB para uma concentração final de 0,2%.
o Após foi homegeneizado amostra/tampão por inversão repetidamente.
o Foi adicionado 1 µL de proteinase K, em cada tubo e incubado em banho-maria por 16
!
35
o Foi adicionado volume igual de clorofórmio: álcool isoamílico (24:1) e centrifugado a
2000-2500 rpm por 15 min a temperatura ambiente (TA).
o A fase superior aquosa foi transferida para um tubo identificado.
o Ao sobrenadante foi adicionado 2/3 volume de isopropanol 100% à fase aquosa,
misturado por inversão, em seguida deixado para precipitar por 16 horas no freezer, a -15°C. Centrifugado a 2000 rpm por 10 min a TA e descartado o sobrenadante por inversão.
o O pellet foi ressuspendido em um mínimo do volume (na proporção de 2 mL p/ cada
0,6 g de tecido) de NaCl 1M e adicionado 2,5 volumes de etanol 100% gelado e misturado por inversão e centrifugado a 2000 rpm por 5 min a TA.
o Em seguida o pellet foi lavado com etanol 70% e centrifugado a 2000 rpm por 5 min a
TA para recuperar o pellet.
o Removido o sobrenadante,o pellet foi colocado para secar a TA e resuspendido em 50
µL de água estéril.
o A qualidade do DNA extraído foi avaliada por eletroforese em gel de agarose a 1%,
corado com brometo de etídio,visualizada em transluminador de luz ultravioleta e a
quantidade do DNA foi determinada utilizando o NanoDrop TM
fluoroespectrofotometro 3300. Seguiu-se a detecção da presença de H. pylori, através
da identificação de fragmentos específicos de seus genes.
o DNA obtido foi armazenado em freezer a -14ºC, devidamente identificados até o
momento do uso.
3.6 Detecção de H. pylori
A presença de H. pylori nas amostras estudadas foi detectada pela técnica PCR
utilizando fragmento do gene ureC que codifica a proteína urease, com os oligonucleotídeos
iniciadores sense 5’ AAG CTT TTA GGG GTG TTA GGG GTT T 3’ e anti-sense 5’ AAG CTT ACT TTC TAA CAC TAA CGC 3’ (LAGE et al., 1995). A mistura para PCR foi
composta Master mix®2x Promega, utilizado conforme as recomendações do fabricante em