Thèse préparée à l'Institut de Recherche sur la Catalyse et l'Environnement de Lyon, Université Claude Bernard Lyon 1. Le chapitre III concerne l'application de la catalyse acide hétérogène dans la réaction de transestérification de l'huile de colza avec l'éthanol.
CHAPITRE I : ETUDE BIBLIOGRAPHIQUE – OBJECTIFS
Contexte politique, économique et environnemental
- Evaluation des réserves fossiles et demande en énergie
- Les émissions de CO dues aux transports 2
- Carburants alternatifs ou biocarburants
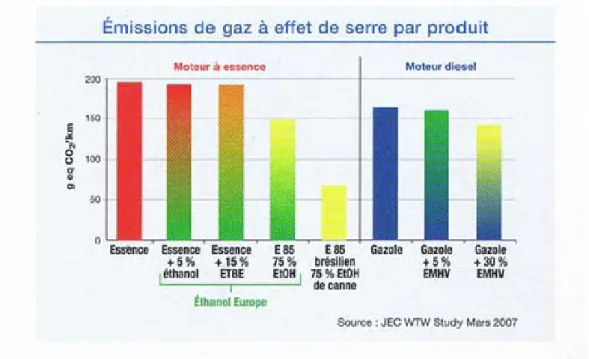
Le remplacement du diesel par du biodiesel de colza entraîne une réduction de la consommation d'énergie fossile d'environ 60 % et 50 %, respectivement. La logique de cette pratique est l’amélioration de la qualité de l’air, qui est essentiellement liée à une forte réduction des émissions de particules.
![Figure 1-2: Consommation de produits pétroliers dans le monde en 2002:3.5 Gtep [2].](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465529.70693/17.892.225.671.581.895/figure-1-consommation-produits-pétroliers-monde-2002-gtep.webp)
Le Biodiesel comme carburant
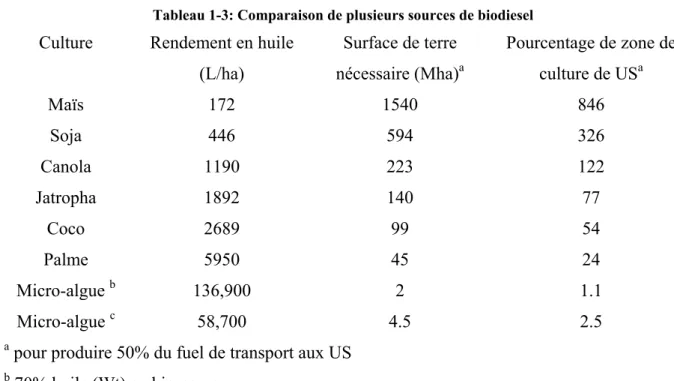
- Les huiles : Différentes sources, Critères de choix, Composition et caractéristiques
- Propriétés physiques comparées des huiles, de leurs esters (biodiesel) et du Gazole
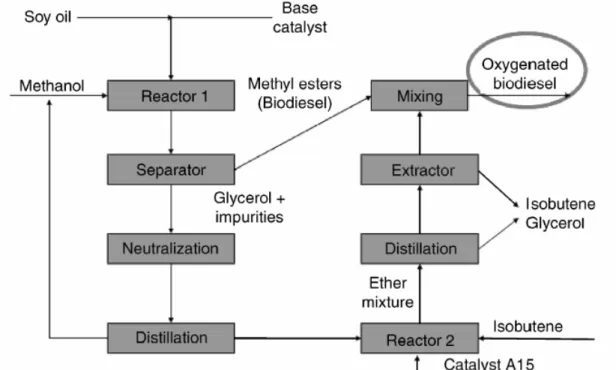
- Comment produire du biodiesel ?
L’indice de saponification est donc une mesure indirecte de la masse molaire PM des acides gras et donc de l’huile. Une autre méthode d'utilisation de l'huile végétale comme carburant est sa dilution [5].
Réaction de transestérification des huiles
- Historique
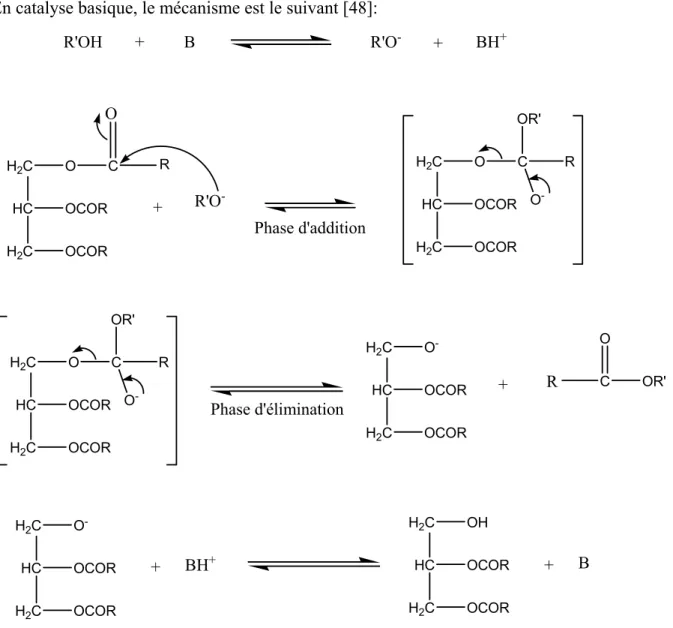
- Mécanisme de la réaction
- Paramètres importants de la réaction de transestérification des huiles
- Cinétique de la réaction de transestérification
- Thermodynamique de la réaction de transestérification
- Procédés industriels de transestérification
- Transestérification par catalyse hétérogène acide et basique
- Transestérification en phase supercritique
La littérature explique que la vitesse de la réaction de transestérification est fortement affectée par la température. Deux ans plus tard (2009), Bokade et al. ont étudié l'influence de plusieurs paramètres de réaction.
Valorisation du sous produit de la réaction de transestérification
- Marché du glycérol
- Ethers de glycérol : additifs aux carburants
- Procédés industriels d’éthérification
En revanche, l'ajout d'éthers de glycérol au biodiesel permet d'abaisser sa viscosité et son « point de trouble ». En effet, la présence du groupe hydroxyle des éthers de glycérol partiellement éthérifiés pourrait permettre d'incorporer de petites quantités d'eau dans les carburants, ce qui réduirait les émissions de NOx. L'éther de glycérol est déjà commercialisé comme additif de carburant oxygéné pour les moteurs à essence.
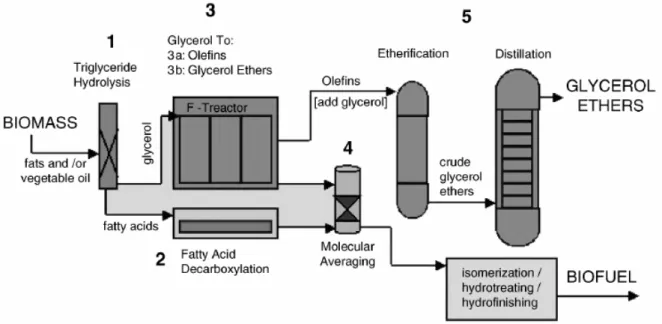
Conclusions – Objectifs de la thèse
Le chromatogramme ci-dessous montre les différents produits de la réaction de transestérification de l'huile de colza avec l'éthanol. Ce chapitre étudie l'utilisation de la catalyse acide hétérogène dans la réaction de transestérification de l'huile de colza avec l'éthanol. Conclusion de la transestérification de l'huile de colza avec l'éthanol en présence de catalyseurs acides hétérogènes.
CHAPITRE II : PARTIE EXPERIMENTALE
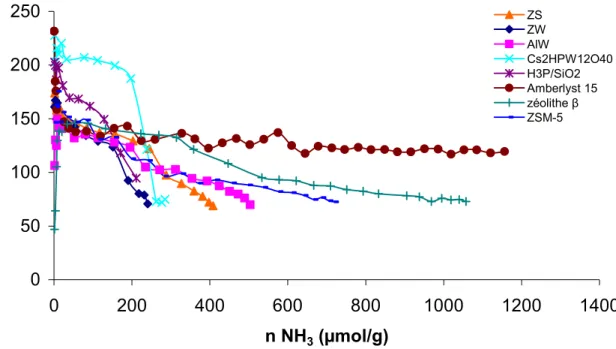
Diffraction des Rayons X (DRX)
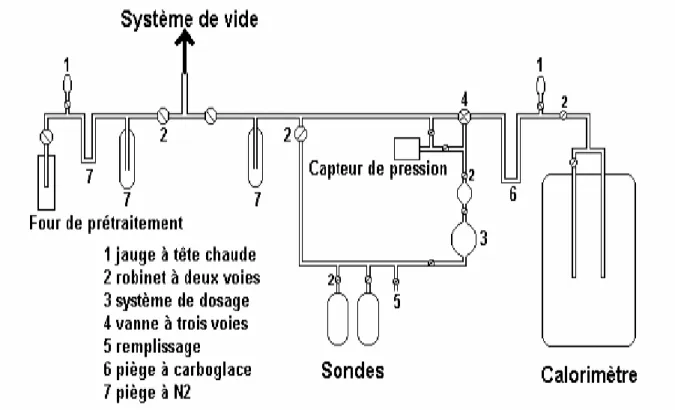
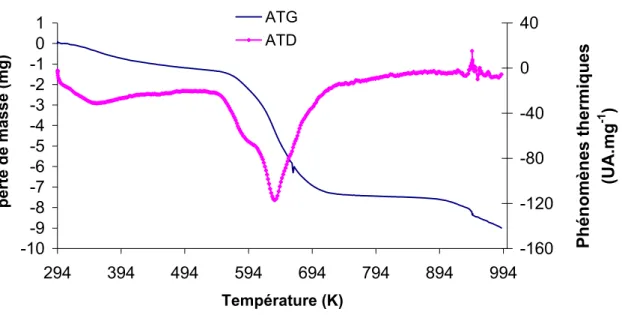
Analyse Thermo-Gravimétrique (ATG), Analyse Thermique-Différentielle (ATD)
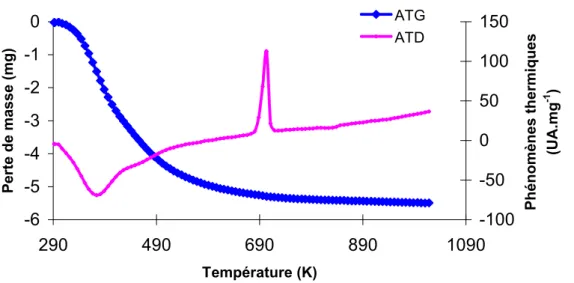
Le diffractomètre utilisé au laboratoire est un instrument Bruker D5005 équipé d'une anode en cuivre Cu KĮ1+Į2 (Ȝ = 1,54184 Å) et d'un monochromateur arrière. Dans ce cas, elle a lieu vers 873 K et s'accompagne d'un phénomène exothermique (cristallisation du WO3).
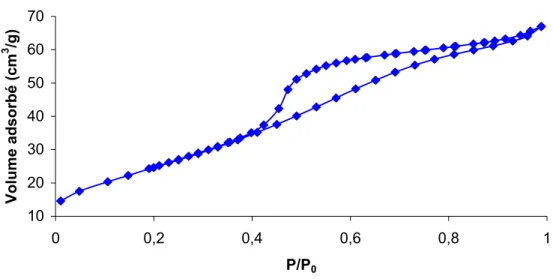
Isothermes d’adsorption d’azote et surface spécifique, BET
Analyse élémentaire
- Mise en solution du tungstène
- Teneur des éléments dans la solution à l’issu d’une réaction de transestérification
- Dosage du Césium
- Teneur en soufre
Pour détecter les éléments dans les solutions, une évaporation a été réalisée sur plaque chauffante, suivie d'une calcination au four à 873 K puis d'une récupération en milieu H2SO4 + HNO3. Le carbone, le soufre et l'azote sont respectivement convertis en dioxyde de carbone, soufre et azote puis quantifiés par des détecteurs infrarouges spécifiques.
XPS
Techniques de caractérisation de l’acidité ou la basicité des catalyseurs
- Adsorption de gaz carbonique ou d’ammoniac suivie par microcalorimétrie
- Adsorption de pyridine suivie par Spectroscopie Infra rouge
La spectroscopie infrarouge à transformée de Fourier (FTIR) des catalyseurs d'adsorption de la pyridine permet d'étudier les modes d'adsorption de la pyridine qui caractérisent la nature des sites catalytiques. L'interaction de la molécule de pyridine avec la surface d'un catalyseur, puis avec les différents vibrateurs, dépend de la nature de ses sites catalytiques. Adsorption de la pyridine à température ambiante, pression de vapeur saturée, -Spectre du culot + pression partielle de la pyridine.
Tests de transestérification
- Ballon en pyrex
- Autoclave
Ces quantités sont respectées de manière à ce que la teneur en étalon soit de 5% en poids (la même teneur lors des étalonnages) et la teneur en huile représente également 5% en poids (ces teneurs simulent une conversion d'huile de 10%). Cet autoclave en acier inoxydable est équipé de quatre pales de mélange mécanique et d'un insert interne en verre. Le protocole expérimental utilisé en flacon est adopté dans cette partie mais les quantités de réactifs et de catalyseur sont multipliées par 1,5 afin d'assurer un remplissage de l'autoclave jusqu'à 2/3 de son volume pour assurer une agitation efficace grâce à une turbine.
Analyses GC
Le temps de rétention est proche de celui des esters éthyliques de l'huile de colza (20 ou 18 C). Les coefficients de réponse relatifs de chaque produit de réaction, ainsi que celui de l'huile, sont calculés selon la méthode de l'étalon interne. On voit que les esters sont bien séparés du standard interne, des intermédiaires réactionnels et de l'huile.
Expressions des résultats
Ces bandes sont similaires à celles observées dans le spectre de la silice imprégnée d'huile. La figure 4-29 compare l'activité initiale de l'oxyde de zirconium ZrO2 à celle de la zircone dopée au Cs. La figure 4-31 montre l'influence du prétraitement du catalyseur MgLaO sur la conversion de la réaction de transestérification de l'huile de colza en éthanol.
ETUDE DE LA REACTION DE TRANSESTERIFICATION DE
Les zéolithes et les résines acides : H-Beta, H-ZSM-5 et Amberlyst 15
C'est un polymère qui ne supporte pas une température > 393 K. Il est fonctionnalisé par des groupements SO3H à raison de 4,7 meq/g. Sa surface spécifique BET est de 53 m2/g avec un diamètre moyen de pores de 300 Å et un volume poreux de 0,4 cm3/g. b) Zéolite - Origine. Sa conversion en forme H+ s'effectue par traitement thermique, illustré sur la figure 3-19, sous air, avec un débit de 6 L/h.
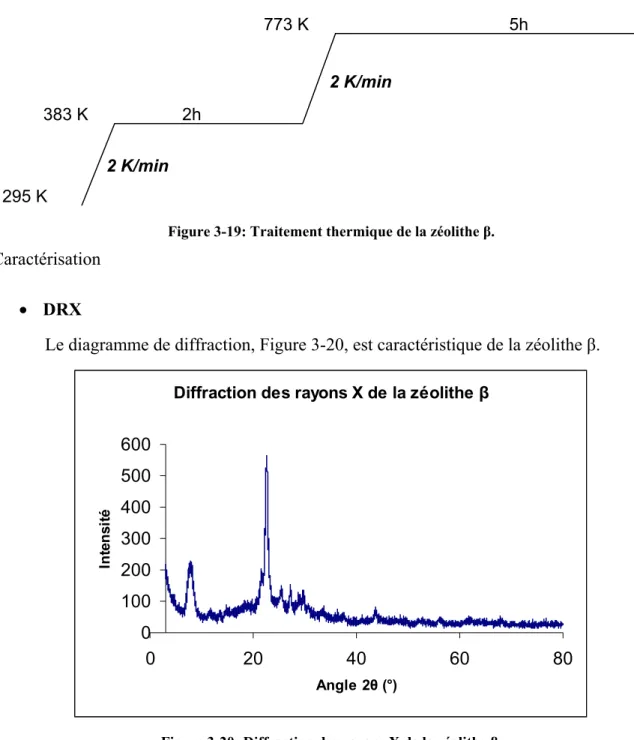
Conclusion de la préparation et caractérisations des catalyseurs acides utilisés
Propriétés acides des catalyseurs
- Adsorption d’ammoniac suivie par microcalorimétrie
- Adsorption de pyridine suivie par spectroscopie Infrarouge
- Conclusion des propriétés acides des catalyseurs
A l'exception de la zéolithe ȕ, les catalyseurs les plus actifs sont ceux possédant un nombre important de sites BrØnsted forts. Cette diminution de réactivité pourrait être due à la désactivation du catalyseur due à un empoisonnement des sites catalytiques ou à une lixiviation de la phase active, raison évidente dans le cas du H3P/SiO2. Les spectres obtenus ont été comparés à ceux de silice imprégnée de différents produits.
Conclusions du chapitre III
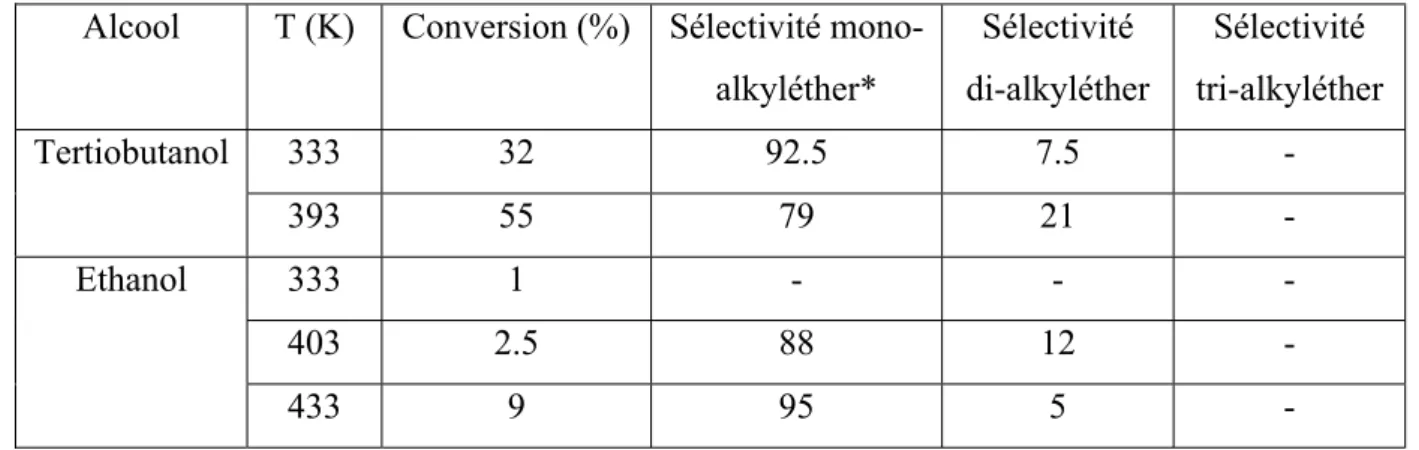
Le tableau ci-dessous résume les résultats de la réaction d'éthérification avec le tertiobutanol et l'éthanol en présence d'Amberlysta A35. Ainsi, dans le cas d'une catalyse basique, l'éthanol est le premier à être activé. La vitesse de la réaction augmente avec la longueur de la chaîne alcoolique.
ETUDE DE LA REACTION DE TRANSESTERIFICATION DE
Hydrotalcites
Le diagramme de diffraction des rayons X, figure 4.2, montre la structure de l'hydrotalcite avant calcination du solide. Le diagramme DRX du HDT-ZnAl non calciné, figure 4-5, montre la structure de l'hydrotalcite. L'analyse élémentaire confirme un rapport Zn/Al de 1,91, proche du rapport théorique souhaité.

Catalyseurs à base d’oxydes d’Al ou de Zr dopés aux Cs
La boehmite dopée au césium est préparée par imprégnation humide naissante de boehmite préalablement calcinée à 823 K. Les diagrammes de diffraction des rayons X de la zircone dopée au césium calcinée à 823 K et 923 K sont présentés ci-dessous, Figure 4-11. Ceci est cohérent avec l’augmentation de la basicité de la zircone dopée au Cs.
Catalyseurs à base de Mg et/ou de La
Nous avons essayé de supporter l'oxyde de lanthane sur du charbon actif au lieu du MgO. Cette préparation est réalisée par coprécipitation à pH constant (9) d'hydroxyde de lanthane en présence de charbon actif en suspension [171]. Le protocole expérimental est identique à celui utilisé pour la préparation du La/C mais la précipitation de l'hydroxyde de lanthane se fait sans présence de carbone.
Conclusion sur la préparation et les caractérisations des catalyseurs basiques utilisés
En revanche, les sites basiques les plus forts de (HDT-ZnAl) présentent une chaleur d'adsorption de CO2 autour de 95 kJ.mol-1.
Boehmite dopée au Césium
Zircone dopée au Césium
Catalyseurs à base de Lanthane et/ou Magnésium
La dispersion de La2O3 sur un support de grande surface, tel que du charbon actif ou du graphite, augmente le nombre de sites basiques de ce catalyseur (respectivement 124 et 66 µmol.g-1). Ce type de catalyseur est prometteur en raison du grand nombre de sites bases homogènes en force. Nous constatons que cet effet de prétraitement augmente la force basique du catalyseur ainsi que le nombre de sites basiques.
Comparaison de la force basique des catalyseurs les plus forts de chaque famille
L'oxyde mixte MgLaO présente un nombre réduit de sites basiques (14 µmol.g-1) mais forts, avec une chaleur initiale d'adsorption du CO2 d'environ 140 kJ/mol. Un traitement à haute température telle que 923 K permettra d'éliminer ces espèces carbonatées et de libérer les sites de base plus forts. De plus, l'hydrotalcite de MgAl, la boehmite dopée au Cs 550 et les ZrC ont les densités de sites centraux les plus élevées de 160, 300 et 262 µmol/g, respectivement.
Conclusion sur les propriétés basiques des catalyseurs
MgLaO, La/C et ZrC ont tous une chaleur d'adsorption de CO2 à 383 K d'environ 130 et 140 kJ/mol et des sites relativement homogènes en termes de force pour La/C et ZrC. L'hydrotalcite à base de magnésium a la résistance basique la plus faible avec une chaleur d'adsorption d'environ 100 kJ/mol. Ce traitement, qui élimine les carbonates les plus stables, permet de mesurer un nombre significativement plus élevé de sites bases plus énergétiques Qdiff = 155 kJ/mol.
Transestérification de l’huile de colza par l’éthanol
- Activités de chaque famille de catalyseurs
- Activités et stabilités comparées des catalyseurs hétérogènes basiques les plus actifs
- Résistance à la lixiviation des solides basiques les plus actifs
On constate que le dopage de la zircone au césium augmente significativement l'activité initiale. Le tableau 4-7 montre que la zircone dopée au césium perd une quantité importante d'alcali au cours de la réaction. On note une forte contribution de la catalyse homogène dans le cas des deux catalyseurs dopés au Cs.

ETUDE COMPARATIVE ENTRE CATALYSE ACIDE ET
Diffusion externe
Concernant l'agitation, nous avons obtenu deux vitesses différentes : 2000 tr/min, qui correspond à la vitesse maximale d'agitation de l'autoclave, et 1000 tr/min. On voit que la conversion des triglycérides passe de 64% avec agitation maximale de l'autoclave (2000 tr/min) à 27% lorsqu'on divise la vitesse d'agitation par 2 (1000 tr/min). Ensuite, nous réglons la vitesse d'agitation à la valeur maximale de 2000 tr/min.
Diffusion interne
L'effet de la diffusion externe a été étudié en faisant varier soit la vitesse d'agitation, soit la masse du catalyseur dans le cas du catalyseur basique ZrCs, beaucoup plus actif que le catalyseur acide. Dans ce dernier cas, on peut conclure que l'on est limité par le transfert de masse utilisant une vitesse d'agitation de 1000 tr/min. On observe alors que la conversion double lorsque l'on double la masse du catalyseur, indiquant que la vitesse spécifique de la réaction est constante.
Cinétique = Etude comparative : catalyse acide hétérogène – catalyse basique hétérogène
- Introduction
- Activités et sélectivités
- Conclusion partielle
- Modélisation des courbes TTi = f(TTG)
- Discussions et interprétation des résultats
La Figure 5-3 et la Figure 5-4 montrent respectivement la conversion des triglycérides en fonction du temps et les différents rendements en fonction de la conversion. La solution de ce système exprime les rendements en diglycérides et monoglycérides en fonction de la conversion en triglycérides. La tendance est différente dans le cas du catalyseur basique pour lequel l'ensemble des valeurs relatives des constantes k'1/k'2/k.
Influence de la nature de l’alcool
Nous concluons donc qu'en catalyse basique, avec les ZrC, la conversion est fortement influencée par la nature de l'alcool. Ainsi, avec Cs2HP, à 338 K et pendant 5 h, la réaction est très lente avec les trois alcools. Cette observation est cohérente avec une étude préliminaire similaire sur H3PW12O40 à 352 K qui établit une réaction plus rapide avec l'éthanol par rapport au méthanol, résultats qui peuvent s'expliquer d'une part.
Résistance à l’eau
Valorisation du glycérol in situ par catalyse acide
- Introduction
- Conclusion de la valorisation du glycérol
Éthérification du glycérol par le tertiobutanol et l'éthanol en présence d'Amberlyst A35 (Rohm et Haas) et d'autres solides fortement acides. Le tableau 5-5 montre l'influence du temps de réaction sur l'éthérification du glycérol par l'éthanol en présence de HPA/charbon. Nous avons donc d'abord étudié l'éthérification du glycérol par l'éthanol et le tertiobutanol par catalyse acide en présence d'Amberlyst A 35 et de différents solides acides.
Conclusion du chapitre V
Dans le cas de la catalyse acide, nous avons remarqué qu'en présence des trois alcools, aucune différence significative de conversion n'était mesurée à 338 K. Nous avons noté une augmentation de la réactivité avec l’augmentation de la longueur de la chaîne alcoolique. Nous avons réussi à éthérifier le glycérol, l'un des produits de la réaction de transestérification, avec de l'éthanol in situ.
![Figure 1-1: courbe théorique de l'épuisement des réserves prévisibles avant le choc pétrolier 1973, [1]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465529.70693/16.892.208.685.716.959/figure-courbe-théorique-épuisement-réserves-prévisibles-choc-pétrolier.webp)
![Figure 1-14: Production des esters éthyliques par éthanolyse de l'huile de ricin par catalyse basique, éthanol/huile/catalyseur 60 :10 :2 à 80°C [55]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465529.70693/49.892.240.657.107.389/figure-production-éthyliques-éthanolyse-catalyse-basique-éthanol-catalyseur.webp)
![Figure 1-15: Production des esters méthyliques par méthanolyse de l'huile de ricin par catalyse basique, méthanol/huile/catalyseur 60 :10 :2 à 60°C [55]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465529.70693/49.892.241.655.459.775/figure-production-méthyliques-méthanolyse-catalyse-basique-méthanol-catalyseur.webp)