43 Figure 1.3 : Représentation schématique de la production électrochimique de radicaux hydroxyles par le procédé Electro-Fenton [115]. 149 Figure 4.16 : Evolution du taux de réduction de la DCO et de l'efficacité apparente du courant lors de la dégradation du diuron par le procédé Electro-Fenton.
SYNTHESE BIBLIOGRAPHIQUE
1 G ENERALITES SUR LES HERBICIDES
1.1 C ONTEXTE DE L ’ UTILISATION DES HERBICIDES
Avec l'augmentation des applications d'herbicides depuis la Seconde Guerre mondiale, les méthodes traditionnelles ont été quelque peu abandonnées au profit d'une méthode chimique moins coûteuse en main d'œuvre et plus rentable. Il existe aujourd'hui plus de 30 000 espèces de mauvaises herbes dans le monde et plus de 200 groupes d'herbicides sont utilisés pour les contrôler [2-4].
1.2 N ATURE DES HERBICIDES
1.3 D EVENIR DES HERBICIDES
La dégradation chimique est une décomposition provoquée par des réactions chimiques, notamment l'hydrolyse (réaction avec l'eau), l'oxydation (réaction avec l'oxygène) et la dissolution (libération d'ammonium et d'autres groupes chimiques de la molécule mère). L'importance de ces réactions chimiques pour la dégradation des herbicides dans les champs n'est pas bien établie [10].
1.3.2 Immobilisation / Adsorption
Les études de photodégradation des herbicides sont généralement réalisées sous irradiation avec des lampes UV. Les conditions du sol qui maximisent la dégradation microbiologique comprennent la chaleur, l’humidité et une teneur élevée en matière organique.
1.3.3 Transfert vers les eaux souterraines
Ces courbes montrent que la cinétique de dégradation de trois herbicides chlorophénylurées (diuron, monuron et fénuron) diminue avec l'augmentation de la concentration du catalyseur Fe3+. Une augmentation du courant d'électrolyse entraîne une augmentation du taux de dégradation et de minéralisation.

1-4 U SAGE ET PROPRIETES DES CHLOROPHENYLUREES
1.4.1 Choix de herbicides phénylurées
1.4.2 Structure chimique
Monolinuron Cl H 3-(4-chlorophényl)-1-méthoxy-1-diméthylurée Linuron Cl Cl 3-(3,4-dichlorophényl)-1-méthoxy-1-diméthylurée Métobromuron Br H 3-(4-bromophényl)-1 -méthoxy-1-diméthylurée. Dans le cadre de ce travail, nous avons sélectionné trois herbicides phénylurées appartenant au groupe des pesticides N-diméthylés et différant selon la nature des substituants du cycle : le diuron (substitué par 2 Cl), le monoron (substitué par 1 Cl) et le fénuron (non substitué par 2 Cl). chlore) ).
1.4.3 Mode d’action des phénylurées
1.4.4 Propriétés physico-chimiques et toxicité des phénylurées
En fait, la vitesse de décomposition (ou de formation) d’un composé dépend de la quantité de photons absorbés par les réactifs. L'effet du débit d'injection de l'échantillon est particulièrement critique pour les premiers pics du chromatogramme.

2 D EPOLLUTION DES EAUX
2.1 P ROCEDES PHYSICO - CHIMIQUES
2.2 P ROCÉDÉS BIOLOGIQUES
Les procédés de traitement biologique sont couramment utilisés pour traiter les eaux usées urbaines. Dans la suite de ce travail, l'accent sera mis principalement sur ces dernières techniques appelées procédés d'oxydation avancés.
3 P ROCÉDÉS D ’ OXYDATION AVANCÉS
Peu de travaux ont été réalisés pour évaluer l'influence de la température sur la réaction de Fenton. 45] qui notent qu'une augmentation de la concentration en H2O2 accélère principalement l'efficacité du procédé.

3.1 R EACTIVITE DES RADICAUX HO
3.2 M ECANISMES REACTIONNELS ET MODE D ’ ACTION DES RADICAUX HYDROXYLES
3.3 C ONSTANTES CINETIQUES DE REACTIONS ENTRE LES HO . ET COMPOSES ORGANIQUES
3.4 D ETERMINATION DES CONSTANTES CINETIQUES
3-6 G ENERATION DES RADICAUX HYDROXYLES PAR LES DIFFERENTS POA
3.6.1 Procédés Fenton
À pH acide (pH < 3 à 4), il est généralement admis que l'étape initiale du mécanisme d'oxydation des composés organiques en milieu aqueux H2O2/Fe2+ est la réaction de Fenton. Des études spectrophotométriques ont montré que la réaction de H2O2 avec Fe3+ conduit essentiellement à la formation du complexe hydroperoxy Fe(III) de formule suivante : FeIII(HO2)2+.
![Tableau 1.7 : Mécanismes de décomposition de H 2 O 2 par Fe 3+ [54]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/39.892.158.663.557.874/tableau-mécanismes-de-décomposition-de-h-par-fe.webp)
3.6.2 Procédés photochimiques
Plusieurs auteurs ont étudié la dégradation des composés organiques par un procédé photo-Fenton modifié (en présence d'un ligand fer). 78] ont montré que l'oxalate inhibe la dégradation du phénol par le procédé photo-Fenton.
![Tableau 1.8 : Rendement quantique de production des radicaux hydroxyles par irradiation UV/visible de solution de Fe(III) [75-76]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/43.892.126.707.444.683/tableau-rendement-quantique-production-radicaux-hydroxyles-irradiation-solution.webp)
3.6.3 Irradiation avec les ultrasons
Le procédé O3/UV est un procédé d'oxydation avancé largement utilisé dans le traitement de l'eau potable pour éliminer les polluants organiques toxiques et réfractaires [91]. Par conséquent, la photolyse de l’ozone n’a pas les mêmes limites que la photolyse du peroxyde d’hydrogène lors de l’utilisation d’une lampe UV au mercure basse pression.
3.6.4 Méthodes électrochimiques
L'évolution de la concentration en fonction du temps d'électrolyse de trois herbicides chlorophénylurées lors du traitement par le procédé Electro-Fenton est représentée sur la figure 4.4. La figure 4.15 présente les résultats des analyses des ions chlorure et nitrate produits lors de la dégradation de ces herbicides par le procédé Electro-Fenton.
![Figure 1.3 : Représentation schématique de la production électrochimique des radicaux hydroxyles par le procédé Electro-Fenton [115]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/51.892.182.720.278.673/représentation-schématique-production-électrochimique-radicaux-hydroxyles-procédé-electro.webp)
4 D EGRADATION DES CHLOROPHENYLUREES
4.1 D EGRADATION PHOTOCHIMIQUE
4.1.1 Photolyse des chlorophénylurées en milieu aqueux
La régiosélectivité de la réaction est influencée par la nature des substituants situés en position N-terminale. La formation de ces isomères serait le résultat de la rupture homolytique de la liaison N-CO, suivie de la recombinaison des radicaux ainsi formés.
![Figure 1.4 : Schéma du mécanisme de déméthylation directe par photolyse en milieu aqueux [117]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/53.892.155.724.142.348/figure-schéma-mécanisme-déméthylation-directe-photolyse-milieu-aqueux.webp)
4.1.2 Dégradation photoinduite par le Fe(III)
La même étude pour le fénuron et la figure 4.3 présentent le suivi HPLC de la dégradation pendant le traitement avec le procédé Electro-Fenton. La diminution du taux de dégradation avec l’augmentation de la concentration en Fe3+ est associée à une réaction parasite consommatrice de radicaux hydroxyles.
![Figure 1.8 : Schéma du mécanisme réactionnel de la dégradation chimique du diuron [125]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/56.892.118.781.137.294/figure-schéma-mécanisme-réactionnel-dégradation-chimique-diuron-125.webp)
4.2 D EGRADATION PAR VOIE CHIMIQUE
4.2.1 Dégradation catalytique en milieu acide tamponné
La réaction démarre par la formation de zwitterion (1) par catalyse acide-base, qui provoque ensuite la formation de dérivé phénylisocyanate (2) et de diméthylamine par réaction non catalytique. À faible concentration de catalyseur (pH de 3 à 11 et faible concentration de tampon), la transformation de (1) en (2) est une étape limitante, tandis qu'à forte concentration de catalyseur, la formation de (1) devient une étape limitante. étape. .
L'évolution de la DCO des solutions aqueuses de trois herbicides étudiées lors du traitement par le procédé photo-Fenton est représentée sur la Figure 3.12. La disparition de l'herbicide d'origine après l'effet oxydant des radicaux hydroxyles et accompagnée de la formation d'intermédiaires aromatiques.
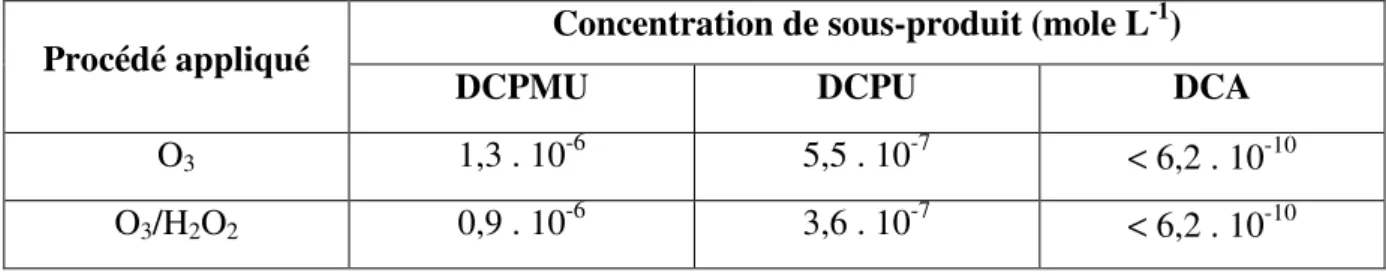
4.3 D EGRADATION PHOTOCATALYTIQUE
4.4 : P ROCEDE P HOTO -F ENTON
Cependant, plusieurs produits de dégradation ont été identifiés par chromatographie liquide (HPLC) couplée à la spectrométrie de masse. Les taux de conversion de cet herbicide à 2 et 5 minutes sont regroupés dans le tableau suivant.
![Figure 1.11 : Schéma du mécanisme réactionnel de dégradation de diuron par photo- photo-Fenton [136]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/64.892.155.702.128.871/figure-schéma-mécanisme-réactionnel-dégradation-diuron-photo-fenton.webp)
L'actinométrie chimique présente l'avantage de permettre une irradiation dans les mêmes conditions que l'actinomètre et la solution étudiée. La cinétique de dégradation des trois herbicides du mélange se caractérise par une diminution régulière et rapide de la concentration en fonction du temps d'électrolyse (Figure 4.6).

5 CONCLUSIONS
Ce procédé, appelé Electro-Fenton, n'a jamais été appliqué auparavant pour étudier la dégradation des herbicides à base de chlorophénylurée. Cette technique a été appliquée pour la première fois à la dégradation des herbicides chlorophénylurées dans cette thèse.
PROTOCOLES EXPERIMENTALES ET METHODES ANALYTIQUES
1 REACTEURS PHOTOCHIMIQUE ET ELECTROCHIMIQUE
D’un autre côté, l’augmentation de la concentration du catalyseur (dans le cas des ions fer ferriques) réduit la cinétique de dégradation car les ions Fe2+ en excès piègent les radicaux hydroxyles.
![Figure 2.2 : Zones d’émission de quelques sources lumineuses [141].](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/73.892.194.708.659.1044/figure-2-2-zones-émission-sources-lumineuses-141.webp)
1.1 R EACTEUR PHOTOCHIMIQUE
1.2 L ES SOURCES LUMINEUSES
La production de lumière est liée au phénomène de luminescence des atomes ou molécules excités : les transitions électroniques des états excités aux états fondamentaux peuvent s'accompagner de l'émission de rayonnement lumineux. Par conséquent, les fréquences d’émission de la source doivent correspondre le plus précisément possible aux fréquences d’absorption du matériau de départ.
1.2.1 Les lampes à vapeur de mercure
1.3 D ETERMINATION D ’ UN FLUX PHOTONIQUE INCIDENT
1.3.1 Actinométrie chimique
L'actinométrie chimique permet d'obtenir le flux de photons incidents d'une source lumineuse à une certaine longueur d'onde et température. Une liste d'actinomètres compilée par Braun et al.[141] est répertorié dans le tableau 2.2 pour différentes plages de longueurs d’onde.
1.3.2 Principes de l’actinométrie au ferrioxalate
1.3.3 Mesures de rendements quantiques par actinométrie chimique
La figure suivante montre l'évolution chimique de la solution de diuron lors du traitement par le procédé Electro-Fenton suivi d'HPLC. Les résultats de l'étude de minéralisation des herbicides montrent séparément que la DCO diminue régulièrement avec la cinétique de dégradation et que les taux de minéralisation dépassent 90 % avec une durée de traitement de 3 heures.

1.4 C ARACTERISTIQUES DU REACTEUR PHOTOCHIMIQUE UTILISE
1.4.1 Lampe UV utilisée
La lampe UV utilisée pour les expériences réalisées avec les solutions synthétiques est une lampe au mercure basse pression (HERAEUS – Noblelight NNQ 40/20) d'une puissance électrique nominale de 40 W et d'une puissance UV nominale de 12 W (données fournisseur). La puissance UV réelle de la lampe ou la puissance de rayonnement Pe a été vérifiée par actinométrie chimique (voir § II-I.4.3).
1.4.2 Photolyse de l’actinomètre
1.4.3 Calcul du flux photonique incident
45] ont observé l'influence de la concentration des réactifs sur la cinétique de dégradation dans le cas de certains colorants : une augmentation de la concentration en Fe2+ accélère principalement la cinétique.
1.5 R EACTEUR D ’ OXYDATION PAR P ROCEDE E LECTROCHIMIQUE
1.5.1 Description
L'électrode au calomel saturé (SCE) est utilisée comme électrode de référence (RE) pour l'électrolyse à potentiel contrôlé. Au cours de l'électrolyse à potentiel contrôlé, le potentiel de l'électrode de travail a été réglé à (-0,5 V/ECS, soit -0,255 V/ENH), ce qui a permis une réduction simultanée de l'oxygène et des ions Fe3+ en ions H2O2 et Fe2+, respectivement.
1.5.2 Détermination du rendement faradique apparent
ER : électrode de référence, ET : électrode de travail, CE : contre-électrode et ECS : électrode au calomel saturé.
2 METHODES ANALYTIQUES
La figure 3.13 montre la réduction de la DCO pour les trois herbicides pour une concentration de 0,5 mM d'ions Fe3+. L'augmentation du courant d'électrolyse entraîne une augmentation du taux de dégradation, en revanche l'augmentation de la concentration en catalyseur altère la cinétique de dégradation.

2.1 C HROMATOGRAPHIE LIQUIDE A HAUTE PERFORMANCE
2.1.1 Principe d’analyse chromatographique
La chromatographie quantitative est basée sur la comparaison de la hauteur de l'air ou du pic de l'analyse avec celle d'un ou plusieurs étalons. Les paramètres qui doivent être soigneusement contrôlés sont la température de la colonne, le débit d’éluant et l’injection de l’échantillon.
2.1.2 Analyse des herbicides et de leurs sous produits de dégradation
Les figures suivantes montrent les résultats des taux de réduction de la DCO en fonction du temps de photolyse au cours du processus photo-Fenton.
2.2 A NALYSE PAR SPECTROMETRIE DE MASSE
2.2.1 Structure d’un Spectromètre de masse
Lorsque l'échantillon est introduit directement à l'aide d'une sonde, l'ionisation se produit simultanément à la désorption du composé. La combinaison de plusieurs analyseurs en série (de même nature ou non) permet de réaliser ensemble de la spectrométrie de masse. d) détection des ions et traitement du signal.
2.2.2 Mode d’introduction et d’ionisation
Il existe plusieurs voies d'ionisation : la plus ancienne est l'impact électronique (EI) et l'ionisation chimique (CI) classiquement appliquées lorsqu'elles sont couplées à la chromatographie en phase gazeuse. Lorsqu'elle est couplée à la chromatographie liquide, l'ionisation peut se produire avant, simultanément ou après la nébulisation en fonction de l'interface utilisée (c'est-à-dire ionisation à pression atmosphérique, électrospray, thermospray).
2.3 D OSAGE DES IONS CHLORURE
L'ionisation des composés est privilégiée dans cette technique car la fréquence de collision est élevée à pression atmosphérique. L'APCI est une technique qui utilise des réactions ions-molécules en phase gazeuse à pression atmosphérique et conduit à la formation principalement d'ions.
2.3.1 Principe
En général, la phase mobile vaporisée agit comme un gaz d'ionisation et les électrons sont obtenus au moyen de décharges corona ou d'émetteurs de particules β.
2.3.2 : Courbe d’étalonnage
2.4 : D OSAGE DES IONS NITRATE
2.4.1 Principe du dosage
2.4.2 : Courbe d’étalonnage
Nous avons également donné dans ce tableau les valeurs des constantes de vitesse absolues (kabs) de la réaction de ces herbicides avec les radicaux HO.

2.5 : M ESURE DE LA D EMANDE C HIMIQUE EN O XYGENE (DCO)
2.5.1 Principe du dosage
L'excès de dichromate n'ayant pas réagi en fin de réaction est titré avec une solution de Fe(II) (solution saline de Mohr, Fe(NH4)2(SO4)2). La DCO est obtenue en faisant la différence entre la quantité initiale de dichromate et l'excès non consommé par l'oxydation chimique.
2.5.2 Expression des résultats
Dans cette partie de nos recherches expérimentales, nous avons d'abord étudié l'oxydation des chlorophénylurées par le procédé FENTON (système Fe2+/H2O2) dans le but de Deuxièmement, nous avons étudié l'oxydation par des processus photochimiques impliquant les systèmes : UV uniquement, UV/H2O2, UV/Fe3+ et UV/H2O2/Fe3+ comme cible.
1 OXYDATION DES CHLOROPHENYLUREES PAR REACTION DE FENTON
Les concentrations finales d'herbicides mesurées par HPLC indiquent les valeurs limites de détection (10-6 M). Ce résultat peut s'expliquer par la diminution de la réactivité du cycle vis-à-vis d'une attaque radicalaire électrophile sur HO.
1.1 I NFLUENCE DE QUELQUES PARAMETRES SUR LE RENDEMENT DE MINERALISATION
1.1.1 Température
1.1.2 pH du milieu
La diminution de l'efficacité à un pH plus élevé est généralement attribuée à la précipitation du fer ferrique.
Le taux de réduction (ou efficacité de minéralisation) a été déterminé pour différents temps de réaction du ratio. De ce tableau il ressort qu'une augmentation des dosages de réactifs génère une augmentation du taux de réduction de la DCO.
1.2 I NFLUENCE DU RAPPORT R
Des mesures de DCO lors du traitement de solutions herbicides par différents procédés ont donc été réalisées (Tableaux 3.5 à 3.7). Le mécanisme de minéralisation des herbicides chlorophénylurées est initié par l'attaque de radicaux hydroxyles dans la molécule de départ en deux sites : le groupe N-terminal et le cycle aromatique, qui génère plusieurs sous-produits.
![Figure 3.2 : Evolution de taux d’abattement de DCO de solutions aqueuses d’herbicides par procédé Fenton à R=10 avec [H 2 O 2 ] = 5 mM et [Fe 2+ ] = 0,5 mM](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/101.892.190.679.316.681/figure-evolution-abattement-solutions-aqueuses-herbicides-procédé-fenton.webp)
1.3 C OMPARAISON DE L ’ EFFICACITE DU SYSTEME SUR LES TROIS HERBICIDES
2 DEGRADATION PHOTOCHIMIQUE DES CHLOROPHENYLUREES
127] ont montré lors de la dégradation des herbicides chlorophénylurées par ozonation que cette voie de dégradation conduit à un remplacement du chlore présent par le monuron ou du parachlore du groupe urée dans le cas du diuron. Les analyses DCO sont réalisées lors de l'électrolyse des trois herbicides chlorophénylurées (diuron, monuron et fénuron) ainsi que du mélange de ces trois herbicides.
![Figure 3.3 : Suivie Chromatographique des échantillons de dégradation d’une solution aqueuse de diuron (C 0 = 0,17 mM) par procédé photo-Fenton (système Fe 3+ /H 2 O 2 /UV, [Fe 3+ ]= 0,1 mM, [H 2 O 2 ]= 1 mM) et V= 450 mL, a: 0 min, b:](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/103.892.221.698.122.750/figure-suivie-chromatographique-échantillons-dégradation-solution-procédé-système.webp)
2.1 E TUDE DE LA CINETIQUE DE DEGRADATION
2.1.1 Dégradation de diuron
L'utilisation du système UV/H2O2/Fe3+ (procédé photo-Fenton) permet d'augmenter significativement l'efficacité de dégradation. Le système photo-Fenton qui produit catalytiquement des ions ferreux permet d'obtenir une vitesse de dégradation très rapide.
2.1.2 Dégradation de monuron et fénuron
Les courbes cinétiques de dégradation photochimique (figures 3.7 et 3.8) montrent que les durées de traitement par UV seuls et par UV/H2O2 sont respectivement de 60 min et 20 min pour le monoron et de 45 min et 20 min pour le fénuron. Les courbes cinétiques de dégradation indiquent également que le procédé photo-Fenton conduit à une nette réduction du temps d'irradiation pour une dégradation complète.

2.1.3 Dégradation d’un mélange des herbicides : diuron + monuron + fénuron
Ces valeurs de constante de vitesse sont très élevées et proches du taux limite de diffusion, ce qui explique la dégradation rapide de ces herbicides en présence de radicaux hydroxyles. La 3,4-dichloroaniline (composé 12), proposée comme principal produit de dégradation chimique du diuron, a été détectée.
![Figure 3.9 : Suivie chromatographique de la cinétique de dégradation d’une solution de mélange de trois herbicides par procédé Photo-Fenton, [diuron] 0 : 0,17 mM, [monuron] 0 : 0,25 mM, [fénuron] 0 : 0,20 mM, [H 2 O 2 ]= 1 mM, [Fe 3+ ]= 0,1 mM et V= 45](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/109.892.201.665.129.842/chromatographique-cinétique-dégradation-solution-mélange-herbicides-procédé-fénuron.webp)
2.2 DETERMINATION DES CONSTANTES APPARENTES ET ABSOLUES DE LA REACTION AVEC LES
2.3 D ETERMINATION DES RENDEMENTS QUANTIQUES
2.4 E TUDE DE LA MINERALISATION
2.4.1 Minéralisation par Fe 3+ /UV
Ce résultat tient compte du fait que le fer absorbe fortement dans cette bande d'émission de la lampe utilisée par notre réacteur. Cependant, ces résultats sont cohérents avec le flux de photons entrant dans le réacteur, qui dans notre cas est très faible car la puissance radiante de la lampe est également faible (5W).
Au niveau cinétique, la vitesse d'oxydation des composés organiques par les radicaux hydroxyles dépend de leur concentration dans le milieu réactionnel. La concentration en radicaux hydroxyles dépend du taux instantané de production et de consommation de ceux-ci.

3 CONCLUSION
La comparaison des courbes présentées à la figure 3.17 montre également que le procédé Fe3+/H2O2/UV est plus efficace que le procédé Fe2+/H2O2 en termes de rendement de minéralisation. Ces résultats peuvent s’expliquer par une cinétique de formation de radicaux hydroxyles plus rapide dans le procédé Fe3+/H2O2/UV que dans le procédé Fe2+/H2O2.
DEGRADATION DES CHLOROPHENYLUREES PAR PROCEDE
1 E TUDE CINETIQUE
1.1 S UIVI DE LA DEGRADATION PAR CLHP
1.2 D ETERMINATION DES CONSTANTES DE VITESSE ABSOLUES ET APPARENTES
1.3 I NFLUENCE DES CONDITIONS EXPERIMENTALES
1.3.1 Influence de l’intensité du courant appliqué
On observe que la cinétique de dégradation s'accélère en augmentant l'intensité du courant appliqué entre l'électrode de travail (feutre de carbone) et la contre-électrode. Cette augmentation est due à l'augmentation de la vitesse de production de H2O2 et à l'accélération du cycle catalytique Fe3+/Fe2+, ce qui conduit à une amélioration de la vitesse de formation des radicaux hydroxyles et par conséquent de la vitesse de dégradation des chlorophénylurées.
1.3.2 Effet de la concentration du catalyseur
2 I DENTIFICATION DES SOUS - PRODUITS
Ce type de produits a été identifié par plusieurs auteurs dans le cadre de la dégradation du diuron et du monuron par différents procédés d'oxydation : photoinduction par Fe(III) [124], ozonation [127], photocatalyse hétérogène [131] et photo-Fenton [ 136 ]. Le mécanisme de minéralisation est initié par l'attaque des radicaux hydroxyles de la molécule de départ à deux endroits : le groupe N-terminal et le cycle aromatique qui génère divers sous-produits.
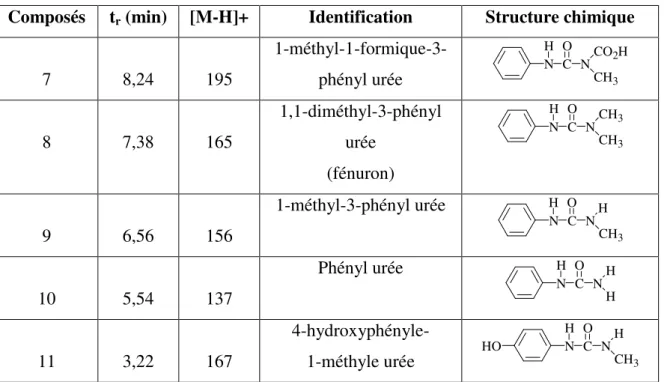
2.1 A TTAQUE DE LA FONCTION N- DISUBSTITUEE
2.2 H YDROXYLATION DU CYCLE AROMATIQUE
127], qui ont montré que l'hydroxylation en position ortho est préférée par rapport à la fonction urée. Ce résultat est en accord avec le caractère électroattractif du chlore et la fonction donneuse d'électrons de l'urée, qui induisent ensemble une charge partielle négative plus élevée sur les sites ortho de l'urée et donc leur plus grande réactivité face aux attaques des radicaux hydroxyles électrophiles.
2.3 S UBSTITUTION D ’ UN ATOME DE CHLORE
113-115] ont démontré la formation d'acides carboxyliques lors de la dégradation de diverses molécules organiques par des processus d'oxydation électrochimique. Les ions chlorure et nitrate ont été quantifiés : l'évolution de la concentration de ces ions au cours du traitement montre que les ions chlorure se minéralisent plus facilement que les ions nitrate.

3 E TUDE DE LA MINERALISATION
3.1 S UIVI DE LA MINERALISATION PAR MESURE DE LA DCO
3-2 E VOLUTION DES ACIDES CARBOXYLIQUES GENERES
3.3 C INETIQUE DE FORMATION DES IONS CHLORURE ET NITRATE
3.4 E FFICACITE DU COURANT APPARENT
4 M ECANISME DE DEGRADATION
5 C OMPARAISON DE PERFORMANCES DES PROCEDES CHIMIQUE , PHOTOCHIMIQUE ET
6 C ONCLUSION
Influence of some groundwater and surface water components on the degradation of 4-chlorophenol by the Fenton reaction. The role of oxygen and reaction intermediates in the degradation of 4-chlorophenol on immobilized TiO2 particle films.
![Figure 1.1 : Désignation des technologies de traitement des eaux usées selon leurs teneurs en DCO [27]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/37.892.259.703.103.364/figure-désignation-technologies-traitement-eaux-usées-teneurs-dco.webp)
![Figure 1.2 : Schéma des réactions chimiques lors la réaction de Photo-Fenton [77]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/44.892.119.742.547.847/figure-schéma-réactions-chimiques-lors-réaction-photo-fenton.webp)
![Figure 1.6 : Schéma de réaction de déhalogénation/réduction du monuron en solution méthanolique et en absence d’hydrogène [120]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465483.70670/54.892.127.713.245.492/figure-schéma-réaction-déhalogénation-réduction-solution-méthanolique-hydrogène.webp)

