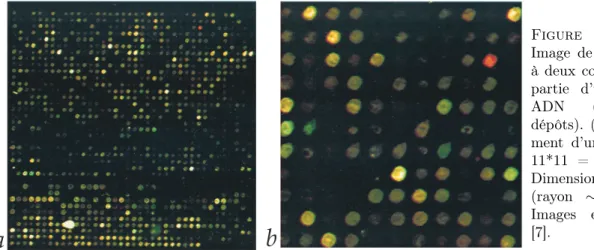
Actuellement, la détection d’hybridation sur puce nécessite un marquage préalable des molécules d’ADN à l’aide de fluorophores. Enfin, le dernier chapitre retrace le chemin parcouru pour parvenir à la détection électronique d'hybridation sur les réseaux de transistors.
L’analyse du génome
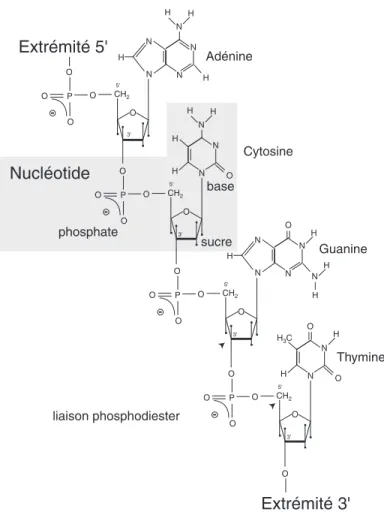
- Les acides nucléiques
- Appariement entre bases : hybridation
- Gènes, transcription et traduction de l’information génétique
- Séquençage et Projet Génome
Cette information (représentée sur le chromosome par une séquence linéaire de gènes séparés par des régions intergéniques) est utilisée lors de l'expression génétique, c'est-à-dire pour la synthèse des protéines. Les ARN qui codent pour la synthèse des protéines sont appelés ARN messagers ; d'autres ARN (de transfert et ribosomiques) interviennent également lors de l'étape de traduction de l'ARN messager en protéine.
Puces à ADN
- Principe des puces à ADN
- Technologies mises en jeu
- Fabrication des puces à ADN
- Détection standard de l’hybridation sur puces à ADN : la fluorescence
Actuellement, la détection de l’hybridation sur puces à ADN est le plus souvent réalisée par fluorescence16. L'utilisation d'isotopes radioactifs (125I, 32Pou33P) comme marqueurs permet une détection sensible et quantitative de l'hybridation sur la membrane voire directement sur la surface de la caméra CCD [38].

Techniques alternatives pour la détection de l’hybridation et application aux puces
Techniques "optiques" et "opto-électroniques"
Les valeurs de densité surfacique spécifiées correspondent à une détection dans les dépôts de l'ordre de (100 µm)2, la sensibilité par capteur (dépôt) est donc de l'ordre de 10−2 pour 1 atomol. Après couplage à l'argent, cette détection optique est environ cent fois plus sensible que la détection fluorescente sur le même système biologique.
Techniques "mécaniques" et "électro-mécaniques"
En revanche, les marqueurs utilisés présentent une bonne stabilité, contrairement aux fluorophores qui peuvent être « endommagés » par la lumière. En revanche, les surfaces n'étant pas planes, les techniques de microdépôt utilisées pour réaliser les chips ne sont pas directement applicables.
Techniques "électrochimiques"
Détection de biomolécules sur des structures semiconductrices et application à la
L'article de Fritz et al [66], publié en octobre 2002, décrit la détection électronique différentielle (à l'aide de 2 capteurs) et l'hybridation en temps réel entre oligonucléotides (12 bases). La détection de l'interaction biotine/streptavidine a également été démontrée à l'aide de nanotubes fonctionnalisés [69].
Structures des transistors à effet de champ
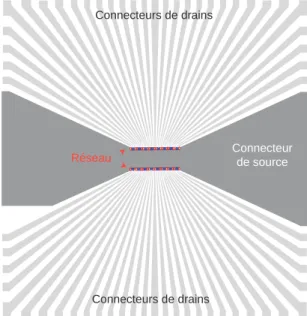
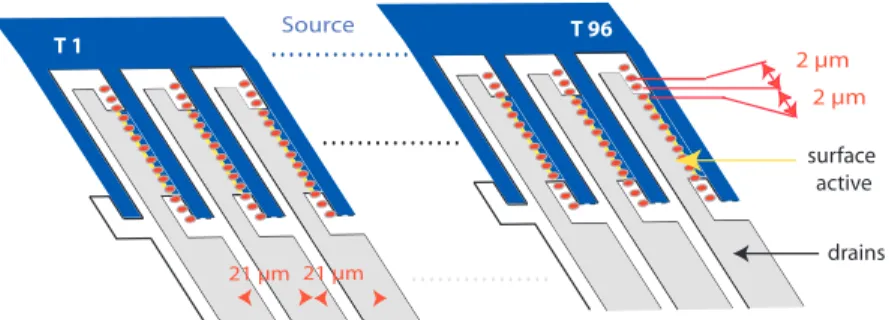
Réseau de 96 transistors
Le premier réseau comporte 96 transistors espacés linéairement de 21 µm, ce qui donne une longueur totale d'environ 2 mm pour l'ensemble du réseau. Les connexions de drain ainsi que celles de la source commune (deux connexions pour la source) sont réalisées directement dans le substrat de silicium par implantation de bore p+.
Réseau de 62 transistors
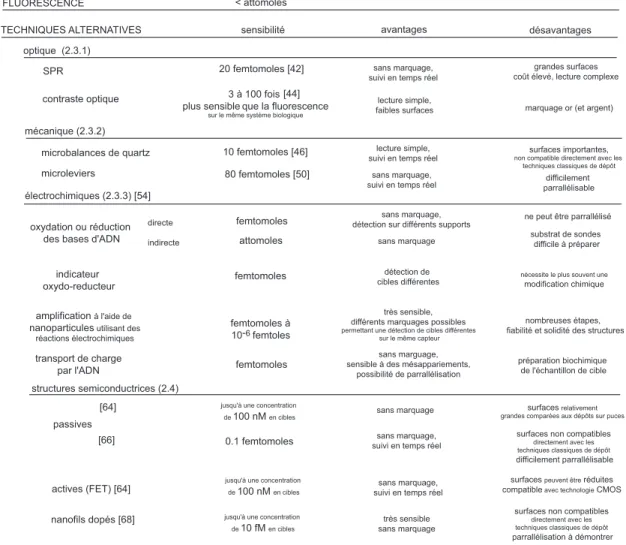
Principe de la mesure électronique
Dispositif électronique de mesure
Le circuit analogique possède un différenciateur qui permet de comparer les potentiels du drain et de la source avec ceux de l'électrode (on impose respectivement la tension U˜SE sur la source et la tension U˜DE sur le drain). Le réseau et le deuxième étage de mesure sont placés dans un boîtier métallique, assurant une isolation électronique et lumineuse de l'échantillon à mesurer.
Caractéristiques des transistors et corrections
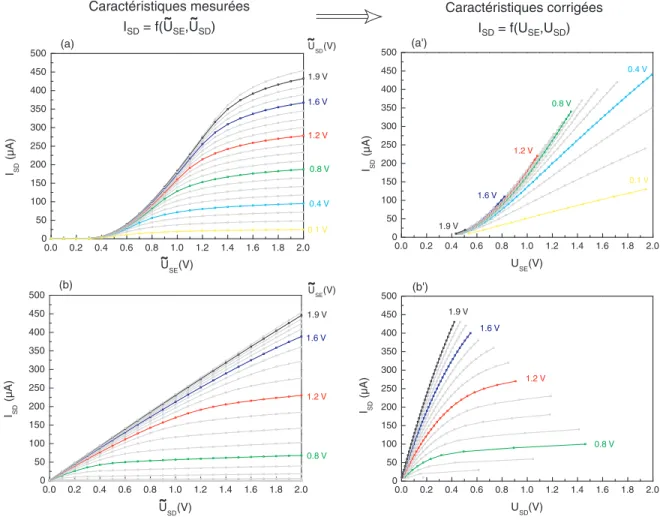
L'acquisition des caractéristiques ISD (˜USE, U˜SD) associées à chaque transistor du réseau est contrôlée par un programme écrit dans l'environnement LabWindows CVI. Ce programme permet, par interpolation, de passer des caractéristiques bidimensionnelles mesurées ISD (˜USE, U˜SD) aux caractéristiques corrigées ISD (USE, USD) pour l'ensemble du réseau.
Avant d'étudier les variations des caractéristiques des transistors lors d'une entrée de charge, il faut corriger les caractéristiques mesurées pour prendre en compte les résistances séries générées par les connexions implantées dans le substrat entre les connexions métalliques et les transistors. Au chapitre 4.2 nous verrons un exemple de ces deux méthodes d'analyse dans le cas d'un apport de charges positives pour une expérience modèle.
Dépôt des solutions étudiées
Microdépôts
De cette manière, la pointe peut être amenée au niveau du foyer de l'objectif du microscope (Olympus 4X). L'ordre de grandeur des volumes déposés ainsi que les diamètres moyens des microdépôts dépendent de la pointe choisie.
Macrodépôts
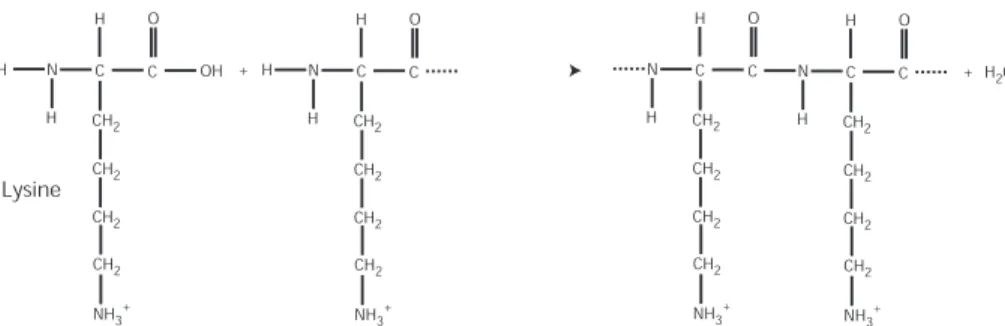
Nos premières études sur les transistors se sont concentrées sur la détection électronique de l'adsorption d'un biopolymère : le polysène. La charge de la polylysine est essentiellement due aux groupes amines N H2 (un groupe par monomère) qui à pH neutre sont chargés positivement en solution (lien R−N H3+/R−N H2, pKa = 10,2 le long de la chaîne latérale).
Un fixateur pour les ADN sondes
La solution basique, dont la concentration sera notée ci-après c0, est une dilution de la solution commerciale à 0,01 %.
- Ensemble statistique et moyennage des pics
- Variabilité intra-dépôt
- Variabilité inter-dépôts
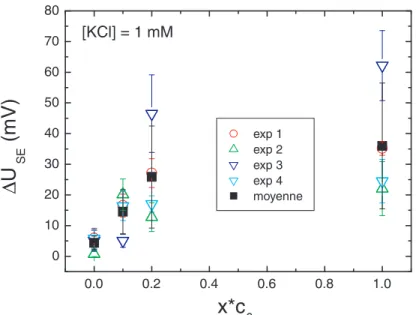
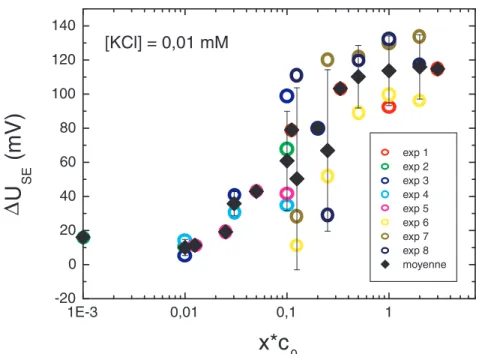
- Effet de sel
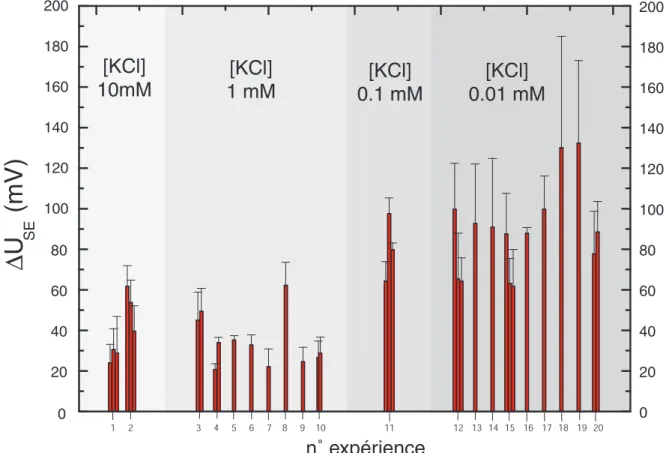
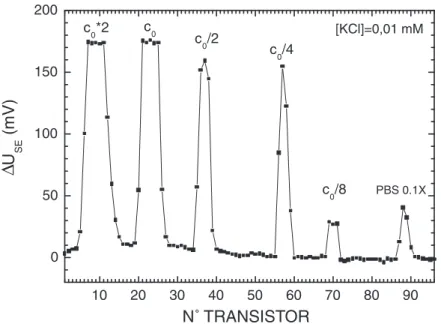
Ces points de mesure examinent la répartition latérale de la quantité de polylysine à l'intérieur d'un dépôt. Nous notons sur la figure 4.5 une augmentation progressive des signaux de polylysine à mesure que la molarité du sel utilisée pour la lecture électronique diminue.
Variation de la concentration en polylysine
En encadré, la moyenne des pics de polylysine dépend de la concentration en polylysine. On observe une augmentation progressive du signal électronique en fonction de la concentration de polylysine déposée.
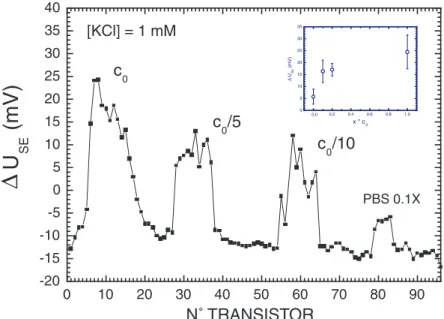
Pour l'expérience précédente, nous obtenons une évolution linéaire de ce signal intégré en fonction de la concentration en polylysine (courbe cercle plein sur la figure 4.9). A partir de la densité surfacique σc0 correspondant à une concentration de polylysinec0, on peut estimer la sensibilité du capteur à la détection de polylysine.
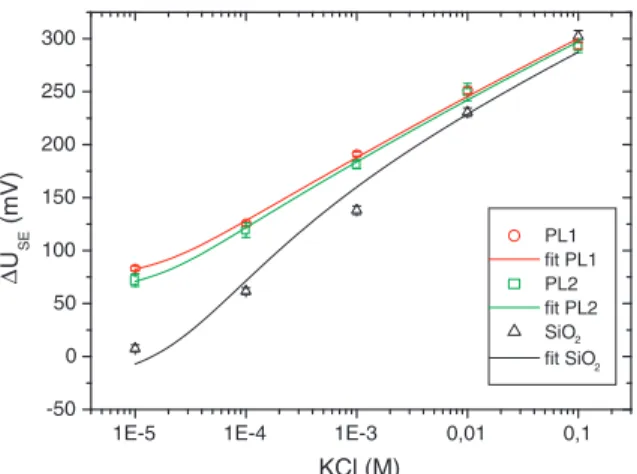
Variation de la concentration en sel de l’électrolyte de mesure
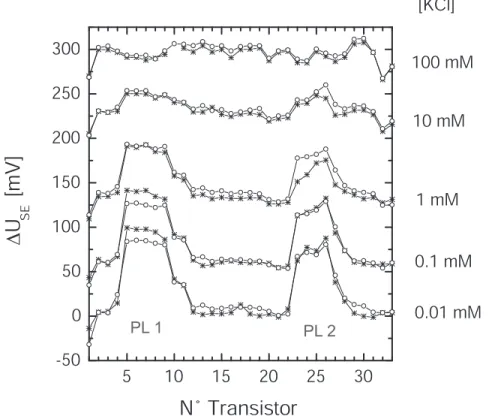
Exemple d’une double série en sel avec dépôts de polylysine
Cette première série de sels est représentée par toutes les courbes en étoile de la figure (4.11). Cette deuxième série de sel correspond à toutes les courbes représentées par des cercles sur la figure (4.11).
Modélisation et interprétation des variations en sel
Cette charge négative pour la surface nue est due à la présence de groupes silanol chargés négativement sur la surface de l'oxyde. En effet, la charge effective ajustée est fonction de la charge d'interface (σint) et de la charge dans le semi-conducteur (σS).
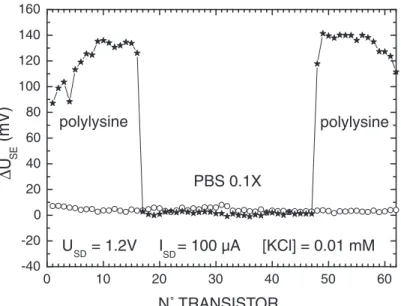
Vers une couche stable de polylysine pour la fixation future des ADN sondes
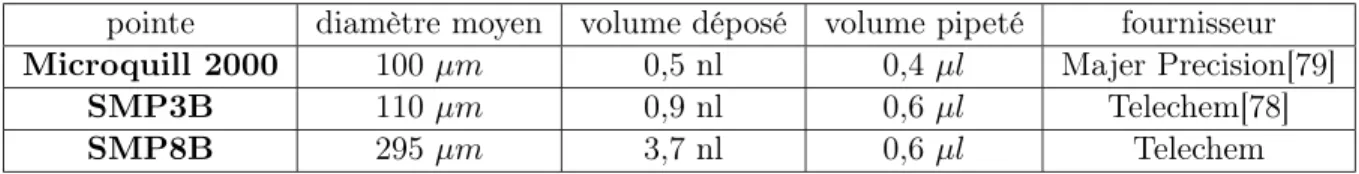
Etude de l’incubation partielle du réseau avec des macrodépôts de polylysine 48
Pour la couche de polylysine (Incubation PL) on obtient une variabilité relativement grande des signaux électroniques (15 mV ± 10 mV). Pour la stabilité de la couche de polylysine (PLrinçage), le phénomène est équivalent à celui observé lors de l'incubation.
Macrodépôts d’oligonucléotides
Reproductibilité des mesures électroniques
En revanche, en microdépôt les déplacements induits par les solutions de dilution sont 4 à 5 fois plus importants. Ce signal observé sur les solutions de dilution est le facteur limitant la détection de faibles concentrations d'ADN.
Variation de la concentration en ADN
Expériences en microdépôts
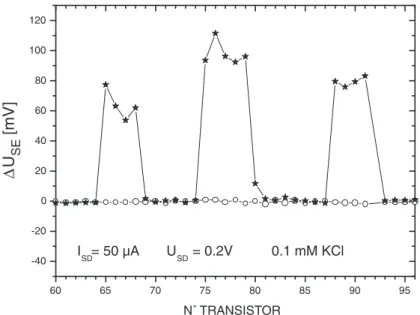
La courbe en étoile de la figure 5.3 représente le signal électronique mesuré après dépôt (la différence entre la mesure après et avant dépôt). Les résultats de toutes ces expériences ainsi que l'évolution de la valeur moyenne pour chaque concentration sont donnés sur la figure 5.4.
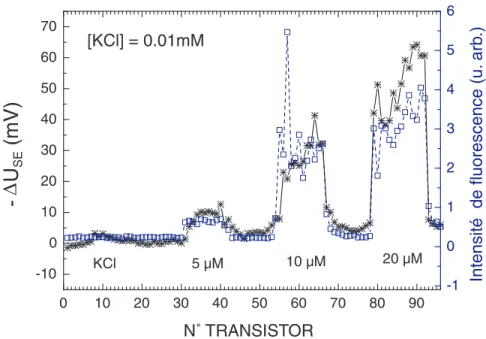
Expériences en macrodépôts
Ces chiffres représentent des surestimations de la quantité minimale d'ADN détectable car ici nous supposons que toutes les molécules déposées sont fixées sur la couche de polylysine et nous choisissons une valeur limite de détection de 10 µM. L'adsorption de l'ADN dépend de l'état de charge de la couche de polycine, qui est difficile à contrôler pour les préparations sur différentes structures de transistor.
Variation de la concentration en sel de l’électrolyte de mesure
- Une optimisation nécessaire
- Test des tampons de purification
- Test de purification des oligonucléotides
- Influence du substrat
- Détection d’un ADN de 1009 paires de base
- Détection d’autres ADN issus de PCR
Pour étudier les dépendances du signal électronique en fonction de la structure de l'ADN (double brin ou simple brin), il faudrait affiner les valeurs correspondant aux deux échantillons (oligonucléotides/substrat). La seule différence entre ces deux tubes est la présence d'ADN double brin synthétisé par PCR à partir de la solution A.
De la détection électronique de fragments PCR à la détection d’une mutation
- Protocole biologique : allèle-spécifique PCR
- Détection électronique : mise en évidence de la mutation
- Applications potentielles
- Protocole de fixation
- Séquences des oligonucléotides sondes et cibles
- Protocole d’hybridation
- Hybridation spécifique et variation de concentration
- Réhybridation et fixation covalente
- Réhybridation spécifique
- Fixation covalente de longues molécules d’ADN
- Premières mesures électroniques
La première utilise une amorce spécifique pour la détection des mutations (MUT) et une amorce commune (COM). Grâce à une fixation améliorée entre les molécules sondes et la surface, nous pouvons dénaturer les duplex d’ADN formés lors de l’hybridation sans perdre trop de molécules sondes fixes7,8.

Couplages complémentaires : interaction biotine/ streptavidine
Détection directe
Après la fixation des deux oligonucléotides Thi-ARS5 et Thi-ARS5-Biot, on réagit pendant 10 minutes avec une solution de streptavidine14 fluorescente, après quoi on rince trois fois les échantillons avec une solution de PBS 1X pendant une minute. On obtient un signal de fluorescence spécifique à la réaction biotine/streptavidine ; l'intensité de la fluorescence est d'env. 100 fois plus élevé pour les gisements Thi-ARS5-Biot par rapport aux gisements Thi-ARS5.
Détection en utilisant des nanoparticules d’or recouvertes d’une couche
Nous avons d’abord démontré l’interaction biotine/streptavidine en utilisant une solution fluorescente de streptavidine. Pour ces courbes, la mesure de référence est celle réalisée après dépôt de la sonde et avant collage de l'or.
Détection d’une hybridation en utilisant une fixation de polylysine
Influence du bloqueur
La solution d'anhydride succinique neutralise également les groupements amines qui n'ont pas réagi au niveau du dépôt d'ADN. Tous les résultats de ces manipulations montrent une négatisation de l'interface tendant vers un état de charge final homogène entre la surface nue de la polylysine et la surface de l'ADN.
Détection électronique d’une hybridation entre oligonucléotides
De plus, une surface positive permet d'augmenter localement la concentration des cibles proches de la surface et ainsi de réduire la durée d'hybridation. La régulation de l'évolution des sels permet l'émergence d'une tendance à la neutralisation de la charge d'interface lors des adsorptions successives des biopolymères.
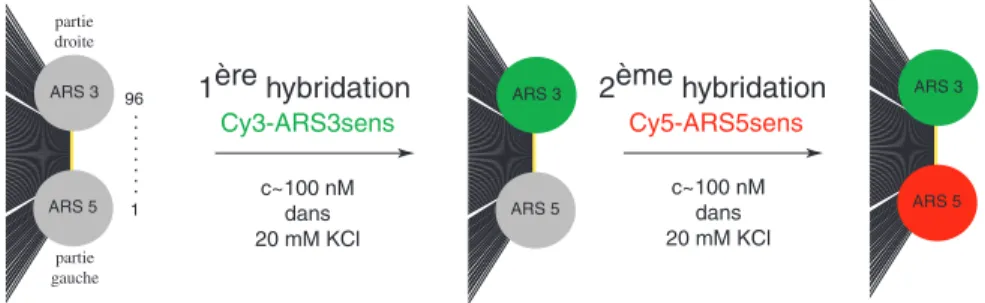
Adsorption de biopolymères chargés et variation de la concentration en sel de
Influence des résistances en série
Les figures B.1 et B.2 représentent les caractéristiques mesurées pour un transistor donné dans un réseau de 96 FET. Dans la figure B.1, qui présente les caractéristiques de ISD = f( ˜USE) pour différents U˜SD, nous observons la saturation du courant ISD à mesure que la tension USE augmente.
Détermination des résistances en série et correction pour le réseau de 96 transistors112
Détermination des résistances par une analyse des caractéristiques des
La figure B.6 montre le calcul de la résistance effective du dixième transistor de l'un des réseaux de 96 transistors. On peut calculer de la même manière toutes les résistances séries de l’ensemble du réseau.
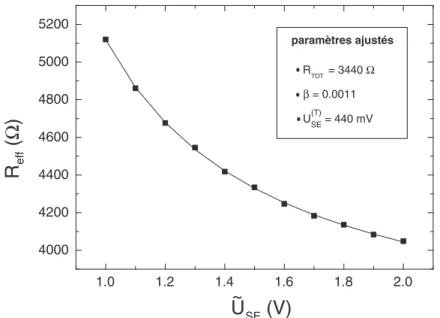
Correction des caractéristiques
Après correction, on remarque que pour les caractéristiques réelles ISD = f(USE) (figure a') il n'y a pas de saturation du courant ISD, contrairement aux caractéristiques mesurées ISD = f( ˜USE) (figure a), pour lesquelles le la saturation du courant est le résultat de l'influence des résistances série. Pour les mesures du mémoire sur le réseau de 96 transistors, nous avons utilisé un fichier de résistances évaluées géométriquement pour corriger les caractéristiques mesurées, car il est le même pour tous les différents réseaux.
Caractéristiques pour le réseau de 62 transistors
La figure B.14 montre les résistances série des connecteurs de drain pour chaque transistor du réseau de 62 FET. Ceci explique le faible effet des résistances série sur les caractéristiques des transistors du réseau 62 FET par rapport aux effets significatifs observés avec le réseau 96 transistors.
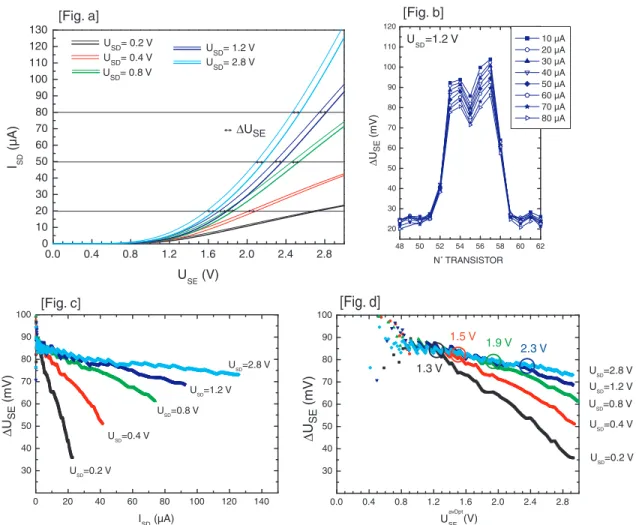
Variations des caractéristiques lors d’un apport de charge pour différents points
Fig.c] : Variations ∆USE en fonction de l'ISD calculées pour différentes valeurs de USD (pour le transistor 55 dans [Fig.b]). Cette configuration permet de produire une image de fluorescence bicolore de la surface de nos échantillons.
Fluorescence et réseaux de transistors
Effet de l’épaisseur d’oxyde
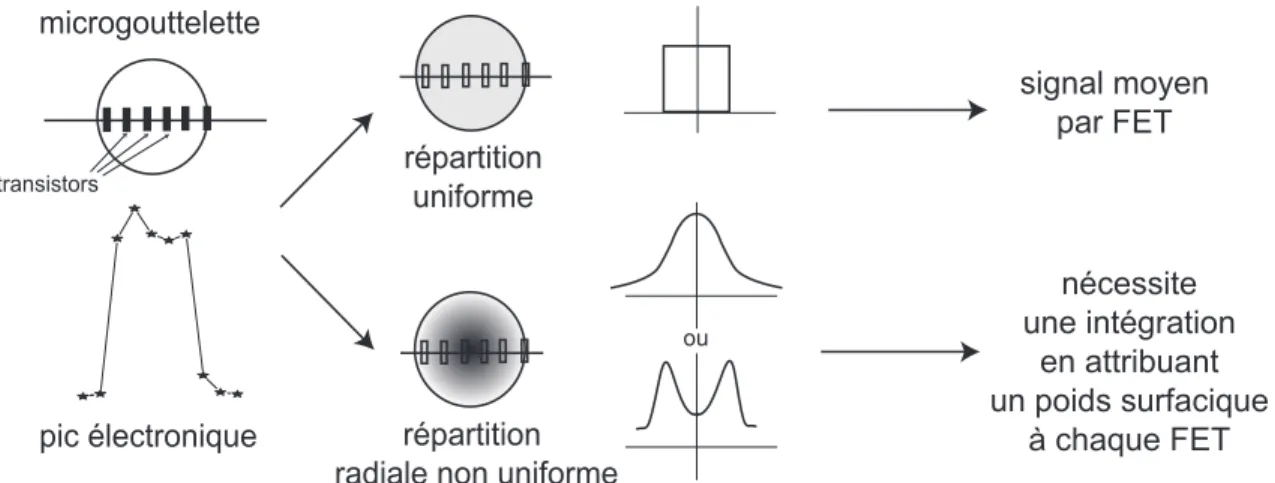
L'acquisition pour chaque position d'une intensité moyenne de fluorescence à l'aide du photomultiplicateur permet de reconstruire une image bidimensionnelle des dépôts de fluorescence à la surface de nos échantillons. La surface de l'oxyde n'a pas une épaisseur constante sur le réseau (notamment au niveau des surfaces actives où l'oxyde de silicium est dilué) et cela provoque des variations de fluorescence pour une couche homogène d'ADN adsorbée à la surface du réseau.
Moyennage sur les surfaces actives
La figure C.4 présente l'image obtenue pour trois microdépôts d'ADN marqués aux fluorophores Cy5 à la surface d'un ensemble de 96 transistors. 1 : dénaturation] La première étape consiste en une dénaturation de l'ADN double brin (séparation thermique des deux brins de la double hélice).
PCR sur le λ BstE-II
Cependant, leur croissance est linéairement dépendante du nombre de cycles et leur nombre reste négligeable par rapport à l'ADN d'intérêt. La PCR permet également de déterminer si une séquence souhaitée est présente dans un échantillon d'ADN.
PCR sur un gène de souris
Nous synthétisons deux types de fragments PCR : l'un non modifié et l'autre modifié par des fluorophores (1kbCy5) en incorporant 1 base fluorescente toutes les 20 paires de bases lors de la PCR. Pour les expériences de fixation avec des silanes (Chapitre 7.1.7), nous avons également synthétisé un ADN Thi-1kbCy5 en remplaçant l'amorce ARS5 par l'amorce Thi-ARS5, les quantités de produits utilisées étant par ailleurs les mêmes.
Synthèse de longs fragments d’ADN (10 kb)
14] G Yershov et al (1996) DNA analysis and diagnostics on oligonucleotide microarrays. Proc. 2001) Surface characterization of a silicon-based DNA microarray. Molecular theory of polyelectrolyte solutions with applications to the electrostatic properties of polynucleotides.Q. 1997) Direct Detection of the Hybridization of Synthetic Homo-Oligomer DNA Sequences by Field Effect.J. 2001).