HAL Id: tel-00424935
https://tel.archives-ouvertes.fr/tel-00424935
Submitted on 19 Oct 2009
HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci- entific research documents, whether they are pub- lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Transfert couplé d’électron et de proton dans des complexes de métaux de transition modèles et d’intérêts
biomimétiques. Etudes mécanistiques par une approche électrochimique.
Anne-Lucie Teillout
To cite this version:
Anne-Lucie Teillout. Transfert couplé d’électron et de proton dans des complexes de métaux de tran- sition modèles et d’intérêts biomimétiques. Etudes mécanistiques par une approche électrochimique..
Autre. Université Paris-Diderot - Paris VII, 2009. Français. �NNT : �. �tel-00424935�
UNIVERSITE PARIS-DIDEROT (PARIS 7)
Ecole doctorale de chimie physique et chimie analytique de Paris centre (ED 388)
DOCTORAT
ELECTROCHIMIE
TEILLOUT ANNE-LUCIE
TRANSFERT COUPLE D’ELECTRON ET DE PROTON DANS DES COMPLEXES DE METAUX DE TRANSITION MODELES ET D’INTERETS BIOMIMETIQUES.
ETUDES MECANISTIQUES PAR UNE APPROCHE ELECTROCHIMIQUE.
COUPLED PROTON ÉLECTRON TRANSFER IN BIOMIMETIC TRANSITION METAL COMPLEXES. ELECTROCHEMICAL MECHANISTIC STUDIES.
Thèse dirigée par Marc Robert Soutenue le 25 septembre 2009
Rapporteurs M.-N. COLLOMB DR CNRS, Grenoble Y. LEMEST DR CNRS, Brest
Examinateurs W. A. RUTHERFORD DR CNRS, CEA Saclay J.-M. SAVEANT DR CNRS, Paris
« Le pouvoir correspond à l’aptitude à agir de façon concertée » Hannah ARENDT
A mes proches qui ne sont plus de ce monde.
Ce travail a été réalisé au Laboratoire d’Electrochimie Moléculaire, dirigé par Monsieur B.
Limoges. Je le remercie de m’avoir accueillie au sein du laboratoire.
Madame M.-N. Collomb et Monsieur Y. Lemest me font l’honneur d’être les rapporteurs de cette thèse, je les en remercie. Monsieur A.W. Rutherford a bien voulu juger ce travail. Qu’il me soit permis de lui adresser de très sincères remerciements.
Je tiens à remercier vivement Monsieur M. Robert pour la possibilité qu’il m’a donnée de faire cette thèse dans des conditions intellectuelles et matérielles idéales. Il m’a poussé et aidé à valoriser mon travail. Je lui en suis très reconnaissante.
Je tiens à exprimer ma profonde gratitude envers Monsieur C. Costentin. Son savoir, sa gentillesse, sa disponibilité et son flegme normand, ont été pour moi source d’apprentissage, de sérénité et de bonne humeur. Je tiens sincèrement à le remercier de la confiance qu’il m’a accordée.
Je tiens à exprimer à Monsieur J.-M. Savéant ma reconnaissance envers sa bienveillance et les discussions multiples qui ont permis de faire progresser ce travail.
Cette thèse, pour moi, a été aussi bien une aventure scientifique qu’humaine. Durant les trois ans passés au laboratoire, j’ai été confrontée, comme tout thésard, à des difficultés techniques. Des rencontres ont permis la résolution d’une grande partie de ces problèmes ou simplement un soutient moral. Une partie de ma thèse et non loin la moins laborieuse a été la synthèse du complexe d’osmium. Novice en synthèse, j’ai eu la chance de bénéficier des conseils, du savoir-faire et du soutient de V. Balland, C. Hureau, B. Limoges, D. Evrard et C.
Tard. Je les remercie très vivement. Une autre partie, je dois bien l’avouer, plus « bling- bling », a été de manipuler avec une électrode de Diamant Dopée au Bore. Ces expériences n’auraient pu voir le jour sans les connaissances scientifiques et techniques de P. Mayet, P.
Bergonzo, J. De Sanoît et de E. Van Hove. Je les remercie pour leur efficacité et leur disponibilité. Durant ces trois années, j’ai travaillé parallèlement sur des complexes de manganèse. Je transmets ainsi ma reconnaissance à A. Aukauloo, B. Lassalle et C. Policar pour leur expérience et savoir-faire qu’ils m’ont partagés. Qu’il me soit également permis de remercier E. Anxolabéhère-Mallart pour ses conseils et les discussions enrichissantes que nous avons eus, J. Bonin pour son soutien et sa bonne humeur, M. Druet pour ses compétences qui ont sauvé mainte fois mes expériences de problèmes électroniques, E. Cabet pour avoir été une collègue de laboratoire amicale, C. Guiolet, D. Saunière, M.-N. Ollivier pour l’aide logistique précieuse qu’ils m’ont apportée et G. Thoraval pour sa sympathie et son travail de verrerie efficace.
J’ai une pensée toute particulière pour ceux avec qui j’ai partagé mon bureau : F.Mavré, C.
Goyer, T. Defever, C. Louault et C. Tard. Ils ont eu le mérite de supporter mon petit caractère. Les fou rires et leur soutien resteront des souvenirs mémorables. Je souhaite aussi ajouter une pensée affectueuse pour V. Hajj et C. Renault. De plus, je tiens à exprimer mes sentiments les meilleurs à tous les membres du laboratoire que je n’ai pas encore cités, véritable melting-pot, vivre à leur coté à été un apprentissage de tous les jours.
Je tiens à exprimer ma profonde reconnaissance à ma famille qui a été d’un soutient sans faille.
Enfin, je remercie du fond du cœur Jean-Baptiste, pour sa patience, sa présence et toute l’aide qu’il m’a apportée.
SOMMAIRE
Table des abréviations et constantes………
INTRODUCTION GENERALE………..
CHAPITRE I. INTRODUCTION………
I.A.CONTEXTE BIOLOGIQUE……….
I.A.1. Le photosystème II : producteur de dioxygène………
I.A.2. Réactions de consommation de O2 et activité SOD………
I.B.DESCRIPTION DU TRANSFERT D’ELECTRON COUPLE AU TRANSFERT DE PROTON……….
I.B.1. Caractérisation thermodynamique d’un transfert 1e-,1H+………
I.B.2. Aspects mécanistiques : dualité mécanisme concerté/séquentiel pour un PCET………..
I.B.3. Description des constantes de vitesse standard intrinsèques des deux mécanismes possibles……….
I.B.4. Etablissement de la loi cinétique globale……….
I.C.OBJECTIFS………..
CHAPITRE II . ETUDE D’UN COMPLEXE « MODELE », [OsII(bpy)2py(H2O)]2+, PAR VOLTAMETRIE CYCLIQUE………...
II.A.PROPRIETES THERMODYNAMIQUES : DEUX TRANSFERTS SUCCESSIFS 1e-,1H+………..
II.B.SPECIFICITES DE L’ETUDE DU COUPLE OsIII(OH)/OsIV=O……….
II.B.1. Etude sur électrode de diamant dopée au bore……….……….
II.B.2. Echange de ligands à pH basique……….
II.C.ETUDE CINETIQUE……….
II.C.1. Transfert rapide et transfert lent………..
II.C.2. Etude cinétique en fonction du pH………
II.C.3. Effet cinétique isotopique………...
II.C.4. Effet de la concentration du tampon………
II.D.CONCLUSION………
CHAPITRE III. PARAMETRES INFLUENCANT LA NATURE DU PCET ……...
III.A.INFLUENCE DE LA VALEUR DES pKa DU COUPLE REDOX………..
III.B.INFLUENCE DE LA PRESENCE D’ESPECES NON ACIDO-BASIQUES………...
3
5
7 9 9 18 23 24 26
29 34 40
49 51 54 55 61 62 63 66 78 81 84
89 91 94
III.C.INFLUENCE DE LA CONCENTRATION DE L’ACCEPTEUR ET DU DONNEUR DE PROTON… III.C.1. Influence de la concentration des espèces tampons sur le couple OsII/OsIII………...
III.C.2. Influence de la concentration des espèces tampons sur le couple OsIII/OsIV………..
III.D.INFLUENCE DE LA PROXIMITE DE L’ACCEPTEUR ET DU DONNEUR DE PROTON………..
III.E.CONCLUSION………
CHAPITRE IV . ETUDE D’UN COMPLEXE DE MANGANESE BIOMIMETIQUE DE LA SOD………..
IV.A.ETAT DE L’ART………
IV.B.ETUDE DU COMPORTEMENT DU COMPLEXE EN MILIEU AQUEUX………..
IV.B.1. Etude de [MnII(LNH)(H2O)]2+ par voltamétrie cyclique à basse vitesse de balayage……..
IV.B.2. Etude de [MnII(LNH)(H2O)]2+ pour des pH inférieurs à 6……….
IV.B.3. Etude cinétique de [MnII(LNH)(H2O)]2+ pour des pH compris entre 6 et 10……….
IV.B.4. Etude de [MnII(LNH)(H2O)]2+ pour des pH supérieurs à 10……….
IV.C.CONCLUSION………...
CONCLUSION GENERALE………...
PARTIE EXPERIMENTALE………..
A.MANIPULATION ELECTROCHIMIQUES………...
A.1. Voltamétrie cyclique linéaire……….
A.2. Electrolyse à potentiel contrôlé……….
B.PRODUITS CHIMIQUES………...
B.1. Solvants et composés non-électroactifs………
B.2. Substrats……….
ANNEXES………...
Annexe I : Expressions du potentiel standard apparent pour un simple PCET…………...
Annexe II : Expressions de la constante de vitesse standard apparentes pour un simple PCET………
Annexe III : Linéarisation de la loi quadratique issue de la théorie de Marcus-Hush…….
Annexe IV : Expression des constantes thermodynamiques et cinétiques caractéristiques du couple OsIII(OH)/OsIV=O en présence d’électrolyte support………..
97 98 99 102 108
111 114 116 116 118 123 130 138 145
147 149 149 155 156 156 157
167 168 173 180 182
Table des abréviations et constantes
PCET : Proton Coupled Electron Transfer EPT : Electron Proton Transfer
PET: Proton Electron Transfer
CPET: Coupled Proton Electron Transfer PSII: Photosystème II
OEC: Oxygen Evolving Complex SOD: Superoxide Dismutase
C Concentration en solution du substrat E Potentiel
E0 Potentiel standard
0
Eapp Potentiel standard apparent E1 2 Potentiel de demi pic
F Constante de Faraday i Courant
ks Constante de vitesse
apps
k Constante de vitesse standard apparente Ka Constante d’acidité
Kas Constante d’association M Masse molaire
R Constante molaire du gaz parfait S Surface de l’électrode
T Température
Zel Facteur pré-exponentiel dérivé de la théorie des collisions α Coefficient de transfert
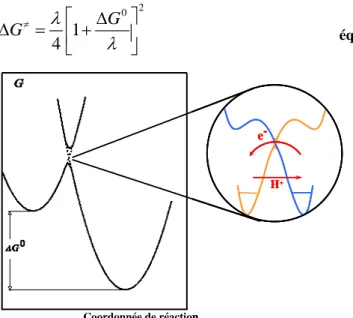
G0
Δ Force motrice
0≠
ΔG Barrière intrinsèque G≠
Δ Barrière d’enthalpie libre λ Réorganisation nucléaire
Introduction Générale
De nombreux processus naturels et enzymatiques font intervenir l’oxydation de complexes de métaux de transition ligandés par une molécule d’eau. Le photosystème II est un exemple remarquable : durant le processus catalytique d’oxydation de l’eau en dioxygène, un cluster d’atomes de manganèse est porté à de hauts degrés d’oxydation donnant lieu à la formation, à partir d’une structure MnII-aquo, de complexes de type MnIII-hydroxo et MnIV=oxo.1 Les superoxyde dismutases (SOD) mettent en jeu une chimie redox similaire.2 Ces deux systèmes biologiques seront présentés dans le chapitre I. Le point commun à tous ces processus est d’associer intimement changement de degré d’oxydation et transfert de proton.
Un engouement croissant a été porté sur l’élaboration de complexes imitant ces derniers processus biologiques. Cependant la plupart des systèmes biomimétiques présents dans la littérature présentent des efficacités moindres que les systèmes naturels. L’idée selon laquelle la performance de nombreux processus biologiques impliquant un transfert 1e-,1H+ serait due à un couplage intime entre le transfert d’électron et le transfert de proton, est de plus en plus mise en avant. Ainsi, nous verrons, dans le chapitre I, les différents mécanismes possibles pour un mécanisme 1e-,1H+ de même que les critères les différenciant.
Pour mieux comprendre les mécanismes des réactions 1e-,1H+ et les paramètres les influençant, nous avons pris le parti d’étudier un système « modèle », un complexe d’osmium portant un ligand aquo, [OsII(bpy)2py(H2O)](PF6)2 , au moyen de la voltamétrie cyclique. En s’oxydant, le complexe subit deux transferts successifs à 1e-,1H+ passant ainsi de l’état OsII(H2O) à OsIII(OH) puis à OsIV=O.3, 4 Les caractéristiques thermodynamiques et cinétiques complètes du système électrochimique ainsi que les mécanismes mis en jeu seront présentés dans le chapitre II. Les facteurs intrinsèques et environnementaux contrôlant la réactivité de ce type d’édifices seront explicités quant à eux dans le chapitre III ; leur mise à jour permet désormais d’envisager une approche rationalisée des mécanismes PCET sur de tels complexes.
Dans un second temps, nous avons étudié un complexe de manganèse, complexe biomimétique de la SOD impliquant le couple redox MnII(H2O)/ MnIII(OH). Cette étude
détaillée dans le chapitre IV présente l’originalité de déterminer le mécanisme emprunté par le PCET en milieu aqueux d’un complexe mononucléaire de manganèse. Malgré un accès restreint aux caractéristiques thermodynamiques du système en raison du caractère labile du manganèse, la nature du mécanisme sera déterminée et permettra de confirmer les prédictions faites à l’aide du composé « modèle ».
1. Huynh M.H.V. and Meyer T.J., Proton-Coupled Electron Transfer Chem. Rev., 2007, 107, 5004-5064
2. Miller A.-F., Padmakumar K., Sorkin D.L., Karapetian A. and Vance C.K.,
Proton-coupled electron transfer in Fe-superoxide dismutase and Mn-superoxide dismutase J. Inorg. Biochem., 2003, 93, 71-83
3. Costentin C., Robert M., Saveant J.-M. and Teillout A.-L.,
Concerted and stepwise proton-coupled electron transfers in aquo/hydroxo complex couples in water: oxidative electrochemistry of [OsII(bpy)2(py)(OH2)]2+
ChemPhysChem, 2009, 10, 191-198
4. Costentin C., Robert M., Saveant J.-M. and Teillout A.-L.,
Concerted proton-coupled electron transfers in aquo/hydroxo/oxo metal complexes:
electrochemistry of [OsII(bpy)2py(OH2)]2+ in water Proc. Natl. Acad. Sci. U. S. A., 2009, 106, 11829-11836
Chapitre I.
Introduction
CHAPITRE I. INTRODUCTION ... 7
I.A.CONTEXTE BIOLOGIQUE... 9
I.A.1. Le photosystème II : producteur de dioxygène ... 9
I.A.1.a. Le site actif ... 12
I.A.1.b. Les complexes mimétiques de l’OEC... 15
I.A.2. Réactions de consommation de O2 et activité SOD ... 18
I.A.2.a. Réactions de consommation de O2 et réactions associées... 18
I.A.2.b. La SOD : protection élaborée contre l’ion superoxyde... 19
I.A.2.c. Les complexes biomimétiques de la SOD à manganèse ... 22
I.B.DESCRIPTION DU TRANSFERT D’ELECTRON COUPLE AU TRANSFERT DE PROTON... 23
I.B.1. Caractérisation thermodynamique d’un transfert 1e-, 1H+... 24
I.B.2. Aspects mécanistiques : dualité mécanisme concerté / séquentiel pour un PCET. ... 26
I.B.3. Description des constantes de vitesses standard intrinsèques des deux mécanismes possibles... 29
I.B.3.a. Description cinétique du mécanisme séquentiel par le modèle Marcus-Hush... 29
I.B.3.b. Description du mécanisme concerté ... 32
I.B.4. Etablissement de la loi cinétique globale ... 34
I.B.4.a. Contribution du chemin séquentiel ... 34
I.B.4.b. Contribution du chemin concerté... 37
I.B.4.c. Expression de la constante de vitesse standard apparente de la réaction globale ... 38
I.C.OBJECTIFS... 40
Pour des raisons énergétiques et thérapeutiques, l’élaboration de complexes de métaux de transition ayant pour finalité d’imiter des processus biologiques connaît un grand développement. Un grand nombre de ces complexes mimétiques, tout comme les processus biologiques qui leur sont associés, font intervenir un (ou des) transfert(s) d’électron couplé(s) à un (ou des) transfert(s) de proton(s) (PCET, acronyme de Proton Coupled Electron Transfer). Ainsi la compréhension de la nature du couplage entre un transfert d’électron et de proton et des facteurs influençant celui-ci prend place dans ce contexte.
Dans ce chapitre, seront présentés, dans un premier temps, le contexte biologique dans lequel s’inscrit le travail effectué, puis, dans un second temps, les fondements théoriques sur lesquels le travail a été développé.
I.A. Contexte biologique
Point de folie, la dette énergétique d’un organisme se paye « en petite monnaie d’électrons » ! (Pr Laborit) Même si la monnaie énergétique principale d’un organisme est l’électron, le proton accompagne très souvent le transfert d’électron dans les processus biologiques. Il sera présenté par la suite deux exemples de processus biologiques faisant intervenir des PCET ainsi que quelques complexes mimétiques associés à ces derniers. Ces exemples ont en commun de mettre en jeu une molécule essentielle à notre monde : la molécule de dioxygène. Source d’énergie indispensable à l’activité du monde animal, le dioxygène est produit par les végétaux lors du processus de la photosynthèse.
I.A.1. Le photosystème II : producteur de dioxygène
Le dioxygène est produit par la réaction d’oxydation de l’eau dans les plantes et certaines bactéries au sein du photosystème II (PSII), sous-unité de l’ensemble photosynthétique. Le PSII est capable de réduire deux plastoquinones (PQA,B) et d’oxyder deux molécules d’eau à l’aide de la lumière.
équation I-1
Les plastoquinones (PQH2) migrent vers le Photosystème I (PSI) pour permettre la réduction de la nicotamide diphosphonium (NADP+) en nicotamide diphosphate (NADPH). L’énergie
chimique ainsi stockée est ensuite utilisée pour la synthèse de sucres (CH2O)n à partir de CO2
par la protéine Rubisco. Quant au dioxygène et aux protons générés par le PSII au niveau du lumen (intérieur de la cellule), ils sont expulsés vers le stroma (extérieur de la cellule) par des canaux spécifiques. L’augmentation de la concentration en protons dans le stroma entraîne la formation d’un gradient de protons entre l’extérieur et l’intérieur de la cellule. La force protomotrice en résultant permet la synthèse d’ATP par l’ATP-synthase, ultime étape de conversion de l’énergie solaire en énergie chimique.
Les réactions d’oxydation de l’eau et de réduction des plastoquinones impliquent un grand nombre de réactions intermédiaires servant de relais au transfert d’électron. Ces différentes étapes intermédiaires sont représentées sur la Figure I-1.
stroma
lumen stroma
lumen
Figure I-1 : Représentation du Photosystème II selon Boussac et Rutherford.1
Les flèches violettes représentent les transferts d’électrons entre c la paire de chlorophylles P680 et la phéophytine, d la phéophytine et la plastoquinone PQA e la tyrosine et la paire de chlorophylles P680, f
l’OEC et la tyrozine et g la plastoquinone PQA et la plastoquinone PQB.1
L’excitation lumineuse du pigment chlorophylle P680 déclenche une séparation de charge photo-induite. L’état excité du donneur primaire P680* est alors formé et réduit une plastoquinone PQA via une phéophytine pour créer la forme oxydée P680+ (c et d sur Figure I-1). Le P680+ oxyde la fonction phénol du résidu tyrosine (e sur Figure I-1). L’oxydation de celle-ci par le P680+ est rendue possible par l’existence d’une liaison hydrogène entre la fonction phénol et l’histidine 190. La fonction phénoxy est alors réduite par le centre de dégagement d’oxygène (OEC, acronyme de Oxygen Evolving Complex) constitué d’un cluster de quatre atomes de manganèse et d’un atome de calcium (f sur Figure I-1). Quatre
répétitions de ce processus d’oxydation sont nécessaires à la formation d’une molécule de dioxygène.2 Durant ce cycle, quatre électrons et quatre protons sont libérés. Ce cycle catalytique est nommé « cycle de Kok »3 (Figure I-2). Les différentes étapes sont appelées
« états Sn », n étant le nombre d’électrons ayant quitté l’OEC. Ainsi l’état S0 est l’état non- oxydé de l’OEC, mais l’état stable du cluster est l’état S1. Les degrés d’oxydation des ions manganèse dans les états S0, S1 et S2 sont maintenant connus, mais les états S3 et S4 font encore l’objet d’études et d’hypothèses. Il a également été prouvé que l’OEC subit un réarrangement structural important lors de la transition de S2 à S3.4
Figure I-2: Représentation simplifiée du cycle de Kok.5
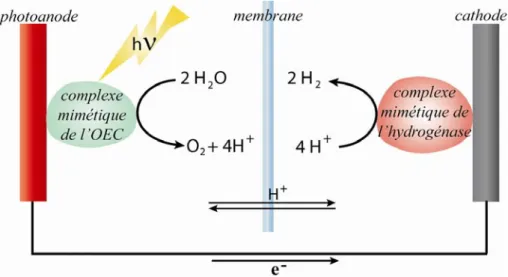
L’élaboration de complexes biomimétiques du PSII et plus particulièrement de l’OEC revêt un intérêt particulier dans le domaine de l’énergie. Devant l’appauvrissement des réserves naturelles en énergies fossiles, la production de dihydrogène, vecteur énergétique, est un enjeu majeur des prochaines décennies. Cependant, aujourd’hui, la production de celui-ci nécessite des réactifs issus essentiellement d’alcanes d’origine fossile. Le principe innovant dans lequel s’inscrit l’élaboration de complexe biomimétique du PSII est le suivant : en combinant un complexe biomimétique du PSII avec un complexe mimétique de l’hydrogénase (enzyme responsable de la réduction des protons en dihydrogène), la production de dioxygène et de dihydrogène serait possible à partir des réactifs peu coûteux que sont la lumière et l’eau (Figure I-3).5, 6
Figure I-3 : Schéma de cellule productrice de O2 et H2. Schéma inspiré de la référence 7. 7
Ainsi de nombreux chercheurs s’attachent à comprendre le mécanisme de fonctionnement de l’OEC afin de reproduire son fonctionnement avec une efficacité équivalente.
I.A.1.a. Le site actif
I.A.1.a.i. Structure de l’OEC
Les techniques de diffraction et d’adsorption des rayons X (noté RX) ont permis de décrire la structure primaire du PSII. Cependant, la structure précise de l’OEC reste toujours un sujet de controverse. Il a été montré que quatre ions manganèse sont présents, reliés par des ponts oxo.5 Il a été également établi que la présence d’un ion calcium1 et d’un ion chlorure8 est essentielle au bon fonctionnement de l’enzyme. Toutefois de nouvelles données combinant des mesures de DRX et EXAFS ont permis de réduire le nombre de modèles sur la structure du OEC. Ainsi quatre modèles très similaires sont retenus dans la littérature présentant une structure cubane ouverte avec un ion manganèse excentré par rapport au reste du site (noté Mn4) et relié par un pont di-µ-oxo à l’ion manganèse le plus proche. Une de ces propositions de structure est représentée sur la Figure I-4.5 Les modèles retenus diffèrent par la position relative de l’ion calcium et/ou de l’orientation de Mn4.
Figure I-4 : Modèle de structure possible de l’OEC à l’état S1.5
Les atomes de manganèse sont représentés en rouge (Mn4 est repéré par la lettre A), les atomes d’oxygène en bleu et l’atome de calcium en jaune. Les lignes pointillées en vert indiquent des distances inférieures à
3Å, tandis que les lignes pointillées en orange indiquent des distances supérieures à 3Å.
I.A.1.a.ii. Mécanisme d’oxydation de l’eau
Devant l’abondance de propositions de mécanismes d’oxydation de l’eau par l’OEC, une synthèse des grandes idées émises actuellement sera présentée. Trois grandes classes de mécanismes sont admises : les mécanismes nucléophile/électrophile, les mécanismes radicalaires et le couplage de deux groupements oxo ou hydroxo.
Les mécanismes nucléophile/électrophile ont pour idée générale l’attaque d’un groupement électrophile, tel qu’un oxygène lié à un (ou deux) manganèse(s) possédant un degré d’oxydation élevé, par un groupement nucléophile pouvant être soit une molécule d’eau, soit une molécule H2O/OH- liée à l’ion calcium, soit une molécule H2O/OH- liée à la fois à l’ion calcium et à un ion manganèse (ces deux derniers cas étant nommés par la suite « molécule d’eau activée » (Figure I-5).5
O Mn
OH2
O Mn
O Ca H
O Mn
O H Ca
Mn
Figure I-5 : Schéma du mécanisme nucléophile/électrophile.
Les mécanismes faisant intervenir des espèces oxygénées radicalaires ont été proposés dans des variantes pontantes ou terminales. Au préalable, il y a oxydation d’un ligand oxo pontant ou pas, générant ainsi un radical. Puis le groupement radicalaire est attaqué par une molécule d’eau résiduelle ou une « molécule d’eau activée » (Figure I-6).5 Ce type de mécanisme présenterait l’avantage d’être moins coûteux énergétiquement que les mécanismes nucléophile/électrophile.9 De plus il rend correctement compte de la modification structurale des distances intermétalliques observées lors du passage de S2 et S3. Il n’est cependant pas aisément vérifiable, car aucun exemple de radical oxyle coordinné au manganèse n’a été rapporté dans la littérature à ce jour.
Mn O
Mn O
Ca HO
Mn
O Mn
O Ca
Mn
Figure I-6: Schéma du mécanisme radicalaire.
Les hypothèses de mécanismes de couplage de deux groupements oxo ou hydroxo ont pour origine les observations faites sur des composés dinucléaires de métaux de transition tels que des complexes dinucléaires de ruthénium.10 Ce type de mécanisme consiste en la formation d’un pont µ-(hydro)peroxido entre deux manganèses à partir de deux ligands hydroxo/oxo placés respectivement sur chacun des ions manganèse (Figure I-7). Toutefois ce type de mécanisme est depuis quelque temps écarté pour des raisons de géométrie de l’OEC ainsi qu’à cause du caractère labile du manganèse.
Mn Mn/Ca OHx OHy
Mn Mn/Ca HxO OHy
Mn Mn/Ca O
OHz
Figure I-7 : Schéma du mécanisme de couplage de deux groupements oxo ou hydroxo.
Les figures I-5, I-6 et I-7 schématisent les mécanismes proposés. Les degrés d’oxydation des ions manganèses ne sont pas précisés de même que l’ordre des liaisons Mn-O.
I.A.1.b. Les complexes mimétiques de l’OEC
Les données structurales et mécanistiques du fonctionnement du PSII ne permettent pas de fournir aux chimistes un modèle à imiter. De nombreux complexes ont été présentés dans la littérature comme modèles de l’OEC, certains structuraux, d’autres fonctionnels.
La première catégorie comprend les molécules comportant jusqu’à quatre ions manganèse, reliés par des atomes d’oxygène pontants.11,12-16 Si ces complexes présentent un intérêt du point de vue de leurs structures et propriétés magnétiques, leur activité catalytique est faible.
Dans la seconde catégorie rentrent divers systèmes mono ou polynucléaires de métaux de transition (Ru et Mn) capables de réaliser l’oxydation catalytique de l’eau, bien qu’ayant peu de points communs avec le système naturel.
N N
bpy
N
N N
N
bpm
N
N N
N
bpz
N N
N
tpy
N
HN N
N
bpp
N N N
N N
N
bnp
Figure I-8 : Exemples de ligands utilisés pour obtenir des complexes mimétiques fonctionnels de l’OEC.
Des complexes dinucléaires de ruthénium, possédant un pont oxo et effectuant la catalyse de l’oxydation de l’eau, sont étudiés depuis une vingtaine d’années.6, 17 Le premier complexe de ce type à avoir été publié est le cis, cis- [(bpy)2(H2O)RuIIIORuIII(OH2)(bpy)2]4+ par Meyer et al18 nommé par la suite « blue dimer ».19 Des complexes similaires dans lesquels les ligands
bipyridine sont substitués par des ligands acide 2,2’-bipyridil-5,5’-dicarboxylique ou acide 2,2’-bipyridil-4,4’-dicarboxylique, ont aussi montré une activité catalytique non négligeable vis-à-vis de l’oxydation de l’eau.20-22 Des propriétés identiques ont été observées avec le complexe [(tpy)(H2O)2RuORu(OH2)2(tpy)]4+ 23, 24 et le complexe trinucléaire [(NH3)5RuIIIORuIII(NH3)4O(NH3)4ORu(NH3)5]6+.25 Cependant un pont oxo entre les ions ruthénium n’est pas une condition nécessaire aux propriétés catalytiques du complexe tel que le montrent les travaux sur les complexes [Ru2(bpp)(tpy)2(O)2]3+ 26, [RpyRu(bnp)(µ- Cl)RupyR]3+ (Rpy : 4-substitué (CH3,CF3,NMe2pyridine) 27 et [Ru(OH)(3,6- tBu2qui)Ru(OH)(3,6-tBu2qui)]2+.28
Différents mécanismes de formation du dioxygène ont été proposés pour cette catégorie de composés. Ces propositions s’appuient principalement sur le caractère dinucléaire du complexe.6, 10
Plus récemment, des complexes mononucléaires de ruthénium ont été relevés comme effectuant la catalyse de l’oxydation de l’eau : [Ru(tpy)(bpm)(OH2)]2+ et [Ru(tpy)(bpz)(OH2)]2+.29 Il a été proposé que la création du dioxygène se fasse via un intermédiaire réactionnel peroxido 29.
Tous les composés cités ci-dessus comprennent un ligand aquo/hydroxo/oxo dans leur sphère de coordination. Il a été montré que l’activité de complexes mononucléaires de ruthénium ne présentant pas de ligand aquo/hydroxo/oxo dans leur sphère de coordination à l’état stable peuvent aussi présenter une activité catalytique vis-à-vis de la réaction d’oxydation de l’eau.30, 31 Il est envisagé que le complexe prenne, dans un état intermédiaire, une configuration heptacoordinnée, la septième position étant coordinné par une molécule d’eau provenant du milieu.
L’efficacité de ces complexes vis-à-vis de l’oxydation de l’eau a été montrée essentiellement par addition d’un oxydant fort comme Ce4+ ou Co3+ 18-20, 22-30
ou par photochimie,21 très rarement par électrochimie,24, 29 la concentration de dioxygène libéré étant mesurée par chromatographie en phase gazeuse.
Aujourd’hui, le prix et la présence limitée sur la terre du ruthénium renforcent les efforts portant sur la synthèse de complexes de manganèse. Un petit nombre de complexes poly/mononucléaires de manganèse sont présentés comme ayant une activité catalytique vis-à-vis de l’oxydation de l’eau.25, 32-35 Les mesures effectuées sur ces composés sont faites
en présence d’oxydants forts (NaClO, KHSO5, mCPBA (acide méta-chloroperbenzoïque) ou encore TBHP (ter-butylhydroperoxyde)). Toutefois, l’emploi de tels oxydants peut conduire à ce que l’un des deux atomes d’oxygène de la molécule de dioxygène dégagée ne provienne pas d’une molécule d’eau du solvant mais de l’oxydant lui-même.33, 36 Deux des composés précédemment cités ont été étudiés avec Ce4+ comme oxydant concluant dans ces conditions à aucun dégagement de dioxygène37 ou à une concentration en dioxygène dégagée par rapport à la quantité d’oxydant beaucoup plus faible.33
Depuis quelques années, plusieurs équipes avancent l’hypothèse selon laquelle l’efficacité du système biologique PSII réside dans un mécanisme de PCET peu coûteux en énergie. 38-40 Cette dimension mécanistique implique alors un nouveau mode de conception des complexes bio-mimétiques et surtout des études thermodynamiques et cinétiques du transfert 1e-, 1H+ sur ces derniers. L’étude thermodynamique et cinétique du PCET a été effectuée pour quelques complexes inorganiques41-43 sans réelle étude mécanistique approfondie. Le but du travail présenté dans les chapitres II et III consiste à déterminer le mécanisme de couplage entre le transfert de proton et d’électron pour un complexe de métal de transition. Le complexe étudié est [OsII(bpy)2py(H2O)]2+ ; l’étude a porté sur les réactions OsII(H2O)/OsIII(OH)/OsIVO. Le choix d’un complexe mononucléaire portant un ligand aquo a semblé être la meilleure approche pour des raisons de simplicité. Les complexes mononucléaires de ruthénium ont été écartés à cause de leur propension à dismuter lorsqu’on amène le complexe au degré d’oxydation +IV.44, 45 Les complexes mononucléaires de manganèse n’ont pas été considérés comme la meilleure stratégie pour une première étude systématique mécanistique devant la difficulté de synthèse et le caractère très labile de ces complexes, impliquant une faible stabilité du complexe en milieu aqueux et en fonction du pH. Même si le complexe [OsII(bpy)2py(H2O)]2+ que nous avons étudié n’est pas un complexe mimétique du PSII, dans le sens où il n’effectue pas l’oxydation de l’eau, il a l’avantage d’être soluble en milieu aqueux et stable sur une plage de pH étendue (de pH 1 à 13). L’étude de ce complexe a pour objectif d’apporter des éléments-clefs pour la compréhension des différents facteurs influençant la nature du PCET permettant d’atteindre des degrés d’oxydation élevés du métal.
I.A.2. Réactions de consommation de O
2et activité SOD
I.A.2.a. Réactions de consommation de O
2et réactions associées
Le dioxygène absorbé par les animaux est impliqué dans des réactions d’oxydation directe ou catalysées par les dioxygénases (exemple : lipogénases), les monoxygénases (exemple : cytochrome P450) et les oxydases (exemple : cytochrome c).46 Toutefois, ces processus produisent aussi par des réactions annexes des espèces oxydantes tel que le radical anion superoxyde O2 -. Les cellules impliquées dans les mécanismes de défense contre l’infection, comme les leucocytes et les macrophages, produisent également à partir du dioxygène des espèces oxydantes comme le superoxyde O2 - ou l’ion hypochlorite ClO - qui participent à la destruction des microorganismes.
Dans certaines conditions (concentration élevées de dioxygène, présence de radiation ionisante, situation pathologique…), l’oxydation du dioxygène produit une trop grande concentration en espèces oxydantes au sein de la cellule et conduit à une situation de stress oxydant. La cellule possède un moyen de défense : la superoxyde dismutase (SOD), métalloenzyme qui catalyse la dismutation du superoxyde en oxygène et peroxyde d’hydrogène, permettant ainsi de réguler le taux d’espèces oxydantes au sein de la cellule.
équation I-2
La dismutation de l’ion superoxyde est une réaction spontanée ayant une vitesse de réaction de 6.105 mol-1.L.s-1 à pH neutre. La présence des SOD au sein des cellules permet une élimination plus rapide de l’ion superoxyde (kdis(SOD)~108 mol-1.L.s-1) limitant ainsi le temps de vie de l’ion superoxyde au sein de la cellule.
Lorsque la régulation de la concentration des espèces oxydantes ne peut plus être assurée par les SOD, l’équilibre entre production des espèces radicalaires et production des défenses antioxydantes est alors rompu, pouvant impliquer de graves lésions cellulaires.47 Le superoxyde participe à la phase d’apparition de désordres neurologiques, comme les maladies de Parkinson, d’Alzheimer et de Hungtington, la sclérose latérale amyotrophique et la maladie du prion. Le superoxyde joue aussi un rôle dans les infections secondaires du SIDA, certaines allergies et les processus inflammatoires comme l’arthrite.47, 48
A travers toutes les maladies précédemment citées, l’étendue des applications potentielles d’un médicament ayant une action similaire à la SOD apparaît nettement. Ainsi, de nombreuses équipes s’attachent à comprendre le modèle naturel et développent des composés mimétiques ayant une activité catalytique non négligeable envers la dismutation du superoxyde.
I.A.2.b. La SOD : protection élaborée contre l’ion superoxyde.
Quatre types de SOD existent : les SOD cuivre-zinc, les SOD fer, les SOD manganèse et les SOD nickel. Un même organisme peut posséder des SOD différentes. Chez l’homme, trois formes de SOD ont été identifiées : deux SODs à cuivre-zinc cytoplasmique et extracellulaire et la SOD à manganèse mitochondriale.49
Le mécanisme de dismutation du superoxide commun aux quatre types de SOD est le suivant :
équation I-3 équation I-4
L’oxydation de O2 - est thermodynamiquement favorable (équation I-3), tandis que sa réduction en tant que telle est défavorable thermodynamiquement. Cependant la présence de la métalloenzyme protonée permet de faciliter la réduction de O2 -. Ainsi la réaction de réduction de O2 -
(équation I-4) nécessite au préalable l’oxydation de O2 -
(équation I-3).
Dans la suite de ce manuscrit, nous ne décrirons que la SOD à manganèse car celles-ci ont une portée thérapeutique possible plus pertinente que les autres SOD. En effet, l’ion Mn2+ est moins toxique que les ions Cu+, Fe2+ et Ni2+, ne donnant pas lieu, une fois décoordiné, à la réaction de Fenton, qui génère le redoutable radical hydroxyle. 48
équation I-5 : réaction de Fenton
La SOD à manganèse est largement répandue chez les plantes, les bactéries et les mitochondries des cellules de mammifères et de levures.50 Elle présente des homologies de séquence et de structure tridimensionnelle avec la SOD à Fer.50, 51 Le site actif se situe au fond d’un canal profond et étroit contenant des résidus chargés positivement créant un gradient électrostatique qui dirige le superoxyde jusqu’au centre métallique.46 Le centre
métallique est lié à 3 histidines (His 26, His 81 et His 171), un aspartate monodente (Asp167) et à une molécule d’eau H2O/OH-.50, 52 La SOD à manganèse adopte alors une géométrie de type bipyramide trigonal.50, 52 Les résidus glutamine (Gln 146) et tyrosine (Tyr 34) forment un réseau de liaison hydrogène stabilisant la forme MnIII de l’enzyme50, 52, 53 (voir Figure I-9).
Figure I-9 : Représentation du site actif de SOD à manganèse.52
Les atomes d’oxygènes sont représentés en gris foncé, les atomes d’azotes en gris clair.
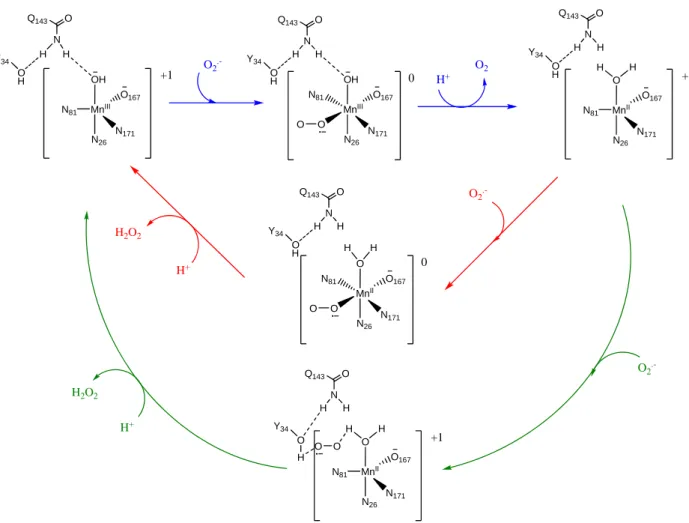
Lors de l’étape d’oxydation du superoxyde et de la réduction de MnIII en MnII, l’ion superoxyde coordinne le manganèse qui est de ce fait hexacoordiné. Le ligand hydroxyle joue le rôle d’accepteur de proton. Un transfert d’électron par sphère interne génère alors le dioxygène qui est libéré. La charge globale du site actif reste égale à +I. Lors de la réduction du superoxyde et de l’oxydation de MnII en MnIII, deux mécanismes sont envisagés dans la littérature. i) Un mécanisme dit de sphère interne : le manganèse II accueille à nouveau une molécule de superoxyde dans sa sphère de coordination. Le superoxyde y est réduit et reçoit deux protons, dont l’un provient du ligand aquo. ii) un mécanisme dit de sphère externe : le superoxyde ne coordine pas le centre métallique mais réagit avec la molécule d’eau de la sphère de coordination du MnIII. Dans les deux cas le départ du peroxyde d’hydrogène restaure l’état natif du SOD. Ces mécanismes sont représentés dans la Figure I-10.
MnIII N171
O167
N26 N81
OH N H H
O Q143
Y34 OH
O2.-
MnIII N171
O167
N26 OH N H H
O Q143
Y34 OH
N81 O O
+1 0 H+
O2
MnII N171
O167
N26 N81
O N H H
O Q143
Y34 O
H H H +1
O2.-
MnII N171
O167
N26 O N H H
O Q143
Y34 O H
N81 O O
0 H H H+
H2O2
MnII N171
O167
N26 N81
O N H H
O Q143
Y34
O H H +1
O O H
O2.- H2O2
H+
Figure I-10: Proposition de mécanismes de dismutation de O2.-
par le site actif de la SOD.
Voie rouge : mécanisme par sphère interne, voie verte : mécanisme par sphère externe.
Le potentiel apparent déterminé pour deux SOD à manganèse est compris entre 0,02 V vs ECS et 0,07 V vs ECS à pH 7.54 Le bon fonctionnement de la SOD à manganèse et de toutes les autres, réside dans le fait qu’à pH 7, son potentiel apparent est situé entre les potentiels apparents des couples O2/ O2.-
(-0,40 V vs ECS) et O2.-
/ H2O2 (0,65 V vs ECS). Les différents couples rédox sont représentés sur la Figure I-11.
E vs ECS (V)
1,0
0,5
0
- 0,5
O2/O2.- (-0,4V)
O2.-/ H2O2( 0,65V)
MnIII–SOD /MnII-SOD E.coli (0,07V)
MnIII–SOD / MnII-SOD B.stearothermophilus (0,02V) E vs ECS
(V) 1,0
0,5
0
- 0,5
E vs ECS (V)
1,0
0,5
0
- 0,5
O2/O2.- (-0,4V)
O2.-/ H2O2( 0,65V)
MnIII–SOD /MnII-SOD E.coli (0,07V)
MnIII–SOD / MnII-SOD B.stearothermophilus (0,02V)
Figure I-11 : Potentiels redox apparents des couples O2/O2.-
et O2.-
/ H2O2 et potentiel redox apparents de SODs à manganèse à pH 7 vs ECS.54
I.A.2.c. Les complexes biomimétiques de la SOD à manganèse
Etant donné l’implication du superoxyde dans un certain nombre de pathologies humaines, les modèles synthétiques ont des applications thérapeutiques potentiellement intéressantes. Des chimistes essaient de créer des systèmes fonctionnels ayant la même activité catalytique que l’enzyme en s’inspirant du modèle naturel, sans pour autant reproduire exactement sa structure.
Cependant un certain nombre de critères doivent être remplis par un composé mimétique du SOD pour qu’il soit potentiellement intéressant. Il doit avoir une bonne stabilité thermodynamique et un bon turn-over, posséder un potentiel apparent compris entre les potentiels rédox des couples O2/O2.- et O2.-/ H2O2, ne pas produire de radicaux hydroxyles via la réaction de Fenton lorsque le métal est sous forme libre, résister aux milieux acides ou réducteurs favorisant la dissociation des complexes ou oxydants susceptibles de dégrader le ligand, être stable vis-à-vis de la présence d’autres ions métalliques ou chélateurs biologiques et dans le but d’une utilisation thérapeutique, avoir une solubilité adaptée au type de tissu de la pathologie ciblée. Comme nous l’avons vu précédemment, le manganèse est le métal susceptible de former le complexe le moins toxique. La recherche sur les complexes biomimétique de SOD à manganèse est assez abondante. Parmi les mimes de superoxyde dismutase décrits dans la littérature, trois grands groupes se distinguent : les métalloporphyrines, les dérivés du « salen » et les complexes formés avec des ligands
cycliques polyamines.48 Les complexes formés avec des ligands cycliques polyamines semblent le mieux remplir les conditions nécessaires au composé mime du SOD exploitable thérapeutiquement.48
Des études cinétiques concernant le mécanisme catalytique des complexes formés avec des ligands cycliques polyamines montrent que l’étape cinétiquement déterminante est l’oxydation de MnII en MnIII.48 Tout comme dans le système naturel, deux mécanismes sont envisagés pour l’étape d’oxydation de MnII en MnIII : le mécanisme par sphère externe et le mécanisme par sphère interne dans lequel un site vacant sur le MnII est nécessaire à la fixation de l’ion superoxyde.
Le chapitre IV de ce manuscrit présente l’étude mécanistique de la réaction rédox réversible LMnII(H2O)/LMnIII(OH) effectuée sur un complexe de manganèse formé avec des ligands cycliques polyamines (complexe « mime » de la SOD). Le travail accompli dans le chapitre IV n’a pas pour but de répondre aux grandes questions mécanistiques sur la fixation de l’ion O2 - mais il a l’originalité de présenter une étude mécanistique et cinétique de la réaction d’oxydation LMnII(H2O)/LMnIII(OH) en milieu aqueux et en fonction du pH au moyen de l’électrochimie.
I.B. Description du transfert d’électron couplé au transfert de proton
Le transfert d’électron de ou vers une molécule est souvent accompagné d’un bouleversement moléculaire pouvant aller jusqu’à une coupure de liaison. C’est le cas pour un transfert de proton couplé à un transfert d’électron (PCET) : l’expulsion d’un électron implique la coupure de liaison X-H, où X est un atome lourd. La description d’un tel couplage a largement été décrite dans la littérature lorsqu’il implique la rupture de liaison entre deux atomes lourds.55, 56 En particulier, une théorie dite du transfert d’électron dissociatif a été proposée lorsque le couplage est si intime que le transfert d’électron et la coupure de liaison sont concertés.55 Mais cette théorie ne peut s’appliquer dans le cas d’un PCET, car le proton n’est pas assimilable à un atome lourd et possède des propriétés particulières. Cependant, une théorie décrivant le transfert d’électron couplé au transfert de proton a été proposée57-63 et récemment étendue au cas de l’électrochimie, c’est-à-dire lorsque l’électron est transféré de ou vers une électrode.64 Comme nous le verrons par la suite, cette théorie permet d’exprimer
la cinétique d’une réaction PCET en fonction du potentiel appliqué à l’électrode. Ainsi nous avons les outils en main pour d’étudier le PCET par une méthode électrochimique, telle que la voltamétrie cyclique. Cette approche présente en effet plusieurs avantages : (i) c’est une méthode non destructive, (ii) la multitude d’espèces oxydantes et réductrices qui serait nécessaire à l’étude d’une plage de potentiel, en vue de la caractérisation d’une relation activation-force motrice, est remplacée par la simple variation du potentiel de l’électrode de travail, (iii) le courant mesuré en fonction du potentiel est le reflet de la cinétique et du mécanisme mis en jeu (incluant la contribution de la diffusion des espèces partant de l’électrode ou allant vers celle-ci), (iv) les réactions aller et retour sont caractérisées simultanément.
Dans cette partie I.B, nous traiterons uniquement le cas d’une réaction d’oxydation impliquant le transfert d’un électron et d’un proton (notée 1e-, 1H+) en milieu aqueux ; ceci en vue de l’analyse des systèmes expérimentaux décrits dans les chapitres suivants. Dans un premier temps, la thermodynamique d’un tel système sera décrite. Puis dans un deuxième temps, nous exposerons les différents aspects mécanistiques de ce type de transfert ; c’est-à-dire les différents chemins réactionnels possibles. La loi cinétique propre à chaque chemin sera présentée dans un troisième temps. Enfin, dans une quatrième temps sera explicité le modèle cinétique global appliqué au transfert 1e-, 1H+ et permettant d’analyser les résultats expérimentaux décrits dans la suite de ce manuscrit.
I.B.1. Caractérisation thermodynamique d’un transfert 1e
-, 1H
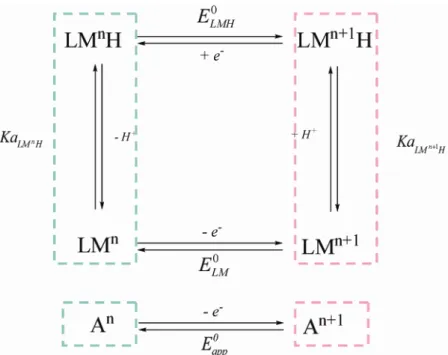
+Ce type de réaction est communément représenté par un schéma carré. La Figure I-12 représente le schéma carré pour un transfert 1e-, 1H+ appliqué à un complexe métallique (les ligands du complexe sont notés L, le symbole du métal M, le degré d’oxydation du métal n).
Le complexe métallique présente à la fois un caractère électroactif et acido-basique. Il est alors susceptible d’échanger un proton avec une espèce acido-basique non électroactive présente dans le milieu (nommée Z/ZH+ par la suite quand bien même la base Z serait chargée). ELMH0 et ELM0 représentent respectivement les potentiels standards des espèces protonées et déprotonées. KaLM Hn et KaLMn+1H représentent respectivement les constantes d’acidité des espèces réduites et oxydées.
Figure I-12 : Schéma carré présentant les différentes espèces lors d’un transfert 1e-, 1H+.
En considérant les équilibres entre les différentes espèces du schéma carré, il est aisé de montrer que celui-ci est thermodynamiquement équivalent à une réaction globale rédox dans laquelle An représente l’ensemble des espèces réduites et An+1, l’ensemble des espèces oxydées. Cette réaction globale est alors caractérisée par un potentiel standard apparentEapp0 . La dépendance du potentiel standard apparent en fonction du pH est classiquement représentée par un diagramme de Pourbaix indiquant le potentiel standard en fonction du pH (Figure I-13). Ce type de diagramme permet de définir les domaines d’existence des différentes espèces rédox et protonées.
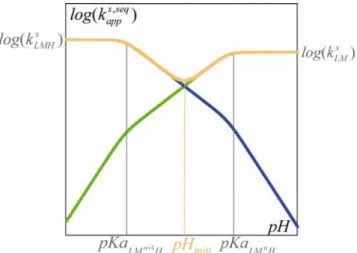
Figure I-13 : Diagramme de Pourbaix pour un transfert 1e-, 1H+.
Pour le système présenté, le diagramme de Pourbaix (Figure I-13) présente pour des pH inférieurs à pKaLMn+1H, un potentiel standard apparent constant en fonction du pH caractéristique du couple électrochimique LMn+1H /LM H . De même, pour un pH supérieur n àpKaLM Hn , le potentiel standard apparent constant en fonction du pH est caractéristique du couple rédox LM /n LMn+1. Pour les pH compris entre pKaLMn+1H etpKaLM Hn , la variation du potentiel standard apparent en fonction du pH est caractéristique du système électrochimiqueLMn+1/ LM H et correspond donc à un PCET. Le potentiel standard apparent n varie alors en fonction du pH avec une pente égale à RT ln10
− F / unité pH (soit –59,2 mV à T
= 298 K). Ce potentiel standard apparent peut être exprimé en fonction de pKaLM Hn ,
1
LMn H
pKa + , ELMH0 et ELM0 :
1
1
0 0
0 ln
2
n n
n n
LMH LM LM H LM H
app
LM H LM H
H Ka
E E RT Ka
E F Ka H Ka
+
+
+ +
⎛ ⎛ ⎞⎛ ⎡ ⎤ + ⎞⎞
+ ⎜ ⎜ ⎣ ⎦ ⎟⎟
= + ⎜⎝ ⎜⎜⎝ ⎟⎟ ⎜⎠ ⎣⎝⎡ ⎤ +⎦ ⎟⎠⎟⎠
équation I-6
Dans ce cas de figure (lorsque le mécanisme correspond à un PCET), il est légitime de s’interroger sur la façon dont s’effectue microscopiquement le transfert de l’électron et du proton. Y a-t-il un ordre pour ces deux transferts ? Les transferts peuvent-ils s’effectuer simultanément ?
I.B.2. Aspects mécanistiques : dualité mécanisme concerté / séquentiel pour un PCET.
D’un point de vue microscopique, pour effectuer la réaction de PCET, plusieurs chemins réactionnels sont possibles. Deux types de mécanismes sont envisagés : un mécanisme séquentiel où électron et proton sont transférés dans des étapes élémentaires distinctes et un mécanisme concerté où électron et proton sont transférés dans la même étape élémentaire.
Dans la suite, et pour l’ensemble de ce manuscrit, nous ne considérerons que des réactions en milieu aqueux et nous nous intéresserons à des réactions d’oxydation.
Le mécanisme séquentiel pour un PCET en milieu aqueux a été décrit analytiquement par Laviron dans les années quatre-vingts.65-67 Cependant, des résultats expérimentaux obtenus avec des composés tels que le galvinol,68 le [Ru(bpy)2py(H2O)]2+,69 le complexe [Os(bpy)2(4-
py-NH2)(H2O)]2+ 42, 43 présentent une divergence par rapport au modèle cinétique décrit par Laviron. Afin de rendre compte de ces déviations par rapport au mécanisme séquentiel, un autre mécanisme a donc été envisagé : le mécanisme concerté.
Figure I-14 : Mécanismes pour un transfert de proton couplé à un transfert d’électron.
Le mécanisme EPT est représenté par la couleur bleue. Le mécanisme PET est représenté par la couleur verte. Le mécanisme CPET est représenté par la couleur rouge. Z et ZH+ sont les espèces acido-basiques
du tampon présent en solution.
Le mécanisme séquentiel implique deux chemins réactionnels possibles tous deux composés de deux étapes réactionnelles. L’électron et le proton sont transférés dans des étapes différentes, impliquant le passage par des intermédiaires réactionnels. Un tel mécanisme est classiquement représenté sous la forme du schéma carré (Figure I-14).
Pour ce type de mécanisme, l’étape cinétiquement déterminante est l’étape de transfert d’électron. En effet, l’étape de protonation/déprotonation est considérée comme rapide car il est admis que les transferts de protons sont à l’équilibre en milieu aqueux. Toutefois, il est nécessaire de garder à l’esprit que dans certains cas, comme par exemple lorsque la réaction a lieu à un pH très éloigné des pKas, le transfert de proton peut ne plus être à l’équilibre ce qui doit être pris en compte dans le modèle cinétique.
Quand le transfert d’électron précède le transfert de proton, le chemin est appelé EPT (chemin de couleur bleu sur Figure I-14). Il est caractérisé par les constantes thermodynamiques
1
LMn H
pKa + et ELMH0 . La cinétique du transfert d’électron de ce chemin est alors décrite par la loi de Butler-Volmer caractérisée par une constante de vitesse standard kLMHs et un coefficient
de transfert. Lorsque le transfert de proton est suivi du transfert d’électron, le chemin est nommé PET (chemin de couleur verte sur Figure I-14). Il est caractérisé par les

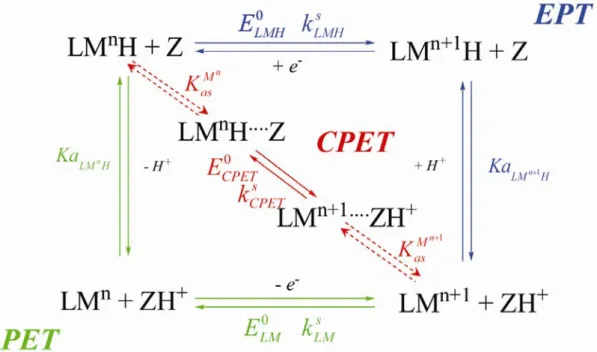

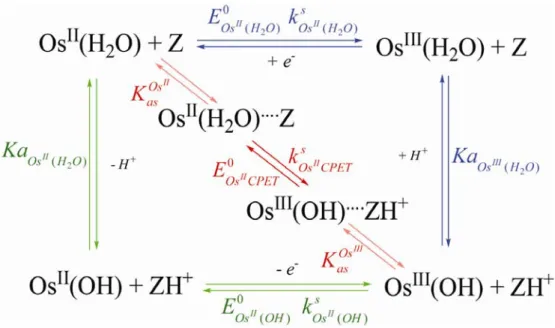
 en tampon Britton Robinson](https://thumb-eu.123doks.com/thumbv2/1bibliocom/473936.76648/77.892.168.727.104.781/figure-voltamétrie-cyclique-première-oxydation-complexe-britton-robinson.webp)