65 5.1- Avaliação da atividade fagocitária antipromastigota de Leishmania chagasi em neutrófilos e monócitos do sangue periférico de cães vacinados com Leishmune®. 83 5.5- Avaliação do perfil de citocinas intracelulares em monócitos do sangue periférico de cães vacinados com Leishmune®. 87 5.6- Avaliação do perfil de citocinas intracelulares em linfócitos do sangue periférico de cães vacinados com Leishmune®.
CD80 em monócitos do sangue periférico de cães nos grupos não vacinados (T0), um mês (T1), seis meses (T6) e doze meses após a vacinação (T12).
INTRODUÇÃO
Objetivo Geral
Objetivos Específicos
REVISÃO DA LITERATURA
Leishmanioses: epidemiologia, conceito e transmissão
Os pacientes com LV geralmente apresentam sintomas como febre, hepatoesplenomegalia, perda de peso, linfadenopatia, anemia e leucopenia (Badaro et al., 1986). No intestino, os parasitas causam infiltração local ou difusa de macrófagos não parasitados e outras células do sistema imunológico, que causam os sinais e sintomas da doença, principalmente hepatoesplenomegalia, linfadenopatia e leucopenia (Deane & Grimaldi Jr, 1985; . Badaro e outros e outros, 1986). A alta taxa de cães assintomáticos representa outro fator epidemiologicamente relevante, pois esses animais desempenham um papel ativo na cadeia de transmissão da doença (Berrahal et al., 1996; Gradoni, 2001).
Já os cães podem permanecer infectados de forma assintomática, desenvolver sinais clínicos mais leves e serem classificados como oligossintomáticos, ou desenvolver uma infecção sintomática que pode levar à morte (Mancianti et al., 1988).
Medidas de controle
Um fator complicador adicional é a relutância dos proprietários em sacrificar cães infectados, mais frequentemente nos casos em que o animal está livre de sintomas. Com isso, alguns proprietários transferem seus cães para outras residências na tentativa de burlar a campanha de controle sanitário, o que gera o risco de novos surtos da doença em áreas antes não afetadas (Lainson; Rangel, 2005). Esses autores não conseguiram curar cães infectados com antimônio pentavalente e diamidina aromática, então sugeriram realocar os cães ou removê-los como uma alternativa bem-sucedida para o controle da doença.
Por isso, medidas menos radicais do que a eliminação dos cães soropositivos devem ser buscadas para resolver o problema do controle da leishmaniose em relação aos reservatórios da doença.
Imunologia das Leishmanioses
Pinelli et al (1999) demonstraram em cães uma diminuição na expressão de moléculas co-estimuladoras na superfície de macrófagos infectados com L. Sua capacidade de inibir respostas do tipo Th1 suprimindo a síntese de IL-12, interrompendo a produção de IFN- de macrófagos. , células B e DCs (D'Andrea et al., 1993). Uma citocina associada ao quadro sintomático da leishmaniose é o TGF-β, que pode estar associado à diminuição da atividade das células NK, expressão de TNF- e IFN- e redução da produção de óxido nítrico (Omer; . Kurtzhals; Riley, 2000; Vodovotz et al ., 1993).
Imunoglobulinas do tipo IgG1 têm sido relacionadas à suscetibilidade e progressão da doença; enquanto IgG2, a resistência natural ao LVC ou cães vacinados (Deplazes et al., 1995; Nieto et al., 1999).
Vacinas contra Leishmaniose
Além disso, é desejável que uma imunobiologia contra LVC seja capaz de controlar a parasitemia tecidual, evitando a transmissão para flebotomíneos, além de ser de baixo custo e fácil produção em larga escala (Reis et al., 2010). Apenas 0,01% dos cães apresentaram reação alérgica após a terceira dose, e todos os efeitos adversos desapareceram naturalmente antes da administração da próxima dose da vacina, indicando tolerância a ela (Parra et al., 2007). Seus resultados indicam que Leishmune® estimulou forte imunogenicidade, demonstrada pela sororreatividade, reação intradérmica positiva e pelo aumento da população de células CD8+ e CD21+ no grupo de cães vacinados (Borja-Cabrera et al., 2008).
Ao mesmo tempo, na resposta imune adaptativa, foram relatadas alterações fenotípicas, indicando ativação de células T CD4+ e células T CD8+ com aumento seletivo de células CD3+CD5+lowCD8+ (Araújo et al.
Animais
Todos os cães participantes dos grupos T1, T6 e T12 eram primos vacinados com Leishmune® conforme protocolo de imunização recomendado pelo fabricante (três doses com intervalo de 21 dias entre elas). O estudo foi realizado de forma transversal, de forma que cada cão participou de apenas uma coleta e consequentemente de apenas um grupo. Todos os procedimentos descritos neste trabalho foram aprovados pelo Comitê de Ética no Uso de Animais CEUA - FIOCRUZ (PROTOCOLO nº P-71/11-3).
Amostras
Obtenção de formas promastigotas de Leishmania chagasi
Uma vez que a cultura foi aprovada para esses requisitos, os parasitas foram transferidos para tubos cônicos de polipropileno de 50 ml (Falcon®, Becton Dickinson - BD, EUA) e a suspensão foi submetida a centrifugação diferencial a 10 x g por 10 min em temperatura ambiente para remover os contaminantes como aglomerados de parasitas no sedimento. Em seguida, adicionou-se 20 ml de tampão fosfato salino PBS 0,015M, pH 7,4 - PBS (SIGMA, EUA) suplementado com 10% FBS, homogeneizou-se com movimentos circulares e a suspensão celular foi centrifugada a 357 x g por 7 minutos a 18ºC.
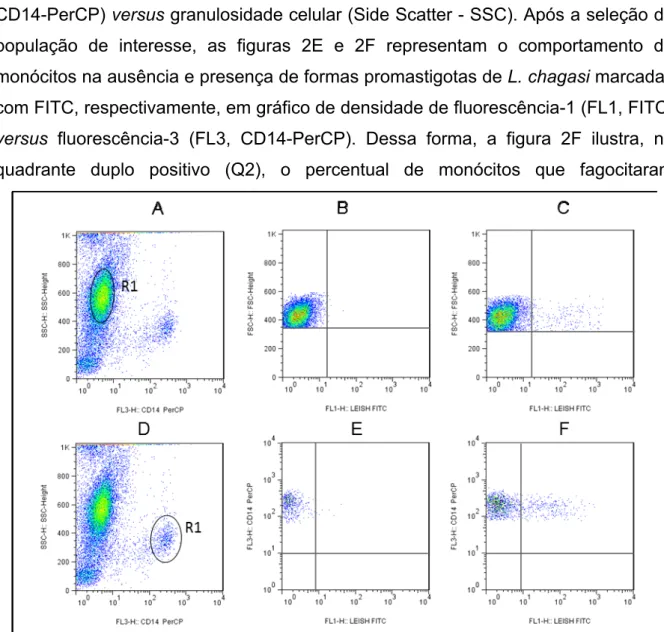
Avaliação da capacidade fagocítica anti-promastigotas de Leishmania chagasi
- Marcação de L. chagasi com Isoticianato de fluoresceína (FITC) e
- Ensaios de fagocitose de formas promastigotas de Leishmania chagasi
- Avaliação do perfil de expressão de marcadores de superfície celular em
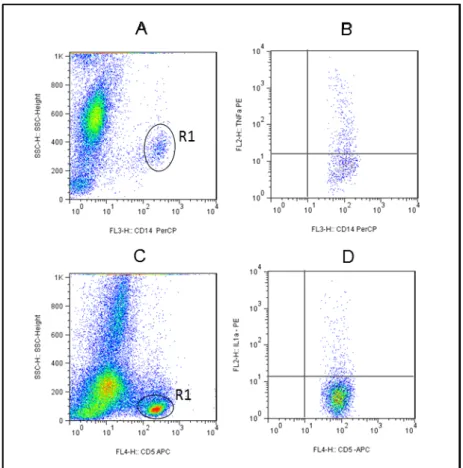
Em seguida, o sangue coletado em heparina sódica foi transferido para tubo cônico de polipropileno de 15 ml (FALCON® – BECTON DICKINSON) e centrifugado por 10 minutos a 664 x g, temperatura 18 °C. Após a adaptação, a suspensão celular obtida de cada animal foi incubada com parasitas vivos marcados com FITC (conforme descrito na seção 4.1) na relação parasita/célula estabelecida de 1/2, com meio RPMI na presença de 2% de plasma autólogo, para Tubos de cultura de 14 ml de polipropileno (FALCON® – BECTON DICKINSON), por uma hora com agitação constante em homogeneizador hematológico (Hemoquímica Mod. H1, Brasil), em estufa a 37 °C contendo 5% de CO2. 150 µL de amostras de cultura obtidas em ensaios de fagocitose (conforme descrito na seção 4.4.2) foram transferidos para tubos cônicos de poliestireno de 5 mL (FALCON® – BECTON DICKINSON) contendo 2 L de anticorpos contra a.
As amostras foram cuidadosamente homogeneizadas e após 30 minutos de incubação em temperatura ambiente e protegidas da luz, foram submetidas à lise eritrocitária utilizando 3 mL de solução comercial de lise (FACS LISYNG SOLUTION – BECTON DICKINSON) diluída dez vezes em água destilada, sob vórtex e incubadas por 10 minutos nas mesmas condições descritas. Em seguida, as amostras foram centrifugadas a 400 x g, temperatura de 18oC por 7 minutos, os sobrenadantes foram descartados e as células ressuspensas por vórtex em baixa velocidade. Por fim, o sobrenadante foi descartado, as células ressuspensas por vórtice e fixadas com 200 L de solução fixadora para citometria - MFF (MaxFacsFix - 10 g/L paraformaldeído, 1% cacodilato de sódio, 6,67 g/L cloreto de sódio, pH 7,2).
O volume de 1300 µL das culturas obtidas nos ensaios de fagocitose (conforme seção 4.4.2) foi transferido para tubos cônicos de polipropileno de 14 mL (FALCON® – BECTON DICKINSON) e 7 µL de cada um dos anticorpos monoclonais anti-CD14 (para monócitos identificação) e anti-CD-5 (para marcação de linfócitos T). As amostras foram então cuidadosamente homogeneizadas e, após 30 minutos de incubação dos tubos em temperatura ambiente e ao abrigo da luz, foram submetidas à lise de eritrócitos, para a qual foram diluídos dez vezes 6 ml de solução comercial de lise (FACS LISYNG SOLUTION – BECTON DICKINSON) em água destilada em vórtex e incubados por 10 minutos nas mesmas condições descritas. Em seguida, as amostras foram centrifugadas a 400 x g a 18oC por 7 minutos, os sobrenadantes foram descartados, as células foram ressuspensas por vórtex em baixa velocidade.
A placa foi submetida à centrifugação a 400 x g, temperatura de 18°C por 7 minutos, os sobrenadantes foram então descartados e as células ressuspensas em vórtex em baixa velocidade. Por fim, o sobrenadante foi descartado, as células ressuspensas em vórtice e fixadas com 200 µL de solução fixadora para citometria - MFF e as suspensões celulares foram transferidas para microtubos de poliestireno de 500 µL (FALCON® – BECTON DICKINSON).
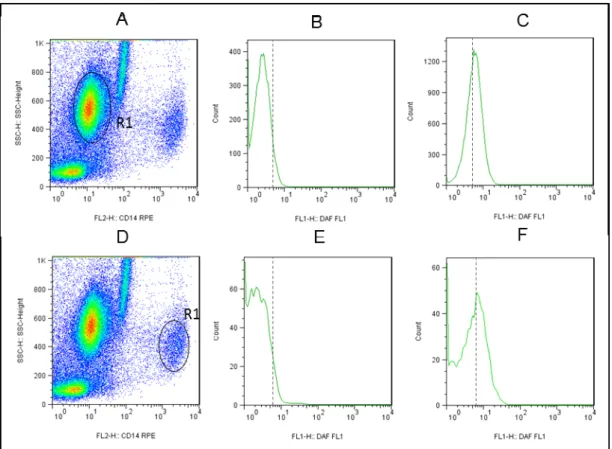
Avaliação da expressão de óxido nítrico intracelular em neutrófilos e monócitos do sangue
54 Por fim, os tubos foram centrifugados a 400 x g, 18°C por 7 minutos, os sobrenadantes foram descartados e 200 μl de solução fixadora para citometria - MFF foram adicionados às células já ressuspensas. Os tubos foram condicionados a 4°C por até 24 horas e um total de 50.000 eventos foram avaliados para coleta de dados usando um citômetro de fluxo FACSCalibur (Becton Dickson - BD, EUA).
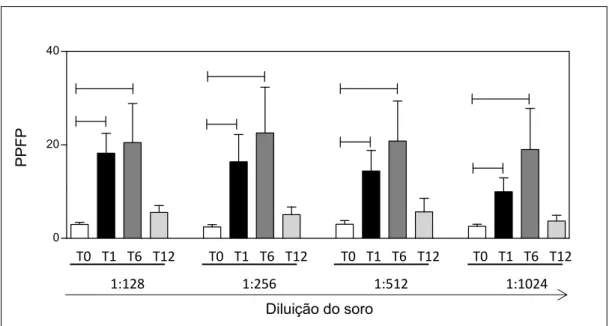
Pesquisa de anticorpos anti-promastigotas fixadas de Leishmania chagasi (AAPF)
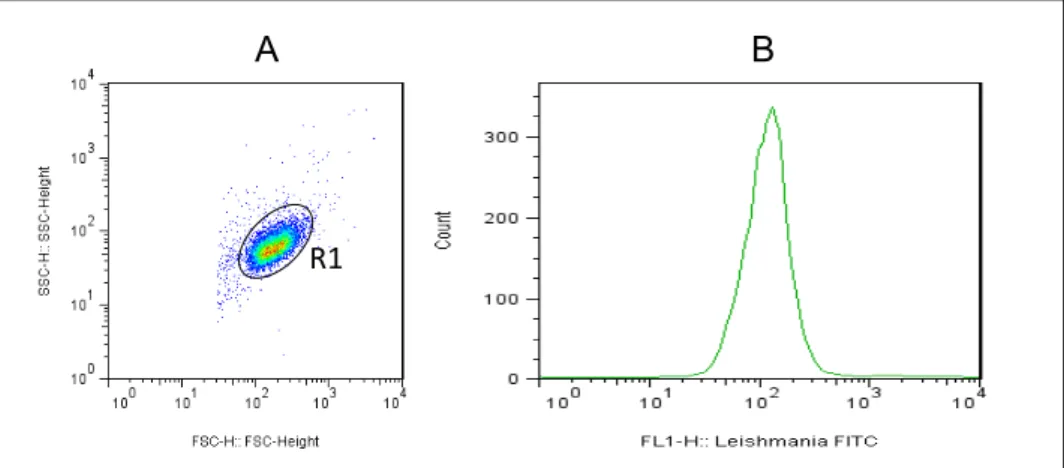
Obtenção e análise de dados por citometria de fluxo
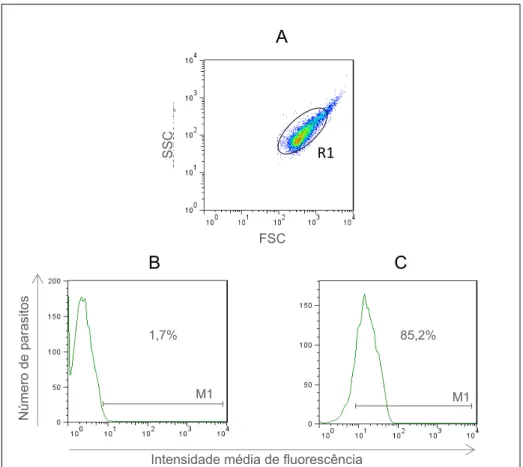
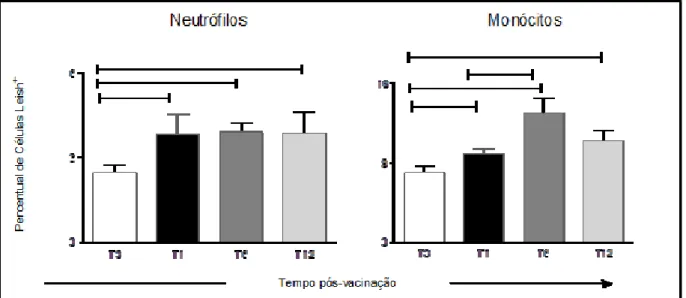
5.1- Avaliação da atividade fagocitária contra promastigotas de Leishmania chagasi em neutrófilos e monócitos do sangue periférico de cães vacinados com Leishmune®. 70 5.2- Avaliação dos níveis intracelulares de óxido nítrico em neutrófilos e monócitos do sangue periférico de cães vacinados com Leishmune®. 5.2.1- Avaliação dos Níveis Intracelulares de Óxido Nítrico em Neutrófilos e Monócitos no Sangue Periférico de Cães Vacinados com Leishmune®.
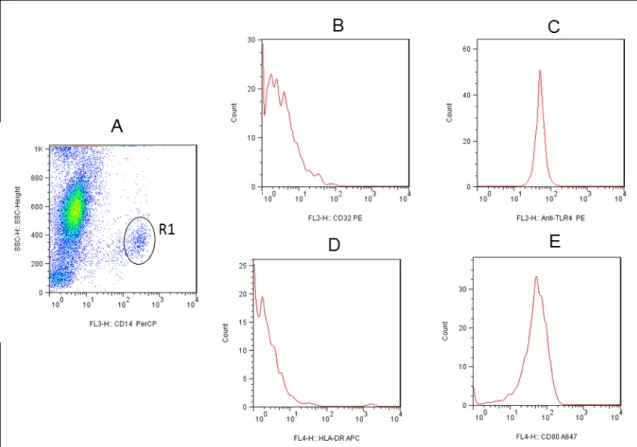
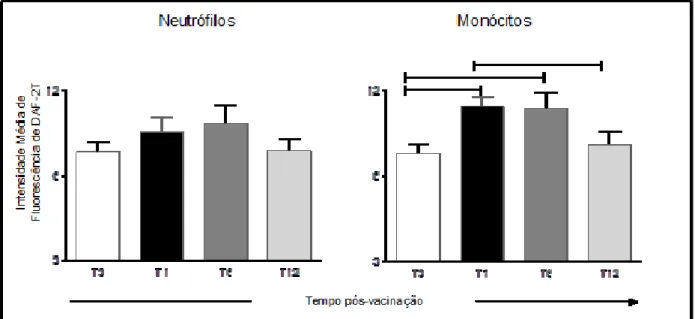
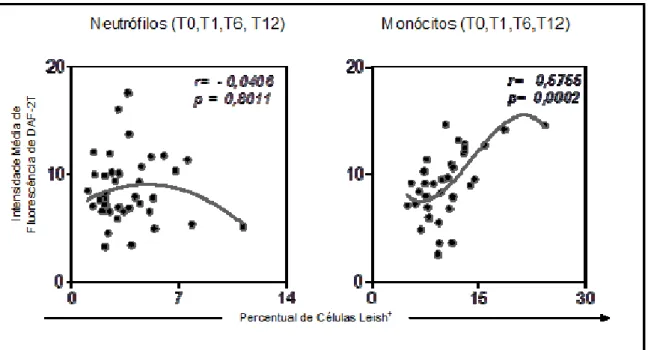
Neste trabalho, os resultados referentes ao perfil de expressão do óxido nítrico intracelular produzido por neutrófilos e monócitos do sangue periférico foram analisados na forma de "intensidade média de fluorescência (IMF)" da densidade de expressão DAF-2T (FL1) de populações celulares de interesse, em culturas com L. 5.2.2- Correlação entre atividade fagocitária anti-promastigota de Leishmania chagasi e níveis de óxido nítrico intracelular em neutrófilos e monócitos do sangue periférico de cães vacinados com Leishmune®. 5.4- Avaliação do impacto da imunização com Leishmune® no perfil de expressão de moléculas relacionadas ao processo de interação fagócito-parasita (CD32 e Tol), molécula de ativação (MHC II) e molécula de coativação (CD80) em monócitos do sangue periférico de cães vacinados.
5.4.2.2- Avaliação da correlação entre a atividade fagocitária anti-promastigota de Leishmania chagasi e a expressão de TLR2 e TLR4 por monócitos de sangue periférico de cães vacinados com Leishmune®. Avaliação da correlação entre a atividade fagocítica anti-promastigota de Leishmania chagasi e a expressão de TLR2 e TLR4 de monócitos sanguíneos. A avaliação da correlação entre o nível de óxido nítrico intracelular e a expressão de TLR5 e TLR9 em monócitos do sangue periférico de cães foi realizada por meio do teste de Pearson.
Neste trabalho, os resultados relacionados à expressão da molécula de ativação (MHC II) e da molécula de coativação (CD80) em monócitos do sangue periférico foram avaliados na forma de "intensidade média de fluorescência (IMF)". 5.5- Avaliação do perfil de citocinas intracelulares em monócitos do sangue periférico de cães vacinados com Leishmune®. 86 5.5.1 Avaliação do perfil de expressão intracelular de citocinas (IL-8, IL-1α, IL-12, TNF-α e IL-4) em monócitos do sangue periférico de cães vacinados com Leishmune®.
Neste trabalho, os resultados referentes ao perfil de expressão de citocinas intracelulares de monócitos do sangue periférico são avaliados na forma de. Além disso, a expressão do receptor de imunoglobulina Fc II (CD32) nos monócitos do sangue periférico de cães vacinados também aumentou um e seis meses após a vacinação. Monócitos de animais vacinados com Leishmune® apresentaram aumento da expressão de receptores Toll-like (TLR2, TLR4), que apresentaram correlação positiva com atividade fagocitária contra promastigotas de Leishmania.