Material para coleta de amostras para diagnóstico de doenças do aparelho respiratório Amostras para diagnóstico de doenças do aparelho respiratório. Material para coleta de amostras para diagnóstico de doenças do sistema osteoarticular Amostras para diagnóstico de doenças do sistema osteoarticular. Material para colheita de amostras para diagnóstico de doenças do sistema nervoso central (SNC) Amostras para diagnóstico de doenças do sistema nervoso central (SNC).
Material para coleta de amostras para diagnóstico de doenças das abelhas Apis mellifera Garantindo a segurança.

2 - Equipamentos para contenção dos animais
3 - Identifi cação do animal e da amostra
4 - Descarte de material
5 - Acondicionamento para remessa de amostras para diagnóstico
Na parte externa da tampa da caixa isotérmica, afixar um pedido de inspeção devidamente preenchido e colocado em um saco plástico transparente. Feche bem a caixa isotérmica e coloque-a na embalagem terciária, que deve estar rotulada de acordo com as normas nacionais e internacionais. Telefone de emergência Marque “UN 3373” na superfície externa da embalagem terciária para que possa ser visto e lido.
Colocar o recipiente na caixa isotérmica (embalagem intermediária), que por sua vez deve ser colocada na embalagem terciária (externa).
Pontos importantes no preenchimento da Requisição de Exames
Nome completo (sem abreviações) e endereço do proprietário do animal suspeito
Nome completo da propriedade ou estabelecimento onde foi colhida a amostra
Localização que facilite o acesso à propriedade citada
Nome completo (sem abreviações) e endereço do responsável pelo encaminhamento da amostra. Deverá constar um número
O responsável pelo preenchimento do formulário e envio da amostra deverá ser um profi ssional devidamente habilitado
Informar o número de animais existentes na propriedade, quantos animais apresentaram sinais clínicos semelhantes e
Informar quais amostras foram remetidas e conservante utilizado
6 - Requisição de exames
Alguns pontos importantes no preenchimento da Requisição de Exames Para Síndrome Neurológica
- Nome da propriedade ou estabelecimento onde foi colhida a amostra
- Endereço da propriedade ou estabelecimento onde foi colhida a amostra (incluir localização que facilite o acesso à
- Nome completo (sem abreviações) e endereço e telefone do proprietário do apiário
- Nome completo (sem abreviações), endereço e telefone do responsável pelo encaminhamento da amostra
- Preencher um formulário por colmeia
- Informar todos os tipos de amostras colhidas em cada colmeia, com as observações pertinentes
- Caso o apicultor não adote marcação permanente nas colmeias, fazer marcação em cada uma das colmeias de
- Detalhar o manejo de alimentação suplementar adotado pelo apicultor (incluindo época de fornecimento às abelhas)
- Caso o apicultor pratique apicultura migratória, indicar os locais para os quais as colmeias são deslocadas em cada época do ano
- Informar se outros apicultores têm colmeias na mesma propriedade
- Utilizar o verso do formulário para outras observações que considerar importantes e não contempladas pelos
INFORMAÇÕES MÍNIMAS NECESSÁRIAS PARA O ENVIO DE AMOSTRAS PARA O DIAGNÓSTICO DAS CODOENÇAS Apis mellifera. Não se esqueça de indicar o local dentro da colmeia onde foi recolhido o pedaço de pão de gengibre.
RUMINANTES, EQUÍDEOS E
SUÍDEOS
Sangue
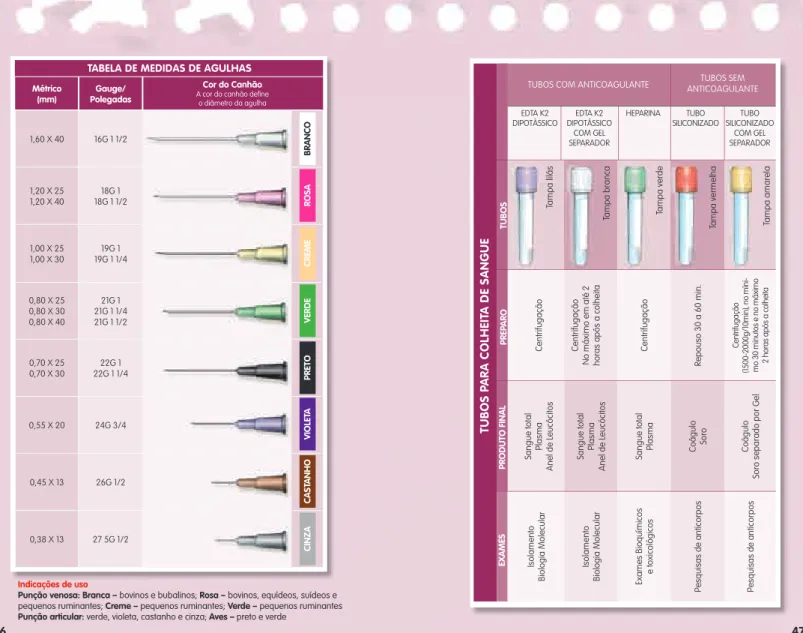
- Rosquear a agulha no adaptador. Retirar a capa protetora da agulha somente no momento da
- Realizar antissepsia do local escolhido para punção; passar algodão embebido em álcool a
- Retirar a capa da agulha e fazer o garrote;
- Puncionar a veia; (fi gura c)
- Introduzir o tubo no adaptador, pressionando-o até o limite; (fi guras d e e)
- Esperar o sangue parar de fl uir para dentro do tubo, só então retirar o tubo, assegurando a
- Separar a agulha do adaptador e descartá-la em recipiente para perfuro-cortantes
- Movimentar o êmbolo da seringa (para frente e para trás) para retirar o ar; (fi gura b)
- Fazer a antissepsia do local escolhido para punção;
- Retirar a capa da agulha e fazer o garrote;
- Introduzir a agulha na veia e puxar o êmbolo da seringa lentamente, para que o sangue possa fl uir; (fi gura c)
- Soltar o garrote após a venopunção;
- Separar a agulha da seringa. Descartar a agulha em recipiente para perfuro-cortantes (fi gura d)
- Transferir o sangue da seringa para um tubo de ensaio com ou sem anticoagulante. Para evitar hemólise, o
Mova o êmbolo da seringa (para frente e para trás) para retirar o ar; (figura b) costas) para retirar o ar; (figura b). Insira a agulha na veia e puxe o êmbolo da seringa lentamente para que o sangue possa fluir; (figura c) lentamente, para que o sangue possa fluir; (figura c) 6. Tubos com anticoagulante com volume insuficiente ou com excesso de sangue alteram a correta relação sangue/aditivo, podendo levar a hemólise e resultados incorretos.
Não centrifugar a amostra de sangue em tubo para obtenção de soro antes do término da retirada da coagulação, pois a formação do coágulo ainda não está completa, o que pode levar à ruptura celular.
Principais doenças de pele e mucosas e espécies acometidas
Pele e mucosas
Material para colheita de amostras para diagnóstico de
Uma hora antes da coleta, realize os movimentos para a coleta do LEF. Coloque o coletor na boca do animal. Momento crítico até a chegada ao laboratório Colher com uma zaragatoa estéril. esfregue vigorosamente o local Tubo de ensaio estéril. Preferencialmente na área de transição com e sem lesão.. de acordo com o tamanho do fragmento.
Fragmentos em solução de formol a 10%, mesmo que não totalmente fixados, podem ser enviados ao laboratório.
Sistema respiratório
Principais doenças do sistema respiratório e espécies acometidas
Material para coleta de amostras para diagnóstico de amostras para diagnóstico de doenças do aparelho respiratório. Fragmentos em solução de formol a 10%, mesmo que não totalmente fixados, podem ser enviados ao laboratório b) Histopatologia. Amostras para o diagnóstico de. doenças do aparelho respiratório b) fragmentos de 3x1x1 cm de cada órgão a) fragmentos de 20 g e cabelos.
O soro sanguíneo pode ajudar a diagnosticar algumas doenças respiratórias; portanto, enviar o soro junto com o material para exame direto pelo agente.
Principais doenças do sistema gastrintestinal e espécies acometidas
Sistema gastrintestinal
Material para coleta de amostras para o diagnóstico de amostras para o diagnóstico de doenças do sistema gastrointestinal. Inserir a sonda gástrica pela boca e retirar o fluido ruminal, criando vácuo por sistema manual ou bomba elétrica. No caso da ruminocentese, a punção é feita no abdome esquerdo do animal, no ponto médio entre a última costela e a articulação femorotibiopatelar.
No caso de material de autópsia, enviar um fragmento de alça intestinal com o conteúdo fecal, amarrar as pontas com barbante. Além disso, enviar fragmentos de fígado e rim, uma parte refrigerada para estudos toxicológicos e a outra parte em formol a 10% para estudos histopatológicos. Se for utilizado um tubo com gel de separação, . será necessário centrifugar. sangue pelo menos 30 minutos após a coleta e não mais que 2 horas e enviar o soro para o próprio tubo. Que).
Principais doenças do sistema reprodutor e urinário e espécies acometidas
Sistema reprodutor e urinário
Material para colheita de amostras para diagnóstico de doenças do
Fragmentos em solução de formol a 10%, mesmo que não totalmente fixados, podem ser encaminhados ao laboratório a) Fazer. Tricotomize o prepúcio e lave externamente o prepúcio apenas com água e seque com papel toalha. Colete o muco inserindo um bastão estéril preso a uma pipeta IV no prepúcio.
Lave a cavidade prepucial com uma pipeta de inseminação artificial acoplada a um tubo flexível conectado a uma seringa com 40 ml de soro fisiológico 0,85% estéril. Insira a pipeta no fundo da cavidade prepucial e injete o volume total da solução salina. Retire a pipeta e esfregue o óstio prepucial com uma das mãos e massageie o prepúcio vigorosamente por um minuto com a outra.
Encaixe o swab em uma pipeta de inseminação artificial e insira o swab na vulva até o colo do útero usando um espéculo. O uso de um espéculo é essencial para obter uma amostra de boa qualidade do muco cervicovaginal. Bactérias c) Teste de Tritrichomonas foetus a) Teste. Antes da colheita, limpe a vulva ou o prepúcio com água e sabão, enxágue e seque com papel toalha.
Indução da micção em touros por massagem suave e rítmica do prepúcio e em vacas por massagem na vulva.
Principais doenças dos sistemas circulatório e linfático e espécies acometidas
Sistemas circulatório e linfático
Material para colheita de amostras para diagnóstico de doenças dos
- Manter a lâmina horizontalmente entre o polegar e o indicador
- Colocar uma pequena gota de sangue sem anticoagulante na extremidade da lâmina. (fi gura a)
- Movimentar a lâmina para trás, de modo que entre em contato com a gota de sangue, pressionando-a até que a
- Secar rapidamente ao ar e identifi car com lápis
- Fixar por dois minutos em álcool metílico, retirar e secar
- Enviar ao laboratório em porta-lâminas
Autópsiar o animal e coletar os fragmentos com tesoura ou bisturi e pinça estéreis, evitando danos teciduais durante a retirada. Fragmentos em solução de formol a 10%, mesmo que não totalmente fixados, podem ser encaminhados ao laboratório a). Tecidos fixados em formaldeído Fragmentos de órgãos. que serão encaminhados ao laboratório, fixados em formol. individualmente para encontrar agentes causadores Íleo terminal.
Coloque uma pequena gota de sangue sem anticoagulante na borda da lâmina. fig a) anticoagulante na borda da lâmina. Colocar uma segunda lâmina (extensor) contra a superfície da lâmina, à frente da gota de sangue, num ângulo de 45º. Mova a lâmina de volta para que entre em contato com a gota de sangue, pressione-a até que entre em contato com a gota de sangue, pressione-a até que a gota se espalhe por toda a borda da lâmina. A sensibilidade da técnica pode ser aumentada tirando-se esfregaços de sangue da punção dos capilares na ponta da orelha.
Principais doenças do sistema osteoarticular e espécies acometidas
Sistema osteoarticular
Material para coleta de amostras para diagnóstico de doenças para diagnóstico de doenças.
2º Tricotomia e desinfecção do local da punção; 3ª Conter o animal para evitar movimentos bruscos;. uso de seringas com agulhas de 0,8 mm de diâmetro e 40 mm de comprimento para as articulações escapuloumeral e coxofemoral e com agulhas mais curtas para as articulações do carpo e do tarso; 5º Em seguida, dividir a amostra em um tubo com anticoagulante, para exame citológico e outro tubo sem anticoagulante, para exame direto do agente; Punção da articulação do carpo em ovelha com artrite. Punção da articulação do carpo.
Principais doenças do sistema nervoso central e espécies acometidas
Sistema nervoso central (SNC )
3º passo: cortar a dura-máter com tesoura e retirar o encéfalo cortando os nervos cranianos 4º passo: enviar todo o encéfalo com a medula espinhal cervical e montagem pituitária, trigêmeos e rede admirável carótida (capilares ao redor da hipófise). Momento crítico de chegada ao laboratório Saco plástico ou garrafa; capacidade de acordo com o tamanho do órgão. Nunca congele, pois o laboratório irá dividir as porções para os diversos exames e ainda fixar uma porção em formol.
Corte os pedúnculos do cerebelo, um de cada vez, inserindo uma lâmina de corte rostral e horizontalmente entre o tronco cerebral e o cerebelo. Separação do tronco cerebral Corte o tronco cerebral do resto do cérebro, ao nível do tálamo, em ambos os lados do cérebro e da medula espinhal. 3 - hipófise, rede admirável carótida e gânglio do nervo trigêmeo; 4 - tronco cerebral; 5 - medula espinhal cervical.
Colete os fragmentos com tesoura estéril ou bisturi e pinça, evitando danos ao tecido durante a remoção. Parte do intestino delgado. b1) fragmentos de 3x1x1 cm de cada órgão b2) órgão tubular de 10 cm (duodeno, jejuno e parte terminal do íleo). Fragmentos em solução de formol a 10%, embora não completamente fixados, podem ser enviados ao laboratório a) Para .. e outros órgãos Tecido fixado em formol.
AVES
Principais doenças que acometem as aves
Material para colheita de amostras para diagnóstico de doenças das aves
Traquéia, pulmão e orofaringe;
Coração, fígado, baço e rins;
Para o diagnóstico da doença de Newcastle e da gripe aviária, os órgãos devem ser coletados separadamente, com cada órgão de cada ave colocado em um único recipiente. Atenção: sempre use luvas descartáveis na colheita e abra a embalagem com um cotonete no lado da luva, evitando tocar no algodão. Passe o cotonete sobre a ave; em seguida, corte a ponta do swab que ficou em contato com a mão e mergulhe o restante no frasco que contém o carreador.
Obs: Use sempre luvas descartáveis na hora da colheita e abra a embalagem do cotonete do lado onde fica o cabo, evitando tocar no algodão. Momento crítico de chegada ao laboratório. Tampão esterilizado b) Solução salina acrescida de antimicrobianos específicos. Se o laboratório fornecer um palito estéril, use-o para colocar o cotonete no recipiente. a) Use luvas descartáveis e abra o pacote de cotonetes na casa a ser amostrada.
Caixa de transporte de aves 1 dia. a) Swab: com luvas descartáveis, esfregue gaze esterilizada em toda a superfície interna da caixa, preferencialmente sobre as fezes, e a seguir coloque em recipiente adequado. Alinhamento de caixa de embarque com no mínimo 4 caixas agrupadas por lote no mesmo container. Utilizando luvas descartáveis e com o auxílio de uma espátula esterilizada, colher amostras frescas de fezes de diferentes pontos da lixeira, colocar na mesma embalagem para cada lote.
Usando luvas descartáveis e usando uma espátula esterilizada, colete amostras de fezes frescas de vários locais do galpão. colocá-los no mesmo a) Nenhum. Usando luvas descartáveis, colete o mecônio diretamente em um recipiente adequado após a ave expeli-lo sob leve pressão.
ABELHAS
Material para colheita de amostras para diagnóstico
Abelhas Apis mellifera
Garantindo a segurança
Reconhecendo as partes de uma colmeia
Identifi cando os indivíduos da colônia, células de operárias,
Abrindo e inspecionando uma colmeia
Fases do desenvolvimento das abelhas
Fase larvalLarva
Pré-pupa
Fase de pupa
Diferentes anomalias na fase de cria
Bactéria Melissococcus plutonius Estágio de desenvolvimento da ninhada afetada Geralmente larva destapada no estágio de alimentação; às vezes cria capeamento. Filhos Afetados Estágio de Desenvolvimento Bebês já operados, pré-pupa e pupa (permanecem mumificados). Embrulhe as amostras de pente em jornal ou outro papel encerado.
Pedaços de favo contendo o máximo de cria anormal possível - 3 a 5 pedaços de favo de cerca de 3x3 cm a 3x10 cm, de preferência entre os arames do quadro. Use uma faca entre os fios da armação para cortar pedaços de pente na área com suspeita de filhotes. Um pedaço de favo de aproximadamente 3x10 cm (contém pelo menos 100 crias cobertas) Use uma faca para cortar um pedaço de favo com a cria.
Quantidade Pedaços de favo contendo mel operculado. em cima dos favos de cria - se não o encontrar, recolha o mel sem as tampas). O que comumente se observa é a presença de algumas abelhas adultas moribundas na entrada da colmeia (alvado) ou rastejando pelo chão até a morte. Quando ocorre a mortalidade por algum tipo de inseticida, observa-se um maior número de abelhas mortas no chão em frente à colmeia e às vezes no fundo da colmeia.
Como coletar Feche a entrada da colmeia (alvado) com uma fita de espuma comum e recolha as abelhas que chegarem dentro de um frasco plástico tipo universal com álcool 70%. Para recolher as abelhas no canteiro, pode sugá-las com um sugador de abelhas ou, em alternativa, varrê-las com uma escova.
Bibliografia